Сенсебилизация к УВК. Эффективность устройств вспомогательного кровообращения
Добавил пользователь Валентин П. Обновлено: 22.01.2026
ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского», Москва, Россия
Отделение кардиореанимации и интенсивной терапии ФГБУ РНЦХ им. акад. Б.В. Петровского РАМН, Москва
Современные устройства поддержки левого желудочка, устанавливаемые посредством чрескожного доступа
Журнал: Кардиология и сердечно-сосудистая хирургия. 2018;11(3): 35‑40
Обзор посвящен устройствам кратковременной поддержки функции левого желудочка с чрескожным способом установки, таким как внутриаортальная баллонная контрпульсация, Tandem Heart, Impella, и включает подробное описание нового устройства вспомогательного кровообращения с пульсирующим кровотоком, устанавливаемого чрескожным путем (PulseCath iVAC 2L). Кратко описаны принципы работы устройств, влияние на гемодинамику, показания и противопоказания, а также рассмотрены результаты основных исследований у пациентов с острой или декомпенсированной сердечной недостаточностью и при чрескожных коронарных вмешательствах высокого риска.
За последние десятилетия в лечении сердечно-сосудистых заболеваний достигнут значительный прогресс. Однако вместе с увеличением выживаемости после инфаркта миокарда (ИМ) растет количество пациентов с дисфункцией левого желудочка (ЛЖ) и сердечной недостаточностью [1]. Прогресс в рентгенохирургии позволяет проводить чрескожные коронарные вмешательства (ЧКВ) у пациентов, которые ранее считались неоперабельными. Все чаще выполняются стентирования при многососудистых поражениях, стенозах ствола левой коронарной артерии, но одновременно возрастает риск значимых нарушений гемодинамики и летального исхода во время ЧКВ [2, 3].
В описанных группах пациентов существует потребность в кратковременной поддержке кровообращения. Устройства для кратковременного вспомогательного кровообращения должны быть простыми в установке, несложными в работе и безопасными. Этот обзор посвящен современным устройствам кратковременной поддержки кровообращения с чрескожным способом установки и включает подробное описание нового устройства PulseCath iVAC 2L.
Внутриаортальная баллонная контрпульсация
С тех пор как Kantrowitzetal в 1968 г. описал применение баллонной контрпульсации у пациентки с кардиогенным шоком, а В.И. Бураковский и соавт. в 70-х годах XX века внедрили этот метод в практику в нашей стране [4], ВАБК долгое время была единственным методом вспомогательного кровообращения и до сих пор остается самым распространенным устройством кратковременной поддержки функции ЛЖ как за рубежом [5], так и в России [6].
Двухпросветный катетер для ВАБК диаметром 7—8 Fr устанавливается путем пункции артерии (чаще всего бедренной) так, чтобы баллон на дистальном конце катетера находился в нисходящей аорте. Консоль контролирует работу баллона и обеспечивает подачу газа. В диастолу баллон раздувается, увеличивая диастолическое артериальное давление (АД) и перфузию коронарных артерий. В начале систолы быстрое сдувание баллона создает присасывающее действие, которое снижает давление в аорте (т.е. постнагрузку) и способствует оттоку крови из Л.Ж. При этом уменьшаются напряжение стенки ЛЖ и его работа. Время раздувания/сдувания баллона определяется по электрокардиограмме (ЭКГ) или кривой А.Д. Низкое качество ЭКГ и аритмии могут приводить к ошибкам в работе баллона и снижать эффективность поддержки; у современных устройств, использующих фиброоптические датчики и компьютерные алгоритмы, эти недостатки менее выражены [7]. Гемодинамический эффект ВАБК зависит от объема и расположения баллона, точности работы, а также от частоты сердечных сокращений (ЧСС) и сосудистого сопротивления пациента. В среднем ВАБК увеличивает сердечный выброс (СВ) на 0,5 л/мин [8]. ВАБК противопоказана пациентам с выраженной аортальной недостаточностью, диссекцией и аневризмой аорты. К относительным противопоказаниям относятся облитерирующие заболевания периферических артерий и сепсис. Осложнения ВАБК включают кровотечения, тромбоцитопению, ишемию конечности, тромбоэмболические осложнения, в том числе инсульт, травму аорты или устьев висцеральных артерий. Частота осложнений ВАБК была довольно высокой в прошлом, но значительно снизилась по мере совершенствования технологии и накопления клинического опыта. По данным недавних крупных исследований [9, 10], этот показатель составляет 8—18%, а частота кровотечений и осложнений в месте доступа не превышает 3,5%.
Несмотря на широкое применение, данные об эффективности ВАБК при кардиогенном шоке противоречивы. В реестре SHOCK у пациентов с кардиогенным шоком, вследствие ИМ, внутрибольничная и однолетняя летальность снизились при применении ВАБК в дополнение к тромболизису [11]. В ретроспективном анализе у пациентов с ИМ и кардиогенным шоком установка ВАБК до ЧКВ снизила внутрибольничную летальность, частоту крупных кардиологических нежелательных событий (major adverse cardiac events — MACE) и пиковый уровень креатинфосфокиназы по сравнению с установкой ВАБК после ЧКВ [12]. Однако в проспективном рандомизированном исследовании IABP—SHOCK II у пациентов с ИМ и кардиогенным шоком, которым выполнялось ЧКВ, не удалось показать влияние ВАБК на летальность и время пребывания в отделении интенсивной терапии [13, 14]. Учитывая эти данные, Европейское кардиологическое общество не рекомендует рутинное применение ВАБК у всех пациентов с кардиогенным шоком (класс рекомендаций III, уровень доказательности A), но ВАБК по-прежнему рекомендована пациентам с нестабильной гемодинамикой или кардиогенным шоком вследствие механических осложнений острого коронарного синдрома (класс рекомендаций IIa, уровень доказательности B) [15]. В США класс рекомендаций для ВАБК при кардиогенном шоке после ИМ с подъемом сегмента ST снижен с I до IIa [16]. Возможно, отсутствие явного клинического эффекта у тяжелых пациентов связано со скромным вкладом ВАБК в гемодинамику (прирост СВ на 0,5 л/мин), и пациентам с кардиогенным шоком требуются более производительные методы вспомогательного кровообращения.
Что касается применения ВАБК при ЧКВ высокого риска, в проспективном рандомизированном исследовании BCIS-1 в группе плановой установки ВАБК перед ЧКВ частота MACE, цереброваскулярных событий и летальность через 6 мес были такими же, как и при установке ВАБК после возникновения гемодинамических нарушений [10]. С другой стороны, плановое применение обеспечивало более стабильную гемодинамику во время ЧКВ и снижало число осложнений процедуры. Уменьшение летальности после плановой установки ВАБК при ЧКВ высокого риска удалось показать только при сравнении 5-летних исходов [17].
Устройство вспомогательного кровообращения с постоянным кровотоком левое предсердие-аорта (Tandem Heart)
Устройство Tandem Heart («Cardiac Assist Inc.», США) разрешено к применению для экстракорпоральной поддержки кровообращения длительностью до 6 ч (США) и 30 дней (ЕС). Tandem Heart состоит из наружного центробежного насоса, создающего постоянный кровоток до 5 л/мин, венозной и артериальной канюль и консоли управления. Канюля для забора крови диаметром 21 Fr устанавливается чрескожно в бедренную вену и с помощью пункции межпредсердной перегородки заводится в левое предсердие; канюля возврата крови (15—19 Fr) устанавливается чрескожно в бедренную артерию. Устройство забирает кровь из левого предсердия, тем самым снижая конечное диастолическое давление и работу ЛЖ, и возвращает ее в кровоток на уровне бифуркации аорты. У пациентов с рефрактерным кардиогенным шоком Tandem Heart увеличивал СВ, среднее АД и снижал давление наполнения обоих желудочков [18]. В рандомизированном исследовании у 40 пациентов с ИМ и кардиогенным шоком в группе Tandem Heart гемодинамические и метаболические показатели были лучше, чем в группе ВАБК, однако это не сопровождалось увеличением выживаемости [19].
Установка Tandem Heart требует пункции двух сосудов и опыта проведения канюли через межпредсердную перегородку. Во время работы устройства необходима постоянная инфузия гепарина и рекомендуется мониторировать давление заклинивания легочной артерии, поскольку эффективность работы насоса зависит от преднагрузки [20]. К противопоказаниям для применения Tandem Heart относятся — дефект межжелудочковой перегородки (ДМЖП) из-за риска шунтирования крови справа налево, выраженное поражение периферических сосудов и невозможность системной антикоагуляции гепарином. Из-за большого диаметра канюль рекомендуется ангиографическая оценка сосудов перед установкой устройства [21]; кроме того, у некоторых пациентов с кардиогенным шоком требовалось применение дополнительной антеградной канюли для дистальной перфузии конечности [22, 23]. Кровотечения в месте установки канюль и ишемия конечности при применении Tandem Heart возникали намного чаще, чем при использовании ВАБК [19]. К другим осложнениям относятся травма сердца при пункции межпредсердной перегородки или дислокации канюли, инфекция, тромбоэмболия [23].
Устройство вспомогательного кровообращения с постоянным кровотоком ЛЖ-аорта (Impella)
Устройство Impella («Abiomed Inc.») устанавливается ретроградно в ЛЖ через аортальный клапан. Благодаря загнутой форме (pig-tail) кончик катетера устойчиво располагается в полости Л.Ж. Катетер присоединяется к канюле, внутри которой находится осевой насос. Насос создает градиент давления на входе и выходе канюли и обеспечивает движение крови из ЛЖ в аорту. Проксимальный катетер диаметром 9 Fr, внутри которого располагаются питание насоса и линия для измерения давления, соединяет канюлю с консолью управления.
Первое из серии устройство Impella 2.5 имеет диаметр канюли 12 Fr и обеспечивает кровоток до 2,5 л/мин. Более мощные Impella 5.0 и Impella LD способны перекачивать до 5 л/мин, однако из-за большого диаметра канюли (21 Fr) устанавливаются хирургическим путем через бедренную или подмышечную артерии, либо на открытом сердце соответственно. Impella CP с промежуточным уровнем поддержки (3,0—4,0 л/мин), как и Impella 2.5, устанавливается чрескожным путем.
Impella разгружает ЛЖ, уменьшает конечно-диастолическое напряжение стенки, тем самым снижая работу ЛЖ и потребность миокарда в кислороде [24]. Impella увеличивает среднее и диастолическое АД, поддерживая системный кровоток и перфузию коронарных артерий. Гемодинамические эффекты Impella также включают снижение давления заклинивания легочной артерии, что свидетельствует об уменьшении постнагрузки ПЖ [25, 26]. В отличие от ВАБК, Impella не требует синхронизации с сердечным ритмом и ее эффективность не снижается при тахикардии и кратковременных аритмиях, однако для функционирования насоса необходимы достаточное наполнение ЛЖ и адекватная работа ПЖ.
Противопоказания к применению Impella: тромб в ЛЖ, стеноз, кальцификация, выраженная недостаточность или механический протез аортального клапана, выраженное облитерирующее заболевание периферических артерий, выраженная правожелудочковая недостаточность, ДМПП и ДМЖП. Для применения Impella требуется системная антикоагуляция под контролем активированного времени свертывания.
К наиболее частым осложнениям применения насоса Impella относятся кровотечение и инфекция в месте установки и ишемия конечности. По данным исследования Impella-EUROSHOCK, у 5—10% пациентов в первые 24 ч после установки Impella возник гемолиз, который иногда приводил к острой почечной недостаточности и требовал удаления устройства [27].
Применение Impella у пациентов с ЧКВ высокого риска описано в двух крупных обсервационных исследованиях USpella и Europella [28, 29]. Большинство пациентов этих реестров имели множественные сопутствующие заболевания, выраженную сердечную недостаточность и были признаны неподходящими для операций коронарного шунтирования. По данным исследования USpella, применение Impella позволило провести успешную многососудистую реваскуляризацию в 90% случаев, выживаемость составила 91 и 88% через 6 и 12 мес соответственно [29]. В крупном рандомизированном исследовании PROTECT II насос Impella 2.5 обеспечивал более стабильную гемодинамику во время ЧКВ, чем ВАБК, однако частота MACE и летальность в течение 30 дней после ЧКВ высокого риска не отличались между группами. Тенденция к снижению частоты MACE отмечена только при длительном наблюдении [30]. Стабилизация гемодинамики позволяет провести более полную и качественную реваскуляризацию, что может улучшить отдаленные исходы ЧКВ [31].
В небольшом рандомизированном исследовании ISAR-SHOCK у 25 пациентов с ИМ и кардиогенным шоком в группе Impella 2.5 показатели гемодинамики были лучше, чем при применении ВАБК, однако 30-дневная летальность была сходной [32]. По данным недавнего исследования IMPESS, применение более мощного устройства, Impella CP при кардиогенном шоке вследствие ИМ также не сопровождалось уменьшением летальности через 30 дней и 6 мес по сравнению с использованием ВАБК [33].
Устройство вспомогательного кровообращения с пульсирующим кровотоком ЛЖ-аорта (iVAC PulseCath)
iVAC 2L («PulseCath BV», Нидерланды) — это новое устройство вспомогательного кровообращения с пульсирующим кровотоком, устанавливаемое чрескожным путем. В ЕС iVAC 2L разрешен к применению для поддержки ЛЖ в течение 24 ч. iVAC 2L относится к семейству устройств PulseCath, которые имеют одинаковый принцип действия, но отличаются размерами, производительностью и способом установки. iVAC 2L устанавливается чрескожно и обеспечивает кровоток до 2 л/мин. iVAC 3L обеспечивает дополнительный СВ до 3 л/мин, для установки требуется хирургический доступ через подмышечную или подключичную артерию. iVAC 3LST (short tip) с производительностью 3 л/мин устанавливается на открытом сердце. iVAC 3L успешно применялся в различных клинических ситуациях: при операциях коронарного шунтирования без искусственного кровообращения [34, 35], при хирургическом обратном ремоделировании сердца [36], в сочетании с экстракорпоральной мембранной оксигенацией (ЭКМО) [37] и в качестве поддержки ПЖ [38].

Устройство iVAC 2L состоит из внешнего мембранного насоса, катетера диаметром 17 Fr для реверсивного потока крови, запатентованного двухходового поворотного клапана (см. рисунок). Устройство PulseCath iVAC 2L. а — устройство PulseCath iVAC 2L: 1 — насос, 2 — катетер, 3 — клапан; б — двухходовой поворотный клапан, определяющий направление тока крови; в — насос, заполненный кровью; г — iVAC 2L in situ на рентгенограмме, дистальный кончик (*) располагается в полости ЛЖ, а двухходовой клапан (±) — над аортальным клапаном (с изменениями из [39]). Насос имеет две камеры: одну для крови, вторую для воздуха, разделенные гибкой мембраной. Кровяная камера соединяется с катетером, а воздушная камера подсоединяется к обычной консоли ВАБК. В 6 см от внутреннего кончика катетера имеется встроенный клапан, определяющий направление тока крови. Катетер заводится ретроградно через бедренную артерию так, чтобы его кончик находился в ЛЖ, а клапан — в восходящей аорте. Синхронизируясь с сердечным циклом, устройство в систолу забирает кровь из ЛЖ в камеру насоса, а в диастолу выбрасывает кровь из насоса в восходящую аорту.
Показания к применению iVAC 2L. ЧКВ высокого риска, острый инфаркт миокарда, кардиогенный шок, недостаточность ЛЖ с фракцией выброса
Противопоказания к применению iVAC 2L. Заболевания аорты (аневризма восходящего отдела аорты, выраженная кальцификация сосудистой стенки), выраженный порок аортального клапана (стеноз или недостаточность), механический (металлический) протез аортального клапана, диаметр бедренной артерии 2.
Изменения гемодинамики при применении iVAC 2L
В систолу iVAC 2L забирает кровь из ЛЖ в камеру насоса, после закрытия аортального клапана открывается клапан iVAC 2L и устройство выбрасывает кровь в восходящую аорту. iVAC 2L разгружает ЛЖ в систолу и создает дополнительный кровоток в диастолу. In vitro производительность iVAC 2L составляет 2,2 л/мин. Производительность in vivo зависит от ЧСС. При высокой ЧСС диастола укорачивается, следовательно, уменьшается время изгнания крови из насоса и снижается ударный объем устройства. Оптимальная производительность устройства регистрировалась при ЧСС 70—80 уд/мин, а выброс iVAC 2L составил 1,4 (1,1—2,0) л/мин (ударный объем 21 (12—26) мл) [40]. Во время работы iVAC 2L статистически значимо увеличиваются среднее АД и СВ, индекс мощности сердца (cardiac power index) и насыщение смешанной венозной крови кислородом [40].
Наибольший опыт применения iVAC 2L накоплен при ЧКВ высокого риска: вмешательства на единственной проходимой артерии либо на незащищенном стволе ЛКА, а также реваскуляризация трех сосудистых поражений у пациентов с фракцией выброса ЛЖ ≤35% [40, 41].
В пилотном проспективном исследовании установка устройства удалась у 13 из 14 пациентов [40]. Поддержка iVAC 2L со средней длительностью 67 мин обеспечивала стабильную гемодинамику, что позволило успешно провести ЧКВ у всех пациентов группы высокого риска (медиана возраста 74 года, средняя фракция выброса ЛЖ 30%, медиана оценки по шкале SYNTAX 28,5). Применение iVAC 2L было безопасным; выраженных кровотечений и гемолиза не было [40]. В декабре 2016 г. стартовало международное исследование PULSE (номер NCT03200990 в базе данных ClinicalTrials.gov), цель которого — оценить параметры системной и легочной гемодинамики, а также биохимические показатели при использовании iVAC 2L по сравнению с Impella CP при ЧКВ высокого риска. Ряд исследователей [42, 43] предполагают, что пульсирующий кровоток более физиологичен, чем постоянный, и в большей степени увеличивает перфузионное давление в коронарных артериях и улучшает микроциркуляцию. В связи с этим в исследовании PULSE будет изучено, как устройства с пульсирующим и постоянным кровотоком разгружают ЛЖ и как при этом меняется потребление кислорода миокардом. Результаты этого пилотного исследования смогут стать основанием для рандомизированного сравнения клинических исходов при применении устройств вспомогательного кровообращения с разным типом кровотока.
Заключение
Несмотря на увеличение количества ЧКВ высокого риска и «утяжеление» популяции кардиологических пациентов, существует не так много устройств временной поддержки кровообращения, которые могли бы эффективно обеспечивать безопасность пациентов во время вмешательств. Устройство поддержки ЛЖ iVAC 2L обладает рядом потенциальных преимуществ: небольшой диаметр катетера, сочетание эффектов обхода ЛЖ и ВАБК, пульсирующий характер кровотока, использование стандартной консоли ВАБК, относительно невысокий риск кровотечения и гемолиза. Дальнейшие клинические исследования покажут, смогут ли эти характеристики улучшить клинические исходы, тем самым обосновав широкое применение этого устройства в клинической практике.
Инновационные подходы к лечению хронической сердечной недостаточности с помощью систем механической поддержки левого желудочка сердца. Всероссийская научно-практическая конференция «Кардиология на марше - 2021». Сателлитный симпозиум компании «Эбботт»
Хроническая сердечная недостаточность (ХСН) занимает одно из ведущих мест среди причин смерти в экономически развитых странах, что подчеркивает необходимость применения у пациентов с ХСН новейших методов терапии. В рамках Всероссийской научно-практической конференции «Кардиология на марше - 2021» и 61-й сессии ФГБУ «НМИЦ кардиологии» Минздрава России 8 сентября 2021 г. состоялся кардиологический и кардиохирургический симпозиум. Ведущие российские и зарубежные эксперты в области кардиологии и кардиохирургии обменялись клиническим опытом, обсудили последние научные достижения и подходы к хирургическому лечению и реабилитации больных сердечно-сосудистыми заболеваниями. В ходе мероприятия прозвучали доклады, посвященные инновационным методам лечения ХСН с помощью инновационной системы механической поддержки левого желудочка сердца.
- КЛЮЧЕВЫЕ СЛОВА: сердечная недостаточность, неприлизин, тромбоз, HeartMate II
Использование систем поддержки левого желудочка сердца для лечения сердечной недостаточности: формирование программы - от отдельного центра к уровню страны
Профессор кардиологии университета Копенгагена (UCPH), медицинский директор программы расширенной сердечной недостаточности, трансплантации и MCS в Национальном госпитале Копенгагена (Дания) Финн ГУСТАФССОН (Finn GUSTAFSSON) отметил, что в последних рекомендациях Европейского общества кардиологов (European Society of Cardiology, ESC) (2021) пересмотрены подходы к лечению пациентов с острой и хронической сердечной недостаточностью (ХСН).
Для лечения больных ХСН рекомендованы, в частности, ингибиторы ангиотензинпревращающего фермента, рецепторов ангиотензина и неприлизина, бета-адреноблокаторы, антагонисты минералкортикоидного рецептора. Пациентам, отвечающим на лекарственную терапию частично или не отвечающим совсем, должны быть предложены другие терапевтические опции. Обновленные рекомендации предусматривают необходимость индивидуального подхода. Кроме того, в рекомендациях представлены понятие и критерии тяжелой (терминальной) сердечной недостаточности, алгоритм лечения, включающий показания для краткосрочной и долгосрочной механической поддержки кровообращения.
К критериям терминальной стадии ХСН относят персистирующие симптомы сердечной недостаточности III-IV функционального класса (ФК) по классификации Нью-Йоркской ассоциации сердца (New York Heart Association, NYHA), тяжелое нарушение функции, сниженную фракцию выброса левого желудочка (менее 30%), в ряде случаев недостаточность правого желудочка. У пациентов на этой стадии увеличивается частота госпитализаций, отмечаются плохие показатели теста шестиминутной ходьбы, затруднение дыхания, одышка и другие признаки сердечной недостаточности.
В настоящее время разработан Межведомственный регистр случаев тяжелой сердечной недостаточности, при которой показано применение механических устройств для вспомогательного кровообращения - INTERMACS. Классификация ХСН по INTERMACS определяет профили пациентов, позволяющие идентифицировать риски, связанные со сроками имплантации. Согласно обновленным рекомендациям ESC, для пациентов с терминальной стадией ХСН (III-IV ФК по NYHA) предусмотрена классификация по семи профилям INTERMACS. В частности, первый профиль - критический кардиогенный шок. Пациентам требуется механическая поддержка кровообращения в пределах нескольких часов. Пациенты, относящиеся ко второму и третьему профилю, с тяжелыми нарушениями функции сердца, также нуждаются в устройстве для поддержания функции левого желудочка и, вероятно, в последующей трансплантации сердца. Сказанное относится и к пациентам четвертого профиля по INTERMACS.
Хирургическое лечение ХСН - имплантация механических вспомогательных устройств (искусственных желудочков) улучшает качество и продлевает продолжительность жизни благодаря улучшению кровообращения у большинства пациентов. Показаниями для имплантации механического вспомогательного устройства левого желудочка (left ventricular assist device, LVAD) являются фракция выброса левого желудочка менее 25%, более трех эпизодов госпитализации по поводу сердечной недостаточности за последний год, зависимость от внутривенной инотропной терапии или временная поддержка кровообращения, прогрессирование терминальных болезней внутренних органов.
Итак, длительная механическая поддержка кровообращения относится к рекомендациям класса IIА. Но подходы к выбору стратегии лечения пациентов должны быть строго индивидуальными. Поэтому, прежде чем назначить определенные методы терапии, необходимо проанализировать имеющиеся альтернативы.
В двойном слепом исследовании пациенты с сердечной недостаточностью II, III или IV ФК и фракцией выброса ≤ 40% получали сакубитрил/валсартан (LCZ696) или эналаприл в дополнение к рекомендуемой терапии. Задача исследования заключалась в выявлении разницы в показателях смертности от сердечно-сосудистых причин. Терапия комбинацией «сакубитрил/валсартан» продемонстрировала преимущество перед терапией эналаприлом, в частности в снижении риска смерти и частоты госпитализаций 1 .
Кроме того, добавление LVAD к фармакотерапии у пациентов с сердечной недостаточностью в терминальной стадии оказалось эффективнее только фармакотерапии. LVAD нового поколения - HeartMate III более эффективны по сравнению с вспомогательными устройствами предыдущего поколения HeartMate XVE и HeartMate II.
Таким образом, механическая поддержка кровообращения однозначно улучшает прогноз пациентов, получающих фармакотерапию.
Крайне актуальным остается вопрос своевременного применения методов имплантации LVAD или трансплантации сердца. В ходе многоцентрового проспективного исследования пациенты после проведения сердечной ресинхронизирующей терапии и/или больные с имплантируемым кардиовертером-дефибриллятором были обследованы на фракцию выброса ≤ 40% и класс III-IV по NYHA. Из 1722 пациентов только 7% соответствовали требуемым параметрам. Исследование выявило обширную группу пациентов, которые не получали надлежащего лечения на терминальной стадии ХСН 2 .
Прежде чем принять решение о применении методов механической поддержки кровообращения или пересадки сердца у пациентов с терминальной стадией ХСН, необходимо с помощью определенных критериев и опросников оценить показания к использованию данных методов в каждом конкретном случае. По мнению экспертов ESC, установка устройств механической поддержки кровообращения рекомендуется пациентам с фракцией выброса левого желудочка 3 . Между тем, по данным исследований, не все пациенты с острой ХСН, нуждающиеся в долгосрочной имплантации устройства механической поддержки кровотока, своевременно получают специализированную помощь 4 .
По другим данным, выживаемость больных через два года после имплантации LVAD составляет 66%, что сопоставимо с 30-дневной смертностью в 60% случаев без механической поддержки кровотока. При этом важно своевременно определять пациентов, которым такая терапия жизненно необходима, и выполнять имплантацию устройств поддержки кровотока 5 .
Не секрет, что во многих медицинских кардиологических центрах до сих пор количество процедур имплантации устройств поддержки кровотока при ХСН ограниченно. Принятие решения об имплантации механических систем кровообращения тем, кто получает экстракорпоральное жизнеобеспечение (extracorporeal life support, ECLS), осложняется ожидаемыми плохими результатами.
В многоцентровом обзоре определяли предикторы исхода, способные облегчить будущий отбор пациентов и принятие решений. Было имплантировано 531 устройство вспомогательного кровообращения после ECLS. Основной конечной точкой служила выживаемость через год после длительной имплантации механических систем кровообращения. Наблюдались предикторы годичного исхода, такие как возраст, женский пол, повторные операции, заболевания печени на конечной стадии, история фибрилляции предсердий, повторная операция и индекс массы тела > 30 кг/м 2 . Соответственно чем продолжительнее механическая поддержка кровотока, тем выше риск летального исхода 6 .
В недавно опубликованных исследованиях представлены результаты применения методов артериального доступа для поэтапного подхода при кардиогенном шоке. Показано, что основными недостатками веноартериального ECLS при кардиогенном шоке являются неполная разгрузка левого желудочка с сопутствующим отеком легких и осложнениями в месте сосудистого доступа. Авторы исследования предложили поэтапную методику лечения тяжелого кардиогенного шока, предусматривающую одновременное использование устройства импеллы 5,0/5,5 и периферических ECLS (ECMELLA) через один артериальный доступ 7 .
Следует учитывать, что у пациентов, перенесших трансплантацию сердца, не исключены отторжение трансплантата, кардиогенный шок, вторичная митральная регургитация, требующая стабилизации гемодинамики с помощью временной механической поддержки кровообращения. Важно своевременно определять таких пациентов и оказывать им надлежащую помощь 8 .
Как уже отмечалось, предоперационная диагностика обязательно предусматривает определение уровня по INTERMACS. Пациенты с терминальной стадией ХСН (III+ по NYHA) требуют особого внимания и должны наблюдаться в локальном или крупном федеральном специализированном кардиологическом центре. К факторам высокого риска относят резистентность к диуретикам, непереносимость блокады ренин-ангиотензин-альдостероновой системы, нарушение функции правого желудочка, терминальную стадию болезней внутренних органов.
Нарушение функции правого желудочка после имплантации LVAD имеет место в 10-40% случаев. У пациентов возникает асцит, нарушается функция почек и печени. Им требуется механическая поддержка правого желудочка. К сожалению, предоперационный предиктор, который позволял бы прогнозировать исход имплантации LVAD и риск развития нарушения функции правого желудочка, к настоящему моменту не определен. В сложившейся ситуации крайне важно понимать патофизиологическое состояние пациента, оценивать риск правосторонней сердечной недостаточности. После имплантации постнагрузка правого желудочка должна быть оптимизирована для минимизации риска развития осложнений. При необходимости следует проводить гемофильтрацию, оценивать перегрузку жидкостью, эхокардиографические параметры и выполнять процедуры, направленные на оптимизацию работы левого и правого желудочков 9 .
Как показали результаты анализа по EUROMACS, выживаемость пациентов с терминальной стадией ХСН через 12 месяцев при установке бивентрикулярных устройств поддержки обоих желудочков достигает 55% 10 .
Итак, у пациентов с кардиогенным шоком обязательным мероприятием считается механическая поддержка кровообращения. При стабильном состоянии назначают инотропную терапию, оценивают состояние правого желудочка, выполняют манипуляции по стабилизации клинического состояния. Наблюдения проводится каждые 3-6 месяцев.
Важно помнить, что пациентам с ХСН требуются высококвалифицированная помощь и наблюдение, что подразумевает наличие хорошо организованной медицинской сети. К слову сказать, в Германии структура оказания медицинской помощи пациентам с ХСН трехуровневая: амбулаторные центры, региональные клиники и трансрегиональные центры помощи пациентам с сердечной недостаточностью. Поскольку распространенность ХСН достаточно высока, очевидно, что врач общей практики также должен участвовать в процессе лечения больных ХСН. Безусловно, важной частью системы по оказанию медицинской помощи является проведение обучающих мероприятий для пациентов и курсов повышения профессионального уровня для врачей.
Терминальная стадия сердечной недостаточности: использование системы поддержки левого желудочка как «моста к жизни»
Как отметил в начале своего выступления профессор Иван НЕТУКА (Ivan NETUKA) (Институт клинической и экспериментальной медицины, Прага, Чехия), на фоне прогрессирования сердечной недостаточности возрастает частота госпитализации. При декомпенсации состояния пациентам требуется инотропная поддержка. В отсутствие эффекта от других видов лечения назначают хирургическое лечение, прежде всего имплантацию вспомогательных устройств - LVAD.
Сегодня применение методов вспомогательного кровообращения у больных с терминальной стадией сердечной недостаточности становится распространенной процедурой. Однако выбор кандидатов для установки LVAD остается сложным. Для принятия решения о применении LVAD необходимо учитывать наличие сопутствующих патологий со стороны других органов и систем, что требует мультидисциплинарного подхода.
В последние годы технологии LVAD значительно эволюционировали. Новое поколение LVAD HeartMate III - современный магнитно-левитационный желудочек вспомогательного кровообращения, устройство для поддержания функции желудочка с центробежным потоком. В отличие от LVAD предыдущих поколений применение этого устройства позволяет снизить инвазивность процедуры имплантации, минимизировать кровопотери и пребывание в отделении интенсивной терапии. С внедрением в хирургическую практику LVAD нового поколения HeartMate III увеличились выживаемость и качество жизни пациентов с ХСН 11 .
Благодаря уникальной конструкции мотор HeartMate III функционирует без соприкосновения с другими частями системы, тем самым минимизируется воздействие трения. Создаваемое пульсирование нормализует циклы и движение кровотока.
Эффективности применения современных систем LVAD у пациентов с сердечной недостаточностью посвящен ряд исследований. В одном из них сравнивали группы пациентов с ХСН в терминальной стадии, получавших краткосрочную поддержку кровообращения Heartmate III и долговременную поддержку кровообращения HeartMate II. Всего в исследовании участвовало 1028 больных, сопоставимых по базовым характеристикам. Почти 1/3 пациентов имела первый и второй уровень по INTERMACS. Первичной конечной точкой служила свобода от инвалидизирующего инсульта либо отсутствие необходимости повторной операции по замене или удалению неработающего устройства поддержки. Частота замены насоса через два года вследствие тромбоза в группе HeartMate III была значительно меньше, чем в группе HeartMate II. Кроме того, у пациентов с прогрессирующей сердечной недостаточностью имплантация центробежного насоса с полной магнитной левитацией ассоциировалась с лучшими результатами, чем имплантация HeartMate II, в отношении частоты инсультов и предотвращения желудочно-кишечных кровотечений 12 .
Имели место и социально-экономические преимущества HeartMate III перед HeartMate II. На фоне применения HeartMate III отмечалось снижение средней длительности повторной госпитализации и использования LVAD.
В исследовании MOMENTUM-3 зафиксировано преимущество LVAD HeartMate III, центробежного насоса с полностью магнитной левитацией, перед осевым насосом HeartMate II.
В рамках пилотного исследования применения HeartMate III проведен сравнительный анализ долгосрочных исходов у 2200 пациентов с имплантированной системой HeartMate III. Ученые проанализировали характеристики пациентов из основного испытания и протокола непрерывного доступа, в частности выживаемость без инвалидизирующего инсульта или повторного открытия для замены или удаления неисправного устройства (основная составная конечная точка), общую выживаемость и основные неблагоприятные события в течение двух лет.
Важно, что в объединенном анализе двухлетняя первичная конечная точка была одинаковой между профилями INTERMACS I-II (нестабильная прогрессирующая сердечная недостаточность), профилем III (стабильная на инотропной терапии) и профилями IV-VII (стабильная амбулаторная прогрессирующая сердечная недостаточность). Чистое бремя нежелательных явлений было ниже в группе пациентов из протокола непрерывного доступа. Данные пилотного исследования свидетельствуют о более низком бремени неблагоприятных событий как у стабильных, так и нестабильных пациентов с HeartMate III и аналогичной выживаемости по сравнению с основным испытанием 13 .
В свою очередь в исследовании MAGENTUM-2 критерии включения для пациентов были еще более жесткими. Например, среди ключевых критериев исключения было наличие любых протезов сердечного клапана, инсульта в анамнезе, тромбоза и др. Выживаемость без тромбоза помпы, любого ишемического удара или крупного кровотечения оценивали через три и шесть месяцев после отмены антикоагулянтной терапии. Согласно анализу результатов исследований MAGENTUM-1 и MAGENTUM-2, в течение шести месяцев после процедуры установки LVAD HeartMate III не наблюдалось ни одного случая желудочного кровотечения, инсульта, других серьезных осложнений. В отличие от других LVAD HeartMate III продемонстрировал низкий риск тромбообразования.
Полученные данные еще раз подтверждают концепцию четкого отбора пациентов для использования механических устройств вспомогательного кровообращения.
Таким образом, в отдельных случаях допустима полная отмена антикоагулянтной терапии. Этим обосновано применение альтернативных подходов, таких как использование прямых антикоагулянтов в комбинации с Heartmate III.
В заключение И. Нетука отметил, что проведенные многочисленные клинические исследования убедительно доказывают, что установка системы HeartMate III улучшает показатели качества жизни и снижает риск смерти среди пациентов с сердечной недостаточностью. Благодаря системе LVAD нового поколения появилась реальная возможность оптимизировать стратегию ведения больных ХСН.
Аппарат искусственного кровообращения

Аппарат искусственного кровообращения (АИК), или аппарат «искусственное сердце — лёгкие» — специальное медицинское оборудование, обеспечивающее жизнедеятельность человека при частичной или полной невозможности выполнения функций сердца и/или лёгких.
Принцип работы
Аппарат искусственного кровообращения временно замещает функцию сердца и легких. Поэтому он состоит из нескольких блоков, а именно:
1) Оксигенатор. Кровь попадает туда из катетеризированных вен правого предсердия самотеком. В оксигенаторе она насыщается кислородом и освобождается от углекислого газа. В некоторых оксигенаторах кровь соприкасается с газом (пузырьковые, пленочные), в других она насыщается кислородом через газопроницаемую мембрану.
2) Артериальный насос. По своей конструкции он может быть мембранный, камерный, роликовый, пальчиковый. Основная функция его состоит в нагнетании оксигенированной крови в артерию.
3) Коронарный отсос. Его задача отсасывать излившуюся кровь из раны и возвращать в циркуляторный контур аппарата искусственного кровообращения.
4) Теплообменник. Согревает или охлаждает кровь до определенной требуемой температуры. Так, чтобы избежать травматизации клеток крови во время перфузии, а это возможно при длительных оперативных вмешательствах, когда она проходит через циркуляторный контур многократно, используют гипотермию. Теплообменник может быть трубчатым или щелевым.
5) Фильтр-ловушка. Кровь, попадая в аппарат искусственного кровообращения, может образовать сгустки, содержать пузырьки газа, поэтому перед обратным поступлением в кровеносное русло больного ее фильтруют.
Где используется
В основном аппарат искусственного кровообращения (АИК) применяется в кардиохирургии, при операциях на открытом сердце. Во время оперативного вмешательства сердце не может выполнять свою функцию насоса и ее заменяют механическим перекачиванием оксигенированной крови. Есть и другое применение аппарата искусственного кровообращения - это регионарная перфузия.
Осложнения при искусственном кровообращении
Основные осложнения, которые могут возникнуть при использовании аппарата искусственного кровообращения это:
- Эмболия сосудов газами или тромбами;
- Гипоксия, нарушения микроциркуляции органов;
- Гематологические осложнения, нарушение свертываемости, фибринолиз.
Кардиоплегия
Большое значение в предупреждении воздушной эмболии имеет искусственная остановка сердца (кардиоплегия). Кардиоплегию применяют не только для предупреждения воздушной эмболии, а в основном для предупреждения гипоксических изменений в миокарде в период, когда прекращено коронарное кровообращение, и для создания удобств оперирующему на открытых полостях сердца хирургу. Кроме того, вследствие кардиоплегии удается уменьшить кровопотерю из операционной раны сердца, если во внутрисердечном периоде операции не включено коронарное кровообращение.
Экстракорпоральная мембранная оксигенация (ЭКМО, ЭМО) — инвазивный экстракорпоральный метод насыщения крови кислородом (оксигенации) при развитии тяжёлой острой дыхательной недостаточности. Используется в кардиологии при острой сердечной недостаточности и для поддержания жизнедеятельности при проведении операции на открытом сердце совместно с аппаратом искусственного кровообращения.
История
Впервые метод экстракорпоральной оксигенации был применён в 1952 году в Великобритании у больного с дыхательной недостаточностью. В 1953 году впервые успешно проведена операция на открытом сердце с искусственной перфузией и оксигенацией крови. В 1965 году пузырьковый оксигенатор впервые использован у новорождённого, умирающего от дыхательной недостаточности. В 1969 году группой врачей под руководством T.G.Baffes впервые использован мембранный оксигенатор для искусственного кровообращения у детей. В 1970 году компания Avecor создала мембранный оксигенатор, ставший прообразом всех современных аппаратов ЭКМО.
Механизм
Для проведения ЭКМО к больному подсоединяют мембранный оксигенатор. Существует два способа подключения — вено-артериальная канюляция (ВАК) и вено-венозная канюляция (ВВК). При ВАК кровь забирается из венозного русла, очищается, насыщается кислородом и подаётся в артериальное русло. ВАК рекомендуется к применению у новорождённых, а также у взрослых с компенсированным инфарктом миокарда. При ВВК кровь забирается и возвращается в венозное русло. ВВК может применяться у взрослых с изолированным поражением лёгких. Для соблюдения физиологических механизмов забор и вливание крови осуществляется максимально близко к сердцу. ВАК предпочтительнее, так как при этом способе не происходит смешивание артериальной и венозной крови. ВВК требует вдвое большую поверхность мембран оксигенатора, поэтому на практике данный способ применяется реже.
При проведении процедуры новорождённым для компенсации объёма крови, циркулирующего в аппарате, используется донорская кровь.
ЭКМО является симптоматической терапией, не устраняющей фактор развития заболевания.
Возможные осложнения и недостатки
Использование донорской крови может вызвать аллергическую реакцию и привести к развитию шока. Кроме того, для исключения свёртывания крови в аппарате на протяжении всего времени использования ЭКМО пациенту вводят антикоагулянты, что может спровоцировать тромбоцитопению, кровоизлияния в головной мозг и в полости в месте канюляции, усиленный гемолиз. Недостаточность или неэффективность антикоагулянтов может привести к тромбообразованию и закупорке механизмов аппарата ЭКМО. Неисправность аппарата может вызвать воздушную эмболию сосудов, отказ аппарата фатален для пациента.
Главными недостатками метода являются необходимость наличия дорогостоящего оборудования, высококвалифицированного персонала и высокая стоимость процедуры.
Доктор БОСТИ рекомендует высококачественные оксигенаторы от Medos HiLite® .
Надежность. Превосходная работа и практическая функциональность.
Постоянный и равномерный уровень обмена газов крови является залогом максимальной безопасности наших пациентов. Немецкое качество. Модели оксигенаторов производятся со стандартными микропорами или с инновационными плазменными тонкими волокнами, используемых в оксигенаторах длительного использования. Все модели оксигенаторов MEDOS имеют следующие преимущества:
- Исключительный трансфер газа.
- Низкий обьем заполнения.
- Оптимизированный поток крови, газа и жидкости.
- Компактная, простая в сборке конструкция.
Купить оксигенатор Medos производства Германии Вы можете обратившись к менеджеру-консультанту Акжолу Марасулову (+996 555 710 885).
Сенсебилизация к УВК. Эффективность устройств вспомогательного кровообращения
АИК (аппарат искусственного кровообращения) - медицинский аппарат, применяемый при операциях на отрытом сердце, поддерживающий все физиологические параметры гемодинамики во время операции. Любой аппарат искусственного кровообращения состоит из двух блоков: физиологического и механического. Физиологический блок включает в себя детали, которые соприкасаются с кровью. Механический блок включает в себя собственно сам АИК, который имеет центрифужные и роликовые насосы, электронные системы контроля и безопасности. АИК оказывает негативно воздействие на организм, вызывает гипероксию, гипотермию, гемодилюцию, повреждаются форменные элементы крови, запускается воспалительный процесс, а также кровоток становится не пульсирующим, что приводит к нарушению постоянства внутренней среды организма. Главной целью модификации и внедрения в АИК дополнительных составляющих, является обеспечение наибольшей безопасности пациента, во время проведения операции и минимизация послеоперационных осложнений. Достижением перфузионных технологий является применение мини-контуров, гепариновых и биосовместимых покрытий. Применение мини-контуров без кардиотомных резервуаров позволили сократить контактную поверхность и уменьшить нарушение целостности ткани. Также инновационным в техники перфузии стало лейкодипиляция и ультрафильтрация, а также добавление в прайм (первичный объем заполнения) кортикостероидов, донорских NO-соединений и апротинина. Все это позволяет уменьшить негативное влияние АИК на организм человека и способствует быстрейшему восстановлению в послеоперационной период.
1. Зюзин С.О., Голованов А.В., Сидорова М.А. Актуальность искусственного кровообращения в современной медицине // Научный альманах 2018. № 1-2(39). С.101-104
2. Евтушенко С.А. Оптимизация искусственного кровообращения при кардиохирургических вмешательствах без использования донорской крови: дисс. канд.мед.наук. Новосибирск, 2009. 114с.
3. Аверина Т.В. Искусственное кровообращение ФГБУ Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева РАМН, Москва. 2013. С2.
4. Локшин Л.С., Лурье Г.О., Дементьева И.И. Искусственное и вспомогательное кровообращение в сердечно-сосудистой хирургии. М.: Пресса; 1998.
5. Groom R.C., Froebe S., Martin J. et al. Update on pediatric perfusion practice in North America. 2005. Survey. JECT. 37: 343-50.
6. Brix-Cristensen V. The systemic inflammatory response after cardiac surgery with cardiopulmonary bypass in children. Acta Anaesthesiol. Scand. 2001. 45: 671-9.
7. Быков И.В. Вспомогательное кровообращение на базе осевых насосов (математическое моделирование процессов управления): дис.кан.био.наук. Москва, 2014. 126 с.
8. Байжигитов Н.Б. Кулимбет М.Б. Мереке А.А. Клинические эффекты применения модифицированной ультрафильтрации крови у детей раннего возраста // КазНМУ Вестик. 2016. №3. С.72-75.
9. Сидоров Р.В., Федерякин Д.В., Анохин А.В. Опыт использования миниинвазивного экстракорпорального контура (месс-перфузии) с оценкой динамики когнитивных функций у больных после операции аорто-коронарного шунтирования // Вестник Национального медико-хирургического Центра им. Н.И. Пирогова 2017. №3. С13-15.
Применение аппаратов искусственного кровообращения в кардиохирургии стало на сегодняшний день достаточно распространенной практикой. Но, несмотря на накопленный клинический опыт, этот метод остается небезопасным. Главным образом это связано с применением донорской крови. В результате её использования возникают различные осложнения, для устранения которых многие исследователи искали альтернативные растворы для первичного заполнения АИК [1]. Также немаловажную роль в развитии осложнений в послеоперационный период играют физиологические, технические, хирургические и деонтологические аспекты.
С течением времени аппараты искусственного кровообращения постоянно модифицировались, появились дополнительные устройства, позволяющие минимизировать повреждающее действие на организм, такие как оксигенаторы, экстракорпоральные контуры с минимальным первичным объемом заполнения, изготовляемые из биосовместимых материалов.
Но, несмотря на все достижения кардиохирургии в этом направлении до сих пор высок риск послеоперационных осложнений, так как эта процедура расстраивает все звенья гомеостаза.
Пациентом современной кардиохирургической клиники всё чаще становится человек, находящийся в очень тяжелом состоянии: новорожденный, ребёнок с малым весом или тяжелым врожденным пороком сердца или же взрослый, подвергающийся повторному хирургическому вмешательству или имеющий сопутствующие патологии [2].
Главной целью перфузиолога, как и много лет назад, является обеспечение наибольшей безопасности пациента во время проведения операции и минимизация послеоперационных осложнений.
Целью работы является проведение анализа литературных источников, научных статей и статистических данных по вопросу применения аппарата искусственного кровообращения в кардиохирургической практике.
Материалы и методы исследования
Материалами исследования послужили научные публикации отечественных и зарубежных ученых, опубликованные за последние 10 лет.
Результаты исследования и их обсуждение
Перфузиология - интенсивно развивающаяся отрасль медицины, которая изучает использование аппарата искусственного кровообращения при оперативных вмешательствах на сердце, которые предполагают выключение сердца из кровообращения.
Первые аппараты искусственного кровообращения (АКИ) были применены в клинической практике более 60 лет назад, причем довольно-таки успешно. С развитием кардиохирургии аппараты для перфузии длительно совершенствовались, многократно модифицировались и корректировались; в практику вводились новые методы искусственного кровообращения.
Создателем первого АИК считается советский ученый-патофизиолог С.С. Брюхоненко. В 20-е годы XX века он подробно изучал механизмы терморегуляции и причины повышения температуры тела. На основании полученных данных Брюхоненко разработал методику «переживания» головы собаки, отделенной от тела, с помощью так называемого автожектора, который со временем был запатентован в Англии, Франции и Германии. Сначала автожектор применялся для выведения организма из состояния клинической смерти, а с 1929 года он стал использоваться и для экспериментальных операций на сердце с отрытым доступом. Идея оживления после наступления клинической смерти нашла практическое применение в методиках вспомогательного кровообращения [4].
Первая успешная операция на человеке с выключением сердца из кровообращения при ушивании дефекта между предсердиями была проведена 6 мая 1953 года. В России же операции, проводимые с использованием АИК вошли в практику чуть позже, в 1957 году (первые операции были проведены под руководством А.А. Вишневского).
Тем не менее, долгое время подобные операции не находили широкого применения ввиду большого количества недостатков аппарата и высокими показателями послеоперационных осложнений. АИК для своего заполнения требовал до 4-6 литров донорской крови, аппараты были крайне ненадежны, так как физиологические узлы аппарата использовались многократно, да и способы управления таким устройством были крайне тяжелыми.
С момента первой операции аппараты постоянно усовершенствовались, появились оксигенаторы с минимальными первичными объемами заполнения; кроме того постоянно внедрялись новые биосовместимые материалы. Все это минимизировало неблагоприятное воздействие перфузии на организм. Разработка и внедрение гемодилюции (Panico F., Neptune W., 1959 г.), гипотермии в сочетании с искусственным кровообращением (Sealy W., 1958 г.) и защиты миокарда (Melrose D.G., 1955 г.) способствовали оптимизации перфузионных протоколов и повлекли за собой ряд фундаментальных исследований, посвященных изучению патофизиологических и клинических аспектов этих направлений [3].
АИК состоит из двух блоков: механического и физиологического. Механический блок включает в себя собственно сам АИК, который имеет центрифужные и роликовые насосы [7], электронные системы контроля (температуры, давления, уровня в кардиотомном резервуаре, пузырьков воздуха) и безопасности. Главным узлом механического блока является артериальный насос, замещающий функцию сердца и регулирующий минутный объем крови. Другие роликовые насосы используются в качестве коронарных отсосов, для нагнетания раствора, а также осуществляют ультрафильтрацию [4].
Физиологический блок состоит из одноразового экстракорпорального контура, выполняющего роль оксигенатора, то есть замещающего легкие. Его основная функция заключается в насыщении крови кислородом и выведении углекислого газа. Для пациентов разных возрастных и весовых категорий применяются оксигенаторы с различной максимальной производительностью и разными объёмами первичного заполнения. ЭК-контур состоит из кардиотомного резервуара, который может быть как жестким, так и мягким; насосного сегмента; теплообменника; артериального фильтра-ловушки; двух или трех магистралей для отсосов и артериальной/венозной линий.
Перед тем, как начать искусственное кровообращение, ЭК-контур заполняют, диаэрируют, и только после этого подсоединяют к сердечно-сосудистой системе [9].
Существуют различные схемы и методы подключения ЭК-контура к сердцу, в зависимости от патологической причины, которую будут устранять во время операции. При стандартном подсоединении используется следующая схема: верхняя полая вена (ВПВ), нижняя полая вена (НПВ), аорта (Ао) (рис. 1a).
Схемы подключения ЭК-контура к сердцу: а - стандартная, б - двухсекционная, в - обходная.
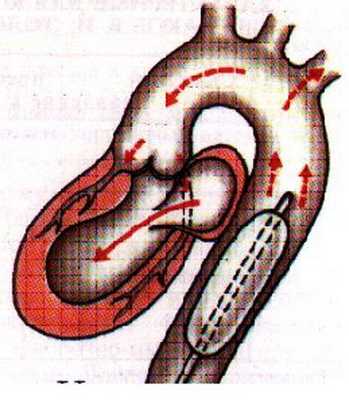
При проведении операций без вскрытия камер сердца или при остановке кровообращения с глубокой гипотермией считается достаточным применение одного венозного катетера. Также существует метод двухсекционного подключения, при котором один порт забора подсоединяют к сердцу на уровне правого предсердия, а другой - на уровне нижней полой вены. (Рис. 1б). В случаях, когда операцию проводят на аорте, а именно на восходящей её части или дуге, а также при повторных вмешательствах канюлю присоединяют к бедренной артерии. (Рис 1в).
Редкими случаями подключения являются бедренно-бедренный метод канюлирования и метод левожелудочкового обхода. Последний метод широко используется при реконструктивных операциях торакоабдоминального отдела аорты, для создания частичного сердечно-легочного обхода.
Для определения размера аортальных канюль, использующихся при присоединении ЭК-контура, учитывают максимальный минутный объем кровообращения индивидуальный для каждого конкретного пациента, а также пропускную способность канюли определенного диаметра. Выбор диаметра венозного катетера зависит от массы тела пациента и от диаметра полых вен, который хирург определяет визуально. В норме диаметр катетера должен быть не более 2/3 от просвета сосуда.
Если невозможно обеспечить адекватный венозный отток крови, в частности из-за низкой пропускной способности катетеров, применяют технику вспомогательного венозного дренажа. Эта методика является эффективной и безопасной благодаря тому, что улучшается венозный возврат без изменения градиента между кардитомным резервуаром и правыми камерами сердца, не травмируются форменные элементы крови, а также не происходит образование микроскопических эмболов.
Как только хирург подключил катетеры к магистральным сосудам, начинается перфузия. Существует две её разновидности: параллельная и полная. Параллельной перфузия считается до момента пережатия полых вен и, соответственно, прекращения притока крови к сердцу, а полной - после пережатия полых вен.
После снятия турникетов с полых вен и зажима с аорты начинается параллельная перфузия, которая может проводиться с полными объемными скоростями, когда необходимый минутный объем крови обеспечивается аппаратом искусственного кровообращения, и во вспомогательном режиме, когда часть минутного объема крови обеспечивается работой сердца, а часть - производительностью артериального насоса.
Составы первичного объема заполнения (прайма) разнообразны и зависят от многих показателей (объема циркулирующей крови, возраста и массы тела пациента, исходного гематокрита и т. д.). К основным компонентам прайма относят кристаллоидные и корригирующие растворы (KCl, NaHCO3), эритроцитарную массу, гепарин, растворы естественных (альбумин, сверхзамороженная плазма) и синтетических коллоидов (гидроксиэтилкрахмал и производные желатины), маннитол, апротинин и антибиотик [5].
АИК оказывает негативно воздействие на организм, вызывает гипероксию, гипотермию, гемодилюцию; его использование повреждает форменные элементы крови и запускает воспалительный процесс; кроме того при его использовании кровоток становится непульсирующим, что приводит к нарушению постоянства внутренней среды организма [4].
В результате этого развивается синдром системной воспалительной реакции (ССВР), к его развитию приводят активация фибринолиза, коагуляции, системы комплемента и калликреин-кининовой системы. Активируются тромбоциты и лейкоциты, повреждаются клетки эндотелия сосудов. Все это приводит к увеличению проницаемости сосудов, накоплению жидкости в интерстициальном пространстве, нарушению микроциркуляции и гипоперфузии ткани с морфофункциональными изменениями [6]. Могут возникнуть такие осложнения, как кровотечение и повреждение легких.
Клиническими проявлениями чрезмерного иммунного ответа является постперфузионный синдром, включающий в себя лихорадку, респираторные нарушения, почечную недостаточность, коагулопатии, дисфункцию миокарда и неврологические осложнения. Новорожденные и дети первого года жизни наиболее подвержены негативным влияниям переливания крови, это связано с морфофункциональными особенностями молодого организма и незрелостью иммунной системы.
Достижением перфузионных технологий является применение мини-контуров, гепариновых и биосовместимых покрытий. Применение мини-контуров без кардиотомных резервуаров позволили сократить контактную поверхность и уменьшить нарушение целостности ткани [8]. А это в свою очередь исключает возникновение ССВР за счет повышения биологической совместимости применяемых материалов, так как уменьшается контакт с чужеродной поверхностью.
Усовершенствованные оксигенаторы минимально травмируют форменные элементы и белки крови, а также обеспечивают оптимальный газовый состав.
Инновационными внедрениями в технику перфузии стали лейкодеплеция (уменьшение числа лейкоцитов) и ультрафильтрация, а также добавление в прайм (первичный объем заполнения) кортикостероидов, донорских NO-соединений и апротинина. Активированные лейкоциты повреждают эндотелий сосудов, поэтому их непрерывное удаление из переливаемой крови предотвращает возникновение воспалительного процесса. Также с донорскими лейкоцитами возможен перенос различных вирусных заболеваний (ВИЧ-инфекция, гепатиты B и C). В связи с этим для удаления лейкоцитов применяют специальные фильтры, гидрофильная синтетическая поверхность которых имеет высокое сродство к лейкоцитам, что обеспечивает высокую степень очистки.
Для новорожденных и маловесных детей разрабатываются педиатрические ЭК-контуры, которые позволяют не только уменьшить контактирующую поверхность, но и минимизируют первичный объем заполнения этих систем вплоть до полного отказа от компонентов донорской крови.
Значительный вклад в развитие кардиохирургии принесло внедрение гипотермии в процесс искусственного кровообращения. Гипотермия оказывает на организм как положительные, так и отрицательные воздействия. К положительным характеристикам гипотермии, улучшающим показатели гемодинамики при применении аппарата искусственного кровообращения, относятся снижение интенсивности метаболических процессов и потребности организма в кислороде. Благодаря этому увеличивается устойчивость организма к гипоксии. За счет увеличения растворимости газов и снижения парциального давления углекислого газа в крови наблюдается сдвиг кислотно-щелочного равновесия в кислую сторону. К отрицательным эффектам относятся централизация кровообращения за счет резкого снижения скорости кровотока в мышцах, коже и жировой ткани, повышение вязкости крови, а также увеличение сродства гемоглобина к кислороду, благодаря сдвигу кривой диссоциации оксигемоглобина влево.
Метаболизм катехоламинов в организме значительно снижается при гипотермии, в результате чего кровоснабжение сердечных и скелетных мышц ухудшается. При полной перфузии из кровотока выключаются легкие, что также негативно влияет на организм, так как в них происходит инактивация многих гормонов и вазоактивных веществ.
В современной кардиохирургии имеется тенденция к ограничению использования низких температур, однако в хирургии сложных врожденных пороков сердца гипотермическая перфузия по-прежнему остается предпочтительным методом [5].
Современные технологии позволяют минимизировать негативное влияние АИК на организм человека и значительно снижают риск возникновения послеоперационных осложнений. Общей тенденцией в дальнейшем совершенствовании аппаратов является модифицирование физиологического блока для одноразового пользования, микропористых фильтров в артериальной линии и переход к мембранным оксигенаторам.
Своевременная диагностика расстройств, возникающих во время и после проведения перфузии, является одним из главных элементов, на основании, которого проводятся многочисленные эксперименты по улучшению и повышению качества перфузии. Большинство признаков адекватности перфузии являются интегральными показателями, характеризующими «среднее» состояние организма. Поэтому мнение В.П. Осипова (1971 г.) о том, что «состояние кровотока на уровне микрососудов является прямым признаком качества перфузии» и что «ряд признаков адекватности перфузии достоверны только при отсутствии нарушений микроциркуляции», особенно актуально сегодня, когда наши возможности понять и оценить параметры микроциркуляции значительно расширились.
Читайте также:
- Случай стероидорезистентного синдрома Фишера Эванса тяжелой степени тяжести
- Уйти красиво. Советы увольняющимся
- Алкоголизм: стадии, признаки, причины и лечение
- Инструктивная функция врожденного иммунитета. Контроль за формированием адаптивного иммунитета
- УЗИ, МРТ при кровоизлиянии в надпочечник у плода
