Синдром Мунье-Куна (Mounier-Kuhn) - синонимы, авторы, клиника
Добавил пользователь Skiper Обновлено: 22.01.2026
Синдром Зиверта - Картагенера. Первое описание сделано в 1902 киевским врачом А. К. Зивертом, позднее его описал шведский врач M. Kartagener (1897-1975г.). Синоним - синдром декстрокардии, бронхоэктазов и синуситов - одна из форм первичной цилиарной дискинезии или синдрома «неподвижных ресничек» (замедления, десинхронизации их функционирования) - генетически детерминированный дефект строения мерцательного эпителия слизистой оболочки респираторного тракта. Характерно сочетание полного или неполного обратного расположения органов (декстрокардия - сердце справа), синуситов и бронхоэктазов. Отмечаются хронические риниты, отиты, пневмосклероз, поликистоз. Вторично развиваются аносмия, полипы носовой полости, снижение слуха.
Клиническая картина
Непрерывно рецидивирующее бронхо-легочное воспаление с первых дней жизни. Отставание в физическом развитии, постоянный кашель с гнойной мокротой, влажные хрипы в легких, изменения формы ногтей и концевых фаланг пальцев, хронический синусит.
Диагностика
При рентгенологическом исследовании определяется деформация легочного рисунка, очаговые уплотнения, бронхоэктазы. Обратное расположение внутренних органов. При бронхоскопии определяется хронический гнойно-воспалительный процесс.
Лечение
Лечение симптоматическое: стимуляция дренажной функции бронхов с помощью постурального дренажа, лечебная физкультура, лечебные бронхоскопии, ингаляции муколитиков.
Синдром Мунье-Куна
Синдром Мунье - Куна - редкий порок развития, характеризующийся расширением трахеи и крупных бронхов, обусловленных недоразвитием эластической, мышечной и (или) хрящевой ткани стенок трахеобронхиального дерева. Нарушение дренажной функции бронхов ведет к развитию гнойного трахеобронхита, бронхоэктазов и пневмосклероза. С раннего возраста этим больным сопутствует кашель с мокротой, периодические обострения заболевания, нарастание дыхательной недостаточности особенно в период обострений. Отмечается деформация ногтевых фаланг в виде «барабанных палочек». Чаще болеют мужчины. К 20-40 годам появляется развернутая клиническая картина заболевания: постоянный мучительный кашель (грубый, вибрирующий, напоминающий «блеяние козы»), обильное выделение слизисто-гнойной или гнойной мокроты, редко кровохарканье, одышка при физической нагрузке.
При рентгенологическом исследовании определяется расширение верхнего отрезка трахеи до 5-6 см (в норме 2-2,5 см) и главных бронхов, дивертикулоподобные выпячивания стенок. Рентгенологические данные подтверждают бронхоскопия и компьютерная томография.
Лечение симптоматическое; необходимы профилактические мероприятия по предупреждению и купированию обострений бронхолегочной инфекции.
Муковисцидоз
Муковисцидоз (mucoviscidosis; лат. mucus слизь + iscidus липкий + -ōsis; синонимы: панкреофиброз, кистозный фиброз) — распространенное наследственное заболевание с аутосомно-рецессивным типом наследования, обусловленное мутацией гена муковисцидоза (гена CF) и характеризующееся нарушением секреции экзокринных желез жизненно важных органов, прежде всего дыхательной и пищеварительной систем, а также тяжелым прогрессирующим течением.
В 1938 г. Dorothy Anderson, патологоанатом Нью-Йоркской детской больницы опубликовала первое подробное описание кистозной дегенерации поджелудочной железы в сочетании с легочной патологией у детей, выделив его в самостоятельную нозологическую единицу под названием "кистозный фиброз". Смертность в течение первых 10 лет жизни составляла почти 100%. Термин - "муковисцидоз" предложил Sydney Farber в 1944 г. (лат. mucus - слизь, viscus - вязкий), указывая на роль повышения вязкости экскрета. Важным открытием 1950-х годов явилось обнаружение повышенного содержания хлоридов в поте больных муковисцидозом (тепловой коллапс у грудничков). Потовый тест, разработанный Гиббсоном и Куком, стал "золотым стандартом" диагностики. В 1989 г. совместными усилиями канадских и американских ученых под руководством доктора Lap-Сhee Tsui был открыт ген муковисцидоза. В настоящее время достижения медицины позволяют говорить - предполагаемая выживаемость больных в Великобритании, родившихся в 2000 г., равна 50 годам.
Частота заболевания существенно варьирует, составляя в среднем 1: 2 000 - 2 500 новорожденных у представителей белой расы и 1: 9 000 - 10 000 у представителей африканской расы. По оценке ВОЗ, частота в России - 1 случай на 4900 новорожденных. Достижения медицины в диагностике и лечении муковисцидоза привели к значительным изменениям продолжительности жизни. В 1938 г. 70% заболевших погибало в течение первого года жизни, а в 2001 г. средняя продолжительность жизни в США и странах Западной Европы достигла 32 лет.
Этиология и патогенез.
| Муковисцидоз развивается в результате мутации гена CF, расположенного в 7-й аутосоме. Результатом этой мутации являются структурно-функциональные изменения кодируемого им белка — муковисцидозного трансмембранного регулятора (белка CFTR — cystic fibrosis transmembran regulator), играющего роль одного из ионных каналов в клетке, обеспечивающих активный транспорт ионов хлора. Эти изменения обусловливают выработку экзокринными железами секрета с измененными физико-химическими свойствами и повышенной вязкостью. Наиболее часто поражаются слизистые оболочки органов дыхания и пищеварения. В первую очередь, еще во внутриутробном периоде, вследствие повышенной вязкости секрета происходит закупорка выводных протоков поджелудочной железы, что в дальнейшем вызывает перерождение её ткани и значительные нарушения пищеварения, особенно жиров. Одновременно в патологический процесс вовлекаются органы дыхания с преимущественным поражением слизистой оболочки трахеобронхиального дерева. Мутация гена CF является причиной увеличения вязкости бронхиального секрета. При этом значительно нарушается эвакуаторная функция мерцательного эпителия, возникает мукоцилиарная недостаточность с избыточным накоплением патологического секрета в различных участках бронхиального дерева. |
Клинические проявления муковисцидоза не являются специфичными, они полиморфны. Заподозрить муковисцидоз у ребенка позволяет прогрессирующее течение воспалительного процесса в дыхательной системе в сочетании с патологией желудочно-кишечного тракта (поджелудочной железы, желчевыводящих путей и кишечника). Признаки поражения легких чаше всего (в 90% случаев) возникают еще в детском возрасте, на 1—2-м году жизни, реже (в 10% случаев) — в подростковом возрасте или позже.
Бронхолегочные изменения преобладают и определяют прогноз заболевания у 95% больных. В течение первого года жизни появляются респираторные симптомы обычно после вирусных заболеваний: стойкий сухой кашель, приступы удушья, одышка, иногда рвота. Кашель обычно усиливается ночью или при пробуждении. Мукостаз и присоединяющаяся хроническая бронхиальная инфекция становятся фоном для повторных респираторных эпизодов: бронхиолитов, бронхитов, пневмоний. В дальнейшем основными жалобами являются кашель с большим количеством трудно отделяемой гнойной мокроты, периодическое кровохарканье. Характерна малая эффективность кашля. Кашель при этом заболевании надсадный, малопродуктивный, часто в виде приступов. В дальнейшем наблюдается формирование бронхоэктазов, которые с течением времени становятся более распространенными и во многом определяют картину заболевании и тяжесть ее течения. Отмечается бочкообразная форма грудной клетки, деформация позвоночника и изменение дистальных фаланг пальцев в виде "барабанных палочек", одышка, акроцианоз. У взрослых характерной особенностью инфекционно-воспалительного процесса в легких является его непрерывно-рецидивирующее течение на фоне стойких изменений бронхиальной стенки - бронхоэктазов, распространенного пневмофиброза и гиперинфляции легких.
Клиническим проявлением кистозного фиброза поджелудочной железы является экзокринная недостаточность, которая встречается у 95% больных муковисцидозом. В результате плохого усвоения жиров в организме возникает дефицит жирорастворимых витаминов, что обусловливает потерю кальция. Следствием последнего являются остеопороз и мышечная гипотония. Возможно развитие пеллагры и других авитаминозов. Нарушается функция не только поджелудочной железы, но и желез желудка с повышением секреции соляной кислоты и пепсина. Среди больных муковисцидозом язвенная болезнь желудка и двенадцатиперстной кишки встречается в 10 раз чаще. Повышение вязкости желчи вызывает развитие холестатического гепатита, желчнокаменной болезни, билиарного цирроза печени. Течение заболевания на определенном этапе может осложниться сахарным диабетом.
Экскрет потовых желез при МВ характеризуется повышенной концентрацией натрия и хлора- содержание соли превышает нормальный показатель примерно в 5 раз. Такая аномалия выявляется уже при рождении и сохраняется на протяжении всей жизни. Повышение концентрации натрия и хлора лежит в основе потовой пробы— пилокарпиновый тест Гибсона и Кука — является "золотым стандартом" диагностики муковисцидоза.
Пилокарпиновый тест Гибсона и Кука
| Суть пробы состоит в стимуляции потовыделительной функции кожи электрофорезом с пилокарпином и последующем количественном определении хлоридов пота. Электрофорез солянокислого пилокарпина проводится в области предплечья. После очистки кожи дистиллированной водой пот собирают с помощью фильтровальной бумаги, которая кладется на стимулируемый электрофорезом участок кожи. Бумагу сверху прикрывают полиэтиленовой салфеткой или марлей для предупреждения испарения пота. Через 30—60 мин фильтровальную бумагу переносят в конверт, взвешивают, а затем кладут в колбу, которая содержит 50 мл дистиллированной воды. Через 24 ч фильтр выжимают на стенках колбы и удаляют. В жидкости, которая осталась в колбе, определяют содержание хлоридов и натрия. При концентрации хлоридов свыше 60 ммоль/л диагноз "муковисцидоз" считается достоверным, при концентрации хлоридов 40-60 ммоль/л — сомнительным. Отрицательной считается проба при концентрации хлоридов менее 40 ммоль/л. Диагностическую ценность имеет положительный результат двух- или трехразового исследования пота с интервалом между исследованиями в 2 нед при наличии минимального количества пота 100 мг. |
Почти у всех мужчин (97%), больных муковисцидозом развивается обструктивная азооспермия (отсутствие сперматозоидов), вызванная обструкцией, атрофией или атрезией семявыносящих протоков. Сперматогенез не нарушен.
Основным критерием в диагностике муковисцидоза считается увеличение концентрации ионов хлора в секрете потовых желез — более 60 ммоль/л (пилокарпиновый тест Гибсона и Кука). Необходимо сочетание этого критерия с одним и более из нижеперечисленных признаков:
- Хроническое заболевание дыхательной системы: хронический кашель с выделением вязкой мокроты; бронхиальная обструкция; носовые полипы, синусит или рентгенологические изменения в придаточных пазухах носа; деформация дистальных фаланг пальцев в виде барабанных палочек.
Эти критерии позволяют поставить точный диагноз в 95% случаев заболевания у детей и взрослых. Генетический анализ проводится у пациентов с подозрением на муковисцидоз, но не имеющих классических диагностических критериев. Анализ крови или иных образцов ДНК на мутации гена муковисцидоза — наиболее чувствительный и специфический тест диагностики.

Синдром Мунье-Куна
МКБ-10 коды
Описание
Синдром Мунье-Куна. Это патологическое расширение просвета трахеи и проксимальных бронхов за счет структурных дефектов их стенок. Анатомическая аномалия сопровождается клиникой рецидивирующих респираторных инфекций: характерным «вибрирующим» кашлем с гнойной мокротой, свистящими хрипами при дыхании, постоянной одышкой, кровохарканьем. Предполагаемый диагноз уточняется по результатам трахеобронхоскопии, рентгенографии, бронхографии, компьютерной томографии. Поддерживающая терапия направлена на купирование рецидивирующей инфекции: в период обострений проводят антибактериальную терапию, санитарную бронхоскопию, ингаляции и массаж.

Дополнительные факты
Синдром Мунье-Куна (трахеобронхомегалия, мегатрахея, трахеобронхоэктазы, трахеоцеле) — врожденное расширение трахеобронхиального дерева. Первые упоминания об аномалии — «пульсирующий дивертикул трахеи» — относятся к концу 19 века. Подробное клиническое описание трахеобронхомегалии принадлежит французскому отоларингологу П. Мунье-Куну (1932). У мужчин патология встречается в 4 раза чаще. В настоящее время зафиксировано около 100 случаев заболевания, хотя их реальное количество могло быть гораздо больше, так как многие больные протекают совершенно бессимптомно. Возраст проявления варьирует от 20 до 40 лет.
Причины

Патогенез
В патологоанатомической основе синдрома Мунье-Куна лежит атрофия эластических волокон и истончение гладкомышечного слоя трахеи и главных бронхов. Это приводит к лабильности стенок трахеобронхов и значительным колебаниям размеров дыхательных путей в разные фазы дыхания. Возможно изолированное расширение бронхов (бронхомегалия) без трахеомегалии.
Во время вдоха повышается отрицательное внутригрудное давление, что сопровождается расширением просвета трахеобронхов; в фазе выдоха давление снижается, что приводит к коллапсу дыхательных путей. При усилиях кашля стенки трахеи смыкаются и вибрируют. Слабость мышечного слоя вызывает выпячивание стенки трахеи между хрящевыми кольцами и образование дивертикулов.
Нарушается бронхиальный дренаж, что приводит к развитию гнойного трахеобронхита. Постоянный кашель способствует повышению внутрибронхиального давления, а через некоторое время вторично формируются бронхоэктазы дистальных бронхов, пневмосклероз и эмфизема легких.
Трахеобронхомегалия.
Классификация
В зависимости от выраженности структурных изменений при ТБД различают три подтипа синдрома Мунье-Куна:
• тип 1. Имеется незначительное симметричное расширение трахеи и главных бронхов.
• тип 2. Выраженное расширение и дивертикулы трахеи.
• тип 3. Расширение ТБД распространяется билатерально на дистальные отделы бронхов.
Клиническая картина
При отсутствии бронхолегочных инфекций синдром Мунье-Куна протекает бессимптомно. Клиническая картина обычно имеет место на третьем-четвертом десятилетии жизни. Симптомы трахеобронхомегалии неспецифичны и обычно неотличимы от симптомов, вызванных хроническим трахеобронхитом.
Основная жалоба — хронический изнуряющий кашель с обильным выделением гнойной мокроты. Звуки кашля характеризуются вибрирующим тембром, напоминающим «блеяние козы». Из-за множества хрипов дыхание становится шумным, «мурлыкающим», слышимым на расстоянии. Беспокоит одышка, усиливающаяся при физической нагрузке, стеснение и боль в груди, усиливающаяся при вдохе, периодические подъемы температуры. При обширном поражении ТБД отмечают акроцианоз, деформацию фаланг пальцев. Возможны эпизоды кровохарканья.
Ассоциированные симптомы: Боль в грудной клетке. Влажный кашель. Гнойная мокрота. Деформация. Кашель. Кровохарканье. Мокрота. Одышка. Пальцы - барабанные палочки.
Возможные осложнения
На фоне рецидивирующих респираторных инфекций и упорного кашля у больных с синдромом Мунье-Куна со временем развиваются деформирующий бронхит, бронхоэктазы и трахеобронхомаляция. Буллезная эмфизема возникает дистальнее измененных бронхов. Возможны эпизоды спонтанного пневмоторакса. Постепенно формируются ХОБЛ, легочная гипертензия, хроническая дыхательная недостаточность. Наиболее частым нереспираторным осложнением является гастроэзофагеальная рефлюксная болезнь, вторичная по отношению к устойчивому повышению внутрибрюшного давления.
Диагностика
Обследование больных с подозрением на синдром Мунье-Куна проводят в пульмонологическом стационаре. Аускультативная картина характеризуется влажными хрипами, вибрирующим тоном в проекции трахеи при форсированном дыхании и кашле. Для подтверждения трахеобронхомегалии проводят:
• Рентгенодиагностика: на простых рентгенограммах легких выявляют вторичные изменения легочной паренхимы, сильно расширенную трахею, диаметр которой превышает диаметр позвоночного столба. Для уточнения состояния ТБД и степени поражения проводят бронхографию. Более точную рентгенологическую картину получают при КТ легких, выявляющей патологическое расширение дыхательных путей (диаметр трахеи >25-27 мм у мужчин и 21-23 мм у женщин).
• Бронхоскопия. Трахеобронхомегалия подтверждается эндоскопическим исследованием TBD. Стенки трахеи истончены, слизистая оболочка атрофирована и втянута в межхрящевые промежутки («зубы пилы»). В сегментарных бронхах находим явления гнойного эндобронхита, возможна визуализация дивертикулов трахеи. При выдохе и кашле возникает экспираторный коллапс — стенки трахеи спадаются в передне-заднем направлении. Для подтверждения морфологического диагноза проводят биопсию.
• Другие исследования. Для оценки выраженности нарушений дыхания проводят спирометрию, выявляющую обструктивно-рестриктивные нарушения, увеличение остаточного объема (иногда показатели спирометрии остаются в норме). Проводят пульсоксиметрию, анализ газов крови, бактериологический посев мокроты.
Диф. диагностика
При верификации синдрома Мунье-Куна исключают другие врожденные и приобретенные патологии дыхательных путей:
• трахеомаляция.
• синдром Вильямса-Кэмпбелла.
• команда Картагенер.
• кистозная гипоплазия легких.
• инородные тела трахеи и бронхов.
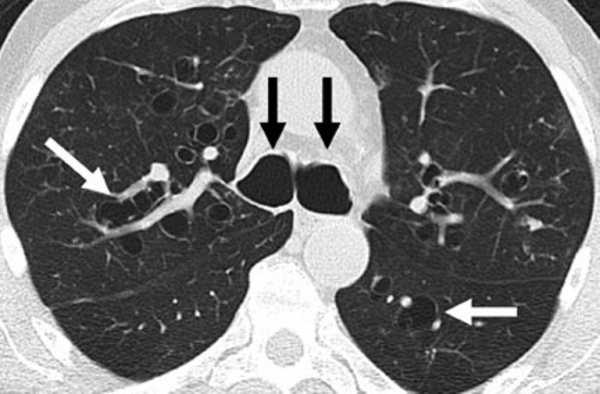
КТ легких. Расширенные бронхи (черные стрелки) и бронхоэктазы (белые стрелки).
Лечение
Бессимптомные пациенты с синдромом Мунье-Куна не требуют специального лечения. При рецидивирующих бронхолегочных инфекциях проводят симптоматическую поддерживающую терапию. В периоды обострения проводят антибактериальную терапию, назначают муколитики, бронходилататоры, кортикостероиды, проводят бронхоальвеолярный лаваж.
Для улучшения дренирующей функции ТБД показаны сеансы электрофореза, лечебные ингаляции, дыхательная гимнастика, перкуссионный массаж и постуральный дренаж. Некоторым пациентам может потребоваться неинвазивная вентиляция CPAP.
Хирургическое лечение синдрома Мунье-Куна малоэффективно. Стентирование трахеи и трахеобронхопластика выполняются редко в связи с распространенным характером поражения. Резекция легкого часто имеет обратный эффект и вызывает прогрессирование трахеобронхомегалии. Трансплантация легких также не продемонстрировала эффективности с точки зрения прогноза и выживаемости заболевания.
Прогноз
Прогноз зависит от степени и скорости развития заболеваний органов дыхания. Рецидивирующие инфекции нижних дыхательных путей, фиброз легких оказывают наибольшее влияние на качество жизни и ее продолжительность. Рекомендации по профилактике включают отказ от курения, минимизацию воздействия промышленных и профессиональных раздражителей, загрязняющих веществ и профилактику бронхолегочных инфекций. Пациентов с синдромом Мунье-Куна регулярно вакцинируют против гриппа и пневмококковой инфекции.
Список литературы
1. Пороки развития, наследственные интерстициальные болезни легких у детей/ Самаль Т.Н. - 2014.
2. Врожденные пороки трахеобронхиального дерева у детей/ Закиров И.И., Сафина А.И.// Вестник современной клинической медицины. - 2014.
3. Эпонимические бронхолегочные синдромы/ Розинова Н.Н., Лев Н.С., Богорад А.Е./ Российский вестник перинатологии и педиатрии. - 2012.
4. Редкие заболевания легких у детей - актуальная проблема современной пульмонологии/ Мизерницкий Ю.Л. // Российский вестник перинатологии и педиатрии. - 2012.
Синдром Мунье-Куна ( Мегатрахея , Трахеобронхомегалия , Трахеобронхоэктазия , Трахеоцеле )
Синдром Мунье-Куна - это патологическое расширение просвета трахеи и проксимальных бронхов, обусловленное структурными дефектами их стенок. Анатомическая аномалия сопровождается клиникой рецидивирующих инфекций дыхательных путей: характерным «вибрирующим» кашлем с гнойной мокротой, хрипами при дыхании, постоянной одышкой, кровохарканьем. Предполагаемый диагноз уточняется по результатам трахеобронхоскопии, рентгенографии, бронхографии, компьютерной томографии. Поддерживающая терапия направлена на купирование рецидивирующей инфекции: при обострениях проводится антибиотикотерапия, санационные бронхоскопии, ингаляции, массаж.
МКБ-10



Общие сведения

Причины трахеобронхомегалии
В современной пульмонологии синдром Мунье-Куна преимущественно рассматривается как первичная врожденная аномалия, в основе которой лежит системная дисплазия соединительной ткани. При этом заболевании отмечается дистрофия хрящевого каркаса и/или недоразвитие мышечного слоя трахеобронхиального дерева (ТБД), приводящее к его гигантскому расширению.
Этиологически трахеобронхомегалия может быть связана с такими патологиями, как синдром Марфана, синдром Элерса-Данлоса, эластолизис (синдром дряблой кожи) и др. Предполагается, что дефект структуры ТБД наследуется аутосомно-рецессивным путем, на что указывают семейные наблюдения трахеобронхомегалии. Однако на сегодняшний день генетическая мутация не выявлена, а большинство известных случаев являются спорадическими.
- респираторных инфекций (трахеобронхита, коклюша);
- диффузного легочного фиброза;
- респираторного дистресс-синдрома у недоношенных новорожденных, длительно находящихся на ИВЛ;
- врожденного иммунодефицита (синдрома Луи-Бар, агаммаглобулинемии Брутона);
- предшествующих манипуляций и хирургических вмешательств на трахее.
Раздражающими и провоцирующими факторами могут выступать вдыхание сигаретного дыма, токсичных производственных газов, загрязненного воздуха, постоянный кашель.
Патоанатомической основой синдрома Мунье-Куна выступает атрофия эластических волокон и истончение гладкомышечного слоя трахеи и главных бронхов. Это приводит к лабильности трахеобронхиальных стенок и значительному колебанию размера дыхательных путей во время различных фаз дыхания. Может встречаться изолированная дилатация бронхов (бронхомегалия) без трахеомегалии.
Во время вдоха отрицательное внутригрудное давление увеличивается, что сопровождается расширением трахеобронхиального просвета, в фазу выдоха давление снижается, приводя к коллапсу дыхательных путей. При кашлевых усилиях стенки трахеи смыкаются и вибрируют. Слабость мышечного слоя обусловливает выпячивание участка трахеальной стенки между хрящевыми кольцами и образование дивертикулов.
Нарушается бронхиальный дренаж, в результате чего развивается гнойный трахеобронхит. Постоянный кашель способствует повышению внутрибронхиального давления, и спустя некоторое время вторично формируются бронхоэктазы дистальных бронхов, пневмосклероз, эмфизема.

В зависимости от выраженности структурных изменений ТБД различают три подтипа синдрома Мунье-Куна:
- тип 1 - имеется небольшое симметричное расширение трахеи и главных бронхов;
- тип 2 - отмечается выраженная дилатация и дивертикулы трахеи;
- тип 3 - расширение ТБД распространяется билатерально на дистальные бронхи.
Симптомы трахеобронхомегалии
При отсутствии бронхолегочных инфекции синдром Мунье-Куна протекает бессимптомно. Клиническая картина обычно разворачивается на третьем-четвертом десятилетии жизни. Симптомы трахеобронхомегалии неспецифичны и обычно неотличимы от симптомов, вызванных хроническим трахеобронхитом.
Ведущая жалоба - хронический изнуряющий кашель с обильной гнойной мокротой. Для кашлевых звуков характерен вибрирующий тембр, напоминающий «блеяние козы». Из-за множества хрипов дыхание становится шумным, «мурлыкающим», слышимым на расстоянии. Беспокоит одышка, нарастающая при физической нагрузке, стеснение и боль в грудной клетке, усиливающиеся на вдохе, периодические подъемы температуры. При обширных поражениях ТБД отмечается акроцианоз, деформация фаланг пальцев. Могут возникать эпизоды кровохарканья.
Осложнения
На фоне рецидивирующих респираторных инфекций и упорного кашля у пациентов с синдромом Мунье-Куна с течением времени развивается деформирующий бронхит, бронхоэктазы, трахеобронхомаляция. Дистальнее измененных бронхов возникает буллезная эмфизема легких. Возможны эпизоды спонтанного пневмоторакса. Постепенно формируется ХОБЛ, легочная гипертензия, хроническая дыхательная недостаточность. Наиболее распространенным нереспираторным осложнением выступает гастроэзофагеальная рефлюксная болезнь как следствие постоянного повышения внутрибрюшного давления.
Обследование пациентов с подозрением на синдром Мунье-Куна проводится в условиях пульмонологического стационара. Аускультативная картина характеризуется влажными хрипами, вибрирующим призвуком в проекции трахеи при форсированном дыхании и кашле. Для подтверждения трахеобронхомегалии выполняется:
- Рентгеновская диагностика.Обзорная рентгенография легких выявляет вторичные изменения в легочной паренхиме, резко расширенную трахею, диаметр которой шире диаметра позвоночного столба. Для уточнения состояния ТБД и распространенности поражения выполняется бронхография. Более точную рентгенологическую картину получают с помощью КТ легких, по данным которой обнаруживается аномальное расширение дыхательных путей (диаметр трахеи >25-27 мм у мужчин и 21-23 мм у женщин).
- Бронхоскопия. Трахеобронхомегалия подтверждается с помощью эндоскопического осмотра ТБД. Стенки трахеи истончены, слизистая атрофична и втянута в межхрящевые промежутки («зубцы пилы»). В сегментарных бронхах обнаруживаются явления гнойного эндобронхита, возможна визуализация дивертикулов трахеи. Во время выдоха и кашля происходит экспираторный коллапс ‒ стенки трахеи спадаются в передне-заднем направлении. Для подтверждения морфологического диагноза производится забор биоптата.
- Другие исследования. Для оценки степени выраженности дыхательных нарушений выполняется спирометрия, демонстрирующая обструктивно-рестриктивные нарушения, увеличение остаточного объема (иногда спирометрические значения остаются нормальными). Осуществляется пульсоксиметрия, исследование газового состава крови, бактериологический посев мокроты.
Дифференциальная диагностика
При верификации синдрома Мунье-Куна исключаются другие врожденные и приобретенные патологии дыхательных путей:
- трахеомаляция;
- синдром Вильямса-Кемпбелла;
- синдром Картагенера;
- кистозная гипоплазия легких;
- инородные тела трахеи и бронхов.

Лечение трахеобронхомегалии
Бессимптомные пациенты с синдромом Мунье-Куна специального лечения не требуют. При рецидивирующих бронхолегочных инфекциях проводится поддерживающая симптоматическая терапия. В периоды обострения осуществляется антибиотикотерапия, назначаются муколитики, бронходилататоры, кортикостероиды, выполняется бронхоальвеолярный лаваж.
Для улучшения дренажной функции ТБД показаны сеансы электрофореза, лекарственные ингаляции, занятия дыхательной гимнастикой, перкуторный массаж, постуральный дренаж. Некоторым пациентам может быть необходима неинвазивная вентиляция легких в режиме CPAP.
Хирургическое лечение синдрома Мунье-Куна малоэффективно. Стентирование трахеи и трахеобронхопластические операции выполняются редко из-за диффузного характера поражения. Резекция легких зачастую имеет обратный эффект и вызывает прогрессирование трахеобронхомегалии. Трансплантация легких также не имеет доказанной эффективности в отношении прогноза заболевания и выживаемости.
Прогноз и профилактика
Прогноз зависит от степени и скорости развития дыхательных нарушений. Наиболее существенное влияние на качество и продолжительность жизни оказывают рецидивирующие инфекции нижних отделов дыхательных путей, легочный фиброз. Рекомендации по профилактике включают отказ от курения, сведение к минимуму воздействия промышленных и профессиональных раздражителей, загрязняющих веществ, предупреждение бронхолегочных инфекций. Пациентам с синдромом Мунье-Куна показана плановая вакцинация против гриппа и пневмококковой инфекции.
2. Врожденные пороки трахеобронхиального дерева у детей/ Закиров И.И., Сафина А.И.// Вестник современной клинической медицины. - 2014.
3. Эпонимические бронхолегочные синдромы/ Розинова Н.Н., Лев Н.С., Богорад А.Е./ Российский вестник перинатологии и педиатрии. - 2012.
4. Редкие заболевания легких у детей — актуальная проблема современной пульмонологии/ Мизерницкий Ю.Л. и др.// Российский вестник перинатологии и педиатрии. - 2012.
Читайте также:
- Клиника, диагностика белково-энергетической недостаточности пожилых. Диагноз
- Свищ прямой кишки: причины, симптомы и лечение
- Советы при парапроктите и свище прямой кишки
- Микропенис у детей. Агенезия полового члена
- Примитивная нейроэктодермальная опухоль глазницы: признаки, гистология, лечение, прогноз
