Клиника, диагностика белково-энергетической недостаточности пожилых. Диагноз
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Белковая недостаточность представляет собой болезненное состояние организма, связанное с недостаточным поступлением и усвоением белка либо с его усиленным распадом. Истинный дефицит поступления белков с пищей может развиваться у лиц, длительное время недоедающих, придерживающихся так называемых монодиет, или у вегетарианцев. Вторичный дефицит белка, связанный с его усиленным распадом, может сопровождать целый ряд заболеваний, например тяжелые формы инфекционных заболеваний, ожоги, патологии почек, наследственные нарушения обмена веществ. Белки являются основным строительным материалом организма, поэтому даже легкие формы белковой недостаточности, внешне протекающие бессимптомно, влияют на способность противостоять инфекции или на скорость заживления ран, замедляют рост ногтей и волос, вызывают сухость кожи. Тяжелая белковая недостаточность может нарушить нормальную работу всех органов и систем. Особенно опасен дефицит белка в детском возрасте, так как он способен повлиять на развитие умственных способностей, формирование мышц, замедлить рост ребенка.
Своевременное выявление белковой недостаточности и установление ее причины крайне важно, так как позволяет избежать опасных для жизни осложнений.
Синонимы русские
Дефицит белка, белковая дистрофия, белково-энергетическая недостаточность.
Синонимы английские
Симптомы
Легкие формы белковой недостаточности чаще всего протекают бессимптомно. Исключение могут составлять наследственно обусловленные дефициты отдельных аминокислот (структурных компонентов молекулы белка), характерные признаки которых наблюдаются в раннем детском возрасте.
Внешние проявления дефицита белка:
- общая слабость;
- прогрессирующее снижение веса;
- ломкость, тусклость и выпадение волос;
- ломкость ногтей;
- сухость и шелушение кожи;
- отеки.
Проявления со стороны нервной системы:
- вялость и повышенная утомляемость; ;
- снижение умственной активности;
- неустойчивое настроение;
- бессонница.
Проявления со стороны костно-мышечной системы:
- боли в мышцах и реже в суставах;
- замедленный рост (у детей);
- уменьшение массы и видимого объема мышц;
- мышечная слабость.
Со стороны органов пищеварения:
- повышенная тяга к сладкому; ;
- боль и вздутие живота;
- нарушения стула (запор, сменяющийся поносом);
- увеличение печени.
Кто в группе риска?
- Население стран с низким уровнем жизни.
- Вегетарианцы.
- Лица, соблюдающие монодиету или голодающие в целях снижения веса.
- Пациенты с заболеваниями почек.
- Пациенты с заболеваниями органов пищеварения.
- Лица с наследственной предрасположенностью к нарушениям белкового обмена.
- Лица с профессионально обусловленным дефицитом веса: балерины, модели, гимнасты.
- Лица старше 60 лет.
Общая информация о заболевании
Белки относятся к числу основных питательных веществ, выполняющих в организме следующие функции.
- Строительная - белок входит в состав всех клеток человеческого тела и, по сути, является основой существования жизни.
- Каркасная - белки участвуют в образовании волос и ногтей, формируют защитную оболочку глаза, хрящи, сухожилия и связки. Даже такое свойство, как гладкость кожи, напрямую зависит от содержащегося в ней белка.
- Двигательная и сократительная. Белки являются основным компонентом мышечной ткани, обеспечивающим ее работу.
- Транспортная. Многие белки обладают способностью связываться с питательными веществами, содержащимися в крови, и переносить их к органам и тканям. Примером транспортного белка служит гемоглобин, содержащийся в красных кровяных клетках (эритроцитах) и осуществляющий транспорт кислорода.
- Защитная. В организме вырабатываются специфические белки (антитела), обеспечивающие защиту от микроорганизмов и вирусов.
- Ферментативная. Ферментами называются белки, участвующие во всех химических процессах, происходящих в организме (например, в переваривании пищи).
- Гормональная. Большинство гормонов человеческого тела являются белками.
Реализация этих функций происходит за счет белкового обмена - постоянно протекающих процессов образования (синтеза) и распада белка.
Основные причины белковой недостаточности:
- Тяжелые и длительные заболевания требуют от организма использования всех резервов. Белки тратятся на восполнение энергетических затрат, восстановление погибших клеток. При ряде заболеваний происходят значительные потери белка.
- Хронические заболевания почек (гломерулонефрит, почечная недостаточность, нефротический синдром) могут приводить к выделению значительного количества белка с мочой (протеинурии), вызывая падение уровня белка и хроническую белковую недостаточность.
- Цирроз печени и печеночная недостаточность бывают причиной дефицита белка, особенно на поздних стадиях заболевания, когда развиваются отеки - в брюшной полости может скапливаться жидкость, содержащая большое количество белка (асцит). В печени синтезируются многие необходимые организму белки, а вырабатываемые ею пищеварительные ферменты участвуют в их усвоении. При циррозе нормальная работа печени нарушается и может развиваться белковая недостаточность.
- Ожоги (ожоговая болезнь). При термических ожогах на коже могут образовываться пузыри, заполненные содержащей белок жидкостью. Потери белка при вскрытии этих пузырей бывают весьма значительны.
- Для диареи (поноса) характерна значительная потеря жидкости и пищеварительных соков, содержащих белки.
- Злокачественные новообразования на поздних стадиях способны приводить к тяжелой белковой недостаточности. Белок расходуется на рост опухоли, а также теряется при ее распаде и кровотечении. Образующиеся в опухолевых клетках вещества чужеродны организму. Попадая в кровь, они вызывают его отравление продуктами распада (синдром раковой интоксикации), одним из проявлений которого бывает падение уровня белка. может стать причиной белковой недостаточности за счет усиленного распада белка, а также диабетического поражения почек и вторичной протеинурии.
- Нарушения белково-аминокислотного обмена. Белки являются сложными веществами, которые, подобно цепочке, состоят из звеньев, называемых аминокислотами. Последовательность аминокислот для каждого организма индивидуальна, поэтому поступающий с пищей белок в процессе пищеварения расщепляется до уровня отдельных звеньев, из которых затем составляется собственная последовательность. При этом одни аминокислоты могут образовываться в человеческом организме, другие же (их еще называют незаменимыми) поступают только с пищей. Роль незаменимых аминокислот настолько велика, что без них образование белка становится невозможным. Если какие-либо незаменимые аминокислоты отсутствуют в рационе или не усваиваются, равновесие между распадом и синтезом белка может сместиться в сторону распада и привести к белковой недостаточности.
- Нарушенная усвояемость незаменимых аминокислот относится к наследственным патологиям. В развитии хронической белковой недостаточности наиболее значимы следующие заболевания.
- Фенилкетонурия - нарушение обмена аминокислоты фениланина. Фениланин участвует в образовании практически всех белков человеческого тела, в первую очередь белков нервной системы. Заболевание характеризуется отсутствием или недостаточным уровнем в печени специального белка (фермента), отвечающего за усвоение этой аминокислоты. В результате происходит ее избыточное накопление в тканях. Фенилкетонурия обычно диагностируется в раннем детском возрасте и сопровождается различными расстройствами нервной системы, а также отставанием в физическом развитии. Без лечения может привести к психической инвалидности.
- Обмен тирозина. Тирозин - аминокислота, необходимая для образования одного из основных белковых пигментов человеческого тела - меланина, поэтому одним из проявлений нарушенного его обмена является альбинизм (бледность кожи, обесцвечивание волос и радужной оболочки глаз). Тирозин также требуется для образования гормонов щитовидной железы.
- Нарушения синтеза белка могут приводить к недостаточному образованию белка либо появлению так называемых дефектных, или патологических, белков, которые не способны выполнять свои функции. Например, при таком наследственном заболевании, как серповидно-клеточная анемия, в крови выявляется гемоглобин, который не в состоянии переносить такое же количество кислорода, как нормальный. Причиной приобретенных нарушений белкового синтеза могут стать злокачественные опухоли или прием некоторых лекарственных препаратов.
- Алиментарная (пищеварительная) белковая недостаточность - наиболее частая форма белкового дефицита. Она может развиваться при следующих обстоятельствах:
- Недостаточное поступление белка с пищей. Некоторые диеты предусматривают ограничение животного белка (мяса), замену его растительным или же полный отказ от белков. К белковой недостаточности может также приводить длительное голодание. В последнем случае может начаться необратимый распад белка, представляющий угрозу для жизни.
- Нарушения переваривания белка могут развиваться при заболеваниях желудочно-кишечного тракта, сопровождающихся недостаточной продукцией пищеварительных соков, например при атрофических гастритах с пониженной секреторной функцией.
В зависимости от степени выраженности недостаток белка может приводить к:
- отставанию в умственном и физическом развитии;
- ослаблению памяти и интеллекта;
- ослаблению защитной системы организма.
Диагностика
Белковая недостаточность в первую очередь может быть заподозрена у пациентов с дефицитом массы тела, а также у лиц с симптомами заболеваний, для которых характерен дефицит белков. Для подтверждения диагноза проводится комплекс исследований.
- Общий анализ крови относится к числу базовых исследований.
- Уровень эритроцитов и гемоглобина может быть понижен (анемия) у пациентов с тяжелыми формами белковой недостаточности при общем истощении. Нормальное содержание эритроцитов при низком уровне гемоглобина может наблюдаться при его недостаточном образовании или избыточном разрушении. Такое состояние называется гипохромной анемией.
- Лейкоциты. Рост числа лейкоцитов с появлением в лейкоцитарной формуле молодых клеточных может указывать на инфекционно-воспалительный процесс, явившийся причиной белковой недостаточности.
- Скорость оседания эритроцитов (СОЭ) также относится к показателям, указывающим на воспалительный процесс как причину белкового дефицита.
- Общий анализ мочи является основным при исключении или подтверждении почечной причины белковой недостаточности. Включает в себя изучение следующих параметров.
- Цвет мочи. В норме оценивается как соломенно-желтый. Красное или коричневое окрашивание может наблюдаться при поступлении в мочу крови (гематурия) и указывать на серьезные почечные расстройства. Темно-коричневая моча, особенно в сочетании с желтушностью, характерна для заболеваний печени.
- Прозрачность. Нормальная моча прозрачна. При заболеваниях почек она бывает мутной за счет значительного содержания гноя (пиурия) или солей.
- Удельный вес мочи - показатель эффективности работы почек. При белковой недостаточности, вызванной поражением почек, он может значительно снижаться.
- Белок в анализе мочи в норме отсутствует. При положительном тесте (протеинурии) проводят количественное определение белка в моче и обязательно исследуют его состав. Альбумин - наиболее часто выявляемый вид белка, однако могут обнаруживаться и другие белки, например иммуноглобулины, гемоглобин, миоглобин и другие. Степень протеинурии позволяет косвенно судить об уровне и тяжести поражения почек.
- Исследование мочи с помощью специальных тест-полосок проводится для выявления протеинурии - выделения белка с мочой. Положительный результат может стать первым указателем на почечное происхождение белковой недостаточности. В таком случае необходима микроскопия осадка. Исследование осадка мочи:
- Красные кровяные клетки - эритроциты белковой недостаточности, обусловленной патологией почек, могут присутствовать в моче в большом количестве. Наличие измененных обесцвеченных эритроцитов позволяет заподозрить поражение клубочков (гломерулонефрит).
- Цилиндры формируются в почечных канальцах из белка, лейкоцитов, эритроцитов, эпителия. Выявление цилиндров, особенно белковых, может указывать на почечное происхождение белковой недостаточности.
- Белок в сыворотке крови. Исследование является "золотым стандартом" при изучении белкового обмена и подтверждении белковой недостаточности. Уровни белка в плазме крови и тканях находятся в состоянии равновесия. При потере тканевого белка уровень белков плазмы также снижается, что и определяет значимость этого параметра.
- Белковые фракции сыворотки крови. Определение количественного состава и соотношения видов белка в сыворотке крови. Общий белок сыворотки представлен альбуминами и глобулинами, выполняющими различные функции. Основную часть составляет альбумин - главный строительный белок организма. Колебания его уровня в наибольшей степени отражают состояние белкового обмена. Глобулины более специфичны по своему предназначению. Это белки защитной системы, маркеры воспалительных реакций и специальные транспортные белки. При различных патологических состояниях соотношение и количество белков того или иного вида может существенно меняться, а в некоторых случаях появляются дополнительные (патологические) белковые фракции. По соотношению отдельных фракций белкового состава крови в некоторой степени можно судить о причине белковой недостаточности. Например, при поражении печени и почек может снижаться уровень альбумина. Глобулины повышаются при воспалительных процессах, отражая активность воспаления или иммунной (защитной) системы. Снижение уровня глобулинов может указывать на заболевания почечных канальцев, а также наблюдаться при нарушенной функции печени и при угнетении иммунной системы организма (как при тяжелых формах сепсиса).
- Глюкоза (сахар крови). Определение уровня глюкозы может быть назначено при подозрении на белковую недостаточность, обусловленную сахарным диабетом. Поражение почек при сахарном диабете (диабетическая нефропатия), а также усиление распада белка могут быть причиной белковой недостаточности.
- Мочевина и креатинин в сыворотке крови. Это вещества, образующиеся в процессе распада белков. При интенсивном разрушении белка уровень их в крови может повышаться. Показатель следует оценивать вместе с уровнем мочевины в суточной моче.
- Мочевина в суточной моче отражает эффективность работы почек. При интенсивном распаде белка может существенно повышаться. Низкий уровень мочевины в моче при повышении его в крови больше характерен для почечной недостаточности.
- Креатинин в суточной моче - индикатор нарушения выделительной способности почек, о которой свидетельствует снижение его уровня. Для более точной оценки рассчитывается клиренс креатинина, представляющий собой соотношение его уровней в суточной моче и крови. При почечных формах белковой недостаточности этот показатель может существенно снижаться.
- Копрограмма - исследование кала, позволяющее выявить возможные нарушения основных этапов пищеварения. Оценивается химический состав каловых масс, их цвет, запах, консистенция, выявляются отдельные виды микроорганизмов (дисбактериоз). Анализ позволяет оценить активность основных ферментов печени, желудочного и кишечного сока, поджелудочной железы. При белковой недостаточности, вызванной нарушением усвоения белка, в каловых массах могут обнаруживаться непереваренные мышечные волокна.
Дополнительные (инструментальные) методы исследования
Объем диагностических исследований зависит от предполагаемой причины белковой недостаточности и должен определяться лечащим врачом. К числу основных методов диагностики относятся:
- Ультразвуковое исследование органов брюшной полости. Врач может назначить его, чтобы исключить заболевания печени и поджелудочной железы, а также почек. оно сочетает в себе высокую информативность и безопасность для пациента. Ультразвук проходит сквозь мягкие ткани до исследуемого органа и, отразившись, возвращается обратно. Полученное изображение передается на монитор. Исследование позволяет оценить размеры внутренних органов, структуру их тканей, выявить опухолевое поражение или кисту, исключить наличие жидкости в брюшной полости. При необходимости исследование может быть дополнено биопсией под УЗИ-контролем.
- Эзофагогастродуоденоскопия. Представляет собой непосредственный осмотр пищевода, желудка и двенадцатиперстной кишки. Оценивается проходимость верхних отделов пищеварительного тракта, состояние слизистой оболочки, степень ее воспаления или атрофии. В процессе исследования может быть взят фрагмент ткани на анализ (биопсия). Наряду с УЗИ гастроскопия является обязательной при подозрении на алиментарный характер белковой недостаточности.
- Суточная РН-метрия. Это изучение суточных колебаний кислотности желудочного сока. Зонд с размещенным на его конце датчиком помещается в желудок, и информация, поступающая с него, записывается портативным устройством, закрепленным на поясе пациента. Основная часть белка, поступающего с пищей, переваривается в желудке под воздействием соляной кислоты и пепсина - фермента, расщепляющего белок. Если кислотность желудочного сока снижена, переваривание белка может быть нарушено.
- Энтероскопия (интестиноскопия). Осмотр тонкой кишки. Исследование по своим возможностям аналогично гастроскопии, но технически более сложно, так как предусматривает осмотр всей тонкой кишки. Позволяет оценить состояние слизистой, исключить эрозивное поражение и взять содержимое на анализ для исключения инфекционного процесса.
- Колоноскопия - осмотр толстой кишки. При белковой недостаточности может назначаться пациентам с подозрением на опухоль кишечника или язвенные колиты, при которых вероятна значительная потеря белка.
Лечение
Лечение белковой недостаточности направлено на восполнение объема белка и нормализацию белкового обмена. Одновременно лечится основное заболевание.
Белково-энергетическая недостаточность
Белково-энергетическая недостаточность (БЭН) - тяжелая, при длительном течении летальная системная патология, обусловленная дефицитом высококалорийных соединений и белковой пищи в организме, или же нарушениями метаболизма таких продуктов.
Если в странах третьего мира БЭН зачастую приобретает эпидемический характер, особенно распространена среди детей, в т.ч. самого раннего возраста, и практически всегда связана с банальным голодом, непропорциональным преобладанием растительной пищи при хроническом дефиците белка, низким общим уровнем жизни и другими социально-экономическими факторами, то в более благополучных странах, - где белково-энергетическая недостаточность также не является спорадической редкостью, - причины БЭН более разнообразны, а сама патология встречается преимущественно у социально-заброшенных лиц пожилого и старческого возраста.
2. Причины
Различают первичную и вторичную белково-энергетическую недостаточность.
Первичная непосредственно связана с алиментарным фактором, т.е. с недостаточным потреблением питательных веществ (чаще всего речь идет не только о белковых продуктах, но и о питании как таковом, т.е. дефицит белка и высокоэнергетической пищи сопровождается также дефицитом ключевых витаминов и микроэлементов). В свою очередь, причиной такого дефицита может быть не только элементарное отсутствие еды в достаточном количестве, но и фанатичные религиозные посты и самоистязания, к которым вполне можно отнести и экстремальные диеты «для похудения».
Вторичная БЭН обусловлена нарушениями метаболизма, заболеваниями ЖКТ (при которых страдает всасывающая функция кишечника и необходимые соединения не усваиваются), эндокринными расстройствами, инфекциями и паразитозами, иногда сердечнососудистой патологией (кардиальная кахексия, т.е. связанное с сердечной недостаточностью тотальное истощение, характеризуется особенно высокой летальностью), психическими заболеваниями (напр., анорексия или тяжелая депрессия), иммунодефицитными состояниями, агрессивными онкопроцессами (при которых наступает специфическая «мумификация»).
Этот перечень, если проанализировать его внимательно, объясняет преобладание среди больных БЭН детей раннего возраста (для организма которых особенно опасны любые алиментарные дефициты, перекосы и нарушения обмена веществ) и стариков, - особенно тех, кто в забвении и заброшенности доживает свой век в домах престарелых, страдая от равнодушного, а иногда и жестокого обращения, от латентных и клинически явных, но не получающих достаточного терапевтического ответа депрессий, деменций и других психопатологических расстройств сенильного возраста.
3. Симптомы и диагностика
В клинике первичной белково-энергетической недостаточности выделяют три основные формы.
Алиментарный маразм (т.н. сухая форма БЭН) характеризуется глубокой утратой массы тела за счет атрофии мышечной ткани и истощения всех жировых подкожных запасов; патологическими изменениями в составе костных тканей, что приводит к их прогрессирующему истончению и хрупкости.
Квашиоркор (влажная, одутловатая форма) проявляется жировой дистрофией печени, задержкой жидкости в организме, т.е. системными и периферическими отеками, изменениями состава крови; масса тела утрачивается не так катастрофично, как при маразме.
Различия обусловлены тем, какой компонент дефицита преобладает в данном случае - белковый или энергетический; в свою очередь, это делает различные формы БЭН эндемичными заболеваниями, поскольку упомянутый дисбаланс в значительной степени зависит от особенностей доступного в регионе рациона. Существенного клинического или прогностического значения, однако, форма БЭН не имеет. Кроме того, распространена простая форма (смешанная, маразматический квашиоркор), сочетающая, как следует из определения, черты маразма и квашиоркора в примерно равных пропорциях.
Для любых форм белково-энергетической недостаточности характерны задержки психофизического развития у детей, угнетение психической деятельности взрослых. При отсутствии лечения и кардинальных изменений в условиях жизни и питания прогрессирует полиорганная и мультисистемная недостаточность, которая с определенного момента становится необратимой и результирует летальным исходом.
В большинстве случаев БЭН не составляет никакой диагностической сложности: достаточно стандартного осмотра и изучения анамнеза. Лишь в тех указанных выше случаях, когда белково-энергетическая недостаточность развивается и протекает на фоне достаточного питания, может потребоваться углубленное обследование с привлечением ряда профильных специалистов.
4. Лечение
В случае алиментарного происхождения БЭН первоочередными задачами, разумеется, являются восстановление нормального по объему и сбалансированного по составу питания, - что, однако, делается с большой осторожностью и в соответствии со специально разработанной тактикой. Необходимо нормализовать водно-электролитный баланс, стимулировать иммунитет, ослабленный кахексией, и принять все прочие меры по восстановлению естественных функций и нормальной жизнедеятельности организма.
В наиболее тяжелых случаях, когда самостоятельный прием пищи пациентом исключен, прибегают к кормлению через зонд.
Прогноз зависит, главным образом, от стадии заболевания, на которой начинается адекватная терапия, а также от наличия или отсутствия присоединившихся инфекций и других сопутствующих заболеваний.
Заболевания Жалобы и симптомы- Высокая температура тела
- Иммунитет снижен
- Боли различной локализации
- Резкое снижение или набор веса
- Плохая работы желудка тракта
- Частые ОРЗ, ОРВИ
- Слабость, головокружение, недомогания
Если вы обнаружили у себя подобные симптомы, возможно, это сигнал заболевания, поэтому рекомендуем проконсультироваться с нашим специалистом.
Диагностика- ЭКГ (электрокардиограмма)
- Общий анализ крови
- Биохимический анализ крови
- Общий анализ мочи
- Пульсоксиметрия
- Консультация терапевта - от 1500 р.
- Биохимический анализ крови (стандартная, 10 показателей) - 2470 р.
- Биохимический анализ крови (расширенаяая, 14 показателей) - 3565 р.
- Общий анализ крови - 675 р.
- ЭКГ (электрокардиография) - 1500 р.
- Общий анализ мочи - 320 р.
- Пульсоксиметрия - 500 р.
Мы стараемся оперативно обновлять данные по ценам, но, во избежание недоразумений, просьба уточнять цены в клинике.
Данный прайс-лист не является офертой. Медицинские услуги предоставляются на основании договора.
Недостаточность питания в пожилом и старческом возрасте

Распространенность недостаточности питания у людей старше 60 лет составляет 10-40 %. Недостаточное питание ухудшает качество жизни и функциональный статус пациентов пожилого и старческого возраста. Развитие нарушений питания может быть связано с различными факторами. Диагностика недостаточности питания направлена на ее выявление и поиск причин. Лечение должно быть комплексным, включающим адекватную нутритивную поддержку и коррекцию факторов, приведших к развитию недостаточности питания. Необходимо помнить, что некоторые нарушения питания могут стать причиной развития или прогрессирования различных гериатрических синдромов (падений, недержания мочи, когнитивных расстройств, депрессии и т. д.).
Ключевые слова
Полный текст
Недостаточность питания (англ. malnutrition) — состояние, которое развивается в результате недостаточного потребления или усвоения пищи и компонентов и приводит к изменению состава тела (потери безжировой массы и активной клеточной массы), снижению уровня физического функционирования или когнитивных функций, а также к ухудшению клинического исхода заболеваний.
E40-E46. Недостаточность питания;
E41. Алиментарный маразм;
E42. Маразматический квашиоркор;
E43. Тяжелая белково-энергетическая недостаточность неуточненная;
E44. Белково-энергетическая недостаточность умеренной и слабой степени;
E46. Белково-энергетическая недостаточность неуточненная.
Эпидемиология
Распространенность недостаточности питания разной степени тяжести среди лиц в возрасте 60-74 лет, имеющих полиморбидные состояния, составляет 10-20 %, а среди пациентов старше 75 лет — около 40 %. Недостаточность питания у пожилых людей, проживающих в пансионах и реабилитационных центрах, достигает 50 %. У пациентов с онкологическими заболеваниями недостаточность питания встречается почти в 90 % случаев.
Истинная распространенность недостаточного потребления витаминов и минералов, особенно в пожилом и старческом возрасте, неизвестна. По данным исследований, около 50 % пожилых людей потребляют витамины и минералы в количестве ниже рекомендованного. По данным метаанализа, проведенного в 2015 г., наиболее часто в рационе питания у людей старше 65 лет встречается недостаточное потребление витамина D (84 % мужчин и 90 % женщин), В1 (50 % мужчин и 40 % женщин), В2 (41 % мужчин и 31 % женщин), кальция (65 % мужчин и 73 % женщин), магния (73 % мужчин и 41 % женщин), селена (30 % мужчин и женщин). Около 20-30 % пожилых потребляют недостаточно витаминов А, С, Е и йода.
Скудное питание ухудшает качество жизни и функциональный статус пожилого человека, снижая уровень физической активности, замедляя скорость восстановления после перенесенных заболеваний и оперативных вмешательств, увеличивая длительность пребывания в ста ционарах.
Этиология
К развитию недостаточности питания в пожилом и старческом возрасте часто приводит не одна причина, а несколько, зачастую связанных между собой. Основные факторы, влияющие на развитие недостаточности питания в пожилом и старческом возрасте, — пищевые привычки, выработанные в течение жизни, снижение зрения, вкуса, обоняния, гормональные изменения в системе, отвечающей за чувство насыщения, прием лекарственных препаратов (табл. 1), трудности при приготовлении пищи вследствие артритов и слабости мышц, стоматологические проблемы, снижение когнитивных функций, депрессия, хронические заболевания, сопровождающиеся и не сопровождающиеся воспалением, а также социально-экономический статус (рис. 1).
Таблица 1. Влияние лекарственных препаратов на риск развития дефицита различных нутриентов
Название препарата или группы препаратов
Последствия приема (влияние на аппетит и развитие дефицита минералов и витаминов)
Ингибиторы АПФ (каптоприл)
Витамины В1, В6, С, калий, магний, цинк
Кальций, коэнзим Q10
Блокаторы кальциевых каналов
Витамины В1, В12, фолиевая кислота
Витамин В12, фолиевая кислота, коэнзим Q10
Препараты сульфонилмочевины и лития
Нарушение поглощения и высвобождения йода щитовидной железой
Антациды (карбонат кальция)
Витамин В1, кальций, фосфор
Витамины D, K, B6, B12, фолиевая кислота, кальций
Фенобарбитал (корвалол), антипсихотические средства, антидепрессанты
Витамины А, С, D, фолиевая кислота, кальций, хром, магний, селен, цинк, фосфор. Задержка натрия и воды
Витамины B1, B2, B3, B5, B6, B12, K
Кальций, магний (тетрациклин)
Кальций, железо (ципрофлоксацин)
Ингибиторы протонной помпы, H2-гистаминоблокаторы
Витамины В12, С, D, фолиевая кислота, железо, кальций, магний
Витамины А, D, Е, K, калий
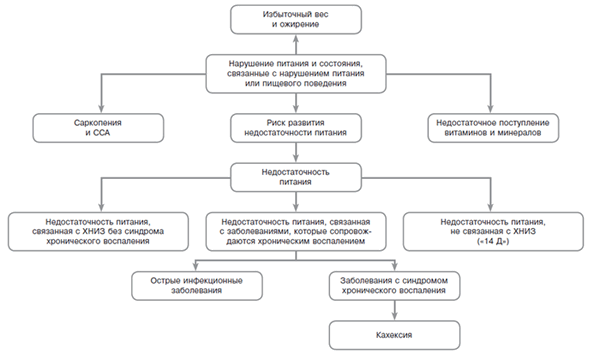
Рис. 1. Состояния, связанные с нарушением питания. ССА — синдром старческой астении; ХНИЗ — хронические неинфекционные заболевания
Начальные инволютивные изменения желудочно-кишечного тракта (ЖКТ), сопровождающиеся нарушением моторики, постепенным разрастанием соединительной ткани в стенке кишки, нарушением ее кровоснабжения, атрофией слизистой оболочки и снижением секреции секреторного иммуноглобулина А, начинаются в 40-50 лет. Эти изменения оказывают неблагоприятное влияние на состояние питания человека. Например, атрофия слизистой желудка ведет к снижению синтеза соляной кислоты, пепсина и внутреннего фактора Касла, что приводит к нарушению переваривания и усвоения белка (мяса, рыбы и т. п.) и витамина В12. Снижение синтеза соляной кислоты в желудке способствует избыточному бактериальному росту в кишечнике, ведущему к развитию синдрома слепой кишечной петли (застойная кишечная петля, англ. blind loop syndrome, stagnant loop syndrome). Клинические проявления синдрома слепой кишечной петли: избыточное газообразование, диарея со стеатореей, мальабсорбция и снижение массы тела. Развивающаяся при этом синдроме хроническая диарея встречается у 3-5 % пожилых людей и является фактором риска развития дизэлектролитемии, гипо- и авитаминоза, обезвоживания, гипоперфузии других органов и тканей и развития недостаточности питания.
Нарушения аппетита и обоняния в пожилом и старческом возрасте наблюдаются у 50 % пожилых людей и достигают максимума к 80 годам. У 25 % происходит постепенное снижение числа вкусовых рецепторов на языке, пропадает способность определять один из пяти вкусов (сладкий, горький, соленый, кислый, умами). Чувствовать горький или кислый вкус люди перестают в последнюю очередь.
Дополнительный вклад в нарушение аппетита в пожилом и старческом возрасте вносит возраст-ассоциированное снижение секреции оре ксигенных гормонов (опиоидов, нейропептида Y, норадреналина, орексина, грелина, галанина, серотонина и кокаин-амфетамин стимулирующего фактора) и увеличение синтеза анорексигенных стимуляторов (холецистокинина, панкреатического пептида, лептина, инсулина).
С возрастом развивается слабость жевательной мускулатуры, снижается активность слюнных желез, атрофируется слизистая оболочка, из-за увеличения стоматологических проблем пожилые люди часто отказываются от употребления твердых продуктов (овощей, орехов и т. п.), сухой (хлеб), липкой (мед) и трудно поддающейся разжевыванию (мясо) пищи. Это приводит к снижению количества потребляемого белка, витаминов А, С, В6, В1, В2, кальция и железа.
Ксеростомия разной степени выраженности встречается у 20 % пожилых людей. Клинические признаки ксеростомии — сухость во рту, гиперемированная, легкоранимая слизистая, эрозии на слизистой оболочке, трещины, хейлит, кариес зубов, а также частые воспалительные и грибковые заболевания полости рта. Дополнительные факторы риска развития ксеростомии — прием лекарственных препаратов (около 400 из них могут снижать активность слюнных желез, в том числе гипотензивные, антиаритмические и противопаркинсонические, антидепрессанты и диуретики) и сопутствующие хронические заболевания (сахарный диабет, артериальная гипертензия, тиреотоксикоз, ревматоидный артрит и др.).
Заболевания, сопровождающиеся хроническим или острым воспалением, способствуют повышению в организме уровня провоспалительных цитокинов (фактор некроза опухоли α, интрелейкин-1, 6), катаболических гормонов (глюкокортикостероидов, катехоламинов) и снижению уровня анаболических гормонов (соматотропного гормона, инсулина, половых стероидов). Данные изменения ведут к снижению аппетита, катаболизму мышечной ткани и потере массы тела. Дополнительными факторами, увеличивающими риск развития недостаточности питания, являются синдром мальабсорбции и повышенный расход некоторых веществ при определенных заболеваниях. Например, при хронической сердечной недостаточности может возникать отек кишечной стенки, способствующий нарушению абсорбции пищи, при длительной лихорадке развивается недостаточность витамина В2. При болезни Крона воспаление может быть триггером развития недостаточности питания на начальном этапе, но не оказывает клинически значимого воздействия на более поздних стадиях развившейся недостаточности питания.
Нередко причиной недостаточности питания становятся когнитивные нарушения и депрессия. Потеря способности к самообслуживанию или частичная зависимость от посторонней помощи также могут приводить к развитию недостаточности питания.
Снижение уровня физического функционирования и силы мышц, артрозы, артриты могут стать причиной снижения способности пожилых пациентов покупать продукты, самостоятельно готовить и принимать пищу, что также будет приводить к развитию недостаточности пи тания.
Еще одна частая причина развития недостаточности питания в пожилом возрасте — дисфагия. Она рассматривается как затруднение в начале глотания (обычно определяется как ротоглоточная дисфагия) или как ощущение наличия препятствия при прохождении пищи/жидкости от рта до желудка (обычно определяется как пищеводная дисфагия). Синдром дисфагии у пациента ведет к отказу от приема пищи и развитию недостаточности питания. Основные клинические признаки ротоглоточной дисфагии: носовая регургитация, кашель, «носовая» речь, ослабленный кашлевой рефлекс, приступы удушья, дизартрия. Для пищеводной дисфагии характерны ощущение препятствия при прохождении пищи/жидкости по пищеводу, чувство «застревания» пищи/жидкости, необходимость запивать пищу, боль по ходу пищевода при глотании, срыгивание, потеря массы тела.
К социальным факторам, вызывающим недостаточность питания, относятся одиночество, социальная изоляция, низкий уровень доходов.
Следует также упомянуть намеренное снижение массы тела или отказ от употребления определенных продуктов (с высоким содержанием холестерина, соли, соблюдение поста).
Диагностика
Диагностика недостаточности питания состоит из двух этапов: скрининга, нацеленного на выявление риска развития или существующей недостаточности питания, и более углубленного обследования, если эти состояния выявлены.
1. Скрининг недостаточности питания
- Измерение массы тела с расчетом индекса массы тела (ИМТ) и определение степени потери массы по сравнению с предыдущим измерением. Масса тела у пожилых людей должна измеряться в амбулаторной практике при каждом посещении врача. По возможности пациентов следует взвешивать в нижнем белье, в одно и то же время.
Согласно рекомендациям Европейского общества парентерального и энтерального питания, критериями диагностики недостаточности питания является наличие любых двух следующих признаков:
- непреднамеренное снижение массы тела более чем на 10 % за любой период времени или на 5 % за три предшествующих месяца;
- ИМТ < 20 кг/м2 у людей младше 70 лет и ИМТ < 22 кг/м2 у людей старше 70 лет;
- индекс безжировой массы (fat free mass index, FFMI) < 15 кг/м2 у женщин или < 17 кг/м2 у мужчин.
Важно помнить, что в основе недостаточности питания лежит именно непреднамеренное снижение массы за счет потери сухой массы тела и активной клеточной массы. Вследствие этого ИМТ > 22 кг/м2 не исключает развития недостаточности питания.
- Оценка аппетита (табл. 2) и количества приемов пищи, их изменений за последнее время, оценка качества принимаемой пищи.
Таблица 2. Простой опросник оценки аппетита (Simplified Nutritional Appetite Questionnaire, SNAQ)
Профилактика белково-энергетической недостаточности

Оперативное вмешательство, независимо от вида сопровождающей его анестезии, вызывает мощные метаболические сдвиги в организме, выраженные нарушениями всех видов обмена веществ, особенно белкового и энергетического. Расстройства белкового обмена являются ведущим фактором риска развития послеоперационных метаболических расстройств и снижения защитных сил организма, которые, в свою очередь, замедляют сроки восстановления целостности поврежденных тканей, адекватной функциональной активности различных органов и систем, течения общего и местного воспалительного процесса.
К настоящему времени достигнут высокий уровень в разработке хирургической техники оперативного лечения гастродуоденальных язв. Благодаря современным достижениям удалось разработать индивидуальные подходы к выбору метода операции. Однако любое оперативное вмешательство является колоссальным стрессом для организма человека в целом и отдельных его систем. В максимальной степени это касается больных пожилого и старческого возраста. Выполненные операции спустя больший или меньший отрезок времени у ряда больных приводят к различным формам послеоперационных расстройств, требующих упорного консервативного лечения и иногда пожизненной индивидуализации пищевого рациона.
Опыт свидетельствует, что даже если в раннем послеоперационном периоде выполнен весь необходимый объем нутриционного обеспечения больного, адекватно компенсирующий все метаболические затраты организма на оперативное вмешательство, это не может гарантировать профилактику развития на последующих этапах реабилитации одного из наиболее частых отдаленных послеоперационных осложнений у лиц пожилого возраста — белково-энергетической недостаточности (БЭН). Именно развитие этого синдрома, как показывает клиническая практика, у больных людей пожилого возраста может стать инициирующим фактором снижения общей реактивности организма, развития иммунной недостаточности и связанных с ними инфекционно- воспалительных процессов, регенераторных нарушений, дисбиотических явлений и др.
Доказано, что БЭН в отдаленном послеоперационном периоде может характеризовать собой причинную обусловленность развития дисфункции всех звеньев пищеварительного конвейера, нарушений функции печени и поджелудочной железы, усугубляющих, в свою очередь, механизмы и клинику белково-энергетической недостаточности. Общеизвестно, что у лиц пожилого возраста формирование дефицита белка может не только активизировать, но и инициировать все виды патологии рассматриваемого возраста, включая сердечно-сосудистые заболевания, болезни дыхательной системы, мочевыделения и т. п. Наконец, белково-энергетическая недостаточность — один из доказанных внутренних факторов, активно влияющих на скорость старения организма, придающий дополнительную интенсивность патологическим механизмам инволюции.
Поэтому целью нашего исследования явилась разработка системы диетической профилактики БЭН на основе ее прогноза у больных пожилого возраста, перенесших оперативное лечение болезней желудка и двенадцатиперстной кишки.
Подготовительный этап
В ходе обследования нами было осмотрено 268 больных пожилого возраста (61-75 лет; женщин — 76 человек, мужчин — 192), прооперированных за последние 5 лет по поводу различных гастродуоденальных заболеваний: язвенной болезни желудка (78 больных), язвенной болезни двенадцатиперстной кишки (13 больных), симптоматических язв желудка различного генеза — трофических, гемодинамических и др. (44 больных), неязвенных кровотечений (64 больных), синдрома Золлингера — Эллисона (5 больных), тяжелого эрозивного гастрита (8 больных), доброкачественных опухолей и полипов желудка (16 больных), синдрома Маллори — Вейсса (12 больных) и некоторых других патологических процессов.
Злокачественный характер заболеваний у всех был исключен либо при комплексном, преимущественно эндоскопическом, предоперационном обследовании пожилых больных (243 пациента, т. е. 90,7 %), либо интраоперационно. Важно отметить, что большинство больных (183 больных, т. е. 68,3 %) поступили в стационар по экстренным показаниям: профузное желудочно-кишечное кровотечение, перфорация или пенетрация язвы, декомпенсированный стеноз выходного отдела желудка и некоторые другие.
Всем 268 больным, поступившим в хирургический стационар, проводилось комплексное обследование, включавшее не только традиционные для клиники абдоминальной хирургии методы исследования (эндоскопию, Rö-диагностику, компьютерную томографию, стандарты лабораторных показателей), но и все необходимые параметры для прогноза возникновения белково- энергетической недостаточности (Барановский А. Ю., 2002; Барановский А. Ю. и др., 2010). Основные из лабораторных методов оценки нутриционного статуса, характеризующих висцеральный пул белка: общий белок, альбумин, преальбумин, трансферрин, показатели белковосинтетической функции печени. Пациентам проводилось исследование инсулина, альдостерона, кортизола и соматостатина в плазме крови как важнейших регуляторных факторов течения белкового и энергетического видов обмена веществ. Проводился анализ крови на содержание минеральных веществ (Fe, K, Na, Ca, Mg, Cl, P), осуществлялась оценка основных параметров иммунного статуса.
Всем больным, поступившим в стационар, проведена послеоперационная (через 7-10 дней после хирургического вмешательства) диагностика нутриционного статуса как основополагающий блок исследовательской программы прогноза послеоперационной белково-энергетической недостаточности у пожилых людей. Для этого был использован биоимпедансный анализатор состава тела, обеспечивший количественной информацией о состоянии скелетной мускулатуры, содержании жира и воды в организме, активной и сухой клеточной массе, основном обмене веществ. В карту прогноза вносилась величина оценки индекса массы тела.
Гистохимическое исследование биоптатов слизистой оболочки тонкой кишки проводилось для изучения активности пищеварительных ферментов в проксимальном отделе тонкой кишки. Материал для исследования брался прицельно в ходе фиброгастродуоденоскопии из слизистой оболочки дистального отдела двенадцатиперстной кишки на расстоянии 3-5 см от дуоденоеюнального перехода. В гомогенатах слизистой оболочки двенадцатиперстной кишки выявлялась активность мембранных ферментов: аланинаминопептидазы (ААП), щелочной фосфатазы (ЩФ) и преимущественно внутриклеточных дипептидаз. Активность трансмембранных и цитозольных ферментов выражалась в мкмолях продуктов гидролиза, образующихся в минуту, в расчете на 1 г влажной массы ткани.
Алгоритм прогнозирования
Прогноз возникновения послеоперационной БЭН у пожилых больных проводился на основе созданной карты обследования хирургического больного, по разработанному нами в 2010 г. алгоритму принятия прогностических решений. Карта обследования больного состоит из нескольких информационных блоков, содержащих вопросы анамнеза, характера хирургического вмешательства, состояния пищевого обеспечения на догоспитальном этапе. Наибольшее число признаков заболевания, включенных в карту прогноза, освещают состояние метаболизма и функциональные особенности пищеварительной системы пожилого пациента, планирующегося на операцию или прооперированного по поводу гастродуоденальной патологии.
Описание исследования
В исследование включены 268 больных пожилого возраста, прооперированных по поводу неонкологических заболеваний гастродуоденальной зоны в ургентном и плановом порядке. Критерии исключения из исследования: 1) наличие БЭН при поступлении больного в стационар; 2) наличие тяжелой соматической патологии, способной самостоятельно инициировать у больного БЭН.
На основании клинической информации о больных, полученной при лабораторно-инструментальном их обследовании при поступлении в стационар и через 7-10 дней после операции, осуществлялось прогнозирование возникновения БЭН в отдаленном послеоперационном периоде. Положительное прогностическое решение о высоком риске БЭН получено у 179 больных (66,8 %).
Из 179 больных группу исследования составили 104 больных, группу контроля — 75 больных. Все больные групп исследования и контроля в раннем послеоперационном периоде были обеспечены адекватными современными нутриционными программами, индивидуализацию которых осуществляла группа нутриционной поддержки. Больные группы исследования не позднее 7-10 дней после операции в сочетании с фармакотерапией и другими методами реабилитации были обеспечены специализированным разработанным нами диетическим лечением в виде модифицированной диеты Р, назначавшейся на весь период динамического наблюдения за пациентами (3-5 лет). Больные группы контроля в отличие от больных группы исследования получали на всех этапах реабилитации традиционную для данного контингента больных диету: последовательно назначаемые стандартные хирургические диеты — резекционные диеты (протертый и непротертый варианты диеты Р).
Во время динамического наблюдения за больными в группе исследования и в группе контроля проводились регулярные комплексные обследования больных, объем которых был представлен выше. Частота обследования больных: в первый год после операции — 2 раза в год, в дальнейшем — 1 раз в год.
Хотите больше информации по вопросам диетологии?
Приобретите информационно-практический журнал «Практическая диетология» в электронном или печатном формате!
Расшифровка целиакии
В силу особенностей течения рассматриваемого заболевания диагностика его затруднена. Именно поэтому врачу-диетологу, консультирующему пациента, прежде чем назначить диетотерапию, важно понимать природу возникновения целиакии, особенности клинической картины заболевания и остальные не менее важные нюансы, о которых пойдет речь в этой статье.
Определение
Дефицит ферментов, расщепляющих белки растительного происхождения, ведет к непереносимости белков риса, пшеницы и других злаков и развитию заболевания — целиакии (coeliakia; от греч. koilikos — кишечный, страдающий расстройством кишечника). Это необычное заболевание имеет несколько синонимов: глютеновая болезнь, глютеновая энтеропатия, нетропическая спру, болезнь Ги-Гертера-Гейбнера, англ.: — coeliac disease.
Авторы книги «Секреты питания» (Москва, 2009 г.) Чарльз В. Ван Вэй III, Кэрол Айэротон-Джонс дают следующее определение рассматриваемому заболеванию:
«Целиакия, называемая также „нетропическое спру“ или „глютенчувствительная энтеропатия“, — это болезнь детского возраста, вызываемая реакцией на глютен. Более точно, реакция возникает на глиадин-спирторастворимый компонент глютена. Симптомы появляются с детства и включают диарею, рвоту и острый синдром мальабсорбции. Лечение почти полностью нутриционное и сводится к назначению диеты, свободной от глютена и глиадина».
Немного из истории
По данным ряда исследований, первые упоминания о целиакии как заболевании найдены в работах древнегреческих врачей Аретея из Каппадокии и Целия Аврелиана. Они описали хроническую диарею со стеатореей и назвали болезнь “Morbus coeliacus”.
Первое официальное описание клинической картины целиакии датировано 1888 г. Врач Лондонского Бартоломеевского госпиталя S. J. Gee описал наиболее типичные симптомы целиакии: хроническую диарею, истощение, отставание в физическом развитии и анемию. Первая догадка о связи развития целиакии с непереносимостью белка злаковых глютена и развития диареи принадлежит голландскому педиатру W. Dicke. И только более чем через 50 лет G. Vclver и J. French, воспользовавшись предположением W. Dicke о возможной связи целиакии с употреблением в пищу хлеба, исключили из пищевого рациона детей хлебные злаки и убедились в терапевтическом эффекте такой диеты (Парфенов А. И., 2007).
Выдержки из научных теорий
Ключевым моментом в формировании клинической картины целиакии является воздействие глютена на слизистую оболочку тонкой кишки, развитие заболевания реализуется по одному из трех механизмов:
Нормальная слизистая оболочка не может быть повреждена при контакте с глиадиновой фракцией глютена (клейковиной) белка, содержащейся в злаках (пшенице, ржи, ячмене, овсе), так как содержит пристеночные ферменты, расщепляющие его на нетоксические фракции: глутаминилпролил и глицилпролиндипептидазу, гаммааглютаминилтранспептидазу, пирролидонилпептидазу. У больных целиакией эти ферментативные реакции не происходят до конца из-за наличия дефектов разного уровня. Происходит реализация токсического воздействия глиадина и продуктов частичного гидролиза на поверхностный эпителий слизистой оболочки тонкого кишечника.
Рядом научных исследований доказано, что у большинства больных целиакией обнаруживаются антитела (IgA) к глиадину в слизистой тонкого кишечника. Титр антител к глиадину начинает снижаться при проведении безглютеновой диеты. В то же время при морфологических исследованиях установлено значительное увеличение плазмоцитарной инфильтрации подслизистого слоя и содержания плазматических клеток, содержащих IgA, M, G и большое количество межэпителиальных лимфоцитов. В плазме крови, кишечном содержимом, кале обнаруживаются антиретикулярные антитела. Наличие наследственной предрасположенности у 80-90 % пациентов (HLA-B8 и HLA-DR3) определяет формирование по меньшей мере двух генетических дефектов. Генетически кодируемые белки ответственны за запуск продукции антител.
- Пролиферация недифференцированных эпителиоцитов.
При отсутствии ферментов глютен не расщепляется, что приводит к повреждению энтероцитов за счет непосредственного воздействия глютена и за счет антигенной стимуляции слизистой продуктами его неполного расщепления. Этот механизм запуска патологического процесса на слизистой тонкого кишечника ведет к значительному слущиванию эпителия и гибели энтероцитов на фоне повышенной пролиферации эпителиального покрова крипт, не происходит полная компенсация клеток покровного эпителия, в результате чего снижается высота ворсинок, формируется картина вначале порциальной, субтотальной и далее тотальной атрофии ворсинок.
Важно, что в процессе атрофии ворсинок эпителий, выстилающий ворсинки, уплощается, количество бокаловидных энтероцитов резко уменьшается. Ускоренное новообразование клеток приводит к тому, что на поверхности ворсинок оказываются незрелые энтероциты, в которых содержится меньше ферментов, чем в высокодиффенцированном эпителии. Недостаточность протеолитических ферментов в эпителии тонкой кишки больных целиакией доказана гистохимическими и биохимическими методами. Таким образом, в результате повреждения энтероцитов ворсинок глютеном происходит повышенное отторжение клеток в просвет кишки и реактивное по принципу отрицательной обратной связи ускорение регенерации. Это приводит к тому, что на поверхности ворсинок оказываются незрелые энтероциты, неспособные выполнять свои специфические функции.
В результате развивается классическая клиническая картина синдрома мальабсорбции.
Шифр по МКБ-10:
XI. Болезни органов пищеварения.
K90-К93. Другие болезни органов пищеварения.
К90. Нарушения всасывания в кишечнике.
K90.0. Целиакия. Глютенчувствительная энтеропатия. Идиопатическая стеаторея. Нетропическая спру.
Синдром мальабсорбции
Синдром мальабсорбции характеризуется нарушением или неадекватным всасыванием питательных веществ в пищеварительном тракте и включает в себя ряд взаимосвязанных симптомов: диарею, потерю массы тела, белковую недостаточность и признаки гиповитаминоза. Степень проявления и выраженность перечисленных выше симптомов зависит от степени дефицита питания, вовлеченности органов и систем в патологический процесс и нарушения обменных процессов. В связи с этим синдром мальабсорбции может клинически проявляться различной клиникой: от легких проявлений дисфункции желудочно-кишечного тракта с минимальными проявлениями гиповитаминоза до тяжелых расстройств всасывания и метаболических нарушений с потерей массы тела.
Диарея при мальабсорбции может развиваться по двум направлениям: осмотическому и секреторному.
Процесс развития диареи при мальабсорбции профессор Джозеф М. Хендерсон в своем труде «Патофизиология органов пищеварения» (2012 г.) описывает следующим образом:
«Диарея при мальабсорбции развивается преимущественно по принципу осмотического механизма, однако при некоторых общих заболеваниях тонкой кишки может присоединяться и секреторный компонент.
Осмотическая диарея является характерным признаком нарушения всасывания углеводов, так как наличие в просвете кишечника непереваренных и невсосавшихся углеводов за счет их осмотической активности способствует выходу в просвет кишки воды. Более того, когда углеводы попадают в толстую кишку, они метаболизируются бактериями до жирных кислот с короткой цепью, повышающих осмоляльность содержимого толстой кишки, что также сопровождается выходом воды в просвет кишечника. Жирные кислоты с короткой цепью абсорбируются колоноцитами, и это несколько снижает осмоляльность в просвете кишки. Однако, если поступление углеводов в толстую кишку превышает способность микроорганизмов их метаболизировать, углеводы остаются в просвете кишки как осмотически активные вещества. Нарушение всасывания углеводов часто сочетается с метеоризмом из-за ферментативного расщепления углеводов микроорганизмами».
При осмотической диарее повреждается функционально активная поверхность апикальных ворсинок тонкой кишки, что приводит к уменьшению абсорбционной поверхности слизистой оболочки и дисахаридаз, Nа+, К+, АТФ-азы, глюкозостимулированного транспорта. Сохранение в просвете кишечника осмотически активных дисахаридаз приводит к задержке жидкости в просвете тонкой кишки и нарушению реабсорбции воды и солей.
В своей книге «Патофизиология органов пищеварения» (2012 г.) Джозеф М. Хендерсон рассказывает о заболеваниях, способствующих развитию диареи с секреторным компонентом:
«Заболевания, при которых поражается слизистая оболочка тонкой кишки, также вызывают диарею с секреторным компонентом. Например, при повреждении кончиков ворсинок оставшиеся интактными крипты компенсаторно гиперплазируются. Недифференцированные клетки крипт не имеют необходимых дисахаридаз и пептидаз или натрийсвязанных транспортеров, служащих для абсорбции ряда веществ. Клетки также теряют Na+-, H+-антипорт и Сl-, НСО3-антипорт на апикальных участках мембран энтероцитов. Однако эти клетки остаются способными секретировать хлор, благодаря наличию Na+-, K+-ATФ- азы и Na+-, K+-, Cl-котранспортера. Общим результатом является нарушение абсорбции натрия и воды и усиленная секреция осмотически активных хлоридов, приводящая к секреторной диарее».
Схема 1. Симптомокомплекс синдрома мальабсорбции
Распространенность заболевания
Оцененная по клиническим данным, распространенность целиакии составляет 1 на 1000- 10 000 человек (Mylotte М. et al, 1973; Van Stikum J. et al, 1982; Logan R. F. A. et al, 1986). Исследования с использованием серологических и гистологических методов определили распространенность целиакии в отдельных странах значительно выше, а именно 1 на 100-200 человек (Maeki М. et al, 2003; Shahbazkhani В. et al, 2003; Tomassini A. et al, 2004; Tatar G. et al, 2004; Ertekin V. et al, 2005).
Источник: «Скрининг населения Центрального региона России на антитела класса IgA к тканевой трансглутаминазе и применение данного метода обследования для диагностики целиакии у детей», Стройкова М. В., кандидатская диссертация, Москва, 2007 г.
Снижение массы тела
Один из ключевых симптомов развития и прогрессирования синдрома мальабсорбции — снижение массы тела. Основной причиной снижения массы тела является уменьшение поступления в организм основных пищевых компонентов. Главную роль в этом играет белок. Так как при недостаточном поступлении белка организм начинает использовать резервный белок и белок скелетной мускулатуры, внутренних органов.
Профессор Джозеф М. Хендерсон в своей книге «Патофизиология органов пищеварения» (2012 г.) объясняет причины снижения массы тела:
«Причины снижения массы тела при мальабсорбции различны. Характерные для мальабсорбции длительные заболевания слизистой оболочки кишечника вызывают анорексию и, как следствие, общее истощение. При нарушении всасывания питательных веществ в желудочно-кишечном тракте органы начинают использовать запасы жиров и белков организма, что приводит к уменьшению массы тела. Поступление питательных веществ из-за мальабсорбции не соответствует потере запасов, возникает отрицательный баланс между поступлением и потреблением калорий. Несмотря на компенсаторную гиперфагию, у больных наблюдается потеря массы тела».
Белковая недостаточность
Другой основной симптом при развитии синдрома мальабсорбции — белковая недостаточность. Естественный барьер слизистой оболочки кишечника нарушается, что приводит к свободному выходу белков из интерстициального пространства через энтероцит в просвет кишечника. Характерно, что синтез альбуминов в печени не успевает восстановить потери альбуминов плазмы крови. Параллельно в связи с развитием повреждения эпителия слизистой оболочки нарушаются пристеночные процессы пищеварения, гидролиз и всасывание аминокислот, приостанавливается процесс синтеза альбуминов. Проявлением снижения синтеза белков, альбуминов является развитие гипопротеинемии с клиническими проявлениями отека и асцита. В связи с нарушениями структуры слизистой оболочки формируется обструкция лимфатических сосудов, что усиливает потерю белков и лимфы через кишечник за счет повышения гидростатического давления и увеличения интерстициального пространства.
Гиповитаминозы
Развитие гиповитаминозов как проявление нарушения всасывания жирорастворимых витаминов A, D, Е и К происходит по таким же механизмам, как и всасывание жиров пищи. Нарушение образования мицелл, отсутствие щелочной среды в просвете кишечника, нарушение метаболизма в энтероцитах и лимфооттока приводит к нарушению всасывания (Джозеф М. Хендерсон, 2012 г.). Поражение слизистой оболочки тонкого кишечника приводит к нарушению всасывания витаминов.
О механизме нарушения всасывания фолатов (солей фолиевой кислоты) подробно рассказывает Джозеф М. Хендерсон в монографии «Патофизиология органов пищеварения» (2012 г.):
«Нарушение всасывания фолатов встречается при заболеваниях тощей кишки, так как в ней на апикальной мембране энтероцитов имеется фермент конъюгаза. Потеря неповрежденных энтероцитов исключает нормальный метаболизм фолатов и образование 5-метилтетрагидрофолиевой кислоты (многие препараты, такие как метотрексат, способны нарушить образование тетрагидрофолиевой кислоты). Это приводит к нарушению всасывания фолатов.
Для всасывания витамина В12 необходимо наличие внутреннего фактора и интактного состояния слизистой оболочки подвздошной кишки. Нарушения образования соединения ВФ-В12 в двенадцатиперстной кишке (панкреатическая недостаточность, низкий рН в просвете кишки, снижение уровня ВФ) или связывания ВФ-B12 в подвздошной кишке (резекция или воспаление) приводят к нарушению всасывания витамина B12.
Железо абсорбируется в виде геминового или негеминового железа. Нарушение перевода железа из трехвалентного в двухвалентное, вызванное снижением кислотности желудочного сока или развитием дуоденита, а также быстрым сбросом химуса, может приводить к нарушению всасывания. Поскольку геминовое железо всасывается лучше негеминового, его прием препятствует развитию железодефицита в этих случаях».
На уровне генетики
В настоящее время проведена более углубленная расшифровка заболевания целиакии, знание которой очень важно при сборе анамнеза у пациента при проведении дифференциального диагноза неспецифических энтеритов и целиакии.
Об одном из подходов изучения генетических факторов риска при целиакии рассказывает Е. В. Лошкова в своем научном труде — автореферате кандидатской диссертации «Генетические и иммунологические механизмы формирования клинических проявлений целиакии у детей и подростков и их значение в реабилитации» (2009 г.):
«Несмотря на то что заболевание впервые было описано в 1888 г. (Gee S. J.), на сегодняшний день отношение диагностированных к недиагностированным случаям целиакии в Европе находится на уровне от 1:5 до 1:13 (Bai J. et al., 2005). Клиническая картина заболевания настолько полиморфна, что лишь 20-30 % пациентов имеют классические симптомы болезни, в то время как почти 70-80 % случаев целиакии остаются не диагностированными (Hill I. et. al., 2006). Одним из подходов изучения генетических факторов риска при мультифакториальных заболеваниях, к которым относится и целиакия, является концепция молекулярной генетики о пяти ассоциациях полиморфных генетических маркеров с предрасположенностью или устойчивостью к развитию патологии (Sollid L. M. et. al., 2007). Эти специфичные для конкретной патологии маркеры могут быть выявлены задолго до ее клинической манифестации, что позволит определить группы риска, организовать их мониторинг, а в случае необходимости назначить превентивную терапию (Sturges R. P. et al., 2001; Srinivasan U. et al., 2008). Особый интерес представляет изучение генов-кандидатов, если продукт их экспрессии (фермент, гормон, рецептор) прямо или косвенно участвует в развитии патологического процесса (Kim C. Y. et. al., 2004)».
В чем особенность с позиции медицинской генетики формирования целиакии более чем у 95 % больных? Присутствие генов (одного из двух типов HLA-DQ), вызывающих повышение риска возникновения целиакии, приводит к тому, что рецепторы этих генов образуют с пептидами глиадина более сильную связь, чем другие антиген-представляющие рецепторы (antigen-presenting receptor). Именно эти формы рецептора активируют Т-лимфоциты и, соответственно, весь каскад реакций аутоиммунного процесса.
Читайте также:
- Неправильный сон младенца и новорожденных. Какие требования к подушке младенца?
- Оценка функции миокарда при гипертрофии по тканевой допплер-эхокардиографии
- Аллергизация организма при зубном протезировании. Факторы протезной аллергии
- Синдром Ригера (Rieger)
- Рентгенограмма, КТ, МРТ при дефекте развития проксимальных отделов бедренной кости
