Синдром псевдосифилитический - синонимы, авторы, клиника
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образова- ния» МЗ РФ, Москва ; ГБУЗ «Детская городская клиническая больница им. З.А. Башляевой» ДЗ г. Москвы
Для цитирования: TORCH-синдром: клиническая диагностика и этиологическая верификация. РМЖ. 2014;3:194.
TОRCH-синдром, или TОRCH-инфекции, - это обобщенное название, используемое для обозначения группы внутриутробных инфекций (ВУИ). В основе термина, который предложил Andre J. Nahmias в 1971 г., лежит сокращение (по первым буквам) латинских названий наиболее часто верифицируемых врожденных инфекций:
T - токсоплазмоз (Тoxoplasmоsis)
О - другие инфекции (Оther)
R - краснуха (Rubella)
С - цитомегалия (Cytomegalia)
Н - инфекции, вызванные вирусом простого герпеса (Herpes).
В отечественной педиатрической практике наиболее часто используют термин «внутриутробные инфекции», что является синонимом термина «TОRCH-инфекции».
ВУИ - инфекционно-воспалительные заболевания плода и новорожденного. Несмотря на то, что ВУИ имеют различную этиологию, их объединяют общие эпидемиологические закономерности и сходные клинические проявления [1-3, 7-9]. ВУИ возникают в результате анте- или интранатального инфицирования плода.
ВУИ считаются одной из наиболее острых проблем современной медицины, решение которой возможно только при междисциплинарном подходе и совместной работе специалистов-медиков различных профилей (акушеры-гинекологи, инфекционисты, неонатологи, педиатры, эпидемиологи). Актуальность ВУИ обусловлена целым рядом факторов, главными среди которых являются:
- широкая распространенность потенциальных возбудителей среди всех групп населения;
- бессимптомное течение или отсутствие патогномоничных клинических симптомов;
- высокий риск развития патологии у плода или новорожденного при первичном инфицировании женщины во время беременности;
- возможность обострения латентной инфекции у иммунокомпрометированных женщин во время беременности с потенциальным риском внутриутробного заражения плода;
- существенное место ВУИ в структуре неблагоприятных исходов беременности (выкидыши, мертворождение, преждевременные роды);
- тератогенное влияние возбудителей ВУИ на эмбриогенез и ранний фетогенез, приводящее к развитию у плода врожденных пороков. Неблагоприятное влияние внутриутробного инфекционно-воспалительного процесса с поражением ЦНС, сердца, печени, почек и других органов и систем;
- высокий уровень летальности среди новорожденных и грудных детей с манифестными формами ВУИ;
- неблагоприятное воздействие ВУИ на состояние здоровья детей в последующие периоды постнатального развития, в ряде случаев приводящее к инвалидизации и снижению качества жизни в целом.
Истинная частота врожденных инфекций до настоящего времени не установлена, хотя, по данным ряда авторов, распространенность внутриутробного инфицирования в некоторых случаях может достигать 10-15%.
ВУИ во многом определяют уровень перинатальной и младенческой смертности, а также инвалидизацию выживших детей. В подавляющем большинстве случаев источником инфекции для плода является мать. Механизм передачи инфекции - вертикальный. В антенатальный период передача инфекции может происходить трансовариальным, трансплацентарным и восходящим путями, в интранатальный период - контактным, алиментарным. Ятрогенное инфицирование плода встречается крайне редко и только в тех случаях, когда нарушены правила асептики при проведении инвазивных методов пренатальной диагностики (амниоцентез, кордоцентез и др.) и лечения (введение лекарственных средств и препаратов крови через сосуды пуповины и др.) [2, 5, 8, 9].
При антенатальном инфицировании этиология ВУИ представлена, как правило, различными вирусами (цитомегаловирус, вирус краснухи, Коксаки и ЕСНО-вирусы и др.), токсоплазмой и микоплазмой. Интранатальное заражение характеризуется более широким спектром возбудителей и зависит от особенностей микробного пейзажа слизистых оболочек родовых путей матери. Наиболее часто в этот период происходит инфицирование плода такими микроорганизмами, как стрептококки группы В, различные энтеробактерии, стафилококки, герпес-вирусы, ВИЧ, микоплазмы, уреаплазмы, хламидии, грибы и др.
Помимо «классических» возбудителей TОRCH-инфекции установлено патогенное влияние на плод энтеровирусов, ВИЧ, хламидий (Chlamydia trachomatis), микоплазм (Mycoplasma hominis, Mycoplasma genitalium), уреаплазмы (Ureaplasma urealyticum), вирусов гриппа, парагриппа, аденовирусов, парвовируса B19, вирусов герпеса человека 4 и 6 типов и других микроорганизмов [1, 7-9, 11].
Фактором риска внутриутробного инфицирования плода является отягощенный соматический, акушерско-гинекологический и инфекционный анамнез. При этом риск инфицирования значительно повышается при воспалительных заболеваниях урогенитального тракта, неблагоприятном течении беременности (инфекционные заболевания, тяжелый гестоз, угроза прерывания, патологическое состояние маточно-плацентарного барьера) и патологических родах.
Прогноз при ВУИ зависит от срока гестации, в котором произошло инфицирование, особенностей возбудителя (патогенные свойства, тропность и т. д.), функционального состояния иммунной системы матери, состояния маточно-плацентарного барьера и др. Наиболее часто инфицирование плода и развитие тяжелых форм ВУИ отмечают в тех случаях, когда во время беременности женщина переносит первичную инфекцию.
Инфицирование в период эмбриогенеза приводит к самопроизвольному выкидышу или возникновению тяжелых, несовместимых с жизнью пороков развития (табл. 1). Проникновение возбудителя в организм плода в ранний фетальный период ведет к развитию инфекционно-воспалительного процесса, который характеризуют преобладание альтернативного компонента и формирование в поврежденных органах фиброзно-склеротических деформаций. Инфицирование плода в поздний фетальный период может приводить как к поражению отдельных органов и систем, так и к генерализованному воспалению (гепатит, кардит, менингоэнцефалит, хориоретинит, поражение органов кроветворения и др.) (табл. 1). При интранатальном инфицировании клиническая манифестация ВУИ в подавляющем большинстве случаев происходит в ранний неонатальный период, но может отмечаться и в последующие недели жизни.
В МКБ-10 ВУИ представлены в классе XVI «Отдельные состояния, возникающие в перинатальном периоде» в блоках Р35-Р39 «Инфекционные болезни, специфичные для перинатального периода». В зависимости от этиологии выделяют ВУИ вирусного, бактериального и паразитарного генеза (табл. 2).
Клинические проявления TОRCH-синдрома в подавляющем большинстве случаев зависят не только от этиологии, но и от сроков беременности, когда произошло инфицирование. Манифестные формы ВУИ у новорожденных имеют сходные клинические проявления. При этом очень часто дети рождаются раньше срока или с признаками задержки внутриутробного развития, гепатоспленомегалией. Нередко у детей с ВУИ отмечаются желтуха, экзантемы, дыхательные и разнообразные неврологические нарушения, геморрагические синдромы, анемия (рис. 1). При этом необходимо особо подчеркнуть крайне низкую достоверность диагноза, если используется анализ только клинических особенностей заболевания. В то же время достоверную верификацию этиологии ВУИ следует провести как можно раньше, учитывая, что в настоящее время возможно применение эффективных этиотропных лекарственных препаратов для целого ряда ВУИ (ацикловир - при врожденном герпесе, бензилпенициллин - при врожденных сифилисе и стрептококковой В инфекции, ампициллин - при врожденном листериозе, макролиды - при внутриутробных микоплазмозе, хламидиозе и уреаплазмозе, пириметамин + сульфаниламид или спирамицин - при врожденном токсоплазмозе и др.).
Лабораторная верификация этиологии TОRCH-синдрома является ключевым звеном диагностики и определяет возможность своевременного назначения специфической терапии. При этом однотипность клинических проявлений ВУИ обосновывает необходимость безотлагательного проведения лабораторной расшифровки этиологии заболевания. Для этиологической верификации врожденных инфекций используют 2 основные группы методов, условно обозначаемых как «прямые» и «непрямые».
К «прямым» лабораторным тестам относятся методы, направленные на обнаружение самого возбудителя (классические микробиологические, вирусологические), его ДНК или РНК (молекулярно-биологические) или антигенов (иммунохимические). «Непрямые» тесты - методы, позволяющие обнаружить в сыворотке крови пациента специфические антитела к антигенам возбудителя. В последние годы для этого наиболее часто используют иммуноферментный анализ (ИФА).
«Золотым стандартом» лабораторной диагностики ВУИ считается комбинация «прямых» и «непрямых» методов диагностики, что позволяет существенно повысить диагностические возможности лабораторной верификации этиологии ВУИ. При этом наиболее часто из «прямых» методов используют полимеразную цепную реакцию (ПЦР) (специфичность и чувствительность - более 90%), а из «непрямых» - ИФА (специфичность и чувствительность - более 75%) [2, 5, 8-15].
Применяя ПЦР, целесообразно использовать современные методики количественного определения ДНК или РНК инфекционных агентов, основанные на амплификации с гибридизационно-флуоресцентной детекцией продуктов анализа в режиме реального времени, а также параллельно тестировать несколько биологических сред (кровь, спинномозговая жидкость, моча, назофарингеальные мазки, эндотрахеальные аспираты и др.). Подобный подход достоверно увеличивает клиническую информативность проводимых исследований, позволяет оценить динамику развития инфекционного процесса и эффективность этиотропной терапии.
ИФА должен проводиться до введения плазмы и иммуноглобулинов. При этом диагностическое значение ИФА существенно повышается, если обследование новорожденного проводится одновременно с обследованием матери с обязательным определением индекса авидности специфических IgG. Использование «парных сывороток» для определения нарастания концентрации антител в динамике возможно только в тех случаях, если новорожденный не получал препаратов крови (плазмы, иммуноглобулинов и др.) [2, 8, 10].
Критериями верификации этиологии ВУИ является выявление у новорожденного ребенка специфических IgM и/или генома (ДНК, РНК) возбудителя. Косвенным лабораторным признаком ВУИ определенной этиологии является детекция специфических IgG c низким индексом авидности при отсутствии специфических IgM (рис. 2). Диагностическое значение низкоавидных специфических IgG существенно повышается, если при параллельном серологическом обследовании матери у нее выявляют высокоавидные специфические IgG [2, 5, 8, 10].
Таким образом, в настоящее время имеются высокочувствительные и высокоспецифичные методы лабораторной диагностики, которые позволяют быстро и с высокой степенью достоверности верифицировать этиологию заболевания, что определяет возможность раннего начала этиотропной терапии для улучшения прогноза ВУИ.
Синдром псевдосифилитический - синонимы, авторы, клиника
Общая психопатология
Амнестический (или Корсаковский) синдром представлен фиксационной амнезией и вытекающими из нее расстройствами. Компоненты синдрома:
· Фиксационная амнезия — утрата способности запоминать (запечатлевать, фиксировать) происходящие события + «вытекающие» из фиксационной амнезии нарушения:
- Антероградная амнезия на период с момента развития фиксационной амнезии, т.е. с момента, когда пациент перестал запоминать то, что с ним происходит. Во многих случаях дополнительно присутствует и ретроградная амнезия, захватывающая тот или иной период времени до начала болезни, поэтому можно говорить о ретроантероградной амнезии.
- Амнестическая дезориентировка во времени и окружающем из-за неспособности запомнить место пребывания, текущую дату и пр.
- Псевдореминисценциии конфабуляции— заполнение пробелов памяти ложными воспоминаниями.
Амнестический синдром может быть вызван различными органическими поражениями головного мозга, интоксикациями и нарушениями обмена веществ, в том числе при алкоголизме.
Амнестический синдром у больных с алкоголизмом впервые был описан выдающимся русским психиатром Сергеем Сергеевичем Корсаковым в конце XIX в., поэтому во всем мире этот синдром часто называют его именем. Однако в дальнейшем выяснилось, что патогенез амнестического синдрома при алкоголизме (ключевой фактор в этом случае — дефицит витамина B1) является только одним из вариантов патогенеза этого синдрома. Анатомически амнестический синдром может быть связан с поражением гиппокампа (и медиальных височных областей в целом), мамиллярных тел, таламуса.
В отличие от деменции (приобретенного слабоумия), амнестический синдром потенциально может быть обратим (например, у больных алкоголизмом на фоне терапии витаминами группы В способность запоминать происходящие события во многих случаях постепенно возвращается). Кроме того, при амнестическом синдроме должны присутствовать только расстройства памяти, а другие когнитивные функции (в том числе интеллект) должны оставаться относительно сохранными.
В целом семантическая и эпизодическая память на события до развития амнезии при синдроме Корсакова в большинстве случаев остаются сохранными, при этом пациент с фиксационной амнезией, используя свою рабочую память, может вполне компетентно вести разговор на какие-либо общие темы, рассказывать о своей жизни до периода, с которого у него появилось нарушение запоминания, делать достаточно логичные заключения или даже успешно играть в шахматы или домино. Поведение таких пациентов в привычной обстановке (например, дома), а иногда и в стационаре, также может некоторое время не привлекать внимания, так как в случаях затруднений эти больные могут руководствоваться подсказками окружающих и в целом стараться вести себя «как обычно» или «как все». В связи с этим в некоторых случаях развитие амнестического синдрома у пациентов, поступивших в многопрофильные стационары с какими-либо травмами или судорожным синдромом в абстиненции, выявляется лечащими врачами далеко не сразу, обычно в те моменты, когда медперсонал просит пациента самостоятельно что-либо сделать, например, сходить на те или иные процедуры и пр.
Интересно, что одним из первых подтверждений того, что долговременная память состоит из двух независимых типов — декларативной и недекларативной (процедурной) памяти — явились эксперименты с участием больных с амнестическим синдромом: их учили выполнять те или иные непривычные для них действия (например, писать, глядя на отражение рук в зеркало) и, хотя каждый день они встречали экспериментаторов как первый раз, не в состоянии вспомнить, что накануне уже работали с ними и выполняли тесты, но по количеству ошибок в них было очевидно, что сам навык к новому виду деятельности формируется у этих больных теми же темпами, что и у лиц без амнестического синдрома.
Синдром Морриса - симптомы и лечение
Что такое синдром Морриса? Причины возникновения, диагностику и методы лечения разберем в статье доктора Литвинова Владимира Валентиновича, репродуктолога со стажем в 39 лет.
Над статьей доктора Литвинова Владимира Валентиновича работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
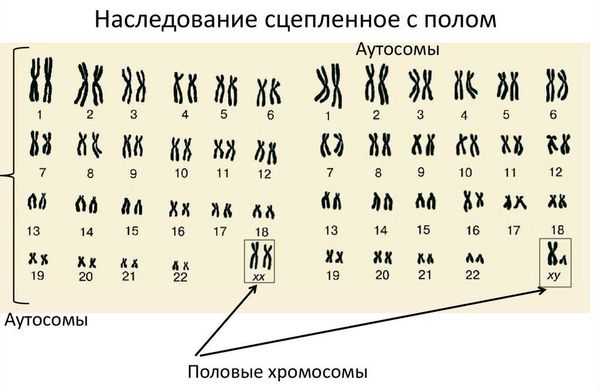
Синдром Морриса (синдром тестикулярной феминизации) — это врождённое генетическое заболевание, при котором у людей мужского пола ткани-мишени не чувствительны к мужским половым гормонам — андрогенам. Человек с синдромом Морриса генетически является мужчиной (имеет кариотип 46 XY), но выглядит как женщина.
Кариотип — это набор хромосом, который передаётся ребёнку от матери и отца. Кариотип позволяет определить характеристики индивида, включая пол. В норме у человека в генетическом наборе присутствует 46 хромосом, из них 22 пары аутосомных (не определяющих пол) и одна пара половых хромосом, которая определяет гендерную принадлежность ребёнка. Половые хромосомы женщины обозначаются как ХХ, мужчины — ХY. То есть нормальный женский кариотип — 46 XX, мужской — 46 XY.
Причина синдрома Морриса — мутации (изменение) гена рецептора андрогенов, у наследованные от матери или возникшие впервые . Мутации обуславливают резистентность (нечувствительность) рецепторов к гормону тестостерону [19] . В этом случае развивается синдром тестикулярной феминизации (СТФ). Ещё это заболевание называют синдромом Морриса — по имени американского гинеколога, который впервые ввёл термин в обиход, подробно описав его в 1953 году. Другие синонимы патологии — синдром нечувствительности к андрогенам, синдром андрогенной резистентности.
Часто мужчины с синдромом Морриса даже не догадываются о своём биологическом поле (как и их родители) и живут как девочки/женщины. Это объясняется тем, что данная патология больше никак себя не проявляет, кроме проблем с фертильностью (способностью к зачатию) во взрослом возрасте.
В популяции синдром встречается редко. По данным разных авторов, частота заболевания составляет от 1: 20 400 до 1: 99 100 случаев [19] . Точные данные собрать сложно, так как патология часто остаётся нераспознанной. Согласно исследованию, которое проводилось в Дании в течение семилетнего периода, полная нечувствительность к андрогенам случается с вероятностью 1 на 20 400 новорождённых с кариотипом 46 XY [15] .
Синдром тестикулярной феминизации впервые в Европе описан в 1817 году баварским врачом Джорджем Стегленером, в России — в 1893 году профессором клиники московского университета Благоволиным Сергеем Ивановичем (1865-1947) [4] .

Есть заключения генетиков и историков (по утверждению профессора Эфроимсона), которые приписывают синдром тестикулярной феминизации и королеве Англии Елизавете Тюдор (1533-1603) [5] .
Несмотря на то, что синдром Морриса встречается редко, он обнаруживается почти у 1 % выдающихся спортсменок , которые имеют превосходство в физической силе, быстроте и ловкости [5] [18] . Это стало причиной исключения женщин и девушек с синдромом тестикулярной феминизации из женских спортивных состязаний [5] . Регламент многих серьёзных спортивных соревнований, особенно в силовых видах спорта, беге, прыжках, обязывает женщин предоставить результат анализа на кариотип. Обязательное тестирование стали проводить после истории с немецкой легкоатлеткой Дорой Ратьен, которая участвовала в Олимпийских играх 1936 года. После игр стало известно, что Дора генетически была мужчиной. Этот случай послужил поводом к тому, что всех участниц соревнований стали осматривать врачи. Позже вместо осмотров спортсменки стали сдавать анализ крови на кариотип.

Иногда синдром Морриса называют синдромом манекенщиц , так как женщины с данной патологией часто имеют привлекательную внешность [16] [17] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы синдрома Морриса
Как правило, люди с синдромом тестикулярной феминизации имеют женский фенотип, т. е. внешне выглядят как женщины. Однако есть некоторые признаки, по которым можно определить наличие заболевания.
- С началом полового созревания больные отличаются женским телосложением. Это объясняется влиянием эстрогенов и отсутствием эффекта тестостерона. П ри этом у таких людей часто высокий рост, узкий таз и широкие плечи, что более характерно для мужчин. [1][2][6][7] .

- При нормальном росте и отсутствии аномалий развития характерны крупные кисти рук и крупные стопы.
- Молочные железы обычно развиты соответственно 3-4 размеру, однако ареолы сосков окрашены бледно.
- Характерно отсутствие полового оволосения (в области подмышечных впадин и на лобке), т. к. "не работает" тестостерон.
- В результате влияния эстрадиола и отсутствия действия тестостерона в ходе эмбрионального развития у плода мужского пола наружные половые органы формируются по женскому типу: не формируется половой член, но есть половые губы, укороченное влагалище, заканчивающееся слепо (т. е. нет матки, шейки матки и яичников).
- У детей с синдромом Морриса (4-5 лет) иногда появляются паховые грыжи. В таких случаях родители обращаются к детскому хирургу. Врач проводит операцию и в составе грыжевого содержимого обнаруживает ткань, напоминающую по структуре яичко (мужскую гонаду). Так как у "девочки" не может быть мужской гонады, берут биопсию (для подтверждения диагноза СТФ). В таком случае яичко не удаляют, ушивают грыжевой мешок и заканчивают операцию. Далее врач рекомендует провести генетическое обследование ребёнка, которое устанавливает мужской кариотип 46 XY. Считается, что удалять гонады до пубертатного периода нельзя, т. к. это может нарушить формирование организма ребёнка в целом.
- В 14-16 лет (если патология не была выявлена раньше), родители замечают, что у "девочки" отсутствует менструация, в связи с чем обращаются к врачу-гинекологу. Во время гинекологического осмотра и УЗИ выявляется, что у ребёнка имеется слепо заканчивающееся влагалище (в виде слепого мешка). Глубина влагалища может варьировать от нормальной до укороченной [1][2][6][7] .
Патогенез синдрома Морриса
В начале эмбрионального развития у зародышей вне зависимости от хромосомного набора, образовавшегося при оплодотворении яйцеклетки сперматозоидом, половая система закладывается одинаково и предоставляет возможности для развития как женской, так и мужской половой системы. В частности, у зародыша одновременно формируются вольфов и мюллеров протоки, которые потом превращаются в семявыносящие протоки у мужчин и матку с фаллопиевыми трубами и влагалищем у женщин. Половые железы эмбриона (гонады) не дифференцированы и содержат первичные половые клетки (гаметы), которые могут превратиться как в клетки яичников (женские гонады), так и в клетки семенников (мужские гонады).
Таким образом, эмбрион до 6 недель является нейтральным по полу (имеет признаки и мужского, и женского пола). Далее процесс формирования половых признаков и в дальнейшем организма происходит под строгим контролем гормонов: у эмбриона мужского пола — под влиянием тестостерона (влагалище атрофируется), у эмбриона женского пола — под влиянием эстрадиола и прогестерона (влагалище трансформируется из "слепого мешка" и формируется шейка матки и матка). Тестостерон и эстрадиол вырабатываются как у мужчин, так и у женщин, только их соотношение разное. В норме у мальчиков соотношение мужского гормона к женскому 4\1, а в случае СТФ — 0\1. У девочек соотношение мужского гормона к женскому, прямо противоположное — 1\4.
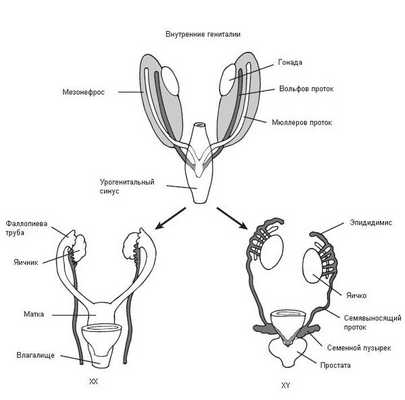
В процессе эмбриогенеза у людей с синдромом Морриса под влиянием мужской Y-хромосомы гонады развиваются как яички, они не способны к сперматогенезу, но способны вырабатывать тестостерон [8] . Однако из-за генетической мутации организм "не видит"/"не чувствует" присутствие тестостерона в крови, поэтому гормон не может проявить свои свойства и сформировать мужской организм. При этом секретируемые надпочечниками эстрогены (эстрадиол), хоть и в небольшом количестве, нормально вырабатываются и усваиваются организмом, в результате чего начинают превалировать в организме (как у девочки). В связи с этим влагалище не атрофируется, в дальнейшем ребёнок развивается по женскому типу.
Классификация и стадии развития синдрома Морриса
Синдром тестикулярной феминизации делят на две формы — полный и неполный. Дети с полной формой нечувствительности к мужским гормонам имеют однозначно женский внешний вид. При этом состоянии чувствительность организма к мужскому половому гормону (тестостерону) отсутствует полностью. Рождается здоровая "девочка", не имеющая, на первый взгляд, каких-либо отклонений в развитии.
Неполная форма СТФ характеризуется более разнообразной клинической картиной. В этом случае отмечается некоторая чувствительность рецепторов к тестостерону. Выделяют пять основных степеней неполного синдрома тестикулярной феминизации (классификация 1996 года) [10] .
- Мужской тип. У больных мужской фенотип без каких-либо отклонений.
- Преимущественно мужской тип. Наблюдаются нарушения формирования половых органов, хотя фенотип больных — мужской.
- Амбивалентный тип. Более выраженные нарушения формирования половых органов: уменьшение полового члена, который становится похожим на клитор, мошонка похожа на большие половые губы. Характерно расширение таза, узкие плечи, гинекомастия (увеличение груди).
- Преимущественно женский тип. По фенотипическим признакам больные являются женщинами. Однако у них, как правило, короткое влагалище и гипертрофированый (увеличенный) клитор
- Женский тип. По всем внешним признакам, за исключением увеличенного клитора, больные являются женщинами.
Осложнения синдрома Морриса
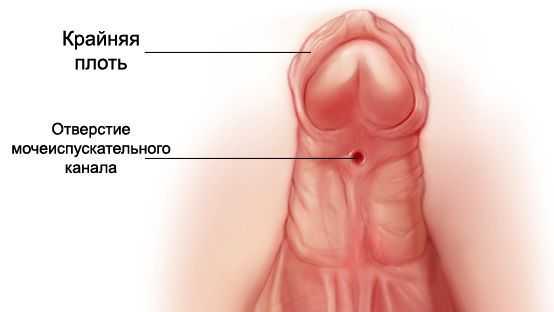
- Из-за нарушения проходимости (опущения) яичек по паховому каналу у больных СТФ в детском возрасте (3-5 лет) часто обнаруживают паховые грыжи и гипоспадию ( недоразвитие полового члена и неправильное расположение мочеиспускательного канала) . Гипоспадия, в свою очередь, может стать причиной развития различных воспалительных процессов в мочевыделительной системе ( уретриты , пиелонефриты) [13] .
- Крипторхизм (неопущение яичек) в будущем грозит злокачественным перерождением тканей яичка (развитием гонадобластомы), что является наиболее тяжёлым осложнением данного заболевания [10][19] . Одна из причин образования гонадобластомы в том, что яички постоянно находятся в забрюшинном пространстве, где температура выше 37 °C. В норме яички должны находиться снаружи (в мошонке), т. к. для их жизнедеятельности нужна постоянная температура ниже 34 °C. Точную частоту возникновения рака у пациентов с синдромом тестикулярной феминизации оценить очень трудно, однако по различным данным общий риск составляет примерно 5 % всех случаев патологии. При этом с возрастом вероятность развития рака возрастает [reference:19 ] .
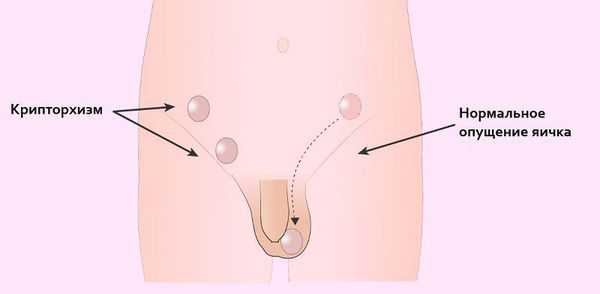
- Ещё одним серьёзным осложнением заболевания является бесплодие.
Диагностика синдрома Морриса
- Определение фенотипа — совокупности внешних признаков.
- Изучение семейного анамнеза пациента. Если в семье были случаи андрогенной нечувствительности, то вероятность наличия патологии выше, однако нужно понимать, что отсутствие отягощённого семейного анамнеза не исключает диагноз.
- Гинекологический и урологический осмотр. Выявляется слепо заканчивающееся влагалище (слепой мешок), отсутствие шейки, не пальпируется матка и её придатки.
- Определение половых гормонов в крови (тестостерона, эстрадиола). Выявляется высокий уровень тестостерона, уровень эстрадиола выше, чем у мужчин, но ниже, чем у женщин в норме.
- Ультрасонографии органов малого таза (УЗИ) и р ентгенологическое обследование для выяснения состояния органов малого таза . В малом тазу не визуализируется матка и яичники. Забрюшинно визуализируются образования, похожие на "яичники", на самом деле это яички (без дополнительных данных анамнеза бывает трудно это предположить). Мужские гонады могут располагаться в паховых каналах, в стенках таза или в толще больших половых губ.
- Кариотипирование — исследование хромосомного набора. Позволяет обнаружить отклонения в структуре и числе хромосом . При синдроме тестикулярной феминизации определятся мужской кариотип — 46 XY. Для исследования используется венозная кровь.
- Молекулярно-генетический анализ гена андрогенного рецептора. Определение мутаций гена при наличии характерной клинической картины подтверждает диагноз СТФ с вероятностью близкой к 100 %.
Лечение синдрома Морриса
Лечение синдрома тестикулярной феминизации должно осуществляться междисциплинарной командой врачей, которая состоит из хирурга, гинеколога, генетика, эндокринолога и клинического психолога или психиатра.
При полной андрогенной нечувствительности и в случае частичной нечувствительности с преимущественно женским типом в 20-50 % случаев необходимо удалять яички из-за риска развития рака [19] . Операция, как правило, проводится после завершения пубертатного периода и конституционального формирования (14-15 лет) [11] . Хирургическое лечение в отношении половых желёз (гонад) проводится в настоящее время лапароскопическим доступом [3] [6] . Лапароскопию должен проводить хирург высокой квалификации, так как удаляемые гонады (яички) находятся забрюшинно и имеют высокую степень кровоснабжения. Динамическое наблюдение, УЗИ и контроль гормона тестостерона позволяют оценивать эффективность проведённой операции [14] .
Операция эффективна в 100 % случаев. Но так как удаляемые гонады мягкие и не имеют чёткой формы и структуры, возможны случаи неполного их удаления. Тогда оставшаяся ткань яичка может возобновить свою работу, что проявляется повышением тестостерона в крови и визуализацией на УЗИ гонады/гонад. В этом случае необходима повторная операция. Однако это случается очень редко.
После удаления гонад показана последующая длительная заместительная терапия эстрогенами. Она необходима для продолжения дальнейшего формирования женского организма и обязательна (до возраста 45-50 лет) для профилактики остеопороза (потери костной тканью кальция) [8] [12] . Развитие остеопороза связано с тем, что в организме пациента мало собственного эстрадиола, который в норме удерживает кальций в костях. Следовательно, у таких людей кальций будет вымываться быстрее и плотность костей будет снижаться. Такое состояние опасно частыми переломами.
В случае короткой длины влагалища для предотвращения диспареунии (боли во время полового акта) возможно хирургическое увеличения длины влагалища [20] .
Больным с частичной андрогенной нечувствительностью с преимущественно мужским типом , которые выросли как мужчины, может быть предложено хирургическое лечение крипторхизма и гипоспадии. При крипторхизме проводится орхипексия — низведении неопущенного яичка в мошонку и фиксации его к окружающим тканям путём наложения шва. Коррекция гипоспадии подразумевает:
- восстановление отсутствующей части мочеиспускательного канала;
- восстановление нормального расположения мочеиспускательного канала;
- выпрямление полового члена;
- придание эстетически адекватного внешнего вида наружным половым органам.
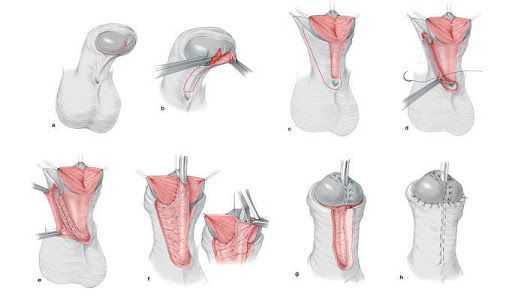
В случае гинекомастии (увеличения груди) мужчинам может потребоваться маммопластика [21] . Часто пациентам с выявленным заболеванием требуется психологическая помощь.
Прогноз. Профилактика
Прогноз для жизни в случае синдрома Морриса благоприятный. Своевременная диагностика, гонадэктомия и заместительная гормональная терапия обычно дают хорошие краткосрочные и долгосрочные результаты. Пациентки часто адаптируются, нередко выходят замуж. Преодоление бесплодия возможно с помощью программ ЭКО с использованием донорских яйцеклеток, оплодотворённых спермой мужа, и суррогатного материнства. Главное — правильная адаптация и объяснение пациентке её состояния [12] .
Для профилактики синдрома тестикулярной феминизации женщинам, планирующим беременность рекомендуется пройти генетическое исследование, чтобы выяснить, не является ли она носителем патологического гена. Исследование должно проводится при отягощённом наследственном анамнезе, т. е. в том случае, если в семье были случаи андрогенной нечувствительности. Для профилактики остеопороза рекомендуется дополнительный приём кальция и витамина D [8] .
Нейросифилис
Нейросифилис — инфекционное поражение центральной нервной системы, обусловленное проникновением в нее возбудителей сифилиса. Может возникнуть в любой период сифилиса. Нейросифилис проявляется симптомами менингита, менинговаскулярной патологии, менингомиелита, поражения задних канатиков и корешков спинного мозга, прогрессивного паралича или очагового поражения головного мозга в связи с образованием в нем сифилитической гуммы. Диагностика нейросифилиса основана на клинической картине, данных неврологического и офтальмологического обследования, МРТ и КТ головного мозга, положительных серологических реакциях на сифилис и результатах исследования ликвора. Лечение нейросифилиса проводится внутривенно большими дозами препаратов пенициллина.
Общие сведения
Еще несколько десятилетий назад нейросифилис был весьма распространенным осложнением сифилиса. Однако массовые обследования пациентов на сифилис, своевременное выявление и лечение инфицированных лиц привели к тому, что современная венерология все реже сталкивается с такой формой заболевания как нейросифилис, несмотря на то, что заболеваемость сифилисом неуклонно растет. Многие авторы считают также, что снижение случаев нейросифилиса связано с изменением патогенных характеристик его возбудителя — бледной трепонемы — в том числе и со снижением ее нейротропности.
Классификация нейросифилиса
Латентный нейросифилис не имеет никаких клинических проявлений, но при исследовании цереброспинальной жидкости пациента выявляются патологические изменения.
Ранний нейросифилис развивается на фоне первичного или вторичного сифилиса, в основном в первые 2 года заболевания. Но может возникнуть в течение 5-ти лет от времени заражения. Протекает с поражением преимущественно сосудов и оболочек мозга. К проявлениям раннего нейросифилиса относят острый сифилитический менингит, менинговаскулярный нейросифилис и сифилитический менингомиелит.
Поздний нейросифилис возникает не ранее чем через 7-8 лет от момента заражения и соответствует периоду третичного сифилиса. Характеризуется воспалительно-дистрофическим поражением паренхимы мозга: нервных клеток и волокон, глии. К поздним формам нейросифилиса относят спинную сухотку, прогрессивный паралич и сифилитическую гумму мозга.
Симптомы нейросифилиса
Острый сифилитический менингит характеризуется симптомами острого менингита: сильная головная боль, шум в ушах, тошнота и рвота не зависимо от приема пищи, головокружение. Часто протекает без подъема температуры тела. Отмечаются положительные менингиальные симптомы: ригидность мышц затылка, нижний симптом Брудзинского и симптомы Кернига. Возможно повышение внутричерепного давления. Нейросифилис в виде острого менингита развивается чаще всего в первые несколько лет заболевания сифилисом, в период его рецидива. Он может сопровождаться кожными высыпаниями или являться единственным проявлением рецидива вторичного сифилиса.
Менинговаскулярный нейросифилис развивается при сифилитическом поражении сосудов мозга по типу эндартериита. Проявляется острым нарушением кровообращения головного в виде ишемического или геморрагического инсульта, за несколько недель до которого пациента начинают беспокоить головные боли, нарушения сна, головокружения, появляются изменения личности. Возможно течение менинговаскулярного нейросифилиса с нарушением спинномозгового кровообращения и развитием нижнего парапареза, расстройств чувствительности и нарушений со стороны тазовых органов.
Сифилитический менингомиелит протекает с поражением оболочек и вещества спинного мозга. Имеет место медленно нарастающий спастический нижний парапарез, сопровождающийся выпадением глубокой чувствительности и дисфункцией тазовых органов.
Спинная сухотка возникает вследствие сифилитического воспалительного поражения и дегенерации задних корешков и канатиков спинного мозга. Эта форма нейросифилиса появляется в среднем через 20 лет от момента заражения. Характеризуется радикулитом с выраженным болевым синдромом, выпадением глубоких рефлексов и глубоких видов чувствительности, сенситивной атаксией, нейро-трофическими нарушениями. При нейросифилисе в форме спинной сухотки возможно развитие импотенции. Наблюдаются нейрогенные трофические язвы на ногах и артропатии. Характерен синдром Аргайла-Робертсона — неправильной формы суженные зрачки, не реагирующие на свет. Вышеуказанные симптомы могут сохраняться и после проведения специфической терапии нейросифилиса.
Прогрессивный паралич может появиться у пациентов с 10-20-летней давностью заболевания. Этот вариант нейросифилиса связан с непосредственным проникновением бледных трепонем в клетки головного мозга с последующим их разрушением. Проявляется постепенно усиливающимися изменениями личности, ухудшением памяти, нарушением мышления вплоть до возникновения деменции. Нередко наблюдаются психические отклонения по типу депрессивных или маниакальных состояний, галлюцинаторного синдрома, бредовых идей. Нейросифилис в виде прогрессивного паралича может сопровождаться эпилептическими приступами, дизартрией, нарушением тазовых функций, интенционным тремором, снижением мышечной силы и тонуса. Возможно сочетание с проявлениями спинной сухотки. Как правило, пациенты с подобными симптомами нейросифилиса погибают в течение нескольких лет.
Сифилитическая гумма локализуется чаще всего в основании головного мозга, что приводит к сдавлению корешков черепно-мозговых нервов с развитием пареза глазодвигательных нервов, атрофии зрительных нервов, тугоухости и пр. По мере роста гуммы в размерах увеличивается внутричерепное давление и нарастают признаки сдавления вещества мозга. Реже гумма при нейросифилисе располагается в спинном мозге, приводя к развитию нижнего парапареза и дисфункции тазовых органов.
Диагностика нейросифилиса
Установление диагноза нейросифилиса производится с учетом 3 основных критериев: клинической картины, положительных результатов исследований на сифилис и выявленных изменений в цереброспинальной жидкости. Правильная оценка клиники нейросифилиса возможна только после проведения неврологом полного неврологического обследования пациента. Важную дополнительную информацию для диагностики нейросифилиса дает исследование зрения и осмотр глазного дна, которые проводит окулист.
Лабораторные исследования на сифилис применяются комплексно и, при необходимости, многократно. К ним относятся RPR-тест, РИФ, РИБТ, обнаружение бледной трепонемы с содержимом кожных элементов (если таковые имеются). При отсутствии симптомов сдавления мозга пациенту с нейросифилисом проводится люмбальная пункция. Исследование цереброспинальной жидкости при нейросифилисе обнаруживает бледные трепонемы, повышенное содержание белка, воспалительный цитоз свыше 20 мкл. Проведение РИФ с ликвором, как правило, дает положительный результат.
МРТ головного мозга и КТ головного мозга (или спинного мозга) при нейросифилисе обнаруживают в основном неспецифические патологические изменения в виде утолщения мозговых оболочек, гидроцефалии, атрофии вещества мозга, инфарктов. С их помощью можно выявить локализацию гуммы и дифференцировать нейросифилис от других, сходных по клинике, заболеваний.
Дифференциальный диагноз нейросифилиса проводится с менингитами другого генеза, васкулитами, бруцеллезом, саркоидозом, боррелиозом, опухолями головного и спинного мозга и др.
Лечение нейросифилиса
Терапию нейросифилиса проводят в стационарных условиях внутривенным введением больших доз препаратов пенициллина в течение 2 недель. Внутримышечная пенициллинотерапия не обеспечивает достаточную концентрацию антибиотика в цереброспинальной жидкости. Поэтому при невозможности внутривенной терапии внутримышечное введение пенициллинов сочетают с приемом пробеницида, который тормозит выведение пенициллина почками. У пациентов с нейросифилисом, страдающих аллергией на пенициллин, применяют цефтриаксон.
В первые сутки лечения нейросифилиса может произойти временное усугубление неврологической симптоматики, сопровождающееся подъемом температуры тела, интенсивной головной болью, тахикардией, артериальной гипотензией, артралгиями. В таких случаях пенициллинотерапию нейросифилиса дополняют назначением противовоспалительных и кортикостероидных лекарственных препаратов.
Эффективность лечения оценивают по регрессу симптоматики нейросифилиса и улучшению показателей цереброспинальной жидкости. Контроль излеченности пациентов с нейросифилисом проводят в течение 2-х лет путем исследования цереброспинальной жидкости каждые полгода. Появление новых неврологических симптомов или нарастание старых, а также сохраняющийся цитоз в ликворе являются показаниями для повторного курса лечения нейросифилиса.
Скрытый сифилис — коварство болезни

Несмотря на высокий уровень развития медицины и достаточную информированность населения о венерических инфекциях, случаи сифилиса все-таки продолжают выявляться, в том числе и среди довольно-таки благополучных слоев населения. Эта венерическая болезнь на сегодняшний день успешно поддается терапии и после полного излечения никак не вредит здоровью. Но иногда сифилис протекает практически бессимптомно — в скрытой форме, что существенно затрудняет его своевременную диагностику и адекватное лечение.
Причины скрытой болезни

На самом деле, проблема скрытого сифилиса среди населения стоит достаточно остро. Врачи-венерологи в разных уголках мира фиксируют довольно много случаев такой болезни, что вызывает среди них некую настороженность. Нетипичное малосимптомное течение сифилиса чаще всего объясняется неразумным самолечением, а именно — бесконтрольным приемом антибактериальных лекарств.
Если пациент с сифилисом на ранней стадии получает антибиотики (например, при самолечении ангины, ОРВИ, прочих венерических болезней и пр.), активность бледной трепонемы несколько подавляется. Но такая бактерия остается в организме и продолжает свое развитие, хоть и не вызывает типичных проявлений болезни.
Скрытый сифилис чаще всего выявляют при прохождении профилактических осмотров. На сегодняшний день анализ крови на бледную трепонему обязателен во многих женских консультациях, также его выполняют при плановой госпитализации в любое стационарное отделение больницы.
Классификация
Медики выделяют две основные разновидности скрытого сифилиса:
- Ранний. О такой форме болезни говорят, если прошло не более двух лет с момента инфицирования. Пациенты с таким недугом представляют потенциальную опасность для окружающих. Хотя у них нет никаких явных симптомов заболевания, тем не менее, инфекция может активироваться в любой момент и вызвать типичные признаки сифилиса. При активации возбудителя больной становится потенциально опасным источником заражения, на его коже могут появиться высыпания, содержащие большое количество бледных трепонем.
- Поздний. Такая разновидность заболевания не столь опасна в эпидемиологическом плане, так как активация болезни в этом случае приведет к поражению внутренних органов, а также нервной системы. На теле могут появиться малозаразные третичные сифилиды.
Чаще всего, при случайном обнаружении скрытого сифилиса пациент не может определить давность заражения. Из-за этого врач не способен выявить сроки недуга.
Симптомы
Скрытый сифилис потому и называется скрытым, что практически не дает о себе знать. Это коварное заболевание протекает в латентной форме и не вызывает никаких специфических симптомов, типичных для классической разновидности болезни: шанкров, сыпи, поражений внутренних органов и пр. Болезнь может проявлять себя лишь неявными нарушениями самочувствия:
Некоторым повышением температуры до субфебрильных цифр (периодическим либо постоянным).
- Некоторой вялостью, слабостью и апатией.
- Отсутствием аппетита, похудением.
- Несущественным и безболезненным увеличением лимфатических узлов.
Перечисленные признаки могут наблюдаться при множестве других проблем со здоровьем, и заподозрить по ним именно сифилис просто нереально.
Диагностика у врача

Как правило, скрытый сифилис диагностируется случайно — во время исследования крови на реакцию Вассермана (RW). Так называют лабораторное исследование, которое дает возможность определить наличие в организме антител к бледной трепонеме. При отсутствии любых признаков болезни врач обычно рекомендует провести дополнительные исследования, в частности:
- RPR-тест. Такой анализ считается более современной альтернативой реакции Вассермана. Это исследование дает возможность выявить в организме человека антитела к материалу, высвобождаемому из поврежденных сифилисом клеток.
- РИФ — реакцию иммунофлюоресценции. При таком исследовании фиксируется выраженное свечение бледных трепонем в используемом препарате, которое может наблюдаться лишь при наличии антитрепонемных антител у пациента в крови.
- РИБТ — реакцию иммобилизации (неподвижности) бледных трепонем. Данный тест базируется на способности сыворотки больного сифилисом блокировать движение бледных трепонем. Для полностью здоровых людей такая реакция нетипична. РИБТ считается высокоспецифичным и чувствительным исследованием и отлично подходит для распознания скрытого сифилиса.
- ПЦР-диагностику. Такой анализ позволяет обнаружить в биологических жидкостях индивида ДНК возбудителя сифилиса.
При выявлении скрытого сифилиса врачи обязаны обследовать лиц, находившихся в половых контактах с больным.
Лечение
Скрытый сифилис нуждается в обязательном лечении. Цель терапии при такой болезни — устранить возбудителей заболевания и предупредить переход недуга в активную форму, которая уже будет заразна для окружающих. Если у пациента диагностирован поздний скрытый сифилис, лекарственная коррекция направлена на предупреждение осложнений, в частности, нейросифилиса, а также поражений соматических органов.
К счастью, на сегодняшний день скрытый сифилис, как и прочие формы такого заболевания, успешно поддается антибиотикотерапии. При этом начало такого лечения вызывает у пациента скачок температуры, что становится дополнительным подтверждением верно установленного диагноза.
Для оценки эффективности терапии врач отслеживает результаты анализов крови, в частности, снижение титров антител.
Лекарства в терапии скрытого сифилиса
Как правило, лечение скрытого сифилиса базируется на пенициллинотерапии. Бледная трепонема — это единственный микроорганизм, который на сегодняшний день сохраняет довольно высокую чувствительность к пенициллину, а также к производным данного антибактериального вещества. Лекарства в основном используют в таблетированной форме, но иногда рекомендуется их внутримышечное введение.
При невозможности применения пенициллинов лечение скрытого сифилиса может осуществляться с использованием:
- Макролидов, в частности, эритромицина.
- Производных тетрациклина.
- Цефалоспоринов.
При активации скрытого сифилиса лечение происходит по стандартной схеме. В дополнение к антибиотикам могут использоваться препараты висмута, которые способны угнетать активность бледной трепонемы. Параллельно врачи применяют другие лекарства, направленные на поддержание организма и активацию иммунной системы.
Читайте также:
- Синдром Огилви (Ogilvie)
- УЗ-признаки геморрагической кисты щитовидной железы
- Профилактика возрастной макулярной дистрофии (ВМД). Рекомендации
- Недостаточность фолиевой кислоты в неврологии. Недостаточность витамина Е в неврологии.
- Функциональная анатомия голеностопного сустава. Суставная капсула и сухожилия
