Синдром Тернера (Turner) - синонимы, авторы, клиника
Добавил пользователь Alex Обновлено: 22.01.2026
хромосомная болезнь женщин, обусловленная отсутствием в кариотипе одной Х-хромосомы, проявляющаяся недоразвитием первичных и вторичных половых признаков и птеригиум-синдромом.
1. Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991—96 гг. 2. Первая медицинская помощь. — М.: Большая Российская Энциклопедия. 1994 г. 3. Энциклопедический словарь медицинских терминов. — М.: Советская энциклопедия. — 1982—1984 гг .
Смотреть что такое "Тернера синдром" в других словарях:
Тернера синдром — (Н. Н. Turner, род. в 1892 г., амер. эндокринолог; син.: Шерешевского Тернера синдром, Шерешевского Тернера Бонневи Улльриха синдром) хромосомная болезнь женщин, обусловленная отсутствием в кариотипе одной X хромосомы, проявляющаяся недоразвитием … Большой медицинский словарь
Тернера синдром — - см. Шерешевского Тернера синдром … Энциклопедический словарь по психологии и педагогике
ТЕРНЕРА, СИНДРОМ — Хромосомная аномалия у фенотипических женщин. Основной генетический дефект - отсутствие половой хромосомы, так что об число составляет 45, X. Этот синдром характеризуется невысоким ростом и отсутствием яичников. Если вводить женские половые… … Толковый словарь по психологии
Шерешевского — Тернера синдром — I Шерешевского Тернера синдром (Н.А. Шерешевский, сов. эндокринолог, 1885 1961; Н.Н. Turner, амер. эндокринолог, родился в 1892 г.; синоним: синдром Тернера, синдром Ульриха, сексогенная карликовость и др.) генетически обусловленная форма… … Медицинская энциклопедия
Шерешевского-Тернера синдром — (Н. А. Шерешевский, 1885 1961, сов. эндокринолог; Н. Н. Turner, род. в 1892 г., амер. эндокринолог) см. Тернера синдром … Большой медицинский словарь
синдром Тернера — синдром Шерешевского Тернера синдром Улльриха сексогенная карликовость НЗЧ, проявляющееся в недоразвитии или отсутствии гонад, в низкорослости и в др. аномальных признаках; в основе С.Т. лежит моносомия по половым хромосомам (у мужчин теряется Y… … Справочник технического переводчика
Шерешевского-Тернера синдром — аномалия половых хромосом. Встречается только у лиц женского пола с частотой один случай на 3000 рождений. За рубежом известен как синдром Тернера (описан Г. Тернером в 1938 г.), в отечественной дефектологии как синдром Шерешевского Тернера… … Дефектология. Словарь-справочник
Синдром Шерешевского — Тёрнера — МКБ 10 Q96. МКБ 9 758.6 MedlinePlus 000379 … Википедия
Синдром Нунан — 12 летняя девочка с синдромом Нунан Типичная перепончатая шея … Википедия
Синдром Пехкранца — Бабинского Фрелиха МКБ 10 E23.623.6 МКБ 9 253.8253.8 DiseasesDB … Википедия
СИНДРОМ ТЕРНЕРА — СИНДРОМ ТЕРНЕРА, наследственая черта, передающаяся женщинам наличие только одной Х хромосомы вместо двух. Вызывает бесплодие (из за недоразвитости яичников), малый рост и различные дефекты развития, включая отсутствие вторичных половых признаков … Научно-технический энциклопедический словарь
Синдром Тернера (Turner) - синонимы, авторы, клиника
Клиника ГЕНЕЗИС, Санкт-Петербург
Санкт-Петербургское ГБУЗ «Городской консультативно-диагностический центр для детей «Ювента» (репродуктивное здоровье)», Санкт-Петербург, Россия;
ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России, Санкт-Петербург, Россия
Возможности реализации репродуктивной функциипри синдроме Шерешевского—Тернера
Журнал: Проблемы репродукции. 2020;26(2): 34‑40
Синдром Шерешевского—Тернера представляет собой наиболее частую причину нарушения половой дифференцировки у женщин. Одной из основных проблем у этих пациенток является тяжелое нарушение функции яичников, приводящее к бесплодию. В обзоре рассматриваются возможности сохранения репродуктивной функции у пациенток с этим синдромом.
Наиболее частой причиной нарушения половой дифференцировки является синдром Шерешевского—Тернера (СШТ). Этот синдром характеризуется полным или частичным отсутствием Х хромосомы при женском фенотипе. Распространенность этого заболевания составляет 1 случай на 2000—2500 новорожденных девочек.
Существует мнение, что полное отсутствие 2-й хромосомы в 23-й паре (кариотип 45,Х) приводит к остановке в развитии беременности. Это означает, что все дети, родившиеся с СШТ, являются в той или иной степени мозаиками [1]. При изучении кариотипа преимплантационных эмбрионов и эмбрионов беременностей, остановившихся в развитии в I триместре, кариотип 45,Х встречается с частотой от 1 до 1,5%, и 99% таких беременностей останавливаются в развитии.
Возможна пренатальная диагностика СШТ. Существует метод исследования внеклеточной циркулирующей в крови беременной женщины ДНК (NIPT, non-invasive prenatal testing, НПТ, неинвазивное пренатальное тестирование). Однако прогностическое значение этого теста остается низким, не более 26%. Это связано с присутствием в крови и материнской, и плацентарной ДНК, а также большим числом случаев мозаицизма и существованием механизма потери с возрастом одной из Х хромосом [2]. Обычно пренатальная диагностика основывается на обнаружении эдемы плода при ультразвуковом исследовании, аномальных уровней хорионического гонадотропина человека, неконъюгированного эстриола и альфа-фетопротеина при скрининге материнской сыворотки (тройной скрининг) или на основании результатов кариотипирования плода, выполненного с учетом возраста матери. При пренатальной диагностике плода с кариотипом 45,Х он обычно подтверждается при родах. Для сравнения, примерно 90% плодов, у которых случайно во время скрининга установлен мозаицизм 45,X/46,XX или 45,X/46,XY, будут иметь при рождении нормальный фенотип, женский или мужской. Ребенок, у которого 45,X/46,XX или 45,X/46,XY мозаицизм установлен после рождения, из-за фенотипических признаков, наводящих на мысль о СШТ, имеет прогноз, аналогичный прогнозу для детей с 45,X [3]. Примерно у 20—30% девочек с СШТ диагноз после рождения устанавливают в связи с отеками верхних и нижних конечностей и шеи, что является остаточным эффектом кистозных гигром . СШТ следует заподозрить у любой новорожденной девочки с отеками, с гипоплазией левых отделов сердца или с коарктацией аорты, так как частота этой патологии увеличена среди детей с СШТ. Примерно у 30% девочек с этим синдромом диагноз устанавливается в детском возрасте в ходе выяснения причин низкорослости. СШТ является наиболее распространенной причиной невысокого роста у девушек, за исключением семейной низкорослости и конституциональной задержки роста. Диагноз следует исключить у любой девочки-подростка невысокого роста с первичной или вторичной аменореей. В представлены наиболее частые варианты кариотипа у пациенток с СШТ. Классические признаки СШТ представлены в . При наличии в кариотипе хромосомы Y необходимо принимать решение об удалении гонад из-за высокой вероятности развития гонадобластомы [4].
Следует отметить, что варианты кариотипа сильно влияют на фенотип женщин с этим синдромом. Так, согласно результатам проведенных исследований, у пациенток с кариотипом 45,Х средний рост составляет 147 см, при этом у 61% выявлена патология сердечно-сосудистой системы, у 46% — аномалии почек, у 36% — эдема и только у 10% девочек отмечено начало первой менструации. В то же время у пациенток с мозаицизмом 45,Х/46ХХ средний рост составил 150 см, патология сердечно-сосудистой системы выявлена у 40%, аномалии почек — у 39%, эдема — у 15%, начало первой менструации наблюдалось у 40% девочек. Кроме того, при СШТ, обусловленном делециями длинного или короткого плеча Х хромосомы, рост пациенток составляет уже 153—163 см, патология сердечно-сосудистой системы у этих пациенток не наблюдалась, патология почек обнаружена у 22%, эдема — у 17%, а начало первой менструации отмечено у 71—86% пациенток [3]. От генетического варианта СШТ зависит также возраст, при котором установлен диагноз. При кариотипе 45,Х в 56% случаев диагноз установлен в возрасте до 11 месяцев, тогда как заболевание в этом возрасте выявлено только у 22% у пациенток с другими вариантами кариотипа [5]. До 20% пациенток с СШТ имеют спонтанный менструальный цикл, однако у большинства пациенток уже через несколько лет развивается преждевременное истощение яичников [6].
Гормонозаместительная терапия у пациенток с СШТ, принимающих гормон роста по поводу низкорослости, должна начинаться в 12 лет, у пациенток, не принимавших этот гормон, — в 14 лет. Стартовые дозы обычно составляют 0,3 мг конъюгированного эстрогена или 2—5 мкг этинилэстрадиола или 0,1—0,25 мг эстрадиола валерата. Через полгода необходимо оценить развитие молочных желез и при необходимости увеличить дозу эстрогенов. После года монотерапии эстрогенами с постепенно увеличивающимися дозами можно переходить на комбинацию эстрогенов с гестагенами, что вызывает начало менструаций. К 15—17 годам обычно назначается гормонозаместительная терапия с применением лекарственных препаратов в дозах для взрослых, также можно применять циклические низкодозные комбинированные пероральные контрацептивы. Данная терапия может быть применена пожизненно или до наступления естественной менопаузы [3].
Спонтанная беременность у пациенток с СШТ встречаются редко и часто ассоциирована с самопроизвольными патологическими прерываниями беременности, мертворождениями и врожденными дефектами развития плода [7]. Только 50% женщин с СШТ живут половой жизнью, и, согласно данным Национального института здоровья США, только 12% таких женщин воспитывают детей. У 9% женщин дети усыновлены, 1,4% родили ребенка в результате самостоятельной беременности, 0,4% — в результате процедуры экстракорпорального оплодотворения с собственными ооцитами и 1,4% — в результате использования донорских ооцитов [8].
Часто у женщин с СШТ выявляется патология сердечно-сосудистой системы, которая включает в себя коарктацию аорты, удлинение дуги аорты, расширение аорты, двустворчатый клапан аорты. Такая патология служит причиной смерти и меньшей, чем в популяции, средней продолжительности жизни женщин с СШТ, а также может быть причиной осложнений беременности и материнской смертности [9]. Американское общество репродуктивной медицины (АОРМ) предложило следующий порядок обследования сердечно-сосудистой системы у пациенток с СШТ. Консультация кардиолога и скрининг, включающий рентгеновское исследование органов грудной клетки и электрокардиографию (ЭКГ), должны проводиться на момент установления диагноза СШТ.
Необходимо выполнять ежегодное исследование функции сердца, в том числе, контроль уровня артериального давления. Если при первичном осмотре аномалий не выявлено, то рекомендован повторяющийся скрининг, включающий рентгеновское исследование органов грудной клетки и ЭКГ каждые 3—5 лет. Если ультразвуковое исследование показало наличие патологии или когда восходящий отдел аорты не визуализируется, то рекомендовано проведение магнитно-резонансной томографии сердца. Консультация кардиолога требуется при обнаружении любой аномалии сердечно-сосудистой системы [10].
В рекомендациях АОРМ подчеркивается, что при ведении беременности у пациенток с СШТ необходимо специальное наблюдение, которое должно включать в себя последовательное лечение гипертензии, периодическое проведение ЭКГ и консультации кардиолога. Женщины в стабильном состоянии с диаметром корня аорты менее 4 см могут рожать самостоятельно под эпидуральной анестезией. Женщин с исходным или прогрессирующим расширением корня аорты родоразрешают путем кесарева сечения до начала родовой деятельности под эпидуральной анестезией [10].
Специалисты по сохранению репродуктивной функции предложили следующий алгоритм сохранения и реализации репродуктивной функции у пациенток с СШТ . Согласно ему, при первичной консультации по реализации репродуктивной функции у конкретной пациентки с СШТ необходимо комплексно оценить показатели овариального резерва, которые могут включать в себя подсчет числа антральных фолликулов, уровень фолликулостимулирующего гормона, эстрадиола и ингибина В. Однако ведущую роль в определении тактики играет уровень антимюллерова гормона (АМГ). У девочек в препубертатном периоде и при уровне АМГ более 2 нг/мл возможна выжидательная тактика, однако при падении уровня ниже этого показателя может быть рекомендована криоконсервация ткани яичника. В постпубертатном периоде тактика также зависит от показателей овариального резерва. При сохраненном овариальном резерве могут быть применены методы замораживания ооцитов, криоконсервация ткани яичников и у взрослых замужних женщин — криоконсервация эмбрионов [15].
ЧАФ — число антральных фолликулов; ФСГ — фолликулостимулирующий гормон; Е2 — эстрадиол; АМГ — антимюллеров гормон.
Предложенный подход следует прокомментировать. К сожалению, не более чем у 20% пациенток с СШТ удается обнаружить хотя бы остаточные признаки функции яичников, и у большинства таких молодых женщин к взрослому состоянию развивается преждевременное истощение яичников. С другой стороны, криоконсервация яичников у таких пациенток осложняется малым количеством фолликулов в полученной ткани, а также высоким уровнем атретических фолликулов. В доступной литературе не удалось обнаружить случаев успешной ретрансплантации ткани яичника у пациенток с СШТ. Успехи по культивированию фолликулов до зрелой стадии имеются, однако получить качественные зрелые ооциты до настоящего времени не удалось [16]. Спонтанные беременности относительно редки, а для овариальной стимуляции необходимы достаточные показатели овариального резерва, что редко встречается у пациенток с СШТ. Таким образом, методом выбора для реализации репродуктивной функции у этих пациенток является программа донорства ооцитов.
Опубликованы результаты овариальной стимуляции с целью сохранения репродуктивной функции у 7 пациенток с СШТ. У одной пациентки наблюдался кариотип 45,Х, у остальных — различные варианты мозаицизма. Возраст пациенток от 18 до 26 лет. Уровень АМГ колебался от 0,4 до 3 нг/мл. В результате стимуляции получено от 4 до 13 ооцитов, у всех пациенток заморожены зрелые яйцеклетки [20].
Попытки сохранить ткань яичника с помощью криоконсервации проводятся на протяжении последних 20 лет. Так, в большом исследовании, проведенном в Швеции, показано, что технически биопсия яичников возможна у 47 из 57 девочек с СШТ в возрасте от 8 до 19 лет. У 15 из 57 исследуемых фолликулы выявлены при гистологическом исследовании. Обнаружены фолликулы в ткани яичников у 6 из 7 девочек с мозаицизмом, у 6 из 22 — со структурными хромосомными перестройками, у 3 из 28 — с кариотипом 45,Х в ткани яичников. У 8 из 13 девочек с фолликулами отмечено начало первой менструации, и у 11 из 19 со спонтанным пубертатом также в ткани яичников определялись фолликулы. Чаще всего фолликулы обнаруживались у девочек 12—16 лет. Нормальные уровни фолликулостимулирующего гормона, АМГ и выраженная стадия пубертатного периода ассоциированы с обнаружением фолликулов [21]. При исследовании фолликулов у пациенток с СШТ наблюдается более высокая частота апоптоза и нарушений экспрессии генов блестящей оболочки, а также более низкий уровень эстрадиола и тестостерона и более высокий уровень АМГ, чем у пациенток без этого синдрома [22]. В голландском исследовании изучен кариотип ооцитов и клеток гранулезы у 10 пациенток с СШТ. У 5 пациенток с кариотипом 45,Х фолликулы, годные для исследования, получить не удалось, в то время как у остальных 5 пациенток фолликулы получены. Установлено, что все изученные ооциты содержали нормальное число хромосом Х, в то время как многие клетки гранулезы оказались анеуплоидными по этой хромосоме, и наблюдались как мозаичные фолликулы (45,Х/46,ХХ), так и варианты 45,Х и 46,ХХ [23].
В качестве вывода следует отметить, что синдром Шерешевского—Тернера является наиболее частой причиной нарушения половой дифференцировки. Клиническая картина обычно зависит от варианта кариотипа. Более чем у 50% больных с таким заболеванием выявляется различная патология сердечно-сосудистой системы, которая определяет высокий уровень смертности этих пациенток. Со стороны репродуктивной функции обычно наблюдаются первичная аменорея и преждевременное истощение яичников. Случаи спонтанной беременности и родов относительно редки, при сохранении репродуктивной функции можно выполнять заморозку ооцитов и эмбрионов. Заморозка ткани яичников в настоящее время должна рассматриваться как экспериментальная процедура. Методом выбора для реализации репродуктивной функции является применение донорства ооцитов, однако планирование беременности должно сопровождаться обязательным обследованием у кардиолога и других специалистов. Согласно данным ряда исследований, материнская смертность при беременности у пациенток с синдромом Шерешевского—Тернера может достигать 2%. Беременность часто сопровождается повышенным уровнем артериального давления. Необходимо избегать многоплодной беременности, с этой целью рекомендуется перенос одного эмбриона.
Синдром Персонейджа-Тернера ( Идиопатический плечевой неврит , Невралгическая амиотрофия , Синдром лопаточного пояса )
Синдром Персонейджа-Тернера — это поражение нервных стволов и ветвей плечевого сплетения неясной этиологии, характеризующееся приступами невропатической боли, быстрым многоочаговым парезом и атрофией мышц верхних конечностей с длительным восстановительным периодом. Диагностика проводится с учетом данных неврологического статуса, лабораторных, электрофизиологических, рентгенологических, томографических исследований. Консервативное лечение осуществляется глюкокортикоидами, нестероидными противовоспалительными, внутривенными иммуноглобулинами. При неэффективности медикаментозной терапии возможно применение хирургических методов.
МКБ-10



Общие сведения
Синдром Персонейджа-Тернера относится к группе невральных амиотрофий. Первое упоминание патологии датируется 1887 г.. Подробное описание сделано в 1948 г. англичанами Морисом Персонейджем и Джоном Тернером по результатам наблюдения 136 клинических случаев. Синонимичными названиями заболевания являются «идиопатический плечевой неврит», «невралгическая амиотрофия», «синдром лопаточного пояса». Уровень годовой заболеваемости составляет 1 случай на 1000 человек. Среди заболевших доминируют мужчины, по различным данным, они заболевают в 2-10 раз чаще женщин. Интерес к заболеванию увеличился в связи с появлением случаев, индуцированных коронавирусом и вакциной против COVID-19.

Причины
Этиологические факторы продолжают изучаться. Выявлены формы патологии, передающиеся по наследству, и спонтанно возникающие идиопатические варианты. Среди основных этиофакторов, способных привести к возникновению синдрома Персонейджа-Тернера, выделяют:
- Генетические нарушения. В пользу наследственной природы болезни свидетельствует семейный анамнез. У 50% пациентов выявлены точечные мутации гена SEPT9, расположенного на хромосоме 17q25.
- Иммунологические факторы. Более 50% заболевших имеют в анамнезе такое событие, активирующее иммунную систему, как инфекция, вакцинация, хирургическое вмешательство, беременность, стресс. Инфекционные причины включают оспу, коксаки-вирусы, цитомегаловирус, коронавирус, парвовирус, ВИЧ.
- Механические нагрузки. Спровоцировать развитие синдрома могут занятия спортом, связанная с тяжелой физической нагрузкой работа. В исследованиях около 10% больных сообщали о предшествующей интенсивной механической нагрузке на плечевой пояс и верхнюю конечность.
Патогенез
Наследственные генетические мутации обуславливают нарушения синтеза гуанозин 5-трифосфатсвязывающего белка, участвующего в формировании цитоскелета глиальных клеток, образующих миелиновую оболочку периферических нервных стволов. Патологическое строение последней делает нерв подверженным воспалительным изменениям под воздействием внешних триггеров, обуславливая рецидивирование клинической симптоматики.
Среди патогенетических теорий спонтанного возникновения амиотрофии Персонейджа-Тернера наиболее признана иммунологическая. Согласно данной теории, вариабельные иммунологические триггеры вызывают иммунную гиперактивацию, приводящую к воспалительным процессам. Имеются данные о повышении уровня антител к миелину периферических нервов.
Иммунологическая теория нашла подтверждение в ряде исследований, выявивших эпиневральные периваскулярные Т-клеточные инфильтраты в биоптатах пораженных нервов. CD8+ Т-лимфоциты, CD68+ макрофаги и CD20+ В-лимфоциты были также обнаружены в эндотелии сосудов, окружающих вовлеченные нервные стволы. При этом механические факторы имеют провоцирующее действие, запускают механизм иммунного воспаления.

Классификация
Согласно современным представлениям об этиологии и патогенезе синдрома Персонейджа-Тернера, различают 2 основных варианта болезни. Их клиническая картина мало отличается, понимание различий в механизме возникновения необходимо для успешного лечения и определения прогноза:
- Идиопатическая форма. Представляет большинство случаев невралгической амиотрофии. Отличается более доброкачественным течением, отсутствием рецидивов.
- Наследственная форма. Встречается примерно в 10 раз реже, чем идиопатическая. Наследуется аутосомно-доминантно. Характеризуется возникновением рецидивов острого или подострого воспаления.
Симптомы
Синдром Персонейджа-Тернера чаще затрагивает одну конечность, у 30-35% пациентов наблюдается двустороннее асимметричное поражение. В 96% случаев болезнь дебютирует острой болью в плечевом поясе, иррадиирующей в шею, плечо, переднюю поверхность грудной клетки, предплечье. Небольшая часть больных испытывает боль только в ограниченной области, например, в шее, лопатке или плече.
Примерно в 60% случаев приступы начинаются ночью. Пациенты просыпаются рано утром с сильной болью, которая затем достигает максимальной интенсивности в течение следующих нескольких часов. Боль обычно носит «колющий», «пульсирующий», «ноющий» характер, нарастает при движениях плечом, руками. Продолжительность приступа брахиалгии варьирует от нескольких часов до 2 месяцев, средняя длительность болевого синдрома составляет 4 недели.
Примерно у 5% пациентов боль проходит в течение 24 часов, у 10% пациентов боль сохраняется более 2 месяцев. Спустя несколько дней или недель после манифестации симптомов возникает мышечная слабость, прогрессирующая по мере стихания боли. Типично поражение бицепса и трицепса плеча, передней зубчатой, надостной, дельтовидной, подостной мышцы.
У большинства пациентов отмечаются сенсорные расстройства в виде гипестезии и/или парестезии латеральной поверхности плеча, зоны над дельтовидной мышцей. Однако на первое место в клинической симптоматике выходит слабость мышц, затрудняющая движения верхней конечностью. Поражение длинного грудного нерва с парезом передней зубчатой мышцы приводит к отстоянию нижнего угла лопатки от грудной клетки.
Осложнения
В целом, синдром Персонейджа-Тернера имеет доброкачественное течение. Однако выраженный парез с силой мышц менее 3 баллов приводит к ее неполному восстановлению поле стихания основных симптомов. Развитие мышечной атрофии сопровождается стойкой утратой нормальной двигательной функции. Другим осложнением болезни выступает рецидив воспалительного процесса с возобновлением болевого эпизода, что более характерно для наследственного варианта невралгической амиотрофии.
Диагностика
Диагноз синдрома Персонейджа-Тернера устанавливается на основании анамнеза и осмотра неврологом после исключения другой возможной патологии. В анамнезе внимание уделяют семейности случая, заболеваниям и механическим факторам, предшествующим возникновению симптомов. Общий осмотр определяет ограничение движений в одной или обеих руках, положение вынужденного приведения плеча и сгиба в локтевом суставе. В 20% случаев выявляется крыловидная лопатка. Для подтверждения диагноза проводят следующие обследования:
- Неврологический осмотр. Позволяет выявить и определить степень пареза мышц плечевого пояса и верхних конечностей. Нарушения поверхностной чувствительности диагностируются в области дельтовидной мышцы, наружной поверхности плеча. Глубокая чувствительность сохранена.
- Лабораторные исследования. Включают общий анализ крови, посев крови для исключения инфекционного процесса. Ревмопробы необходимы для дифдиагностики с заболеваниями соединительной ткани.
- Электромиография. Позволяет локализовать место поражения нервов, оценить степень поражения, динамику процесса, эффективность лечения. Выявляет снижение амплитуды М-ответа, фибрилляции в мышцах, которые иннервируются пораженными нервными волокнами.
- Электронейрография. Наблюдается снижение амплитуд прохождения потенциалов действия в стволах и ветвях пораженных двигательных нервов. Нарушения проводимости по сенсорным нервам наблюдаются в 30-45% случаев.
- Рентгенография. Выполняется при необходимости дифференцировать синдром от патологии позвоночника и плечевого сустава. При синдроме Персонейджа-Тернера диагностируются только возрастные изменения.
- Магнитно-резонансная томография. МРТ позвоночника проводится для исключения радикулопатии, вызванной грыжей межпозвоночного диска. На МРТ мягких тканей с усилением гадолинием визуализируются участки высокой интенсивности сигнала, соответствующие воспалению в нервных волокнах.
Дифференциальная диагностика
Болезнь Персонейджа-Тернера необходимо дифференцировать от заболеваний плечевого сустава, плексита, патологии шейного отдела позвоночника, имеющих сходную симптоматику. К основным заболеваниям, требующим исключения относятся:
- плечевой плексит;
- субакромиальный бурсит;
- шейная радикулопатия;
- компрессионная нейропатия;
- разрыв вращательной манжеты плеча.
Отличительной особенностью синдрома Персонейджа-Тернера является усиление пареза при снижении интенсивности брахиалгии, отсутствие рентгенологических и томографических изменений позвоночника и плечевого сустава.

Лечение синдрома Персонейджа-Тернера
Консервативная терапия
В остром периоде пациентам рекомендована иммобилизация для минимизации боли. С целью купирования воспалительных изменений и болевого синдрома проводится активная фармакотерапия. В последующем для восстановления мышечной силы необходимы реабилитационные мероприятия, включающие массаж, индивидуально подобранную лечебную гимнастику. В ходе терапии болезни Персонейджа-Тернера в практической неврологии применяют следующие лекарственные средства:
- Нестероидные противовоспалительные. Применяются в качестве поддерживающей терапии. Позволяют купировать воспалительный процесс, снизить интенсивность болевых ощущений. Существенно не влияют функциональные исходы заболевания.
- Кортикостероиды.Глюкокортикоидная пульс-терапия в течение 2 недель ускоряет облегчение боли, уменьшает время восстановления нерва, увеличивает шансы на выздоровление. Применение кортикостероидов не предупреждает возникновение мышечных атрофий.
- Иммуноглобулины. Назначаются внутривенно в комбинации с кортикостероидами. По данным клинических исследований, такая схема лечения позволяет сократить длительность острого периода, улучшить результаты лечения.
Хирургическое лечение
Поскольку у многих пациентов с синдромом Персонейджа-Тернера наблюдается спонтанное разрешение болезни, хирургические вмешательства показаны при отсутствии клинических признаков выздоровления в течение 3-х месяцев. Предварительно проводится магнитно-резонансная нейрография. При выявлении сужения нервного ствола рассматривают вопрос о целесообразности операции. К вариантам оперативного лечения относятся:
- Интрафасцикулярный невролиз. Показан при истончении нерва менее 75% по данным томографии. Операция направлена на иссечение патологически измененных тканей и создание оптимальных условий для регенерации нерва.
- Нейрорафия. Проводится при уменьшении диаметра нерва более 75%. Хирургическое вмешательство заключается в иссечении места сужения и сшивании концов, что может явиться стимулом для восстановления нерва.
Прогноз и профилактика
Исход синдрома Персонейджа-Тернера зависит от степени развития коллатеральной иннервации. В большинстве случаев происходит спонтанное выздоровление. Как правило, пациенты восстанавливаются до 80-90% своего предшествующего состояния за 2-3 года, однако более 70% больных имеют остаточную двигательную слабость.
Если амплитуда сложных двигательных потенциалов при электромиографии снижена более 70%, или имеется начальный парез ≤3 степени по шкале мышечной силы, коллатеральная реиннервация будет неполной, и прогноз восстановления двигательной функции будет неблагоприятным. Поскольку этиология заболевания Персонейджа-Тернера окончательно неясна, специфические профилактические мероприятия не разработаны.
1. Невралгическая амиотрофия плечевого пояса/ Хайбуллин Т. И., Гранатов Е. Б., Аверьянова Л. А., Бабичева Н. Н.// Практическая медицина. - 2013. - №1(66).
2. Острая идиопатическая невралгическая амиотрофия: синдром Персонейджа-Тернера/ Бушкова Ю.В., Стаховская Л.В., Ковражкина Е.А., Шурдумова М.Х.// Consilium Medicum. - 2018. - №20(2).
3. COVID-19 Vaccine-Induced Parsonage-Turner Syndrome: A Case Report and Literature Review/ Amjad M.A., Hamid Z., Patel Y., et al.// Cureus. - 2022. - 14(5).
4. Neuralgic amyotrophy: an underrecognized entity/ Kim T.U., Chang M.C.// The Journal of International Medical Research. - 2021. - 49(4).
Кафедра факультетской хирургии №1 лечебного факультета РНИМУ им. Н.И. Пирогова, Москва, Россия
ФГБОУ ВО «Российский научно-исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, кафедра факультетской хирургии №1, Москва, Россия
Городская клиническая больница №1 им. Н.И. Пирогова, Москва, Россия
ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, 117997, Москва, Россия;
ГБУЗ Москвы «Городская клиническая больница №1 им. Н.И. Пирогова» Департамента здравоохранения Москвы, 117049, Москва, Россия
Кафедра факультетской хирургии Российского национального исследовательского медицинского университета им. Н.И. Пирогова;
Городская клиническая больница №1 им. Н.И. Пирогова
Кафедра факультетской хирургии, урологии лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова, Городская клиническая больница №1 им. Н.И. Пирогова, Москва, Россия
кафедра урологии и андрологии лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова, Москва, Россия
Возможности гибридных технологий в лечении синдрома тазового венозного полнокровия
Журнал: Флебология. 2018;12(3): 134‑141
Цель исследования — демонстрация возможностей эндоваскулярных и эндоскопических методик в лечении тазового венозного полнокровия, обусловленного синдромом Мея—Тернера в сочетании с синдромом правой гонадной вены. Материал и методы. Пациентка, 37 лет, с клиническими признаками тазового венозного полнокровия (ТВП). По результатам компьютерной томографии, оварикографии и тазовой флебографии подтвержден диагноз синдрома тазового венозного полнокровия (СТВП) и диагностированы синдромы Мея—Тернера и правой овариальной вены. Компрессия правого мочеточника гонадной веной сопровождалась явлениями правосторонней уретерообструкции. Результаты. Первым этапом лечения выполнено эндоваскулярное стентирование левых подвздошных вен, вторым — ретроперитонеальная эндоскопическая резекция правой гонадной вены, затем — эндоскопическое стентирование правого мочеточника. Комплекс проведенных лечебных мероприятий позволил восстановить проходимость левой общей подвздошной вены, купировать симптомы ТВП и правосторонней уретерообструкции. Проведен анализ медицинской литературы, посвященной проблеме лечения синдромов Мея—Тернера, тазового венозного полнокровия и правой овариальной вены. Заключение. СТВП может сочетаться со стенозом левой общей подвздошной вены и синдромом правой гонадной вены. Адекватная диагностика состояния тазовых вен, мочевыделительной системы и комбинированное поэтапное применение эндоваскулярных методик позволяют эффективно купировать признаки ТВП, нормализовать пассаж мочи по мочеточникам.
Синдром тазового венозного полнокровия (СТВП) — патологическое состояние, возникающее на фоне расширения внутритазовых вен, рефлюкса крови по ним и характеризующееся тазовыми, коитальными и посткоитальными болями, дисменореей, дизурическими расстройствами [1]. В подавляющем большинстве случаев причиной возникновения варикозного расширения вен таза и венозных тазовых болей служат повторные беременности и роды [2]. Другой причиной СТВП является синдром Мея—Тернера — сдавление левой общей подвздошной вены правой общей подвздошной артерией, сопровождающееся нарушением венозного оттока по левым подвздошным венам, расширением и рефлюксом крови по левой внутренней подвздошной вене и ее притокам, варикозной трансформацией гонадных вен [3—5]. Расширение яичниковых вен в редких случаях приводит к формированию синдрома правой либо левой гонадной вены — уретероовариальному конфликту [6]. Это состояние характеризуется нарушением нормального пассажа мочи по мочеточникам, развитием уретеро- и пиелоэктазии, сипмтомами персистирующей мочевой инфекции [7].
В медицинской литературе представлены редкие случаи комбинации синдромов Мея—Тернера и тазового венозного полнокровия, правостороннего либо левостороннего уретероовариального конфликта и СТВП [3, 8, 9]. Мы представляем случай сочетания синдромов Мея—Тернера, правой гонадной вены и тазового венозного полнокровия, успешно излеченный благодаря применению гибридных технологий, а именно ‒ сочетанию эндоваскулярных и эндоскопических лечебных методик.
Клинический случай
Пациентка М., 37 лет, ИБ № 1574, обратилась за медицинской помощью 01.11.17 в университетскую хирургическую клинику им. В.С. Савельева РНИМУ им. Н.И. Пирогова с жалобами на постоянные тупые боли в нижних отделах живота, правой мезогастральной области, боли после полового акта. Из анамнеза известно, что указанные выше симптомы впервые возникли после вторых родов в 2013 г. Неоднократно лечилась по поводу хронического пиелонефрита. Полного исчезновения болевого синдрома не отмечала. В ходе выполнения ультразвукового исследования (УЗИ) органов малого таза и почек в августе 2017 г. обнаружены варикозно-расширенные вены малого таза и расширение правой почечной лоханки. Обследована урологом, выполнена экскреторная урография, по результатам которой обнаружена правосторонняя пиелоэктазия, механических препятствий оттоку мочи по правому мочеточнику не обнаружено. Рекомендовано консервативное лечение.
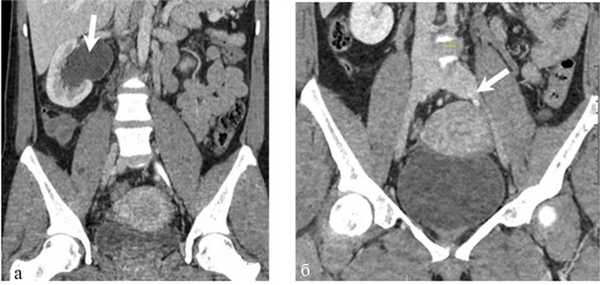
В клинике больная дообследована. В анализах крови и мочи значимых изменений не обнаружено. Помимо общеклинического обследования, выполнено трансабдоминальное и трансвагинальное ультразвуковое ангиосканирование (УЗАС), по результатам которого обнаружены расширение параметральных вен до 10 мм, маточных вен до 7 мм, правой гонадной вены до 8 мм, патологический рефлюкс крови по этим сосудам. Ультрасонографических признаков патологии подвздошных вен не выявлено. В ходе выполнения мультиспиральной компьютерной томографии (МСКТ) с контрастным усилением диагностированы правосторонняя пиелоэктазия до 50×28 мм, расширение мочеточника в средней и нижней трети до 15 мм, сужение просвета левых подвздошных вен, расширение правой гонадной вены (рис. 1). Рис. 1. Компьютерные томограммы пациентки М. а — расширение правой почечной лоханки; б — стеноз левой общей подвздошной вены (указано стрелками). Органической патологии органов малого таза, забрюшинного пространства не выявлено.
Для уточнения диагноза и определения тактики лечения выполнены ренофлебография, оварикография, тазовая флебография. По результатам флебографического исследования выявлены: сдавление правого мочеточника расширенной правой гонадной веной в верхней трети, расширение правого мочеточника в средней и нижней трети, стеноз левой наружной и общей подвздошной вен до 95% неопухолевого и нетромботического генеза, расширение левой внутренней подвздошной вены и ее притоков, депонирование контрастного вещества в варикозных венах малого таза (рис. 2). Рис. 2. Флебограммы пациентки М. а: 1 — правая гонадная вена; 2 — S-образный изгиб мочеточника в верхней трети; 3 — сдавление правого мочеточника правой гонадной веной; 4 — расширенный мочеточник в средней и нижней трети; б — стеноз общей подвздошной вены (указано стрелками). Случай расценен как синдром Мея—Тернера, тазовое венозное полнокровие, синдром правой гонадной вены. Учитывая выраженное сужение левых подвздошных вен, высокий риск развития венозных тромбоэмболических осложнений, первым этапом лечения решено выполнить эндоваскулярное стентирование левых подвздошных вен. Проведена имплантация стента Wallstent—Uni 14×60 мм. На контрольной флебографии определяется полная проходимость подвздошных вен (рис. 3). Рис. 3. Флебограмма пациентки М. Стент в левых общей и наружной подвздошных венах (указано стрелками). После стентирования проводили антикоагулянтную и дезагрегантную терапию (клексан 60 мг 2 раза в сутки под кожу живота, плавикс 75 мг/сут в течение 3 нед, затем клексан 40 мг/сут однократно). Постимплантационный период протекал без осложнений.
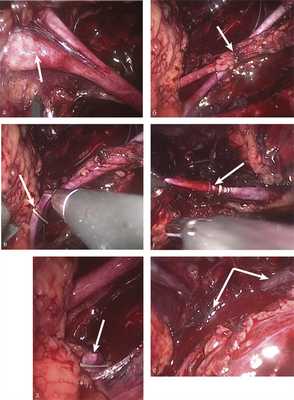
Через 1 мес вторым этапом лечения с целью коррекции СТВП и синдрома правой овариальной вены выполнена ретроперитонеальная эндоскопическая резекция правой гонадной вены. После формирования правостороннего забрюшинного доступа обнаружено, что правая гонадная вена расширена до 8 мм, пересекает правый мочеточник в его верхней трети, сразу над зоной расширения мочеточника. S-образного изгиба мочеточника не выявлено. Правая лоханка расширена, мочеточник в верхней трети диаметром 8 мм, в средней и нижней трети — расширен до 1,5 см. Выполнены мобилизация правой овариальной вены, уретеролизис. Вена клипирована в дистальном и проксимальном направлении, резецирована. Уретероовариальный конфликт ликвидирован (рис. 4). Рис. 4. Фото этапов операции. а — расширенная правая почечная лоханка; б — пересечение правых гонадной вены и мочеточника; в — клипирование правой гонадной вены в приустьевом отделе; г — клипирование правой гонадной вены в дистальном отделе; д — вид резецированной правой гонадной вены в приустьевом отделе; е — вид мочеточника после уретеролизиса (указано стрелками).
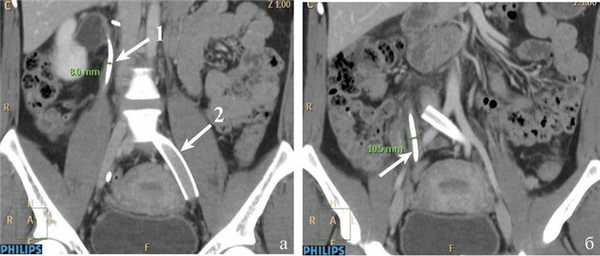
Учитывая выраженную диффузную кровоточивость тканей (пациентка получала низкомолекулярный гепарин в профилактической дозе), в забрюшинное пространство установлен силиконовый дренаж. Продолжительность операции составила 50 мин, кровопотеря — около 100 мл. Послеоперационный период без осложнений, дренаж удален на 1-е сутки после вмешательства. Через 2 дня после операции пациентка отметила значительное уменьшение болевого синдрома. При повторных ультразвуковых исследованиях и МСКТ на 3-й день послеоперационного периода сохранялись правосторонняя пиелоэктазия и расширение правого мочеточника, в связи с чем решено выполнить временное стентирование правого мочеточника (рис. 5). Рис. 5. Компьютерные томограммы пациентки М. после стентирования мочеточника. а: 1 — мочеточниковый стент в верхней трети; 2 — стент в правых подвздошных венах, проходимость его не нарушена; б — мочеточниковый стент в нижней трети (указано стрелками).
Через сутки после стентирования мочеточника пациентка выписана из стационара в удовлетворительном состоянии, болевой синдром купирован. Через месяц выполнено удаление уретрального стента. При контрольной МСКТ стент в подвздошной вене проходим, явления тазового венозного полнокровия, пиело- и уретероэктазии отсутствуют.
Варикозная трансформация внутритазовых вен наиболее часто сопровождается симптомами тазового венозного полнокровия [10, 11]. Многочисленными исследованиями [12—14] доказано, что хирургические вмешательства на гонадных венах служат оптимальным методом лечения СТВП. Вместе с тем всегда следует учитывать такой этиологический фактор СТВП, как синдром Мея—Тернера, адекватная коррекция которого обеспечивает успех лечебного процесса и безрецидивное течение послеоперационного периода [3, 8]. В настоящее время доказано, что эндоваскулярное стентирование — наиболее эффективный способ восстановления проходимости подвздошных вен при синдроме Мея—Тернера [15—17]. В случае сочетания СТВП и компрессии левой общей подвздошной вены предпочтительнее первым этапом выполнить эндоваскулярное стентирование, затем — вмешательство на гонадных венах [3]. Неустраненный стеноз левой наружной подвздошной вены может обусловливать сохранение тазовых болей, усугубление признаков ТВП, возникновение вульварного и промежностного варикоза [18].
Эндоваскулярная эмболизация гонадных вен — достаточно эффективный способ лечения СТВП [25—27]. Несмотря на это, некоторые авторы высказывают обоснованные сомнения относительно повсеместного применения данного метода лечения при ТВП [10, 28, 29]. В наибольшей степени это относится к пациентам с синдромом овариальных вен. Установка эмболизирующих спиралей в гонадные вены на фоне компрессии мочеточников чревата дальнейшим усугублением уретральной обструкции.
В представленном клиническом случае у пациентки выявлены три синдрома: Мея—Тернера, тазового венозного полнокровия и правой овариальной вены, что предопределило применение гибридной технологии лечения. Первый этап, включающий коррекцию нарушения венозного оттока по левым подвздошным венам, осуществлен с помощью эндоваскулярного стентирования. Ликвидация этиологического фактора развития СТВП позволила выполнить вторым этапом лечения патогенетически обоснованную операцию — резекцию правой гонадной вены, направленную на устранение патологического рефлюкса по правой гонадной вене, купирование симптомов ТВП. В случае сохранения стеноза подвздошных вен выполнение редукции кровотока по гонадным венам может привести к прогрессированию явлений ТВП, развитию венозных тромбоэмболических осложнений. Кроме того, эндоскопическая ретроперитонеальная резекция в данном случае позволила не только устранить рефлюкс крови по гонадной вене и участок сосуда в зоне перекреста с правым мочеточником, но и выполнить уретеролизис на значительном протяжении.
В конкретной ситуации этой операции оказалось недостаточно для купирования явлений уретерообструкции, в связи с чем проведено эндоскопическое стентирование правого мочеточника, окончательно разрешившее имеющееся нарушение пассажа мочи по правому мочеточнику. Безопасность и эффективность этой процедуры доказаны в практике лечения синдрома овариальных вен у беременных женщин [30]. Таким образом, резекция вены и стентирование мочеточника послужили взаимодополняющими вмешательствами, их сочетанное выполнение обеспечило положительный клинический эффект. Использование лишь временного стентирования мочеточника при неустраненной его компрессии правой гонадной веной в последующем могло привести к рецидиву правосторонней уретральной обструкции.
Заключение
В клинической практике СТВП может сочетаться со стенозом левых подвздошных вен и синдромом овариальных вен. Это диктует необходимость применения различных диагностических методов (УЗИ, УЗАС, МСКТ, флебографии) для получения необходимой информации, определения тактики лечения и последовательности выполнения хирургических вмешательств. Сочетанное применение эндоваскулярных и эндоскопических технологий позволяет эффективно проводить коррекцию нарушений венозного оттока на разных уровнях и устранять уретральный блок. Помимо этого, мини-инвазивные технологии сопровождаются кратковременным нахождением пациента в стационаре, быстрой реабилитацией, хорошими косметическими результатами.
Синдром Тернера (Turner'S Syndrome)
Синдром Тернера (Turner'S Syndrome) генетический дефект, характеризующийся наличием у женщины только одной Х-хромосомы вместо двух. Такие женщины страдают бесплодием: у них имеются нормальные наружные половые органы, но нет яичников, а следовательно, отсутствуют и менструации (см. Аменорея). Обычно они невысокого роста и имеют некоторые другие явно выраженные пороки развития, например, птеригиум-синдром (в отечественной литературе принято название ""синдром Терешевского-Тернера"").
Медицинские термины . 2000 .
Смотреть что такое "Синдром Тернера (Turner'S Syndrome)" в других словарях:
ШЕРЕШЕВСКОГО - ТЕРНЕРА СИНДРОМ — (описан отечественным эндокринологом Н. А. Шерешевским, 1885-1961, позднее - американским эндокринологом H. H. Terner, 1892-1970) - хромосомная патология с полной или частичной моносомией по Х хромосоме. Клиническая характеристика: нанизм, шейные … Энциклопедический словарь по психологии и педагогике
ПЕРСОНЕЙДЖА - ТЕРНЕРА СИНДРОМ — (описан британскими неврологами M. J. Parsonage и J. W. A. Terner; синонимы - невралгическая амиотрофия, идиопатическая плечевая плексопатия, острый плечелопаточный паралич) - заболевание предположительно аутоиммунного генеза, преимущественно… … Энциклопедический словарь по психологии и педагогике
культуральное наследование — cultural transmission “культуральное” наследование. Один из факторов, определяющих взаимодействие “генотип среда” в генетике человека, проявляется в том случае, когда социальная среда, в которой находятся члены одной семьи, “зависит” от фенотипа… … Молекулярная биология и генетика. Толковый словарь.
дисгенез женских гонад — female gonadal dysgenesis дисгенез женских гонад. Hедоразвитие или отсутствие гонад у женщин (или самок животных) в результате моносомии по Х хромосоме (синдром Тернера ) либо других аномалий половых хромосом (присутствие… … Молекулярная биология и генетика. Толковый словарь.
сексогенная карликовость — Turner syndrome синдром Тернера, синдром Шерешевского Тернера, синдром Улльриха, сексогенная карликовость. НЗЧ, проявляющееся в недоразвитии или отсутствии гонад, в низкорослости и в др. аномальных признаках; в основе С.Т. лежит моносомия по… … Молекулярная биология и генетика. Толковый словарь.
Список наследственных заболеваний — Список генетических заболеваний Основные статьи: наследственные заболевания, Наследственные болезни обмена веществ, Ферментопатия. В большинстве случаев приведен также код, указывающий на тип мутации и связанные с ней хромосомы. См. также система … Википедия
Читайте также:
