Стимуляция задних столбов. Интраспинальное программируемое введение опиоидов. Хирургическая симпатэктомия.
Добавил пользователь Владимир З. Обновлено: 28.01.2026
это малоинвазивная операция, которая состоит в прерывании нервного импульса, исходящего из спинного мозга в направлении потовых желез. Достигается это путем удаления, разрушения, пересечения или пережатия титановой клипсой симпатического ствола.
Научно-практический центр хирургии располагает всем необходимым специальным инструментом для проведения подобных операций. Высокая квалификация хирургов, позволяет осуществлять операции с технической точностью и эффективностью.
Показания к торакоскопической симпатэктомии:
- Повышенная потливость ладоней
- Стрессовое покраснение лица
- Болезнь Рейно
- Рефлекторная симпатическая дистрофия верхних конечностей
Противопоказания к торакоскопической симпатэктомии:
- Острая сердечная или легочной недостаточности
- Туберкулез
- В случае проведения операций в брюшной полости
Анализы до торакоскопической симпатэктомии:
- Общий анализ мочи и крови
- Электрокардиография
- Коагулограмма
Техника проведения торакоскопической симпатэктомии:
Операция проводится под общим обезболиванием. Выполняется прокол, куда вводится тонкая трубка, на конце которой располагается источник света и видеокамера. Изображение подается на большой экран, находящийся в поле зрения хирурга. Затем, через такие же проколы вводятся инструменты. Хирург находит симпатический ствол и пересекает симпатический ствол на нужном уровне, либо накладывает клипсу на определенный участок. По завершении процедуры на поврежденные участки кожи накладывают одиночные швы, что снижает риск появления рубцов. Эффективность симпатэктомии настолько велика, что иногда ладони пациентов становятся сухими прямо на операционном столе.
Длительность операции:
Длительность операции составляет 20-30 минут
Реабилитационный период:
Малоинвазивность данной операции обеспечивает пациенту быстрый и легкий реабилитационный период, поэтому пациент может покинуть клинику уже в этот же день.
СИМПАТЭКТОМИЯ
Симпатэктомия [лат. (systema nervorum) sympathicum симпатическая нервная система + греч. ektome иссечение, удаление; син. симпатикотомия] — хирургическая операция — резекция симпатического нервного ствола (его узлов или ветвей).
Различают тотальную Симпатэктомию — удаление пограничного ствола с цепочкой симпатических узлов, частичную — удаление симпатического узла, трункулярную — резекция симпатического ствола, периартериальную — удаление каротидного гломуса, наружной оболочки или адвентиции артерий , с проходящими в ней симпатическими волокнами, спланхнэктомию — резекцию чревных нервов. Кроме того, выделяют преганглионарную и постганглионарную Симпатэктомию. Различают также одностороннюю и двустороннюю Симпатэктомию, одномоментную и поэтапную Симпатэктомию.
Цель Симпатэктомии — прерывание патологических центростремительных импульсов, создающих стойкие очаги возбуждения в ц. н. с., а также нарушение потока центробежных патологических импульсов, способных вызывать вазомоторный спазм, расстройства кровообращения, гуморальные и трофические нарушения в очаге поражения. В результате С. в этих условиях наступает вазодилатация, снимается периферический спазм, улучшается коллатеральное кровообращение в десимпатизированной области. Под влиянием С. улучшается капиллярное кровообращение, ускоряется заживление трофических язв, ограничиваются участки некроза, уменьшаются боли, стихает воспалительный процесс-.
Симпатэктомия относится к паллиативным методам лечения. Ее производят при облитерирующих поражениях сосудов конечностей, болезни Рейно, ишемической болезни сердца, гипертонической болезни, нарушениях мозгового кровообращения. С. применяют также при болевых синдромах, каузалгиях, табетических кризах, симпаталгиях, при панкреатите, бронхиальной астме и склеродермии. С. А. Русанов с успехом использовал поясничную С. на стороне поражения для борьбы с грозящей ишемической гангреной нижней конечности после перевязки раненой магистральной артерии. В этих случаях С. целесообразна, если новокаииовая блокада поясничных ганглиев дала достаточно отчетливый, но кратковременный эффект.
Противопоказаниями к С. являются тяжелое состояние больного, сердечно-сосудистая и эндокринная недостаточность, туберкулез легких и плевры (грудная Симпатэктомия), воспалительные заболевания органов грудной и брюшной полости. Относительное противопоказание к грудной С.— кифосколиотическая деформация позвоночника с реберным горбом.
Подготовка к операции и обезболивание такие же, как при оперативных вмешательствах на шее, грудной и брюшной полостях. При шейной С. может быть применена местная анестезия (см. Анестезия местная), грудную и брюшную С. проводят под наркозом (см. Ингаляционный наркоз).
Для удаления верхнего шейного симпатического узла (С1) используют зачелюстной доступ (см. Ганглиэктомия, Рамикотомия). После обнажения сосудисто-нервного пучка шеи вскрывают превертебральную фасцию и проводят рамикотомию, ганглиэктомию. При необходимости более радикальной десимпатизации ганлиэктомию сочетают с денудацией (см.) сонных артерий и резекцией каротидного гломуса. Средний шейный симпатический узел обнаруживается на уровне щитовидной железы. Нижний шейный симпатический или звездчатый узел удаляют передним или задним доступом. При переднем доступе производят поперечный надключичный или продольный разрез соответственно грудино-ключично-сосцевидной мышце. Обнажают сосудисто-нервный пучок шеи, подключичную артерию. В глубине раны позади сосудов определяют звездчатый узел. Вскрыв плеврокостальную связку, его удаляют.
Симпатэктомия в грудном отделе может осуществляться экстраплеврально и трансплеврально, а также при торакоскопии (эндоскопическая С.). Экстраплеврально грудную С. осуществляют разрезом сзади по средней линии или паравертебрально. После резекции поперечных отростков и одного-двух прилежащих ребер обнажают париетальную плевру и резецируют узлы симпатического ствола, к-рые располагаются вблизи межреберных нервов. Трансплеврально С. производят разрезом по IV межреберью или боковым подмышечным разрезом с последующим вскрытием плевры над симпатическим стволом. Эндоскопическую грудную С. осуществляют при торакоскопии (см.) через IV межреберье по средней подмышечной линии. После введения торакоскопа манипулятором отводят верхнюю долю легкого книзу и медиально. Электрокаутс-ром рассекают плевру и внутригрудную фасцию. Симпатический ствол выделяют манипулятором, пересекают соединительные ветви и иссекают узлы.
Поясничную С. производят чрезбрюшинным и внебрюшинным доступами. При чрезбрюшинном доступе вскрывают брюшную полость (см. Лапаротомия). Рассекают париетальную брюшину соответственно аорте или нижней полой вене на стороне предполагаемой С. При одномоментной ганглиэктомии и резекции верхнего подчревного сплетения разрез продлевают книзу и кнутри. После двусторонней ганглиэктомии резецируют верхнее подчревное сплетение на бифуркации аорты. При внебрюшинном доступе используют разрез кнаружи от прямой мышцы живота или от XI ребра к подвздошному гребню.
В послеоперационном периоде назначают противовоспалительные и обезболивающие средства, проводят комплекс мероприятий, направленных на профилактику пневмонии, пареза кишечника, нарушений сердечной деятельности.
При проведении С. возможны различные осложнения, преимущественно за счет оперативных погрешностей. После шейной С. иногда развиваются парезы мышц шеи, нарушения фонации. При удалении звездчатого узла описаны расстройства дыхания и рефлекторная остановка сердца, повреждение грудного лимфатического протока. Грудная С. может осложняться плевритом, гемотораксом, пневмонией. При эндоскопической грудной С. описаны повреждения легких, межреберных артерий, гемоторакс, плеврит. При поясничной С. возможны повреждения мочеточников, образование за-брюшинной гематомы, нередко развивается парез кишечника.
Ближайшие результаты Симпатэктомии, по различным данным, характеризуются выраженным лечебным эффектом в 50—80% случаев. Отдаленные результаты не всегда положительны. Лучшие исходы С. отмечают при функциональных изменениях; при органических поражениях, в случаях выраженных трофических расстройств, эффект С. значительно слабее.
Библиография: Иванов И. А. Адренал- и симпатэктомия при облитерирующих заболеваниях сосудов нижних конечностей, Сов. мед., № 1, с. 72, 1979, библиогр.; Кохан Е. П., Зобнин И. В. и Мироненко А. А. Отдаленные результаты поясничной симпатэктомии у больных облитерирующим атеросклерозом нижних конечностей, Хирургия, № 1, с. 59, 1979; Михайловский В. С. Хирургические вмешательства на вегетативной нервной системе при неукротимых болях в тазовой области, Вопр. нейрохир., №3, с. 35, 1967; Нестеров С. С., Овчинников В. А. и Мизинов К. Н. Поясничная симпатэктомия при лечении облитерирующих заболеваний артерий нижних конечностей, Хирургия, № 2, с. 23, 1978; Русанов С. А. Распознавание и лечение огнестрельных ранений кровеносных сосудов конечностей, М., 1954; Фокин А. А., Шапиро М. Я. и Вербовецкий Л. П. Эндоскопическая грудная симпатэктомия, Грудн. хир., № 4, с. 77, 1976; Mattassi R., Miele F. a. D’Angelo F. Thoracic sympathectomy, J. cardiovasc. Surg. (Torino), v. 22, p. 336, 1981; Sebesteny M. u. a. Spater-gebnisse der thorakalen Sympathektomie b ei verschiedenen Krankheitsbildern, Acta chir. Acad. Sci. hung., Bd 19, S. 69, 1978.
Стимуляция задних столбов. Интраспинальное программируемое введение опиоидов. Хирургическая симпатэктомия.
РНЦХ им. акад. Б.В. Петровского РАМН
Клиника аортальной и сердечно-сосудистой хирургии ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова», Москва, Россия
Клиника аортальной и сердечно-сосудистой хирургии, отделение сосудистой хирургии УКБ №1 Первого МГМУ им. И.М. Сеченова
ГБОУ ВПО Первый МГМУ им. И.М. Сеченова, Университетская клиническая больница №1, Клиника аортальной и сердечно-сосудистой хирургии, Москва
Отделение сосудистой хирургии Университетской клинической больницы №1 Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва
отделение лучевой диагностики Университетской клинической больницы №1 ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова», Москва, Россия
Двусторонняя видеоэндоскопическая поясничная симпатэктомия при хронической ишемии нижних конечностей
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2015;(8): 70‑73
Хронические облитерирующие заболевания артерий нижних конечностей составляют до 20% среди всех видов сердечно-сосудистых заболеваний и встречаются в 2-3% общей численности населения. Число этих больных увеличивается с возрастом и к шестому-седьмому десятилетию жизни распространенность составляет уже 5-7% [3, 6, 9, 13, 17]. Особенностями этих заболеваний являются тенденция к неуклонному прогрессированию патологического процесса, сохранение высоких показателей инвалидизации, числа ампутаций и летальности. По статистическим данным, приводимым в Европейских совместных документах, критическая ишемия нижних конечностей встречается у 500-1000 пациентов на 1 000 000 населения в год [24, 26, 27, 29]. В США ежегодно госпитализируется более 400 тыс. больных с облитерирующими заболеваниями периферических артерий. При этом выполняется 50 тыс. ангиопластик, 110 тыс. шунтирующих операций и 69 тыс. ампутаций стоп и конечностей в год [26]. Лечебный прогноз у большинства пациентов с хронической ишемией конечностей неутешительный. В течение первого года с момента установления диагноза 25% больных нуждаются в высокой ампутации конечности. Летальный исход непосредственно после ампутации ниже коленного сустава наступает в 5-15% наблюдений, при ампутации выше щели коленного сустава летальность увеличивается до 11-39%. Через 1 год после ампутации бедра выживают 76% больных, через 3 года - 51-56%, через 5 лет 34-36%, к 10-му году умирают практически все [20, 21]. Неудовлетворенность большим числом тромботических осложнений, невозможность выполнения реконструктивных операций из-за наличия сопутствующих заболеваний (гипертоническая болезнь до 90%, поражение сосудов сердца в 50-70%, головного мозга в 38% наблюдений) и большое число ампутаций конечностей при лечении окклюзии дистального артериального русла заставляют хирургов искать более адекватные и эффективные методы реваскуляризации [1, 2, 8].
В настоящее время не существует каких-либо медикаментозных методов лечения, позволяющих восстановить магистральный кровоток у больных с облитерирующими заболеваниями. Вся проводимая консервативная терапия (медикаментозная, баротерапия, физиотерапия) направлена на стимуляцию коллатерального кровообращения в пораженной конечности. Длительность эффекта консервативных методов лечения ограничена сроком их применения с относительно небольшим периодом последействия.
Разработка нестандартных методов реваскуляризации (артериализации венозного русла, трансплантации большого сальника, компактной остеотомии) способствовали улучшению результатов лечения облитерирующих заболеваний [5, 10-12, 14, 18, 23, 25, 28]. Однако при наличии ограниченного некроза и гангрены, сопровождающихся воспалительными изменениями в виде лимфангита, лимфаденита и тромбофлебита, указанные оперативные вмешательства не только неприемлемы, но и опасны из-за возможности тяжелых последствий. Частота послеоперационных тромботических и инфекционных осложнений и неудачных исходов при этом доходит до 28%, а ампутации - до 16-22% [18, 23, 25, 28]. Кроме того, травматичность и продолжительность операции, связанные с лапаротомией, подготовкой и реверсией вен, сопряжены с большим риском побочных осложнений у этой категории ослабленных и истощенных больных. На исключительную ценность симпатэктомии при облитерирующих заболеваниях как наиболее эффективный метод стимулирования коллатерального кровообращения при дистальных формах поражения сосудов конечностей указывают многие авторы [7, 15, 16, 19, 22]. Вместе с тем для повышения эффективности реваскуляризирующих операций важно параллельное воздействие на патогенетическое звено заболевания, которое достигается путем сочетания ганглиэктомии с другими оперативными и консервативными мерами [4].
Представляем наблюдение успешного хирургического лечения артериальной ишемии нижних конечностей при дистальном типе поражения методом лапароскопической ретроперитонеальной одномоментной двусторонней поясничной симпатэктомии (заявка на приоритет № 2014153537/085562 от 29.12.14).
Больной Б., 64 лет, поступил в клинику аортальной и сердечно-сосудистой хирургии УКБ №1 Первого МГМУ им. И.М. Сеченова с диагнозом: облитерирующий атеросклероз артерий нижних конечностей, гемодинамически значимые стенозы обеих поверхностных бедренных артерий. Дистальный тип поражения артерий голени. Хроническая ишемия нижних конечностей III стадии. Гипертоническая болезнь II стадии, III степени, риск 4.
Больной предъявлял жалобы на боли в нижних конечностях при прохождении расстояния до 50 м.
Из анамнеза известно, что считает себя больным около
10 лет, когда впервые стали беспокоить боли в ногах при ходьбе, преимущественно в голенях. С течением времени дальность безболевой ходьбы сокращалась. Находился на лечении в клинике суставной боли по поводу травмы коленного сустава, обратился в УКБ №1, где при дообследовании выявлено многососудистое атеросклеротическое дистальное поражение артерий нижних конечностей.
При мультиспиральной компьютерной томографии аорты и артерий нижних конечностей с контрастированием выявлены значимые стенозы обеих поверхностных бедренных артерий, дистальное поражение артерий голени. При ЭКГ и холтеровском мониторировании ЭКГ обнаружены признаки гипертрофии левого желудочка с изменением миокарда, суправентрикулярная экстрасистолия. При исследовании функции внешнего дыхания регистрировались нарушения вентиляции легких по рестриктивному типу.
Учитывая гемодинамически значимые стенозы обеих поверхностных бедренных артерий в сочетании с дистальным поражением артерий голени и развитием хронической ишемии нижних конечностей III стадии, недостаточную эффективность проводимой вазоактивной консервативной терапии, курса гипербарической оксигенации, бесперспективность реконструктивной операции, пациенту выполнили оперативное лечение в объеме двусторонней видеоэндоскопической поясничной симпатэктомии.
Пациент был уложен на операционном столе с опущенными головной и ножной секциями в положении на правом боку с наклоном назад под углом примерно 60° к плоскости стола и с валиком под поясничной областью (рис. 1 ).
Найдена исходная точка доступа на задней подмышечной линии в середине ее отрезка, ограниченного XII ребром и гребнем подвздошной кости, и в этой точке в забрюшинную клетчатку вертикально сверху вниз сквозь наружную и внутреннюю косые и поперечную мышцы живота введена игла Вереша, через которую подан углекислый газ в объеме 1700 мл под давлением 12-13 мм рт.ст., и создан ретропневмоперитонеум. В той же точке после удаления иглы Вереша установлен 10-миллиметровый троакар и введен лапароскоп со скошенной 10-миллиметровой оптикой. После этого выполнены проколы в выбранных точках ввода манипуляторов, расположенных на концах отрезка средней подмышечной линии, ограниченного краем XII ребра и гребнем подвздошной кости, на расстоянии 2 см от каждого из его концов (рис. 2 ). В каждый прокол установлен 5-миллиметровый троакар и через один из троакаров введен лапароскопический диссектор, через другой - лапароскопический электрокоагулятор (см. рис. 2 ).
Сформировано рабочее пространство в границах, определяемых сверху брюшиной, предбрюшинной клетчаткой, мочеточником и инфраренальным отделом аорты, сзади квадратной мышцей поясницы и большой поясничной мышцей, с боковых сторон слева гребнем подвздошной кости и подвздошной мышцей, справа почкой и паранефральной клетчаткой. Выделен тупым путем участок симпатического ствола, содержащий 2, 3 и 4-й ганглий (рис. 3 ). Ствол с ганглиями пересечен, коагулирован на протяжении 2 см, выполнен гемостаз, удалены инструменты.
Далее в положении на левом боку проведена аналогичная описанной выше операция, рабочее пространство которой было ограничено сверху брюшиной, предбрюшинной клетчаткой, мочеточником и нижней полой веной, сзади квадратной мышцей поясницы и большой поясничной мышцей, с боковых сторон слева почкой и паранефральной клетчаткой, справа гребнем подвздошной кости и подвздошной мышцей (см. рис. 3 ). Длительность двусторонней операции 15 мин. Кровопотеря 10 мл.
По окончании операции пациент экстубирован в операционной, переведен в отделение, где проводилась плановая послеоперационная терапия, ранняя активизация. Явления ишемии нижних конечностей уменьшились, увеличилась дистанция безболевой ходьбы, нижние конечности на ощупь стали теплыми, болевой синдром купирован. Послеоперационный период протекал без осложнений, больной выписан на 3-и сутки под наблюдение поликлиники по месту жительства.
Видеоэндоскопическая поясничная симпатэктомия внедрена нами в 1998 г. С этого времени выполнено 250 оперативных вмешательств, в том числе двусторонняя видеоэндоскопическая поясничная симпатэктомия произведена у 95 пациентов. Осложнений и летальных исходов не было.
Таким образом, мы считаем, что больные с облитерирующими поражениями дистального артериального русла должны рассматриваться как отдельная группа, требующая комплексного подхода в лечении. Симпатэктомия в изолированном виде при начальных стадиях заболевания, устраняя спастический компонент заболевания, замедляет прогрессирование ишемического процесса. Применение видеоэндоскопической техники при проведении симпатэктомии значительно уменьшает травматичность и продолжительность операции, позволяет избежать послеоперационных осложнений, способствует сокращению послеоперационного периода и раннему восстановлению пациента.
Оперативное вмешательство, которое носит название симпатэктомия, включает клипирование либо рассечение симпатического нерва с целью предотвращения спазма артерии. Основное показание к операции - облитерирующее заболевание артерий ног.
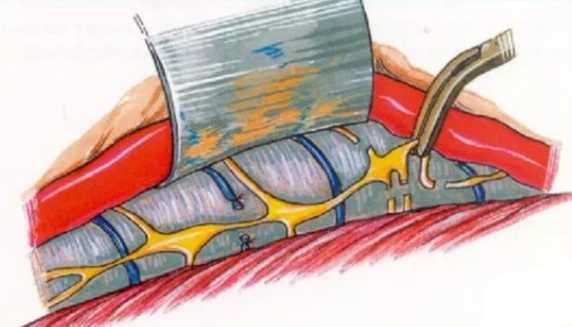
Симпатэктомия: подготовка к операции
- Накануне операции следует отказаться от курения и употребления алкоголя. Соблюдается обезжиренная диета.
- Если пациент перенес тромбоз кровеносных сосудов, потребуется пройти УЗИ вен нижних конечностей.
- С утра в день операции нельзя есть и пить.
Симпактэтомия: методы проведения
Оперативное вмешательство бывает 4-х видов:
- При тотальной операции иссекается пограничный симпатический ствол.
- При трункулярной симпатэктомии хирург проводит резекцию пограничного ствола между ганглиями.
- Симпатический узел удаляется при ганглиэктомии.
- Периартериальная симпатэктомия подразумевает резекцию оболочки стенки артерии.
Вмешательство хирурга проводится под наркозом. При поясничной симпатэктомии врач делает 3 прокола на стенке живота. Симпатический ствол обнаруживают с помощью инструмента эндоскопа, оснащенного видеокамерой. Ствол отделяют от окружающей ткани и иссекают. На рану накладывается шов.
При малоинвазивной операции нервные волокна разрушаются путем электрического воздействия на симпатический ствол. Оперативное вмешательство длится около 1 часа и не оставляет видимых шрамов.
Противопоказания
Вмешательство не проводится при:
- выраженной сердечной недостаточности;
- болезнях легких;
- туберкулезе;
- тяжелых формах сопутствующих заболеваний.
Медицинский прогноз
Восстановительный период требует от пациента соблюдения всех врачебных предписаний. Пациенту запрещается подъем тяжестей. С целью реабилитации назначается определенная поддерживающая терапия.
Симпатэктомия разрушает нервные волокна симпатического ствола. В итоге спадает отек, прекращаются боли и дискомфорт, заживают трофические язвы. Операция помогает облегчить симптомы болезни Рейно, болезни Бюргера, купирует гипергидроз подмышек и ладоней.
Медицинский прогноз в большинстве случаев благоприятный. Операция не вызывает осложнения.
Смотрите также:
О возможных противопоказаниях проконсультируйтесь с нашими специалистами.
Информация на сайте не является публичной офертой.
Хабаровск
ул. Тихоокеанская, д. 171 В/1
Наш специалист позвонит Вам в ближайшее время.
Отправляя заявку, Вы даете согласие на сбор и обработку персональных данных. Политика конфиденциальности.
Мы используем куки для наилучшего представления нашего сайта. Если Вы продолжите использовать сайт, мы будем считать что Вас это устраивает. Политика конфиденциальности Ok
Малоинвазивные методы в лечении боли

В лечении болевых синдромов наряду с фармакотерапией используются малоинвазивные способы. К ним относят нейромодуляцию и лечебно-медикаментозные блокады. Оптимальность мультидисциплинарного подхода в терапии хронической боли не подлежит сомнению, но вместе с тем очевидно, что каждый из указанных методов в определенных случаях может оказаться важным и результативным способом лечения.
Проведение малоинвазивных процедур требует определенного оснащения и специфических навыков, в связи с чем уступает по доступности фармако-терапевтическому подходу, но знать о терапевтических возможностях этих методик, их потенциальных преимуществах и вероятных осложнениях должны как узкие специалисты, так и врачи общей практики, так или иначе связанные с лечением пациентов, страдающих острой и хронической болью.
Хирургическая нейромодуляция представлена методами лечения, основанными на электрическом или медиаторном воздействии на структуры нервной системы. Ее подразделяют на нейростимуляцию и длительное эпидуральное или интратекальное введение лекарственных средств.
Нейростимуляции лучше поддается боль, имеющая нейрогенную природу. Для лечения ноцигенной боли более действенным оказывается эпидуральное или интратекальное введение опиоидных анальгетиков. Каждый из этих методов имеет теоретическое обоснование.
Эпидуральное применение опиоидов
Существенный прогресс в понимании механизма анальгетического действия опиоидов произошел в начале 70-х годов ХХ столетия. Вначале был выделен класс высоко специфичных опиоидных рецепторов, а затем обнаружена высокая плотность нахождения этих рецепторов в местах межсинаптической передачи в спинном и головном мозге. В экспериментах на животных была подтверждена возможность обеспечения селективной анальгезии после введения морфина в субарахноидальное пространство.
На рубеже 70-80-х годов прошлого столетия начались клинические исследования эффективности подоболочечного (субарахноидального) и эпидурального использования морфина для купирования боли у пациентов с прогрессирующим раком, сопровождающимся трудно купируемым болевым синдромом.
Подведение опиоидов к спинномозговым структурам, контролирующим проведение сигналов от периферии в головной мозг, позволяет существенно увеличить их концентрацию в рецепторной зоне, поэтому эффект анальгезии достигается использованием малого количества наркотического анальгетика. Рандомизированные клинические исследования показали преимущество такого способа перед традиционным парентеральным введением максимальных доз опиоидов как по выраженности обезболивания, так и по частоте развития побочных эффектов.
Первоначально к выведенному через кожу концу эпидурального катетера присоединялся бак фильтр с целью снижения частоты инфекционных осложнений. Катетер крепили к коже с помощью прозрачного пластыря. Эффективное функционирование такой системы составляло от 1 недели до 2-3 месяцев. Одним из лимитирующих факторов их использования являлся риск развития инфекции и близость входных ворот (места пункции) к эпидуральному пространству (4-5 см). Поэтому начали использовать методики подкожной туннелизации катетера, что удлиняло реальные сроки относительно безопасной его эксплуатации до нескольких месяцев.
При высокой эффективности анальгезии и существенном уменьшении суточной дозы морфина (по сравнению с подкожными инъекциями) выявился существенный недостаток: методика введения морфина требовала участия в процедуре медработника или самого пациента. Поэтому со временем стали использоваться полностью имплантируемые системы с помпой и подкожным портом, доступ к которому для «дозаправки» осуществлялся с помощью чрескожной иглы.
Субарахноидальное введение опиоидов
Следующим шагом в совершенствовании методики явилась установка катетера в субарахноидальное пространство: расход морфина для получения желаемого эффекта обезболивания сокращался на порядок — суточная доза морфина снижалась до 1 мг. Внедрение такого способа обезболивания подразумевало не только использование микрокатетеров, но и специальных устройств-дозаторов (помп) — резервуаров с активным веществом с постоянным или регулируемым режимами введения препарата. В этом случае скорость введения обеспечивается при помощи специального радиопередатчика — программатора.
Как и в случае использования подобных эпидурально устанавливаемых систем, помпа и катетер полностью имплантируются под кожу (помпа — обычно на уровне передней поверхности грудной клетки на уровне 12-го ребра). Заправка такой системы анальгетиком производится раз в несколько недель и сводит к минимуму участие пациента.
Хроническая стимуляция спинного мозга
Наиболее распространенной формой нейростимуляции (существует электростимуляция периферических нервов, задних столбов спинного мозга, глубоких структур и коры головного мозга) является хроническая стимуляция спинного мозга.
Объяснить получаемый при помощи такой методики анальгетический эффект можно при помощи теории «воротного контроля», предложенной П. Уоллом и Р. Мелзаком в 1965 году. Авторы предположили, что в спинном мозге на уровне 2-го нейрона через вставочные интернейроны желатинозной субстанции осуществляется подавление ноцигенной информации, приходящей с периферии. Модуляторами этого «болевого» потока выступают антиноцицептивная система и поступающая к тому же нейрону сенсорная «неболевая» информация.
Таким образом, легкое потирание поврежденного участка или электрическая стимуляция нервов и задних колонн «закрывают ворота» для ноцигенного стимула. Ввиду низкой силы генерируемых импульсов, повреждения нервных структур не происходит, формируемые ощущения в виде тепла или легкой вибрации не приносят беспокойства пациенту, но их вполне достаточно, чтобы блокировать ощущение боли. При этом происходит не только конкурентное подавление восходящей ноцицептивной информации, но и стимуляция антиноцицептивных механизмов, значительно подавленных при хроническом болевом синдроме. Таким образом, происходит восстановление баланса между болевой и противоболевой активностью, клинически проявляющегося купированием или значительным ослаблением боли.
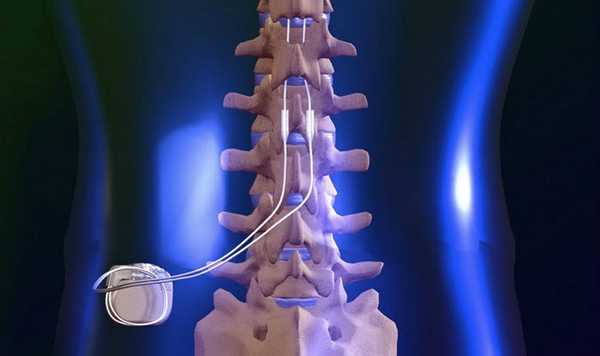
Схема имплантируемого под кожей устройства похожа на описанную выше катетерную эпидуральную методику обезболивания при помощи помпового механизма, только вместо катетера используются специальные электроды, а вместо помпы с лекарственным веществом — программируемый генератор. Развитие технологий привело к созданию тонких электродов, программируемых нейростимуляторов, возможности полностью имплантировать системы и осуществлять их настройку с помощью программатора. Методика показала высокую эффективность в лечении периферической нейропатической боли. Важным сдерживающим фактором ее широкого применения у пациентов с рефрактерными болевыми синдромами является достаточно высокая стоимость.
Блокады нервных стволов
Одним из важных методов лечения болевых синдромов являются блокады нервных стволов, сплетений, ганглионарных структур. Далеко не каждое инъекционное воздействие следует считать медикаментозной блокадой. Блокада — это малоинвазивное высокоселективное воздействие на определенные структуры, генерирующие или транслирующие события, воспринимаемые как локализованная боль. Для ее успешного проведения специалист должен обладать не только базовыми знаниями по патологии, которую собирается лечить, но и хорошо представлять топографическую анатомию области манипуляции, фармакологию средств, которыми предполагает работать, а также прогнозировать возможные осложнения (порой довольно драматичные) и в случае их развития использовать приемы интенсивной терапии и жизнеобеспечения.
В настоящее время с целью купирования болевых синдромов преимущественно применяются паравертебральные, эпидуральные, внутри суставные и внутрикостные блокады. Необходимо понимать, что эффективность лечебных блокад основана не на временном выключении ноцицепторов с помощью местного анестетика, а на прерывании болевой импульсации, которая поддерживает нейрональную гиперактивность.
Блокады бывают двух типов: диагностические и лечебные. Цель диагностической блокады — уточнение локализации источника боли и определение предполагаемой эффективности процедуры. Терапевтическая блокада — по возможности должна быть этиопатогенетической.
Нередко для усиления действия местного анестетика используют комбинацию лекарственных препаратов с противовоспалительным действием. Бывают ситуации, когда для эффективной анальгезии может потребоваться стойкое выключение нейрональной структуры посредством подведения раствора нейролептика или проведения радиочастотной абляции. В качестве примера остановимся на некоторых вариантах блокад. Одной из важнейших медико-социальных проблем является боль в спине — наиболее распространенная причина ограничения физической активности у лиц молодого и среднего возраста. Среди причинных факторов ведущее значение имеют поражение фасеточных суставов и радикулопатии.
Селективные блокады корешков спинномозговых нервов
Основным показанием для селективной корешковой блокады является радикулопатия. При этом клиническая картина болевого синдрома не всегда позволяет четко определить локализацию поражения, а существующие методы визуальной диагностики (МРТ, КТ) могут выявить многоуровневый характер поражения. Для невролога, выбирающего фармакотерапию, возможно, точность локализации генератора боли не повлияет на лечебную тактику. Но для специалиста, проводящего лечебно-медикаментозную блокаду, а тем более собирающегося проводить оперативное лечение, безошибочное определение «мишени», т.е. очага поражения, имеет первостепенное значение.
Поэтому в затруднительных ситуациях первоначально осуществляется диагностическая блокада местным анестетиком. Эта процедура, заключающаяся в высокоточном подведении малого количества местного анестетика к «подозрительному» корешку (предпочтительно в условиях лучевой или ультразвуковой визуализации), позволяет селективно блокировать его.
Блокада фасеточных (дугоотросчатых) суставов
Кому не знакомы схваткообразные боли в поясничной области, иррадиирующие в ягодицы и бедра, усиливающиеся при длительном сидении, при наклонах, разгибании и ротации туловища, чувство скованности в пояснице, уменьшающееся при ходьбе?
Так характеризуются ощущения при патологии парных дугоотросчатых суставов, образованных суставными отростками соседних позвонков. В структуре боли в спине данная патология достигает 50%. Внутрисуставная инъекция малого количества местного анестетика (объем сустава — 0,5-1,0 мл) или блокада медиальной ветви задней порции спинномозгового нерва на уровне поражения и сегментом выше — основная диагностическая процедура при патологии фасеточного сустава. Стойкий эффект возможен при острой ситуации — люмбаго.
В случаях хронической люмбалгии часто эффект ограничен длительностью действия анестетика. Добавление к смеси глюкокортикоида (0,5 мл) может существенно удлинить аналгезию, однако стойкое улучшение состояния может быть достигнуто при помощи радиочастотной абляции медиальной ветви.
Манипуляции должны выполняться под рентген контролем. Осложнения могут включать разрыв сустава, непреднамеренную корешковую блокаду, случайное интратекальное введение, неврит при проведении абляции.
Симпатические блокады
Среди лечебно-медикаментозных блокад, используемых в лечении болевых синдромов, особое место занимают симпатические блокады, прерывающие симпатические эфферентные влияния, играющие важную роль в патогенезе ряда заболеваний (плексопатиях, КРБС, постгерпетической невралгии, сосудистых поражениях, висцеральных болевых синдромах). В своей практике врачи анестезиологи-реаниматологи нередко используют преимущества симпатического блока для устранения, например, послеоперационного пареза кишечника, устанавливая для обезболивания катетер в эпидуральное пространство. К сожалению, возникающий в таких ситуациях блок неселективен, поскольку вместе с симпатическими волокнами выключаются и сенсорные нервы.
Изолированные симпатические блокады имеют четкие показания:
- Заболевания внутренних органов. Не случайно вегетативную нервную систему раньше называли висцеральной: по сути, висцеральные волокна, ответственные за афферентацию, имеют тесную анатомическую связь с симпатическими структурами — чревным, верхним подчревным сплетением, спланхническими нервами, ганглиями симпатической цепочки. Блокада (временная или стойкая) этих образований способна прервать болевой поток от внутренних органов.
- Ишемические поражения конечностей. Способность симпатических волокон участвовать в регуляции тонуса периферических сосудов с успехом используется при лечении ряда заболеваний (синдром и болезнь Рейно, облитерирующий эндартериит, атеросклероз, ангиопатии при сахарном диабете). Симпатическая блокада в таких случаях способна улучшить периферический кровоток, уменьшить трофические нарушения и существенно уменьшить болевые ощущения в конечностях.
- Симпатически поддерживаемая боль.
В многопрофильной международной клинике Медика24 принимают пациентов любой степени тяжести, в том числе с онкологическими диагнозами III и IV стадий. Инкурабельным пациентам наши врачи могут помочь паллиативным лечением, направленным на продление качественной жизни пациента. Паллиативное лечение включает в себя не только уход за пациентом, но и проведение оперативных вмешательств с целью снятия болезненных симптомов. В частности, в клинике проводят: циторедуктивные операции, радиочастотную аблацию метастатического поражения печени и костей, фотодинамическую терапию, стентирование при стенозах внутренних органов, гастростомия, колостомию и др.
Литература:
- Браун Д.Л. Атлас регионарной анестезии / Пер. с англ.под ред. акад. В.К. Гостищева. М., 2009.
- Ван Роенн Д.Х., Пэйс Д.А., Преодер М.И. Диагностика и лечение боли / Пер. с англ. под ред. проф. М.Л. Кукушкина. М., 2012.
- Каннер Р.М. Секреты лечения боли / Пер. с англ. под ред. проф. А.М. Овечкина. М., 2006.
- Benzon H.T. Complications associated with neurolytic blocks // Complications in regional anesthesia and painmedicine. / Eds. J.M. Neal, J.P. Rathmell. Philadelphia:Saunders Elsevier. 2007. P. 273-286.
Источник: Научно-практический журнал «Паллиативная медицина и реабилитация» № 2. 2018.
Читайте также:
