Строение канала транслокации белков из ЭПР
Добавил пользователь Алексей Ф. Обновлено: 16.01.2026
Почти все белки образуются на рибосомах, расположенных в цитозоле. Белки, принадлежащие первой транспортной ветви, после завершения их синтеза выделяются в цитозоль. Некоторые из них содержат сигналы сортировки, направляющие их из цитозоля в митохондрии, ядро или пероксисомы, другие же - их большинство - не имеют специфических сигналов сортировки и остаются в цитозоле в качестве постоянных компонентов.
Второй путь транспорта используется для направления белков в эндоплазматический ретикулум для выведения белков из клетки, а также белков, направляемых в аппарат Гольджи, к плазматической мембране или в лизосомы. Все эти белки по мере их образования переносятся в эндоплазматический ретикулум при помощи сигналов сортировки, расположенных обычно на N-конце. Рибосомы, на которых собираются такие белки, остаются связанные с мембраной эндоплазматического ретикулума в течение недолгого времени после начала синтеза полипептидной цепи. Как только очередной участок полипептидной цепи синтезируется, он проникает через липидный бислой этой мембраны. Некоторые белки затем попадают в просвет эндоплазматического ретикулума, другие остаются частично заключенными в мембрану в качестве трансмембранных белков.
Полагают, что на белках существуют два вида сигналов сортировки, направляющие их, шаг за шагом, вдоль разветвляющихся путей. Для некоторых стадий сигналы сортировки представляют собой протяженный участок аминокислотной последовательности длиной 15-60 остатков (табл. 1). Когда эта стадия пройдена, такой сигнальный пептид отрезается. Сигналом сортировки для других стадий, вероятно, служит определенная трехмерная структура, образуемая атомами поверхности белка при свертывании его молекулы. Аминокислотные остатки, формирующие такие сигнальные участки, могут быть расположены очень далеко друг от друга в линейной последовательности белка.
Сигнальные пептиды направляют белки из цитозоля в эндоплазматический ретикулум, митохондрии, хлоропласты и ядро; они также отвечают за то, чтобы некоторые белки остались в эндоплазматическом ретикулуме. Сигнальные участки, видимо, играют важную роль при распознавании определенных лизосомных белков специальным ферментом в аппарате Гольджи.
Чтобы выяснить пункт назначения того или иного белка внутри клетки, необходимо определить тип его сигнального пептида (табл. 1). Белки, которые должны попасть в эндоплазматический ретикулум, обычно несут N-концевой сигнальный пептид. Его центральная часть образована 5-10 гидрофобными аминокислотными остатками. Большинство этих белков направляется из эндоплазматического ретикулума в аппарат Гольджи; те же, которые имеют на С-конце специфическую последовательность из четырех аминокислот, остаются в качестве постоянных компонентов. Многие белки, предназначенные для митохондрий, имеют сигнальные пептиды, в которых положительно заряженные аминокислотные остатки чередуются с гидрофобными. Среди белков, направляющихся в ядро, большинство имеет сигнальные пептиды, в которых положительно заряженные аминокислотные остатки чередуются с гидрофобными. Среди белков, направляющихся в ядро, большинство имеет сигнальные пептиды, образованные кластером положительно заряженных аминокислотных остатков. Наконец, некоторым белкам цитозоля присущи сигнальные пептиды, с которыми ковалентно связывается жирная кислота, направляющая эти белки к мембранам без проникновения в эндоплазматический ретикулум.
Табл. 1. Последовательности сигнальных пептидов.
| Функция сигнального пептида | Пример сигнального пептида |
| Импорт в ЭР | H3N-Met-Met-Ser-Phe-Val-Ser-Leu-Leu-Leu-Val Glu-Ile-Leu-Phe-Trp-Ala-Thr-Glu-Ala-Glu- Gln-Leu-Thr-Lys-Cys-Glu-Val-Phe-Gln |
| Оставление в просвете ЭР | -Lys-Asp-Glu-Leu-COO |
| Импорт в митохондрии | H3N-Met-Leu-Ser-Leu-Arg-Gln-Ser-Ile-Arg-Phe- Phe-Lys-Pro-Ala-Thr-Arg-Thr-Leu-Cys-Ser- Ser-Arg-Leu-Leu- |
| Импорт в ядро | -Pro-Pro-Lys-Lys-Lys-Arg-Lys-Val |
| Присоединение к мембране путем ковалентного связывания миристиновой кислоты с N-концом | H3N-Gly-Ser-Ser-Lys-Ser-Lys-Pro-Lys- |
H3N обозначает N-конец белка;_ COO обозначает карбоксильный конец.
2. Гранулярный эндоплазматический ретикулум.
В клетках млекопитающих импорт белков в эндоплазматический ретикулум (ЭПР) начинается еще до того, как полипептидная цепь полностью синтезирована, т. е. он происходит одновременно с трансляцией (котрансляционно).
Таким образом, в цитоплазме имеется две пространственно изолированные популяции рибосом. Одни из них (рибосомы, связанные с мембраной), расположены на обращенной к цитоплазме поверхности мембраны ЭПР и заняты синтезом белков, которые сразу же переносятся внутрь ЭПР. Другие (рибосомы свободные) не прикреплены ни к какой мембране и производят все остальные белки, кодируемые ядром. Связанные и свободные рибосомы идентичны по строению и функции. Они различаются только по белкам, которые синтезируются на них в каждый данный момент. Если рибосоме достается синтез белка с сигнальным пептидом для ЭПР, то такой сигнал направляет рибосому к мембране эндоплазматический ретикулум.
2.1. Контрансляционный транспорт.
Следует обратить внимание на функции SRP (signal-recognition particle):
— узнавание сигнальной последовательности (SS - signal sequence),
SRP - 11S рибонуклеопротеид, состоящий из 7S РНК и 6 белков, которые называются по их массе: 9, 14, 68, 72, 54, 19 кДа. Некоторые из них входят в состав SRP в виде димеров, другие - в виде мономеров. Если удалить белок 54 кДА, то не происходит узнавание SS, то есть SRP инактивируется. 7S-РНК относится к малой плазматической РНК.
SRP плотно захватывает рибосому, присоединясь и к сигнальному пептиду (как только он появляется на большой субъединице рибосомы), и к рибосомному участку связывания аминоацил-тРНК. В результате трансляция останавливается, так как блокируется связывание следующей аминоацил-тРНК с рибосомой.
Пауза в трансляции длится до тех пор, пока захватившая рибосому частица не свяжется с SRP-рецептором, находящимся на цитоплазматической стороне гранулярного ЭПР. SRP-рецептор - это интегральный белок, состоящий из 2 частей: SR(α) и SR(β). SR(α) - поверхностный мембранный белок, с которым связывается SR(β) - интегральный белок мембраны ЭПР. При взаимодействии SRP-рецептора с SRP частица меняет свое положение и трансляция возобновляется. Иногда SRP-рецептор называют «причальным» белком.
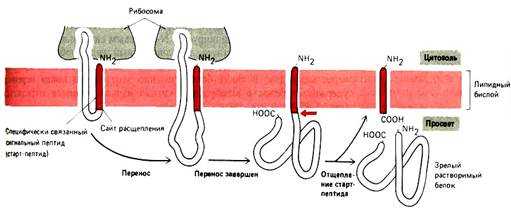
1. Полипептидная цепь (ППЦ) растет в полость канала. Гидрофобный сигнальный пептид (SS) служит сигналом начала переноса и остается погруженным в мембрану все то время, пока остальная часть молекулы белка протискивается через нее в виде большой петли. Когда через мембрану проходит С-конец ППЦ, белок остается связанным с мембраной только при помощи SS. Если SS подвергается действию сигнальной пептидазы, которая связана с мембраной ЭПР, то белок высвобождается в полость ЭПР.
2.В синтезируемой ППЦ существует так называемая стоп-последовательность (STS - stop transport signal). STS состоит приблизительно из 20-25 аминокислот, преимущественно гидрофобных. Белок в области STS остается связанным в мембране, в результате С-конец обращен в цитоплазму, а N-конец и основная часть ППЦ - в люмен ЭПР. В результате, по окончании трансляции, образуется интегральный белок типа I.
3. SS не обязательно должна отделиться от ППЦ. Само по себе присутствие сигнальной последовательности еще не достаточно для работы сигнальной пептидазы. SS не содержит участка для связывания с сигнальной пептидазой. В таких белках существует последовательность USP (uncleaved signal peptid; такая последовательность находится на N-конце белка. В результате такая SS закрепляется в мембране; при этом N-конец обращен в цитоплазму, а С-конец и основная часть ППЦ - в люмен ЭПР. В результате, по окончании трансляции, образуется интегральный белок типа II.
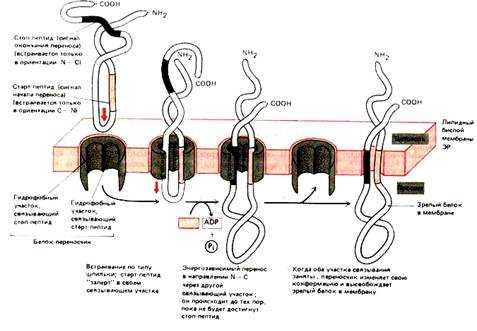
4. При образовании некоторых белков участвует как USP (то есть сигнальная последовательность не отрезается), так и STS. ППЦ имеет USP. По ходу роста ППЦ появляется STS. Белок выходит из канала, рибосома вынуждена сойти. В результате N- и С-концы направлены в цитоплазму, а основная часть цепи расположена в люмене ЭПР.
5. Образование политопных (то есть закрепленных в мембране несколько раз) белков. Процесс формирования ППЦ начинается как в п.4. Отличие состоит в том, что политопные белки имеют несколько STS. Сигнальная последовательность также не отрезается.
Перенесенные в полость белки сворачиваются. В полости ЭПР содержится большое количество связывающего белка BiP (binding protein), который, по-видимому, узнает неправильно свернутые белки, связываясь с их наружными гидрофобными участками. В норме при сворачивании белок имеет гидрофобную сердцевину, но пока не произошло (или произошло неправильно) сворачивание белок обращает свои гидрофобные остатки наружу. BiP узнает неправильно свернутые белки, связываясь с их наружными гидрофобными участками. На карбоксильном конце молекулы BiP имеется сигнальный пептид из четырех аминокислот, благодаря которому белок остается в ЭПР. Существует гипотеза, согласно которой BiP способствует тому, что неправильно свернутые белки остаются в ЭПР (и, следовательно, не попадают в аппарат Гольджи). Возможно, также, что BiP является одним из катализаторов сворачивания белков. Показано, что этот белок связывает АТР и структурно родствен белкам теплового шока, которые участвуют в импорте белков.
В цитозоле содержится смесь восстанавливающих агентов, содержащих SH-группы; эти вещества предотвращают образование S-S-мостиков. В полости ЭПР таких восстанавливающих агентов мало, и поэтому S-S-мостики там образуются. При обилии белков этот процесс, по-видимому, идет неправильно. В полости ЭПР существует фермент, помогающий исправлять такие ошибки, - дисульфидизомераза. Этот фермент имеет тот же сигнал удержания в ЭПР, что и BiP. Механизм действия дисульфидизомеразы состоит в том, что разрезая S-S- связи, она дает белку возможность быстро поменять множество информаций, пока не будет достигнута конформация с наименьшей общей свободной энергией. На этом этапе вновь синтезированный белок сворачивается правильно. Правильная конформация может быть выбрана и случайно, но дисульфидизомераза значительно ускоряет процесс поиска.
Большинство белков в ЭПР, прежде чем попасть в аппарат Гольджи и далее, становятся гликопротеинами, то есть к белкам присоединяются сахара.
N -гликозилирование. Почти тотчас после того, как ППЦ попала в просвет ЭПР, она гликозилируется. Сначала присоединяется всего лишь один олигосахарид, состоящий из 2 молекул N-ацтелгликозамина, 9 молекул маннозы и 3 молекул глюкозы. Этот олигосахарид всегда присоединяется к NH2-группе боковой цепи остатка аспарагина. Присоединение катализируется ферментом гликозилтрансферазой; этот фермент связан с мембраной ЭПР, и его активный центр обращен в полость ЭПР. Сигналами для N-гликозилирования служат 2 последовательности: Asn-X-Ser и Asn-X-Thr (где X- любая аминокислота, кроме пролина). Один такой олигосахарид удерживается в мембране ЭПР молекулой специального липида - долихола. Олигосахарид связан с долихолом высокоэнергетической фосфатной связью, обеспечивающей энергию активации для гликозилирования.
Все разнообразие N-связанных олигосахаридных структур возникает в результате модификаций молекулы исходного предшественника. Еще в ЭПР у большинства гликопротеинов отщепляется 3 остатка глюкозы и один остаток маннозы. Дальнейшая «доделка» олигосахарида продолжается в аппарате Гольджи.
Транспорт фосфолипидов из ЭПР в органеллы.
ПМ, мембрана АГ и мембрана лизосом - это части мембранной системы, связанной с ЭПР. Митохондрии и пероксисомы не принадлежат к этой системе и нуждаются в других механизмах для импорта белков и липидов мембран. Специальные водорастворимые белки - переносчики фосфолипидов обладают способностью переносить индивидуальные молекулы фосфолипидов от одной мембраны к другой. Предполагают, что таким образом переносится в митохондрии фосфатидилсерин, затем он декарбоксилируется, образуя фосфатидилэтаноламин; фосфатидилхолин, по всей вероятности, импортируется в виде интактной молекулы. Белки-переносчики распределяют фосфолипиды между органеллами случайным образом.
3.1. Цитохром р450.
На первой фазе биотрансформации (эффективный механизм инактивации и выведения чужеродных веществ; биотрансформация происходит главным образом в печени) менее реакционноспособные соединения подвергаются ферментативному гидроксилированию. Такая модификация делает возможной последующую конъюгацию с полярным веществом. Вообще гидроксилирующие ферменты являются монооксигеназами, включающими в качестве кофермента (это вспомогательные соединения, которые выполняют функцию промежуточных переносчиков атомов или функциональных групп) железосодержащий гем. Восстановленная форма гема связывает оксид углерода (СО) и приобретает характерное поглощение света при 450 нм. Поэтому такая группа ферментов носит название цитохромы Р450 (цитР450).
ЦитР450-зависимые монооксигеназы катализируют расщепление веществ разного типа с участием НАДФН и молекулярного кислорода (О2). При этом один атом кислорода присоединяется к субстрату, а второй освобождается в составе молекулы воды. В реакции принимает участие флавопротеин, выполняющий функцию переносчика восстановительного эквивалента с кофермента НАДФН + Н + на собственно монооксигеназу, которая переносит электроны на молекулярный кислород.
В печени, а также в железах, продуцирующих стероидные гормоны, и в других органах встречаются разные формы фермента цитР450. Субстратная специфичность фермента печени невелика. Наиболее эффективно он катализирует окисление неполярных соединений с алифатическими или ароматическими кольцами. К ним относятся эндогенные субстраты организма, например стероидные гормоны, а также лекарственные вещества, инактивированные путем модификации. Превращение этилового спирта в печени также катализирует фермент цитР450 («микросомальная система окисления этанола»). Так как спирт и лекарственные вещества являются субстратами одной и той же ферментативной системы, их совместное воздействие на организм может быть опасным для жизни. Поэтому фермент цитР450 представляет особый интерес для фармакологии.
Из множества цитР450-зависимых реакций здесь приводится только несколько примеров. Гидроксилирование ароматического кольца играет центральную роль в метаболических превращениях медицинских препаратов и стероидов. При этом ангулярные метильные группы могут окисляться до гидроксиметильных. Эпоксидирование приводит к высокореакционноспособным и часто токсичным продуктам. Примером является биотрансформация бензпирена в эпоксид, обладающий мутагенным действием. ЦитР450-зависимая реакция дезаминирования приводит к отщеплению алкильных заместителей при гетероатомах (О, N или S) в виде альдегидов.
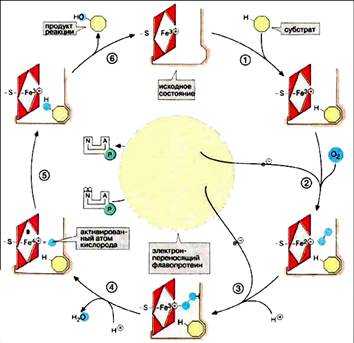
Ход каталитической реакции с участием цитР450 в принципе известен. Решающая роль группы гема состоит в том, что она переводит атомарный кислород в реакционно-способную форму, которая собственно и ответственна за все описанные выше реакции. В исходной стадии атом железа трехвалентен. Цитохром связывает субстрат рядом с группой гема (1). Это делает возможным восстановление трехвалентного железа до двухвалентной формы и последующее присоединение молекулы О2 (2). Далее следует перенос электронов (3) и окисление атома железа, который восстанавливает связанный кислород в пероксид. От промежуточного продукта отщепляется ион гидроксила (4) с образованием молекулы воды и реакционноспособной формы кислорода. В этом радикале железо формально четырехвалентно. Активированный атом кислорода атакует связь С-Н субстрата с образованием гидроксигруппы (5). После освобождения продукта реакции (6) фермент возвращается в исходное состояние.
Биосинтез холестерина.
Биосинтез холестерина, кап и всех изопреноидов, начинается с ацетил-КоА. Углеродный скелет С27-стерина строится из С2-звеньев в длинной и сложной последовательности реакций. Биосинтез холестерина можно разделить на четыре этапа. На первом этапе из трех молекул ацетил-КоА образуется мевалонат (С6). На втором этапе мевалонат превращается в «активный изопрен», изопентенилдифосфат. На третьем этапе шесть молекул изопрена полимеризуются с образованием сквалена (С30). Наконец, сквален циклизуется с отщеплением трех атомов углерода и превращается в холестерин. На схеме представлены только наиболее важные промежуточные продукты биосинтеза.
1. Образование мевалоната. Превращение ацетил-КоА в ацетоацетил-КоА и затем в З-гидрокси-З-метилглутарил-КоА (3-ГМГ-КоА) соответствует пути биосинтеза кетоновых тел, однако этот процесс происходит не в митохондриях, а в эндоплазматическом ретикулуме (ЭР). 3-ГМГ-КоА восстанавливается с отщеплением кофермента А с участием 3-ГМГ-КоА-редуктазы, ключевого фермента биосинтеза холестерину (см. ниже). На этом важном этапе путем репрессии биосинтеза фермента (эффекторы: гидроксистерины), а также за счет взаимопревращения молекулы фермента (эффекторы: гормоны) осуществляется регуляция биосинтеза холестерина. Например, фосфорилированная редуктаза представляет собой неактивную форму фермента; инсулин и тироксин стимулируют фермент, глюкагон тормозит; холестерин, поступающий с пищей, также подавляет 3-ГМГ-КоА-редуктазу.
2. Образование изопентенилдифосфата. Мевалонат за счет декарбоксилирования с потреблением АТФ превращается в изопентенилдифосфат, который и является тем структурным элементом, из которого строятся все изопреноиды.
3. Образование сквалена. Изопентенилдифосфат подвергается изомеризации с образованием диметилаллилдифосфата. Обе С5-молекулы конденсируются в геранилдифосфат и в результате присоединения следующей молекулы изопентенилдифосфата образуют фарнезилдифосфат. При димеризации последнего по типу «голова к голове» образуется сквален. Фарнезилдифосфат является также исходным соединением для синтеза других полиизопреноидов, таких, как долихол и убихинон.
4. Образование холестерина. Сквален, линейный изопреноид, циклизуется с потреблением кислорода в ланостерин, С30-стерин, от которого на последующих стадиях, катализируемых цитохромом Р450, отщепляются три метильные группы, вследствие чего образуется конечный продукт — холестерин.
Описанный путь биосинтеза локализован в гладком ЭР. Синтез идет за счет энергии, освобождающейся при расщеплении производных кофермента А и энергетически богатых фосфатов. Восстановителем при образовании мевалоната и сквалена, а также на последних стадиях биосинтеза холестерина является НАДФН + Η + . Для этого пути характерно то, что промежуточные метаболиты можно подразделить на три группы: производные кофермента А, дифосфаты и высоко липофильные соединения (от сквалена до холестерина), связанные с переносчиками стеринов.
Котрансляционный транспорт растворимых белков на мембранах гранулярного ЭПР.
- В гиалоплазме происходит связывание иРНК, кодирующей секреторный белок, с рибосомой и начинается синтез белковой цепи.
- Сначала синтезируется «сигнальная последовательность», богатая гидрофобными аминокислотами. Эта «сигнальная последовательность» в цитозоле узнается и происходит ее связь с «узнающей сигнал частицей», частица связывается после узнавания сигнального конца синтезирующейся молекулы белка с рибосомой, что приводит к полной остановке синтеза белка.
- На поверхности же мембраны ЭПР, обращенной к гиалоплазме, расположены интегральные рецепторные белки, соединяющиеся с SRP-частицами. В результате SRP-частица связывается со своим рецептором, одновременно она осуществляет связь данной рибосомы с мембраной ЭПР. Такая рибосома с SRP-частицей, блокирующей дальнейший рост полипептидной цепи, взаимодействует с большим белковым канальным комплексом - транслаконом. После связывания рибосомы с транслаконом происходит отделение SRP-частицы и синтезированный первичный пептид входит в канал, который образует транслакон. После этого возобновляется синтез полипептида, он удлиняется и его сигнальная последовательность вместе с растущей цепочкой оказываются внутри полости цистерны ЭПР.
- Таким образом, синтезируемый белок проходит сквозь мембрану ЭПР во время его синтеза, т.е. котрансляционно, одновременно с его трансляцией. Внутри полости ЭПР с помощью фермента (сигнальная петидаза) сигнальная последовательность отщепляется. После окончания синтеза вся белковая молекула оказывается в полости ЭПР, и в это время рибосома отделяется от транслакона и диссоциирует. После этого в транслаконе канал закрывается. Во время трансмембранного переноса растущей белковой цепи происходит ее связь с олигосахаридами (гликозилирование). В полости цистерн ЭПР белки претерпевают ряд дополнительных изменений: образуются дисульфидные связи, происходит их правильное сворачивание, а также сборка четвертичной структуры белков. Только белки с правильной конформацией в дальнейшем будут переноситься в зону аппарата Гольджи.
Клеточный центр: центриоли и диплосома.
Клеточный центр - немембр органоид всех эу клеток. Он представлен центросомой - плотной частицей, и центросферой - расходящимися от центросомы белковыми нитями. Большинство их являются микротрубочками, т.к. центросома выполняет функцию центра организации микротрубочек - в ней сконцентрированы белки, необходимые для начала синтеза микротрубочек.
- Центросомы клеток большинства животных и некоторых растений содержат еще один немембранный органоид - центриоли, которые были открыты в 1875 г. В. Флемингом.
- Центриоль - цилиндрическая частица. Ее основу составляют триплеты микротрубочек - 3 микротрубочки, последовательно соединенные боковыми поверхностями. 9 триплетов взаимодействуют друг с другом специальными белками и формируют стенку цилиндра. В центре цилиндра расположена белковая ось с девятью белковыми спицами, каждая из которых взаимодействует с одним триплетом и соседней спицей. Снаружи стенка покрыта центриолярным матриксом, на котором и располагается центр организации микротрубочек, функционирующий даже после разрушения центриоли.
- В каждой центросоме находятся две центриоли, расположенные перпендикулярно друг другу и называемые диплосомой. Перед делением клетки центриоли диплосомы расходятся, и рядом с каждой из них путем самосборки формируется вторая центриоль - образуются две диплосомы, которые в дальнейшем станут полюсами веретена деления.
- Функция центриолей: необходимы для формирования жгутиков и ресничек. После разрушении центриолей они не восстанавливаются и клетка теряет способность образовывать эти органоиды движения. У высших растений центриоли отсутствуют, поэтому у них нет клеток со жгутиками или ресничками.
Биология клетки/Часть 1. Клетка как она есть/9/1
Рибосомы - внутриклеточные органоиды, осуществляющие синтез белков. От синтезируемого в данный момент белка зависит расположение рибосомы в клетке.
"Свободные" рибосомы плавают в цитоплазме, не прикрепляясь к мембранам. Эти рибосомы синтезируют белки, которые работают в цитоплазме или поступают из цитоплазмы в митохондрии, пластиды и ядро. Например, протонная АТФ-синтетаза - белок, работающий в митохондриях; следовательно, рибосома, которая её синтезирует- "свободная". Миозин - двигательный белок, работающий в цитоплазме клетки, также синтезируется "свободными" рибосомами. ДНК-полимераза синтезируется "свободными" рибосомами, т.к. находится в ядре.
"Сидячие" рибосомы прикреплены к мембранам шероховатой эндоплазматической сети (ЭПС). Эти рибосомы синтезируют белки, поступающие в ЭПС. Большинство из таких белков затем поступает в АГ, а оттуда - в лизосомы, на наружную мембрану или во внеклеточную среду (секреция). Например, рецептор SRP - белок, который работает на мембране ЭПС, а следовательно рибосома, синтезирующая его - "сидячая". Белок коллаген выделяется во внешнюю среду; значит, рибосома - "сидячая".
Транспорт белков в ЭПР осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные транслокационные комплексы на мембране ЭПР.
Сигнальная (лидерная) последовательность для ЭПР включает обычно 5-10 преимущественно гидрофобных аминокислот и расположена на N-конце белка. В ее удаленной от конца части имеется консенсусная последовательность, узнаваемая специфической протеазой (за счет этого лидерные последовательности удаляются после завершения синтеза белка). Сигнальная последовательность опознаётся специальным комплексом — «опознающей сигнал частицей» (signal-recognition particle, SRP). В состав SRP входит шесть белков и короткая молекула РНК.
Анимация, демонстрирующая процесс котрансляционного транспорта. Общая продолжительность ролика - 2 минуты
Этапы синтеза и транспорта белков в ЭПР:
- Один участок SRP связывает сигнальную последовательность, а другой связывается с рибосомой и блокирует трансляцию. Отдельный домен SRP отвечает за связывание с SRP-рецептором на мембране ЭПР.
Попавший в ЭПР белок остается в этой органелле, если имеет специальную «удерживающую в ЭПР» (ER-retaining) последовательность из четырех аминокислот на С-конце. Некоторые из остающихся в ЭПР белков играют важную роль в сворачивании и посттрансляционной модификации проходящих через ЭПР белков. Так, фермент дисульфид-изомераза катализирует окисление свободных SH-групп цистеина и образование дисульфидных связей, а белок-шаперон BiP препятствует неправильному сворачиванию и аггрегации белков до образования ими четвертичных структур, а также способствует удержанию связанных с ним белков в ЭПР.
Похожий, но более сложный механизм обеспечивает котрансляционное встраивание трансмембранных белков в мембрану ЭПР.
[1] - Видео с описанием транслокации белка в ЭПР. Также описан процесс встраивания в мембрану. Третье издание "Молекулярной биологии клетки" Б. Альбертса и др.
Строение канала транслокации белков из ЭПР
Организация клетки. Внутриклеточный транспорт
Транслокация белков. Шапероны
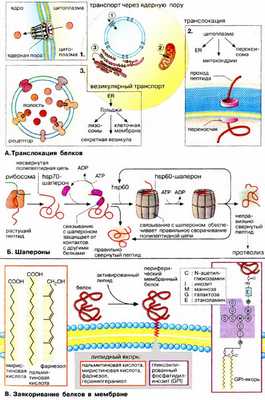
А. Транслокация белков
Перенос белков через биомембраны осуществляется специальными транспортными системами.
1. Пориновый комплекс. Из цитоплазмы в ядро (см. с. 210) белки попадают через крупный (125000 кДа) заполненный водой пориновый комплекс. Транспорт белков через комплекс энергозависим и поэтому может регулироваться Ядерные белки несут одну или несколько сигнальных последовательностей (см. с. 232), с помощью которых они связываются с пориновым комплексом и импортируются с сохранением третичной структуры.
2. Переносчики белков. Импорт белков из цитоплазмы в органеллы осуществляется белками-переносчиками, которые представляют собой белковые комплексы, переносящие линейные полипептиды через биомембраны энергозависимым образом. Специфичность процесса обеспечивается за счет связывания сигнальной последовательности (см. с. 232) с ближайшим рецептором (на схеме не приведен) Процессы развертывания и вторичной укладки белков контролируются шаперонами.
3. Везикулярный транспорт. Перенос белков от одних органелл к другим происходит с помощью везикул. Везикулы отпочковываются от мембран одной органеллы, а затем исчезают, сливаясь с мембраной другой органеллы. Белки переносятся в полости пузырька или в составе мембран подобно интегральным белкам.
Пептидная цепь, растущая в процессе трансляции, принимает вторичную и третичную структуру (см. с. 80) в результате сложного многоступенчатого процесса, идущего во времени Для образования правильной структуры с еще несвернувшейся пептидной цепочкой связываются специальные белки — шапероны . Шапероны обладают сродством к экспонированным гидрофобным участкам полипептидной цепи. Связывание с шаперонами препятствует агрегации с другими белками и тем самым создает условия для нормального сворачивания растущего пептида. Взаимодействие с шаперонами — процесс энергозависимый: при освобождении шаперонов гидролизуется АТФ (АТР).
Шапероны принадлежат к трем белковым семействам, так называемым белкам теплового шока (hsp60, hsp70, hsp90). Свое название эти белки получили потому, что и к синтез возрастает при повышении температуры и других формах стресса. При этом они выполняют функцию защиты белков клетки от денатурации. Белки — представители семейства hsp70 — связываются на начальной фазе образования растущего пептида. Одни из них контролируют процесс сворачивания белка в цитоплазме, другие — участвуют в переносе белков в митохондрии. Белки hsp60 охватывают синтезированный полипептид наподобие бочонка, тем самым обеспечивая условия для принятия правильной конформации.
В. Заякоривание белков в мембранах
Белки, синтезируемые в ШЭР и несущие «стоп-транспорт-сигнал» (см. сс. 226, 232), остаются в мембране ШЭР и закрепляются там за счет гидрофобных взаимодействий в качестве интегральных мембранных белков (см. с. 216). Фиксация белка в мембране может быть также осуществлена путем присоединения липофильного якоря. Такие периферические мембранные белки (см. с. 216) присоединяют липиды во время или сразу после трансляции. Соответствующий сигнал обычно содержится в белке в форме специфической пептидной последовательности.
Мембранными якорями являются жирные кислоты (ацильные остатки, см. с. 54) или изопреноиды (пренильный остаток, см. с. 58). Белки могут быть ацилированы пальмитиновой (C 16 ) или миристиновой (C 14 ) кислотами, пренилированы путем связывания с фарнезолом (С 15 ) или геранилгераниолом (С 20 ).
Некоторые белки несут на С-конце гликозилированный фосфатидилинозит (ГФИ (GPI)]. В эту группу входят многие адгезионные молекулы (например, N-CAM, гепаринсульфатпротеогликан), ряд мембранных ферментов, таких, как щелочная фосфатаза, ацетилхолинэстераза и различные протеиназы.
Транспорт белков
Секреция белков у прокариот: Sec-аппарат, системы секреции I-IV типов Процесс секреции белков является важным аспектом жизнедеятельности бактерий, поскольку значительное количество белков бактериальной клетки локализованы вне цитоплазмы. Способность к секреции белков является важнейшей для вирулентных бактерий, поскольку в процессе инфекции многие белковые продукты должны располагаться на внешней поверхности бактериальной клетки, либо секретироваться во внешнюю среду.
Содержание
Секреция белков у прокариот: Sec-аппарат, системы секреции I-IV типов
Распределение белков по компартментам клетки эукариот
2.1 Котрансляционная транслкация белков в полость эндоплазматического ретикулума
2.2 SRP-частица и ее рецептор
2.3 Модификации белков в полости ЭР и их последующая сортировка
Транспорт белков в митохондрии и хлоропласты, контроль локализации белков внутри этих органелл
3.1 Транспорт белков через ядерные поры
Работа содержит 1 файл
реферат транспорт белков.docx
«ПОЛЕССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Реферат на тему:
студентка 5 курса 831411 группы
Гайдалёнок Виктория Сергеевна
- Секреция белков у прокариот: Sec-аппарат, системы секреции I-IV типов
- Распределение белков по компартментам клетки эукариот
2.1 Котрансляционная транслокация белков в полость эндоплазматического ретикулума
2.2 SRP-частица и ее рецептор
2.3 Модификации белков в полости ЭР и их последующая сортировка
- Транспорт белков в митохондрии и хлоропласты, контроль локализации белков внутри этих органелл
3.1 Транспорт белков через ядерные поры
- Секреция белков у прокариот: Sec-аппарат, системы секреции I-IV типов Процесс секреции белков является важным аспектом жизнедеятельности бактерий, поскольку значительное количество белков бактериальной клетки локализованы вне цитоплазмы. Способность к секреции белков является важнейшей для вирулентных бактерий, поскольку в процессе инфекции многие белковые продукты должны располагаться на внешней поверхности бактериальной клетки, либо секретироваться во внешнюю среду. Кроме того, секреция белков имеет важнейшее значение для биотехнологии, поскольку очистка белков из культуральной среды простого состава значительно проще, чем из лизатов, которые представляют собой сложные смеси различных веществ. В связи с этим изучение процесса белковой секреции является весьма актуальной проблемой.
Секреция присутствует не только у эукариот, она также есть у бактерий и архей. Кассетные АТФ-связывающие транспортеры (АВС-система) характерны для всех трёх доменов живых организмов. Сек-система — это другая консервативная секреторная система, которая гомологична каналу- транслокону в эндоплазматическом ретикулуме эукариот. Она состоит из комплекса Сек-61 у дрожжей и комплекса Сек Y-E-G у бактерий.
В отличие от секреции у эукариот, секреция через бактериальную плазматическую мембрану протекает в основном посттрансляционно. Работу Sec системы можно разделить на три стадии:
- направление белка на транспорт
- собственно транслокация белка через мембрану
- освобождение транспортированного белка на периплазматической стороне мембраны
На первой стадии пребелки направляются к точкам секреции в цитоплазматической мембране (местам, где собран транслокационный комплекс). На второй стадии полипептидная цепочка пересекает липидный бислой, скорее всего через транслоказу. На третьей стадии транслоцированный полипептид освобождается и либо принимает свою нативную конформацию, либо направляется для дальнейшей секреции в одну из терминальных ветвей GSP.
Как минимум 10 белков необходимы для работы Sec системы (Рис. 1.). Первая стадия реакции требует присутствия специфичного для секреции шаперона SecB. Этото шаперон является тетрамером, опознает белки, содержащие сигнальный пептид, и связывается с ними, выполняя фактически функцию молекулярного шаперона, связываясь собластями пресекреторных белков, не принявшими свою окончательную конформацию и поддерживая их в компетентном для транслокации состоянии. Второй функцией SecB является "доставка" предшественников белков к SecA субъединице мембранной транслоказы. В некоторых случаях могут привлекаться гомеостатические шапероны GroEL и DnaK.
Вторая стадия реакции катализируется сложным белковым комплексом, расположенным в цитоплазматической мембране - транслоказой. Транслоказа содержит пронизывающий мембрану канал, состоящий из субъединиц трех белков, SecY, SecE и SecG. Эти три белка являются интегральными мембранными белками, составляющими структурную основу транслоказы - каркас или раму. SecY -интегральный мембранный белок (10 НТМ - стр-ра подобная мембр транспортерам, напр, LacY). SecE имеет три трансмембранных сегмента, SecD и SecF - шесть. А «мотором» транслокационный машины служит АТФаза SecA. Этот белок уникален для бактерий - эукариоты используют другую транслокационную АТФазу. SecA - большая вытянутая димерная молекула, содержащая два домена -амино-концевой АТФазный и карбокси-конец, необходимый для димеризации. Карбокси-концевой домен позволяет SecA связаться с SecYEG, что создает функциональную основу транслоказы. Дополнительные субъединицы транслоказы SecD и SecF оптимизируют секреторную реакцию. Источником энергии для секреции служит АТФ и протондвижущая сила (ускоряет транслокацию).
Бактериальные системы секреции
Для секреции белков бактериальные клетки используют различные системы секреции в зависимости от строения и конечной локализации белка. Поэтому является необходимым приведение небольшого обзора систем секреции всех типов.
Секреция первого типа. Аппарат этой системы секреции устроен относительно просто. Он включает в себя три компонента белковой природы. Эта система является Sec-независимой и осуществляет секрецию субстратов непосредственно из цитоплазмы в одну стадию без периплазматических посредников. По этому пути секретируются токсины, протеазы, липазы, антибиотики и другие соединения (D. Thanassi et al., 2000).
Секреция второго типа. Эта система секреции устроена уже довольно сложно. Характерной особенностью является ее разделение на две части и секреция субстратов в две стадии. Первая часть, называемая Sec-системой, экспортирует белки через цитоплазматическую мембрану, далее белки либо остаются в периплазме, либо секретируются через внешнюю мембрану посредством терминальных компонентов системы секреции (S. Lory, 1998). По этому пути секретируются такие белки, как пектатлиазы, пектинметилэстеразы и целлюлазы рода Erwinia, целлюлаза, протеаза и амилаза Xanthomonas campestris, липаза, фосфолипаза, эластаза, энтеротоксин А у Pseudomonas aeruginosa, амилаза и протеаза Aeromonas hydrophila, хитиназа, протеаза и холерный токсин Vibrio cholerae (J. Hacker at al., 2000). В связи с большим количеством и разнообразием субстратов, секретируемых через этот аппарат секреции, его называют “общим секреторным путем” (General Secretory Pathway, GSP).
Секреция третьего типа. Этот тип секреции, подобно первому типу, является независимым от Sec-системы. Характерной особенностью его является доставка субстратов (факторов вирулентности) непосредственно в клетку эукариотического хозяина, также наличие большого количества секреторных шаперонов. Сам аппарат включает в себя около двадцати белковых компонентов, большая часть которых расположена во внутренней мембране, и по структуре довольно схож с системой сборки жгутика. Посредством системы секреции третьего типа экспортируются многие факторы вирулентности патогенов человека и животных, а также Avr-белки, харпины и другие факторы вирулентности фитопатогенных бактерий (J. Hacker еt al., 2000).
Секреция четвертого типа. Аппарат секреции четвертого типа состоит из двух компонентов: конъюгационного канала, через который происходит транслокация субстратов, и конъюгационного пилюса, необходимого для контакта с реципиентной клеткой. Строение этой системы секреции сходно со строением аппарата конъюгации некоторых плазмид. Она также обладает широкой специфичностью как субстратов (экспортируются крупные нуклеопротеидные комплексы, сложные белковые токсины, мономерные белки), так и реципиентов, т.к. ими могут служить практически все живые организмы (S. Lory, 1998).
Секреция пятого типа. В некоторых публикациях именуется системой секреции четвертого типа. Эта система секреции включает в себя группу белков, называемых автотранспортерами, к числу которых относятся: протеазы (IgA)Neiseria gonorrhoeae, цитотоксин (Vac) Helicobacter pylori.
Автотранспортеры экспортируются из цитоплазмы через Sec-систему с отщеплением сигнальной аминоконцевой последовательности. Некоторые из них могут оставаться заякоренными в клеточной стенке, другие же экспортируются непосредственно во внеклеточное пространство (J. Hacker еt al., 2000).
Распределение белков по компартментам клетки эукариот
У эукариотической клетки таких отсеков несколько, эти клетки поделены на функционально различные, окруженные мембранами области (компартменты). Каждый компартмент, или органелла, имеет свой собственный набор ферментов и других специализированных молекул; существуют и сложные системы распределения, проводящие специфические продукты из одного компартмента в другой. Чтобы разобраться в строении эукариотической клетки, необходимо знать, что происходит в каждом из ее компартментов, какие молекулы курсируют между ними и как возникают и сохраняются сами компартменты.
Центральную роль в компартментации эукариотической клетки играют белки. Они катализируют реакции, протекающие в каждой органелле, и избирательно переносят малые молекулы внутрь органеллы и из нее. Белки также служат специфичными для органелл поверхностными маркерами, которые направляют новые партии белков и липидов к соответствующим компартментам. Клетка млекопитающих содержит около 10 миллиардов (1010) молекул белков примерно 10000 разных типов, синтез почти всех этих белков начинается в цитозоле - общем пространстве, окружающем все органеллы. Каждый вновь синтезированный белок затем специфически доставляется в тот клеточный компартмент, который в нем нуждается. Прослеживая путь белка из одного компартмента в другой, можно разобраться в запутанном лабиринте клеточных мембран.
Транспорт белков в ЭПР осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные транслокационные комплексы на мембране ЭПР. Сигнальная последовательность для ЭПР включает обычно 5-10 преимущественно гидрофобных аминокислот и расположена на N-конце белка. В ее удаленном от конца части имеется консенсусная последовательность, узнаваемая специфической протеазой. Эта сигнальная последовательность опознаётся специальным комплексом — «опознающей сигнал частицей» (signal-recognition particle, SRP). В состав SRP входит шесть белков и короткая молекула РНК [1]. Один участок SRP связывает сигнальную последовательность, а другой связывается с рибосомой и блокирует трансляцию. Отдельный домен SRP отвечает за связывание с SRP-рецептором на мембране ЭПР.
Вместе с SRP рибосома перемещается к ЭПР и связывается с рецептором SRP (интегральным белком) на цитозольной стороне мембраны ЭПР. Этот комплекс (рибосома — SRP — рецептор SRP) связывается с порой — транслокатором белка на мембране ЭПР. Обычно с мРНК связаны несколько рибосом, и на мембране ЭПР сидят полирибосомы, причем каждая рибосома присоединена к своей поре. Дойдя до 3'-конца мРНК, рибосома возвращается в цитоплазму, однако мРНК удерживается у мембраны ЭПР за счет того, что новые рибосомы, вязанные с SRP, присоединяются к ее 5'-концу.
После связывания с транслокатором комплекс SRP — рецептор SRP отделяется от рибосомы, и это приводит к возобновлению трансляции. Сейчас доказано, что белок по мере трансляции проникает в ЭПР через водный канал транслокатора, имеющий воротный механизм и сформированный у эукариот четырьмя субъединицами комплекса Sec61 (гомологичные белки есть и на мембранах бактериальных клеток).
После возобновления трансляции гидрофобный участок сигнальной последовательности остается связан с транслокатором, а вновь синтезируемый белок в виде петли проталкивается внутрь ЭПР. Этот процесс не требует дополнительных затрат энерги АТФ. После того, как С-конец белка отделяется от рибосомы и оказывается внутри ЭПР, протеаза сигнального пептида отрезает его от белка. Белок внутри ЭПР сворачивается, приобретая нормальную конформацию, а сигнальный пептид через открывшийся в транслокаторе боковой канал перемещается в липидный бислой мембраны ЭПР, где быстро разрушается протеазами.
Попавший в ЭПР белок остается в этой органелле, если имеет специальную « удерживающую в ЭПР» (ER-retaining) последовательность из четырех аминокислот на С-конце. Некоторые из остающихся в ЭПР белков играют важную роль в сворачивании и посттрансляционной модификации проходящих через ЭПР белков. Так, фермент дисульфид- изомераза катализирует окисление свободных SH-групп цистеина и образование дисульфидных связей, в белок-шаперон BiP препятствует неправильному сворачиванию и агрегации белков до образования ими четвертичных структур, а также способствует удержанию связанных с ним белков в ЭПР.
В направлении сигнального пептида к мембране ЭР участвуют SRP - частица, распознающая сигнал (a signal-recognition particle) и ее рецептор, известный также как стыкующий белок.
2.2 SRP-частица и ее рецептор.
Частица, распознающая сигнал, связывается с сигнальным пептидом, как только он "сходит" с рибосомы. Это приводит к временной остановке синтеза белка. Возникшая пауза в трансляции, вероятно, дает возможность рибосоме связаться с мембраной ЭР до того, как синтез полипептидной цепи будет завершен. Благодаря этому ненужного высвобождения белка в цитозоль не происходит.
Читайте также:
- Эпидемиология рака гортани и причины, механизмы его развития
- Признаки ( клиника ) ожоговой болезни. Диагноз ожогового шока. Постановка диагноза ожогового шока.
- КТ, МРТ при метастатической нейробластоме головы и шеи
- Хирургические и нехирургические методы лечения тугоухости и шума в ушах
- Конфиденциальность информации об алкоголике. Эффективность вмешательств при алкоголизме
