Свойства активных центров антител. Реактивность иммуноглобулинов
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026
Антитела - это иммунные белки, образующиеся в организме в ответ на поступление антигена и обладающие способностью специфически взаимодействовать с ним. В физико-химическом отношении антитела представляют собой гаммаглобулины (гликопротеиновые молекулы.
Суммарное содержание иммуноглобулинов в сыворотке крови составляет около 2,5% сухого остатка, т.е. более 1/3 всех белков крови.
Антитела (иммуноглобулины) вырабатываются В-лимфо-цитами (плазмоцитами) в лимфоидных органах и местах скопления лимфоидной ткани, циркулируют в крови и жидкостях организма (лимфе, тканевой жидкости), а также содержатся в различных секретах организма (материнском молоке, слезе, слюне и др.).
Строение иммуноглобулинов.
Все иммуноглобулины человека построены однотипно и состоят из двух идентичных тяжелых полипептидных цепей (Н-цепей, Heavy chains) и двух идентичных легких полипептидных цепей (L-цепей, Light chains), которые связаны между собой посредством ковалентных дисульфидных мостиков (-S-S-) (Рис. 5-1.).
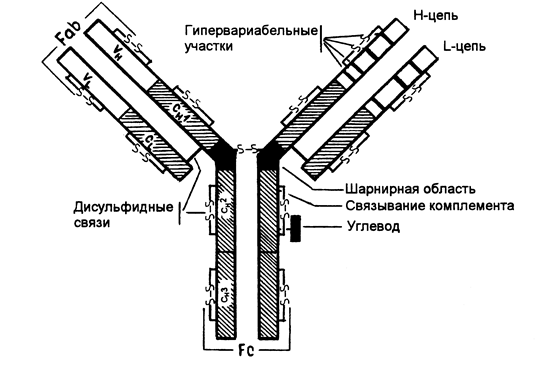 |
Р и с. 5-1. Структура IgG.
Молекулярная масса Н-цепи -50 000 - 70 000,L-цепи - 20000-25000.
Существует 5 типов Н-цепей, которые получили название g (гамма), a (альфа), m (мю), e (эпсилон), d (дельта) и два типа L-цепей k (каппа) и l (лямбда).
Н-цепи, независимо от класса иммуноглобулинов, могут быть связаны либо с каппа-, либо с лямбда-типом L-цепи. В соответствии с типом Н-цепи (g, a, m, d, e), существует пять классов иммуноглобулинов: Ig G, Ig M, Ig A, Ig D, Ig E. Каждый класс иммуноглобулинов обладает особыми свойствами и биологической активностью.
Каждая полипептидная L- и Н-цепь состоит из вариабельной области (V-области, VL и VH) и константной области (С-области, CL и СH) (Рис. 5-1).У каждой легкой цепи имеется одна V-область и одна С-область. У каждой тяжелой цепи имеется одна V-область и 3 или 4 гомологичные константные области. IgG, IgD, IgA имеют три константные области, Ig М, Ig E - 4 константные области.
Тяжелая цепь IgG, IgD, IgA состоит из 450 аминокислотных остатков. V-область этих иммуноглобулинов образована 116 аминокислотными остатками, С-область включает около 334 аминокислотных остатков, ее гомологичные участки СН1, СН2, СНЗ состоят примерно из 100-110 аминокислотных остатков.
Работы Портера, Ниссонова (1959-1963) выявили в молекуле иммуноглобулина несколько функционально активных сегментов (Рис. 5-3.). Так, обработка IgG папаином выявила, что антитело состоит из трех функциональных фрагментов: двух Fab-фрагментов (Fragment antigen binding) и одного Fc-фрагмента (Fragment crystalline). Fab-фрагмент имеет молекулярную массу 50 000, структурно и функционально моновалентен, способен связывать антиген. Fc-фрагмент имеет мол. массу 60 000, состоит из двух Н-цепей (Сg2, СgЗ доменов), связанных между собой дисульфидными связями. Fc-фрагмент обладает способностью связывать комплемент, а также взаимодействовать с иммунокомпетентными клетками, связывая с ними антитела. При расщеплении молекулы иммуноглобулина пепсином образуется 2 функциональных фрагмента: F(ab)2-фрагмент и pFc 1 -фрагмент. F(аb)2-фрагмент состоит из двух Fab-фрагментов связанных между собой дисульфидными мостиками. F(аb)2-фрагмент имеет молекулярную массу 100 000, двухвалентен, обладает во многом свойствами антитела (способен взаимодействовать с антигеном и преципитировать его); pFc 1 -фрагмент представляет собой С-концевую область Fc-фрагмента, состоит из С-концевых областей двух Н-цепей, которые соединены между собой нековалентными связями.
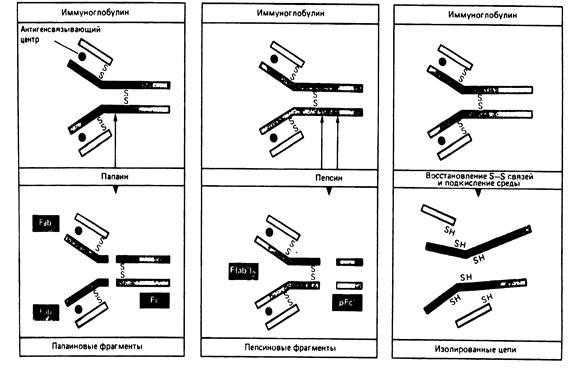
Р и с. 5-3. Расщепление молекулы иммуноглобулина на отдельные пептидные цепи и протеолитические фрагменты.
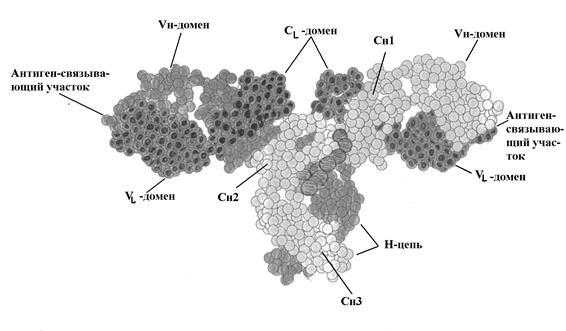
Р и с. 5-4. Трехмерная структура IgG человека.
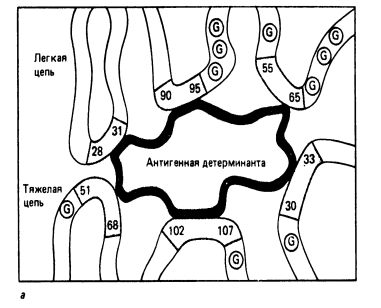
Р и с. 5-5. Упрощенное двухмерное изображение антигенсвязывающего центра.
Активный центр антитела. Важным свойством антитела является способность распознавать и специфически взаимодействовать с антигеном. Активный центр антитела образован V-доменами Н- и L-цепей. (Рис. 5-3; 5-5). Изучение активного центра антитела показало, что он может быть образован 4-8 аминокислотными остатками гипервариабельных областей V-доменов Н- и L-цепей (Рис. 5-5.).
Большинство антител имеет два и более активных центра. Такие антитела называются полными.
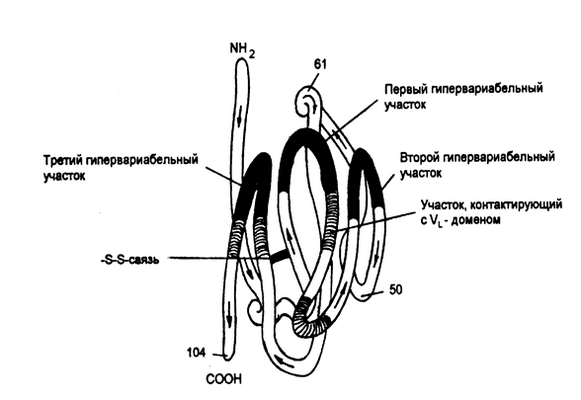
Р и с. 5-6. Пространственное объединение гипервариабелъных участков V-доменов тяжелой цепи IgG человека
Способность антитела связывать определенное количество антигенных детерминант определяется понятием валентность. Валентность антитела, как правило соответствует числу активных центров AT. Молекула иммуноглобулина, связывающая две антигенные детерминанты - двухвалентна, молекула иммуноглобулина, связывающая 5 антигенных детерминант - пятивалентна. Часть иммуноглобулинов имеют один активный центр и способны связывать одну антигенную детерминанту. Такие моновалентные антитела называются неполными антителами
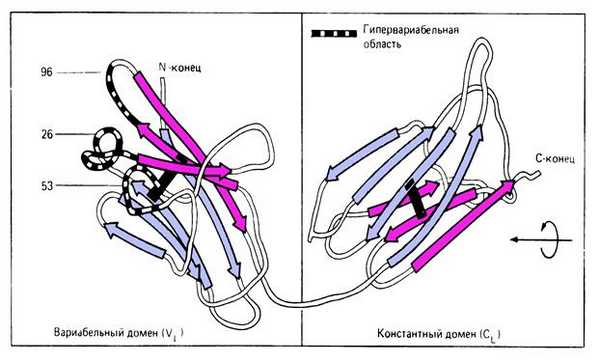
Ри с. 5-7. Структура глобулярных доменов легкой цепи по данным рентген-структурного анализа.
Познавательно:
Основные этапы в истории взаимодействия общества и природы. Понятие экосистемы. Глобальные экологические проблемы современности Взаимодействие общества с природой как естественным условием своей жизни не было одинаковым на разных ступенях исторического развития.
МАНИПУЛЯЦИЯ № 107 «ТЕХНИКА ПОДКОЖНОЙ ИНЪЕКЦИИ» Цель: введение лекарственного раствора подкожно. Показания: определяет врач. Противопоказания: определяет врач. Оснащение: на лотке.
Виды химических реакторов. Реакторы идеального смешения и идеального вытеснения Химические реакторы План лекции: 4.1 Виды химических реакторов. Реакторы идеального смешения и идеального вытеснения. 4.2 Реакторы.
Городские парки, их классификация и назначение Общие положения Озелененные территории общего пользования условно подразделяются на три группы.
Индивидуальная программа реабилитации инвалидов Программы социальной реабилитации Индивидуальная программа реабилитации инвалидов Осуществление всех направлений социальной.
Антитела, основные классы иммуноглобулинов, их структурные и функциональные особенности. Защитная роль антител в приобретенном антиинфекционном иммунитете.
Антитела - специфические белки гамма- глобулиновой природы, образующиеся в организме в ответ на антигенную стимуляцию и способные специфически взаимодействовать с антигеном (in vivo, in vitro). В соответствии с международной классификацией совокупность сывороточных белков, обладающих свойствами антител, называют иммуноглобулинами.
Уникальность антител заключается в том, что они способны специфически взаимодействовать только с тем антигеном, который вызвал их образование.
Иммуноглобулины ( Ig ) разделены в зависимости от локализации на три группы:
- секреторные ( в секретах- содержимом желудочно- кишечного тракта, слезном секрете, слюне, особенно- в грудном молоке) обеспечивают местный иммунитет (иммунитет слизистых);
- поверхностные ( на поверхности иммунокомпетентных клеток, особенно В- лимфоцитов).
Любая молекула антител имеет сходное строение ( Y- образную форму) и состоит из двух тяжелых ( Н ) и двух легких ( L ) цепей, связанных дисульфидными мостиками. Каждая молекула антител имеет два одинаковых антигенсвязывающих фрагмента Fab ( fragment antigen binding ), определяющих антительную специфичность, и один Fc ( fragment constant ) фрагмент, который не связывает антиген, но обладает эффекторными биологическими функциями. Он взаимодействует со “своим” рецептором в мембране различных типов клеток ( макрофаг, тучная клетка, нейтрофил).
Концевые участки легких и тяжелых цепей молекулы иммуноглобулина вариабельны по составу ( аминокислотным последовательностям ) и обозначаются как VL и VH области. В их составе выделяют гипервариабельные участки, которые определяют структуру активного центра антител (антигенсвязывающий центр или паратоп). Именно с ним взаимодействует антигенная детерминанта (эпитоп) антигена. Антигенсвязывающий центр антител комплементарен эпитопу антигена по принципу “ключ - замок” и образован гипервариабельными областями L- и Н- цепей. Антитело свяжется антигеном (ключ попадет в замок) только в том случае, если детерминантная группа антигена полностью вместится в щель активного центра антител.
Легкие и тяжелые цепи состоят из отдельных блоков- доменов. В легких ( L ) цепях - два домена- один вариабельный ( V ) и один константный ( C ), в тяжелых ( H ) цепях- один V и 3 или 4 ( в зависимости от класса иммуноглобулина ) C домена.
Существуют легкие цепи двух типов- каппа и лямбда, они встречаются в различных пропорциях в составе различных (всех) классов иммуноглобулинов.
Выявлено пять классов тяжелых цепей- альфа ( с двумя подклассами), гамма ( с четырьмя подклассами), эксилон, мю и дельта. Соответственно обозначению тяжелой цепи обозначается и класс молекул иммуноглобулинов- А, G, E, M и D.
Именно константные области тяжелых цепей, различаясь по аминокислотному составу у различных классов иммуноглобулинов, в конечном результате и определяют специфические свойства иммуноглобулинов каждого класса.
Известно пять классов иммуноглобулинов, отличающихся по строению тяжелых цепей, молекулярной массе, физико- химическим и биологическим характеристикам: IgG, IgM, IgA, IgE, IgD. В составе IgG выделяют 4 подкласса ( IgG1, IgG2, IgG3, IgG4 ), в составе IgA- два подкласса (IgA1, IgA2 ).
Структурной единицей антител является мономер, состоящий из двух легких и двух тяжелых цепей. Мономерами являются IgG, IgA ( сывороточный), IgD и IgE. IgM - пентамер (полимерный Ig). У полимерных иммуноглобулинов имеется дополнительная j ( joint) полипептидная цепь, которая объединяет ( полимеризует) отдельные субъединицы (в составе пентамера IgM, ди- и тримера секреторного IgA).
Основные биологические характеристики антител.
1. Специфичность - способность взаимодействия с определенным (своим) антигеном (соответствие эпитопа антигена и активного центра антител).
2. Валентность - количество способных реагировать с антигеном активных центров ( это связано с молекулярной организацией- моно- или полимер). Иммуноглобулины могут быть двухвалентными ( IgG ) или поливалентными (пентамер IgM имеет 10 активных центров). Двух- и более валентные антитела навывают полными антителами. Неполные антитела имеют только один участвующий во взаимодействии с антигеном активный центр ( блокирующий эффект на иммунологические реакции, например, на агглютинационные тесты). Их выявляют в антиглобулиновой пробе Кумбса, реакции угнетения связывания комплемента.
3. Афинность - прочность связи между эпитопом антигена и активным центром антител, зависит от их пространственного соответствия.
4. Авидность - интегральная характеристика силы связи между антигеном и антителами, с учетом взаимодействия всех активных центров антител с эпитопами. Поскольку антигены часто поливалентны, связь между отдельными молекулами антигена осуществляется с помощью нескольких антител.
5. Гетерогенность - обусловлена антигенными свойствами антител, наличием у них трех видов антигенных детерминант:
- изотипические - принадлежность антител к определенному классу иммуноглобулинов;
- аллотипические- обусловлены аллельными различиями иммуноглобулинов, кодируемых соответствующими аллелями Ig гена;
- идиотипические- отражают индивидуальные особенности иммуноглобулина, определяемые характеристиками активных центров молекул антител. Даже тогда, когда антитела к конкретному антигену относятся к одному классу, субклассу и даже аллотипу, они характеризуются специфическими отличиями друг от друга (идиотипом). Это зависит от особенностей строения V- участков H- и L- цепей, множества различных вариантов их аминокислотных последовательностей.
Понятие о поликлональных и моноклональных антителах будет дано в следующих разделах.
Характеристика основных классов иммуноглобулинов.
Ig G. Мономеры, включают четыре субкласса. Концентрация в крови- от 8 до 17 г/л, период полураспада- около 3- 4 недель. Это основной класс иммуноглобулинов, защищающих организм от бактерий, токсинов и вирусов. В наибольшем количестве IgG- антитела вырабатываются на стадии выздоровления после инфекционного заболевания (поздние или 7S антитела), при вторичном иммунном ответе. IgG1 и IgG4 специфически (через Fab- фрагменты) связывают возбудителей (опсонизация), благодаря Fc- фрагментам IgG взаимодействуют с Fc- рецепторам фагоцитов, способствуя фагоцитозу и лизису микроорганизмов. IgG способны нейтрализовать бактериальные экзотоксины, связывать комплемент. Только IgG способны транспортироваться через плаценту от матери к плоду (проходить через плацентарный барьер) и обеспечивать защиту материнскими антителами плода и новорожденного. В отличие от IgM- антител, IgG- антитела относятся к категории поздних- появляются позже и более длительно выявляются в крови.
IgM. Молекула этого иммуноглобулина представляет собой полимерный Ig из пяти субъединиц, соединенных дисульфидными связями и дополнительной J- цепью, имеет 10 антиген- связывающих центров. Филогенетически это наиболее древний иммуноглобулин. IgM- наиболее ранний класс антител, образующихся при первичном попадании антигена в организм. Наличие IgM- антител к соответствующему возбудителю свидетельствует о свежем инфицировании (текущем инфекционном процессе). Антитела к антигенам грамотрицательных бактерий, жгутиковым антигенам- преимущественно IgM- антитела. IgM- основной класс иммуноглобулинов, синтезируемых у новорожденных и младенцев. IgM у новорожденных- это показатель внутриутробного заражения (краснуха, ЦМВ, токсоплазмоз и другие внутриутробные инфекции), поскольку материнские IgM через плаценту не проходят. Концентрация IgM в крови ниже, чем IgG- 0,5- 2,0 г/л, период полураспада- около недели. IgM способны агглютинировать бактерии, нейтрализовать вирусы, активировать комплемент, активизировать фагоцитоз, связывать эндотоксины грамотрицательных бактерий. IgM обладают большей, чем IgG авидностью (10 активных центров), аффинность (сродство к антигену) меньше, чем у IgG.
IgA. Выделяют сывороточные IgA (мономер) и секреторные IgA (IgAs). Сывороточные IgA составляют 1,4- 4,2 г/л. Секреторные IgAs находятся в слюне, пищеварительных соках, секрете слизистой носа, в молозиве. Они являются первой линией защиты слизистых, обеспечивая их местный иммунитет. IgAs состоят из Ig мономера, J-цепи и гликопротеина (секреторного компонента). Выделяют два изотипа- IgA1 преобладает в сыворотке, субкласс IgA2 - в экстраваскулярных секретах.
Секреторный компонент вырабатывается эпителиальными клетками слизистых оболочек и присоединяется к молекуле IgA в момент прохождения последней через эпителиальные клетки. Секреторный компонент повышает устойчивость молекул IgAs к действию протеолитических ферментов. Основная роль IgA- обеспечение местного иммунитета слизистых. Они препятствуют прикреплению бактерий к слизистым, обеспечивают транспорт полимерных иммунных комплексов с IgA, нейтрализуют энтеротоксин, активируют фагоцитоз и систему комплемента.
IgE. Представляет мономер, в сыворотке крови находится в низких концентрациях. Основная роль- своими Fc- фрагментами прикрепляется к тучным клеткам (мастоцитам) и базофилам и опосредует реакции гиперчувствительности немедленного типа. К IgE относятся “антитела аллергии”- реагины. Уровень IgE повышается при аллергических состояниях, гельминтозах. Антигенсвязывающие Fab- фрагменты молекулы IgE специфически взаимодействует с антигеном (аллергеном), сформировавшийся иммунный комплекс взаимодействует с рецепторами Fc- фрагментов IgE, встроенных в клеточную мембрану базофила или тучной клетки. Это является сигналом для выделения гистамина, других биологически активных веществ и развертывания острой аллергической реакции.
IgD. Мономеры IgD обнаруживают на поверхности развивающихся В- лимфоцитов, в сыворотке находятся в крайне низких концентрациях. Их биологическая роль точно не установлена. Полагают, что IgD участвуют в дифференциации В-клеток, способствуют развитию антиидиотипического ответа, участвуют в аутоиммунных процессах.
С целью определения концентраций иммуноглобулинов отдельных классов применяют несколько методов, чаще используют метод радиальной иммунодиффузии в геле (по Манчини)- разновидность реакции преципитации и ИФА.
Определение антител различных классов имеет важное значение для диагностики инфекционных заболеваний. Обнаружение антител к антигенам микроорганизмов в сыворотках крови- важный критерий при постановке диагноза- серологический метод диагностики. Антитела класса IgM появляются в остром периоде заболевания и относительно быстро исчезают, антитела класса IgG выявляются в более поздние сроки и более длительно (иногда- годами) сохраняются в сыворотках крови переболевших, их в этом случае называют анамнестическими антителами.
Выделяют понятия: титр антител, диагностический титр, исследования парных сывороток. Наибольшее значение имеет выявление IgM- антител и четырехкратное повышение титров антител (или сероконверсия- антитела выявляют во второй пробе при отрицательных результатах с первой сывороткой крови) при исследовании парных- взятых в динамике инфекционного процесса с интервалом в несколько дней- недель проб.
Реакции взаимодействия антител с возбудителями и их антигенами (реакция “антиген- антитело”) проявляется в виде ряда феноменов- агглютинации, преципитации, нейтрализации, лизиса, связывания комплемента, опсонизации, цитотоксичности и могут быть выявлены различными серологическими реакциями.
Динамика выработки антител. Первичный и вторичный иммунный ответ.
Первичный ответ- при первичном контакте с возбудителем (антигеном), вторичный- при повторном контакте. Основные отличия:
- продолжительность скрытого периода (больше- при первичном);
- скорость нарастания антител (быстрее- при вторичном);
- количество синтезируемых антител (больше- при повторном контакте);
- последовательность синтеза антител различных классов (при первичном более длительно преобладают IgM, при вторичном- быстро синтезируются и преобладают IgG- антитела).
Вторичный иммунный ответ обусловлен формированием клеток иммунной памяти. Пример вторичного иммунного ответа- встреча с возбудителем после вакцинации.
Роль антител в формировании иммунитета.
Антитела имеют важное значение в формировании приобретенного постинфекционного и поствакцинального иммунитета.
1. Связываясь с токсинами, антитела нейтрализуют их, обеспечивая антитоксический иммунитет.
2. Блокируя рецепторы вирусов, антитела препятствуют адсорбции вирусов на клетках, участвуют в противовирусном иммунитете.
3. Комплекс антиген- антитело запускает классический путь активации комплемента с его эффекторными функциями (лизис бактерий, опсонизация, воспаление, стимуляция макрофагов).
4. Антитела принимают участие в опсонизации бактерий, способствуя более эффективному фагоцитозу.
5. Антитела способствуют выведению из организма (с мочой, желчью) растворимых антигенов в виде циркулирующих иммунных комплексов.
IgG принадлежит наибольшая роль в антитоксическом иммунитете, IgM - в антимикробном иммунитете (фагоцитоз корпускулярных антигенов), особенно в отношении грамотрицательных бактерий, IgA - в противовирусном иммунитете (нейтрализация вирусов), IgAs - в местном иммунитете слизистых оболочек, IgE - в реакциях гиперчувствительности немедленного типа.
Лекция № 12. Гуморальный иммунитет. Иммуноглобулины. Роль антител в иммунном ответе. Реакция антиген- антитело, ее применение
Основными формами иммунного ответа на попадание антигена в организм являются: биосинтез антител, образование клеток иммунной памяти, реакция гиперчувствительности немедленного типа, реакция гиперчувствительности замедленного типа, иммунологическая толерантность, идиотип- антиидиотипические отношения.
Для гуморального иммунитета характерна выработка специфических антител (иммуноглобулинов).
Антитела - специфические белки гамма- глобулиновой природы, образующиеся в организме в ответ на антигенную стимуляцию и способные специфически взаимодействовать с антигеном (in vivo, in vitro). В соответствии с международной классификацией совокупность сывороточных белков, обладающих свойствами антител, называют иммуноглобулинами.
- сывороточные (в крови);
- секреторные ( в секретах- содержимом желудочно- кишечного тракта, слезном секрете, слюне, особенно- в грудном молоке) обеспечивают местный иммунитет (иммунитет слизистых);
Концевые участки легких и тяжелых цепей молекулы иммуноглобулина вариабельны по составу ( аминокислотным последовательностям ) и обозначаются как VL и VH области. В их составе выделяют гипервариабельные участки, которые определяют структуру активного центра антител (антигенсвязывающий центр или паратоп). Именно с ним взаимодействует антигенная детерминанта (эпитоп) антигена. Антигенсвязывающий центр антител комплементарен эпитопу антигена по принципу “ключ - замок” и образован гипервариабельными областями L- и Н- цепей. Антитело свяжется антигеном (ключ попадет в замок) только в том случае, если детерминантная группа антигена полностью вместится в щель активного центра антител.
Выявлено пять классов тяжелых цепей- альфа ( с двумя подклассами), гамма ( с четырьмя подклассами), эксилон, мю и дельта. Соответственно обозначению тяжелой цепи обозначается и класс молекул иммуноглобулинов- А, G, E, M и D.
Структурной единицей антител является мономер, состоящий из двух легких и двух тяжелых цепей. Мономерами являются IgG, IgA ( сывороточный), IgD и IgE. IgM- пентамер (полимерный Ig). У полимерных иммуноглобулинов имеется дополнительная j ( joint) полипептидная цепь, которая объединяет ( полимеризует) отдельные субъединицы (в составе пентамера IgM, ди- и тримера секреторного IgA).
Основные биологические характеристики антител.
1. Специфичность - способность взаимодействия с определенным (своим) антигеном (соответствие эпитопа антигена и активного центра антител).
2. Валентность- количество способных реагировать с антигеном активных центров ( это связано с молекулярной организацией- моно- или полимер). Иммуноглобулины могут быть двухвалентными ( IgG ) или поливалентными (пентамер IgM имеет 10 активных центров). Двух- и более валентные антитела навывают полными антителами. Неполные антитела имеют только один участвующий во взаимодействии с антигеном активный центр ( блокирующий эффект на иммунологические реакции, например, на агглютинационные тесты). Их выявляют в антиглобулиновой пробе Кумбса, реакции угнетения связывания комплемента.
3. Афинность - прочность связи между эпитопом антигена и активным центром антител, зависит от их пространственного соответствия.
4. Авидность - интегральная характеристика силы связи между антигеном и антителами, с учетом взаимодействия всех активных центров антител с эпитопами. Поскольку антигены часто поливалентны, связь между отдельными молекулами антигена осуществляется с помощью нескольких антител.
5. Гетерогенность - обусловлена антигенными свойствами антител, наличием у них трех видов антигенных детерминант:
- изотипические - принадлежность антител к определенному классу иммуноглобулинов;
- аллотипические- обусловлены аллельными различиями иммуноглобулинов, кодируемых соответствующими аллелями Ig гена;
- идиотипические- отражают индивидуальные особенности иммуноглобулина, определяемые характеристиками активных центров молекул антител. Даже тогда, когда антитела к конкретному антигену относятся к одному классу, субклассу и даже аллотипу, они характеризуются специфическими отличиями друг от друга (идиотипом). Это зависит от особенностей строения V- участков H- и L- цепей, множества различных вариантов их аминокислотных последовательностей.
Понятие о поликлональных и моноклональных антителах будет дано в следующих разделах.
Характеристика основных классов иммуноглобулинов.
Ig G. Мономеры, включают четыре субкласса. Концентрация в крови- от 8 до 17 г/л, период полураспада- около 3- 4 недель. Это основной класс иммуноглобулинов, защищающих организм от бактерий, токсинов и вирусов. В наибольшем количестве IgG- антитела вырабатываются на стадии выздоровления после инфекционного заболевания (поздние или 7S антитела), при вторичном иммунном ответе. IgG1 и IgG4 специфически (через Fab- фрагменты) связывают возбудителей (опсонизация), благодаря Fc- фрагментам IgG взаимодействуют с Fc- рецепторам фагоцитов, способствуя фагоцитозу и лизису микроорганизмов. IgG способны нейтрализовать бактериальные экзотоксины, связывать комплемент. Только IgG способны транспортироваться через плаценту от матери к плоду (проходить через плацентарный барьер) и обеспечивать защиту материнскими антителами плода и новорожденного. В отличие от IgM- антител, IgG- антитела относятся к категории поздних- появляются позже и более длительно выявляются в крови.
IgM.Молекула этого иммуноглобулина представляет собой полимерный Ig из пяти субъединиц, соединенных дисульфидными связями и дополнительной J- цепью, имеет 10 антиген- связывающих центров. Филогенетически это наиболее древний иммуноглобулин. IgM- наиболее ранний класс антител, образующихся при первичном попадании антигена в организм. Наличие IgM- антител к соответствующему возбудителю свидетельствует о свежем инфицировании (текущем инфекционном процессе). Антитела к антигенам грамотрицательных бактерий, жгутиковым антигенам- преимущественно IgM- антитела. IgM- основной класс иммуноглобулинов, синтезируемых у новорожденных и младенцев. IgM у новорожденных- это показатель внутриутробного заражения (краснуха, ЦМВ, токсоплазмоз и другие внутриутробные инфекции), поскольку материнские IgM через плаценту не проходят. Концентрация IgM в крови ниже, чем IgG- 0,5- 2,0 г/л, период полураспада- около недели. IgM способны агглютинировать бактерии, нейтрализовать вирусы, активировать комплемент, активизировать фагоцитоз, связывать эндотоксины грамотрицательных бактерий. IgM обладают большей, чем IgG авидностью (10 активных центров), аффинность (сродство к антигену) меньше, чем у IgG.
IgE. Представляет мономер, в сыворотке крови находится в низких концентрациях. Основная роль- своими Fc- фрагментами прикрепляется к тучным клеткам (мастоцитам) и базофилам и опосредует реакции гиперчувствительности немедленного типа. К IgE относятся “антитела аллергии”- реагины. Уровень IgE повышается при аллергических состояниях, гельминтозах. Антигенсвязывающие Fab- фрагменты молекулы IgE специфически взаимодействует с антигеном (аллергеном), сформировавшийся иммунный комплекс взаимодействует с рецепторами Fc- фрагментов IgE, встроенных в клеточную мембрану базофила или тучной клетки. Это является сигналом для выделения гистамина, других биологически активных веществ и развертывания острой аллергической реакции.
IgD.Мономеры IgD обнаруживают на поверхности развивающихся В- лимфоцитов, в сыворотке находятся в крайне низких концентрациях. Их биологическая роль точно не установлена. Полагают, что IgD участвуют в дифференциации В-клеток, способствуют развитию антиидиотипического ответа, участвуют в аутоиммунных процессах.
С целью определения концентраций иммуноглобулинов отдельных классов применяют несколько методов, чаще используют метод радиальной иммунодиффузии в геле (по Манчини)- разновидность реакции преципитации и ИФА.
Определение антител различных классов имеет важное значение для диагностики инфекционных заболеваний. Обнаружение антител к антигенам микроорганизмов в сыворотках крови- важный критерий при постановке диагноза- серологический метод диагностики. Антитела класса IgM появляются в остром периоде заболевания и относительно быстро исчезают, антитела класса IgG выявляются в более поздние сроки и более длительно (иногда- годами) сохраняются в сыворотках крови переболевших, их в этом случае называют анамнестическими антителами.
Выделяют понятия: титр антител, диагностический титр, исследования парных сывороток. Наибольшее значение имеет выявление IgM- антител и четырехкратное повышение титров антител (или сероконверсия- антитела выявляют во второй пробе при отрицательных результатах с первой сывороткой крови) при исследовании парных- взятых в динамике инфекционного процесса с интервалом в несколько дней- недель проб.
Реакции взаимодействия антител с возбудителями и их антигенами (реакция “антиген- антитело”) проявляется в виде ряда феноменов- агглютинации, преципитации, нейтрализации, лизиса, связывания комплемента, опсонизации, цитотоксичности и могут быть выявлены различными серологическими реакциями.
Динамика выработки антител. Первичный и вторичный иммунный ответ.
Вторичный иммунный ответ обусловлен формированием клеток иммунной памяти. Пример вторичного иммунного ответа- встреча с возбудителем после вакцинации.
Роль антител в формировании иммунитета.
Антитела имеют важное значение в формировании приобретенного постинфекционного и поствакцинального иммунитета.
1. Связываясь с токсинами, антитела нейтрализуют их, обеспечивая антитоксический иммунитет.
IgG принадлежит наибольшая роль в антитоксическом иммунитете, IgM- в антимикробном иммунитете (фагоцитоз корпускулярных антигенов), особенно в отношении грамотрицательных бактерий, IgA- в противовирусном иммунитете (нейтрализация вирусов), IgAs- в местном иммунитете слизистых оболочек, IgE- в реакциях гиперчувствительности немедленного типа.
Свойства активных центров антител. Реактивность иммуноглобулинов
Физиология:
Популярные разделы сайта:
Активный центр антитела. Антидетерминанта
Активным центром антитела называют участок молекулы, пространственно комплементарный детерминантной группе антигена (гаптена). Комплементарность (пространственное соответствие) активного центра антигенной детерминанте обеспечивает большое число нековалентных связей, возникающих между лигандом и образующими активный центр отрезками пептидных цепей антитела. Эти нековалентные связи стабилизируют комплекс. Хотя между детерминантной группой (гаптеном) и аминокислотными остатками в активном центре не возникают ковалентные связи, однако за счет большого числа слабых связей образуется относительно мало диссоциирующий комплекс. В силу этого равновесие в системе антиген-антитело сильно смещено вправо: Аг + Ат АгАт, где Аг — антиген, Ат — антитело.
Если принять во внимание, что антигены поливалентны, т. е. содержат в молекуле несколько идентичных детерминантных групп, а антитела как минимум бивалентны, становится очевидным второй важный фактор стабильности формирующихся комплексов антиген-антитело. Согласно второму закону термодинамики
F = H-TAS, где F — изменение свободной энергии системы в ходе реакции, Н — изменение энтальпии, или общей энергии, S—изменение энтропии (мера неупорядоченности системы). В ходе реакции антиген-антитело в силу взаимодействия по нескольким точкам возрастает роль энтропийного члена, поскольку в момент диссоциации по одной точке комплекс остается стабильным за счет связи по другим точкам. Подробнее термодинамические особенности реакции антиген-антитело рассматриваются ниже.
Активный центр, или антидетерминанта, представляет собой щель, расположенную между вариабельными доменами легкой и тяжелой цепей. Оба домена участвуют в формировании антидетерминанты. Вклад каждого из них не одинаков, о чем можно судить по сравнительному изучению антиген (гаптен)-связывающих свойств изолированной легкой цепи и амнноконцевои половины тяжелой цепи (Fab-фрагмент), выделенных из какого-либо антитела. Изолированные легкие цепи практически не связывают антиген (гаптен). Fd-фрагменты антител, растворимость которых повышена за счет карбоксиметилирования части аминогрупп монойодацетатом (А. Кульберг, И. Тарханова, 1968) или присоединения коротких цепочек полиаланина — полиаланилирования (J. С. Jaton et al., 1968), специфически связывают антиген или гаптен.
Однако связывающая способность Fd-фрагмента намного уступает таковой Fab-фрагмента и даже Fv-фрагмента.
История изучения строения антидетерминанты включает несколько этапов. Первый этап, начавшийся открытием Р. Портером (R. Porter) в 1958—1959 гг. Fab-фрагментов, увенчался доказательством выраженной структурной автономии участка молекулы, образующего активный центр: получен в изолированном виде низкомолекулярный фрагмент антитела, сохраняющий по крайней мере частично антигенсвязывающие свойства (А. Кульберг, И. Тарханова, 1962).
Размеры этого фрагмента (13 0004=1000) полностью совпадают с размерами изолированного домена, установленными Д. Инбаром (D. Inbar) с соавторами только в 1972 г. Важно подчеркнуть, что получить меньшие по размеру лигандсвязывающие фрагменты молекулы антитела невозможно. Но это стало понятно лидгь теперь, когда выяснилось, во-первых, что домен — очень компактное структурное образование, во-вторых, что в образовании антидетерминанты участвуют гипервариабельные участки, разбросанные по всей длине отрезка цепи, сформированного в вариабельный домен.
Научная электронная библиотека

Антитела (иммуноглобулины, ИГ, Ig) - это особый класс гликопротеинов (т.е. белков с присоединенных к ним углеводными остатками), присутствующих в сыворотке крови, тканевой жидкости или на клеточной мембране, которые распознают и связывают антигены. Иммуноглобулины синтезируются В-лимфоцитами (плазматическими клетками) в ответ на вещества определенной структуры - антигены. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных и нежелательных эндогенных объектов - например, бактерий и вирусов, опухолевых клеток и др. Они являются важнейшим фактором специфического гуморального иммунитета. Антитела выполняют две функции: антиген-связывающую и эффекторную (вызывают тот или иной иммунный ответ, например, запускают классическую схему активации комплемента).
Антитела синтезируются плазматическими клетками, которыми становятся В-лимфоциты в ответ на присутствие антигенов. Для каждого антигена формируются соответствующие ему специализировавшиеся плазматические клетки, вырабатывающие специфичные для этого антигена антитела. Антитела распознают антигены, связываясь с определённым эпитопом - характерным фрагментом антигена.
Антитела являются относительно крупными (~150 кДа для IgG) гликопротеинами, имеющими сложное строение. Антитела состоят из двух идентичных тяжелых цепей и из двух идентичных лёгких цепей, т.е.
фрагментов с меньшим и большим молекулярным весом (рис. 3). К тяжелым цепям ковалентно присоединены олигосахариды. При помощи протеазы папаина антитела можно расщепить на два Fab (англ. fragment antigen binding - антиген-связывающий фрагмент) и один Fc (англ. fragment crystallizable - фрагмент, способный к кристаллизации). Fab фрагменты называются также вариабельной областью антител, т.к. именно их строение определяет связывающую функцию Ат и варьируется в зависимости от структуры антигена. Fc фрагмент называется константной областью Ат, т.к. у особей данного вида для всех молекул Ат этот фрагмент является идентичным.
Рис. 5. Структура антител
В зависимости от выполняемых функций антитела могут существовать как в различных формах (классы иммуноглобулинов): мономерной (IgG, IgD, IgE, сывороточный IgA) или в олигомерной форме (димер-секреторный IgA, пентамер - IgM). Схематичное строение
Иммуноглобулины класса G (IgG) - основной иммуноглобулин сыворотки здорового человека, составляет 70-75 % всей фракции иммуноглобулинов. IgG наиболее активны во вторичном иммунном ответе и антитоксическом иммунитете. Являются единственной фракцией иммуноглобулинов, способной к транспорту через плацентарный барьер и тем самым обеспечивают иммунитет плода и новорожденного. IgG являются самыми небольшими молекулами по сравнению с другими классами Ig (молекулярная масса М = 146 кДа).
Иммуноглобулины класса А (IgA) содержатся в сыворотке (15-20 %
всей фракции Ig), в секреторном компоненте: слюне, слезах, молозиве, молоке, отделяемом слизистой оболочки мочеполовой
и респираторной системы. IgA представлены в виде мономеров (80 % в сыворотке), димеров (в секрете), и тримеров. Средняя молекулярная масса IgA М = 500 кДа.
Иммуноглобулины класса М (IgM) являются пентамерами IgG и составляют до 10 % фракции иммуноглобулинов. Появляются IgM при первичном иммунном ответе B-лимфоцитами на неизвестный антиген. IgM встроены в плазматическую мембрану B-лимфоцитов и выполняют роль антиген распознающего рецептора. Средняя молекулярная масса IgМ М = 970 кДа.
Иммуноглобулины класса Е (IgE) - мономеры. Их функция заключается в связывании с поверхностью базофилов и тучных клеток, с последующим присоединением к ним антигена, при этом происходит дегрануляцию и выброс в кровь гистамина и серотонина - медиаторов воспаления. IgE участвуют в защите от паразитарных инфекций, обуславливают многие аллергические реакции. М = 200 кДа.
Рис. 6. Классы иммуноглобулинов
Антитела также классифицируют по типу антигена и, соответственно, по выполняемым Ат функциям. По этому принципу можно выжделить несколько основных классов антител:
● Антиинфекционные или антипаразитарные антитела, вызывающие гибель или нарушение жизнедеятельности возбудителя инфекции либо паразита.
● Антитоксические антитела, не вызывающие гибели самого возбудителя или паразита, но обезвреживающие вырабатываемые им токсины, либо другие экзогенные токсические вещества.
● «Антитела-свидетели заболевания», наличие которых в организме сигнализирует о знакомстве иммунной системы с данным антигеном (возбудителем) в прошлом или о текущем присутствии этого антигена (возбудителя), но которые не играют существенной роли в борьбе организма с возбудителем (не обезвреживают ни самого возбудителя, ни его токсины, а связываются со второстепенными белками возбудителя).
● Естественные антитела - антитела к эндогенным соединениям, присутствующие в здоровом организме и выполняющие регулятор-
ные функции;
● Аутоагрессивные антитела, или аутологичные антитела, аутоантитела - антитела, способные образовываться из естественных антител и вызывающие разрушение или повреждение нормальных, здоровых тканей самого организма хозяина и запускающие механизм развития аутоиммунных заболеваний.
● Аллореактивные антитела, или гомологичные антитела, аллоантитела - антитела против антигенов тканей или клеток других организмов того же биологического вида. Аллоантитела играют важную роль в процессах отторжения аллотрансплантантов, например, при пересадке почки, печени, костного мозга, и в реакциях на переливание несовместимой крови.
● Гетерологичные антитела, или изоантитела - антитела против антигенов тканей или клеток организмов других биологических видов. Изоантитела являются причиной невозможности осуществления ксенотрансплантации даже между эволюционно близкими видами (например, невозможна пересадка печени шимпанзе человеку) или видами, имеющими близкие иммунологические и антигенные характеристики (невозможна пересадка органов свиньи человеку). К изоантителам относятся также вторичные (антивидовые) антитела, используемые в различных видах ИХМ.
● Антиидиотипические антитела - антитела против антител, вырабатываемых самим же организмом. Этот вид антител специфичен
к вариабельному участку антител, так называемому идиотипу. Антиидиотипические антитела играют важную роль в связывании и обезвреживании избытка антител, в иммунной регуляции выработки антител. Кроме того, антиидиотипическое «антитело против антитела» зеркально повторяет пространственную конфигурацию исходного антигена, против которого было выработано исходное антитело (рис. 5). И тем самым антиидиотипическое антитело служит для организма фактором иммунологической памяти, аналогом исходного антигена, который остаётся в организме и после уничтожения исходных антигенов. В свою очередь, против антиидиотипических антител могут вырабатываться анти-антиидиотипические антитела и т.д.
Читайте также:
- Варианты психотипов и их классификация
- Рентгенограмма, КТ, МРТ позвоночника при вариантах нормы
- Рентгенограмма, КТ, МРТ при периостальной хондроме
- Распределение финансирования во внебольничной медицине. Медицинская помощь пожилым с деменцией
- Лабораторные исследования хирургического больного. Инфузионная подготовка. Переливание крови и компонентов.
