Техника бокового экстраплеврального доступа (БЭПД) при опухоли грудного позвонка
Добавил пользователь Дмитрий К. Обновлено: 08.01.2026
Паравертебральная блокада - это лечебная манипуляция, выполняемая с целью полного купирования или снижения интенсивности болевого синдрома, локализующегося в области позвоночника.
Технически паравертебральные или околопозвоночные блокады - это введение определенной смеси препаратов в пораженную область. Если говорить просто - это обычная инъекция (укол), выполненная у позвоночника, около места выхода нервных корешков, позволяющая временно «отключить» болевой рефлекс, уменьшить отек вокруг нервного корешка и улучшить его питание.
Блокады сегодня являются одним из самых эффективных и популярных методов лечения, позволяющих избавиться от боли самым коротким и действенным путем.
Кроме того, процедура совмещает в себе функции не только обезболивания, но и профилактики появления сопутствующих заболеваний. При хроническом болевом синдроме наблюдается спазмирование мышц, что приводит к нарушению их нормального функционирования, появлению отечности, постоянного напряжения.
Таким образом, можно говорить о том, что блокада - это не просто избавление от боли, но и весьма эффективная лечебная мера против развития возможных паталогических состояний.
Преимущества блокады
Существует много методов обезболивания (локального или глобального), но далеко не все имеют преимущества, выгодно отличающие этот метод от других.
Максимальная близость инъекции к участку боли
Если обезболивающие лекарства попадают в организм через обычные внутримышечные инъекции, степень эффективности препарата снижается по причине «дальности» укола и более затяжной длительностью поступления лекарства к участку боли.
Быстрый обезболивающий эффект
Лекарство быстро проникает в область поражения, уменьшая прохождение болевого импульса по проводникам нервной системы.
Минимум побочных эффектов
Если обезболивающие препараты принимать перорально или проводить стандартные внутримышечные инъекции, лекарства сначала попадают в общий кровоток и гораздо позже (и не в полном объеме) доходят до места поражения. Кроме того, что часть препаратов оседает там, где не нужно, эффект обезболивания будет гораздо слабее.
Многократность проведения
Так как блокада обладает минимальными побочными эффектами, а терапевтический эффект при этом весьма выражен, процедуру можно повторять столько раз, сколько это будет необходимо в каждом конкретном случае.
Показания к проведению блокады
Паравертебральные блокады проводятся исключительно по врачебным показаниям. Решение о том, что вам необходима эта процедура, может принимать только ваш лечащий врач, ориентирующийся на результаты анализов и ваше состояние.
Существуют определенные заболевания и патологические состояния, наличие которых является показанием к проведению блокады:
Заболевания позвоночника:
- остеохондроз;
- радикулит;
- невралгия;
- люмбаго;
- миозиты;
- протрузия; ;
- ущемление периферического нерва.
Другие заболевания
- ;
- боли, связанные с отеком и воспалением нервного корешка;
- боли, возникающие при сдавлении нервного ствола (на фоне спазма мускулатуры).
Травмы позвоночника
Противопоказания
Главным противопоказанием к проведению процедуры является индивидуальная непереносимость препаратов, используемых в лекарственной смеси.
Кроме того, блокаду не проведут, если у пациента выявлены острые инфекционные заболевания, почечная, сердечно-сосудистая и печеночная недостаточность или заболевания центральной нервной системы.
Противопоказанием также является низкое кровяное давление, эпилепсия и беременность в любом триместре.
Проведение процедуры может быть отложено при выявлении повреждений кожного покрова и локальных инфекционных процессов до полного выздоровления.
Техника паравертебральной блокады
По сути, блокада представляет собой обычную инъекцию. Но, так как выполнение укола проводится в области позвоночника, процедуру должен выполнять только высококвалифицированный специалист.
В нашей клинике блокаду проводит врач-нейрохирург, доктор медицинских наук Фархат Файяд Ахмедович.
Паравертебральные блокады являются сегментарными блокадами, поскольку проводятся в определенный сегмент позвоночника (охватывающий «свой» участок кожи, соединительной ткани, мышцы и костной системы). В каждом таком сегменте «работают» свои нервные волокна, которые «переключаются» между собой и перекрестно влияют друг на друга. Именно это «перекрещивание» дает возможность при помощи вроде бы обыкновенного укола оказать яркий терапевтический эффект.
Проведение блокады основано на введении смеси препаратов в определенную точку - тот сегмент позвоночника, где боль проявляется наиболее остро.
1 этап. Подготовка
Кожа в области проведения укола обрабатывается антисептическими препаратами (как правило, это раствор этилового спирта и йода). Затем проводят анестезию - очень тонкой иглой делают несколько уколов справа и слева от определенных сегментов позвоночника, в месте локализации боли.
2 этап. Процедура
После того, как анестезия начнет действовать, осуществляется основная часть процедуры - при помощи достаточно толстой иглы (вы не почувствуете ее), вводится смесь лекарственных препаратов.
Препарат словно «обволакивает» нервный корешок, благодаря этому достигается нужный эффект - обезболивание, снятие отека и воспаления.
Основной целью процедуры является, конечно же, устранение болевого синдрома. Но блокада помогает добиться и других результатов — за счет расширения кровеносных сосудов улучшается кровоток и уменьшается отек нервного окончания.
При соблюдении всех правил и норм проведения процедуры, правил техники безопасности и асептики, блокада абсолютно безопасна и выполняет свою главную цель — купирование болевого синдрома.
Используемые препараты
При выполнении блокады используется анестетик (как правило, это раствор новокаина или лидокаина). Анестетик - это основной инструмент этого метода лечения, поскольку он обладает свойством временно подавлять возбудимость рецепторов, блокировать проведение импульса и, соответственно, снижать болевые ощущения.
Выбор и концентрация анестетика в каждом случае индивидуальны и зависят как от места, куда будет произведен укол, так и от степени болевого синдрома.
Кроме того, для повышения эффективности и увеличения лечебного эффекта к анестетикам добавляют специальные препараты — кортикостероиды, которые дают противовоспалительный и протиовоотечный эффект.
В качестве дополнительных лекарственных средств в смесь могут быть включены витамины группы «В», оказывающие нейротрофический (питательный) эффект, антигистаминные и сосудорасширяющие препараты.
Техника бокового экстраплеврального доступа (БЭПД) при опухоли грудного позвонка
отдел нейрохирургии и ортопедии Научного центра реконструктивной и восстановительной хирургии Сибирского отделения РАМН;
НУЗ Дорожная клиническая больница ОАО "РЖД", Иркутск
Научный центр реконструктивной и восстановительной хирургии Сибирского отделения РАМН, Иркутск;
ГБОУ ДПО "Иркутская государственная медицинская академия последипломного образования"
НУЗ Дорожная клиническая больница ОАО "РЖД", Иркутск
Кафедра госпитальной хирургии с курсом нейрохирургии Иркутского государственного университета
отдел нейрохирургии и ортопедии Научного центра реконструктивной и восстановительной хирургии Сибирского отделения РАМН
Хирургическое лечение дегенеративного стеноза на двух уровнях в грудном отделе позвоночника
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2015;(7): 93‑96
Среди дегенеративных заболеваний позвоночника поражение его грудного отдела встречается наиболее редко. Грыжи грудных межпозвонковых дисков (ГГМД) составляют менее 1% всех грыж позвоночного столба [5, 6]. Частота симптоматической ГГМД составляет 1:1 000 000 населения [7]. ГГМД встречается чаще у мужчин (3:1), пик заболеваемости приходится на возраст от 40 до 50 лет [4, 15]. 75% верифицированных ГГМД локализуются в нижних сегментах грудного отдела позвоночника [15]. Множественные симптоматические ГГМД встречаются крайне редко и могут вызывать тяжелые неврологические расстройства. С учетом анатомического строения грудного отдела позвоночника при ГГМД требуется проведение технически сложного оперативного лечения [14, 16]. В мировой литературе описано около 100 больных с верифицированными множественными ГГМД, оперированных различными способами [5, 6, 9].
Приводим собственное наблюдение.
Больной Г. направлен неврологом в нейрохирургическое отделение Дорожной клинической больницы на станции Иркутск-Пассажирский для проведения диагностических мероприятий и определения тактики лечения. При поступлении предъявляет жалобы на выраженные боли в грудном и умеренные боли в поясничном отделе позвоночника, иррадиирующие в нижние конечности, слабость и чувство онемения в нижних конечностях, невозможность передвигаться самостоятельно, а также частое, иногда затрудненное мочеиспускание. Боли в области нижнегрудного отдела позвоночника беспокоят в течение 3 лет. Не лечился, так как боли возникали периодически. Полгода назад появилась слабость в ногах при статистических и динамических нагрузках, боли усиливались. В покое слабость и боли проходили (синдром нейрогенной перемежающейся хромоты). Боли стали постоянными 3 мес назад, слабость в ногах прогрессировала, не позволяя ходить самостоятельно.
Больной обследован. При спондилографии грудного отдела позвоночника выявлен остеохондроз Th III —Th IV , II период, Th VIII —Th XII III период; данные MPT грудного отдела позвоночника: грыжи межпозвонковых дисков Th III —Th IV , Th IX —Th X , Th X —Th XI (рис. 1). При электронейромиографии нижних конечностей обнаружены выраженные изменения по аксональному типу в левом и правом малоберцовом нервах.
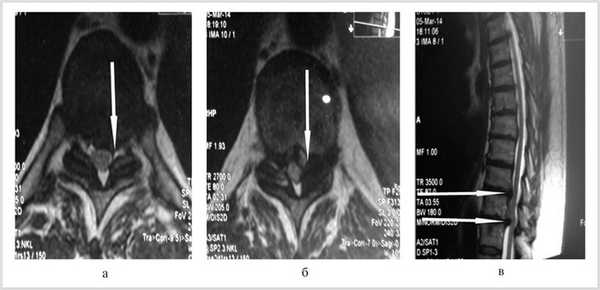
Рис. 1. Магнитно-резонансные томограммы грудного отдела позвоночника (Т1 режим): в аксиальной (а, б) и сагиттальной (в) плоскостях до операции.
Неврологический статус при поступлении: положение в постели лежа, анталгическое. Самостоятельно не передвигается вследствие нижнего спастического парапареза. Перкуссия остистых отростков грудного отдела позвоночника резко болезненна с уровня Th VII до верхнепоясничного отдела позвоночника. Коленные рефлексы справа и слева высокие, ахилловы справа и слева высокие. Вальгусная деформация обеих стоп. Клонус нижних конечностей. Симптом Бабинского положительный с обеих сторон. Рефлекс Бехтерева—Менделя положительный с обеих сторон. Мышечный тонус в руках нормальный, в ногах повышен по центральному типу. Сила в руках 5 баллов, в ногах снижена до 2 баллов с обеих сторон. Нарушения чувствительности в виде гипестезии от дерматома D и ниже. Тазовые нарушения по типу парадоксальной ишурии. Уровень болевого синдрома по визуальной аналоговой шкале 92 балла, по шкале Nurick 4 балла [1].
Локально: трофические нарушения (пролежни) в пяточной области с обеих сторон. Диагноз: остеохондроз грудного отдела позвоночника. Грыжи межпозвонковых дисков Th IX —Th X , Th X —Th XI со стенозированием позвоночного канала и сдавлением спинного мозга. Компрессионная миелопатия. Нижний спастический парапарез. Тазовые расстройства по типу парадоксальной ишурии. Трофические нарушения в виде пролежней в пяточных областях с обеих сторон.
Выполнена операция. В положении больного на правом боку под внутривенной анестезией с ИВЛ осуществлена типичная торакотомия по седьмому межреберью, переднебоковой доступ к телам позвонков Th IX —Th XI . Верификация уровня поражения С-дугой совместно с врачом-рентгенологом. Дискэктомия Th IX —Th X , Th X —Th XI с целью определения границ резекции тела позвонка и его мобилизации. С использованием кусачек и высокоскоростной дрели тело позвонка Th X фрагментировано, осуществлена микрохирургическая интраканальная декомпрессия спинного мозга на 270° в виде резекции костно-хрящевых узлов и оссифицированной задней продольной связки с устранением дискомедуллярного конфликта. При ревизии выявлено плотное сращение твердой мозговой оболочки с гипертрофированной оссифицированной задней продольной связкой и грыжами, а также выраженное увеличение эпидуральных вен. При микрохирургической декомпрессии отмечено обильное эпидуральное кровотечение, остановленное с использованием биполярной коагуляции, аппликации Surgicel fibrilar, пластины Тахокомб. Появилась отчетливая пульсация твердой мозговой оболочки. После рентгенологического контроля подобран размер протеза тела Th X . В последний интегрированы концевые пластины с углами наклона 5° краниально и 0° каудально (диаметр 24 мм) с целью восстановления угла наклона и предупреждения развития кифотической деформации грудного отдела позвоночника. С использованием фирменного инструментария выполнено эндопротезирование тела Th x дистракционным имплантатом Obelisc («Ulrich», Германия). Скелетированы боковые поверхности тел позвонков Тh IX и Тh XI , осуществлен корпородез пластиной Z-plate (75 мм; «Конкомет», Россия). Пластина фиксирована четырьмя блокирующимися винтами длиной 50 мм. На контрольных рентгенограммах стояние протеза, пластины, винтов правильное. Гемостаз. Плевральная полость герметизирована с оставлением активного дренажа. Рана послойно ушита.
После операции больному проводили антибактериальную, сосудистую, симптоматическую и витаминотерапию. В течение 2 нед болевой синдром в значительной степени регрессировал, постепенно увеличились сила и объем движений в нижних конечностях, частично восстановилась чувствительность, пролежни зажили в раннем постоперационном периоде. Больной активен, самостоятельно без посторонней поддержки встает и передвигается с ходунками, через 2 нед — без поддержки. При выписке в неврологическом статусе отмечена положительная динамика: коленные рефлексы справа и слева живые, ахилловы справа и слева живые. Отсутствие клонуса нижних конечностей. Симптомы Бабинского и Бехтерева—Менделя отрицательные с обеих сторон. Мышечный тонус в руках и ногах нормальный. Сила в руках 5 баллов, в ногах до 4 баллов с обеих сторон. Частичные нарушения чувствительности с уровня L4 с обеих сторон. Тазовые нарушения отсутствуют. Менингеальных симптомов нет. В послеоперационном периоде оценка по визуальной аналоговой шкале боли составила 30 баллов, по шкале Nurick — 3 балла, по шкале Макнаб — 3 балла [1].
Проведена МРТ (рис. 2): компрессия спинного мозга устранена. Больной переведен в неврологическое отделение для восстановительного лечения.
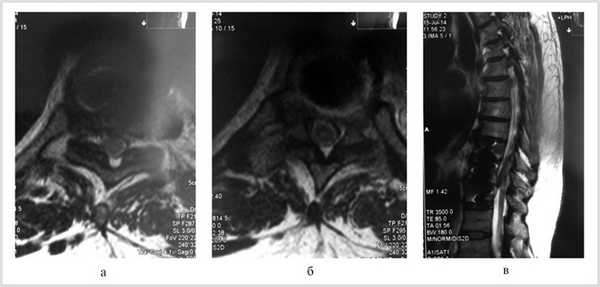
Рис. 2. Магнитно-резонансные томограммы грудного отдела позвоночника (Т1 режим): в аксиальной (а, б) и сагиттальной (в) плоскостях через 2 нед после операции.
Универсального хирургического доступа при множественных ГГМД нет, выбор доступа зависит от ряда факторов. Taк, C. Dickman и соавт. [11] сообщили о 15 повторно оперированных больных, которым ранее осуществлялись операции по поводу грыж грудных дисков. У 11 из них использованы заднебоковые доступы, у 1 — торакотомия, у 3 — торакоскопия. У 13 больных имелись центральные оссифицированные, у 2 — мягкотканные грыжи. У 12 пациентов грыжи были экстрадуральные, у 3 — интрадуральные. Повторная операция потребовалась вследствие неправильного определения уровня грыжи межпозвонкового диска, интраоперационного повреждения спинного мозга, неадекватной визуализации грыжи межпозвонкового диска, дислокации фрагмента диска в позвоночном канале или перидурально. Средний интервал между первой и повторной операцией составил 150 дней (от 1 дня до 4 лет). Эти данные позволяют судить о наиболее распространенных трудностях и ошибках при хирургическом лечении больных с ГГМД.
Описано несколько основных оперативных доступов при ГГМД. В настоящее время применяют задний (ламинэктомия), заднебоковой (костотрансверзэктомия, трансверзоартропедикулэктомия, транспедикулэктомия), боковой (боковая рахотомия, боковой доступ, боковой экстраплевральный), переднебоковой (трансторакальный трансплевральный) доступы [2].
Выбор оперативного доступа зависит от расположения грыжи (медиальная, парамедиальная, латеральная), степени компрессии спинного мозга, консистенции грыжи (оссифицированная, мягкотканная), гипертрофии задней продольной связки. Из перечисленных доступов трансторакальный дает возможность проведения максимально широкой передней декомпрессии без необходимости ретракции корешка или дурального мешка, тем самым обеспечивая безопасность в отношении содержимого позвоночного канала. Технические сложности такого доступа связаны с проведением широкого и травматичного торакального доступа, остеолигаментарной резекции для декомпрессии спинного мозга на нескольких сегментах, применением трансплантатов и имплантатов для последующего спондилодеза [8, 9, 11].
Таким образом, хирургическое лечение больных с грыжами грудного отдела позвоночника в настоящее время является технически трудным и зачастую осложняется усугублением неврологической симптоматики. Применение тщательного дооперационного обследования с уточнением расположения и консистенции грыжи межпозвонкового диска, выбор адекватных хирургических доступов, использование микрохирургических методик дают возможность улучшить результаты оперативных вмешательств у таких больных. В приведенном клиническом наблюдении использование микрохирургической техники позволило провести адекватную интраканальную декомпрессию и полностью резецировать грыжи межпозвонковых дисков и оссифицированную заднюю продольную связку с устранением диско-медуллярного конфликта, что обеспечило хороший клинический эффект, а адекватная стабилизация — возможность ранней активизации больного после вмешательства.
Работа выполнена при поддержке гранта Президента Российской Федерации СП-156.2013.4.
ООО Клиника спинальной нейрохирургии «Аксис»;
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
ФГБНУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко», Москва, Россия
ФГБУ "НИИ нейрохирургии им. акад. Н.Н. Бурденко" РАМН, Москва
ФГБУ "НИИ нейрохирургии им. акад. Н.Н. Бурденко" РАМН, Москва;
Отделение нейрохирургии Нижегородского научно-исследовательского института травматологии и ортопедии
ФГБНУ "НИИ нейрохирургии им. акад. Н.Н. Бурденко", РАМН, Москва
ФГАУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва, Россия
Первый МГМУ им. И.М. Сеченова, Москва
Экстрадуральная гемангиобластома спинного мозга (случай из практики и обзор литературы)
Журнал: Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2016;80(6): 88‑92
Гемангиобластома — редко встречающаяся сосудистая опухоль ЦНС, которая возникает спорадически, а также бывает ассоциирована с болезнью Гиппеля—Линдау. Гемангиобластомы составляют 2—6% от всех новообразований спинного мозга и занимают третье место в структуре интрамедуллярных объемных образований спинного мозга. Впервые в нашей практике мы столкнулись с паравертебральной гемангиобластомой, растущей по типу «песочных часов». В мировой литературе представлено всего 3 случая опухоли с таким вариантом роста.
Клинический случай
Пациентка Н., 56 лет, поступила в НИИ нейрохирургии им. акад. Н.Н. Бурденко 03.09.14 с жалобами на боль в пояснично-крестцовой области с иррадиацией в левую ногу, а также чувствительными расстройствами в виде гипестезии по задней поверхности левого бедра и голени. Из анамнеза известно, что боли в спине беспокоили пациентку длительное время, постепенно усиливаясь, со временем болевой синдром стал постоянным. Неоднократно проводилась медикаментозная терапия, направленная на лечение остеохондроза позвоночника, улучшение от которой не наступало. С 2006 г. боли усилились и стали возникать в покое, в положении и сидя, и лежа. В августе 2013 г. боль стала особенно интенсивной, консервативная терапия результатов по-прежнему не имела. Выполненная в этой связи МРТ пояснично-крестцового отдела позвоночника выявила экстрадуральное объемное образование с паравертебральным распространением на уровне L4—L5 позвонков в межпозвонковое отверстие слева. Образование было овальной формы размером 16×25×10 мм. Выполнена спинальная ангиография, на которой контрастировалась собственная сосудистая сеть объемного образования на уровне L4 позвонка (снимки не представлены). Пациентка была госпитализирована в нейрохирургическое отделение по месту жительства для хирургического лечения. Произведена неудачная попытка удаления опухоли. При гистологическом исследовании фрагмента полученного материала сделано заключение о ганглионевроме.
Через 12 мес после операции было выполнено контрольное МРТ-исследование, на котором выявлена та же МР-картина, что и перед операцией (рис. 1).
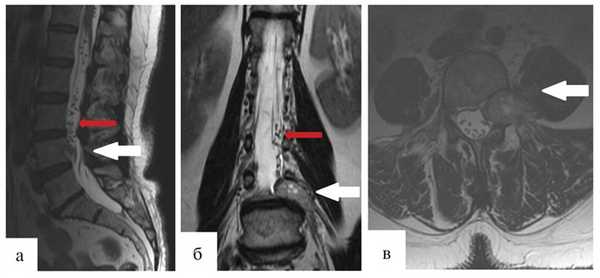
Рис. 1. Гемангиобластома корешка L4. На серии МРТ, выполненных в сагиттальной, фронтальной и аксиальной проекциях в режиме T2 (а, б, в), определяется экстрадурально расположенное гипоинтенсивное объемное образование на уровне L4—L5 позвонков с гиперинтенсивными очагами и паравертебральным ростом влево по типу «песочных часов» (опухоль указана белыми стрелками). В сагиттальной и фронтальной проекциях (а, б) обращает на себя внимание выраженная сосудистая сеть (указана красными стрелками), которой в Т2-режиме соответствуют множественные зоны гипоинтенсивного сигнала.
В НИИ нейрохирургии им. акад. Н.Н. Бурденко 11.09.14 проведено удаление экстрадуральной опухоли с паравертебральным ростом по типу «песочных часов» влево на уровне L4—L5 позвонков.
Операция
Положение пациентки на операционном столе: лежа на животе, в условиях комплексной анестезии с эндотрахеальной вентиляцией легких. Определение уровня локализации опухоли осуществлялось при помощи интраоперационного КТ-томографа O-arm (Medtronic), снимки выполнены в боковой и фронтальных плоскостях в 2D-режиме.
Разрез кожи осуществлен парамедианно слева в нескольких сантиметрах от рубца после предыдущей операции. Для осуществления доступа к опухоли использовался операционный микроскоп и ретрактор системы Caspar. Применение этого расширителя позволило минимизировать травму окружающих тканей. При помощи микрохирургических инструментов и высокооборотного бора Zimmer выполнена гемиламинэктомия слева на уровне дужки L4 позвонка. Визуализирована опухоль вытянутой формы, оранжевого цвета, размером 3×2 см. Опухоль располагалась в межпозвонковом отверстии L4—L5 и напоминала по форме невриному. Исходным местом роста определена экстрадуральная часть корешка L4 слева. В ходе выделения опухоли по периметру обнаружен крупный артериальный сосуд, питающий опухоль. Последний коагулирован и пересечен. На проксимальную часть опухоли и корешок была наложена лигатура, после чего опухоль и нервный корешок коагулированы и удалены единым блоком. В ложе удаленной опухоли уложен гемостатический материал (рис. 2). Рана закрыта по стандартной схеме.
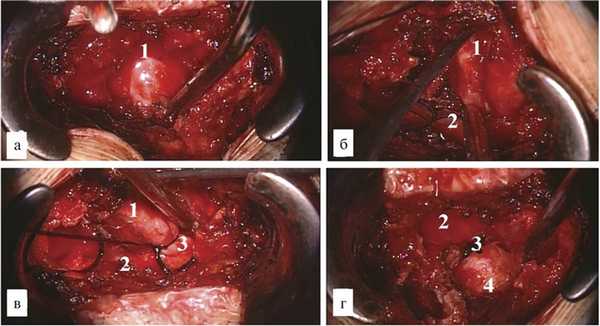
Рис. 2. Этапы операции. а, б — выделение и мобилизация солидной части опухоли; в — перевязка шейки опухоли корешка L4; г — удаление опухоли вместе с корешком. 1 — солидная часть, 2 — корешок L4, 3 — «муфта» корешка, 4 — ложе опухоли.
В послеоперационном периоде отмечен регресс болевого синдрома. Пациентка активизирована на 1-е сутки после операции. Спустя 7 дней больная в удовлетворительном состоянии выписана домой. Гистологический диагноз: гемангиобластома. Через 3 мес после проведенной операции выполнено контрольное МРТ-исследование (рис. 3).
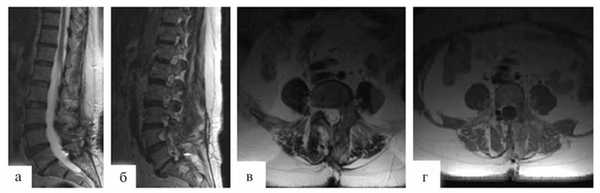
Рис. 3. МРТ, выполненные в сагиттальной и аксиальной проекциях в режиме T2 (а, б, в, г). Состояние после радикального удаления гемангиобластомы.
Гистологическая характеристика опухоли
Гистологическое исследование (рис. 4) подтвердило микроскопический диагноз гемангиобластомы. Опухоль построена из двух типов клеток: стромальные клетки с оптически пустой цитоплазмой и большое количество сосудистых клеток. Опухоль окружена тонким слоем фиброзной ткани, к которой тесно прилежат фрагменты нервной ткани и скопления ганглиозных клеток (рис. 5).
Рис. 4. Гемангиобластома. Стромальные клетки с оптически пустой цитоплазмой (указано красной стрелкой) и сосудистые клетки (указано синей стрелкой). Окраска гематоксилином и эозином, ув. ×200. Рис. 5. Гемангиобластома (указано красной стрелкой) и скопления ганглиозных клеток (указано зеленой стрелкой). Окраска гематоксилином и эозином, ув. ×100.
Во время исследования был обнаружен прилежащий нервный стволик (рис. 6), такую же находку описывают R. Pluta и соавт. [2].
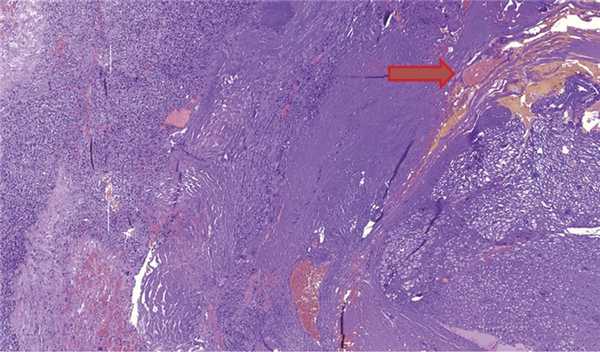
Рис. 6. Гемангиобластома и прилежащий нервный стволик (указан стрелкой), Окраска гематоксилином и эозином, ув. ×50.
Сравнительный анализ результатов хирургического лечения гемангиобластом
Гемангиобластома спинного мозга относится к группе высоковаскуляризированных опухолей, чаще локализующихся интрамедуллярно. Гемангиобластомы составляют 2—6% от всех новообразований спинного мозга и занимают третье место в структуре интрамедуллярных объемных образований спинного мозга [1]. В нашем случае опухоль располагалась паравертебрально, росла по типу «песочных часов», не имела связи с твердой мозговой оболочкой. В мировой литературе [2—4] нами найдены наблюдения о трех пациентах с подобной локализацией объемного образования. В таблице представлены некоторые сведения об этих пациентах, в частности, клинический статус и результаты хирургического лечения (наблюдения № 1—3) в сопоставлении с описываемым нами случаем (наблюдение № 4).

Обзор публикаций о хирургическом лечении корешковых гемангиобластом спинного мозга Примечание. ЭД — экстрадуральное расположение, ПЧ — опухоль по типу «песочных часов», БС — болевой синдром, РБС — радикулярный болевой синдром, СН — сенсорные нарушения, МН — моторные нарушения, НФТО — нарушение функции тазовых органов.
При оценке сведений, представленных в таблице, видно, что были определенные отличия по клинической картине заболевания. Так, в наблюдении № 3 было отмечено острое начало заболевания, когда сильный болевой синдром развился в течение 2 нед, после чего пациентка была госпитализирована в нейрохирургический стационар. В двух других наблюдениях (наблюдения № 1 и 2), так же как и у нашей пациентки (наблюдение № 4), имелся длительный анамнез от 2 до 20 лет. Основными проявлениями опухоли являлась радикулопатия, проявляющаяся болевым синдромом в пояснично-крестцовом отделе позвоночника с иррадиацией в ногу, а также расстройствами чувствительности по корешковому типу. В наблюдении № 3 имелось нарушение функций тазовых органов (недержание мочи), возможно, за счет компрессии корешков «конского хвоста».
Из таблицы видно, что клинико-рентгенологическое обследование лишь в одном случае (наблюдение № 1) позволило предположить до операции правильный гистологический диагноз, чему способствовало то обстоятельство, что у этого пациента с болезнью Гиппеля—Линдау выявлялись множественные гемангиобластомы ЦНС. В 2 случаях (наблюдения № 2 и 3) на дооперационном этапе, по данным МРТ-исследования, был поставлен предположительный диагноз: нейрогенная опухоль — невринома (шваннома) корешка. В нашем случае (наблюдение № 4) опухоль расценивалась как гангионеврома L4 корешка с паравертебральным ростом, так как после первой операции по месту жительства был поставлен соответствующий гистологический диагноз.
После проведенного нами анализа рентгенологических данных можно сделать следующие выводы. Во-первых, все исследования должны проводиться с контрастным усилением. Во-вторых, обнаружение патологически расширенных извитых сосудов в пределах позвоночного канала вокруг новообразования является патогномоничным признаком гемангиобластомы. Лучше всего сосуды визуализируются в Т2-режиме. В-третьих, солидный компонент опухоли имеет гипо- или изоинтенсивный МР-сигнал в Т1-режиме, а кистозные полости имеют сходный с ликвором сигнал в Т1- и Т2-режимах, или более яркий сигнал в режиме Т2. Выявление хотя бы одного из этих перечисленных МРТ-признаков дает основание предполагать опухоль сосудистого ряда и может быть рекомендовано выполнение селективной ангиографии [4, 5].
Оценивая исходы хирургического лечения, отметим, что во всех четырех наблюдениях (см. таблицу) опухоли были удалены радикально. При этом произошел регресс болевого синдрома. Не осложнением, а неизбежным следствием операции следует считать возможное возникновение незначительного неврологического дефицита, так как чаще всего опухоль удаляется вместе с корешком, из которого она исходит.
Гемангиобластома экстрамедуллярной локализации — достаточно редкая патология, поэтому стандартов для их удалении не существует. В своей практике мы впервые встретились с экстрадуральным расположением гемангиобластомы, поэтому технику микрохирургического удаления применяли как для удаления опухолей, растущих по типу «песочных часов». К сожалению, перед хирургическим этапом мы не провели эмболизацию питающего сосуда опухоли, в результате при выделении паравертебральной части новообразования, выходящей за пределы межпозвонкового отверстия, получили кровотечение из питающего опухоль сосуда — корешковой артерии. Кровотечение было успешно остановлено с помощью биполярной коагуляции.
Вторым этапом выделили полюса опухоли, при этом сохранили расширенные дренирующие вены опухоли, что считаем обязательным. Гемангиобластомы хорошо инкапсулированы и легко отделяются от окружающих тканей. Проведение манипуляций внутри капсулы опухоли опасно из-за возможного выраженного кровотечения, которое, как правило, трудно контролируется и может полностью перекрыть все поле зрения. Следующим этапом мы выделили часть опухоли, прилегающую к оболочке; на корешок, входящий в строму опухоли, наложили лигатуру для предотвращения ликвореи из «муфты» корешка. В нашем случае отделить гемангиобластому от корешка не представлялось возможным ввиду плотного сращения последних между собой. Поэтому гемангиобластома была удалена вместе с корешком L4. Несмотря на пересечение корешка, в послеоперационном периоде отрицательной симптоматики в виде нарастания слабости в мышцах левой ноги не наблюдалось. После удаления опухоли образовалось глубокое ложе, которое мы тщательно обследовали, останавливая кровотечение из мелких сосудов. Гемостаз в такой ситуации необходимо осуществлять с помощью гемостатических материалов, не прибегая к биполярной коагуляции.
Выводы
Гемангиобластома экстрадуральной локализации является очень редкой патологией, однако при обнаружении МРТ-признаков, характерных для сосудистого образования, необходимо проводить дообследование, которое может включать КТ-перфузионное исследование, а также в случае необходимости, проведение селективной ангиографии. При выявлении гемангиобластомы с четко дифференцированными питающими сосудами желательно проведение эмболизации для снижения риска интраоперационного кровотечения.
Технология удаления экстрадуральных геман-гиобластом, на наш взгляд, существенно не отличается от операций, выполняемых при других опухолях, растущих преимущественно паравертебрально по типу «песочных часов».
Конфликт интересов отсутствует .
Комментарий
Гемангиобластома — это богатая сосудами доброкачественная опухоль, состоящая из скопления тонкостенных сосудов различного калибра, интерстициальные клетки которой содержат обилие липидов в цитоплазме. Спинальные гемангиобластомы в абсолютном большинстве случаев располагаются интрамедуллярно и составляют 2—8% всех интрамедуллярных образований, уступая эпендимомам и астроцитомам. Спинальные гемангиобластомы составляют до 20% всех гемангиобластом ЦНС. В редких случаях эти опухоли могут располагаться экстрамедуллярно, а в исключительных случаях даже экстрадурально. Несмотря на преимущественное расположение опухоли в пределах ЦНС, гистологической связи образования с глиальной тканью не получено. Это объясняет встречаемость патологии не только в пограничной зоне между центральной и периферической частью нервной системы (экстрамедуллярные интрадуральные гемангиобластомы, как правило, связаны с дорзальной поверхностью спинного мозга или интрадуральной порцией заднего корешка), но и на отдалении. В литературе имеются описания гемангиобластом лучевого и седалищного нер-вов.
Наблюдения экстрамедуллярного расположения опухолей крайне редки, что усложняет выбор правильной диагностики и хирургической тактики данной патологии.
В представленной авторами статье описаны клиническая картина, алгоритм диагностики и предоперационной подготовки пациентов с экстрадуральными гемангиобластомами с учетом имеющихся литературных данных. Отдельное внимание уделено хирургической технике удаления опухолевого узла.
Статья представляет несомненный интерес для широкого круга нейрохирургов.
Удаление опухоли спинного мозга
Опухоли спинного мозга разделяют на несколько групп в зависимости от их расположения:
- Экстрадуральные - расположены в позвоночном канале над мозговой оболочкой, как правило, это вторичные опухоли: метастазы из других органов, инфильтрация злокачественными клетками при лейкозах и т.д.;
- Интрадуральные экстрамедуллярные опухоли - развиваются в тканях твердой мозговой оболочки без прорастания тканей спинного мозга. Чаще всего это доброкачественные образования, но их быстрый рост может привести к компрессии спинного мозга и ряду неврологических расстройств.
- Интрадуральные интрамедуллярные - опухоли из тканей самого спинного мозга. Встречаются довольно редко, могут быть как злокачественными, так и доброкачественными.
Симптомы
Первыми симптомами новообразований спинного мозга могут быть болевые ощущения, двигательные или чувствительные расстройства. Проявления зависят от расположения опухоли и ее размера. Поэтому при любых болях в спине, особенно если они возникают на фоне имеющегося онкологического заболевания, нужно обратиться к врачу. При выявлении новообразования чаще всего принимается решение об удалении опухоли спинного мозга.
Диагностика
Для диагностики применяются:
- ;
- КТ позвоночника с контрастом;
- электромиография;
- биопсия;
- миелография;
- исследование цереброспинальной жидкости.
Лечение
В качестве медикаментозного лечения назначаются кортикостероиды. Если присутствует сдавление спинного мозга, то лечение необходимо начинать как можно скорее.
Хорошо локализованные опухоли можно удалять хирургически. Если опухоль нельзя удалить, применяют лучевую терапию с возможной декомпрессией. Экстрадуральные метастазы, вызывающие сдавление спинного мозга, обычно удаляют из тела позвонка, затем проводят лучевую терапию. Метастатические экстрадуральные опухоли, которые не сдавливают спинной мозг, можно лечить только лучевой терапией, но если лучевая терапия не помогает, то необходимо проведение операции.
Техника операции
Основной метод лечения новообразований спинного мозга - хирургический. Операция показана при неэффективности лучевой терапии или при сдавлении спинного мозга. Удаление опухоли спинного мозга приводит к восстановлению его функций и исчезновению симптомов заболевания. Технология операции выбирается в зависимости от размера и расположения опухоли. Операция в среднем продолжается 2-4 часа.
Вмешательство может быть радикальным - когда опухоль иссекается полностью, либо паллиативным. Радикальное удаление возможно при отсутствии прорастания опухолью спинного мозга и его корешков. Если опухоль интрамедуллярная, то полностью удалить такое образование, не повредив спинной мозг технически невозможно. В таких случаях хирургическим путем добиваются декомпрессии (устранение сдавления) мозга, восстановления циркуляции спинномозговой жидкости и снятия симптомов. Доступ к опухоли производится путем ламинэктомии - удаления дужки позвонка либо с помощью эндоскопической техники.
Все вмешательства на спинном мозге проводятся с электро-нейромиографическим контролем. Этот современный метод визуализации позволяет отличить опухолевую ткань от нервной, и избежать повреждения спинного мозга. Операция без использования инновационных технологий контроля может привести к развитию тяжелых неврологических осложнений в послеоперационном периоде.
Удаление опухоли спинного мозга возможно только в специализированных медицинских центрах, оснащенных оборудованием надлежащего уровня и при наличии опытных высококвалифицированных специалистов. Только использование современных методик позволяет добиться восстановления работоспособности пациента и исчезновения симптомов сдавления спинного мозга: болей, парезов, параличей, недержания мочи, нарушений чувствительности.
Техника проведения операций при образованиях средостения. Общие принципы
Большинство новообразований средостения оперируют, производя боковую торакотомаю или полную срединную стернотомию. Срединную стернотомию выбирают при струме и опухолях вилочковой железы. В тех случаях, когда струма средостения связана с шейным, прибегают к шейно-медиастинальному доступу. Оперативное вмешательство начинают на шее разрезом по Kocher и, если не удается извлечь и экстирпировать струму из шейного доступа, шейный разрез продолжают вниз и производят срединную стернотомию. Встречаются гигантские опухоли, прорастающие в обе плевральные полости, при них приходится производить поперечную стернотомию с двухсторонней торакотомией. Такого рода доступ связан со значительным нарушением дыхательной функции, поэтому желательно избегать его.
Опухоли и кисты, находящиеся в среднем и заднем средостении, а также вблизи от диафрагмы, лучше всего оперировать при боковом доступе, производя стандартную торакотомию. В зависимости от расположения того или иного образования разрез производят кпереди или кзади. С этим связан и выбор соответствующего межреберья. Небольшие доброкачественные опухоли и кисты можно легко удалять и из аксиллярного доступа; при этом щадятся мышцы грудной стенки.
Эксплорация и экстирпация опухоли
После выделения опухоли средостения пальпируют ее. При ощущении флуктуации можно предположить, что это киста средостения. Следует быть осторожным, чтобы не принять аневризму за другое образование средостения. Тератомы, лимфангиомы, лимфомы и некоторые разновидности саркомы иногда имеют смешанную структуру (содержат твердые, жидкие и замазковидные части). В некоторых опухолях пальпируются плотные участки кальцифицированной ткани (дермоидные кисты, тератомы, лимфомы). Если жидкое содержимое находится под сильным напряжением, киста может лопнуть. Нередко вылущивание опухоли затруднено из-за ее больших размеров. В таком случае киста тщательно и осторожно выделяется, а затем ее пунктируют и жидкое содержимое отсасывают. Место пункции зашивают или лигируют. Подозрение на наличие аневризмы (сходное расположение, пульсация) проверяют, производя пробную пункцию тонкой иглой. Отсутствие крови при пункции еще не исключает возможности аневризмы, которая может быть заполнена слоистым организовавшимся тромбом!
Прежде чем перейти к экстирпации опухоли, необходимо произвести осмотр и топографически сориентироваться в отношении связи опухоли с окружающими органами (большими сосудами, перикардом, легким, бронхами, средостением, нервами и спинно-мозговым каналом). Идя сверху вниз, разъединяют окружающую опухоль (кисту) медиастинальную плевру. Нередко при этом проникают в район прохождения трех основных нервных стволов (в заднем средостении — симпатическая цепочка, в средней части средостения — блуждающий нерв, а в переднем — диафрагмальный нерв). Эти нервные стволы необходимо щадить. Доброкачественные опухоли и кисты окружены капсулой, хорошо дифференцированной от окружающих тканей. Их можно легко выделить, отпрепарировать и удалить. Некоторые из злокачественных опухолей прорастают в окружающие ткани; это обстоятельство во многом определяет операбильность данного процесса. Часть перикарда, диафрагмы или легкого может быть удалена вместе с опухолью. Проникновение опухоли в крупные сосуды, сердце и грудную стенку онкологически означает инкурабильность, даже в тех случаях, когда в техническом отношении экстирпация опухоли возможна. В связи с многообразием опухолей средостения следует особо рассмотреть специальные вопросы операционной техники.
Специальная техника операции
Эндоторакальная медиастинальная струма
Примерно в 5% случаев струмы средостения находят истинную эндоторакальную струму (автономную струму), исходящую из эмбриональных зачатков щитовидной железы в средостении. В большинстве случаев медиастинальная струма является загрудинным продолжением шейной части щитовидной железы. Щитовидная железа может быть без особого перехода в виде монолитного конгломерата соединена с загрудинной частью. Встречаются случаи, когда шейная часть струмы только в той или иной степени соединена отшнуровавшимся перешейком от ее грудной части, или даже эта отшнурованная часть выглядит как тонкий шнурок, связующий перешеек (struma endolhoracica falso).
Сравнительно нередко в этих случаях после струмэктомии, произведенной на шее, возникает «медиастинальный рецидив». 7% медиастинальных струм злокачественны (Merlier, Eschapasse, 1973). Малигнизация не имеет внешних характерных проявлений. Сильное сдавливание окружающих органов (например, полой вены) не является типичным, оно может быть вызвано и доброкачественной опухолью. Крупная доброкачественная опухоль средостения, подтвержденная гистологически, включившись в верхнюю апертуру грудной клетки, вызывает сдавливание ветвей верхней полой вены и значительное повышение венозного давления. Расширенные вены создают характерную коллатеральную сеть. При ангиографии полой вены эта коллатеральная сеть отчетливо видна.
Для удаления эндоторакальной струмы можно выбрать как срединную стернотомию, так и комбинированный шейно-медиастинальный доступ. Иногда начинают со срединной стернотомии, выделяют и отделяют струму от окружающих тканей, а затем, после закрытия стернального разреза, удаляют ее через шейный доступ. Мы, однако, придерживаемся мнения о целесообразности обратного порядка оперативного вмешательства. Все более и более часто приходится встречаться с тем обстоятельством, что, начиная операцию на шее, удается извлечь струму, располагающуюся глубоко в средостении, иногда до бифуркации трахеи, так что необходимость в стернотомии отпадает.
Основной опасностью при такой операции является возможность повреждения больших вен. Струма отодвигает левую плечеголовную вену (безымянную вену) кпереди и поднимает ее в вентральном направлении. Уже во время проведения стернотомии следует думать о том, что эта вена расположена сразу за грудиной. Правая плечеголовная (безымянная) вена отодвигается струмой вправо, при этом она сильно изгибается и образует дугу того же направления. При выделении струмы легко повреждаются расширенные и извитые венозные коллатерали. Нижняя щитовидная артерия может простираться далеко вглубь средостения вдоль шейного и медиастинального ложа через перемычку, соединяющую эти два отдела струмы.
Струма, опускаясь от шеи в средостение, простирается впереди больших сосудов (преваскулярно), редко сзади этих сосудов (ретроваскулярно). Как правило, струма асимметричной формы, так как с левой стороны дуга аорты ограничивает ее распространение. Поэтому чаще всего наибольшая часть струмы располагается справа от грудины. Она нередко кольцом охватывает торакальную часть трахеи и распространяется между трахеей и пищеводом. При мобилизации ретроваскулярно расположенной струмы можно легко повредить проходящий справа возвратный нерв, который проходит вокруг подключичной артерии в месте ее выхода из плече-головного ствола.
После окончания оперативного вмешательства ложе, в котором располагалась струма, дренируют, присоединяя дренаж к отсосу. При срединной стернотомии дренаж выводят через эпигастрий. При шейном доступе дренаж выводят на шее, а при шейно-медиастинальном комбинированном вмешательстве дренирование производят как на шее, так и в эпигастрии.
Аденома эпителиальных телец в 20% всех случаев локализуется в передне-верхнем средостении (Derra, 1961). В тех случаях, когда хирург, несмотря на характерную симптоматику, не находит аденому эпителиальных телец на шее, он должен искать ее в средостении и произвести срединную стернотомию.
Опухоли вилочковой железы
В хирургии переднего средостения вилочковая железа играет важную роль. Вилочковая железа обуславливает развитие различных доброкачественных, злокачественных и кистозных новообразований. Опухоли вилочковой железы примерно в 70% случаев связаны с тяжелой миастенией. Однако значительно чаще можно наблюдать миастению без опухоли вилочковой железы. В таком случае миастения протекает на фоне гиперплазии вилочковой железы. Тимэктомия производится и в этих случаях, если медикаментозное лечение не дает результатов.
Вилочковая железа простирается от вырезки грудины до верхних границ перикарда. В горизонтальном направлении эта железа доходит до линий прохождения диафрагмальных нервов. Обе доли железы расположены позади грудины довольно симметрично. Наиболее удачным доступом служит срединная стернотомия, независимо от того, по каким показаниям проводится тимэктомия (опухоль вилочковой железы или ее гиперплазия, миастения). К передней поверхности вилочковой железы проходят сосуды из внутренней грудной артерии и вены. Эти сосуды пересекаются после их перевязки. Затем в обе стороны отодвигают плевру, приподнимают нижний полюс железы и шаг за шагом мобилизуют железу по направлению снизу вверх. От задней поверхности вилочковой железы идут один или два мощных венозных ствола, впадающих с каждой стороны в соответствующие плече-головные вены. После их перевязки и пересечения дальнейшее выделение и удаление гиперплазарованной железы или доброкачественной тимомы происходит без особых трудностей. Исходящая из вилочковой железы лимфосаркома или карцинома, как правило, иноперабильна. Лучевая терапия в каждом подобном случае не должна оставаться без внимания, независимо от того, будет ли удаляться вилочковая железа или нет.
Нейрогенные опухоли
В заднем средостении чаще всего встречаются нейрогенные опухоли. По своей локализации они распространяются от купола плевры до диафрагмы. Опухоли, исходящие из корешков спинного мозга и межреберного нерва, располагаются обычно в реберно-позвоночном углу и в зависимости от строения являются нейриномами или нейрофибромами. Опухоли корешков спинного мозга частично растут внутрь спинномозгового канала, частично же распространяются в средостение. поэтому их называют опухолями в форме песочных часов. Несколько кнаружи от места локализации таких опухолей располагаются ганглионейромы и симпатикобластомы, исходящие из симпатической цепочки и блуждающего нерва.
Операция производится обычно из бокового доступа (стандартная торакотомия), но возможен и аксиллярный доступ. На ощупь опухоль плотная и сращена со своим основанием. После вскрытия медиастинальной плевры над опухолью эту опухоль препарируют и обходят со всех сторон тупым и острым путем, вплоть до основания, где находят ножку опухоли. В этой ножке проходит нерв, из которого исходит опухоль и питающие сосуды. После перевязки ножки опухоли ее пересекают и опухоль удаляют.
Для экстирпации опухоли, имеющей форму песочных часов, приходится расширять межпозвоночное отверстие костным инструментом, чтобы подойти, к той части опухоли, которая расположена рядом со спинномозговым каналом. Если перед операцией на основании симптоматологии и соответствующих исследований (миелография) ставится диагноз опухоли в форме песочных часов, то оперативное вмешательство можно производить и при положении больного на животе. Производят гемиляминэктомию, вскрывают спинномозговой канал и экстраплеврально, удлиняя разрез в сторону средостения, удаляют целиком всю опухоль.
Кисты средостения
Кисты, происходящие из передней кишки
Впервые недели эмбриональной жизни развиваются кисты из передней кишки. Эти кисты связаны с трахеей или с бронхом и снабжены реснитчатым эпителием (трахеальные или бронхиальные кисты). Ткани другой группы этих кист напоминают стенку кишечного тракта (гастроэнтерогенные кисты). Они расположены в средней части верхнею средостения, реже — в средней части нижнего средостения. После вскрытия кисты отсасывают ее творожисто-слизистое содержимое и производят осмотр. Если киста полностью отграничена от воздухоносных путей, ее удаление не представляет особых трудностей. Если же эта киста соединяется с дыхательными путями только посредством тонкой ножки, то, прежде чем удалить кисту, ножку выделяют и перевязывают. Нередко, однако, трахея или бронх соединяются с кистой широким основанием. Полость кисты отделяется от просвета трахеи или бронха только тонкой, перфорированной мембраной. При сдавливании такого рода кисты мембрана сильно выпячивается кпереди, через нее может выступать и воздух. В таких случаях из стенки кисты формируют створчатный лоскут, пришивают его к мембране, фиксируя затем частыми швами к интактному краю трахеи.
Кисты мезотелиального происхождения. Кисты мезотелиального происхождения являются частыми образованиями, локализующимися в нижнем средостении и исходящими из перикарда. Полностью отшнурованный канал или канал диаметром 2-3 см соединяет эту кисту с полостью перикарда (дивертикул). В обоих случаях кисты заполнены перикардиальной жидкостью. Так как эти кисты обычно рыхло связаны с окружающими их тканями, то их удаление не представляет особых трудностей. Если речь идет о т.н. дивертикуле, то его ножку только перевязывают.
Околоперикардиальные липомы
Околоперикардиальные липомы могут находиться в любой части нижнего средостения. Чаще всего они исходят из околоперикардиальной жировой клетчатки. Второй тип этой опухоли имеет отношение к диафрагмальным грыжам; по происхождению и локализации их трудно отличить от грыж грудино-реберного пространства. Околоперикардиальные липомы могут достигать чрезвычайно больших размеров и даже претерпевать саркоматозное перерождение. Если липома плотно сращена с перикардом, следует вскрыть полость перикарда и осмотреть ее изнутри. При необходимости вместе с опухолью удаляют и соответствующую часть перикарда. При выделении опухоли следует прежде всего следить за тем, чтобы не были повреждены диафрагмальный нерв и сопровождающие его перикардио-диафрагмаль-ные артерия и вена.
Медиастинальные лимфомы (туберкуломы)
Локализация медиастинальных лимфом и трудности их экстирпации являются характерными и типичными. Эти опухоли располагаются в области между трахеей, непарной веной и верхней полой веной. Творожистое содержимое опухоли просвечивает через медиастинальную плевру и имеет своеобразный желтый цвет. Опухоль связана с окружающими тканями Рубцовыми сращениями. При экстракапсулярном (радикальном) удалении опухоли можно повредить трахею, главный бронх, непарную вену и даже верхнюю полую вену. Чтобы избежать такого рода осложнений, вскрывают капсулу туберкуломы, удаляют ее творожистое содержимое ложечкой Volkmann, после чего шаг за шагом удаляют стенку туберкуломы в тех пределах, которые позволяют не повредить расположенные рядом органы.
Следует придерживаться этого правила и особенно предохранять от повреждения крупные сосуды, в частности верхнюю полую вену, сращенную с опухолью (туберкуломой, хондромой, саркомой и т. д.). Для этой цели зажимом Safinsky или Derra сращенный участок сосуда выключается из кровотока. Если это невозможно, то сосуд выделяют вне опухоли и на его центральную (интраперикардиальную) и периферическую части накладывают турникетные держалки. На турникетах производится временное пережатие сосуда, и если при удалении опухоли произошло повреждение его стенки, то поврежденная часть ушивается. Чтобы полая вена не была сужена, можно применить лоскутную пластику. Если опухолевый процесс привел к сдавливанию верхней полой вены, то может встать вопрос о шунте «by-pass»: о наложении шунта между периферическим отрезком верхней полой вены и правым ушком сердца. Для такого шунта используются аутовенозный участок подкожной вены бедра или синтетический сосудистый протез.
Читайте также:
- Почечная недостаточность у женщин и мужчин: симптомы, лечение, профилактика
- Болезни экспансии нестабильных повторов: механизмы развития, классификация
- Характеристика возбудителя ботулизма. Механизмы развития ботулизма
- Алюминий и кадмий в стоматологии. Влияние алюминия и кадмия на здоровье
- Техника, этапы операции ограниченного артродеза при болезни Мюллера-Вайсса
