Болезни экспансии нестабильных повторов: механизмы развития, классификация
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
К болезням экспансии относятся наследственные заболевания, обусловленные динамическими мутациями. В основе динамических мутаций лежит нестабильность микро- и минисателлитных повторов ДНК, локализованных в значимых областях генов. При болезнях экспансии наблюдается превышение (экспансия) определенного порогового уровня числа повторяющихся элементов в месте локализации динамической мутации. Подобные экспансии сопровождаются нарушениями работы гена, причем конкретные механизмы этих нарушении различны для разных типов динамических мутаций. Различия определяются, главным образом, двумя факторами: функциональной значимостью того участка гена, где расположен нестабильный повтор, а также характером и функциями самого повтора.
В настоящее время насчитывается более 20 болезней экспансии, подавляющее большинство из них связаны с экспансией тринуклеотидных повторов. Это синдром Мартина-Белл (синдром фрагильной или ломкой Х-хромосомы), миотоническая дистрофия, атаксия Фридрейха, целая серия спиноцеребеллярных атаксий, хорея Гентингтона и ряд других. Болезни экспансии могут быть аутосомными или Х-сцепленными в зависимости от локализации мутантного гена. Механизмы патогенетического действия динамических мутаций зависят от расположения и специфики экспансированного повтора, а тяжесть течения заболевания определяется длиной экспансии (числом повторов). При тяжелых формах заболевания идентифицируются более длинные повторы.
Практически для всех заболеваний, обусловленных динамическими мутациями, характерно поражение головного мозга и особенно подкорковых структур. Поэтому болезни экспансии представляют особую значимость для неврологии. Однако клиническая картина при различных болезнях экспансии достаточно разнообразна. Болезни экспансии имеют много общих особенностей, касающихся не только клинической картины поражения, но механизмов возникновения динамических мутаций, а также молекулярных и биохимических основ патогенеза этих заболеваний.
Для многих болезней экспансии характерны следующие особенности наследования (1) доминантный или полудоминантный характер, (2) антиципация - нарастание тяжести течения заболевания в ряду поколений и (3) геномный импринтинг. Дифференциальный характер поражения при разных болезнях экспансии, в первую очередь, определяется функциями белков, являющихся первичными биохимическими дефектами, а также различиями в тканеспецифической экспрессии соответствующих генов. Остановимся более подробно на некоторых из этих заболеваний.
Синдром Мартина-Белл
Впервые динамические мутации были идентифицированы в гене FRAXA, мутантном при синдроме Мартина-Белл или синдроме ломкой (фрагильной) Х-хромосомы.
В клинической картине этого сцепленного с полом заболевания ведущим симптомом является интеллектуальный дефект различной степени выраженности (IQ 13-75) в сочетании с поведенческими, лицевыми и соматическими аномалиями. У большинства больных встречаются психопатические и речевые нарушения в виде двигательной расторможенности, признаков аутизма, персевераций, эхола-лии. В 10-15% случаев наблюдается судорожный синдром. В соматическом статусе пациентов с синдромом Мартина-Белл нередко отмечаются долихоцефалия, макроцефалия, выступающий лоб, удлиненное лицо, крупные, выступающие («оттопыренные») ушные раковины, эпикант, светлые радужки, нос с клювовидным кончиком, массивный подбородок, крупные кисти и стопы, гипермобильность суставов, макроорхизм. Последний признак, особенно четко выявляемый в постпубертатном периоде, является высокоинформативным симптомом и наряду с умственной отсталостью входит в «фенотипическое ядро» синдрома.
Синдром описан в 1943 году J. Martin и J. Bell. Наиболее существенным в изучении этиологии этого заболевания явилось цитогенетическое исследование. При культивировании лимфоцитов больных мужчин в среде, лишенной фолата, в них обнаруживаются цитогенетические изменения в виде перетяжек района 27-28 длинного плеча Х-хромосомы. Данный цитогенетический феномен получил название фрагильности (ломкости) Х-хромосомы, и он служит цитогенетическим маркером заболевания - marXq28. Распространенность синдрома Мартина-Белл в общей популяции составляет 1:2000 среди лиц мужского пола, то есть это вторая по встречаемости форма умственной отсталости после синдрома Дауна. Для синдрома Мартина-Белл характерны варьирующая экспрессивность, неполная пенетрантность и полудоминантный характер наследования. В ряде семей прослежена передача мутантного аллеля через мужчин, так называемых нормальных трансмиттеров, не имеющих выраженных клинических признаков болезни или имеющих очень стертые формы неспецифической умственной отсталости. Они составляют 20% среди мужчин, несущих мутантный аллель в гене FRAXA (иногда его обозначают как FMR1).
Рисунок 5. Больной синдромом Мартина-Белл.
У 85% матерей больных детей IQ не превышает 85, причем уровень снижения интеллекта коррелирует с экспрессией цитогенетического маркера заболевания (marXq28). У 40% облигатных гетерозигот наблюдаются типичные лицевые особенности, более выраженные у взрослых, чем у детей, а также неровные зубы и гипермобильность суставов пальцев. При этом гетерозиготные женщины, получившие мутантный аллель от фенотипически нормального отца-трансмиттера, всегда интеллектуально сохранны. В первичных культурах лимфоцитов таких женщин отсутствуют клетки с фрагильными сайтами или имеется очень небольшой их процент. В отличие от этого, у больных мальчиков следующего поколения интеллект значительно снижен, и количество лимфоцитов с перетяжками в области Xq27-28, в среднем, составляет 29%. Третья особенность наследования синдрома Мартина-Белл заключается в геномном импринтинге, следствием которого является антиципация заболевания при прохождении мутантного аллеля через женский гаметогенез. Эти особенности наследования заболевания получили название парадокса Шермана.
Открытие в начале 90-х годов гена, ответственного за синдром Мартина-Белл (FRAX), и расшифровка молекулярной природы идентифицированных у больных мутаций позволили полностью объяснить парадокс Шермана. Оказалось, что в промоторной области гена FRAX расположен нестабильный тринуклеотидный повтор CGG. В норме количество CGG-триплетов не превышает 40. У больных это число может увеличиваться до 1000, причем, как правило, увеличение происходит в два этапа. Сначала появляется аллель с числом повторов в диапазоне от 40 до 50 - премутация, который чаще всего и присутствует у нормальных трансмиттеров. При прохождении этого нестабильного повтора через оогенез может происходить дальнейшее достаточно резкое нарастание числа CGG-копий с образованием мутации.
При экспансии CGG-повтора наблюдается различная степень метилирования промотора гена FRAX, что и приводит к снижению уровня его транскрипции. У пациентов с мягкими формами заболевания наблюдается мозаицизм по метилированию промоторной области гена. Мутантный аллель, по-видимому, неметилирован у нормальных мужчин-трансмиттеров, метилирован только в неактивной Х-хромосоме у их дочерей и полностью метилирован у большинства больных сыновей этих дочерей. У некоторых из них наблюдается мозаичная картина по характеру метилирования.
Миотоническая дистрофия
Вскоре вслед за тем, как была расшифрована природа молекулярного дефекта при синдроме Мартина-Белл, было показано, что в основе развития миотонической дистрофии лежит другая динамическая мутация - экспансия CTG-повтора, локализованного в З'-нетранслируемой области гена DM.
Ген DM расположен в области 19ql3.2-3. CTG-повтор в 3 ? -нетранслируемой области гена DM отличается крайней нестабильностью. В норме число триплетов варьирует в пределах от 5 до 30-37. У больных миотонической дистрофией количество CTG-триплетов значительно больше и составляет не менее 50 при наиболее мягких формах болезни, от 100 до 1000 у пациентов с классическим течением и дебютом во взрослом возрасте, в то время как при врожденных формах заболевания оно может достигать 3000. Начальным шагом, предрасполагающим к мутационному событию, является увеличение числа CTG-повторов от 5 до 19-30. Частота этого гетерогенного класса повторов в популяции достигает 10%, и, по-видимому, эти аллели составляют резерв для повторного мутирования. Аллели, связанные с относительно небольшими экспансиями обладают высокой мейотической нестабильностью, что и объясняет наблюдаемую антиципацию. Наиболее вероятным патогенетическим механизмом миотонической дистрофии является локальное нарушение структуры хроматина в области локализации удлиненного CTG-повтора, которое может приводить к инактивации не только гена DM, но и, возможно нескольких других соседних генов. Не исключено, что именно с этим связан высокий плейотропизм заболевания - одновременное вовлечение в патологический процесс нескольких систем.
Много букв про много букв: Болезни экспансии тринуклеотидных повторов
В основном, наследственные генетические болезни характеризуются однократной мутацией в гене или генах. К таким заболеваниям относят, например, митохондриальные болезни, болезни соматических клеток и другие. Болезни, о которых мы сейчас будем говорить, характеризуются несколько иными мутациями - динамическими. Под словом «динамические» подразумевается то, что с каждым поколением возрастает число копий этих самых тринуклеотидных повторов. Число этих повторов прямо пропорционально тяжести заболевания и обратно пропорционально возрасту начала заболевания. Здесь же мы сталкиваемся с таким термином, как антиципация (нарастание тяжести течения заболевания в ряду поколений, усугубление течения наследственных заболеваний от одного поколения к другому). Прежде чем говорить о самих болезнях, стоило бы поговорить о молекулярных механизмах, лежащих в основе этих заболеваний.
Механизмы
- ДНК-Полимераза сталкивается с прямым повтором и реплицирует его.
- ДНК-полимераза приостанавливает свою работу по какой-либо причине (отсутствие нужного нуклеотида, например).
- Происходит отделение вновь синтезированной цепочки, и на ней образуется «шпилька» из повторов.
- ДНК-Полимераза возобновляет свою работу, но из-за образовавшейся шпильки повторяет введение дезоксирибонуклеотидов в позиции, к которым присоединила их до этого. Именно этот механизм лежит в основе экспансии тринуклеотидных повторов , . Смотри Рис. 1.
Болезни, вызываемые экспансией тринуклеотидных повторов.
В первую очередь следовало бы поговорить о самой известной и уже упомянутой выше болезни - Хорея Гентингтона.
Хорея Гентингтона - одно из самых тяжелых прогрессирующих нейродегенеративных наследственных заболеваний головного мозга. Хорея (chorea; от греческого слова "choreia" - пляска) - форма гиперкинеза, характеризуется непроизвольными, быстрыми, нерегулируемыми движениями, возникающими в различных мышечных группах. Для этого заболевания выяснено соотношение числа повторов CAG в гене IT-15 . Этот ген кодирует белок гентингтин, наибольшая концентрация которого обнаружена в ЦНС. Функция его неизвестна, но многие исследования подтверждают его участие в таких процессах, как взаимодействие с транскрипционными факторами, везикулярный транспорт, заякоривание цитоскелета, а также предотвращение апоптоза в нейронах . Увеличение числа повторов триплетов CAG (Рис. 3), кодирующих аминокислоту глутамин, приводит к образованию полиглутаминовой последовательности - из-за этого происходит неправильное сворачивание белка гентингтина, тем самым, приводит к нарушению всех функций, где участвует этот белок . Рис. 3. Соотношение количества повторов CAG с тяжестью заболевания. По типу наследования Хорея Гентингтона является аутосомно-доминантным заболеванием. Болезнь Гентингтона поражает специфические области мозга. Наиболее заметные ранние изменения затрагивают область базальных ганглиев, называемую полосатым телом, которое состоит из хвостатого ядра и скорлупы . Другие повреждаемые области включают: чёрную субстанцию, 3, 5 и 6 слои коры головного мозга, гиппокамп, клетки Пуркинье в мозжечке, боковые туберальные ядра гипоталамуса и часть таламуса (Рис. 4). Рис. 4. Слева - пораженный Хореей Гентингтона мозг Симптомы. Первичная манифестация заболевания может произойти в любом возрасте, но чаще всего первые симптомы появляются в возрастном промежутке от 35 до 40 лет. Основным клиническим признаком на ранних этапах является хорея, которая проявляется неконтролируемыми и беспорядочными движениями. Изначально развивается по типу незначительных нарушений координации с внезапными, не поддающимися контролю движениями. Эти движения могут быть как резкими, так и замедленными. В последующем к данным признакам присоединяются симптомы нарушения речи, проблемы с процессом глотания и жевания. Из-за постоянного подергивания и нарушения тонуса мышц человек гримасничает, больной испытывает проблемы со сном. Также хотелось бы добавить, что с экспансией повторов CAG связана не только болезнь Гентингтона, но и другие нейродегенеративные заболевания: болезнь Кеннеди (спинобульбарная мышечная атрофия), болезнь Мачадо-Джозефа (спиноцеребеллярная атрофия типа 3).
Синдром Мартина-Белла (синдром ломкой X-хромосомы)
Развитие данного заболевания связано с увеличением числа повторов CGG в гене FMR1 (fragile X mental retardation 1). Белок, кодируемый этим геном, отвечает за нормальное когнитивное развитие . Также этот белок связывается со многими мРНК, отвечающими за синаптическую передачу. При увеличении числа повторов CGG происходит сначала уменьшение экспрессии белка FMR1 (состояние премутации), а затем транскрипционный сайленсинг гена: происходит метилирование участков CGG, а также промотора гена FMR1, гипоацетилирование ассоциированных гистонов и конденсация хроматина (Рис. 5). Рис. 5. Как предполагают, аномальное метилирование промотора гена FMR1 является причиной формирования сайта ломкости Х хромосомы (сайта, где с большей вероятностью произойдет разрыв). Обычно на таких сайтах образуются уже знакомые нам шпильки, которые либо препятствуют, либо замедляют репликацию. Синдром является X-сцепленным доминантным заболеванием с неполной пенетрантностью. Симптомы. Проявления могут быть от легких - отставания в обучении, задержки психомоторного развития до более серьезных когнитивных (или умственных) расстройств, приводящих к умственной отсталости. Также есть определённые фенотипические признаки: большая голова с высоким и широким лбом, длинное лицо с увеличенным подбородком, несколько уплощённая средняя часть лица, тупой, слегка клювовидно загнутый кончик носа. Уши большие, иногда оттопыренные, низко расположенные. Кисти и стопы широкие, дистальные фаланги пальцев также широкие, суставы имеют повышенную подвижность. Кожа нередко гиперэластична. Часто встречаются светлоокрашенные радужные оболочки, светлые волосы. Не обязательно встречаются все признаки — могут быть один или несколько. Возможно даже развитие аутизма. Наблюдается также гипотония (Рис. 6). Рис. 6. Ребенок с Синдромом Мартина-Белла.
Заключение
Эффективное лечение болезней экспансии тринуклеотидных повторов пока еще не разработано, однако уже есть потенциальные идеи, как эти болезни победить. Создание лекарств оказалось достаточно трудоемким, поэтому ученые обратили свое внимание на генную терапию - сайленсинг мутантных генов путем использования системы CRISPR/Cas9 , антисмысловых олигонуклеотидов и РНК-интерференции . Каждый из этих методов имеет свои достоинства и недостатки в лечении различных болезней экспансии тринуклеотидных повторов. Главным испытанием для них пока еще остается доставка в клетки in vivo. Но нужно сказать, что и в этой области наблюдается прогресс . Автор: Станислав Груздев
X Международная студенческая научная конференция Студенческий научный форум - 2018

Болезни экспансии тринуклеотидных повторов -это патологическое увеличение числа копий внутригенных тандемных последовательностей, состоящих из 3-х нуклеотидов; этот тип мутаций называется также динамическими мутациями.
Основной механизм возникновения мутаций — пробуксовывание (проскальзывание) при репликации. Случаются такие пробуксовки тогда, когда в зоне репликации оказываются тандемные повторы. В общем и целом этот процесс проходит в четыре стадии:
ДНК-Полимераза сталкивается с прямым повтором и реплицирует его.
ДНК-полимераза приостанавливает свою работу по какой-либо причине (отсутствие нужного нуклеотида, например).
Происходит отделение вновь синтезированной цепочки, и на ней образуется «шпилька» из повторов.
ДНК-Полимераза возобновляет свою работу, но из-за образовавшейся шпильки повторяет введение дезоксирибонуклеотидов в позиции, к которым присоединила их до этого. Именно этот механизм лежит в основе экспансии тринуклеотидных повторов [1]
Болезнь Гентингтона (синдром Гентингтона, хорея Гентингтона или Хантингтона) — генетическое заболевание нервной системы, характеризующееся постепенным началом обычно в возрасте 30—50 лет и сочетанием прогрессирующего хореического гиперкинеза и психических расстройств. Заболевание вызывается умножением кодона CAG в гене HTT. Ген HTT, присутствующий у всех людей, кодирует белок хантингтин (Htt). Ген HTT расположен на коротком плече 4-й хромосомы (4p16.3). [] Этот ген содержит в себе участок с повторяющейся последовательностью трёх азотистых оснований — цитозин-аденин-гуанин. Этот ген кодирует 350-kDa белок хантингтин с неизвестной функцией. В гене дикого типа (не мутантного) у разных людей присутствует разное количество CAG-повторов, однако, когда число повторов превышает 36, развивается болезнь. Нейроморфологическая картина характеризуется атрофией стриатумa, а на поздней стадии также атрофией коры головного мозга.
Частота встречаемости заболевания среди населения с европейскими корнями составляет примерно 3-7:100000, и 1:1000000 среди остальных рас
С момента появления первых симптомов продолжительность жизни составляет около 15—20 лет.Смерть обычно происходит не из-за болезни Хантингтона, а из-за сопутствующих ей осложнений, включая пневмонию, заболевания сердца и травмы. Частой причиной смерти является суицид.
Для проведения генетической диагностики болезни Хантингтона необходим забор крови с последующим определением количества повторов ЦАГ в каждом НТТ-аллеле . Положительный результат не подтверждает диагноз, поскольку может быть получен за несколько лет до появления первых симптомов. Однако отрицательный результат однозначно свидетельствует об отсутствии вероятности развития болезни Хантингтона
Болезнь Хантингтона неизлечима, но существует лечение, способное облегчить некоторые симптомы.[4]
Синдром Синдром Мартина-Белл (ломкой Х-хромосомы)
Развитие синдрома связано с экспансией единичных тринуклеотидов (ЦГГ) в Х-хромосоме и приводит к недостаточной экспрессии белка FMR1, который необходим для нормального развития нервной системы. Мутация гена FMR1 приводит к подавлению транскрипции белка FMR1. У здоровых индивидов FMR1, как считают, регулирует значительную популяцию мРНК: FMR1 играет важную роль в обучении и запоминании, а также принимает участие в развитии аксонов, формировании синапсов, появлении и развитии нервных связей.
Первым признаком, который заставляет заподозрить заболевание, является макроорхизм (увеличение размеров яичек) при отсутствии эндокринной патологии. Также есть определённые фенотипические признаки: большая голова с высоким и широким лбом, длинное лицо с увеличенным подбородком, несколько уплощённая средняя часть лица, тупой, слегка клювовидно загнутый кончик носа. Уши большие, иногда оттопыренные, низко расположенные. Кисти и стопы широкие, дистальные фаланги пальцев также широкие, суставы имеют повышенную подвижность. Кожа нередко гиперэластична. Часто встречаются светлоокрашенные радужные оболочки, светлые волосы. Не обязательно встречаются все признаки — могут быть один или несколько.
Неврологическая симптоматика неспецифична, определяется как и у всех детей с умственной отсталостью. Наблюдается некоторая мышечная гипотония, дискоординация движений. Также могут быть глазодвигательные, пирамидные и экстрапирамидные нарушения.
Распространённость непосредственно заболевания — приблизительно 1 из 4000 мужчин и 6000 женщин
Синдром ундины (врожденный центральный гиповентиляционный синдром) (ССHS)— редкое аутосомно-доминатное заболевание, характеризующееся отсутствием автономного контроля над процессом дыхания при отсутствии нервно-мышечных, лёгочных, кардиологических заболеваний или поражения ствола мозга. Впервые данное заболевание описано в 1970-х годах. Заболевание обусловлено мутацией в гене РНОХ2В в локусе 4р12. Описано два вида мутаций: экспансия триплетных повторов GCN (более 25 повторов) и экспансия триплетов, несвязанных с полиаланином. Число повторов триплетов и степень их экспансии коррелирует со степенью тяжести заболевания. Характер наследования аутосомно-доминантный с неполной пенетрантностью. Чаще заболевание обусловлено мутацией de novo, однако описаны семейные случаи. Первые симптомы заболевания как правило появляются сразу после рождения. В случае более мягких форм заболевание может дебютировать в более позднем детском или зрелом возрасте. Кроме того, существует форма заболевания (синдром ROHHAD), при которой помимо гиповентиляции отмечаются гормональные нарушения (ожирение, обусловленное дисфункцией гипоталамуса, гиповентиляцией и вегетативной дисфункцией). При данном заболевании нарушение автономного контроля дыхания приводит к неадекватному ответу на гиперкапнию и гипоксию. Во время бодрствования дыхание сохранно, однако во время сна наблюдается гиповентиляция с нормальной частотой дыхания и поверхностным дыханием во сне. В тяжёлых случаях гиповентиляция присутствует и во время бодрствования, и во время сна. Часто имеются физиологические и анатомические проявления генерализованной дисфункции автономной нервной системы: нарушение регуляции автономной нервной системы, нарушение развития структур, исходящих из «нейрального гребня», нейрокристопатии. Нейрокристопатии включают болезнь Гиршпрунга (врожденный аганглиоз кишечника), ассоциированную с синдромом ундины в 16% случаев.
Синдром ундины неизлечим и не отвечает на лекарственную терапию. Единственный доступный способ борьбы с ним — искусственная вентиляция лёгких. В первые месяцы после рождения ребёнку необходима постоянная вспомогательная вентиляция. Выполняется трахеостомия и СРАР-терапия. На первом году жизни возможно использование вспомогательной вентиляции только во время сна. В возрасте старше 18 месяцев — имплантация стимулятора диафрагмального нерва. [2]
Список литературы:
Острейков И.Ф. Врождённый центральный гиповентиляционный синдром (клинический случай синдрома Ундины) / И.Ф. Острейков, Ю.Ю. Соколов, Ю.Л. Мизерницкий, С.И. Козлова, В.Н. Шеин, А.Л. Заплатников, В.В. / /«Земский врач» №2, 2012.
Gellibolian, R. СTG Triplet Repeats Associated with Neurodegenerative Disease / R. Gellibolian, A. Bacolla, R.G. Wells // Biol. Chem. 1998, 273:5204-5210.
Болезни экспансии тринуклеотидных повторов, механизмы развития, формы и особенности их наследования(БТЭП)
Болезни экспансии тринуклеотидных повторов представляют собой обширную группу наследственных болезней, обусловленных «динамическими мутациями» или увеличением копий тандемных тринуклеотидных повторов в регуляторной или кодируемой части генов. Установлено, что некоторые гены в норме содержат определенное число тринуклеотидных повторов(ТНП), варьирующих в популяции от нескольких десятков до нескольких сотен. Заболевание возникает в том случае, когда количество тринуклеотидных потовров в гене превысит определенный критический уровень(порог). Процесс возникнвения и становления динамических мутаций носит двуступенчатый характер. На первом этапе происходит увеличение количества ТНП выше нормального для популяции уровня.Для одних заболеваний характерно увеличение количества ТНП в процессе мейотического деления женских половых клеток(овогенез), других-в процессе сперматогенеза, третьих-без наличия такой зависимости. На начальном этапе мутационного процесса возникают гены, содержащие повышенное по сравнению с нормой количество ТНП, без развития болезни. Это состояние называется «премутацией». Гены,содержащие премутацию, характеризуются нестабильностью, что в ряде случаев приводит к дальнейшему увеличению количества ТНП,возникновению полной мутации и развитию болезни. Одним из механизмов возникновения «динамических мутаций» может быть нарушение функции ДНК-полимеразы в процессе репликации ДНК в митозе или мейозе.
Клинико-генетич хар-ка БТЭП:
1) Антиципация или более тяжелое течение болезни из поколения поколение в одной семье, проявляющаяся более ранним началом, быстрым прогрессированием, более тяжелыми проявлениями болезни у потомков пораженных
2) Корреляция между тяжестью клинических проявлений болезни и количеством ТНП в различных семьях и у больных в одной и той же семье
3) Парадокс Шермана-возможность увеличения кол-ва больных в каждом последующем поколении в зав-ти от того, кто из родителей передал мутантный ген
В зав-ти от различий в причинах и механизмах развития БТЭП делятся на:
1) 1 группа-болезни,возникающие в рез-те экспансии ЦАГ-повторов,синтезирующих глутамин в кодирующей части гена. Кол-во повторов от 40 до 80.
2) 2 группа-болезни,обусловленные экспансией ТНП в регуляторной части гена.Кол-во повторов от нескольких сотен до нескольких тысяч.
Болезни геномного импритинга (БГИ)
БГИ представляют собой группу наследственных болезней с неменделевским типом наследования, обусловленных феноменом геномного импритинга, означающим проявление активности генов только отцовского или только материнского происхождения. Геномный импритинг-это эпигенетический процесс, приводящий к стойким функциональным различиям экспрессии гомологичных генов, полученных от одного из родителей. Для большинства известных генов характерна двухаллельная экспрессия отцовских и материнских генов.Моноаллельная экспрессия-это когда экспрессируется только отцовский или только материнский аллель, при этом другой аллель оказывается функционально инактивным. Импритинговые гены локазализованы в 7,11,15 хромосомах и возможно в 2,3,6,14,20 хромосомах. Они оказывают влияние на массу плода, степень развития плаценты и другие параметры внутриутробного развития.
Болезни геномного импритинга развиваются вследствие:
1)однородительской дисомии(ОРД)-присутствие у больного двух хромосом с импритинговыми участками, полученного от одного из родителей. У больных выявляется нормальный кариотип(46 хромосом), но одна из пар получена от одного из родителей.
2)хромосомные перестройки в импритинговых участках
3)точковые мутации в генах импритингового региона
4)делеции в области импритинговых центров
Пример-Синдром Прадера-Вилли(СПВ) возникает в случае ОРД 15 хромосомы матер происхождения.Признаки болезни выявляются с момента рождения: мышечн гипотония, трудности вскармливания, малая масса при рождении
Пример-Синдром Энгельмана(СЭ) обусловлен ОРД 15 хромосомы отцовского происхождения. Заболевание хар-ся задержкой психомоторного развития, олигофренией, недоразвитием речи, начинают поздно ходить и своеобраз походка.
Прионные болезни
Прионные болезни-группа болезней, выделенных в самост нозологическую единицу в последние годы. Причины их возникновения являются генетические и средовые факторы(инфекции).Клинические проявления прионных болезней связаны с поражением отделом нервной системы.Наследственный характер выявлется в 15-20% всех случаев прионных болезней. Ген прионного белка локализуется в коротком плече 20 хромосомы, содержит т.п.н. и 2 экзона. В настоящее время идентифицировано 20 мутаций этого гена: точковые мутации и инсерции. Инсерции хар-ся увеличением кол-ва повторов, состоящих из 8 аминокислот.Мутации приводят к синтезу аномальных форм белка с нарущением их функции. Достаточно 1 молекулы аномального прионного белка для запуска патогенетич механизмов болезни. Выделяются 2 формы патологич белка PrPSC и PrP27-30.Основные наследственные формы прионных болезней-болезни Крейтцфельда-Якобсона, Гертсманна-Штреусслера-Шейнкера и фатальная семейная инсомния.Наследственные ПБ развиваются поздно(45-75 лет), быстро прогрессируют и заканчив смертью через 6 месяцев. Основные клинич признаки-прогрессирующая деменция, атаксия, эпилептич приступы, снижение остроты зрения, парезы и параличи. Диагностика основана на молек-генетич анализе ДНК больных и идентификации типа мутаций.
55)Генетический полиморфизм-это одно из важных свойств популяции. Генетическим полиморфизмом называется присутствие в популяции нескольких генотипов. Например, наследование групп крови в системе АВО, половой диморфизм.Генетическое разнообразие объсняется непррывным влиянием различных факторов на генофонд. Различают балансированный и адаптационный полиморфизм. Балансированный полиморфизм направлен на сохранение гетерозиготных особей. Адаптационный полиморфизм связан с действием факторов окружающей среды, при котором сохраняется тот или иной генотип. Генетический полиморфизм-это итог генетич процессов, соверш на всех уровнях организации- от молек до популяц. Генетический полиморфизм-это генетическое многообразие состояния здоровья, множественность генетических условий устойчивости и потенц предрасположенности к множеству заболеваний.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
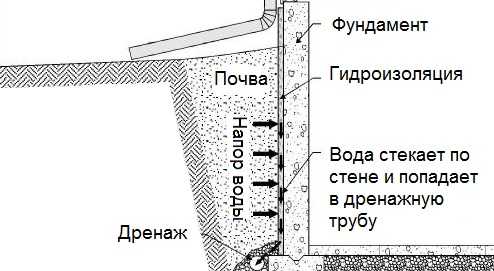
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
© cyberpedia.su 2017-2022 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав
Болезнь Паркинсона - симптомы и лечение
Что такое болезнь Паркинсона? Причины возникновения, диагностику и методы лечения разберем в статье доктора Поляковой Татьяны Акимовны, невролога со стажем в 13 лет.
Над статьей доктора Поляковой Татьяны Акимовны работали литературный редактор Елена Бережная , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Болезнь Паркинсона — это одно из самых распространенных нейродегенеративных заболеваний, поражающее преимущественно дофамин-продуцирующие (дофаминергические) нейроны в определенной области мозга, называемой чёрной субстанцией с накоплением в клетках белка альфа-синуклеина и особых внутриклеточных включений (телец Леви). Это заболевание — самая частая причина синдрома паркинсонизма (80% всех случаев). Распространенность болезни Паркинсона составляет около 140 (120-180) случаев на 100 000 населения. [1] Заболевание чаще всего проявляет себя после 50 лет, однако нередки случаи дебюта болезни и в более раннем возрасте (с 16 лет). Мужчины страдают немного чаще женщин.
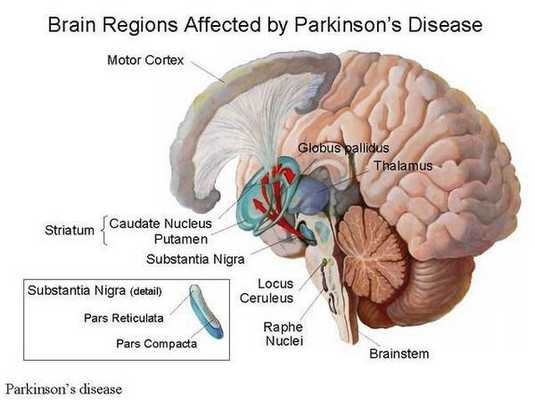
Причина остается в значительной степени неизвестной. Предполагается, что на возникновение заболевания влияют генетические факторы, внешняя среда (возможное воздействие различных токсинов), процессы старения. Генетические факторы имеют доминирующее значение при раннем развитии болезни Паркинсона. Молодые пациенты с этим заболеванием и с семейной историей болезни с большей вероятностью переносят гены, связанные с болезнью Паркинсона, такие, как SNCA, PARK2, PINK1 и LRRK2. В одном из последних исследований показано, что 65% людей с ранним началом болезни Паркинсона в возрасте до 20 лет и 32% людей с началом от 20 до 30 лет имели генетическую мутацию, которая, как полагают, увеличивает риск развития болезни Паркинсона. [2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы болезни Паркинсона
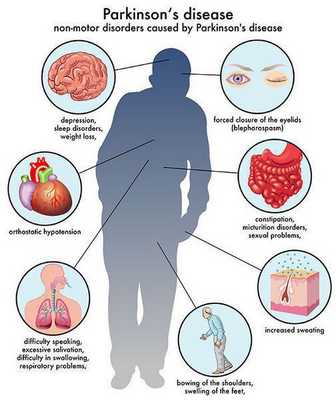
Многие симптомы болезни Паркинсона не связаны с движением. Немоторные («невидимые симптомы») болезни Паркинсона распространены и могут влиять на повседневную жизнь больше, чем более очевидные трудности с движением. Они могут включать:
- нарушение обоняния;
- расстройства сна;
- когнитивные симптомы (снижение памяти, легкомысленность);
- запор;
- расстройства мочеиспускания;
- повышенное потоотделение;
- сексуальную дисфункцию;
- усталость;
- боль (особенно в конечностях);
- покалывание;
- беспокойство и депрессию. [3]
В начале заболевания нередко ставится неверный диагноз — плечелопаточный периартрит, проявляющийся болью и напряжением в мышцах руки и спины.
Синдром паркинсонизма является основным клиническим проявлением болезни Паркинсона, его симптомы: [1]
- замедленность всех движений;
- истощаемость быстрых повторяющихся движений в руках и ногах;
- скованность мышц (мышечная ригидность);
- дрожание рук и ног (но почти никогда — головы), наиболее выражено в покое;
- неустойчивость при ходьбе;
- укорочение длины шага и шарканье при ходьбе, топтание на месте, застывания при ходьбе, отсутствие cодружественных движений руками при ходьбе.
Вначале симптомы возникают только с одной стороны тела, но постепенно приобретают двусторонний характер. Симптомы остаются выраженными на той стороне, где возникли в начале заболевания. Симптомы на другой стороне тела часто не становятся такими же тяжелыми, как симптомы на начальной стороне. Движения становятся все более замедленными (основной симптом паркинсонизма). Симптомы заболевания колеблются в течения дня и зависят от многих факторов.
Патогенез болезни Паркинсона
Болезнь Паркинсона относится к группе синуклеинопатий, так как избыточное накопление в нейронах альфа-синуклеина приводит к их гибели. Повышенный уровень альфа-синуклеина может быть следствием нарушения внутриклеточной системы клиренса белков, осуществляемого лизосомамии и протеосомами. У пациентов обнаружено нарушение функционирования указанной системы, среди причин которого указывают старение, окислительный стресс, действие воспаления, токсины окружающей среды. Клетки гибнут предположительно из-за активации генетически запрограмированного механизма (апоптоза). [4]
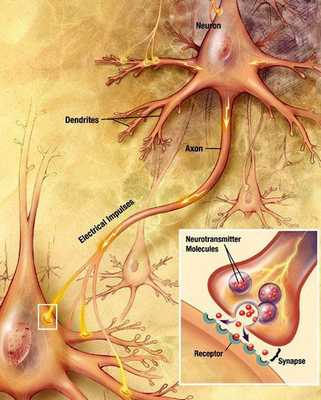
Классификация и стадии развития болезни Паркинсона
Болезнь Паркинсона классифицируется по форме, стадии и темпу прогрессирования заболевания.
В зависимости от преобладания в клинической картине того или иного симптома выделяют следующие формы: [1]
1. Смешанная (акинетико-ригидная-дрожательная) форма характеризуется наличием всех трёх основных симптомов в разном соотношении.
2. Акинетико-ригидная форма характеризуется выраженными признаками гипокинезии и ригидности, к которым обычно рано присоединяются нарушения ходьбы и постуральная неустойчивость, при этом тремор покоя отсутствует или выражен минимально.
3. Дрожательная форма характеризуется доминированием в клинической картине тремора покоя, признаки гипокинезии уходят на второй план.

Для характеристики стадий Болезни Паркинсона используется шкала Хен-Яра, 1967:
- на 1-й стадии акинезия, ригидность и тремор выявляются в конечностях с одной стороны (гемипаркинсонизм);
- на 2-й стадии симптоматика становится двусторонней;
- на 3-й стадии присоединяется постуральная неустойчивость, но сохраняется способность к самостоятельному передвижению;
- на 4-й стадии симптомы паркинсонизма резко ограничивают двигательную активность;
- на 5-й стадии в результате дальнейшего прогрессирования заболевания больной оказывается прикованным к постели.
Выделяют три варианта темпа прогрессирования заболевания:
- При быстром смена стадий заболевания от первой к третьей занимает 2 года или менее.
- При умеренном — от 2 до 5 лет.
- При медленном — более 5 лет.
Осложнения болезни Паркинсона
Болезнь Паркинсона — не смертельное заболевание. Человек умирает с ним, а не от него. Однако поскольку симптомы ухудшаются, они могут вызвать инциденты, которые приводят к смерти. Например, в сложных случаях затруднение глотания может привести к тому, что пациенты начнут аспирировать пищу в легкие, что приведет к пневмонии или другим легочным осложнениям. Потеря равновесия может привести к падению, которое, в свою очередь, может привести к серьезным травмам или смерти. Серьезность этих инцидентов во многом зависит от возраста пациента, общего состояния здоровья и стадии заболевания.
На более поздних стадиях заболевания проявляются более выраженные симптомы болезни Паркинсона: дискинезия (непроизвольные движения или подергивание частей тела, которые могут возникнуть в результате длительного использования леводопы, застывания (внезапное отсутствие возможности двигаться) или семенящая походка (короткие, почти бегущие шаги, которые как будто ускоряются сами по себе).
Следует помнить, что болезнь Паркинсона очень индивидуальна по своему течению и у каждого протекает по своему сценарию.
Диагностика болезни Паркинсона
Паркинсонизм относится к числу тех расстройств, которые можно диагностировать на расстоянии, особенно при развёрнутой картине заболевания. Однако диагностировать болезнь Паркинсона на ранней стадии сложно. Ранняя и точная диагностика заболевания очень важна для разработки лучших стратегий лечения и поддержания высокого качества жизни как можно дольше. В практике возможна недооценка или переоценка болезни Паркинсона. Невролог, специализирующийся на расстройствах движения сможет поставить наиболее точный диагноз. Первоначальная оценка проводится на основе анамнеза, неврологического обследования с использованием специальных тестов для оценки симптомов заболевания. Неврологическое обследование включает в себя оценку координации, ходьбы и мелких моторных задач, оценку нейропсихологического статуса.
Практика получения второго мнения в значительной степени зависит от личного выбора пациента. Но имейте в виду, что болезнь Паркинсона часто трудно диагностировать точно, особенно когда симптомы незначительно выражены. Простейшего диагностического теста нет, и примерно 25% диагнозов болезни Паркинсона неверны. Болезнь Паркинсона начинается с мало видимых симптомов, поэтому многие врачи, которые не обучены в сфере двигательных расстройств, не могут поставить точный диагноз. На самом деле даже лучшие неврологи могут ошибаться. Если врач не имеет особого опыта в этой области, то необходимо консультироваться со специалистом по расстройствам движения. Хороший невролог поймет ваше желание подтвердить диагноз. Второе мнение может помочь принять своевременно правильные решения относительно диагноза и терапии.
Лечение болезни Паркинсона
Несмотря на то, что излечения болезни Паркинсона не существует, есть множество методов, которые могут позволить вести полноценную и продуктивную жизнь на многие годы вперед. Многие симптомы могут облегчаться лекарствами, хотя со временем они могут утратить свою эффективность и вызвать нежелательные побочные эффекты (например, непроизвольные движения, известные как дискинезия).
Существует несколько методов лечения, замедляющих появление моторных симптомов и улучшающих двигательные функции. Все эти методы лечения предназначены для увеличения количества дофамина в головном мозге либо путем его замещения, либо продления эффекта дофамина путем ингибирования его распада. Исследования показали, что терапия на ранней стадии может задержать развитие двигательных симптомов, тем самым улучшая качество жизни. [5]
На характер и эффективность лечения влияет ряд факторов:
- выраженность функционального дефицита;
- возраст больного;
- когнитивные и другие немоторные нарушения;
- индивидуальная чувствительность к препаратам;
- фармакоэкономические соображения.
Задача терапии при болезни Паркинсона — восстановить нарушенные двигательные функции и поддержать оптимальную мобильность в течение максимально длительного периода времени, сведя к минимуму риск побочных действий препаратов. [1]
Существуют также хирургические вмешательства, такие, как глубокая стимуляция мозга, подразумевающая имплантацию электродов в мозг. Из-за рисков, присущих этому типу лечения, большинство пациентов исключают данный метод лечения до тех пор, пока лекарства, которые они принимают, больше не дают им значимого облегчения. Обычно этот метод лечения проводится у пациентов с длительностью заболевания от четырех лет, получающих эффект от лекарств, но имеющих моторные осложнения, такие, как: значительное «отключение» (периоды, когда лекарство плохо работает и симптомы возвращаются) и/или дискинезии (неконтролируемые, непроизвольные движения). Глубокая стимуляция мозга лучше всего работает в отношении таких симптомов, как: скованность, медлительность и тремор, не работает с целью коррекции устойчивости, застывания при ходьбе и немоторных симптомах. Данное лечение может даже усугубить проблемы с памятью, поэтому хирургия не рекомендуется для людей с когнитивными расстройствами. [6]
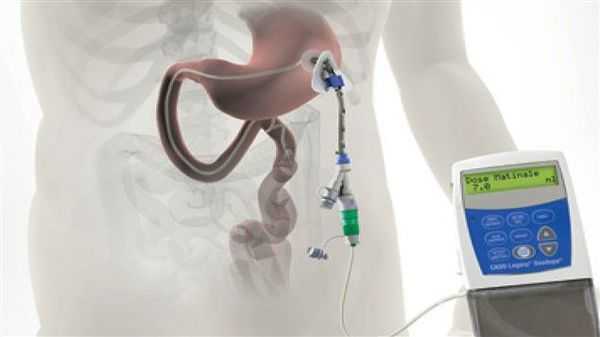
Различные новые способы введения леводопы открывают дополнительные возможности терапии. Сегодня используется интестинальный (кишечный) дуодопа-гель, который уменьшает ежедневные периоды «выключения» и дискинезию у пациентов с прогрессирующей болезнью Паркинсона благодаря постоянному неимпульсному режиму введения препарата. [7]
Исследуется альтернативный подход, использование допаминовых продуцирующих клеток, полученных из стволовых клеток. Хотя терапия стволовыми клетками имеет большой потенциал, требуется больше исследований, прежде чем такие клетки могут стать инструментом в лечении болезни Паркинсона. [8] [9]
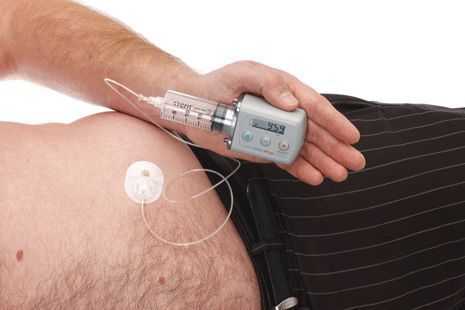
По мере прогрессирования болезни Паркинсона возможности хранения и буферизации дофамина в мозге становятся все более скомпрометированными, сужая терапевтическое окно для терапии и приводя к колебаниям двигательной системы человека. Апоморфин в виде помпы доставляет подкожную инфузию в течение дня для лечения флуктуаций (феномены «ON-OFF») у пациентов с болезнью Паркинсона, которые недостаточно контролируются пероральным антипаркинсоническими препаратами. Эта система используется постоянно, чтобы обеспечить мозг непрерывной стимуляцией.
При болезни Паркинсона очень полезна физическая нагрузка. Если дважды в неделю по 1-2 часа выполнять упражнения, то можно замедлить развитие заболевания: походка, осанка и когнитивные способности будут ухудшаться гораздо медленнее [12] .
Прогноз. Профилактика
Болезнь Паркинсона уникальна для каждого человека, никто не может предсказать, какие симптомы появятся и когда именно. Существуют общее сходство картины прогрессирования болезни, но нет никакой гарантии, что то, что наблюдается у одного, будет у всех с аналогичным диагнозом. Некоторые люди оказываются в инвалидных колясках; другие все еще участвуют в марафонах. Некоторые не могут застегнуть ожерелье, в то время как другие делают ожерелья вручную.
Пациент может сделать всё, чтобы активно повлиять на течение болезни Паркинсона и, по крайней мере, на одну очень вескую причину: ухудшение симптомов часто значительно медленнее у тех, кто проявляет позитивную и активную позицию по отношению к своему состоянию, чем те, кто этого не делает. В первую очередь рекомендуется найти врача, которому доверит пациент, и который будет сотрудничать по развивающемуся плану лечения. Снижение стресса обязательно — стресс ухудшает каждый симптом болезни Паркинсона. Рекомендуются занятия образовательного направления: рисование, пение, чтение стихов, рукоделие, изучение языков, путешествия, работа в коллективе, занятия общественной деятельностью.
К сожалению, даже если адекватно подобрать медикаментозную терапию, это не гарантирует того, что клетки перестанут гибнуть при болезни Паркинсона. Терапия должна быть направлена на создание благоприятных условий для двигательной активности с учётом индивидуальных особенностей клинической картины заболевания. Как показывают результаты многочисленных исследований, профессиональная двигательная реабилитация является необходимым условием для замедления прогрессирования заболевания и улучшения его прогноза. На сегодняшний день по данным клинических исследований показана эффективность реабилитационной программы по протоколам LSVT LOUD, LSVT BIG, теоретическая основа которых сводится к развитию нейропластичности вещества мозга. Она направлена на коррекцию дрожания, ходьбы, постуры, равновесия, мышечного тонуса и речи. [10]
Реабилитационные методики должны быть направленные не только на поддержание сохранившихся двигательных способностей, но и выработку новых навыков, которые бы помогали человеку с болезнью Паркинсона преодолевать ограниченность его физических возможностей, чему способствует программа танцевально-двигательной терапии при болезни Паркинсона, работающая более чем в 100 сообществах по всему миру, включая Россию. Танцевальная терапия позволяет частично решить конкретные проблемы болезни Паркинсона: потеря равновесия, ухудшение координации, шаркающая походка, тремор, застывания, социальная изоляция, депрессия и повышенный уровень тревожности.
Согласно американскому исследованию с участием 52 больных болезнью Паркинсона, регулярная практика аргентинского танца уменьшает симптомы болезни, улучшает баланс и улучшает выполнение сложных движений при болезни Паркинсона. [11]
Читайте также:
