Техника, этапы операции забора костного трансплантата из проксимального метафиза большеберцовой кости
Добавил пользователь Владимир З. Обновлено: 21.01.2026
ОСТЕОСИНТЕЗ КОСТНЫХ ФРАГМЕНТОВ СЛОЖНЫХ ПЕРЕЛОМОВ ПРОКСИМАЛЬНОГО ОТДЕЛА БОЛЬШЕБЕРЦОВОЙ КОСТИ ПРЕДВАРИТЕЛЬНО МОДЕЛИРОВАННЫМ ИМПЛАНТАТОМ
ССЫЛКА ДЛЯ ЦИТИРОВАНИЯ:
Толедо К.В., Гурьев В.В., Паршиков М.В., Лекишвили М.В., ОСТЕОСИНТЕЗ КОСТНЫХ ФРАГМЕНТОВ СЛОЖНЫХ ПЕРЕЛОМОВ ПРОКСИМАЛЬНОГО ОТДЕЛА БОЛЬШЕБЕРЦОВОЙ КОСТИ ПРЕДВАРИТЕЛЬНО МОДЕЛИРОВАННЫМ ИМПЛАНТАТОМ // Кафедра травматологии и ортопедии. 2017.№1(21). с.16-24 [Toledo К.V., Guryev V.V., Parshikov M.V., Lekishvili М.V., OSTEOSYNTHESIS OF BONE FRAGMENTS OF COMPLEX FRACTURES OF THE PROXIMAL TIBIA BY A PRE-MODELED IMPLANT// The Department of Traumatology and Orthopedics. 2017.№1(21). p.16-24]
К. В. ТОЛЕДО 2 , В. В. ГУРЬЕВ 1, 2 , М. В. ПАРШИКОВ 2 , В. В. ТОЛЕДО 3 , А. М. БЕЛЕНЬКИЙ ГОНСАЛЕС 3 , М. В. ЛЕКИШВИЛИ 4
1 НУЗ «ДКБ им. Н.А. Семашко на ст. Люблино ОАО «РЖД»
2 Московски й государственны й медико-стоматологически й университет им. А.И. Евдокимова
3 ГБУЗ ГКБ No 13 МЗ РФ
4 ФГБУ «Центральны й научно-исследовательски й институт Травматологии и Ортопедии имени Н.Н. Приорова» МЗ РФ
Информация об авторах:
Паршиков Михаил Викторович - д.м.н., профессор кафедры травматологии и ортопедии, МГМСУ им. А.И. Евдокимова, РФ, г. Москва.
Переломы проксимального отдела большеберцовой кости - достаточно распространенное явление, сопровождающееся повреждением преимущественно латерального мыщелка с частичным или полным разрывом соответствующего мениска. Авторами разработан фиксатор для накостного остеосинтеза. Фиксатор является индивидуальной анатомической премоделированной пластиной. Проведено исследование, в котором приняли участие пациенты с переломами проксимального отдела большеберцовой кости. Достигнуты положительные результаты в 96,7% случаев, из них хорошие результаты наблюдались в 73,3%, удовлетворительные результаты в 23,4%, неудовлетворительные результаты отмечались у 3,3% от всей группы пациентов.
Ключевые слова: большеберцовая кость; накостный остеосинтез; премоделированная пластина.
Введение
Переломы проксимального отдела большеберцовой кости относятся к тяжёлым повреждениям нижних конечностей и составляют от 6,5 до 12% всех внутрисуставных переломов коленного сустава и 7% от всех переломов опорно-двигательного аппарата [1, 4]. Внутрисуставные переломы являются результатом осевой нагрузки в сочетании с некоторой варусной и вальгусной силой [13]. Подобные переломы проксимального отдела большеберцовой кости характеризуются сложностью восстановления функции коленного сустава, что приводит к стойкой инвалидизации пациента [3, 5]. За последнее десятилетие число осложнений выросло на 20-40%, а процент больных, получивших инвалидность в результате неполностью восстановленной функции коленного сустава, составляет 5,9 - 9,1% [2, 14]. Развитию осложнений частично способствует несвоевременная диагностика данных повреждений [11, 12]. Рентгенологическое исследование и КТ-исследование поврежденного сустава уже вошло в стандарт предоперационного планирования [9, 10, 15]. Именно поэтому адекватная диагностика и своевременное лечение перелома проксимального отдела большеберцовой кости представляет собой актуальную задачу.
Целью лечения таких переломов является анатомическое восстановление суставной поверхности, профилактика посттравматического дегенеративного заболевания сустава, устойчивый остеосинтез, позволяющий раннюю мобилизацию [7, 8]. Выбор лечения зависит от возраста пациента, его состояния, конфигурации перелома, степени смещения отломков и состояния поверхностных мягких тканей, связанных с костными повреждениями и любыми нейроваскулярными осложнениями [6].
Цель исследования
Оценка результатов хирургического лечения переломов проксимального отдела большеберцовой кости с помощью премоделированной пластины.
Материалы и методы

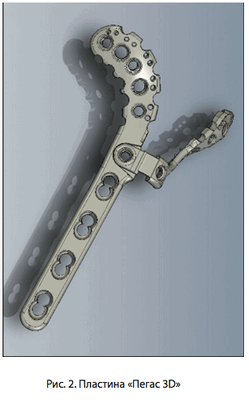
Имплантат “ПЕГАС 3D” представляет собой две металлические пластины, соединяемые между собой с помощью специального замка и зафиксированные на определенный угол специальным штифтом, и изготавливается по рентгенологическим снимкам большеберцовой кости в прямой и боковой проекции.
Основной отличительной характеристикой является использование специальных элементов - стабилизаторов положения - для придания элементам имплантата 6-и и более степеней свободы для осуществления максимального совпадения геометрии кости с геометрией пластины и обеспечения жесткой фиксации при сложных многооскольчатых переломах.
При сохранении конечной жесткости пластины конструкция позволяет осуществлять монтаж фиксатора на кости пациента в процессе операции, подгоняя отдельные элементы вверх-вниз, влево-вправо с возможностью изменений по углу тангажа и по углу рыскания. Это позволяет полностью спрятать имплантат на кости, сохраняя жесткость конструкции и обеспечивая стабильность положения перелома в процессе всего периода эксплуатации пластины. Конструкторский расчёт и моделирование производились как матрица параметрических уравнений, где переменными выступили:
угол скоса центра кости относительно центральной оси (поперечная возрастная и индивидуальная деформация);
длина и локализация перелома;
ширина и форма L-образного среза кости в месте соединения фиксирующих пластин.
Применение имплантата показано при оскольчатых компрессионных и импрессионных переломах проксимального отдела большеберцовой кости.
Внутренняя поверхность пластины представляет собой абсолютно анатомический «слепок» поверхности большеберцовой кости. Имплантат имеет 3 типоразмера в зависимости от роста пациента, и левую и правую симметрию в зависимости стороны повреждения.
Имплантат имеет стабильную фиксацию в трёх плоскостях. Он имеет ряд направленных отверстий для винтов диаметром 5,0 мм, 3,5 мм и 2,5 мм и спиц Киршнера диаметром 2,0 мм, что обеспечивает возможность получения стабильной фиксации любого перелома, в том числе компрессионного и импрессионного, наружного и заднего отдела мыщелков. Вес имплантата в сборе варьируется в диапазоне от 90 грамм до 150 грамм. Благодаря предварительному моделированию поверхностей имплантата существенно снижается время и трудоёмкость операции - на 10-20 минут в зависимости от вида перелома. Высота репонирующих шипов составляет 0,9-1,2 мм. Форма имплантата имеет плавные очертания и плавную геометрию для снижения риска травматизации тканей при установке.
Высокая биосовместимость имплантата обеспечена его изготовлением из специального медицинского сплава методом селективного спекания из материала Сталь AISI 316L | 0 3Х16Н15М3 в соответствии с ГОСТ No 5632-72, и исключает риск наступления тканевого окисления (металлоза) и развития хронической интоксикации тяжелыми металлами.
Имплантат «ПЕГАС 3D» в рабочем состоянии может легко переносить момент нагрузки 2000 кН или постоянную нагрузку в 200-300 кг на сгибание и на разрыв, осуществляя таким образом свою функцию скрепления разрушенной кости в течение длительного времени (до нескольких лет). Для расчета прочности фиксатора была использована программа CREO PARAMETRIC (рис. 3).
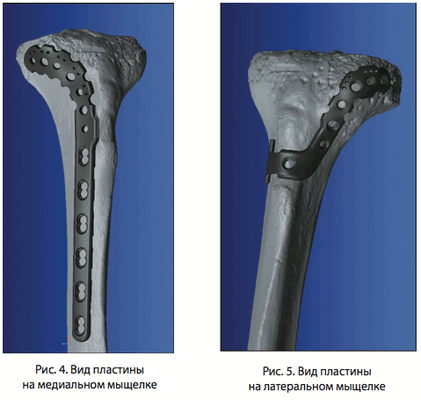
При различных переломах проксимального отдела большеберцовой кости возможно использование пластины в сборе, а при изолированных переломах мыщелков возможно устанавливать отдельные части пластины как на внутренний мыщелок, так и на наружный мыщелок (рис. 4, 5).
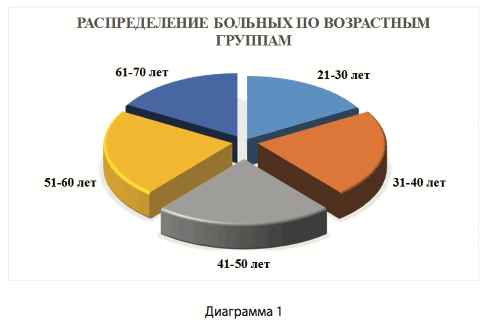
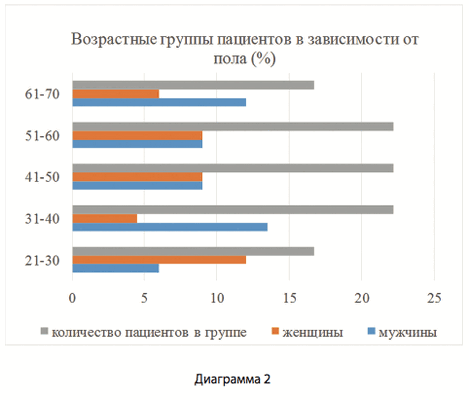
В период с 2014 по 2016 было проведено клиническое исследование, которое является проспективным и контролируемым. В исследовании приняла участие группа из 18 пациентов с переломами проксимального отдела большеберцовой кости. В группу были включены пациенты мужского и женского пола в возрастном диапазоне от 28 до 67 лет, средний возраст пациентов составил 46 лет (диагр. 1, 2). Мужчины составили 55,6 %, а женщины 44,4% от общего количества пациентов. Перелом проксимального отдела большеберцовой кости диагностирован у 12 больных справа и у 6 - слева.
Для удобства распределения пациентов с переломами проксимального отдела большеберцовой кости по группам была использована классификация AO/ASIF. Распределение пациентов по типу перелома представлено на диаграмме 3.
Анализ локализации переломов выявил: в 10 случаях повреждение латерального мыщелка большеберцовой кости, что составило 55,6% от всего количества больных, принявших участие в исследовании. В 3 случаях было диагностировано повреждение медиального мыщелка без повреждения медиального мениска, что составило 16,7% от всего количества больных. В 5 случаях был выявлен перелом обоих мыщелков проксимального метаэпифиза, что составило 27,8% от всего количества больных, принявших участие в исследовании, из которых в 2 случаях был выявлен частичный разрыв обоих менисков, в 1 случае частичный отрыв медиального мениска, и в 1 случае диагностирован полный отрыв латерального мениска. При полных отрывах менисков производилась менискэктомия, при частичных отрывах делали порционную резекцию мениска. Как показано в таблице 3, большинство пациентов имели переломы проксимального отдела большеберцовой кости типа В (В1, В2) и типа С (С1, С2).
При поступлении больных с переломами проксимального отдела большеберцовой кости в стационар проводились обследования в соответствии с МЭС 79.100. Выполнялись рентгенограммы в двух проекциях в масштабе 1:1, МСКТи МРТисследования коленного сустава. По данным рентгенограмм в прямой и боковой проекции снимались размеры проксимального метаэпифиза большеберцовой кости. Далее подготавливалась индивидуальная анатомическая премоделированная пластина «Пегас 3 D» (рис 6, 7). Предоперационные рентгенологическое и КТ исследования поврежденных коленных суставов позволили точнее оценить изучаемые структуры коленного сустава, подобрать вид фиксаторов и их размер.
В зависимости от вида перелома больным были установлены несколько видов пластин-фиксаторов: одна ветвь пластины на латеральный мыщелок, две ветви пластины с замком, монолитная пластина, а также медиальный компонент пластины на медиальный мыщелок. Распределение больных в зависимости от вида перелома и установленного фиксатора представлено в таблице 1.
Техника операционного вмешательства
Операции выполняли в положении больного на спине, под общим обезболиванием после обработки операционного поля через линейный разрез по передне-наружной поверхности коленного сустава длинной 12-16 см. Выполнялась артротомия коленного сустава. Проводили мобилизацию метаэпифиза большеберцовой кости в наружной его части. При ревизии коленного сустава в случае выявления разрыва наружного
мениска производили частичную или полную его резекцию. При наличии консолидации долотом проводили остеотомию наружного мыщелка большеберцовой кости. Далее осуществлялся подъем смещенной части мыщелка кверху с восстановлением конгруэнтности суставной поверхности большеберцовой кости. Передненаружная часть мыщелка укладывалась на место. При наличии костного дефекта закладывался костный трансплантат, взятый с бугристости большеберцовой кости, или гранулы Repro Bone. Фиксацию костных фрагментов осуществляли спицами Киршнера. Интраоперационную визуализацию костных фрагментов и суставной поверхности делали с использованием электронно-оптического преобразователя (ЭОП). После устранения смещения производили остеосинтез премоделированной пластиной с кортикальными блокирующими винтами необходимого размера и в достаточном количестве для стабильного остеосинтеза. Спицы Киршнера удалялись. Контроль за устранением смещения фрагментов и расположением винтов осуществлялся под электронно-оптическим преобразователем с С-дугой. Послойно ушивали рану с наложением асептической повязки.
Иммобилизацию в послеоперационном периоде не выполняли, ограничение нагрузки на оперированную конечность длилось до 2-х месяцев. На 2-3 сутки после операции назначались ЛФК, активная-пассивная разработка движений в коленном суставе.
Клинический пример No1
Пациент Б., 65 лет. Травма получена в результате ДТП (пешеход). Первая помощь была оказана по месту травмы. Затем был переведен в ДКБ им. Н.А. Семашко. При поступлении в клинику выполнена рентгенография в двух стандартных проекциях (рис. 8 а, б), КТ-исследования коленного сустава (рис. 9). Поставлен диагноз: «Компрессионный перелом наружного мыщелка большеберцовой кости справа со смещением. Разрыв наружного мениска. Гемартроз». Тип В3 по классификации АО/ASIF. Выполнена операция: открытая репозиция наружного мыщелка правой большеберцовой кости с остеосинтезом наружного мыщелка премоделированной пластиной с частичной резекцией наружного мениска (рис. 10 а, б). Пациенту была установлена одна ветвь фиксатора на латеральный мыщелок (рис. 11 а, б). Послеоперационной иммобилизации не было. Разработка коленного сустава осуществлялась на 2-3 сутки. После полного сращения перелома, через 7 месяцев после установки фиксатора выполнена операция удаления фиксатора (рис.12 а, б). Функция коленного сустава сохранена, сгибание более 600, разгибание 1800 (рис.13 а, б).
Оперативное лечение переломов проксимального метаэпифиза большеберцовой кости

Оперативное лечение переломов проксимального метаэпифиза голени представляет собой трудную задачу. Характерной особенностью переломов данной локализации является то, что вместе с раскалыванием кости имеет место сминание, раздавливание губчатой субхондральной ткани и нарушение хрящевого покрытия, что затрудняет как закрытую, так и открытую репозицию, восстановление двигательной и опорной функции проксимального метаэпифиза голени.
На лечении в клинике травматологии КБ № 1 УДП РФ за последние 5 лет находились 75 пациентов в возрасте от 16 до 86 лет, мужчин было 32, женщин 43. По механизму травмы переломы случались при резкой опоре на ногу у 52 пациентов, у 23-х в результате удара о твердый предмет. Нами разработан дифференцированный подход в хирургическом лечении переломов проксимального метаэпифиза большеберцовой кости.
Пациенты поступали в клинику через 1 - 4 суток после получения травмы и были оперированы в ближайшие сутки после поступления. Диагностировали тип перелома по данным рентгенграфии сустава, для уточнения обьема операции - возможного количественного подсчета площади и глубины компрессии методом выбора была компьютерная томография.
У 19 больных с изолированными повреждениями мыщелков по типу раскалывания - с неполным внутрисуставным переломами (тип 41В1 по УКП АО) произвели операцию: наименее травматичной была закрытая репозиция перелома под контролем ЭОПа, что повзолило добиться стабильности отломков всего 2-я винтами.
У 30-ти больных при многооскольчатом характере перелома - полный внутрисуставной перелом (тип 41С1 и 41С2 по УКП АО), когда закрытая ручная репозиция была эффективна, произведен закрытый остеосинтез аппаратом Илизарова - в 5-ти случаях. Для этого проводили спицы через голень на разных уровнях, укрепляли их в кольцах аппарата Илизарова, причем через мыщелки проводили спицы с напайками навстречу друг другу, не менее 2- с каждой стороны. Нагрузку на конечность разрешали через 4 недели, фиксацию аппаратом осуществляли 2, 5 - 3 месяца. У 25-ти пациентов провели остеосинтез укороченными блокированными пластинами, винтами из небольших доступов доступов, без артротомии и значительного скелетирования тканей, под рентген-эоп-контролем.
Наибольшую трудность представляют для лечения полные внутрисуставные оскольчатые переломы с элементами раскалывания и вдавливания (тип 41В3 и 41С3 по УКП АО) - 26 пациентов. В этих случаях мы открывали широко сустав и проксимальный метафиз голени, добивались репозиции и максимального восстановления суставной поверхности. Фиксацию осуществляли Т-образной или L-образной мыщелковой пластиной. У 7 пациентов операцию на этом закончили. В 6-ти наблюдениях операцию дополняли пластикой субхондральной зоны аутотрансплантантом из крыла подвздошной кости или бугристости большеберцовой кости и аллотрансплантатом «остеоматрикс».
У 13 пациентов пластику субхондральной зоны осуществили аутотрансплантатом из большеберцовой кости. Для этого брали аутотрансплантат прямоугольной формы 5*1, 5*1 см из боковой поверхности большеберцовой кости на границе с/з и в/з и перемещали его кверху в субхондральное пространство. Дефекты между костными фрагментами плотно заполняли гранулами «остеооматрикс» - 4 раза, «остеоматрикс» прямоугольным трансплантатом - 3 раза, гранулами коллапана - 3 раза. Ложе в большеберцовой кости, оставшееся после перемещения прямоугольного фрагмента также плотно выполняли гранулами «остеоматрикс» и гранулами коллапана.
Для создания опоры восстановленной суставной поверхности один спонгиозный винт проводили субхондрально поперек зоны повреждения через пластину, перекрывающую зоны перелома и места аутопластики с фиксацией к неповрежденной кости 3- 4 кортикальными винтами с угловой стабильностью.
В послеоперационном периоде проводили антибактериальную, сосудистую терапию, ЛФК, ходьба без нагрузки в течение 4 недели. Рекомендовали щадящую нагрузку в ортезе еще 1, 5 месяца, полную нагрузку через 3 месяца после операции.
Таким образом, примененный нами дифференциальный подход в лечении переломов проксимального метаэпифиза голени, позволил получить хорошие и удовлетворительные результаты в 95, 2 % за счет:
выполнения оперативного лечения с предоперационным планированием КТ в ранние сроки
дифференцированного подхода к тактике оперативного лечения в зависимости от типа перелома и вида его импрессии:
При изолированных переломах мыщелков по типу раскалывания (неполные внутрисуставные переломи тип 41В1 по УКП АО) и неполные внутрисуставные переломы по типу вдавливания (тип 41В2 по УКП АО), возможно проведение репозиции под контролем ЭОПа с последующей фиксацией 2-мя винтами.
При многооскольчатом характере перелома (полный внутрисуставной перелом тип 41С1 и 41С2 по УКП АО) эффективна закрытая ручная репозиция и закрытый остеосинтез аппаратом Илизарова или укороченными блокированными пластинами из мини доступа;
При полных внутрисуставных оскольчатых переломах с элементами раскалывания и вдавливания (тип 41В3 и 41С3 по УКП АО) целесообразно проведение открытой репозиции с выполнением пластики субхондральной зоны различными способами:
искуственной костью (остеоматриксом и коллапаном) или перемещенным аутотрансплантотом (фрагментом большеберцовой кости и подвздошной кости). При данном типе перелома проведение фиксации осуществляется L- или Т-образной мыщелковой пластиной с угловой стабильностью.
Трансплантация из большеберцовой кости при окрытом синус-лифтинге
В настоящее время существует большое количество разновидностей костных аугментаций. Могут использоваться материалы различного происхождения, позволяющие достичь высокой клинической успешности. Однако в ряде случаев приходится выбирать методику, по которой будет проводиться данная операция.
Для каждого метода существуют определенные показания, хотя в одном и том же клиническом случае можно пойти разными путями.
На данный момент на рынке присутствует огромное количество различных костных заменителей, которые используются при аугментациях. Большинство прошли успешные клинические испытания и используются в случаях дефицита костной ткани.
В то же время исторически всегда существовали «золотые стандарты». Самым распространенным вариантом из них является аутокость из гребня подвздошной кости.
Аутотрансплантаты обеспечивают самый высокий клинический успех, прошли самые долгие клинические исследования, исторически имеют самый большой опыт использования.
Основное отличие при использовании аутотрансплантатов от ксенотрансплантатов — необходимость инвазии.
Именно повышенная инвазивность при заборе аутокости является отрицательным фактором по сравнению с использованием различных костных заменителей.
В данной статье на примере клинического случая хотелось бы показать относительную легкость использования аутотрансплантатов с достаточно невысокой степенью инвазии. Преимущества использования проксимальной части большеберцовой кости (БК) в качестве донорского участка для получения губчатого костного трансплантата были изучены в ряде исследований. Послеоперационный дискомфорт при использовании большеберцовой кости намного меньше, чем при использовании гребня подвздошной кости (ГПК).
Кроме того, при операциях на ГПК в большинстве случаев требуется общая анестезия. Максимально возможный объем губчатого трансплантата из большеберцовой кости больше, чем из передней или задней части ГПК. Кроме того, риск осложнений при использовании ГПК намного выше в связи с возможностью повреждения латеральной ветви подвздошно-подчревного нерва и травмой большой и малой ягодичной мыщцы.
Топографическая анатомия
Большая часть БК располагается подкожно, а ее проксимальную часть и мыщелки можно пропальпировать ниже колена.
Бугристость БК находится на переднем крае кости между мыщелками и пальпируется как овальное возвышение. Пальпаторное определение бугристости БК чрезвычайно важно для предупреждения повреждения суставных поверхностей коленного сустава.
В непосредственной близости от медиальной поверхности части БК проходят мелкие ветви медиальных поверхностей нижних коленных артерий, которые проходят под связкой коленной чашечки.
Разберем методику на примере клинического случая.
В клинику обратился пациент с жалобой на отсутствие зубов в области 14, 15. После обследования пациенту назначили план лечения, включающий открытый синус-лифтинг и одновременную имплантацию в области 14, 15 зубов. Забор аутокости будет проводиться из БК по методике Ф. Альфаро.
Анестезия
Обработка операционного поля йодом.
Отступив на 20 мм вниз и на 20 мм медиально от наиболее выступающей точки большеберцовой бугристости, проводят горизонтальную линию длиной 10 мм (рис. 1) .
В эту область подкожно вводят 2%-ный раствор артикаина с адреналином (1: 100 000).
Доступ
По отмеченной линии скальпелем № 10 проводят разрез до кости (рис. 2, 3) .
способ забора костного аутотрансплантата при остеосинтезе переломов мыщелков большеберцовой кости
Изобретение относится к травматологии и ортопедии и может быть применимо для забора донорского аутотрансплантата при остеосинтезе переломов мыщелков большеберцовой кости при дефектах под суставной поверхностью большеберцовой кости. Измеряют размеры восполняемого дефекта и определяют его форму. Производят взятие трансплантата через временно отсекаемую кортикальную створку, при формировании которой плоскости остеотомии делают клиновидно сходящимися для последующей фиксации ее заклиниванием при импакции. Делают плоскости остеотомии при формировании трансплантата в форме призмы, в основании которой лежит трапеция, соответствующая форме и размерам дефекта под суставной поверхностью большеберцовой кости. После взятия трансплантата репонируют с импакцией кортикальную створку мыщелка бедренной кости. Способ позволяет обеспечить возможность восстановления донорской области, максимально приблизить форму трансплантата к форме дефекта. 8 ил.
Формула изобретения
Способ забора донорского аутотрансплантата при остеосинтезе переломов мыщелков большеберцовой кости при дефектах под суставной поверхностью большеберцовой кости, отличающийся тем, что донорский аутотрансплантат берут в пределах основного операционного доступа из прилежащего мыщелка бедренной кости, измеряют размеры восполняемого дефекта и определяют его форму, взятие трансплантата производят через временно отсекаемую кортикальную створку, при формировании которой плоскости остеотомии делают клиновидно сходящимися для последующей фиксации ее заклиниванием при импакции, плоскости остеотомии при формировании трансплантата делают в форме призмы, в основании которой лежит трапеция, соответствующая форме и размерам дефекта под суставной поверхностью большеберцовой кости, после взятия трансплантата репонируют с импакцией кортикальную створку мыщелка бедренной кости.
Описание изобретения к патенту
Изобретение относится к медицине, а именно к травматологии и ортопедии, и применяется при оперативном лечении импрессионных переломов мыщелков большеберцовой кости, сопровождающихся дефектом костной ткани, нуждающимся в костной пластике.
При импрессионных переломах мыщелков большеберцовой кости в результате смятия (импрессии спонгиозной кости) возникает ее дефицит, который проявляется во время операции остеосинтеза при репозиции в виде пустоты под отрепонированной суставной поверхностью мыщелка большеберцовой кости, нуждающейся в восполнении (возмещении потерянной костной массы). Это является показанием к костной пластике дефекта. Принято считать, что как способ пластики, так и методика взятия трансплантата, в принципе, не влияют на исход операции и поэтому в руководствах этому вопросу уделяется минимум внимания: принципиально важно восполнить дефект (чем - не важно!).
Известен способ забора трансплантата для костной пластики путем вырубания спонгиозного аутотрансплантата из гребня подвздошной кости (1, 2, 3). Способ является классическим, «золотым стандартом», и поэтому взят в качестве прототипа. Он предполагает забор фрагмента гребня в полную толщину, которая позволяет восполнить дефект и обеспечить достаточную прочность для ранней функциональной нагрузки (1). Недостатками операции являются трудоемкость взятия трансплантата, необходимость перехода на наркоз при спинномозговой анестезии, длительность, которая объясняется необходимостью дополнительного доступа с ушиванием новой раны, требующая не менее 30 дополнительных минут операционного времени для бригады хирургов, а также то, что в ряде случаев массивность гребня оказывается недостаточной для восполнения всего дефекта. Но главным недостатком является болезненность донорского места: пациент продолжает жаловаться на боль в донорском месте несколько месяцев, в том числе и после консолидации перелома мыщелка большеберцовой кости, ради которого брался трансплантат (3-7). Кроме того, возникновение нового костного дефекта может стать значимым при повторных или одновременных (политравма) показаниях к костной пластике: переломе с дефектом костной ткани другой локализации: второго перелома мыщелков, перелома пяточной кости, позвонка и.т.д., при котором взять большой трансплантат, возможно, будет неоткуда, поскольку гребень подвздошной кости окажется исчерпанным.
Техническим результатом настоящего изобретения является обеспечение безболезненности донорского места, максимальное приближение формы аутотрансплантата к форме дефекта, снижение травматичности взятия трансплантата и трудоемкости оперативного вмешательства, а также возможность структурного восстановления донорского места.
Технический результат достигается тем, что в предлагаемом способе донорский аутотрансплантат берут в пределах основного операционного доступа из прилежащего мыщелка бедренной кости через временно отсекаемую кортикальную створку, а при заборе донорского аутотрансплантата и измеряют размеры восполняемого дефекта и принимают во внимание его типичную форму, а после забора аутотрансплантата возвращают (репонируют) с импакцией кортикальную створку мыщелка бедренной кости, причем плоскости остеотомии при формировании створки делают клиновидно сходящимися для последующей фиксации ее заклиниванием при импакции, а плоскости остеотомии при формировании аутотрансплантата делают в форме призмы, в основании которой лежит трапеция, соответствующая форме и размерам дефекта под суставной поверхностью большеберцовой кости.
Соответствие технического решения критерию "новизна" определяется отсутствием в уровне техники идентичного технического решения, позволяющего добиться заявляемого результата.
Соответствие критерию "изобретательский уровень" определилось тем, что наше решение не следует явным образом из уровня техники, а также тем, что эффект, достигаемый посредством заявляемого решения, выявлен в результате целенаправленного поиска самим изобретателем. Взятие такого трансплантата из прилежащего мыщелка бедра сразу решила несколько задач:
1) забор аутотрансплантата для пластики костного дефекта обеспечивается спонгиозной костью из того же доступа, из которого выполняется основная операция остеосинтеза перелома мыщелка большеберцовой кости, то есть отпадает необходимость в специальном оперативном доступе к донорскому месту.
2) сохраняется гребень подвздошной кости в неприкосновенности, что позволяет избежать жалоб на боли в донорском месте, или использовать его при показаниях к иной костной пластике для другой локализации.
3) Объем дистального эпифиза бедра позволяет взять более массивный трансплантат, по сравнению с гребнем подвздошной кости как по толщине, так и по его площади, с возможностью восстановления прочности донорского места. Это объясняется тем, что кортикальная створка бедра отсекается достаточно толстой и после импакционного заклинивания консолидируется до консолидации основного перелома (оперированного мыщелка большеберцовой кости), восстанавливая прочность, а в донорскую полость возможно постепенное врастание спонгиозной костной ткани. Все это в целом к достижению отдаленного результата (через год-полтора) позволяет констатировать восстановление анатомии коленного сустава и архитектоники донорского места в эпифизе бедра.
Соответствие критерию "промышленная применимость" определяется безопасностью и эффективностью восполнения дефекта в зоне повреждения с применением обычных инструментов, а также перспективностью восстановления донорского места после операций по поводу наиболее тяжелых повреждений коленного сустава. Эти факторы поддерживают к данному способу интерес здравоохранения, готового, перейти к широкому внедрению заявляемого способа, для чего заявитель и обращается за патентной защитой новой разработки.
На чертежах изображены:
Фиг.1 - Фотография, на которой показан доступ к поврежденному мыщелку большеберцовой кости, позволяющий осуществить взятие трансплантата из прилежащего мыщелка бедренной кости по заявленному способу. Отломки суставной поверхности отрепонированы и фиксированы временными спицами, под ними определяется зона дефекта типичной формы и размеров.
Цифровые обозначения: 1 - разрез, 2 - мыщелок бедренной кости, 3 - отрепонированная суставная поверхность мыщелка большеберцовой кости, 4 - временные спицы, фиксирующие отломки суставной поверхности, 5 - дефект спонгиозной кости под отрепонированной суставной поверхностью, требующий восполнения, 6 - капсула сустава.
Фиг.2 - Формирование створки для обнажения донорской спонгиозной ткани: наклонные плоскости сечения кортикальной пластинки позволяют при закрывании створки ее заклинить импакцией и обеспечить ее надежную фиксацию. Показано применение импактора для заклинивания створки по окончании костной пластики.
Цифровые обозначения: 2 - мыщелок бедренной кости, 3 - отрепонированная суставная поверхность мыщелка большеберцовой кости, 4 - временные спицы, фиксирующие отломки суставной поверхности большеберцовой кости, 5 - дефект спонгиозной кости под отрепонированной суставной поверхностью, требующий восполнения, 7 - остеотом (цифры I, II, III на ручке показывают последовательность, а стрелки - направление и ориентацию плоскостей остеотомии при формировании створки), 8 - формируемая створка, 13 - импактор (стрелка на нем показывает направление удара, позволяющее фиксировать на прежнее место створку после забора аутотрансплантата).
Фиг.3 - Фотография верхнего угла раны в момент отведения створки на кровоснабжаемой надкостнице. Цифровые обозначения: 2 - мыщелок бедренной кости, 4 - временные спицы, фиксирующие отломки суставной поверхности большеберцовой кости, 5 - дефект спонгиозной кости под отрепонированной суставной поверхностью, требующий восполнения, 6 - капсула сустава, 7 - остеотом, 8 - отсеченная и отведенная створка.
Фиг.4 - Плоскости остеотомии показаны в виде ориентации и глубины внедрения остеотома при формировании аутотрансплантата в форме призмы с трапециевидным основанием.
Цифровые обозначения: 2 - мыщелок бедренной кости, 3 - отрепонированная суставная поверхность мыщелка большеберцовой кости, 4 - временные спицы, фиксирующие отломки суставной поверхности большеберцовой кости, 5 - дефект спонгиозной кости под отрепонированной суставной поверхностью, требующий восполнения, 7 - остеотом (стрелки на условном поперечном сечении клинка остеотома направление и ориентацию плоскостей остеотомии при формировании аутотрансплантата), 8 - откинутая створка, которую придерживают крючком, 10 - трапециевидная форма торца аутотрансплантата, 11 - аутотрансплантат (заштрихован).
Фиг.5 - Отламывание основания аутотрансплантата при помощи шила. Пунктирной линией показано направление введения шила перед отламыванием аутотрансплантата. Дуга и стрелка показывают направление и угол отклонения шила, при котором удается отломать основание трансплантата для последующего извлечения.
Цифровые обозначения: 2 - мыщелок бедренной кости, 3-отрепонированная суставная поверхность мыщелка большеберцовой кости, 4-временные спицы, фиксирующие отломки суставной поверхности большеберцовой кости, 5 - дефект спонгиозной кости под отрепонированной суставной поверхностью, требующий восполнения, 8 - откинутая створка, 9 - кровоснабжающая створку надкостница, 11 - аутотрансплантат (заштрихован), 12 - шило.
Фиг.6 - Фотография извлечения аутотрансплантата при помощи шила.
Цифровые обозначения: 2 - мыщелок бедренной кости, 5 - дефект спонгиозной кости под отрепонированной суставной поверхностью, требующий восполнения, 8 - откинутая створка, 11 - аутотрансплантат (заштрихован), 12 - шило.
Фиг.7 - Фотография переноса аутотрансплантата при помощи шила в полость дефекта.
Цифровые обозначения: 2 - мыщелок бедренной кости, 3 - отрепонированная суставная поверхность мыщелка большеберцовой кости, 5 - дефект восполненный аутотрансплантатом, 8 - створка, 11 - аутотрансплантат (видно точное соответствие формы и размера аутотрансплантата зоне дефекта), 12 - шило, на котором трансплантат перенесен из бедра в большеберцовую кость.
Фиг.8. - Створка анатомично фиксировна на прежнее импакцией: шило указывает на створку, покрытую кровоснабжаемой надкостницей.
Цифровые обозначения: 8 - фиксированная импакцией створка (видно восстановление поверхности донорского места), 6 - капсула сустава, 12 - шило.
Способ взятия костного аутотрансплантата при остеосинтезе переломов мыщелков болыпеберцовой кости осуществляют следующим образом. Продольный разрез 1 начинают, от прилежащего мыщелка 2 бедренной кости и сопровождают подменисковой артротомией. После репозиции суставной поверхности 3 мыщелка большеберцовой кости и фиксации ее временными спицами 4 определяют истинный размер (форму, длину, ширину и высоту) восполняемого дефекта 5 под отрепонированной суставной поверхностью 3 мыщелка большеберцовой кости. Обнажают мыщелок бедренной кости 2, и в нем тотчас над капсулой сустава 6 тонкими широкими остеотомами 7 последовательно формируют три клиновидно сходящиеся плоскости остеотомии (I, II, III), благодаря которым отсекают (Фиг.2) и временно отводят (открывают) кортикальную створку 8 с сохранением кровоснабжаемой надкостницы 9 (Фиг.3). Сходящиеся плоскости остеотомии позволяют после забора трансплантата створку закрыть и фиксировать импакцией - заклинить в том же месте, от которого створку 8 открывали. По размерам дефекта 5 в спонгиозную кость эпифиза бедра 2 обнажившуюся после отведения створки 8, учитывая результаты измерений, последовательно внедряют остеотом 7 на глубину, равную глубине полости 5 с формированием трапециевидного контура 10, соответствующего размеру полости 5 (Фиг.4). После прохождения остеотомами 7 в центр формируемого аутотрансплантата 11 вводят шило 12 на всю его 11 глубину. Шило 12 покачивают из стороны в сторону и отклоняют на такой угол, который позволит сместить основание аутотрансплантата 11 проксимально, и мобилизовать его (то есть отламывают его 11 основание от спонгиозной кости), после чего извлекают аутотрансплантат 11 из бедра 2 (Фиг.5). Его 11 тотчас на шиле 12 переносят и укладывают в зону дефекта 5 большеберцовой кости с импакцией (Фиг.6 и 7). Закрывают кортикальную створку 8 бедренной кости 2, фиксируя ее на место ударом импактора 13 (Фиг.2 - схема, Фиг.8 - фото после импакции). В результате взятия аутотрансплантата в надмыщелковой зоне бедренной кости область донорского костного дефекта оказывается окруженной кровоснабжаемыми мощными спонгиозными стенками с быстро консолидирующейся створкой и имеющая тенденцию к заполнению спонгиозной костной тканью.
Остеосинтез перелома мыщелков проводят по принятой в клинике методике. На длительность периода консолидации предложенный способ костной пластики не влияет.
Такой способ взятия донорского трансплантата позволяет:
- повысить точность соответствия формы и размеров аутотрансплантата форме и размерам полости костного дефекта, что позволяет исключить этап подгонки трансплантата к полости, неизбежный при прочих методиках, а сразу перенести его на шиле из полости в полость;
- избавить пациентов и хирургов от всех проблем, связанных с взятием трансплантата из гребня подвздошной кости;
- сократить длительность и травматичность операции остеосинтеза перелома мыщелков большеберцовой кости за счет исключения дополнительного разреза в дополнительном операционном поле.
Толстая кортикально-спонгиозная створка на скате мыщелка бедренной кости после заклинивания импакцией быстро срастается, восстанавливая прочность донорского места. Восстановление донорской полости в спонгиозной кости донорского места несколько отстает от консолидации перелома, но укладывается в традиционные сроки реабилитации и не ухудшает качества конечного результата.
1. Оперативная хирургия под общей редакцией И.Литтмана, 2-е изд. - Изд-во Акад.Наук Венгрии. - 1982, Будапешт, с.865-866.
2. Мовшович И.А. Оперативная ортопедия. - руководство для врачей. - издание второе, переработанное и дополненное. - М.: Медицина. - 1994 г. - с.31.
3. Arrington, Е.D., Smith, W.J., Chambers, Н.G., Bucknell, A.L., and Davino, N.A.: Complications of iliac crest bone graft harvesting. Clin. Orthop., 329: 300-309, 1996.
4. Banwart, J.C, Asher, M.A., and Hassanein, R.S.: Iliac crest bone graft harvest donor site morbidity. A statistical evaluation. Spine, 20: 1055-1060, 1995.
5. Fowler, B.L., Dall, В.E., and Rowe, D.E.: Complications associated with harvesting autogenous iliac bone graft. Am J Orthop, 24: 895-903, 1995.
6. Younger, E.M, and Chapman, M.W.: Morbidity at bone graft donor sites. J. Orthop. Trauma, 3: 192-195, 1989.
7. E.Ahlmann, M.Patzakis, N.Roidis, L.Shepherd, P.Holtom Comparison of Anterior and Posterior Iliac Crest Bone Grafts in Terms of Harvest-Site Morbidity and Functional Outcomes // J.Bone and Joint Surg. - Am. - 2002. - N84. - p.716-720.
Техники забора и обработки костного материала
Установка дентальных имплантатов требует наличия адекватного объема костной ткани для обеспечения соответствующей поддержки титановой конструкции. Техника аугментации с использованием аутотрансплантатов является довольно распространённой процедурой; в качестве донорских участков для подобного вмешательства служат свод черепа, большеберцовая кость и, конечно же, гребень подвздошной. Но существует и другая сторона медали: при аутотрансплантации объем травматизации пациента увеличивается, а кортикогубчатые трансплантаты из эндохондральных донорских участков характеризируются довольно высоким уровнем резорбции. Следовательно, клиницисты начали использовать костные блоки, сформированные из внутриротовых участков, по типу симфиза или ветви нижней челюсти.
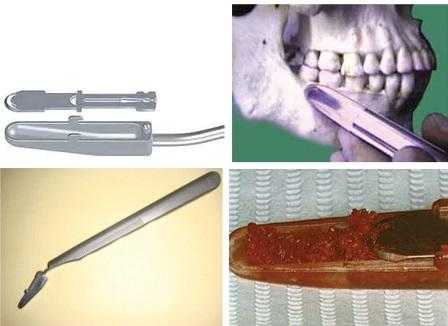
Костный скребок
Расширенный костный скребок типа 502 подходит как для сбора кости, так и для небольшого преднамеренного ее удаления, или нивелирования. Инструмент состоит из многоразовой ручки из нержавеющей стали и лезвия. При контакте лезвия с кортикальной костью образуются своеобразные ошурки, которые перемешиваются с кровью и пакуются в депо. Набранный костный материал можно сразу адаптировать в области дефекта или сначала переместить его в хирургическую чашку. Рукоятки доступны с тремя разными вариациями наклона рабочей части (прямой, 30 ° вверх и 30 ° вниз) - таким образом, клиницист может выбрать наиболее подходящую для себя в конкретном анатомическом участке. Одно из главных правил - край лезвия и поверхность кости должны соприкасаться в диапазоне углов 10-45°. Лезвия скребка стандартны, поэтому могут быть эффективно использованы с любым типом ручки (фото 1).
Фото 1. (а) Лезвия скребка; (б) Ручка скребка; (в) Метод забора кости; (г) Костный коагулят.
Костная мельница
Костная мельница является приспособлением, которое обеспечивает получение однородного костного трансплантата, размеры частиц которого зависят от приложенной силы давления. Подробленные чипсы легко удаляются из коллектора и могут быть адаптированы в области дефекта. После установки костного блока во входном отверстии мельницы, он измельчается путем поворота валика. Костная мельница помогает увеличить объем костного трансплантата, при этом экономя его необходимое количество, чем уменьшает степень инвазивности и травматичности ятрогенного вмешательства (фото 2).
Фото 2. (а) Круговая утрата кости; (б) Дефект вокруг имплантата; (в) Забор кости; (г) Вид костной мельницы; (д) Установка костного трансплантата вокруг титановой инфраконструкции.
Пьезохирургия
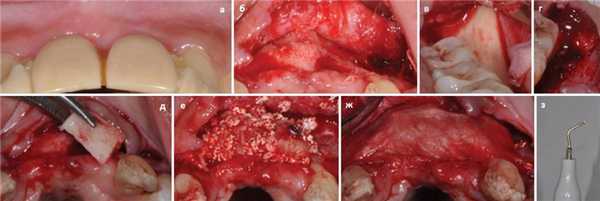
Пьезотом представляет собой специальное устройство, которое использует принцип микровибраций для резки костной ткани. Механизм его действия основан на способности некоторых видов керамики и кристаллов деформироваться при прохождении через них электрического тока, что впоследствии приводит к формированию микровибраций на ультразвуковой частоте. Вибрации затем передаются на нитридный или алмазный наконечник, который движется с частотой 25-30 КГц. Такие параметры аппарата помогают сегментировать тонкие костные структуры легко и с высокой точностью, без какого-либо разрушения мягких тканей. Кроме того, гистологические исследования доказали уменьшение резорбции костной ткани после пьезохирургии по сравнению с классическими вмешательствами, а также признаки лучшего заживления раны в постоперационный период. Использование пьезоэлектрических устройств помогает максимально упростить различные хирургические процедуры по типу синус-лифтинга, хотя некоторые исследования свидетельствуют о том, что существенных различий при сравнении долгосрочных результатов аугментации, выполненной традиционными и пьезоэлектрическими инструментами, в принципе нет (фото 3).
Фото 3 (а) Дефект альвеолярного гребня; (б) Сепарация лоскута; (в) Обнажение ветви нижней челюсти; (г) Забор аутогенного трансплантата; (д) Костный блок; (е) Адаптация аллотрансплантата вокруг аутотрансплантата; (ж) Коллагеновая мембрана; (з) Пьезотом с наконечником.
Размеры частиц, объем трансплантата, а также особенности его поверхности являются важными характеристиками костного материала: так, например, аутотрансплантаты с малыми размерами частиц имеют меньшую механическую стабильность и характеризируются более высокой активностью остеокластов по сравнению с аналогичными графтами с большим размером частиц. При этом важна также плотность трансплантата: если частицы упакованы слишком плотно, то это провоцирует дефицит места для миграции клеток и прорастания сосудов. Аутогенный костный материал может быть представлен в форме блока или смеси частиц. Последние являются более желательными, поскольку создают условия для лучшей реваскуляризации, высвобождения факторов роста и дифференциации клеток на более ранних стадиях. Однако общая площадь поверхности частиц значительно больше, чем у трансплантата в форме блока, следовательно, активность остеокластов в таком случае усиливается, что приводит к большей резорбции материала. Как для блоков, так и подробленных трансплантационных материалов существуют свои показания и рекомендации.
Так, например, было доказано, что резорбция трансплантатов из более мелких частиц более выражена через 4 недели после подсадки, нежели у трансплантатов из крупных частиц. Это может быть объяснено повышенным высвобождением факторов роста и дифференциации из общей большей поверхности мелких структурных составляющих. Последние исследования указывают на превалирующую роль остеоцитов в процессе контроля образования костной ткани по сравнению с остеобластами. Данные клетки, по-видимому, играют фундаментальную роль в ремоделировании костной ткани за счет секреции сигнальных факторов, участвующих в механизмах хемотаксиса, дифференцирования и апоптоза, контроля клеточной активности остеобластов, остеокластов и выстилающих костных клеток. При этом непосредственная чувствительность остеоцитов к внешним факторам трансплантата остается дискуссионным вопросом. Исходя из данного исследования, можно предположить, что на дифференциацию остеобластов и формирование новой костной ткани влияют как параметры забора трансплантата, так и его непосредственные характеристики. Pallesen и коллеги пришли к выводу, что оптимальный размер частиц автогенного костного трансплантата колеблется в диапазоне 0,5-2 мм, и является более рекомендованным нежели показатели около 10 мм, которые не так эффективно влияют на скорость и качество образования новой костной ткани.
Выводы
Аутогенные костные трансплантаты, полученные с использованием костной мельницы и костного скребка, обеспечивают лучшие перспективы для прироста твердой ткани, нежели аналоги, полученные посредством пьезохирургии. Идеальный костный трансплантат должен обладать остеоиндуктивностью, чтобы стимулировать остеогенез, и остеокондуктивностью для формирования адекватного каркаса, в который после мигрируют клетки и кровеносные сосуды. Подробленные костные материалы также являются предпочтительней костных блоков, поскольку обеспечивают лучшую реваскуляризацию трансплантата, и больший объем высвобождения факторов роста и дифференциации, что были доказано результатами гистометрических доклинических исследований.
Читайте также:
