Точки контроля репликации и повреждения ДНК
Добавил пользователь Валентин П. Обновлено: 22.01.2026
Клеточный цикл . Все новые клетки образуются путем деления уже существующих. Этот принцип, как уже отмечалось, сформулировал Р. Вирхов еще в середине XIX в. Деление клеток обеспечивает непрерывность существования жизни на нашей планете. Именно благодаря ему осуществляются различные способы бесполого и полового размножения организмов. В основе процессов роста, регенерации и индивидуального развития многоклеточных организмов также лежит деление клеток.
Период существования клетки от момента ее образования из материнской клетки до собственного деления (включая это деление) или гибели называется клеточным циклом.
Продолжительность клеточного цикла у разных организмов и различных клеток в составе одного организма варьирует. Так, у бактерий в благоприятных условиях он длится примерно 20 мин. Короткие клеточные циклы (30—60 мин) характерны для бластомеров рыб и земноводных на этапе дробления, в то время как у млекопитающих промежуток времени между делениями бластомеров может достигать 10 ч и более. У взрослых мышей клетки кишечного эпителия делятся каждые 11—22 ч, а роговицы глаза — приблизительно один раз в трое суток. Для регулярно делящихся клеток многоклеточных организмов длительность клеточного цикла обычно составляет 12—36 ч.
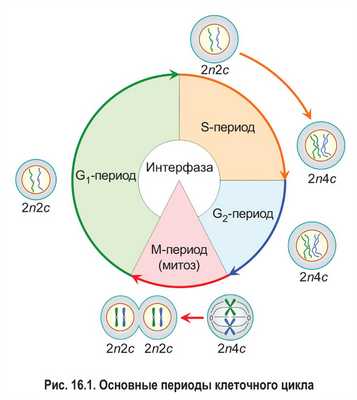
Клеточный цикл состоит из интерфазы и деления клетки (рис. 16.1). Интерфаза — это часть клеточного цикла между двумя последовательными делениями. Как правило, она занимает больше времени, чем само деление. Рассмотрим основные периоды интерфазы на примере эукариотической клетки.
Пресинтетический, или G1-пе риод (от англ. gap — промежуток), начинается с момента образования новой клетки в результате деления материнской. Обычно это самый длительный период интерфазы и клеточного цикла в целом. В течение G1-периода молодая клетка интенсивно растет, в ней увеличивается количество органоидов и синтезируются различные соединения, необходимые для протекания процессов жизнедеятельности. В том числе образуются вещества, которые будут нужны для последующего удвоения молекул ДНК.
Вы уже знаете, что набор хромосом обозначают как n: например, 1n — гаплоидный набор, 2n — диплоидный. Набор молекул ДНК в клетках принято записывать с помощью буквы с. Из § 14 вам известно, что каждая хроматида содержит одну молекулу ДНК, т. е. количество молекул ДНК и хроматид в составе хромосом всегда совпадает. Таким образом, записи типа 1с, 2с, 4с отражают содержание в клетках не только молекул ДНК, но и соответствующих хроматид.
В пресинтетическом периоде каждая хромосома состоит из одной хроматиды. Следовательно, в G1-периоде число хромосом (n) и хроматид (с) в клетке одинаковое. Набор хромосом и хроматид диплоидной клетки в G1-периоде клеточного цикла можно выразить записью 2n2c.
В синтетическом, или S-периоде (от англ. synthesis — синтез), происходит удвоение молекул ДНК — репликация, а также удвоение центриолей клеточного центра (в тех клетках, где он имеется). После завершения репликации каждая хромосома состоит уже из двух идентичных сестринских хроматид, которые соединены друг с другом в области центромеры. Количество хроматид в каждой паре гомологичных хромосом становится равным четырем. Таким образом, набор хромосом и хроматид диплоидной клетки в конце S-периода (т. е. после репликации) выражается записью 2n4c.
Постсинтетический, или G2-период, продолжается от окончания синтеза ДНК (репликации) до начала деления клетки. В это время клетка активно запасает энергию и синтезирует белки для предстоящего деления (например, белок тубулин для построения микротрубочек, образующих впоследствии веретено деления). В течение всего G2-периода набор хромосом и хроматид в клетке остается неизменным — 2n4c.
Итак, интерфаза обычно включает три периода: пресинтетический (G1), синтетический (S) и постсинтетический (G2). На протяжении всей интерфазы хромосомы не спирализованы. Они располагаются в ядре клетки в виде хроматина .
После завершения интерфазы начинается деление клетки. Основным способом деления клеток эукариот является митоз, поэтому данный этап клеточного цикла обозначают как М-период. При митозе происходит спирализация хроматина . Это приводит к формированию компактных двухроматидных хромосом. После этого сестринские хроматиды каждой хромосомы отделяются друг от друга и затем попадают в разные дочерние клетки. Значит, дочерние клетки, образовавшиеся в результате митоза и вступающие в новый клеточный цикл, имеют набор 2n2c.
Обобщенная информация об основных периодах клеточного цикла представлена в таблице 16.1.
Таблица 16.1. Основные периоды клеточного цикла
Период
Содержание наследственного материала в диплоидной клетке
Точки контроля репликации и повреждения ДНК

Вступление
По мере того, как клетки движутся по клеточному циклу, перескакивают ли они бесконтрольно с одной фазы в другую? Если это раковые клетки, ответ может быть да. Нормальные клетки, однако, проходят клеточный цикл регулируемым образом, используя информацию о своем внутреннем состоянии и сигналы из окружающей среды, они решают, следует ли продолжать деление. Это гарантирует, что клетки не станут делиться в неблагоприятных условиях (например, когда их ДНК повреждена или в ткани или органе нет места для большего количества клеток).
Контрольные точки клеточного цикла
Контрольная точка — это стадия в эукариотическом клеточном цикле, на которой клетка анализирует внутренние и внешние сигналы и «решает», стоит ли продвигаться дальше в процессе деления.
Существует несколько контрольных точек, но мы рассмотрим три наиболее важных из них:
· G1 контрольная точка, которую клетка проходит перед переходом из фазы G1 в фазу S.
· G2 контрольная точка,которую клетка проходит перед переходом из фазы G2 в фазу M.
· Контрольная точка шпинделя, при переходе из метафазы в анафазу.
Схема клеточного цикла с отмеченными контрольными точками.
Контрольная точка G1 находится в конце фазы G1 (близко к переходу G1 / S).
Контрольная точка G2 находится в конце фазы G2 (близко к переходу G2 / M).
Контрольная точка шпинделя находится на середине фазы M, а точнее, на переходе от метафазы к анафазе.
Контрольная точка G1
Контрольная точка G1 является основной точкой, в которой клетка должна сделать выбор, делиться ей или нет. Как только клетка проходит G1-контрольную точку и вступает в S -фазу, процесс деления запускается и может прерваться только в случае непредвиденных проблем, таких как повреждение ДНК или ошибки репликации. В остальных случаях клетка, которая прошла через контрольную точку G1, продолжит движение по клеточному циклу и в результате образует две дочерние клетки.
На контрольной точке G1 клетки решают, следует ли продолжить деление, основываясь на таких факторах, как:
· Размер клетки
· Питательные вещества
· Факторы роста
· Повреждение ДНК
В контрольной точке G1 клетка проверяет, являются ли внутренние и внешние условия подходящими для деления. Вот некоторые из факторов, которые может оценить клетка:
· Размер. Достаточно ли велика клетка для деления?
· Питательные вещества. Достаточно ли у клетки запасов энергии или доступных питательных веществ для деления?
· Молекулярные сигналы. Получает ли клетка положительные сигналы (например, факторы роста) от соседей?
· Целостность ДНК. Повреждена ли ДНК?
Это не единственные факторы, которые могут повлиять на прохождение через контрольную точку G1, и то, какие факторы являются наиболее важными, зависит от типа клетки. Например, некоторые клетки также нуждаются в механических сигналах (таких как соединение с поддерживающей сетью — внеклеточным матриксом), чтобы начать деление.
Если клетка не получает сигналов, нужных для прохождения контрольной точки G1, она может выйти из клеточного цикла и войти в состояние покоя под названием фаза G0. После чего в некоторых случаях клетки могут либо постоянно оставаться в фазе G0, либо возобновить деление, если условия поменяются на благоприятные.
Контрольная точка G1 находится в конце фазы G1, до перехода в S-фазу.
Если клетка не проходит контрольную точку G1, она может «выйти из клеточного цикла» и перейти в состояние покоя, называемое G0, из которого она может впоследствии повторно войти в G1 при соответствующих условиях.
X Международная студенческая научная конференция Студенческий научный форум - 2018

Актуальность: Данная тема является актуальной по причине того, что репарация является свойством живой клетки бороться с различными повреждениями ДНК, чтобы сохранить целостность ДНК. Данная тема затрагивает одну из важных задач современной медицины.
Цель: понять, как нарушается целостность генетического материала клетки и какие существуют восстановительные механизмы ДНК и как они работают.
1. Изучить, что такое репарация.
2. Разобрать, как происходит повреждение ДНК и по каким причинам
3. Выяснить, как работают репарационные механизмы ДНК
3. «Световое восстановление»………………………………………. …. 5
4. «Темновое восстановление»………………………………………. …….6
6. Классификация репарации………………………………………………..8
8. Интересные факты о репарации………………………………….………11
Репарация (от лат. reparatio — восстановление) — особая функция клеток, заключающаяся в способности исправлять химические повреждения и разрывы в молекулах ДНК, повреждённых при нормальном биосинтезе ДНК в клетке или в результате воздействия физических или химических реагентов. Осуществляется специальными ферментными системами клетки. Ряд наследственных болезней (напр., пигментная ксеродерма) связан с нарушениями систем репарации. В окружающем мире существует множество факторов, способных вызвать необратимые изменения в живом организме. Чтобы сохранить свою целостность, избежать патологических и несовместимых с жизнью мутаций, должна существовать система самостоятельного восстановления.
Нарушения в ДНК
Молекула дезоксирибонуклеиновой кислоты может быть разорвана как в ходе биосинтеза, так и под влиянием вредных веществ.
Источники повреждения ДНК:
- Ошибки репликации ДНК
- Апуринизация — отщепление азотистых оснований от сахарофосфатного остова
- Дезаминирование — отщепление аминогруппы от азотистого основания
К негативным факторам, в частности, относят температуру или физические силы различного происхождения. Если разрушение произошло, клетка запускает процесс репарации. Так начинается восстановление исходной структуры молекулы ДНК. За репарацию отвечают особые ферментные комплексы, присутствующие внутри клеток. С невозможностью отдельных клеток осуществлять восстановление связаны некоторые заболевания.
Впоследствии исследования Кельнера получили свое логическое продолжение в работах американских биологов Сетлоу, Руперта и некоторых других. Благодаря труду этой группы ученых было достоверно установлено, что фотореактивация является процессом, который запускается благодаря особому веществу - ферменту, катализирующему расщепление димеров тимина. Именно они, как выяснилось, образовывались в ходе экспериментов под воздействием ультрафиолета. При этом яркий видимый свет запускал действие фермента, который способствовал расщеплению димеров и восстановлению первоначального состояния поврежденных тканей. В данном случае речь идет о световой разновидности восстановления ДНК. Определим это более четко. Можно сказать, что световая репарация - это восстановление под воздействием света первоначальной структуры ДНК после повреждений. Однако данный процесс не является единственным, способствующим устранению повреждений.
Спустя некоторое время после открытия световой была обнаружена темновая репарация. Это явление происходит без какого-либо воздействия световых лучей видимого спектра. Данная способность к восстановлению обнаружилась во время исследования чувствительности некоторых бактерий к ультрафиолетовым лучам и ионизирующему излучению. Темновая репарация ДНК - это способность клеток убирать любые патогенные изменения дезоксирибонуклеиновой кислоты. Но следует сказать, что это уже не фотохимический процесс, в отличие от светового восстановления.
Механизм "темнового" устранения повреждений Наблюдения за бактериями показали, что спустя некоторое время после того, как одноклеточный организм получил порцию ультрафиолета, вследствие чего некоторые участки ДНК оказались поврежденными, клетка регулирует свои внутренние процессы определенным образом. В результате измененный кусочек ДНК просто отрезается от общей цепочки. Получившиеся же промежутки заново заполняются необходимым материалом из аминокислот. Иными словами, осуществляется ресинтез участков ДНК. Открытие учеными такого явления, как темновая репарация тканей, - это еще один шаг в изучении удивительных защитных способностей организма животного и человека.
Эксперименты, позволившие выявить механизмы восстановления и само существование этой способности, проводились с помощью одноклеточных организмов. Но процессы репарации присущи живым клеткам животных и человека. Некоторые люди страдают пигментной ксеродермой. Это заболевание вызвано отсутствием способности клеток ресинтезировать поврежденную ДНК. Ксеродерма передается по наследству. Из чего же состоит репарационная система? Четыре фермента, на которых держится процесс репарации - это ДНК-хеликаза, -экзонуклеаза, -полимераза и -лигаза. Первый из этих соединений способен распознавать повреждения в цепи молекулы дезоксирибонуклеиновой кислоты. Он не только распознает, но и обрезает цепь в нужном месте, чтобы удалить измененный отрезок молекулы. Само устранение осуществляется с помощью ДНК-экзонуклеазы. Далее происходит синтез нового участка молекулы дезоксирибонуклеиновой кислоты из аминокислот с целью полностью заменить поврежденный отрезок. Ну и финальный аккорд этой сложнейшей биологической процедуры совершается с помощью фермента ДНК-лигазы. Он отвечает за прикрепление синтезированного участка к поврежденной молекуле. После того как все четыре фермента сделали свою работу, молекула ДНК полностью обновлена и все повреждения остаются в прошлом. Вот так слаженно работают механизмы внутри живой клетки.
На данный момент ученые выделяют следующие разновидности систем репарации. Они активируются в зависимости от разных факторов. К ним относятся: реактивация, рекомбинационное восстановление, репарация гетеродуплексов, эксцизионная репарация, воссоединение негомологичных концов молекул ДНК. Все одноклеточные организмы обладают как минимум тремя ферментными системами. Каждая из них обладает способностью осуществлять процесс восстановления. К этим системам относят: прямую, эксцизионную и пострепликативную. Этими тремя видами восстановления ДНК обладают прокариоты. Что касается эукариот, то в их распоряжении находятся дополнительные механизмы, которые называются Miss-mathe и Sos-репарация. Биология подробно изучила все эти виды самовосстановления генетического материала клеток.
1. Прямая репарация — наиболее простой путь устранения повреждений в ДНК, в котором обычно задействованы специфические ферменты, способные быстро (как правило, в одну стадию) устранять соответствующее повреждение, восстанавливая исходную структуру нуклеотидов. Так действует, например, O6-метилгуанин-ДНК-метилтрансфераза, которая снимает метильную группу с азотистого основания на один из собственных остатков цистеина.
2. Эксцизионная репарация (англ. excision — вырезание) включает удаление повреждённых азотистых оснований из ДНК и последующее восстановление нормальной структуры молекулы. Эксцизионная репарация (excision repair): процесс с участием ферментативной системы, которая удаляет короткую однонитевую последовательность двунитевой ДНК , содержащей ошибочно спаренные или поврежденные основания , и замещает их путем синтеза последовательности, комплементарной оставшейся нити. Эксцизионная репарация является наиболее распространенным способом репарации модифицированных оснований ДНК. Этот тип репарации базируется на распознавании модифицированного основания различными гликозилазами, расщепляющими N-гликозидную связь этого основания с сахарофосфатным остовом молекулы ДНК. При этом существуют гликозилазы, специфически распознающие присутствие в ДНК определенных модифицированных оснований (оксиметилурацила, гипоксантина, 5-метилурацила, 3-метиладенина, 7-метилгуанина и т.д.). Для многих гликозилаз к настоящему времени описан полиморфизм, связанный с заменой одного из нуклеотидов в кодирующей последовательности гена. Для ряда изоформ этих ферментов была установлена ассоциация с повышенным риском возникновения онкологических заболеваний.
3. Пострепликативная репарация Tип репарации, имеющей место в тех случаях, когда процесс эксцизионной репарации недостаточен для полного исправления повреждения: после репликации с образованием ДНК, содержащей поврежденные участки, образуются одноцепочечные бреши, заполняемые в процессе гомологичной рекомбинации при помощи белка. Пострепликативная репарация была открыта в клетках E.Coli, не способных выщеплять тиминовые димеры. Это единственный тип репарации, не имеющий этапа узнавания повреждения.
Интересные факты о репарации
1. Полагают, что от 80 % до 90 % всех раковых заболеваний связаны с отсутствием репарации ДНК[4].
2. Повреждение ДНК под воздействием факторов окружающей среды, а также нормальных метаболических процессов, происходящих в клетке, происходит с частотой от нескольких сотен до 1000 случаев в каждой клетке, каждый час.
3. По сути ошибки в репарации происходят так же часто как и в репликации, а при некоторых условиях даже чаще.
4. В половых клетках сложная репарация, связанная с гомологичной рекомбинацией не происходит из-за гаплоидности генома этих клеток.
Репарация - это обязательное условие нормального функционирования организма. Подвергаясь ежедневно и ежечасно угрозам повреждений и мутаций ДНК, многоклеточная структура приспосабливается и выживает. Это происходит в том числе и за счет налаженной системы репарации. Отсутствие нормальной восстановительной способности вызывает болезни, мутации и другие отклонения. К ним относятся различные патологии развития, онкология и даже само старение. Наследственные болезни вследствие нарушений репарации могут приводить к тяжелым злокачественным опухолям и другим аномалиям организма. Сейчас определены некоторые заболевания, вызываемые именно сбоями систем репарации ДНК. Это такие, например, патологии, как синдром Кокейна, ксеродерма, неполипозный рак толстой кишки, трихотиодистрофия и некоторые раковые опухоли.
1. Кирпичев А.С., Севастьянова Г.А. Молекулярная биология М. AKADEMA. 2005г.
2. С.Коничев, Г.А.Севастьянова Молекулярная биология. — Москва: Академия, 2003г.
3. С.Г. Инге-Вечтомов. Генетика с основами селекции. — Москва: Высшая школа, 1989г.
XI Международная студенческая научная конференция Студенческий научный форум - 2019
Способы обнаружения повреждения генетического материала бактерий
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
ДНК представлена двумя типами молекул: большая - нуклеоид, где закодированы жизненно важные признаки, и малые - внехромосомные факторы наследственности в которых закодированы дополнительные признаки.Бактериальная клетка гаплоидна, а удвоение хромосомы (репликация ДНК) сопровождается делением клетки. Вегетативная репликация хромосомной ДНК обусловливает передачу генетической информации по вертикали от родительской клетки к дочерней. Передача генетической информации по горизонтали осуществляется различными механизмами в результате конъюгации, трансдукции, трансформации.
Внехромосомные молекулы ДНК представлены плазмидами, мигрирующими генетическими элементами - транспозонами и инсервационными (вставочными) или IS- последовательностями. [1].
Индуцированные повреждения ДНК между репликациями могут возникать под действием УФ, рентгеновского излучения, химических агентов и свободных радикалов. При таких повреждениях репаративные системы могут быть не состоятельны, изменения ДНК сохраняются - образуются мутации.
Процесс, позволяющий живым организмам восстанавливать повреждения, возникающие в ДНК, называют репарацией. Все репарационные механизмы основаны на том, что ДНК - двухцепочечная молекула, т.е. в клетке есть 2 копии генетической информации. Если нуклеотидная последовательность одной из двух цепей оказывается повреждённой (изменённой), информацию можно восстановить, так как вторая (комплементарная) цепь сохранена
Ключевыми элементами SOS-системы являются белки RecA и LexA. RecA ключевой белок процесса гомологичной рекомбинации, способствующий формированию особого R-триплекса с гомологичным участком ДНК и переносу нити ДНК с одной молекулы ДНК на другую. LexA - репрессор группы генов (их количество около 30-40), входящих в состав SOS-регулона. LexA связывается со специфическим десятичленным палиндромом в регуляторных областях генов SOS-регулона и таким образом препятствует их транскрипции.
Белок RecA выполняет несколько функций. Во-первых, он имеет высокое сродство к однонитевой ДНК, поэтому при взаимодействии с ДНК образуется растянутый филамент RecA: ДНК. Во-вторых, RecA в этом комплексе активируется и приобретает свойства весьма специфической протеазы, деградирующей белок-репрессор LexA (точнее, ускоряющей авторасщепление белка LexА, то есть он может быть назван его копротеазой). В результате разрушения LexA открываются гены SOS-регулона, из которых два гена, umuD и umuС, имеют прямое отношение к индуцированному мутагенезу.
Известна специфическую активность RecA* по отношению к белку UmuD. При взаимодействии RecA* с UmuD с N-конца UmuD отщепляются первые 24 аминокислотных остатка и образуется белок UmuD', который принимает непосредственное участие в SOS-мутагенезе.
Итак, в SOS-индуцированных клетках Е. coli в области повреждения формируется особая структура ДНК: вплоть до дефектного нуклеотида расположена двунитевая ДНК, с З'-ОН-концом последнего правильного нуклеотида которой связана ДНК-полимераза III, затем идут дефектный нуклеотид в матричной нити и однонитевая ДНК в виде филамента (RecA* : ДНК). Есть еще два уже упомянутых белка - UmuD' и UmuC, которые образуют комплекс (UmuD')2UmuC. Основная задача этого комплекса - "проскочить" сложный дефект и, желательно, без потерь, то есть без формирования бреши напротив дефекта. Подобный вариант синтеза и носит наименование TLS (translesion synthesis). Как правило, TLS сопровождается включением во вновь синтезируемую нить нуклеотида, некомплементарного исходному основанию в матрице. В результате возрастает выживаемость клетки (SOS-репарация) и возникает мутация (SOS-мутагенез) [2].
Биосенсоры - это разновидность химических сенсоров, в которых система распознавания имеет биохимическую природу и использует реакции либо индивидуальных биомолекул, либо биологических надмолекулярных структур. По определению биосенсора элемент биологического распознавания должен находиться в прямом пространственном контакте с преобразователем. Уникальной особенностью биосенсоров в отличие от химических датчиков является высокая специфичность биоузнающего элемента, а также его способность осуществлять узнавание без дополнительных затрат энергии. Биосенсоры могут использоваться для мониторинга веществ как биологической, так и небиологической природы.[3]
В генетической токсикологии для выявления и оценки мутагенной активности химических факторов окружающей среды принят поэтапный подход. На первом этапе тестирования используются бактериальные тест-системы и клеточные культуры. На втором этапе вещества, показавшие активность на этапе скрининга. На этапе первичной оценки мутагенной активности химических соединений чаще всего применяют тест Эймса. В качестве такового был предложен метод регистрации индукции SOS-ответа в клетках Е. coli, получивший название «SOS-хромотест» Сконструировали штамм E. coli PQ37 путем слияния хромосомного гена sfiA, детерминирующего одну из SOS-функций клетки - контроль клеточного деления, с фагом Mudlac, несущим беспромоторный ген lacZ. Последний попадает под контроль промотора SOS-гена и позволяет оценивать SOS-индуцирующий эффект различных химических соединений путем определения активности β-галактозидазы. Результаты изучения активности с помощью SOS-хромотеста большого числа химических соединений , включая и перекись водорода. Было показано, что перекись водорода является индуктором SOS-ответа в клетках E. coli PQ37 и его активность более выражена в клетках E. coli PQ300, отличающихся от E. coli PQ37 наличием делеции в гене антиоксидантной защиты OxyR. Несмотря на то что SOS-хромотест позволяет регистрировать активность генотоксичных соединений, включая перекиси так называемых окислительных мутагенов, то есть веществ, которые сами по себе не являются окислителями, однако нарушают естественный баланс между оксидантными и антиоксидантными процессами в клетке и, соответственно, приводят к развитию окислительного стресса. К числу таких агентов относятся некоторые соединения металлов, наночастицы, прооксиданты и другие индукторы окислительного стресса. Тестирование химических соединений на их способность индуцировать окислительный стресс в клетках стало возможным благодаря штаммам E. coli, содержащим плазмиду, в которую встроена генетическая конструкция с различными индуцируемыми промоторами, слитыми с lux-генами светящихся бактерий в качестве генов-репортеров. Такие штаммы получили название lux-биосенсоров и используются для обнаружения в компонентах окружающей среды тяжелых металлов , антибиотиков , токсичных и генотоксичных соединений [4].
Асонов Н. Р. Микробиология. 3 изд., перераб. и доп. / Н. Р. Асонов. - М.: Колос, 1997. - 352 с.
Сойфер В. Н. Репарация генетического повреждения / В. Н. Сойфер. - Вирджиния США, 1997
Turner A., Karube I., Wilson G. Biosensors, fundamentals and applications / University Press, Oxford. 1987.
Абилев С. К., Глазер В. М. Генетическая токсикология / С. К. Абилев, В. М. Глазер - М.:Генетика, 2013. - 81-93 c .
Хроматин — сенсор повреждений ДНК

Новость
Автор
Редактор
Ученые из России предложили новый механизм узнавания одноцепочечных разрывов ДНК. Нарушения генома, скрытые в нуклеосоме и находящиеся в нематричной цепи, не может регистрировать ни одна известная на данный момент система контроля целостности генома. Оказывается, РНК-полимераза, объединяясь с нуклеосомой, способна служить сенсором таких «скрытых» повреждений.
Зачем нужна репарация ДНК?
В ДНК закодирована генетическая информация любого живого организма, а поэтому она должна храниться в неизменном виде, чтобы избежать нарушений в работе клетки. Однако ДНК постоянно подвергается атаке опасных агентов, таких как ультрафиолет и активные формы кислорода. Избежать вредоносных воздействий невозможно, поэтому в клетке работают специальные «службы ремонта» ДНК — системы репарации [1, 2].
Как репарируются одноцепочечные разрывы свободной от белков ДНК?
ДНК в ядре эукариотической клетки находится в составе хроматина — конденсированного белково-нуклеинового комплекса, — а поэтому очень плотно упакована. Упаковка генетического материала играет важную роль в регуляции экспрессии генов: эффективно считываться (экспрессироваться) может только «распутанная» ДНК. Единицей хроматина является нуклеосома — ДНК, «намотанная» на основные хроматиновые белки — гистоны [3]. Нуклеосомы расположены примерно через каждые 200 пар нуклеотидов.
Таким образом, в клетке есть как свободная от белков ДНК, так и связанная с гистонами, но повредиться может и та, и другая. Самый распространенный тип повреждений ДНК — это одноцепочечные разрывы. Они опасны тем, что при их накоплении увеличивается вероятность нарушений и перестроек в геноме [4]. Это влечет за собой появление различных заболеваний, в том числе нейродегенеративных. В клетке есть специальные белки, которые сканируют свободную ДНК, узнают одноцепочечные разрывы и, в случае чего, запускают соответствующие реакции репарации.
А вот с нуклеосомной ДНК дело обстоит сложнее — разрывы в ней маскируют гистоны. За счет нуклеосом ДНК — молекула длиной в пару метров — упаковывается до микроскопических размеров, которые позволяют генетическому материалу поместиться в ядро. Взаимодействия с гистонами необходимы для правильной упаковки генома, но делают ДНК недоступной для сканирующих ее белков [5].
Как репарируются нарушения в структуре нуклеосомной ДНК?
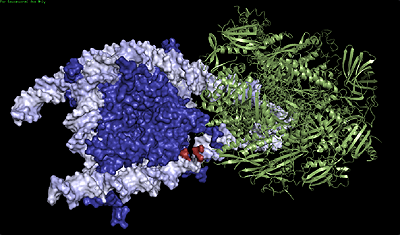
Рисунок 1. РНК-полимераза II, заключенная во внутринуклеосомную петлю, образует комплекс с ДНК и гистонами. РНК-полимераза показана зеленым цветом, ДНК белым, нуклеосомные гистоны синим, одноцепочечный разрыв (находится позади РНК-полимеразы) — красным. Ученые полагают, что именно такие петли могут служить сенсорами повреждений ДНК и предотвращать появление заболеваний, связанных с нарушениями генома.
Нарушения в структуре нуклеосомной ДНК тоже репарируются, но не до конца изучено, как именно. Сенсором в данном случае может служить РНК-полимераза. Наталкиваясь на поврежденный участок ДНК, фермент останавливается, а «застрявшая» РНК-полимераза — это сигнал системам репарации. У данного механизма есть один недостаток. Дело в том, что таким образом могут узнаваться только разрывы в матричной цепи ДНК (той, с которой идет синтез РНК). Однако показано, что разрывы в нематричной цепи также репарируются с высокой эффективностью [5].
Каким же образом это происходит, раз РНК-полимераза не может «чувствовать» такие разрывы? Российские ученые — под руководством доктора биологических наук Студитского Василия Михайловича — предложили интересный механизм, объясняющий, как происходит регистрация таких разрывов. Они показали, что нарушения в структуре нематричной цепи нуклеосомной ДНК также влияют на скорость движения РНК-полимеразы [5].
Ученые, исследуя транскрипцию в хроматине, использовали в качестве модельной системы мононуклеосомы, к которым был прикреплен промотор. Оказалось, что разрывы в нематричной цепи нуклеосомной ДНК радикально влияют на транскрипцию. Если одноцепочечный разрыв находится ближе к промотору (в проксимальной части нуклеосомы), то он вызывает остановку РНК-полимеразы. А если далеко от промотора (в дистальной части нуклеосомы), то, наоборот, ускоряет транскрипцию. Эффект замедления РНК-полимеразы показался исследователям более интересным, потому что, как известно, остановка транскрипции — это сигнал к репарации ДНК. Поэтому далее, изучая этот эффект подробнее, установили положение особенно критических для транскрипции точек. Например, одноцепочечный разрыв в положении +12 нематричной цепи нуклеосомной ДНК останавливает РНК-полимеразу более чем в 90% случаев (здесь и далее положения указаны от начала нуклеосомы).
Интересно, что фермент замирает не в месте разрыва нематричной цепи, а в определенных позициях: +24, +34, +44, которые находятся после разрыва. Видимо, в этих точках РНК-полимераза может заключаться во внутринуклеосомную петлю: то есть связи ДНК и гистонов восстанавливаются как перед ферментом, так и после него (рис. 1). Ученые полагают, что такие петли возникают и в норме, но нарушения в структуре нуклеосомы делают их более устойчивыми и трудноразрешимыми. Такая модель впервые объясняет биологическую роль так называемых топологических замков (topological locks), с которыми сталкиваются все ферменты, «читающие» ДНК эукариот.
Таким образом, хроматин и РНК-полимераза, объединяясь, могут служить сенсором повреждений генома там, где другие системы этого сделать не в состоянии.
На вопросы отвечает Герасимова Надежда — один из первых авторов исследования (разделяет первое авторство с Пестовым Николаем) и сотрудник МГУ им. Ломоносова.
Ваши данные указывают на то, что разрывы в нематричной цепи нуклеосомной ДНК могут как замедлять, так и ускорять транскрипцию. Может ли ускоряющий эффект иметь отношение к репарации ДНК?
Действительно, в некоторых случаях разрывы ДНК могут способствовать ускорению РНК-полимеразы, транскрибирующей нуклеосомную матрицу. На первый взгляд, такой эффект должен «скрывать» повреждения. Однако если ускорение фермента будет приводить к удалению гистоновых белков с ДНК, то это, напротив, может способствовать скорейшему узнаванию повреждения «обычными» системами репарации.
Планируете ли вы продолжать работу над данным исследованием, если да, то в каких направлениях?
Прежде всего мы хотим продолжить изучение обнаруженного эффекта в живых клетках. Здесь возникает много вопросов: насколько значим вклад механизма в общий уровень репарации разрывов, как быстро происходит клеточный ответ на такой сигнал, какова судьба остановленного фермента и другие. Мы надеемся, что дальнейшая работа поможет открыть новые перспективы в лечении и профилактике нейродегенеративных заболеваний, некоторые из которых развиваются именно из-за нарушения работы системы репарации однонитевых разрывов ДНК.
Почему вы решили изучать именно однонитевые разрывы?
Однонитевые разрывы — одни из самых частых повреждений, возникающих в ДНК. Например, в клетках человека они появляются десятками тысяч каждый день. Их накопление приводит к нарушению базовых процессов клеточного метаболизма. В случае активно делящихся клеток при репликации ДНК однонитевые разрывы могут приводить к двунитевым разрывам и нестабильности генома. А у неделящихся клеток однонитевые разрывы вызывают нарушение транскрипции и приводят к потере функциональности клеток (например, нейронов в случае нейродегенеративных заболеваний). Таким образом, поддержание целостности ДНК — важнейший процесс клеточного метаболизма.
Читайте также:
- Техники фиксации новорожденных для выполнения манипуляций. Методика пеленания
- Анатомия: Селезенка. Величина селезенки. Строение селезенки. Форма селезенки
- Зачем откладывать операцию при сходящемся косоглазии (инфантильной эзотропии)?
- Жжение к пластиковым протезам. Причины жжения при пластиковых протезах
- Отравление тетраэтилсвинцом и свинцовым бензином: проникновение в организм, клиника, профилактика
