Угнетение ксенобиотиками системы кроветворения. Бензольная гемопатия
Добавил пользователь Валентин П. Обновлено: 21.01.2026
В статье рассматриваются лекарственные средства, применение которых может привести к гематологическим нарушениям. Отмечается необходимость включения анализа возможного побочного действия лекарств в алгоритм клинического мышления при кровотечении, тромбозе и других нарушениях системы крови.
- КЛЮЧЕВЫЕ СЛОВА: кровотечения, гемостаз, лекарственные препараты, побочные эффекты
Таким образом, к препаратам, вызывающим нарушения кроветворения и гемостаза, относятся:
- антидепрессанты, селективные ингибиторы обратного захвата серотонина (семь препаратов);
- статины (три препарата);
- ингибитор ангиотензинпревращающего фермента (один препарат);
- гипогликемическое средство (один препарат);
- противовирусное средство (один препарат);
- регулятор потенции (один препарат);
- анальгетик (один препарат).
Практические вопросы коррекции гематологических нарушений, возникающих вследствие приема лекарственных препаратов
Селективные ингибиторы обратного захвата серотонина
Основное показание для использования селективных ингибиторов обратного захвата серотонина - большое депрессивное расстройство. Лекарства этого класса часто также назначают при тревожном неврозе, социальных фобиях, паническом расстройстве, обсессивно-компульсивном расстройстве, расстройствах приема пищи, хронических болях, иногда при посттравматическом стрессовом расстройстве. Селективные ингибиторы обратного захвата серотонина также применяются при булимии, ожирении, синдроме предменструального напряжения, расстройствах типа «пограничной личности», хроническом болевом синдроме, злоупотреблении алкоголем.
Селективные ингибиторы обратного захвата серотонина ингибируют активацию тромбоцитов, блокируя фосфолипид-гидролизирующие ферменты и фосфолипазу С тромбоцитарной мембраны [16]. Прием селективных ингибиторов обратного захвата серотонина в сочетании с антитромбоцитарными препаратами (аспирином, клопидогрелом) после инфаркта миокарда увеличивает риск кровотечения [17]. Возрастает риск кровотечения при сочетанном приеме селективных ингибиторов обратного захвата серотонина и варфарина [18]. При сочетании варфарина с флуоксетином возможно развитие спонтанной спинальной субдуральной гематомы, при которой необходимы ранняя декомпрессия и введение концентрата протромбинового комплекса [19].
Повышенный риск желудочно-кишечного кровотечения связывают с увеличением продукции кислоты в желудке при приеме селективных ингибиторов обратного захвата серотонина даже в короткие сроки (7-28 дней) [20].
Селективные ингибиторы обратного захвата серотонина угнетают функцию тромбоцитов, эндотелия и воспалительный ответ, оказывая тем самым протективное действие при ишемической болезни сердца [21].
Селективные ингибиторы обратного захвата серотонина могут быть причиной иммунной тромбоцитопении [22]. При эстетических операциях на молочных железах на фоне приема селективных ингибиторов обратного захвата серотонина риск кровотечения возрастает в четыре раза (с 1,44 до 4,59%). Рекомендуется скорректировать терапию до операции [23].
Особое внимание риску кровотечения следует уделять при длительном (более трех месяцев) приеме селективных ингибиторов обратного захвата серотонина [24]. Показана эффективность сочетания витамина К и концентрата протромбинового комплекса для коррекции кровотечения на фоне мультилекарственной интоксикации с участием селективных ингибиторов обратного захвата серотонина [25].
В рандомизированном исследовании показано, что лизиноприл относительно препаратов сравнения (диуретика, блокатора кальциевых каналов) увеличивает риск желудочно-кишечного кровотечения [26]. Описан случай спонтанной вторичной апластической анемии у 79-летней женщины после 12-месячного приема лизиноприла. Пациентке перелили девять доз эритроцитов и семь доз тромбоцитов. Проводили высокодозную стероидную терапию (преднизолон до 150 мг/сут) и стимуляцию гранулоцитопоэза (филграстим 300 мкг/сут подкожно в течение 25 дней), после латентного периода в течение нескольких недель в крови появились миелоидные клетки-предшественники и кроветворение восстановилось [27].
Прием аторвастатина и симвастатина (но не правастатина) в сочетании с варфарином повышает риск желудочно-кишечного кровотечения [28]. Статины не увеличивают риск внутричерепных кровотечений [29]. Наряду с рабдомиолизом и повреждением печени в редких случаях статины (особенно в сочетании с клопидогрелом) могут быть причиной тромботической тромбоцитопенической пурпуры. У таких пациентов клинический прогноз улучшается при быстром начале плазмообмена [30].
Риск кровотечения связывают с увеличением дозы метформина и пожилым возрастом пациентов. Метформин снижает агрегационную способность тромбоцитов и активирует фибринолиз [31]. Женщинам, принимающим метформин, нужно быть внимательными к вагинальным кровотечениям: их аномалия может свидетельствовать о дисплазии эндометрия [32]. При передозировке метформина развивается лактацидоз. Неблагоприятный исход обусловлен повреждением печени, максимальной диагностической значимостью обладает международное нормализованное отношение. Лечение - продленный бикарбонатный гемодиализ [33].
У некоторых пациентов, принимающих варфарин, начало терапии осельтамивиром приводит к двукратному увеличению международного нормализованного отношения, соответственно увеличивает риск кровотечения [34]. Описан случай развития глубокой анемии после начала терапии осельтамивиром у пациента с хроническим гепатитом С, получающим пегинтерферон альфа [35].
Препарат ингибирует ЦГМФ-специфическую фосфодиэстеразу 5 типа (ФДЭ-5), присутствующую не только в пещеристом теле, а также ингибирует ФДЭ-5-зависимую агрегацию тромбоцитов. Соответственно описаны довольно редкие внутричерепные кровотечения после приема силденафила, а также носовые и геморроидальные кровотечения, кровотечения из расширенных вен пищевода [36, 37].
Следует учитывать гепатотоксичность ацетаминофена и увеличение риска кровотечения при его сочетании с варфарином [38].
Анализ возможного побочного действия лекарств необходимо включить в алгоритм клинического мышления при кровотечении, тромбозе и других нарушениях системы крови.
Антигомотоксическая терапия заболеваний пищеварительного тракта
Оценивая организм как единую биологическую систему, можно определить более точно основную стратегию терапии, рассчитанной на саморегуляцию. В истоках любой сложной болезни, тем более на пике ее развития, всегда имеется несостоятельность функций пищеварительной системы - ключевого звена в системе поддержания гомеостаза и обеспечения способности организма к выздоровлению. Именно поэтому антигомотоксический компонент фармакотерапии заболеваний органов пищеварения следует рассматривать шире - как общетерапевтический перспективный подход к повышению качества жизни пациентов с любой патологией.
- КЛЮЧЕВЫЕ СЛОВА: Мукоза композитум, Лимфомиозот, Берберис-Гомаккорд, Нукс вомика-Гомаккорд, антигомотоксическая терапия, antihomotoxic drugs, diseases of gastrointestinal tract, Mucosa compositum
В последние десятилетия отмечается рост резистентности к широко используемым в гастроэнтерологии препаратам. Вместе с тем возникают сложности в проведении стандартной терапии, связанные с возможными побочными эффектами у пациентов с заболеваниями желудочно-кишечного тракта (ЖКТ). Сказанное обусловливает поиск новых подходов к терапии подобных заболеваний.
На наш взгляд, в плане оптимизации лечебных и профилактических программ у больных гастроэнтерологического профиля перспективными представляются комплексные антигомотоксические препараты, назначаемые согласно концепции гомотоксикоза Х.-Х. Реккевега (Hans-Heinrich Reckeweg) в различных схемах антигомотоксической терапии. Антигомотоксические средства представляют собой гомеопатические комплексы, содержащие малые дозы веществ растительного, животного и минерального происхождения и, следовательно, практически полностью исключающие токсическое и аллергическое воздействие на организм больного. К тому же препараты этого класса оказывают многостороннее терапевтическое действие на различные патогенетически значимые механизмы развития и прогрессирования того или иного заболевания. Это делает их незаменимыми в терапии хронических патологических процессов, имеющих прогредиентное течение и, как правило, требующих изнуряющих курсов медикаментозной терапии большим количеством аллопатических препаратов. Как известно, одно из основных положений гомотоксикологии Х.-Х. Реккевега заключается в том, что понятие «абсолютное здоровье» рассматривается как состояние человека, при котором все многочисленные факторы, поддерживающие постоянство внутренней среды, определяются в диапазоне нормальных значений, что априори свидетельствует об отсутствии нарушения каких-либо метаболических процессов и наличия в организме «гомотоксинов» (токсинов человека). Практическая реализация стратегии антигомотоксической терапии заболеваний ЖКТ невозможна без внедрения одного из ее базовых принципов - дезинтоксикации. Важность именно этого принципа объясняется следующим. С одной стороны, нарушения обменных процессов во многих случаях являются результатом дисфункций различных органов ЖКТ. С другой - зашлакованность продуктами нарушенного метаболизма внеклеточного пространства (матрикса) может благоприятствовать воспалительным и дегенеративным (хроническим) поражениям органов пищеварения и ими же усугубляться. Отметим, что адекватное восстановление дезинтоксикационного потенциала организма через оптимизацию функционального состояния органов пищеварения происходит по разным алгоритмам и на разных уровнях (организменном, тканевом, клеточном) и выходит за пределы решения чисто гастроэнтерологических проблем. В таблице перечислены широко применяемые в антигомотоксической терапии препараты и их дренажно-элиминационные свойства. Несмотря на специфическую органо-тканевую тропность комплексных антигомотоксических препаратов, ее следует признать относительной и не препятствующей использованию перечисленных средств в протоколах лечения различных заболеваний органов пищеварения. Эти лекарственные средства, имеющие принципиально разный состав по количественно-качественным характеристикам отдельных компонентов, а также различные общие показания к назначению, крайне необходимы для выполнения трех основных принципов антигомотоксической терапии - дренажа и дезинтоксикации, биологической поддержки тканей, органов и клеток, иммуномодуляции.
Лимфомиозот, Берберис-Гомаккорд, Нукс вомика-Гомаккорд (все препараты в виде капель для перорального применения) составляют универсальный детоксический набор (Detox-kit) [1], рекомендованный к использованию практически при любых алгоритмах антигомотоксической терапии. Лимфотропный препарат Лимфомиозот способен успешно дренировать соединительную ткань от экзо- и эндотоксинов и создавать условия для оптимальной работы иммунной системы [2]. Сложно переоценить роль этого антигомотоксического средства и в поддержании функционального состояния муцина - важного компонента слизистого слоя для эффективной терапии синдрома повышенной проницаемости ЖКТ [3]. Препарат Берберис-Гомаккорд стимулирует детоксикационные процессы не только в почках, но и в печени и показан в терапии мочекаменной и желчнокаменной болезни [4]. Препарат Нукс вомика-Гомаккорд, основное терапевтическое показание которого спастический колит [5], обоснованно применяется при острых и хронических гастритах [6]. Препарат Мукоза композитум (ампулированная лекарственная форма) как средство, тропное к дыхательной системе, с выраженными биостимулирующими и иммуномодулирующими свойствами заслуживает внимания и в аспектах оптимизации ряда процессов дезинтоксикации. Это комплексное средство, созданное на основе вытяжек из слизистых оболочек различной локализации, эффективно поддерживает функцию таких систем, как цитохром Р450 и р-гликопротеин и катион/анион-транспортирующая система, - важных элементов различных фаз детоксикации [3]. Терапевтические точки приложения препарата неограниченны.
Антигомотоксическое лечение как достаточно самостоятельный вид терапии может быть оправданно при самых разных по характеру патологических процессах в органах пищеварения - от функциональных расстройств до серьезных органических поражений. В любом случае оптимальная стратегия антигомотоксического лечения базируется на максимальном учете субъективных и объективных признаков в клинической картине пациента и особенностей патогенеза заболевания.
Комплексные антигомотоксические препараты целесообразно назначать в амбулаторных условиях детям, страдающим гастродуоденитами в сочетании с дискинезиями желчевыводящих путей и диспанкреатизмом [7]. В первом клиническом варианте сочетанной патологии органов ЖКТ следует применять три препарата - Лимфомиозот, Траумель С, Мукозу композитум, а во втором - четыре - Лимфомиозот, Траумель С, Хепель, Гепар композитум. Исследования показали, что результатом эффективности такой терапии является достаточно раннее улучшение субъективной и объективной симптоматики у больных. Уже на 3-5-й день от начала лечения наблюдалось выраженное уменьшение диспепсических проявлений, улучшение аппетита. К концу первой недели жалоб на боли в эпигастрии и области правого подреберья не отмечалось. Стойкая клиническая ремиссия заболевания возникала к 10-12-му дню терапии. Обследование, проведенное через два месяца после завершения 4-5-недельного курса лечения, показало, что в 100% случаев у больных отсутствовали признаки нарушения ферментативной активности ЖКТ (по данным копрограммы).
Триада антигомотоксических препаратов (Лимфомиозот, Мукоза композитум, Траумель С) оказалась целесообразной в терапии эрозивных гастродуоденитов, ассоциированных с инфекцией Helicobacter pylori. По эффективности четырехнедельный курс такого лечения не уступал стандартной эрадикационной терапии (Де-Нол + амоксициллин + фуразолидон + Линекс), но обходился в 1,42 раза дешевле [8].
Очень важным аспектом практического использования комплексных антигомотоксических препаратов при заболеваниях органов пищеварения является практически абсолютная встраиваемость этих средств не только в стандартные протоколы терапии, но и в общепринятые подходы к лечению тех или иных патологических процессов. Установлено, что препараты Гепар композитум, Траумель С, назначаемые в сочетании с одним из комплексных антигомотоксических катализаторов обменных процессов (Коэнзим композитум или Убихинон композитум) внутривенно капельно в процессе предоперационной подготовки больных желчнокаменной болезнью на фоне цирроза печени, существенно сокращают общие сроки стационарного лечения пациентов в среднем на пять дней [10]. Имеются и более расширенные программы применения этих комплексных антигомотоксических средств у хирургических больных во всем периоперационном периоде, в частности при проведении лапароскопических холецистэктомий по поводу желчнокаменной болезни, осложнившейся хроническим холециститом [11]. Таким пациентам после выписки из стационара при долечивании в условиях поликлиники или во время реабилитации в условиях специализированного санатория целесообразно назначать пероральную антигомотоксическую терапию (Траумель С, Хепель).
Высокая эффективность антигомотоксических средств в условиях терапевтического стационара показана в отношении пациентов с язвенной болезнью в стадии обострения с локализацией процесса в двенадцатиперстной кишке (ДПК) [12]. Комплексные антигомотоксические препараты (Мукоза композитум, Траумель С) назначались на фоне стандартного лечения [13], диетического питания и электролечения (КВЧ-терапия). Сочетанные протоколы лечения язвенной болезни ДПК приводили к достаточно быстрому купированию болевого синдрома, а болезненность при пальпации в эпигастральной и пилородуоденальной зоне живота в 50% случаев исчезала через две недели от начала лечения. К тому же сроку, по данным эндоскопического гастродуоденального мониторинга (один раз в 7-10 дней), почти у всех больных восстанавливалась функция кардиального жома, были полностью ликвидированы воспалительные явления и эпителизированы эрозии в пищеводе и антральном отделе желудка, устранены функциональные нарушения привратника. У большинства пациентов на третьей неделе терапии в ДПК на месте язвенных дефектов (от 0,5 до 1,0 см по большому размеру) констатировалось образование функционально полноценных рубцов, не деформирующих стенку кишки, а к концу четвертой недели у всех пациентов процесс рубцевания благополучно завершался. С этими результатами во многом согласуются данные, полученные Е.А. Рурой и соавт. [14], позволившие дифференцированно охарактеризовать терапевтические показания лекарственных средств при язвенных поражениях верхних отделов пищеварительного тракта. Препарат Мукоза композитум показан при геморрагических осложнениях язвенного процесса, склонности к рубцовой деформации и при сниженной общей реактивности пациента. В сочетании с другими комплексными антигомотоксическими препаратами (Гастрикумель, Дуоденохель) Мукоза композитум существенно повышает процент пациентов со стабильным состоянием по данным катамнестических клинико-лабораторных наблюдений, проводимых каждые шесть месяцев в течение двух лет.
Таким образом, комплексные антигомотоксические препараты, назначаемые в лечебно-профилактических программах больным с заболеваниями ЖКТ, являются высокоэффективными средствами. Вызывая адекватную стимуляцию неспецифических механизмов резистентности и иммуномодуляцию [15], они позволяют воздействовать на многочисленные патогенетические звенья при патологии органов пищеварения и обладают выраженным морфофункциональным потенциалом - не только способствуют восстановлению или повышению функциональной активности ЖКТ, но и обеспечивают физиологически выгодную репарацию различных по глубине язвенных дефектов. Важно, что данные эффекты антигомотоксических препаратов в ряде случаев были достигнуты на фоне стандартной терапии, в частности при проведении эрадикации и подавлении секреторной активности желудка у больных язвенной болезнью [12], что в целом давало положительный экономический результат лечения и сокращало дни временной нетрудоспособности пациентов. При выборе адекватной тактики фармакотерапии при заболеваниях органов пищеварения можно руководствоваться принципом разумного риска и пользы [16]. При легкой и среднелегкой формах нарушения экзокринной недостаточности поджелудочной железы терапевтически оправданно лечение комплексными антигомотоксическими препаратами (Момордика композитум, Лептандра композитум и др.). При тяжелой показана только сочетанная тактика лечения с дополнительным назначением ферментных препаратов.
Комплексный подход к терапии заболеваний ЖКТ позволяет значительно расширить рамки медикаментозного лечения больных с различной патологией органов пищеварения как в амбулаторных условиях, так и в специализированных стационарах, реабилитационных центрах, профилакториях и санаториях. Дальнейшая разработка данного направления может способствовать оптимизации и созданию новых программ фармакологического сопровождения больных с заболеваниями ЖКТ.
Механизм угнетения нормального кроветворения при гемобластозах
Что такое Механизм угнетения нормального кроветворения при гемобластозах -
Само по себе угнетение нормального кроветворения при опухолях из кроветворных клеток является главным звеном их механизма развития.
Нет какого-то одного механизма угнетения нормального кроветворения. Таких механизмов может быть несколько. Например, угнетение эритроцитопоэза и гранулоцитопоэза при сублейкемическом миелозе может находиться в связи с постепенным вытеснением нормального микроокружения кроветворной ткани за счет фиброза костного мозга, индуцируемого лейкозными клетками. Этот частный механизм редко свойствен другим лейкозам.
Определенной форме гемобластоза свойствен определенный довольно специфический эффект, которым может быть либо стимуляция, либо подавление, что далеко не всегда зависит от стадии и особенностей процесса. Специфичным является феномен, при котором между распространенностью опухолевых клеток в костном мозге и угнетением нормальных ростков нет отчетливой связи. Особенно ярка картина угнетения нормальных ростков на фоне малого распространения лейкозных клеток при так называемых предстадиях острого лейкоза, когда появление отдельных небольших групп бластных клеток в костном мозге сопровождается глубокой панцитопенией (чаще всего это предстадии острого эритромиелоза, миелобластного или миеломонобластного лейкоза).
К каким докторам следует обращаться если у Вас Механизм угнетения нормального кроветворения при гемобластозах:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Механизма угнетений нормального кроветворения при гемобластозах, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Лейкопении и агранулоцитозы
Удельный вес лейкопенических состояний среди других заболеваний системы крови довольно велик. Статистические данные свидетельствуют об увеличении за последние годы числа больных с выраженной лейкопенией. Нередко развитие данной патологии находится в определенной связи с применением в лечебной практике новых бактериостатических средств, с воздействием ионизирующей радиации, а также с увеличением эпизодов аллергических заболеваний. В оценке лейкопенических состояний врачу следует избегать двух противоположных тенденций: в одних случаях отсутствует должное внимание к лейкопении, являющейся началом тяжелой патологии системы крови, и не принимаются необходимые профилактические и лечебные меры, в других -любое снижение количества лейкоцитов расценивается как симптом тяжелой патологии с необоснованным применением сильнодействующих лейкопоэтических средств (средств, усиливающих интенсивность образования указанных форменных элементов крови). Поэтому для правильной оценки значения «индивидуальной» лейкопении необходимо по возможности выяснить ее причины и механизм развития, так как только подобное решение вопроса обеспечивает успех лечебно-профилактических мероприятий в каждом отдельном случае. Лейкопении часто сочетаются со значительным уменьшением количества нейтрофилов в периферической крови, поэтом- по своей сути они являются нейтропениями или гранулоцитопениями (соответственно снижение количества нейтрофилов и гранулоцитов).
Причины гранулоцитопении при всем их разнообразии разделяются на экзогенные (действующие извне), эндогенные (возникающие в самом организме) и наследственные. К первой группе факторов относятся некоторые вещества, которые обладают токсическим действием, такие как бензол, толуол, мышьяк, ртуть; некоторые лекарственные препараты; радиация; инфекционные заболевания.
Эндогенными причинами нейтропении могут являться нарушение эндокринной регуляции гранулоцитопоэза, т. е. образования гранулоцитов (тиреотоксикоз, недостаточность функции надпочечников, нарушение функции гипофиза), повышение функции селезенки, аллергические состояния.
Перечисленные лейкопении относят к группе функциональных. Но лейкопения и нейтропения могут быть проявлением нарушения костномозгового кроветворения при системной патологии крови: остром лейкозе, гипо- и апластических состояниях. В ряде случаев не удается выявить причинный фактор, приводящий к развитию гранулоцитопении. В последнее время таких форм становится все меньше.
В последние годы выделяется особая группа наследственных нейтропении (постоянные и периодические нейтропении). Кроме того, лейкопении могут носить симптоматический характер в виде непостоянного гематологического признака при некоторых заболеваниях.
Умеренные бессимптомные лейкопении без каких-либо клинических проявлений обнаруживаются случайно, являются одним из второстепенных и необязательных симптомов разных заболеваний. Характеризуются умеренным снижением количества лейкоцитов (до 3,0-4,0 Ч 109/л) и нерезкой гранулоцитопенией (40-60% от общего числа нейтрофилов). Функциональные свойства лейкоцитов не изменены. Миелопоэз не нарушен. Костный мозг нормален. Не отмечается также изменений формирования эритроцитов и тромбоцитов. Подобные лейко- и нейтропении носят чаще всего чисто симптоматический характер, сопровождая ряд заболеваний, не относящихся к системе крови (тиреотоксикоз, гастриты, энтероколиты, холециститы и многие др.).
Резко выраженная лейкопения сопровождается обычно резким понижением количества нейтрофилов в периферической крови и носит название агранулоцитоза.
Очень важно определить, когда с уверенностью можно говорить о лейкопении. В существующих руководствах по гематологии и физиологии, а также в сп-авочниках указывается нормальное содержание лейкоцитов, которое составляет 6,08,0 Ч 109/л, и врач при оценке патологических сдвигов исходит из этих цифр.
В последние годы внимание гематологов всех стран привлекает тот факт, что при отсутствии какой-либо патологии у совершенно здоровых людей обнаруживается пониженное количество лейкоцитов (от 4,0 до 2,0-2,5 Ч 109/л) с умеренной нейтропенией и относительным лимфоцитозом в лейкоцитарной формуле. В этой связи были проведены массовые исследования периферической крови здоровых лиц, что позволило расширить суженную норму количества лейкоцитов от 4,0 до 9,0 Ч 109/л. В повседневной практике содержание лейкоцитов менее 4,0 Ч 109/л можно расценивать как лейкопению, а более 9,0 Ч 109/л - как лейкоцитоз. Расширены и пределы нормальных колебаний процентного содержания палочкоядерных нейтрофилов до 7%, моноцитов - до 10%, лимфоцитов - от 19 до 40%, эозинофилов - до 5%. Поэтому те случаи, когда имеются низкие цифры лейкоцитов (до 4,0-3,0 Ч 109/л), при которых тщательное клинико-гематологическое обследование и последующее наблюдение не обнаруживают какой-либо патологии, могут расцениваться как «безопасная лейкопения». В развитии такой лейкопении имеет значение прежде всего индивидуальная конституциональная особенность регуляции кроветворения у каждого человека. В таких случаях не требуется никакой терапии, стимулирующей образование в костном мозге и выход в периферическую кровь лейкоцитов.
В основе агранулоцитоза лежит клинико-гематологический синдром, характеризующийся полным или почти полным исчезновением гранулоцитов из периферической крови. За агранулоцитоз следует принимать состояние, характеризующееся снижением числа лейкоцитов до 1 Ч 109/л (1000 в 1 мм3) и ниже с падением абсолютного числа зернистых лейкоцитов менее 0,5 Ч 109/л (150 в 1 мм3).
Патогенез (что происходит?) во время Лейкопении и агранулоцитозы:
Агранулоцитоз разделяется на две основные формы: миелотоксический и иммунный.
Причиной миелотоксического агранулоцитоза могут быть цитостатические факторы любой природы - химиопрепараты (меркаптопурин, метотрексат, циклофосфан, миелобромол, Тио-Тэф), ионизирующая радиация, а также некоторые медикаменты, не использующиеся как химиопрепараты с цитостатической целью, но обладающие иногда подобным побочным эффектом (левомицетин, аминазин).
Механизм миелотоксического агран-лоцитоза обусловлен подавлением цитостатическими факторами клетки предшественницы миелопоэза или полипотентной стволовой клетки.
Аналогичная гематологическая картина наблюдается при острых лейкозах, в терминальной стадии хронического миелолейкоза, метастазах в костный мозг, рака и саркомы, также вызывающих угнетение и остановку нормального кроветворения, следствием чего является агранулоцитоз.
Иммунный агранулоцитоз в отличие от миелотоксического обусловлен не остановкой продукции нейтрофилов, а их гибелью в крови и костном мозге, иногда вплоть до клеток-предшественниц гранулоцитарного ряда вследствие появления антигранулоцитарных антител (антител против гранулоцитов). Различают гаптеновый иммунный агранулоцитоз и аутоиммунный. Первый возникает под воздействием лекарственных препаратов, являющихся гаптенами (неполными антигенами), к которым относятся аминодопирин, анальгин, бутадион, сульфаниламиды, метилтиоурацил, ртутные, мочегонные, противотуберкулезные препараты - ПАСК, фтивазид, тубазид. Соединение антител с антигенами, фиксирующимися на поверхности лейкоцитов, сопровождается агглютинацией («склеиванием») и гибелью клеток. При аутоиммунном агранулоцитозе антилейкоцитарные антитела (антитела против лейкоцитов) возникают вследствие извращенной реакции иммунной системы с образованием аутоантител к лейкоцитам с неизмененной антигенной структурой. Часто наблюдаются при больших коллагенозах (системная красная волчанка, ревматоидный полиартрит).
В развитии миелотоксического агранулоцитоза решающая роль принадлежит величине повреждающего воздействия - дозам медикамента, ионизирующей радиации, степени подавляющего эффекта атипичных клеток при опухолевых процессах. При иммунном агранулоцитозе доза причинного фактора не имеет решающего значения, так как важнейшая роль в данном случае принадлежит индивидуальной чувствительности организма.
Симптомы Лейкопении и агранулоцитозы:
В клинических проявлениях миелотоксического и иммунного агранулоцитозов имеются различия. Иммунный агранулоцитоз, связанный с приемом медикаментов гаптенового ряда, чаще развивается остро, с быстрым нарастанием симптомов. Вскоре после приема медикаментов развиваются гранулоцитопения или агранулоцитоз, высокая лихорадка и быстрое присоединение инфекционных осложнений (ангина, стоматит, кандидамикоз носоглотки, иногда - и слизистой пищевода). Септические осложнения представляют основную опасность для жизни больного. Некротическая ангина является классическим проявлением агранулоцитоза. На миндалинах обнаруживаются грязно-серый налет, затем - некроз и язвы. Некротизация захватывает язычок, мягкое и твердое небо; часто возникает кровотечение. Однако некрозы могут локализоваться также в кишечнике, протекая с тифоподобной картиной, в пищеводе, мочевом пузыре, женских половых органах. В легких нередко развивается пневмония, которая протекает атипично, часто приводит к образованию абсцесса, гангрены. Печень может быть умеренно увеличена, размеры селезенки, как правило, не изменены. Желтуха встречается довольно редко; в моче - умеренная альбуминурия (белок в моче), связанная с септическим состоянием.
При иммунном агранулоцитозе со стороны крови отмечается лейкопения, абсолютный агранулоцитоз. Число эритроцитов, ретикулоцитов, тромбоцитов не изменено. Геморрагический синдром не выражен. Костный мозг не опустошен, наблюдается небольшое снижение его клеточного состава. Лишь при обострениях агранулоцитоза наступает опустошение костного мозга.
Миелотоксический агранулоцитоз имеет особенности клинической и гематологической картины, что определяется спецификой его развития - высокой чувствительностью к повреждению стволовых и созревающих клеток костного мозга и очень малой чувствительностью зрелых элементов. Он начинается внезапно. Без каких-либо субъективных признаков болезни в крови снижается содержание лейкоцитов и, как правило, ретикулоцитов и тромбоцитов. Первые внешние признаки болезни: лихорадка, стоматит, «агранулоцитарная ангина», геморрагический синдром - выявляются на фоне глубоких изменений в периферической крови и резкого снижения клеточности костного мозга.
В то же время поражение слизистой оболочки ротоглотки и желудочно-кишечного тракта с развитием некротической энтеропатии является одним из наиболее постоянных признаков миелотоксического агранулоцитоза, имеющим двоякое происхождение.
К инфекционным осложнениям агранулоцитоза относятся также сепсис (нередко стафилококковый), медиастинит (воспаление средостения) и пневмонии. При этом пневмонии протекают на фоне скудных физикальных и рентгенологических данных.
Диагностика Лейкопении и агранулоцитозы:
Диагноз агранулоцитоза следует обязательно дифференцировать с острым лейкозом (его лейкопенической формой).
Диагностические ошибки возможны в обоих направлениях, чаще всего это касается морфологических ошибок, когда значительный процент лимфобластов принимают за лимфоциты, поскольку и те и другие имеют некоторые черты сходства. В ряде случаев возможен «агранулоцитарный старт» острого лейкоза, который в начале заболевания ошибочно квалифицируется как агранулоцитоз. В дальнейшем же развивается типичная лейкемическая стадия острого лейкоза. В отличие от апластической анемии при агранулоцитозе нет анемического и тромбоцитопенического синдрома.
Прогноз при пластических (функциональных) формах агранулоцитоза благоприятный, в течение 2-3 недель наступают клиническое выздоровление и полная репарация (восстановление) крови. При апластических формах прогноз более серьезен, однако при своевременной и обоснованной терапии возможно выздоровление.
Признаком начинающегося восстановления кроветворения у больных агранулоцитозом является моноцитоз (увеличение количества моноцитов) с наличием их предшественников в крови.
Лечение Лейкопении и агранулоцитозы:
Основная роль в борьбе с цитопеническими состояниями принадлежит профилактике. Учитывая выраженные воздействия лучистой энергии, производных бензола, необходимы строгие меры защиты лиц, систематически подвергающихся воздействию этих факторов. Одними из таких мероприятий являются контроль за составом крови у них и своевременные мероприятия по обеспечению мер безопасности. Это определяет наиболее эффективную форму динамического клинико-гематологического контроля - диспансерное наблюдение всех лиц с лейкопенией, нейтропенией и цитопенией.
Далеко не каждое снижение количества лейкоцитов требует энергичной, стимулирующей образование лейкоцитов терапии. Такая терапия необходима там, где лейкопения является следствием нарушения функции костного мозга. Терапевтические мероприятия при лейкопениях различного происхождения зависят от их выраженности и клинических проявлений. В настоящее время в клинике применяется значительное количество препаратов, обладающих способностью стимулировать созревание гранулоцитов. К их числу относятся нуклеиновокислый натрий, пентоксил, лейкоген, батилол, которые являются физиологическими стимуляторами лейкопоэза. Однако лечебная эффективность этих препаратов оправдана лишь при умеренной лейкопении, особенно медикаментозной.
В лечебной тактике агранулоцитоза необходимо исключение цитостатических препаратов, ионизирующего излучения, медикаментозных гаптенов. Особое значение имеет создание асептических условий (помещение больных в боксы или изоляторы с установленными бактериоцидными лампами, ультрафиолетовое облучение палат), санация кожи и слизистых оболочек.
Лечение бактериальных осложнений антибиотиками должно быть неотложным с первых дней диагностирования агранулоцитоза. Используются антибиотики широкого спектра и в больших дозах (пенициллин, ампициллин, цепорин, гентамицин).
При иммунном агранулоцитозе лечение антибиотиками проводят до восстановления лейкограммы и ликвидации бактериальных осложнений. С целью снижения степени гранулоцитопении и ее продолжительности важно применение лейкоцитарной, а для борьбы с тромбоцитопеническими кровотечениями (главным образом, при миелотоксической форме агранулоцитоза - цитостатической болезни) - и тромбоцитарной массы. Для профилактики и лечения некротической энтеропатии используют подавление патогенной кишечной флоры со стерилизацией кишечника при помощи антибиотиков (канамицин, ристомицин, нистатин), а также внутривенное питание больных. В терапии иммунного агранулоцитоза основную роль играют кортикостероидные гормоны.
Преднизолон, преднизон, триамоинолон, дексаметазон используются как средства десенсибилизирующие, подавляющие образование агрессивных антител и стимулирующие созревание гранулоцитов. Восстановление белого ростка костного мозга в таких случаях идет быстро. С нормализацией числа лейкоцитов, обычно через 10-14 дней, доза гормонов сокращается не менее чем наполовину. Лечение гормонами прерывистыми курсами продолжается до полного выздоровления и до исчезновения аутоиммунных антител. При выраженных язвенно-некротических проявлениях необходима известная осторожность в отношении использования кортикостероидов. Больным миелотоксическим агранулоцитозом стероидные гормоны противопоказаны.
Прогноз при иммунном агранулоцитозе относительно благоприятен. Раннее и правильное лечение может привести к выздоровлению. При миелотоксическом агранулоцитозе прогноз зависит от тяжести поражения. Общая летальность при агранулоцитозе - около 25%, в основном за счет некротической энтеропатии, общего сепсиса, гангрены, чаще - при миелотоксической форме.
Лица, болевшие агранулоцитозом, нуждаются в диспансерном наблюдении. Это особенно относится к тем больным, которые выписываются из стационара в удовлетворительном состоянии с достаточным числом лейкоцитов (3000-4000), но нередко с низким содержанием гранулоцитов. Это свидетельствует о недостаточном и неустойчивом восстановлении кроветворения. Периодический гематологический контроль периферической крови больных позволяет обнаружить постепенное падение числа гранулоцитов. Профилактика реальна при условии известной причины развития данного заболевания. В частности, должен быть абсолютно исключен медикамент, вызвавший агранулоцитоз или лейкопению.
К каким докторам следует обращаться если у Вас Лейкопении и агранулоцитозы:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Лейкопении и агранулоцитозы, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Апластическая анемия
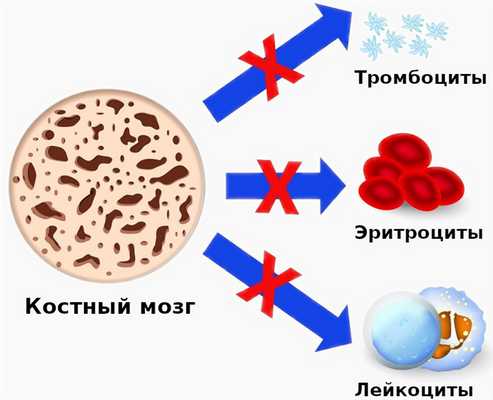
Апластическая анемия - серьёзное нарушение формирования, развития и созревания клеток крови. Оно характеризуется угнетением кроветворной функции костного мозга, что проявляется дефицитом образования белых и красных кровяных клеток, а также тромбоцитов. Иногда наблюдается недостаток формирования только эритроцитов. Заболевание считается одним из самых тяжёлых расстройств гемопоэза и при отсутствии адекватного лечения может стать причиной летального исхода в течение нескольких месяцев. Оно в одинаковой степени поражает пациентов мужского и женского пола в возрасте от десяти до двадцати пяти лет или старше пятидесяти. Согласно медицинской статистике каждый год диагностируют два случая патологии на один миллион человек.
Апластичная анемия: этиология
Согласно происхождению, выделяют врождённую и приобретённую анемию. Первая развивается вследствие хромосомных мутаций, вторая - под воздействием химических веществ, излучения, инфекций. Специалисты считают, что угнетение кроветворения костного мозга может быть инициировано появлением в нём и в крови цитотоксических Т-лимфоцитов. Они производят ФНО (внеклеточный белок) и интерферон “y”, которые подавляюще воздействуют на ростки кроветворения. Причина запуска механизма может крыться в:
- Воздействии ионизирующего излучения или химических веществ в виде ароматических соединений, мышьяка, пестицидов;
- Попадании в организм инфекционных агентов (возбудители гепатитов “D”, “B”, цитомегаловируса, ДНК-содержащего вируса Эпштейна-Барр);
- Приёме миелотоксических препаратов при прохождении курса лечения транквилизаторами, противосудорожными, антитиреоидными и антиопухолевыми средствами;
- Развитии ряда аутоиммунных процессов (красная системная волчанка, поражение соединительной ткани - синдром Шегрена).
В 50% случаев причину развития патологии установить не удаётся. Такая форма апластической анемии называется идиопатической.
Классификация апластической анемии
| Форма патологии | Чем отличается? |
| По продолжительности течения | |
| Острая | Не более одного месяца |
| Подострая | От одного месяца до полугода |
| Хроническая | Более полугода |
| По степени тяжести при избирательной аплазии | |
| Умеренная | Гранулоцитов менее 0,0х10 9 /л, тромбоцитов менее 20,0х10 9 /л. |
| Тяжёлая | Гранулоцитов менее 0,5х10 9 /л, тромбоцитов менее 20,0х10 9 /л. согласно результатам диагностики клеточность костного мозга составляет менее трети от нормы. |
| Очень тяжёлая | Гранулоцитов более 0,5х10 9 /л, тромбоцитов более 20,0х10 9 /л. |
Апластическая анемия: симптомы
Заболевание начинается остро, оно сопровождается ощущением сильной слабости и быстрой утомляемостью. Кожные покровы больного и видимые слизистые оболочки выглядят бледными, а сам он страдает от следующих клинических проявлений:
- шум в ушах;
- появление одышки даже при несущественных усилиях;
- неприятное покалывание в области грудной клетки.
При снижении количества тромбоцитов в единице объёма крови проявляется геморрагический синдром:
- даже после незначительной компрессии или ударах кожного покрова на нём появляются синяки и кровоизлияния;
- на теле, руках и ногах можно увидеть сыпь в виде мелких точек;
- наблюдается кровоточивость дёсен;
- спонтанные кровотечения из носа;
- обильные менструации (у женщин).
Снижение количества лейкоцитов в единице объёма крови характеризуется регулярным частым развитием инфекционных заболеваний кожи и структур мочевыводящей системы, воспалительными процессами слизистой оболочки рта, воспалениями лёгких.
Врождённая форма анемии развивается у детей до десяти лет и сопровождается целым рядом других нарушений:
- недоразвитие черепа и головного мозга;
- снижение размеров и массы почек (гипоплазия);
- интенсивная окраска отдельных участков кожи - гиперпигментация;
- сильное снижение слуха и нарушения речевой функции из-за него.
Апластическая анемия: осложнения
Отсутствие лечения апластической анемии может привести к летальному исходу из-за развития таких осложнений, как:
- инфекционные заболевания;
- кровоизлияние в головной мозг;
- анемическая кома;
- сильные кровотечения.
Апластическая анемия: диагностика
Перед тем, как приступить к лечению заболевания, гематологи ЦЭЛТ проводят комплексную диагностику, направленную на точную постановку диагноза и выявление этиологического фактора. Она включает в себя:
- осмотр у гематолога;
- общий и биохимический анализы крови;
- забор образца костного мозга и его исследование - стернальная пункция.
При наличии заболевания у пациента выявляют серьёзное снижение гемоглобина, вплоть до критического уровня - 20-30 г/л, наблюдается агранулоцитоз - снижение зернистых лейкоцитов и моноцитов. Количество лимфоцитов может быть в норме или сниженным, тромбоцитов - всегда снижено, иногда их не обнаруживают вовсе. Скорость оседания эритроцитов - повышается до 4-60 мм/ч. Исследование образца костного мозга выявляет повышенное содержание жировой ткани - 90%, включающее в себя элементы стромы и лимфы, а вот гематогенные клетки имеются в очень малом количестве.
Лечение апластической анемии
Лечение идиопатической и других видов апластической анемии - очень сложная задача, требующая комплексного индивидуального подхода. При разработке тактики специалисты ЦЭЛТ учитывают результаты диагностики и показания пациента. Больного помещают в изолятор с асептическими условиями, что позволяет исключить риск развития инфекций и их осложнений. Медикаментозная терапия заключается в приёме:
- Глюкокортикоидов - при выявлении аутоиммунных механизмов и формировании антител против собственных кровяных клеток;
- Цитостатиков - при отсутствии эффекта от лечения глюкокортикоидами при аутоиммунной анемиии;
- Циклоспорина «А» - для подавления производства ФНО и интерферона “y”;
- Анаболиков - для стимулирования функции кроветворения;
- Андрогенов - для стимулирования образования красных кровяных клеток.
Всем больным апластической анемией проводят переливание эритроцитарной и/или тромбоцитарной массы, в объёмах, определяемых исходя из клинической картины и показателей периферической крови. Кроме того, пациенту могут назначить спленэктомию - хирургическое вмешательство, направленное на удаление селезёнки. Самые благоприятные прогнозы может обеспечить трансплантация костного мозга. Она заключается в пересадке донорских или собственных стволовых кроветворных клеток, предварительно изъятых из подвздошных костей путём пункции. К сожалению, процедура недоступна для широкого применения из-за сложности подбора совместимого донора. В том случае, если это невозможно, пациенту назначают паллиативную терапию с применение циклоспорина А.
В отделении гематологии нашей клиники ведут приём кандидаты, доктора и профессоры медицинских наук с опытом практической и научной работы от двадцати пяти лет. Вы можете записаться к ним на приём онлайн или обратившись к нашим операторам. Специалисты высокой квалификации работают и в отделении урологии. К ним можно записаться на цистоскопию мочевого пузыря.
Читайте также:
