Ушивание лапаротомии с переменным направлением доступа. Техника сшивания лапаротомных ран.
Добавил пользователь Дмитрий К. Обновлено: 21.01.2026
В статье приведены сравнительная оценка течения послеоперационного периода и результаты лечения пациентов, прооперированных с применением модифицированного двойного ушивания апоневроза после срединной лапаротомии. Группой контроля в исследовании служили 52 пациента, прооперированные с использованием узлового способа ушивания апоневроза. Обеспечивая герметичность раны со стороны кожи и брюшины, модифицированный метод позволяет предотвратить проникновение патогенных микроорганизмов. Являясь менее травматичным, одновременно обеспечивает хорошую реконструкцию тканей в ране. Метод обеспечивает более благоприятное течение репаративных процессов. Тем самым обеспечивается лучшая биологическая консолидация тканей, что уменьшает количество послеоперационных вентральных грыж. В наших наблюдениях гнойно-воспалительные осложнения раны в контрольной группе составили 12 (23,1%) случаев, в основной - 2 (4,3%) (р
Ушивание лапаротомии с переменным направлением доступа. Техника сшивания лапаротомных ран.
Проблема послеоперационных вентральных грыж (ПОВГ) весьма актуальна ввиду роста количества операций на брюшной полости. После срединной лапаротомии формирование вентральной грыжи встречается в 2—28% случаев [1—6]. При ушивании лапаротомной раны важно выполнить пластику без натяжения тканей, учитывая равномерную нагрузку на швы, несоблюдение этих правил ведет к прорезыванию швов, нарушает микроциркуляцию и трофику в тканях и способствует возникновению ПОВГ и эвентрации [4, 7—10]. В связи с этим важность выбора рационального способа ушивания белой линии живота, особенно в ургентной хирургии, не вызывает сомнения.
На практике выбор способа ушивания раны больше связан с предпочтениями и устоявшимися стереотипами, из-за отсутствия опыта и мануального навыка новые методы применяют с опасением или вообще не используют. В связи с этим актуален вопрос внедрения и обучения новым методикам лапарорафии с целью профилактики развития ПОВГ. При этом обучение должно проводиться на специально разработанных для этого тренажерных системах, что будет способствовать отработке навыка в условиях, приближенных к клиническим, и мотивировать применение полученного опыта на практике [2].
Цель исследования — улучшение результатов лечения больных, подвергшихся лапаротомии, путем внедрения в практику разработанного способа ушивания апоневроза после лапаротомии.
Материал и методы
На кафедре общей хирургии РязГМУ разработан и запатентован способ ушивания апоневроза после лапаротомии (патент РФ на изобретение № 2644846). После успешного проведения кадаверного и экспериментального исследования на лабораторных животных, согласно правилам проведения работ с использованием экспериментальных животных от 12.08.77 № 755, а также принципам надлежащей лабораторной практики (Principles of Good Laboratory Practice) с изменениями от 1997 г., инкорпорированными в Директиву Е.С. 2004/10/ЕС, решено внедрить новый способ лапарорафии для клинического применения.
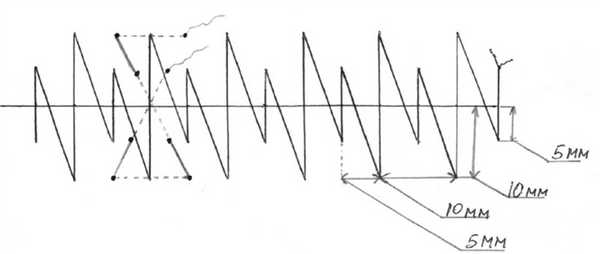
Сущность способа состоит в том, что после шва брюшины апоневроз лапаротомной раны ушивают укрепляющими швами, расстояние между которыми составляет 5 см, затем накладывают непрерывный шов с расположением стежков в шахматном порядке — непрерывный шахматный шов (рис. 1). Рис. 1. Схема наложения непрерывного шахматного шва на апоневроз.
Задачами использования являются уменьшение нагрузки на непрерывный шахматный шов, укрепление наименее прочных участков белой линии живота, предупреждение натяжения краев раны и нити при наложении непрерывного шахматного шва, профилактика несостоятельности шва апоневроза в случае возможной ревизии раны при ее нагноении. Преимуществом укрепляющего шва является его высокая прочность благодаря двум линиям фиксации в вертикальном и горизонтальном направлении относительно линии разреза. При этом нагрузка равномерно распределяется на все стежки шва, уменьшается излишнее сдавление краев раны и, как следствие, снижается их ишемизация.
Преимуществами непрерывного шахматного шва в отличие от классического непрерывного шва являются большие прочностные характеристики благодаря двум линиям фиксации с каждой стороны от разреза, что уменьшает вероятность разволокнения апоневроза и более равномерно распределяет нагрузку на него. Данный шов накладывается с чередованием малых и больших стежков. Расстояние между стежками составляет 0,5 см, от края раны при малых стежках — 0,5 см, при больших — 1 см.

Для организации процесса обучения данной методике разработан и запатентован медицинский тренажер для обучения технике ушивания лапаротомной раны (патент РФ на полезную модель № 181388) (рис. 2). Рис. 2. Медицинский тренажер для обучения технике ушивания лапаротомной раны.
В зажимы тренажера закрепляют импровизированный апоневроз с нанесенными на него метками, располагающимися на расстояниях, соответствующих расстояниям между стежками при наложении укрепляющего и непрерывного шахматного швов. Материал ушивают на расстоянии 18 см. С целью определения обучаемости способу ушивания апоневроза в процессе мануальной отработки навыка привлечены три группы: 1-я — 22 студента III курса, не имеющих общехирургических навыков; 2-я — 12 клинических ординаторов, обучающихся по специальности «Хирургия», имеющих начальные общехирургические навыки; 3-я — 12 врачей-хирургов первой и высшей квалификационных категорий, владеющих навыком лапарорафии на высоком уровне. Проведена оценка обучаемости методике путем сравнения времени ушивания апоневроза предлагаемым способом и классическими отдельными узловыми швами на протяжении всего цикла обучения. Расстояние между узловыми швами, как и между стежками шахматного, составило 5 мм.
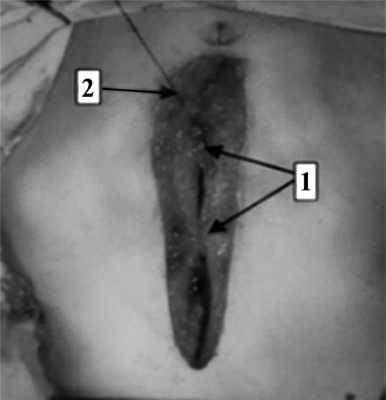
На следующем этапе, после проведения обучения, новый способ лапарорафии внедрили в клиническую практику (рис. 3). Рис. 3. Ушивание лапаротомной раны (интраоперационная фотография). 1 — наложены укрепляющие швы; 2 — наложение непрерывного шахматного шва.
Проспективно обследованы 130 больных, прооперированных в экстренном порядке на органах брюшной полости с использованием срединного лапаротомного доступа. В основную группу вошли 70 пациентов (32 (46%) мужчины и 38 (54%) женщин) в возрасте от 31 года до 94 лет (средний возраст 66,5±13,2 года), которым белую линию живота ушивали разработанным способом. По поводу аппендицита с перитонитом оперированы 9 (13%) больных, кишечной непроходимости — 15 (21%), перфоративной язвы желудка — 11 (16%), калькулезного гангренозного холецистита — 7 (10%), опухоли толстой кишки — 13 (18%), холедохолитиаза — 11 (16%), открытой травмы живота — 4 (6%). Пациентам контрольной группы (n=60) апоневроз ушивали отдельными узловыми швами. Больные были репрезентативны по возрасту, полу, основным и сопутствующим заболеваниям.
При сравнении исследуемых групп применялся критерий t-Стьюдента. Для корреляционного анализа использовали ранговую корреляцию Спирмена. Достоверность результатов оценивали положительно при p
Результаты
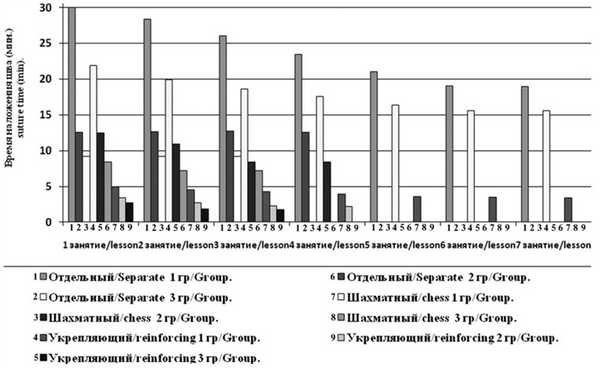
В группе студентов на 1-м занятии время наложения отдельного шва составило 24,1—36,2 мин (в среднем 30,6±1,82 мин), непрерывного шахматного — 17,1—28,1 мин (в среднем 21,8±2,7 мин), двух укрепляющих швов — 4,1—5,9 мин (в среднем 4,9±0,5 мин). При последующих занятиях отмечено ускорение процесса ушивания. К 7-му занятию отработка навыка подошла к концу, так как результаты данного занятия и результаты 6-го занятия достоверно не различались: время наложения отдельного шва от 16,9 до 25,5 мин (в среднем 18,9±2,3 мин) (t=0,326; р<0,05), непрерывного шахматного — от 12,8 до 19,1 мин (в среднем 15,5±1,3 мин) (t=2,571; р <0,05), двух укрепляющих — от 2,7 до 4,1 мин (в среднем 3,4±0,4 мин) (t=0,125;р <0,05) (рис. 4). Рис. 4. Динамика времени ушивания лапаротомной раны в группе студентов.
Во 2-й группе на 1-м и последующих занятиях скорость наложения отдельного узлового шва достоверно не изменялась и составила 11,2—14,1 мин (в среднем 12,6±0,8 мин), что связано с отработкой навыка ранее. А вот динамика обучения другим видам шва была более интенсивной. Для обучения ординаторов понадобилось 4 подхода к отработке навыка. Время наложения непрерывного шахматного шва на 1-м занятии составило 11,4—13,5 мин (в среднем 12,4±0,7 мин), а к последующим занятиям оно уменьшилось до 7,9—9,2 мин (в среднем 8,3±0,5 мин) (t=1,294; р<0,05). Такая же тенденция наблюдалась и с укрепляющими швами. Время при первом освоении навыка 2,9—4,1 мин (в среднем 3,4±0,4 мин), к последнему занятию 1,9—2,5 мин (в среднем 2,1±0,3 мин) (t=0,344; р<0,05).
В группе врачей время наложения отдельных узловых швов на 1-м занятии составило 7,8—9,6 мин (в среднем 9,1±0,5 мин) и достоверно не изменялось и при 2-м (t=0,518; р>0,05) и 3-м (t=1,325; р>0,05) подходе, поскольку в повседневной практике они используют этот способ ушивания. С непрерывным шахматным швом установлена такая же тенденция, как и в группе ординаторов. К 1-му занятию время манипуляции составило 7,8—9,1 мин (в среднем 8,2± 0,4 мин) с тенденцией к ускорению наложения шва на 3-м занятии — 6,6 до 8,2 мин (в среднем 7,2±0,4 мин) (t=2,163; р>0,05). Время наложения укрепляющих швов на 1-м занятии 2,1—3,1 мин (в среднем 2,7±0,4 мин), к 3-му — 1,4—2,1 мин (в среднем 1,7±0,23 мин) (t=0,378; р>0,05).
Таким образом, степень обучаемости новой технике лапарорафии зависит от уровня подготовки обучаемого (r=-0,737, р=0,004). Так, у студентов динамика уровня освоения навыка была одинаковой как в случае распространенного в хирургической практике отдельного узлового шва, так и предлагаемого способа ушивания. У ординаторов и врачей обучаемость отдельному узловому шву не прослеживалась, так как они уже владели этим навыком, хотя время наложения данного шва было меньше в группе врачей, что связано с их более высокой квалификацией и опытом. При освоении ушивания апоневроза новым способом в обеих группах отмечалась тенденция к уменьшению времени наложения швов, различия отмечены лишь во времени, затраченном на освоение манипуляции в пользу 3-й группы.
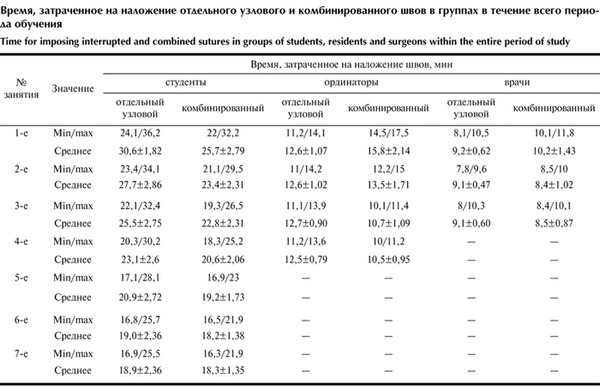
Немаловажно, что в результате обучения время наложения отдельных узловых швов и восстановления апоневроза предлагаемым способом (сумма времени наложения шахматного и укрепляющих швов) в 1-й группе составило в среднем 18,9±2,36 и 18,3±1,35 мин, во 2-й группе — 12,5±0,79 и 10,5±0,95 мин, в 3-й группе — 9,1±0,6 и 8,5±0,87 мин. Предлагаемый способ по временны́м характеристикам не противоречит узловой лапарорафии (см. таблицу). Время, затраченное на наложение отдельного узлового и комбинированного швов в группах в течение всего периода обучения
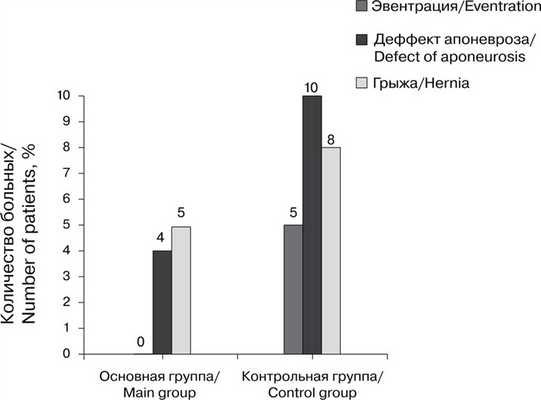
При сравнении способов ушивания в клинике в раннем послеоперационном периоде в контрольной группе выявлены эвентрации у 3 (5%) больных, а через год наблюдения — дефекты апоневроза у 6 (10%) больных и ПОВГ у 5 (8%). В основной группе эвентрации не было, дефекты апоневроза установлены у 2 (3%) больных, ПОВГ — у 3 (5%). Дефекты апоневроза выявляли путем УЗИ (рис. 5). Рис. 5. Осложнения в основной и контрольной группах больных.
Таким образом, представленная модель и этапность внедрения нового способа ушивания апоневроза после лапаротомии позволили не только изменить взгляд на лапарорафию, но и снизить частоту развития послеоперационной вентральной грыжи и эвентрации в ургентной хирургии. Предлагаемый способ ушивания апоневроза после лапаротомии по временно́му параметру не отличается от классической узловой лапарорафии. Внедрению в практику непрерывного, в том числе и шахматного укрепляющего, шва должно предшествовать цикло-вое обучение независимо от квалификации хи-рурга.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Кафедра общей хирургии ФГБОУ ВО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава РФ, Рязань, Россия
ФГБОУ ВО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, Рязань, Россия
Сравнительный анализ способов ушивания лапаротомной раны
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2017;(6): 37‑40
Цель исследования — оценка способов ушивания апоневроза после лапаротомии в эксперименте. Материал и методы. Проведено экспериментальное исследование на лабораторных животных. Всем выполняли лапаротомию, ушивание апоневроза отдельным, непрерывным швом и непрерывным швом с расположением стежков на разном уровне. На 7, 14, 60-е сутки проводили тензиометрическое исследование участков ткани вместе со швами с последующим гистологическим исследованием. Результаты. Отмечена взаимосвязь способа ушивания апоневроза и показателей прочности, эластичности, течения раневого процесса. Вывод. Ушивание лапаротомной раны непрерывным швом по сравнению с отдельным способствует образованию более зрелой грануляционной ткани и формированию в дальнейшем более прочного рубца с низким показателем эластичности.
Проблема послеоперационной вентральной грыжи (ПОВГ) на сегодняшний день весьма актуальна [1, 3, 5—9].
Операции, выполняемые из срединного лапаротомного доступа, сопровождаются развитием ПОВГ в 7—24% наблюдений [3, 5, 7, 9]. По нашим данным, ПОВГ образуется в течение первого года у 17% больных [5]. Важным направлением предупреждения развития ПОВГ является применение правильной техники ушивания тканей передней брюшной стенки после лапаротомии [2—4, 10, 11].
Среди сформулированных еще в начале ХХ века требований выделяют необходимость прочного соединения краев дефекта брюшной стенки с минимальными натяжением и травматизацией прямых мышц живота и окружающей подкожной жировой клетчатки. Швы также должны противостоять повышенному внутрибрюшному давлению, что весьма актуально в ургентной хирургии, и напряжению мышц передней брюшной стенки на протяжении всего периода раневого процесса, вплоть до окончания реорганизации рубца. В связи с этим важным принципом является выполнение пластики без натяжения тканей с учетом равномерной нагрузки на шов, несоблюдение этих правил ведет к прорезыванию швов, нарушению микроциркуляции в тканях и их трофику, способствует возникновению послеоперационной грыжи передней брюшной стенки и эвентрации [2, 4, 6, 10—12].
Цель исследования — оценка различных способов ушивания апоневроза после лапаротомии в эксперименте.
В эксперименте использовано 36 половозрелых белых крыс массой тела 220—300 г. Животных содержали в стандартных условиях вивария со свободным доступом к пище и воде. Всем животным в асептических условиях производили срединную лапаротомию с последующим ушиванием раны. С учетом способа ушивания крысы разделены на три группы. В 1-ю группу вошли 12 животных, которым апоневроз ушивали отдельными узловыми швами с шагом 4—5 мм, расстояние от края раны 4—5 мм. Во 2-й группе, включающей 12 особей, применяли непрерывный шов с аналогичным шагом и расстоянием от края раны. В 3-й группе (12 животных) белую линию ушивали непрерывным швом с расположением стежков на разном уровне. Расстояние от большого стежка до края раны составило 6 мм, от малого — 3 мм. Промежутки между стежками составляли 4—5 мм. Для наложения швов использовали монофиламентную нить Prolen 3/0. Кожную рану ушивали лавсаном. На 7, 14 и 60-е сутки участки апоневроза с мышечной тканью размером 2×3 см с исследуемыми швами в каждой группе были иссечены. Эти животные выведены из эксперимента.
Тензиометрическое исследование полученного материала проводили не электронном динамометре АЦД/1Р-0,1/1И-2 (НПО «Мега Тонн Электронные Динамометры», Санкт-Петербург). Для этого участки ушитого апоневроза закрепляли в разрывном устройстве прибора при расстоянии между зажимами 1 см, подвергая деформации. С помощью динамометра измеряли прочность в Ньютонах (Н). Эластичность (Е) определяли в процентах по формуле:
где Lконеч. — конечная длина апоневроза с исследуемыми швами при его разрыве, Lначальн. — начальная длина до растяжения.
Проводили гистологическое исследование оставшихся участков апоневроза вместе со швами. Оценивали площадь клеточного инфильтрата, площадь очагов некроза, площадь новообразованных сосудов, активность ангиогенеза, степень зрелости грануляционной ткани.
Результаты и обсуждение
Тензиометрическое исследование показало, что на 7-е сутки прочность отдельного узлового шва составила от 2,7 до 5,8 Н (в среднем 3,94±0,9 Н), непрерывного шва — от 4,2 до 8,3 Н (в среднем 6,05±1,15 Н), непрерывного шва с расположением стежков на разном уровне — от 5,4 до 9,1 Н (в среднем 7,2±1,45 Н). К 14-м суткам наблюдалось увеличение прочности всех исследуемых швов. Показатель прочности отдельного узлового шва был от 11,7 до 16,6 Н (в среднем 13,9±1,7 Н), в случае непрерывного шва — от 13,7 до 20,5 Н (в среднем 17,3±2,2 Н), непрерывного шва с расположением стежков на разном уровне — от 19,1 до 24,5 Н (в среднем 21,35±1,57 Н). На 60-е сутки прочность отдельного узлового шва составляла от 31,3 до 50,2 Н (в среднем 43,8±6,2 Н), в случае обвивного шва — от 44,1 до 68,6 Н (в среднем 54,8±7,1 Н), непрерывного шва с расположением стежков на разном уровне — от 45,2 до 67,3 Н (в среднем 55,1±7,6 Н) (рис. 1).
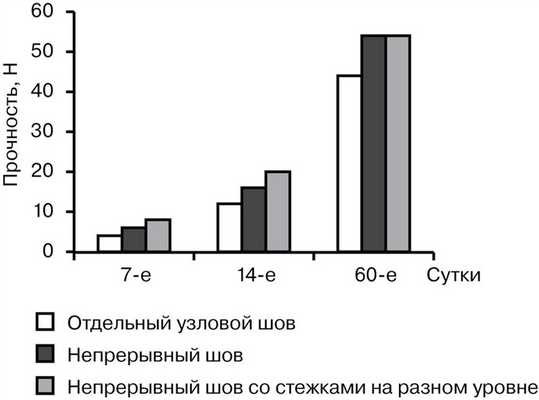
Рис. 1. Сравнительная характеристика прочности швов.
Таким образом, наименьшей оказалась прочность отдельного узлового шва во все сроки наблюдения. Непрерывный шов с расположением стежков на разном уровне превосходил по прочности классический непрерывный шов при их анализе на 7-е и 14-е сутки на 16 и 19% соответственно. К 60-м суткам прочностные характеристики непрерывного шва и непрерывного шва с расположением стежков на разном уровне были практически одинаковыми. Эластичность швов находилась в обратной зависимости от прочности, т. е. с увеличением прочности эластичность уменьшалась. При этом эластичность была наибольшей в случае отдельного шва (от 172,2 до 85,64%) и наименьшей при растяжении непрерывного шва с расположением стежков на разном уровне (от 155,5 до 61,2%) (рис. 2).
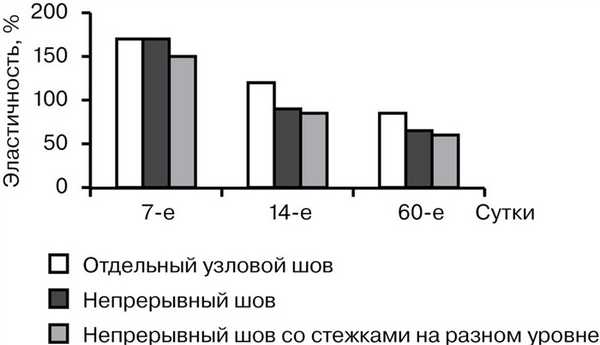
Рис. 2. Сравнительная характеристика эластичности швов.
При гистологическом исследовании на 7-е и 14-е сутки площадь клеточного инфильтрата достоверно была больше в случае отдельного шва (рис. 3).
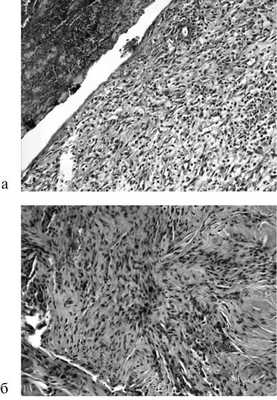
Рис. 3. Микрофотография отдельного шва на 7-е (а) и 14-е (б) сутки. Окраска гематоксилином и эозином. Ув. 200.
В группах, в которых использовали непрерывный шов, в случае расположения стежков на разном уровне инфильтрация была меньше, чем при обычном непрерывном шве. Очаги некроза отсутствовали в группах с непрерывным швом и присутствовали небольшой площадью или отсутствовали в случае с отдельным швом. Неоангиогенез с большей площадью новообразованных сосудов преобладал в случае применения непрерывного шва (рис. 4).
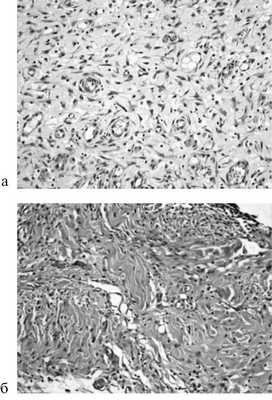
Рис. 4. Микрофотография непрерывного шва (а) и непрерывного шва с расположением стежков на разном уровне (б) на 14-е сутки. Окраска гематоксилином и эозином. Ув. 200.
На 7-е сутки степень развития грануляционной ткани была большей при непрерывном шве с расположением стежков на разном уровне, а наименьшей в случае отдельного шва. На 14-е сутки достоверных различий этого критерия в группах отмечено не было. На 60-е сутки во всех группах сформировался зрелый соединительнотканный рубец, при этом отсутствовали очаги некроза, инфильтрация, хотя имелась олеогранулема в случае отдельного шва (рис. 5).
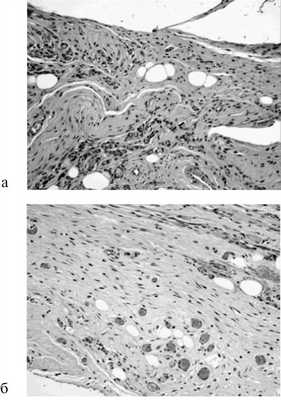
Рис. 5. Микрофотография отдельного шва (а) и непрерывного шва с расположением стежков на разном уровне (б) на 60-е сутки. Окраска гематоксилином и эозином. Ув. 200.
Таким образом, ушивание лапаротомной раны непрерывным швом по сравнению с отдельным швом не вызывает чрезмерного сдавления тканей в местах проколов апоневроза, равномерно распределяя нагрузку по всей длине шва, что проявляется меньшей инфильтрацией тканей, более выраженным неоангиогенезом и формированием зрелой грануляционной ткани.
Образовавшийся после ушивания апоневроза отдельными узловыми швами послеоперационный рубец уступает по прочности (от 20 до 27%) рубцу после непрерывного способа ушивания, отличается более высокой растяжимостью, что является одним из факторов, способствующих образованию послеоперационной грыжи передней брюшной стенки.
Непрерывный шов с расположением стежков на разном уровне в отличие от классического непрерывного ушивания способствует более равномерному распределению нагрузки на края апоневроза, снижая риск его разволокнения, тем самым повышая его прочность до 67,3 Н и снижая эластичность до 61,2%.
Несмотря на современные достижения хирургии, частота развития послеоперационных вентральных грыж остается постоянно на высоком уровне (7,4-24% от общего числа операций) [1, 6, 9, 15, 18, 21, 34, 35, 44, 45]. Отсутствие тенденции к снижению частоты развития грыж подтолкнуло к проведению многочисленных исследований этиологических факторов, приводящих к грыжеобразованию. В качестве факторов были описаны перитонит, диабет, цирроз печени, уремия, старческий возраст, раковая кахексия, ожирение, авитаминоз, анемия, приводящая к гипоксии тканей, стероидная, лучевая терапия, гипопротеинемия, нагноение раны, воспалительные изменения в сшиваемых тканях, пневмония, кашель, рвота, курение, парез кишечника [34, 40, 41, 58, 65, 67]. Однако по большинству факторов в литературе единого мнения не существует. О роли таких факторов, как пол [6, 53,71], цвет кожи [53], пожилой возраст [11, 27, 44, 52], ожирение [5, 7, 22, 31, 46, 52, 62, 72], раневая инфекция [20, 26, 30, 38, 61], высказываются диаметрально противоположные мнения. Имеются многочисленные работы, опровергающие зависимость грыжеобразования от таких «общепринятых» факторов, как раневая инфекция, возраст, ожирение, пневмония [19, 30, 38, 46]. Каким бы ни было отношение к указанным факторам, влияние хирурга на них в момент выполнения операции чаще всего невозможно. Мы не можем ни контролировать, ни даже стандартизировать их [49].
В то же время выбор оперативного доступа, шовного материала, техника ушивания лапаротомной раны целиком зависят от хирурга [12, 48, 57, 66]. Вопрос выбора шовного материала изучен в настоящее время достаточно полно [8, 11, 12, 14, 29, 33, 38, 43, 49, 51, 56, 60, 69, 73, 74]. Большинством авторов отмечается важность выбора лапаротомного доступа с целью предотвращения развития послеоперационных вентральных грыж [10, 30, 36, 72]. Анализ клинических исследований роли оперативного доступа и техники ушивания лапаротомной раны показал отсутствие единого мнения по этим вопросам. По данным одних авторов, срединный разрез является оптимальным для выполнения лапаротомии, при таком доступе практически не образуются послеоперационные грыжи [37, 42]; по другим данным, этот доступ имеет ряд серьезных недостатков и сопровождается развитием наибольшего числа грыж [10, 30, 36, 53]. Подобные диаметрально противоположные суждения высказываются в отношении как косого подреберного, так и парамедианного доступов [47, 50].
Отсутствие единого мнения о выборе рационального операционного доступа, с точки зрения снижения частоты образования грыж, свидетельствует о том, что невозможно добиться решения данной проблемы лишь клиническим исследованием. Мы разработали модель, позволяющую изучить биомеханические свойства различных лапаротомных доступов, ушитых с использованием узловой и непрерывной техники.
Целью настоящего исследования является снижение частоты развития послеоперационных вентральных грыж путем выбора оптимального операционного доступа с учетом биомеханических свойств передней брюшной стенки.
Материал и методы
В клинической части работы в качестве модели исследования с целью минимизации возможного вмешательства внешних факторов, влияющих на грыжеобразование, учет которых крайне затруднителен, были взяты пациенты, которым выполнялась одна операция - холецистэктомия открытым способом. Холецистэктомия из лапаротомного доступа в базовых больницах кафедры общей хирургии РГМУ в период с 2005 по 2008 г. была выполнена 645 больным.
Отдаленные результаты операций прослежены у 508 (78,76%) из 645 больных. Среди них у 351 (69%) больного использован парамедианный доступ, у 109 (21,5%) - верхнесрединный, у 48 (9,5%) больных - косой подреберный доступ. Группы пациентов были сопоставимы по возрасту и полу.
Экспериментальное исследование имело целью выявить оптимальный операционный доступ и технику шва для закрытия лапаротомной раны при первичных операциях путем изучения биомеханических свойств апоневроза передней брюшной стенки - интактного и сшитого с помощью разной техники шва.
В качестве оборудования для измерения деформационно-прочностных показателей апоневроза передней брюшной стенки на растяжение использовали универсальную испытательную машину «Инстрон 1122».
Апоневроз исследовали не позже чем через 24 ч после смерти пациента. Апоневроз до исследования хранился в 0,89% растворе NaCl при температуре 4 °С. Исследование проведено на 30 трупах обоего пола в возрасте от 47 до 82 лет. Смерть всех больных наступила от острого инфаркта миокарда или острого нарушения мозгового кровообращения.

Взятие и подготовку апоневроза передней брюшной стенки к исследованию проводили по специально разработанной методике. На трупном материале по срединной линии передней брюшной стенки выполняли разрез кожи и подкожной жировой клетчатки от мечевидного отростка до лонного сочленения. Затем подкожную жировую клетчатку отсепаровывали от апоневроза до уровня передней подмышечной линии и производили забор мышечно-апоневротического фрагмента передней брюшной стенки, как показано на рис. 1. Рисунок 1. Этап подготовки апоневроза к исследованию.

Далее апоневроз с использованием прецизионной техники отделяли от мышечной ткани и получали образец, представленный на рис. 2. Рисунок 2. Апоневроз, мобилизованный от мышечной ткани.
В дальнейшем проводили нарезку апоневроза в продольном направлении на полосы шириной 30 мм. Для испытания интактного апоневроза и сшитого по белой линии использовали образцы длиной 100 мм, а для парамедианного доступа фрагмент апоневроза для исследования изготавливали из полоски апоневроза длиной 140 мм, при этом отсекая 40 мм апоневроза с противоположного разрезу края. Образцы, моделирующие парамедианный доступ, были рассечены, отступя 20 мм от белой линии.
Подготовленный образец апоневроза закрепляли в пневматические зажимы испытательной машины. Ширина всех образцов 30 мм. База растяжения (расстояние между клеммами испытательной машины) 75 мм. Скорость растяжения равнялась 50 мм/мин.
В качестве шовного материала использовали полипропилен 2-0. Исследовано 140 образцов апоневроза, в том числе 20 цельных и 120 сшитых. С помощью каждого вида шва для каждого доступа сформировано по 20 соединений. Сшивание образцов апоневроза в случае как узловой, так и непрерывной техники проводили 4 швами: расстояние между стежками 8 мм, расстояние от вкола до края среза 8 мм. Исследовали продольные образцы апоневроза передней брюшной стенки, рассеченные и сшитые по белой линии живота и парамедианно с использованием узлового и непрерывного швов. При парамедианном доступе отдельно испытаны сшитые передний и задний листки апоневроза. Таким образом сформировано 6 групп экспериментального исследования сшитого апоневроза:
1) срединный доступ, узловой шов;
2) срединный доступ, непрерывный шов;
3) парамедианный доступ (передний листок апоневроза), узловой шов;
4) парамедианный доступ (передний листок апоневроза), непрерывный шов;
5) парамедианный доступ (задний листок апоневроза), узловой шов;
6) парамедианный доступ (задний листок апоневроза), непрерывный шов.
Результаты и обсуждение
При измерении длины кожного разреза были получены следующие результаты: срединный доступ 92,1±12,2 мм, парамедианный 89,4±11,7 мм, косой подреберный 98,3±18,2 мм.
Среди 508 отслеженных больных послеоперационные вентральные грыжи были выявлены у 45 (8,86%). При использовании срединной лапаротомии грыжа сформировалась у 18 больных, что составило 16,51%, при парамедианном доступе - у 17 (4,84%), при косом подреберном - у 10 (20,83%) больных.
При анализе сроков развития послеоперационных вентральных грыж отмечено, что в 21 (46,67%) наблюдении грыжа была выявлена самим пациентом в сроки от 1 до 12 мес, в 24 (53,33%) - нами во время клинического обследования, проводимого в сроки до 3 лет.
Последние 24 пациента считали себя полностью здоровыми, на момент осмотра жалоб не предъявляли. У 21 из них грыжевой дефект визуально не определялся, был выявлен нами пальпаторно и подтвержден данными УЗИ, еще у 3 пациентов грыжевые образования были выявлены визуально.
Проведен анализ сопутствующих заболеваний у пациентов с выявленными грыжами и без грыж. Чаще всего у пациентов с выявленными грыжами и без них имелись артериальная гипертензия, ожирение, ишемическая болезнь сердца.
При испытании на растяжение поперечных образцов трупного апоневроза, как интактного, так и со швами, получена почти симметричная колоколообразная кривая с одним максимумом. Результаты испытаний представлены в таблице и на рис. 3. Рисунок 3. Диаграмма напряжение-деформация при испытании на растяжение цельного и сшитого апоневроза.
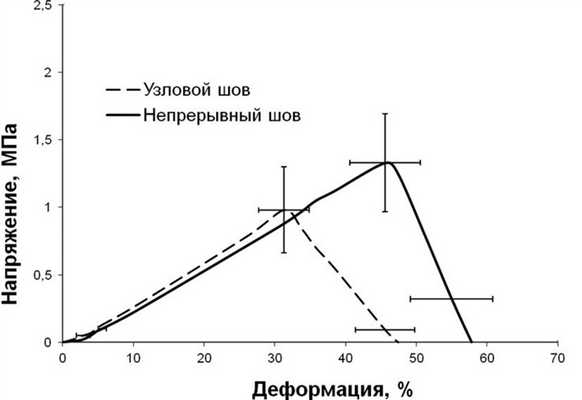
Обращает на себя внимание, что разрушение всех образцов, как цельных, так и со швами, независимо от техники шва и операционного доступа происходило при одной и той же деформации, составляющей от 33,65 до 38,41%. При одинаковых деформациях разрушения и разрыва образца при использовании как узлового, так и непрерывного швов для срединного и парамедианного доступов (передний листок) разрыв образца происходил при одном и том же напряжении. В свою очередь прочность задних листков апоневроза, сшитых узловыми и непрерывными швами, оказалась более чем в 2 раза меньше, чем при сшивании других образцов. Следует отметить, что с помощью какой бы техники ни накладывались швы, где бы ни производился разрез апоневроза, сшитый апоневроз всегда уступает по прочности интактному (см. рис. 3). Разрыв образцов апоневроза со швами всегда происходил в зоне шва. Мы не отметили разницы в механической прочности узлового и непрерывного швов для закрытия как срединного, так и парамедианного (для сшивания передних листков) доступов. В то же время при сшивании задних листков апоневроза влагалища прямых мышц живота наилучший результат показала непрерывная техника шва. Образцы задних листков апоневроза, сшитые непрерывным швом, выдерживают нагрузки на 30% больше, чем при использовании узловой техники шва (рис. 4). Рисунок 4. Диаграмма напряжение-деформация при испытании поперечных образцов задних листков апоневроза, сшитых узловым и непрерывным швом.
При суммировании графиков испытаний на растяжение переднего и заднего листков апоневроза получены данные, представленные на рис. 5 и 6. Рисунок 5. Диаграмма напряжение-деформация при сравнении срединного и парамедианного доступов, сшитых узловым швом. Рисунок 6. Диаграмма напряжение-деформация при сравнении срединного и парамедианного доступов, сшитых непрерывным швом.
При анализе кривых деформация-напряжение выявлено, что парамедианный доступ с учетом свойств обоих листков апоневроза разрушается при нагрузке, превышающей таковую для срединного доступа, независимо от техники шва.
В случае наложения узлового шва разрывная нагрузка для парамедианного доступа на 38% выше, чем для срединного. При применении непрерывного шва разрывная нагрузка для парамедианного доступа выше на 33,8% по сравнению со срединным.
По результатам ретроспективного клинического исследования мы выявили наличие послеоперационной вентральной грыжи в 8,86% наблюдений, что совпадает с данными других авторов [6, 44, 59, 60].
При анализе частоты развития послеоперационных грыж в зависимости от используемого доступа наилучшие результаты получены нами при парамедианном доступе: частота развития послеоперационных вентральных грыж снизилась до 4,84%. Применение срединной лапаротомии и косого подреберного доступа осложнилось развитием грыж соответственно в 16,51 и 20,83% наблюдений. На преимущества парамедианного доступа и меньшую частоту грыжеобразования при его использовании указывают и другие авторы [2, 4, 16, 25, 28, 39, 47, 60]. Однако единого мнения до настоящего времени не существует, о чем свидетельствуют работы, сообщающие о преимуществах срединного лапаротомного доступа [7, 11, 37, 42]. Другой широко обсуждаемый вопрос касается сроков развития послеоперационных грыж. По одним данным, грыжи формируются в сроки от нескольких месяцев до 3-8 лет [59, 67] и даже 10 лет [34] после операции. Другие авторы придерживаются мнения о возникновении грыж в первые 6-12 мес после первичной операции [13, 17, 23, 64].
По нашим данным, послеоперационная грыжа развивается в первые 6-12 мес. Предпосылки к ее образованию закладываются в первые месяцы после операции, когда прочность раны целиком зависит от свойств сшиваемых тканей, выбора операционного доступа и техники шва. Заживление раны не означает ее резистентности к натяжению в течение 2 мес, поэтому изначальная прочность зависит исключительно от прочности шва раны [54]. Процесс заживления апоневроза длится 4-6 мес, а иногда до 1 года. В этот период биологические процессы заживления апоневроза еще не в состоянии обеспечить прочность лапаротомной раны, вследствие чего надежность шва апоневроза целиком зависит от механических свойств сшитого апоневроза [17, 64, 70].
По данным нашего экспериментального исследования, цельный апоневроз всегда прочнее сшитого независимо от доступа и техники шва. Мы попытались выяснить, какие доступ и техника шва обладают наилучшими прочностными характеристиками. Наша модель исследования базируется на анатомических особенностях строения передней брюшной стенки в разных ее областях. Анатомически самым тонким местом является белая линия живота, которая выполняет каркасную функцию, так как является сухожилием 6 мышц передней брюшной стенки, действующих разнонаправленно. На расстоянии нескольких сантиметров от срединной линии передняя брюшная стенка представлена передними и задними листками влагалища прямых мышц живота, между которыми располагается мышца. Прямая мышца живота обладает свойствами несжимаемой жидкости, заключенной в герметичный футляр. Таким образом, прочность при закрытии парамедианного доступа обусловлена механическими свойствами сшитых переднего и заднего листков. Несмотря на то что сшитый передний листок апоневроза выдерживает бо`льшую нагрузку, чем задний, разрушение образцов происходит при одной и той же деформации, что дает нам возможность оценивать прочность парамедианного доступа как сумму механических свойств переднего и заднего листков апоневроза прямой мышцы живота. На основании результатов проведенного эксперимента оптимальным операционным доступом является парамедианный, так как он выдерживает большие нагрузки по сравнению со срединным независимо от техники закрытия лапаротомной раны. При закрытии парамедианного доступа задний листок апоневроза следует сшивать непрерывным швом, тогда как передний листок можно зашивать с использованием любой техники шва.
Итак, экспериментальное и клиническое исследования показали, что парамедианный доступ обладает наилучшими механическими характеристиками и его использование сопровождается развитием грыжи реже, чем при применении срединного и косого подреберного доступов.
Таким образом, выбор рационального операционного доступа снижает частоту развития послеоперационных грыж. Парамедианный доступ обладает наилучшими биомеханическими характеристиками, а его клиническое применение позволяет снизить частоту грыжеобразования.
Послеоперационная вентральная грыжа развивается в первые 6-12 мес после операций на органах брюшной полости. Более поздние сроки выявления грыжи обусловлены ее несвоевременной диагностикой.
Шов кожи с точки зрения общего хирурга
Ни для кого не секрет, что весьма нередко наши пациенты качество работы хирурга, даже после сложнейших полостных вмешательств, оценивают по внешнему виду кожного рубца. Да, мы не занимаемся эстетической хирургией - «хирургией удовольствия», мы возвращаем людям здоровье и, нередко, жизнь. Однако, расхожей фразы о том, что «потеряв голову по волосам не плачут» для сегодняшних чрезмерно требовательных пациентов часто недостаточно для объяснения появления грубого деформированного рубца на брюшной стенке. А такие случаи, как мы знаем, не редкость. Безусловно, часть ран заживает вторичным натяжением. Но это составляет не более 10% от всех лапаротомий. В чем же дело? Может быть в том, что кожному шву в конце операции мы уделяем значительно меньше внимания, чем он того заслуживает. Или вообще поручаем его наложение начинающим хирургам: где же им еще учиться работе с тканью и иглой. Самое интересное заключается в том, что по мнению коллег - пластических хирургов кожа является очень «благодарной» тканью, чье заживление нарушается лишь при очень грубых ошибках хирургической техники.
Под нарушением репаративных процессов в коже понимают не столько ее расхождение после снятия швов (это - легко устранимая проблема), сколько возникновение гипертрофических рубцов.
Гипертрофические рубцы состоят из плотной фиброзной ткани в зоне повреждённой кожи. Они формируются при избыточном синтезе коллагена. Рубцы обычно грубые, тугие, возвышаются над поверхностью кожи, имеют красноватый оттенок, отличаются повышенной чувствительностью и болезненностью, часто вызывают зуд. Гипертрофические рубцы разделяют на две основные категории.
1. Обычный гипертрофический рубец соответствует границам предшествующей раны и никогда не распространяется за пределы зоны повреждения. В развитии гипертрофических рубцов ведущую роль играют следующие факторы: большие размеры заживающего раневого дефекта, ишемизация кожи в зоне шва, длительное заживление и постоянная травматизация рубца. Через 6-12 месяцев рубец обычно стабилизируется, приобретает чёткие очертания, отграничиваясь от атрофической части рубца и неповреждённой кожи, несколько уменьшается и размягчается.
2. Келоид — рубец, внедряющийся в окружающие нормальные ткани, до этого не вовлечённые в раневой процесс. В отличие от гипертрофических рубцов келоиды нередко образуется на функционально малоактивных участках. Его рост обычно начинается через 1-3 мес после эпителизации раны. Рубец продолжает увеличиваться даже через 6 мес и обычно не уменьшается и не размягчается. Типично отсутствие параллелизма между тяжестью травмы и выраженностью келоидных рубцов, они могут возникать даже после незначительных повреждений (укол, укус насекомого) и часто после ожога IIIА степени. Стабилизация состояния келоидного рубца обычно наступает через 2 года после его появления. Характерно, что келоидные рубцы практически никогда не изъязвляются.
Патогенез келоидов неизвестен. Некоторые авторы расценивают их как доброкачественные опухоли. По-видимому, наиболее правильно представление о том, что образование келоидов обусловлено нарушением развития соединительной ткани. Возможна аутоагрессия вследствие избыточного содержания в тканях биологически активных веществ. Не исключена роль эндокринных нарушений, индивидуальная предрасположенность к развитию келоидов, преобладание среди имеющих такие рубцы пациентов молодого и среднего возраста.
Гипертрофические рубцы с трудом поддаются лечению. Иссечение рубца может привести к его повторному развитию. Инъекции стероидов в область рубца (и/или их инъекции вслед за его иссечением), а также близкофокусная лучевая терапия могут предотвратить повторное развитие рубца.
Мы ни в коем случае не призываем к приданию чрезмерной важности эстетическим аспектам кожного шва на лапаротомной ране - основное поле деятельности и проявления мастерства абдоминальных хирургов скрыто от посторонних глаз. Однако, кроме «субстрата косметического эффекта», кожа является еще и частью операционной раны передней брюшной стенки, что требует не меньшей тщательности в формировании кожных швов, чем при ушивании апоневроза. Тем более, что кожный шов не требует неких невероятно сложных технических и временных затрат (как об этом слишком часто говорят в специализированных учреждениях…).
При формировании кожного шва следует:
- придерживаться прецизионной техники с точным сопоставлением эпидермального и дермального слоев;
- стремиться к эвертированию краев кожи; инвертирование (вворачивание краев кожи внутрь раны) недопустимо;
- использовать минимально травматичный шовный материал (монофиламентные или комплексные нити размерами 3/0-0 на атравматичной режущей или обратно-режущей игле в ½ окружности) ;
- использовать атравматичные пинцеты или однозубые крючки для тракции кожи;
- избегать натяжения кожи нитью (только аппозиция и иммобилизация) ;
- ликвидировать полости и карманы в подкожно-жировом слое;
- формировать шов таким образом, чтобы каждая нить проходила через кожу только однажды, сводя к минимуму перекрестное инфицирование вдоль всей линии швов;
- использовать съемные или абсорбируемые нити;
- не препятствовать естественному дренированию раны в первые два-три дня послеоперационного периода;
- оставлять в ране минимально возможное количество шовного материала.
Следует заметить, что наличие некоего специального «косметического шва» - это всего лишь расхожее заблуждение. Любой кожный шов, отвечающий вышеприведенным требованиям в полной мере может считаться косметическим. В настоящее время для ушивания раны кожи наиболее распространены несколько видов швов.
Простой узловой шов - одиночный шов, накладываемый в вертикальной плоскости, наиболее распространен для аппозиции и иммобилизации краев кожной раны, благодаря простоте наложения, гемостатическому эффекту, возможности хорошей адаптации краев раны.
К нюансам формирования простого узлового шва кожи относят следующие обязательные к выполнению технические моменты:
- вкол и выкол производятся строго перпендикулярно поверхности кожи;
- вкол и выкол должны находиться строго на одной линии, перпендикулярной длиннику раны;
- расстояние от края раны до места вкола должно составлять 0, 5-1 см, что зависит от глубины раны и выраженности клетчаточного слоя;
- нить проводится с захватом краев, стенок и, обязательно, дна раны для предотвращения формирования полостей в ране;
- при значительной глубине раны и невозможности наложения отдельного шва на подкожную клетчатку следует использовать многостежковые швы (например, шов Стручкова) ;
- расстояние между швами на коже передней брюшной стенки должно составлять 1-1, 5 см; более частые стежки приводят к нарушению микроциркуляции, более редки - к появлению диастаза краев раны;
- во избежание микроциркуляторных нарушений и неудовлетворительного косметического эффекта (поперечные линии на рубце) затягивание шва не должно быть чрезмерным, с образованием выраженного «валика» над кожей, нить должна обеспечивать лишь плотное сопоставление слоев кожи;
- сформированный узел должен находиться сбоку от линии ушитой раны, но не на ней.
Шов Мак Миллена-Донати (McMillen-Donati) - одиночный вертикальный П-образный узловой шов с массивным захватом подлежащих тканей и целенаправленной адаптацией краев раны. Эффективно применяется при ушивании глубоких ран с большим диастазом краев. Накладывается с помощью большой режущей иглы. Вкол производят на расстоянии 2 и более см от края раны, далее вкалывают так, чтобы захватить как можно больше и проводят до дна раны, где поворачивают иглу в направлении к срединной линии раны и выкалывают в самой ее глубокой точке. Затем на стороне выкалывания, по ходу стяжка, в нескольким мм от края раны иглу вновь вкалывают и выводят в толщу дермы на противоположной стороне, иглу таким же образом проводят в обратном направлении. При затягивании узла однородные ткани сопоставляются. К недостаткам шва следует отнести неудовлетворительный косметический результат вследствие образования грубых поперечных полос.
Несколько видоизмененным вариантом шва Мак Миллена-Донати является шов по Алльговеру (Allgower), отличающийся тем, что нить не проводится через поверхность кожи с контралатеральной стороны. Одиночные узловые швы кожи имеют как преимущества, так и недостатки. К преимуществам одиночных узловых швов следует отнести их относительную простоту и малые временные затраты для их наложения, наличие естественного дренирования полости ушитой раны в первые дни послеоперационного периода через промежутки между швами, возможность ограниченного раскрытия раны при снятии одного или нескольких швов. К недостаткам одиночных швов относится недостаточный косметический эффект при их использовании, даже при условии технически правильного их формирования. Дело в том, что одиночные швы - съемные, а для правильного формирования рубца необходима иммобилизация краев кожной раны максимально долгое время. Кроме того, при формировании отдельных швов неизбежно появление поперечных полос или рубцов в точках вкола-выкола иглы. Исходя из требований к косметическому эффекту, J. Chassaignac и W. Halstedt предложили формирование непрерывного внутрикожного шва на всю длину раны.
Шов Шассеньяка-Холстеда (Chassaignac-Halsted) - непрерывный внутренний адаптирующий. Шовная нить проходит в толще дермы, в плоскости, параллельной поверхности кожи. Иглу вкалывают на одной стороне разреза, проводя ее только интрадермально. После этого переходят на другую сторону разреза. С обеих сторон в шов захватывают одинаковое количество дермы (0, 5 - 1 см). По сути этот шов - непрерывный горизонтальный П-образный. В конце шва иглу выкалывают на коже, отступив от угла раны 1см. Нить фиксируется либо узлами непосредственно над раной, либо специальными якорными устройствами.
Формирование шва Холстеда обеспечивает полную адаптацию эпидермального и дермального слоев кожи и, соответственно, наилучший косметический эффект. При форимровании этого шва требуются особенно тщательный гемостаз, предварительная ликвидация остаточной полости ушиванием подкожной клетчатки и отсутствие натяжения кожи. В случае большой протяженности раны (свыше 8 см) теоретически могут возникнуть затруднения при извлечении длинной неабсорбируемой нити, поэтому при наложении такого шва рекомендуется через каждые 8 см осуществлять выкол на поверхности кожи, чтобы иметь возможность впоследствии удалить нити частями.
Как уже было отмечено, непременным условием применения непрерывного внутрикожного шва является тщательное сопоставление покожно-жировой клетчатки. Помимо гемостатического эффекта и профилактики остаточных полостей ушивание клетчатки способствует сведению краев кожной раны и обеспечивает возможность наложения кожного шва без натяжения. В этой связи J. Zoltan предложил усовершенствованный вариант внутрикожного шва.
Шов Холстеда-Золтана (Halsted - Zoltan) - двурядный непрерывный. Первый ряд накладывают приблизительно посредине подкожной основы, второй - внутрикожно. Первый укол иглы производят вблизи конца раны, на расстоянии 2 см от одного из краев. Затем иглу вкалывают и выкалывают поочередно в одной и другой стенке раны, проводя ее только по посредине толщины подкожной клетчатки в горизонтальной плоскости (непрерывный П-образный шов). Закончив формирование глубокого ряда шва, нить выводят на поверхность кожи. Оба конца нити натягивают, сближая таким образом края раны. Для формирования второго ряда кончик иглы выводят в дерму. Продолжают шить таким образом, чтобы точки вкола и выкола распологались симметрично относительно линии разреза, как при обычном шве Холстеда. До завершения наложения поверхностного шва нити удерживают натянутыми, затем формируют узел, связывая концы нитей на коже.
Непременным условием формирования непрерывного внутрикожного шва является использование только монофиламентной нити размером 3/0 - 2/0 на режущей или, лучше, обратно-режущей игле. Вопрос о предпочтении использования для непрерывного внутрикожного шва абсорбируемой (несъемной) или неабсорбируемой (съемной) монофиламентной нити на сегодняшний день остается открытым: часть хирургов остается убежденными сторонниками Prolene, другая же часть неизменно применяет Monocryl.
Для достижения наилучшего косметического эффекта, во многом связанного с травматизацией кожи при проведении нити, применяются комбинированные методики закрытия кожной раны. В последнее время все большей популярностью пользуется метод, включающий в себя в качестве одного из компонентов, использование клеевой аппликации для иммобилизации кожи после сведения и защиты раны от воздействия внешней среды. При этом в качестве средства иммобилизации и защиты применяется Dermabond - медицинский клей, имеющий в своей основе 2-окинцианокрилат и фиолетовый краситель для контрастирования с кожным покровом. После нанесения на кожу Dermabond вследствие контакта с воздухом в течение 30-60 секунд переходит из жидкой фазы в фазу упруго-эластического геля с исключительно прочной адгезией к кожным покровам. При этом на коже формируется прочная пленка, предотвращающая диастаз краев раны и защищающая края и стенки раны от контаминации микроорганизмами (использование клея исключает необходимость применения асептических повязок на послеоперационную рану). Dermabond обеспечивает иммобилизацию краев кожной раны на срок до 7-8 суток и по прошествии этого времени самостоятельно фрагментируется и удаляется с кожи. Обязательными условиями применения клея Dermabond являются тщательный гемостаз и плотное сведение краев раны швом подкожной клетчатки: возможно применение непрерывного шва или отдельных швов абсорбируемым материалом. Именно поэтому данный метод закрытия кожной раны является комбинированным - шовным и клеевым. Можно полагать, что внедрение в клиническую практику соединения краев кожной раны с помощью клеевой аппликации само по себе указывает на направление эволюции методов соединения тканей в хирургии: от нити к полимерным адгезирующим материалам.
Читайте также:
