УЗ-признаки объемных образований жевательной мышцы
Добавил пользователь Евгений Кузнецов Обновлено: 01.02.2026
Саркомы мягких тканей - разнородная группа злокачественных новообразований мягких тканей головы и шеи. Под мягкими тканями подразумеваются все анатомические образования, расположенные между кожей и костями скелета, подкожная жировая клетчатка, рыхлая жировая межмышечная прослойка, синовиальная ткань, поперечно-полосатые и гладкие мышцы.
Саркомы мягких тканей чаще встречаются у взрослых, чем у детей. Пик заболеваемости приходится примерно на 50-60 лет, но опухоль может возникнуть в любом возрасте. В структуре онкологической заболеваемости саркомы мягких тканей занимают 1%, из них на локализацию головы и шеи приходится 10%.
Следует выделить ряд особенностей сарком мягких тканей, к ним относятся:
- отсутствие истинной капсулы;
- склонность к прорастанию в близлежащие органы и ткани и последующему разрушению этих образований;
- рост с образованием нескольких опухолевых узлов.
Перечисленные признаки обуславливают нередкие местные рецидивы опухолей данной группы.
Причины развития
До сих пор неясно, почему возникают саркомы мягких тканей, однако были выявлены определенные факторы риска.
Генетическая предрасположенность
- невоидный базально-клеточный синдром (синдром Горлина);
- нейрофиброматоз (болезнь фон Реклингхаузена);
- туберозный склероз (болезнь Борневилля);
- синдром Гарднера;
- синдром Вернера.
Канцерогены
Риск развития ангиосарком значительно увеличивается при предшествующем контакте с феноксигербицидами (2,4-дихлорфеноксиуксусная кислота, 2,4,5-трихлорфеноксиуксусная кислота) и диоксинами.
Иммуносупрессия
Наиболее ярким примером является саркома Капоши у людей со СПИД, аутоиммунной гемолитической анемией и у перенесших трансплантацию органов.
Большинство пациентов приходят с жалобой на рост опухоли после перенесенной травмы или ушиба. Связь между травмой и развитием сарком мягких тканей отсутствует.
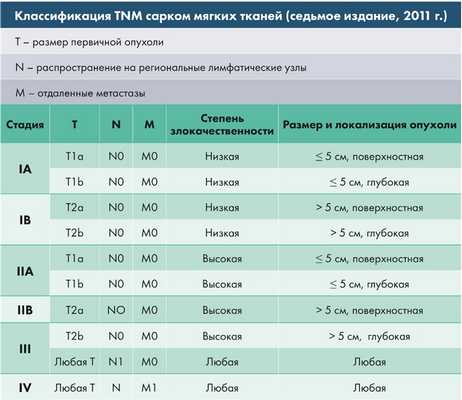
Классификация
Классификация по ткани, из которой происходит опухолевое образование:
- Жировая - липосаркома;
- Мышечная:
- исчерченная мышечная ткань - рабдомиосаркома,
- неисчерченная мышечная ткань - лейомиосаркома;
- Сосуды:
- кровеносные - гемангиосаркома,
- лимфатические - линфангиосаркома;
- Соединительная - фибросаркома;
- Синовиальная мембрана - синовиальная саркома;
- Нервная - нейрогенная саркома;
- Кожа - фибросаркома.
Симптомы
Клинические проявления и выраженность симптомов зависят от первичной локализации и размеров опухоли.
Чаще всего саркомы мягких тканей головы и шеи имеют бессимптомное течение.
- боль;
- парестезия - нарушение чувствительности вдоль хода периферических нервов, которое может проявляться жжением, онемением, покалыванием;
- параличи нервов;
- тризм - спазм жевательной мускулатуры, который характеризуется ограничением движений в височно-нижнечелюстном суставе;
- изъязвление слизистой оболочки;
- дисфония - явление, характеризующееся нарушением голосовой функции;
- дисфагия - нарушение глотания.
При расположении сарком мягких тканей рядом с носом может появиться заложенность носа, не проходящая на протяжении длительного периода.
Примеры сарком мягких тканей головы и шеи
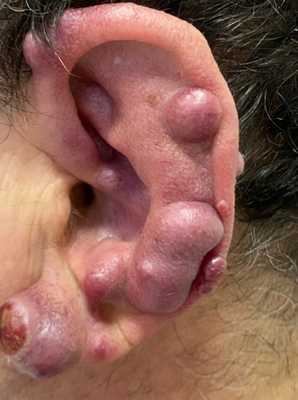
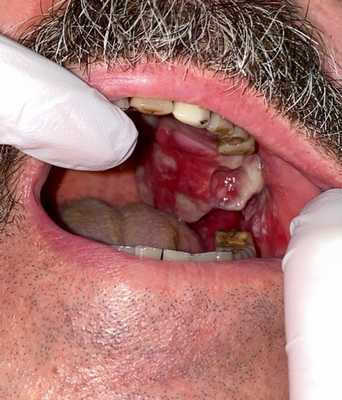
Остеогенная саркома альвеолярного отростка верхней челюсти
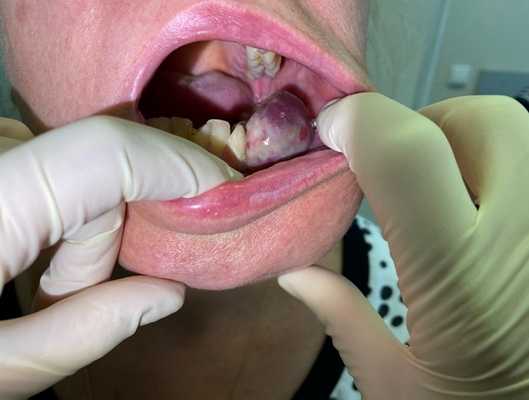
Остеогенная саркома нижней челюсти
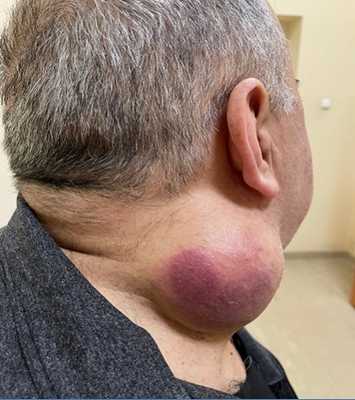
Плеоморфная саркома мягких тканей шеи справа
Диагностика
Диагноз устанавливается на основании гистологического исследования ткани опухоли.
Есть два метода получения материала для исследования:
- толстоигольная биопсия;
- открытая биопсия.
Биопсия должна быть выполнена в той локализации, которая во время операции будет входить в зону иссечения опухолевого образования.
- Осмотр: может наблюдаться бугристый округлый желтый или серый узел. Он может иметь разную плотность и консистенцию. Мягкие узлы - при липосаркомах, плотные - при фибросаркомах, желеобразные образования - при миксомах;
- Общий анализ крови с подсчётом лейкоцитарной формулы и количества тромбоцитов;
- Биохимический анализ крови с определением показателей функции печени, почек (включая электролиты); ;
- МРТ области головы и шеи;
- КТ лёгких;
- Ультразвуковое исследование;
- Радиоизотопное исследование костей скелета (при миксоидных липосаркомах);
- КТ головного мозга (при альвеолярной саркоме мягких тканей и гемангиоперицитоме).
Важно: с целью первичного обследования и уточнения стадии рутинное назначение ПЭТ не рекомендуется.
Лечение
К лечению пациента с саркомами мягких тканей головы и шеи требуется комплексный подход с привлечением ряда специалистов: морфолога, хирурга, лучевого диагноста, химиотерапевта, радиолога.
Хирургическое лечение
Хирургическое вмешательство является основным методом лечения пациентов с данной патологией.
Рост сарком мягких тканей происходит в капсуле, которая впоследствии отодвигает близлежащие ткани. Эта оболочка называется псевдокапсулой. Оперативное вмешательство подразумевает удаление псевдокапсулы единым блоком с отрицательными краями резекции без ее повреждения, так как нарушение целостности этого образования повышает риск рецидива опухоли.
В постоперационном периоде может проводится лучевая терапия для обеспечения местного контроля.
К дополнительным методам лечения можно отнести химиотерапию и лучевую терапию.
Лучевая терапия
Предоперационая лучевая терапия дает значительные преимущества - улучшаются условия оперирования и уменьшаются размеры опухолевого образования.
Негативным моментом этого лечения является высокая частота послеоперационных осложнений инфекционного характера.
Химиолучевая терапия
Лечение, сочетающее химиотерапию с лучевой терапией, называется химиолучевой терапией.
Химиотерапия может улучшить эффективность лучевой терапии, поэтому иногда их применяют вместе. Это комбинация системной и местной терапии.
Лечение при распространенном процессе
Химиотерапия является основой лечения прогрессирующего заболевания, так как вводимые препараты попадают в кровоток и достигают раковых клеток по всему организму.
Наиболее распространенными химиотерапевтическими препаратами, применяемыми при саркомах мягких тканей, являются доксорубицин, трабектедин, гемцитабин, доцетаксел и паклитаксел. Эти препараты могут быть назначены отдельно или в комбинации.
Химиотерапия у больных с прогрессирующим течением заболевания должна быть основана на доксорубицине или эпирубицине, оба препарата принадлежат к антрациклинам. У пациентов с ангиосаркомой вместо доксорубицина может быть предложен паклитаксел или доцетаксел.
Добавление другого препарата(ов) к доксорубицину или эпирубицину может усилить эффект системного воздействия химиотерапии у некоторых больных. Этот выбор в первую очередь зависит от гистологического типа рака.
Если первая химиотерапия не дала ожидаемого результата, то может быть предложена другая химиотерапия. Выбор одного или нескольких препаратов будет зависеть от ранее применяемых препаратов, а также от гистологического типа опухоли. Препараты, которые можно рассматривать, включают ифосфамид, трабектедин, гемцитабин, доцетаксел и паклитаксел.
Таргетная терапия
Этот метод лечения работает путем связывания с определенным белком или структурой, участвующей в росте и прогрессировании опухоли. Побочные эффекты отличаются от традиционной химиотерапии и зависят от механизма действия препарата. Таргетными препаратами, одобренными для применения при саркомах мягких тканей в России, являются:
- пазопаниб - при саркомах мягких тканей, отличных от липосарком;
- иматиниб - при дерматофибросаркоме, когда требуется системная терапия.
Лучевая терапия может применяться для облегчения симптомов или предотвращения осложнений, например, в случае наличия костных метастазов.
Хирургия
Хирургическое лечение метастазов может быть рассмотрено в зависимости от их локализации и от анамнеза заболевания. Например, когда метастазы в легких появляются через длительное время после первоначального лечения и когда, по мнению хирурга, их можно полностью удалить.
Прогноз
Прогноз при саркомах мягких тканей головы и шеи во многом зависит от размера опухоли, первичной локализации, этиологии и наличия местных или отдаленных вторичных очагов злокачественного новообразования. При проведении ранних диагностических мероприятий и адекватной своевременной терапии прогноз благоприятный.
Список литературы:

Авторская публикация:
Миненков Н.В.
Клинический ординатор НМИЦ онкологии им. Н.Н. Петрова

Под научной редакцией:
Раджабова З.А.
Заведующий отделением опухолей головы и шеи
НМИЦ онкологии им. Н.Н. Петрова,
врач-онколог, научный сотрудник, кандидат медицинских наук, доцент
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Ультразвуковое исследование челюстно-лицевой области
Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Ультразвуковой метод исследования прочно вошел в общую диагностическую практику, его роль трудно переоценить. Современный подход к диагностике заболеваний в клинике внутренних болезней немыслим без ультразвукового исследования органов брюшной полости (в том числе забрюшинного пространства и малого таза), щитовидной железы, молочных желез, сердца и сосудов.
По сравнению с перечисленными выше направлениями применения эхо графии ультразвуковое исследование челюстно-лицевой области выполняется существенно реже. Это связано, с одной стороны, с клинической обособленностью стоматологии и челюстно-лицевой хирургии, не позволяющей врачам ультразвуковой диагностики общей практики получить достаточный опыт исследований данной области, а с другой - с некоторым консерватизмом стоматологов и челюстно-лицевых хирургов, считающих основным для них диагностическим методом рентгенологическое исследование. Их скептицизм в отношении ультразвукового исследования основан на том, что практически все мягкотканные структуры челюстно-лицевой области доступны пальпации, а кожа и слизистые оболочки - осмотру.
Однако, отдавая дань истории развития ультразвуковой диагностики, необходимо упомянуть, что объектом самых первых (тогда еще одномерных - в А-режиме) эхографических исследований, выполненных группой исследователей под руководством D. Howry в 1955 г., были околоушные железы.
УЗИ мягких тканей лица и шеи в его современном варианте не требует применения каких либо специальных ультразвуковых сканеров или датчиков и может быть выполнено на оборудовании, предназначенном для исследования периферических структур: вполне достаточными являются линейные датчики с частотой колебаний 5,0-7,5-9,0 МГц. Чрескожная эхография обладает достаточно высокой информативностью и в основном удовлетворяет запросам клиницистов: практически все отделы лица и шеи (включая тело и корень языка) доступны эхографическому исследованию с использованием наружных датчиков. Недоступными являются лишь верхние отделы окологлоточного пространства и крылочелюстное пространство, экранируемые ветвью нижней челюсти.
Возрастных ограничений и специальной подготовки пациента к проведению эхографического исследования не требуется.
Для врача ультразвуковой диагностики челюстно-лицевая область может представлять большой профессиональный интерес, поскольку здесь встречаются заболевания всех нозологических групп (от воспалительных, аутоиммунных и дегенеративно-дистрофических до опухолевых), а также разнообразные пороки развития (ангиодисплазии, лимфангиомы, врожденные кисты). Дифференциально диагностические сложности увеличиваются из-за того, что челюстно-лицевая область является зоной массивного инфицирования и существование первично невоспалительных заболеваний нередко маскируется присоединением воспали тельного процесса со всем спектром (от стертых до клинически выраженных) его признаков.
Сложность анатомического строения челюстно-лицевой области создает дополнительные трудности для трактовки результатов ультразвукового исследования. Вместе с тем анатомическая детализация имеет большое значение, поскольку определение органопринадлежности патологического процесса и уточнение топографо-анатомических особенностей его распространения являются одной из важнейших задач диагностики наряду с идентификацией нозологической формы заболевания. Этот момент приобретает особую актуальность, если учитывать, что при операциях именно на челюстно-лицевой области перед хирургами особенно остро стоит задача поиска компромисса между выбором оптимального доступа для осуществления максимально возможной радикальности вмешательства и нанесением возможно меньшего эстетического ущерба лицу пациента.
Частные вопросы диагностики
В настоящее время благодаря внедрению ультразвуковых диагностических технологий в акушерскую практику челюстно-лицевая область становится объектом врачебного интереса еще до рождения ребенка. Это делает доступным внутриутробное выявление расщелин и других пороков развития лица и шеи плода, ряда синдромов, имеющих лице вые признаки (синдромы Дауна, Турнера, Гольденхара и т.д.), а также распознавание тератом, гемангиом и лимфангиом плода.
Своевременное обнаружение этих изменений заставляет в ряде случаев пересмотреть подход к тактике ведения беременности или предусмотреть необходимость выполнения определенных организационно-тактических и лечебных мероприятий в перинатальном и неонатальном периодах. Это касается, в частности, расширения акушерской бригады с привлечением челюстно-лицевых хирургов для оказания возможно более ранней специализированной помощи.
Ультразвуковое исследование вносит существенный вклад в диагностику за болеваний больших слюнных желез.
При воспалительных заболеваниях околоушных желез эхография позволяет провести дифференциальную диагностику различных форм паротита, выявить сиалодохит - воспаление в протоках слюнных желез, распознать воспаление внутрижелезистых лимфатических узлов (лимфаденит) и уточнить его стадию. Все это по существу является разграничением хирургической и нехирургической патологии околоушных желез (рис. 1-7).
УЗ-признаки объемных образований жевательной мышцы
Кафедра хирургической стоматологии и челюстно-лицевой хирургии
Кафедра патологической анатомии ГБОУ ВПО "Уральская государственная медицинская академия" Минздрава РФ
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
ОГУЗ "Свердловское областное патологоанатомическое бюро", Екатеринбург
Оссифицирующий миозит жевательных мышц
Журнал: Российская стоматология. 2012;5(4): 29‑32
Костина И.Н., Зайцева Л.Н., Филатова А.С., Иощенко С.Е. Оссифицирующий миозит жевательных мышц. Российская стоматология. 2012;5(4):29‑32.
Kostina IN, Zaĭtseva LN, Filatova AS, Ioshchenko SE. Myositis ossificans of masticatory muscles. Russian Stomatology. 2012;5(4):29‑32. (In Russ.).
Оссифицирующий миозит (ОМ) характеризуется ограниченным формированием кости в толще мышцы. ОМ - опухолеподобный процесс, локализующийся в мягких тканях [1]. Заболевание впервые описано в 1648 г., редко встречается у детей, за исключением лиц с наследственным заболеванием, известным как прогрессирующий ОМ (прогрессирующая оссифицирующая фибродисплазия, болезнь Мюнхмейера). Распространенность составляет 1 случай на 2 млн человек [4]. Выделяют также травматический ОМ или ограниченный ОМ [8, 16], у пациентов с повреждением спинного мозга - нейрогенный ОМ [3].
ОМ не связан с воспалением мышцы, поэтому некоторые клиницисты предпочитают называть это заболевание гетеротопическим окостенением. В 70-80% случаев заболевание локализуется на бедре, плече, ягодице [1, 8]. В большинстве случаев появлению ОМ предшествует однократная или многократная тупая травма [5, 6]. Время между получением травмы и обнаружением изменения мышцы может варьировать от 3 нед до 20 лет.
В научной литературе представлены единичные случаи ОМ m. masseter, m. temporalis, m. pterygoideus, m. buccinator, m. platysma, m. sternocleidomastoideus [10, 14]. Поражение ОМ жевательных мышц чаще одностороннее, но описано и двустороннее поражение [7]. Наблюдались случаи ОМ жевательных мышц после сложного удаления нижнего третьего моляра [4, 16], 4-недельной интенсивной терапии онкологической больной c развившимся сепсисом, нейромиопатией и нефропатией [7].
Причина формирования кости в мышце неизвестна [5]. Патогенез ОМ остается неизученным. Согласно одной теории, травма мышцы стимулирует пролиферацию фибробластов, которые затем подвергаются костной метаплазии. Широко обсуждается также теория о том, что травма скелетной мышцы вызывает экспрессию костного морфогенетического белка на поврежденном участке, которая, в свою очередь, стимулирует примитивные стволовые клетки дифференцироваться в остеобласты, что приводит к гетеротопическому окостенению [16, 17]. По данным Е. Shore и соавт. [13], прогрессирующий ОМ вызван мутацией гена, кодирующего активины типа киназы, что приводит к изменению хондро- и остеогенеза [2, 12].
До настоящего времени недостаточно изучена патоморфология оссификации жевательных мышц, дифференциальная диагностика ОМ.
Цель исследования - изучение морфологических особенностей ОМ при поражении жевательных мышц.
Материал и методы
В исследование включено 8 пациентов (3 женщины, 5 мужчин) в возрасте от 19 до 60 лет (средний возраст 33,8 года). При обращении все пациенты предъявляли жалобы на выраженное ограничение открывания рта, нарушение функции жевания. По данным анамнеза, у 7 пациентов имела место предшествующая травма челюстно-лицевой области, у 1 пациентки ограничение открывания рта ни с чем не было связано. Длительность заболевания составила от 1 до 12 мес.
Всем пациентам проведены клиническое, рентгенологическое, лабораторное исследования. У 7 пациентов выполнено хирургическое лечение с последующим исследованием операционного материала. Послеоперационный период протекал без осложнений. Пациентам назначалась симптоматическая терапия, механотерапия, физиотерапия. Один пациент от операции отказался.
Операционный материал фиксировали в 10% растворе нейтрального формалина, декальцинировали в растворе Биодек R, проводили по спиртам возрастающей концентрации, заливали в парафин и микротомировали. Гистологические срезы окрашивали гематоксилином и эозином, пикрофуксином по Ван-Гизону.
Результаты и их обсуждение
У 7 пациентов был выявлен односторонний травматический ОМ с поражением только жевательных мышц: m. pterygoideus lateralis - у 1, m. temporalis - у 2, m. masseter - у 4. Одна пациентка с ОМ m. pterygoideus medialis отрицала наличие травмы в анамнезе. Длительность заболевания составила: 1 мес - у 2 пациентов, 2 мес - у 2 пациентов, 3 мес - у 1 пациента, 6 мес - у 2 пациентов, 12 мес - у 1 пациента.
Поводом для обращения пациентов служило стойкое ограничение подвижности нижней челюсти, что нарушало прием пищи, речь. Максимальное открывание рта составляло 5-15 мм. При открывании рта нижняя челюсть смещалась в сторону пораженной мышцы, иногда с щелканьем в височно-нижнечелюстном суставе. Болевой синдром отсутствовал. Цвет кожи изменен не был. При поражении m. temporalis и m. masseter пальпаторно определялся безболезненный, не смещаемый, с четкими границами участок уплотнения тканей. Пальпировать m. pterygoideus при клиническом осмотре не представилось возможным. Характерных клинических симптомов ОМ выявлено не было.
При компьютерной томографии было исключено поражение височно-нижнечелюстного сустава и выявлены участки окостенения в пораженных жевательных мышцах с четкими границами. Проведенное хирургическое лечение 7 пациентов позволило восстановить функцию нижней челюсти, жевание. Рецидивы ОМ не наблюдали.
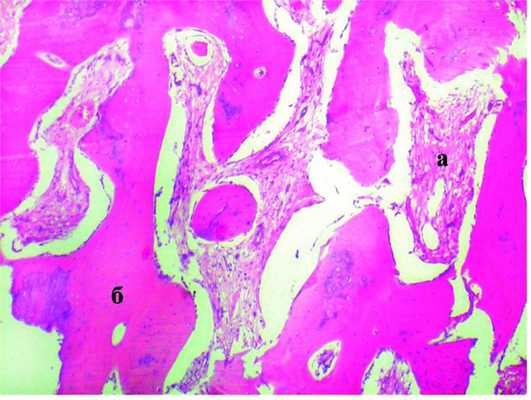
При микроскопическом исследовании было выявлено разное морфологическое строение узлов ОМ в жевательных мышцах. Так, у пациента 19 лет при травматическом поражении m. masseter слева 6 мес назад микроскопически определялся узел с хорошо сформированными костными балками, рыхлой соединительной тканью с небольшим количеством межтрабекулярной ткани со слабым обызвествлением (рис. 1). Рисунок 1. Пациент 19 лет. Оссифицирующий миозит. Микрофото. Окраска гематоксилином и эозином. ×400. а - сформировавшиеся костные балки среди фиброзной ткани, б - разделенные прослойкой рыхлой соединительной ткани, костные балки с признаками дистрофии. Фиброзная ткань плавно переходила в костную ткань. Мышечные волокна с признаками дистрофии.
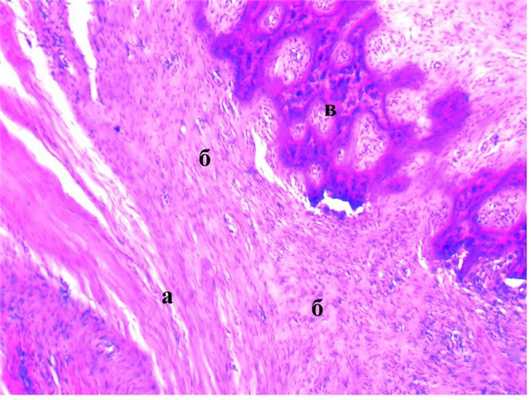
У пациентки 60 лет при поражении m. masseter справа 6 мес назад (после удаления зубов) микроскопически определялся узел, отграниченный от окружающей мышечной ткани грубоволокнистой соединительной тканью (рис. 2). Рисунок 2. Пациентка 60 лет. Оссифицирующий миозит, феномен зональности. Микрофото. Окраска гематоксилином и эозином. ×100. Отграниченный узел (а) среди фиброзной ткани с большим количеством фибробластов (б) с участками гиалиноза, сформированными костными балками (в) с признаками дистрофии.
Мышечные волокна с дистрофическими изменениями. В центре узла определялась фиброзная ткань с пролиферацией фибробластов. Средняя зона представлена незрелым остеоидом и развивающимися хрящевой и костной тканями. Периферия узла содержала строму с коллагеновыми волокнами, большое количество костных балок. Микроскопически выявлен «феномен зональности».
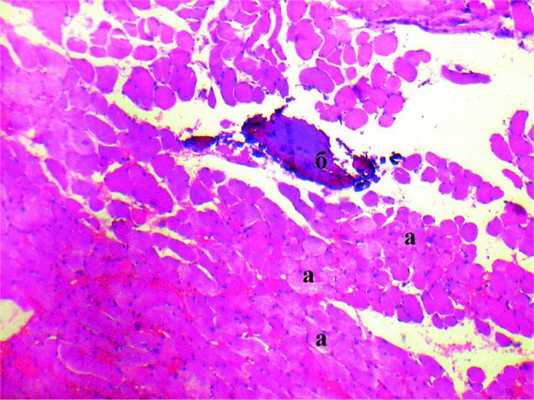
У пациента 44 лет при травматическом поражении m. temporalis слева 12 мес назад был выявлен ОМ в зрелой стадии (рис. 3). Рисунок 3. Пациент 44 года. Оссифицирующий миозит. Микрофото. Окраска гематоксилином и эозином. ×100. а - участки дистрофии поперечно-полосатых мышечных волокон, б - очаг костной ткани с признаками некроза.
Микроскопическая картина характеризовалась наличием в мышечной ткани участков костных структур с признаками некробиоза. Мышечные волокна дистрофически изменены. В узле определялись хорошо дифференцированные костные балки неправильной формы, беспорядочно расположенные участки остеоида со слабым обызвествлением. «Феномен зональности» отсутствовал.
Для ОМ характерно возникновение плотного, неподвижного, безболезненного при пальпации узла. Диагноз травматического ОМ основывается на данных анамнеза о травме (хотя только в 70% случаев пациенты сообщают о наличии удара), клинических симптомах, рентгенологических признаках и микроскопическом исследовании биопсийного материала. Для пациентов с ОМ жевательных мышц характерно ограниченное открывание рта [11, 15]. По данным R. Wiggins и соавт. [16], развитие травматического ОМ проходит несколько гистологических фаз: 1) ранняя фаза - быстрая пролиферация фибробластов; 2) промежуточная фаза - образование остеоида, появление зонирования; 3) последняя фаза - образование на периферии губчатой кости и жира.
Микроскопическая картина ОМ характеризуется значительным разнообразием тканевых структур [1]. В ранней стадии отмечаются кровоизлияния среди волокнистой соединительной ткани, очаги миксоматоза, ангиоматоза, хондроматоза, фокусы кальцинации. Фибробласты, фиброциты местами образуют скопления в большом количестве. Фибробласты крупные или неправильной формы с гиперхромным ядром, зернистой цитоплазмой. Фигуры митоза малочисленны. Могут наблюдаться включения жировых клеток, очаги кроветворения. Очаги костеобразования наблюдаются в различных стадиях созревания. Это могут быть участки энхондральной оссификации, остеоида с разной степенью обызвествления и беспорядочно расположенных сформированных костных балок, нередко окруженных остеобластами.
В зрелой стадии ОМ определяется зональность строения [1, 5, 8, 16]. Центральная зона представлена недифференцированными веретеноообразными клетками с обильными митозами фиброзной, костномозговой ткани и некротической мышечной тканью. Средняя зона с активными остеобластами, незрелым остеоидом, развивающейся хрящевой и костной тканью отделена тонкостенными сосудистыми каналами [5, 16]. По периферии узла располагаются хорошо дифференцированные костные балки со зрелой губчатой костью, остеокластами и стромой, содержащей коллагеновые волокна [8]. Узел отделен от окружающей ткани слоем грубоволокнистой соединительной ткани с хрящевыми участками, костными балками, ориентированными по периферии [1, 16]. В узле определяются пучки мышечных волокон, отдельные волокна с дистрофическими изменениями, миобласты с эозинофильной цитоплазмой.
Зональную архитектонику гистологического строения ОМ при поражении жевательных мышц описывают многие исследователи [1, 5, 8, 16]. При гистологическом исследовании ОМ жевательных мышц S. Meng и соавт. [9] в 5 случаях обнаружили зональные изменения в участках оссификации мышц, в 10 случаях зональность отсутствовала. В нашем исследовании также определены случаи зонального и незонального строения узла ОМ при поражении жевательных мышц.
Заключение
Особенности морфологического строения ОМ: обилие остеоида, незрелые неравномерно минерализованные костные трабекулы с округлыми остеобластами и остеокластами в сосудистой основе. Эти структуры определяются и при остеоид-остеоме и остеобластоме, но в них «обратное зонирование», т.е. зрелая кость в центре и незрелый остеоид с пролиферацией клеток по краю.
ОМ необходимо дифференцировать с доброкачественными опухолями соединительной ткани, остеомой, остеобластомой, остеосаркомой, узловым фасциитом, рабдомиомой, хондромой, остеохондромой [1, 16].
Таким образом, ОМ жевательных мышц имеет разное морфологическое строение с наличием или отсутствием зональности при оссификации ткани. Предложенные Э.Л. Нейштадт и А.Б. Маркочевым [1] дифференциальные признаки ОМ: 1) отсутствие спикул, треугольника Кодмана при рентгенологическом исследовании, 2) малое количество или отсутствие фигур митозов в клетках, 3) большое количество зрелых костных балок, 4) зональность микроскопического строения, - необходимо дополнить непостоянным признаком зональности узла при поражении жевательных мышц, стойким нарушением подвижности нижней челюсти без болевого синдрома.
Институт хирургии им. А.В. Вишневского, Москва
Лечебно-реабилитационный центр Минздрава РФ, Москва
Лечебно-реабилитационный центр Министерства здравоохранения и социального развития РФ, Москва
Интрамускулярная миксома подвздошно-поясничной мышцы
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2014;(12): 75‑77
Кочатков А.В., Негардинов А.З., Богомазова С.Ю. Интрамускулярная миксома подвздошно-поясничной мышцы. Хирургия. Журнал им. Н.И. Пирогова. 2014;(12):75‑77.
Kochatkov AV, Negardinov AZ, Bogomazova SIu. Intramuscular myxoma of iliopsoas muscle. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2014;(12):75‑77. (In Russ.).
Больная Л., 73 лет, госпитализирована в отделение онкологии хирургического профиля Лечебно-реабилитационного центра для предоперационной подготовки и планового оперативного лечения по поводу неорганной забрюшинной опухоли. При поступлении предъявляла жалобы на ноющие боли в левой поясничной области, кризовое течение артериальной гипертензии с периодическими подъемами АД до 200/100 мм рт.ст.

Из анамнеза известно, что указанные жалобы беспокоят на протяжении последних 2 мес. По данным КТ брюшной полости (см. рис. 1 и далее на цв. вклейке) в проекции левой поясничной мышцы выявлена неорганная забрюшинная опухоль размером 75×48×80 мм. Рисунок 1. Компьютерная томограмма органов брюшной полости, артериальная фаза. Визуализируется округлое кистозное опухолевидное образование, располагающееся на подвздошно-поясничной мышце.
При поступлении состояние удовлетворительное, 0 баллов по шкале ECOG (Eastern Cooperative Oncology Group). Больная активна, в сознании, контрактна, адекватна. Не лихорадит. Конституция гиперстеническая, индекс массы тела 37 кг/м 2 . Кожный покров и видимые слизистые физиологической окраски. Периферических отеков нет. Дыхание через нос свободное, частота дыханий 18 в 1 мин. Аускультативно над легкими выслушивается везикулярное дыхание, хрипов нет. Тоны сердца ясные, ритм правильный, АД 180/100 мм рт.ст., ЧСС 88 в 1 мин. На передней брюшной стенке в правой подвздошной области послеоперационный рубец после аппендэктомии, заживший первичным натяжением. Грыж нет. Живот обычной формы, участвует в акте дыхания, при пальпации мягкий, слабо болезненный в эпигастральной области. Перитонеальных симптомов нет. Печень, желчный пузырь и селезенка не пальпируются. Стул оформленный, кал обычного цвета. Область почек безболезненная при пальпации, симптом Пастернацкого отрицательный с обеих сторон.
В лабораторных анализах показатели в пределах нормальных значений. Отмечаются повышение уровня глюкозы крови до 7,9 ммоль/л и лейкоцитурия (до 40 лейкоцитов в поле зрения).
Предоперационный диагноз: неорганная забрюшинная опухоль левой подвздошной области T2bN0M0. Сопутствующие заболевания: распространенный атеросклероз, атеросклероз аорты и ее ветвей. Метаболический синдром. Артериальная гипертензия 2-3-й стадии, III степени, риск сердечно-сосудистых осложнений 4. Дислипидемия. Нарушение толерантности к глюкозе. Ожирение. Хронический пиелонефрит. Аппендэктомия в 2012 г.
Проведена предоперационная подготовка, заключавшаяся в коррекции артериальной гипертонии, уросептическая терапия.
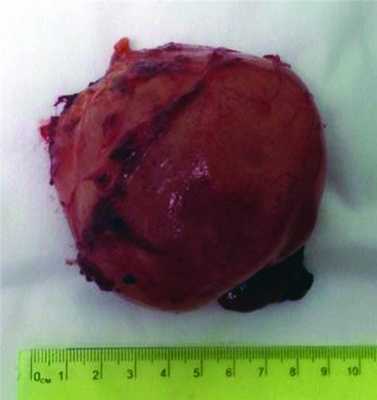
15.05.14 больная оперирована. Выполнено удаление неорганной забрюшинной опухоли. При интраоперационной ревизии опухоль не определялась из-за выраженного висцерального ожирения. Патологических изменений внутренних органов выявлено не было. Произведена латеральная мобилизация нисходящей ободочной кишки. За паранефральной клетчаткой выделена m. Iliopsoas. После этого визуализировано округлое, кистозно-солидное образование диаметром до 9 см плотноэластической консистенции, ограниченной подвижности. Произведена мобилизация образования по передней и боковой поверхности. Сзади, сверху и снизу образование неотделимо от указанной мышцы. Произведена резекция мышцы с образованием. Опухоль удалена без травмы капсулы (рис. 2). Рисунок 2. Удаленный препарат.
При патоморфологическом исследовании макроскопически определяется опухолевидное образование округлой формы, с гладкой поверхностью, размером 8,2×8,0×4,5 см, которое на разрезе представлено однородной, блестящей, серовато-белой слизистой тканью студенистой консистенции; к образованию прилежит фрагмент мышечной ткани. Микроскопически - картина доброкачественной опухоли мягких тканей, представленной примитивными, немногочисленными клетками веретенообразной формы, погруженными в гиповаскулярную, обильную миксоидную строму (рис. 3, а). Рисунок 3. Микрофотографии. Окраска гематоксилином и эозином. Ув. 20. Объяснение в тексте. Опухоль нечетко отграничена и инфильтрирует окружающие склетные мышцы (рис. 3, б). Рисунок 3. Микрофотографии. Окраска гематоксилином и эозином. Ув. 20. Объяснение в тексте. Гистологическая картина соответствует интрамускулярной миксоме (код 8840/0 по международной классификации онкологических заболеваний ICD-Oncolog).
Послеоперационный период протекал без осложнений. Пациентке проведена антибиотикопрофилактика, мультимодальное обезболивание, ранняя активизация. Через 3 ч больная переведена в отделение, вечером пациентка активна в пределах палаты, начато пероральное питание. Дренаж брюшной полости удален на следующие сутки. На 3-и сутки больная соответствовала критериям выписки - болевой синдром, купирующийся приемом пероральных анальгетиков, полное пероральное питание, восстановление пассажа пищи по желудочно-кишечному тракту. При контрольном УЗИ патологических изменений не выявлено. Контрольные анализы в пределах нормальных значений.
На 5-е сутки больная выписана под наблюдение онколога по месту жительства с рекомендациями периодического контрольного обследования (1 раз в 6 мес УЗИ брюшной полости и анализ крови на СА 19-9).
Миксома (myxoma; от греч. myxa - слизь) - доброкачественная опухоль соединительнотканного происхождения, состоящая из недифференцированных звездчатых клеток, расположенных в рыхлой муцинозной строме с базофильными волокнами. Слизеподобная масса является гиалуроновой кислотой, так как растворяется гиалуронидазой и дает реакцию на мукоиды. Считается, что первым термин «миксома» использовал R. Virchow в 1871 г., описывая слизистую опухоль пупочной области [15]. Критерии постановки диагноза предложены A. Stout в 1948 г. [28]. Эти опухоли чаще встречаются в сердце, подкожной и апоневротической ткани, органах мочеполовой системы, в коже и др.
Миксомы, развивающиеся в скелетных мышцах, называют интрамускулярными. Они были описаны в качестве отдельного подтипа миксом в 1965 г. F. Enzinger [6] и составляют лишь 17% случаев мягкотканных миксом. Заболеваемость ИММ крайне мала - 1 случай на 1 000 000 населения в год, чаще встречается у женщин (соотношение 14:3) [10]. Большинство публикаций является описанием отдельных клинических наблюдений [1-4, 7, 9, 12, 17, 19, 20, 22, 23, 27]. Только единичные работы анализируют серию (до 51 наблюдения) ИММ [6, 18, 21]. Описано только 2 наблюдения развития ИММ у детей раннего возраста [12].
Чаще всего ИММ развиваются в мышцах плеча, ягодицы, бедра, голени и туловища [6, 21]. Редко локализациями ИММ являются голова и шея [15]. В литературе имеются единичные описания забрюшинного расположения этих новообразований [9, 25, 29]. Большинство ИММ - солитарные новообразования. Однако небольшая часть множественных ИММ может быть ассоциирована с синдромом фиброзной дисплазии - Mazabraud-синдром [5, 8, 13, 24, 31].
Клиническая картина зависит от первичной локализации. Проявления болезни связаны с синдромом сдавления окружающих органов и тканей. При пальпации ИММ, как правило, безболезненна [32]. Заподозрить ИММ по данным клинического и инструментального обследования, до морфологического исследования, крайне затруднительно. Опухоли визуализируются при ультразвуковом исследовании (УЗИ) и/или компьютерной томографии (КТ). При КТ выявляют гиподенсное образование плотностью около 20 ед. H. ИММ не имеют специфических рентгенологических и ультразвуковых признаков. Как правило, визуализируется кистозное новообразование с солидным компонентом, расположенное в непосредственной близости от мышцы [11, 14]. Эти же характеристики могут встречаться и при других новообразованиях, таких как кистозная гигрома, липома, кистозная тератома и др. Инструментальное обследование пациентов необходимо в первую очередь для планирования хода оперативного лечения.
«Золотым стандартом» лечения является хирургическое удаление опухоли в пределах здоровых тканей без травмы капсулы опухоли.
ИММ является медленно растущей опухолью с благоприятным прогнозом [10, 26]. Однако описаны и рецидивы заболевания [16, 25, 30]. В качестве биохимического контроля за заболеванием может быть использован карбогидратный антиген. Показано повышение концентрации CA 19-9 в крови у пациентов с ИММ на фоне рецидива опухоли [30].
Таким образом, описанная нами интрамускулярная миксома - крайне редкое новообразование, а первичная локализация в забрюшинном пространстве является казуистической. Заподозрить ее до операции затруднительно из-за отсутствия специфических клинических симптомов. В диагностике заболевания ключевую роль играют УЗИ и КТ, необходимые и для планирования операции, которая служит основным методом лечения.
Редкое заболевание, локализуется чаще в коже. Встречается у людей с нарушенным липидным обменом, обычно множественное. Локализуется также в сухожилиях. Представлено мелкими узелками, частью типа ксантелазм.
Юношеская ксантогранулема
Небольшой узелок в толще дермы или подкожной клетчатке. Исчезает спонтанно.
Фиброзная гистиоцитома
Чаще встречается в среднем возрасте, локализуется преимущественно на нижних конечностях. Обычно имеет форму плотного узла до 10см, растет медленно. После хирургического удаления рецидивы редки.
ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ ЖИРОВОЙ ТКАНИ
Липома
Одна из самых частых доброкачественных опухолей (30—40%). Может возникнуть всюду, где есть жировая ткань. При локализации в дерме обычно инкапсулированная, в других участках тела слабо отграничена. Озлокачествляться могут опухоли, локализованные в забрюшинном пространстве, другие локализации практически не озлокачествляются. Липомы нередко бывают множественными, иногда развиваются симметрично. Рост их не связан с общим состоянием организма. Опухоль имеет форму узла дольчатого строения. При длительном существовании в липоме могут развиваться дистрофические изменения, обызвествление, оссификация.
Существуют многочисленные варианты зрелых жировых опухолей, которые отличаются от классической липомы как клиническими проявлениями, так и некоторыми морфологическими особенностями.
Миелолипома
Редкая опухоль, чаще встречается в забрюшинном пространстве, клетчатке малого таза, надпочечниках. Не озлокачествляется.
Подкожная ангиолипома
Многочисленные болезненные узлы. Встречается чаще в молодом возрасте у мужчин на передней стенке живота, на предплечье.
Веретеноклеточная липома
Наблюдается чаще у взрослых мужчин (90%). Узел округлой формы, плотный, медленно растущий, чаще локализован в области плечевого сустава, спины. Рецидивы и метастазы после иссечения не описаны, несмотря на тот факт, что опухоль может инфильтрировать окружающие ткани.
В хондро- и остеолипомах выявляют метапластические участки костной и хрящевой ткани.
Доброкачественный липобластоматоз
Подразделяется на узловатую (добр. липобластома) и диффузную (добр. липобластоматоз) формы. Болеют чаще мальчики до 7 лет (88%). Опухоль локализуется на нижней конечности, в области ягодиц и на верхней конечности — надплечье и кисть. Описаны также поражение шеи, средостения, туловища. Опухолевый узел инкапсулированный, дольчатый, шаровидной формы, может достичь 14 см. После хирургического лечения возможны рецидивы, иногда повторные. Метастазы не описаны.
Гебернома (фетальная липома)
Липома из липобластов, псевдолипома — исключительно редкая опухоль, локализуется в местах, где имеется бурый жир (шея, аксилярная область, сина, средостение). Представлен дольчатым узлом обычно маленького размера. Не рецидивирует и не метастазирует.
ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ МЫШЕЧНОЙ ТКАНИ
Опухоли мышечной ткани делят на опухоли гладких мышц — лейомиомы, и поперечно полосатых — рабдомиомы. Опухоли встречаются достаточно редко.
Лейомиома
Зрелая доброкачественная опухоль. Возникает в любом возрасте у лиц обоих полов. Нередко бывает множественной. Опухоль может озлокачествляться. Лечение хирургическое.
Лейомиома, развивающаяся из мышечной стенки мелких сосудов — небольшие, часто множественные нечетко отграниченные и медленно растущие узлы, часто с изъязвленной кожей, клинически очень напоминает саркому Капоши.
Генитальная лейомиома образуется из мышечной оболочки мошонки, больших половых губ, промежности, сосков молочной железы. Может быть множественной. В опухоли нередко отмечается клеточный полиморфизм. Гормонозависимая. Лечение хирургическое.
Ангиолейомиома из замыкающих артерий
Клинически резко болезненная опухоль, которая при внешних воздействиях или эмоциях может менять размеры. Размеры обычно маленькие, чаще встречается у пожилых людей, на конечностях, вблизи суставов. Характеризуется медленным ростом и доброкачественным течением.
Рабдомиома
Редкая зрелая доброкачественная опухоль, имеет в своей основе поперечно полосатую мышечную ткань. Поражает сердце и мягкие ткани. Представляет собой умеренно плотный узел с четкими границами, инкапсулированная. Метастазов рабдомиомы не описано. Рецидивы крайне редки. Микроскопически различают 3 субтипа — миксоидный, феталный клеточный и взрослый. Выделяют также рабдомиому женских гениталий. Рецидивирует в основном взрослый тип.
ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ КРОВЕНОСНЫХ И ЛИМФАТИЧЕСКИХ СОСУДОВ
Эти поражения включают в себя различные процессы, значительное число из них рассматриваются в дерматологии. Часть из них относится к порокам развития сосудистой системы опухолевидного характера, часть к истинным опухолям.
Капиллярная ангиома
Истинное новообразование с пролиферацией эндотелиальных клеток.
Доброкачественная гемангиоэндотелиома
Врожденная патология, встречается у новорожденных и грудных детей, чаще у девочек, с локализацией в области головы.
Капиллярная гемангиома
После липомы наиболее частая опухоль мягких тканей, часто бывает множественной, максимальной величины достигает к 6 месячному возрасту, при множественном поражении возможны локализации во внутренних органах
Кавернозная гемангиома
Образование, состоящее из причудливых полостей типа синусоид различной величины. Локализуется в коже, мышцах, внутренних органах. Имеет доброкачественное течение.
Старческая гемангиома
Истинная опухоль, характеризуется пролиферацией капилляров с последующей их кавернизацией с вторичными изменениями.
Гемангиома
Зрелая доброкачественная опухоль сосудистого происхождения, встречается часто. Поражает чаще людей среднего возраста, локализуется на слизистой оболочке носа, губы, на коже лица, конечностей, в молочной железе. Представляет собой четко отграниченный узел серовато-розового цвета 2—3 см. Опухоль нередко может озлокачествляться и перейти в ангиосаркому.
Артериальная ангиома
Конгломерат порочно развитых сосудов, не имеет признаков опухоли.
Гломангиома (гломусная опухоль, опухоль Барре—Массона)
Встречается в виде изолированной опухоли или в виде множественной диссеминированной семейной гломусангиомы. Опухоль доброкачественная, встречается у пожилых людей, в кистях и стопах, чаще в зоне ногтевого ложа. Может поражать кожу голени, бедра, лица, туловища. В единичных наблюдениях отмечена в почках, влагалище, костях. При локализации в коже опухоль резко болезненная. Не рецидивирует и не метастазирует.
Гемангиоперицитома
Встречается редко, может возникнуть в любом возрасте. Локализуется в коже, реже в толще мягких тканей. Имеет вид отграниченного плотного узла красного цвета. Опухоль может озлокачествляться — давая рецидивы и метастазы, считается потенциально злокачественным процессом. Озлокачествление до 20% случаев описано у взрослых. Процесс у детей имеет доброкачественный характер.
Лимфангиома
Наблюдается чаще у детей как порок развития лимфатических сосудов, однако может встречаться в любом возрасте. Чаще локализуется на шее, слизистой полости рта.
ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ И ОПУХОЛЕПОДОБНЫЕ ЗАБОЛЕВАНИЯ СИНОВИАЛЬНОЙ ТКАНИ (СУСТАВОВ)
Доброкачественная синовиома без гигантских клеток
Существование доброкачественных синовиом обсуждается. Большинство авторов склоняется к тому, что все синовиомы являются злокачественными независимо от степени зрелости. Опухоль поражает главным образом коленный сустав, в виде небольших плотных узлов. Лечение хирургическое, однако больные должны наблюдаться в течение 5—9 лет. Болезнь может дать рецидивы и метастазы.
Доброкачественная гигантоклеточная синовиома (нодулярный тендосиновиит)
Псевдоопухолевый процесс, встречается достаточно часто. В 15% процесс возникает в области синовиальной оболочки суставов, в 80% — в сухожильных влагалищах, в 5% — в слизистых сумках. Представляет собой узловатое образование, чаще локализованное на пальцах кистей, реже стоп и еще реже в области крупных суставов. Излюбленная локализация — межфаланговые суставы. Чаще встречается у женщин 30—60 лет. При длительном существовании может вызвать атрофию окружающих тканей, в том числе и кости. Процесс часто рецидивиреут, большая часть рецидивов связана с неполным удалением. Метастазов не дает.
Пигментный виллонодулярный синовит
Располагается внутри оболочки суставов, чаще в зоне коленного локтевого и плечевого суставов. Встречается в среднем возрасте. Этиология не ясна.
ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ ПЕРИФЕРИЧЕСКИХ НЕРВОВ
Травматическая или ампутационная неврома
Возникает как результат посттравматической гиперрегенерации нерва. Представляет собой небольшой болезненный узел.
Нейрофиброма
Одиночная, медленно растущая доброкачественная опухоль мезенхимальной оболочки нервного ствола любой локализации, но чаще всего развивается на седалищном нерве и межреберных нервах. Возникает у людей любого возраста. Клинически определяется в виде небольших размеров плотно-эластической консистенции с гладкой поверхностью опухолевого узла, при пальпации которого боль иррадирует по ходу нерва. Некоторые опухоли могут достигать больших размеров. Рост опухоли может происходить как к периферии от нерва, так и в толще нервного ствола, что выявляется при ее морфологическом исследовании.
Лечение хирургическое. Прогноз хороший. Особое заболевание — множественный нейрофиброматоз (болезнь Реклингхаузена), которое относится к группе диспластических процессов. Описаны случаи озлокачествления одной из множественных нейрофибром при этом заболевании.
Неврилеммома (невринома, шваннома)
Доброкачественная опухоль шванновской оболочки. Образуется по ходу нервных стволов. Бывает одиночной. Прогноз благоприятный.
Читайте также:
- Влияние месячных на течение сахарного диабета. Причины декомпенсации диабета
- Гипофизарно-адреналовая система при предраковых заболеваниях желудка
- Случай реабилитации пациента с тяжелой степенью пародонтита при помощи имплантации с немедленной нагрузкой
- Синдром Герлитца (Herlitz)
- Рентгенограмма, МРТ, УЗИ при дисплазии тазобедренного сустава
