УЗИ, ЭхоКГ при брадиаритмии у плода
Добавил пользователь Владимир З. Обновлено: 14.01.2026
Нарушения сердечного ритма плода до недавнего времени во многих случаях являлись причиной мертворождения, неонатальной и младенческой смертности, что послужило импульсом к развитию нового междисциплинарного направления в перинатологии - фетальной кардиологии-аритмологии. В отличие от фетальных тахиаритмий, которые активно поддаются лечению, даже своевременно предпринятая терапия брадикардии далеко не всегда обеспечивает благоприятный исход. В связи с чем предикция и профилактика развития фетальной атриовентрикулярной блокады до настоящего времени являются предметом активного изучения. В обзор включены научные публикации за последние 10 лет (преимущественно систематические обзоры и метаанализы) зарубежных и отечественных авторов, обнаруженные в базе данных Pubmed и в других доступных поисковых платформах: Cochrane, Web of Science, MEDLINE, Google Scholar. Приводятся современные представления о частоте встречаемости и патогенезе брадиаритмий плода, рассмотрены различные лечебно-профилактические подходы.
Заключение. Необходимо проведение дальнейших клинико-лабораторных исследований по разработке комплексного обследования и оптимальной тактики ведения беременных с различными видами фетальных брадиаритмий.
Нарушения сердечного ритма и проводимости у плода до недавнего времени во многих случаях являлись причиной мертворождения, неонатальной и младенческой смертности, что послужило импульсом к развитию нового междисциплинарного направления в перинатологии - фетальной кардиологии-аритмологии.
Фетальные нарушения ритма, по данным литературы, встречаются с частотой от 0,1% до 5% беременностей и подразделяются на тахиаритмии с частотой сердечных сокращений выше 160 в минуту и брадиаритмии с частотой сердечных сокращений ниже 110 в минуту [1]. Среди брадиаритмий ведущее место по тяжести последствий для проводящей системы плода занимает полная атриовентрикулярная (AV) блокада сердца, которая встречается с частотой 1 на 20 000-30 000 беременностей [1, 2]. Именно AV-блокада чаще других нарушений ритма приводит к развитию неиммунной водянки, в каждом втором случае ассоциируется с врожденными пороками развития сердца плода и до 25% - с хромосомными и синдромальными патологиями [3]. Неонатальная смертность от данного вида аритмии составляет 30%, особенно в ситуации ранней манифестации, и достигает 100% при сопутствующем эндокардиальном фиброэластозе и/или дилатационной кардиомиопатии [2, 4, 5].
В то время как фетальные тахиаритмии активно поддаются лечению, даже своевременно предпринятое лечение нарушений ритма сердца плода по типу брадикардии далеко не всегда обеспечивает благоприятный исход. В связи с чем предикция и профилактика развития фетальной AV-блокады до настоящего времени являются предметом активного изучения [1].
По данным литературы, в патогенезе брадиаритмии плода описаны две большие группы этиологических факторов: фетальные (врожденные аномалии развития сердца и генетические каналопатии), вызывающие блокады проведения импульса, и материнские [2].
Врожденные пороки развития сердца (дефект предсердно-желудочковой перегородки, тетрада Фалло, корригированная транспозиция магистральных сосудов) и генетически обусловленные каналопатии (синдром Бругада, синдром слабости синусового узла, синдром длинного Q-T, синдром Андерсена-Танила) нарушают электрофизиологическую преемственность между предсердиями и желудочками, составляют до 25% всех случаев брадиаритмии [2, 6].
Материнский фактор имеет место в 3 из 4 случаев всех брадиаритмий плода и обусловлен [2, 7]:
- заболеваниями обмена веществ у матери (фенилкетонурия, сахарный диабет 2 типа);
- инфильтративными заболеваниями миокарда, связанными с трансплацентарным переходом материнских Ro/La-аутоантител;
- вирусными инфекциями (цитомегаловирус, Коксаки, аденовирус);
- приемом лекарственных средств (антиконвульсанты, ретиноиды, селективные ингибиторы обратного захвата серотонина, препараты лития, препараты аденозинпревращающего фермента);
- ишемическими заболеваниями миокарда.
Патогенез
Наибольшую распространенность - от 50% до 80% всех случаев внутриутробной брадиаритмии, по данным различных авторов 2, имеет аутоиммуноопосредованная брадикардия плода (АОБП), которая связана с наличием у матери аутоиммунного заболевания (синдром Шегрена, системная красная волчанка, ревматоидный артрит, антифосфолипидный синдром, заболевания соединительной ткани, недифференцированная дисплазия соединительной ткани и т.д.) или бессимптомного носительства анти-Ro/La-антител.
Описанный в литературе симптомокомплекс преходящих кожных высыпаний и AV-блокады у новорожденных от матерей с аутоиммунным ревматологическим заболеванием называется неонатальной волчанкой (НВ). В то время как некардиальные проявления волчанки у новорожденных имеют преходящий характер и проходят по мере выведения материнских антител из кровотока новорожденного, болезнь проводящей системы, по существу, необратима. Важно отметить, что в подавляющем большинстве случаев нарушение ритма сердца плода является первым сигналом о подозрении заболевания у матери и служит основанием для ее обследования [7].
Наибольшее значение в развитии ревматологических заболеваний имеют пептид SSB/La 48 кДа и два пептида SSA/Ro 52 кДа и 60 кДа, являющиеся антинуклеарными антителами [7, 8].
Антинуклеарные антитела, специфичные для ряда аутоиммунных заболеваний матери и в норме отсутствующие в организме, вырабатываются к растворимым компонентам ядра клетки - рибонуклеопротеинам (RNP).
По данным ряда авторов [7, 9], анти-Ro-антитела (SSA) и анти-La-антитела (SSB), попав в кровоток плода, могут напрямую связываться с кальциевыми каналами L-типа кардиомиоцитов и обратимо подавлять их активность. Однако в ряде случаев, по неустановленным до настоящего времени причинам, длительное воздействие данных антител приводит к интернализации кальциевых каналов, нарушая метаболизм кальция в кардиомиоцитах плода, что служит причиной апоптоза клетки. Иммуногистохимическими исследованиями было показано, что поглощение макрофагами апоптотических клеток приводит к выработке провоспалительных цитокинов, экспрессия которых, наряду с компонентами комплемента, генерирует устойчивую воспалительную реакцию в .
Возможности эхокардиографии плода в I триместре беременности (11-14 недель)
Московский областной НИИ акушерства и гинекологии (МОНИИАГ), Россия.
Гомельский областной медико-генетический центр с консультацией "Брак и семья", Гомель, Беларусь.
УЗИ сканер HS70
Точная и уверенная диагностика. Многофункциональная ультразвуковая система для проведения исследований с экспертной диагностической точностью.
Введение
Актуальность темы пренатальной диагностики врожденных пороков сердца (ВПС) понятна всем врачам, которые связаны с пренатальной диагностикой, неонатологией, педиатрией, кардиологией, генетикой. ВПС являются одной из ведущих причин перинатальной смертности и регистрируются с частотой 4-13 на 1000 живорожденных [1]. В связи с тем, что профилактические мероприятия по предупреждению ВПС не имеют должного успеха, представляется актуальной и необходимой их пренатальная ультразвуковая диагностика.
- Семьи, имеющие ребенка с ВПС.
- Семьи с ВПС у одного или обоих супругов.
- Женщин, страдающих сахарным диабетом, системными заболеваниями соединительной ткани, гипотиреозом.
- Беременных с тератогенной экспозицией в ранние сроки беременности (герпес ранее 6-7-й недели) [2].
Однако параллельно другими учеными эти группы риска отвергались, потому что большинство ВПС встречались у плодов и детей, матери которых не входили ни в одну из предложенных групп риска. Единственными разумными критериями так называемого селективного отбора были признаны беременные, попавшие в группу риска после проведения скрининга I триместра и беременные с подозрением на ВПС при ультразвуковом исследовании (УЗИ) плода [3].
Неоспоримо, что оптимальными сроками беременности для исследования сердца плода являются 20-22 недели, однако большинство летальных и клинически значимых пороков сердца могут быть диагностированы в конце I триместра беременности. Позволим себе процитировать слова главы Fetal Medicine Foundation Кипраса Николаидеса, высказанные им на страницах сайта FMF (www.fetalmedicine.com): "Специалист ультразвуковой диагностики с 12 недели беременности должен заверить большинство родителей, что у их ребенка нет крупных врожденных пороков сердца. В случае крупных врожденных пороков сердца их раннее выявление может привести к постановке правильного диагноза или хотя бы вызвать подозрение для осуществления ультразвукового мониторинга".
Главная цель пренатальной диагностики сформулирована специалистами пренатальной диагностики всего мира - это обеспечение женщины максимально возможной информацией о пороке как можно раньше. Мы должны дать право женщине и семье в целом решать вопрос о пролонгировании беременности с грубыми пороками развития у плода [4].
С каждым годом все большее количество публикаций посвящается диагностике ВПС в ранние сроки - в I триместре беременности 5. Практически ни один из выпусков журнала ISUOG (Ultrasound In Obstetrics and Gynecology, или "белого" журнала, как его называют специалисты) не обходит своим вниманием тему ранней диагностики врожденных пороков развития.
На самом знаменитом сайте в мире пренатальной диагностики www.thefetus.net (Philippe Jeanty, USA) опубликовано уже более 30 случаев находок ВПС в I триместре беременности. Однако в отечественной периодике встречаются лишь единичные работы по этой теме. Все они пренадлежат "перу" специалистов пренатальной диагностики Российской ассоциации врачей ультразвуковой диагностики в перинатологии и гинекологии, хотя для многих специалистов как раньше, так и сейчас осмотр сердца плода в сроки 11-14 недель заключается лишь в констатации числа сердечных сокращений.
Цель эхокардиографии в I триместре беременности состоит в выявлении летальных и клинически значимых ВПС. Это исследование не ставит целью выявление стенозов и гипоплазий выносящих трактов, диагностику мелких дефектов перегородок, патологий дуги аорты и артериального протока. Многие из этих пороков не только технически невозможно заподозрить в I триместре, манифестируют они после 30-й недели беременности, т.е. их диагностика является прерогативой исследования III триместра.
Точность пренатальной диагностики ВПС во все сроки беременности варьирует в широком диапазоне. Причинами этого могут быть разный опыт специалистов, ожирение беременной, частота использованных ультразвуковых трансдьюсеров и класс ультразвукового аппарата, перенесенные ранее абдоминальные операции, срок беременности, количество околоплодных вод и положение плода. Однако заметим, что многие из этих факторов теряют свою актуальность именно при проведении трансвагинальной эхокардиографии в I триместре беременности. Своевременная диагностика ВПС позволяет идентифицировать плоды высокого риска по генетическим синдромам, что имеет важное значение при проведении пренатального консультирования и оказывает существенное влияние на акушерскую тактику.
Результаты
С 2006 по 2011 г. пренатально в I триместре беременности были выявлены 125 ВПС. Из них 68 (55%) ВПС сочетались с различными хромосомными аномалиями (ХА) плода, 30 (24%) входили в состав различных множественных врожденных пороков развития (МВПР), 27 (21%) ВПС были изолированными.
При эхокардиографии изучались четырехкамерный срез сердца плода (рис. 1) и срез через три сосуда (рис. 2). УЗИ проводилось трансабдоминальным датчиком, лишь при необходимости (затрудненная визуализация) использовался внутриполостной датчик. Четырехкамерный срез сердца плода при ультразвуковом сканировании трансабдоминальным датчиком визуализировался в 85% случаев, срез через сосуды - в 73%, при использовании трансвагинального датчика эти цифры существенно возрастали до 100 и 91% соответственно. Оптимизация пренатальной диагностики ВПС может быть достигнута путем строгого соблюдения основных методических правил. При оценке четырехкамерного среза плода необходимо оценить нормальное расположение сердца плода, исключив его эктопию (рис. 3), положение оси сердца плода, что не представляет никаких трудностей, нормальные пропорции и размеры камер сердца, движение створок атриовентрикулярных клапанов должно быть свободным, септальная створка трикуспидального клапана должна располагаться ближе к верхушке сердца (рис. 4). При оценке среза через три сосуда необходимо оценить взаиморасположение сосудов и их диаметр.
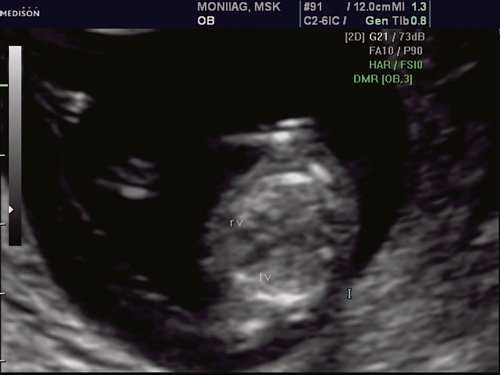
Рис. 1. Беременность 12 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца.
Эхо-КГ (эхокардиография) плода

Эхо кг плода является современным методом диагностики сердечно-сосудистой системы. Суть метода заключается в определении возможных патологических изменений в формировании сердца плода, которые визуализируются при помощи высокочастотных волн. Процедуру проводят по показаниям, в тех случаях, когда во время прохождения плановой УЗИ диагностики у беременной было выявлено отклонения от нормы. Какие ещё существуют показания к проведению исследования, и как оно осуществляется?
Основная характеристика метода
Эхокардиография плода - это не инвазивный метод исследования, способный визуализировать сердце и сосуды в период внутриутробного развития ребенка при помощи ультразвуковых волн. Современные технологии позволяют применять в пренатальной диагностике высокоточные и безопасные аппараты, которые гарантируют безопасность при проведении данного исследования.
Сделать качественный скрининг затруднительно женщинам с избыточной массой тела, так как толстый слой жировой клетчатки хуже пропускает ультразвук
Основой для качественной диагностики является наличие программы, позволяющей определить функциональное состояние сердечно-сосудистой системы на приборе, оснащенным специальным датчиком, имеющим частоту сканирования не менее 5 МГц, а также цветное картирование системы кровообращения и доплер.
Эхо кг плода позволяет определить следующие параметры:
- частоту сокращений сердца;
- проходимость кровеносных сосудов;
- скорость и направленность движения крови по сосудам;
- соотношение объема поступающей и выходящей из аорты крови.
Фетальная диагностика должна осуществляться перинатальными экспертами, имеющими сертифицированную специализацию для выполнения методики. Как правило, это кардиологи и акушеры-гинекологи.
Показания к проведению скрининга
Эхокардиография плода не входит в перечень обязательных исследований при беременности, она назначается для подтверждения или опровержения диагноза после прохождения планового ультразвука на 10-й - 12-й неделях.
Обязательным показанием к проведению скрининга являются беременные, у которых определяют отклонения в количестве околоплодных вод
Эхокардиографию плода назначают при наличии патологических состояний в анамнезе женщины:
- Системные и эндокринные заболевания (сахарный диабет, гипотериоз, васкулит, красная волчанка).
- Повышенный риск хромосомных патологий у плода (они выявляются на первом триместре беременности при прохождении комплексного анализа).
- Наличие ребенка от предыдущей беременности с врожденным пороком сердца.
- Предыдущая беременность закончилась самопроизвольным выкидышем.
- Настоящая беременность протекает с осложнениями (задержка в росте плода, фетоплацентарная недостаточность).
- Многоплодие (относятся и женщины, зачавшие при помощи искусственного оплодотворения).
- Перенесенные инфекционные заболевания в период вынашивания ребенка (герпес, краснуха, ветряная оспа, токсоплазмоз).
- Прием тератогенных медикаментов в первом триместре (антибиотики, ингибиторы МАО, противосудорожные средства, фенобарбитал).
- Возрастная категория женщин старше 35 лет.
Виды эхокардиографии
Методика включает в себя несколько разновидностей техник, которые зависят от используемого оборудования, и цели диагностики:
- Двухмерная диагностика позволяет изучить основные анатомические структуры сердца плода, на данный момент высокая четкость и визуализации способны выявить малейшие изменения.
- Одномерное исследование определяет параметры, функциональную способность и анатомическое строение клапанов, створок и стенок рабочего органа в процессе их деятельности.
- Доплер эхокардиография, более расширенная методика, определяющая гемодинамику, ритмичность и сократительную способность сердца, направленность тока крови по сосудам.
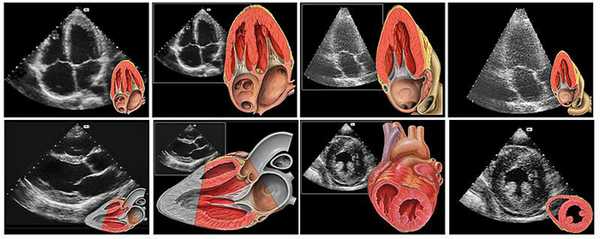
Визуализация анатомических структур сердца плода при эхо кг
Данные виды исследования также позволяют оценить количество циркулирующей крови, степень сужения артерий, минутный выброс, что является важным диагностическим критерием в диагностике патологий сердца.
Выявление патологии
Заподозрить наличие дефекта сердца можно и на ранних сроках вынашивания плода. Так, во время первого скрининга на 12-й - 14-й неделе специалист должен тщательно осмотреть камеры органа, дугу аорты. При подозрении на какие-либо патологические изменения женщина направляется на УЗИ-экспертизу, где находится под присмотром узких специалистов.
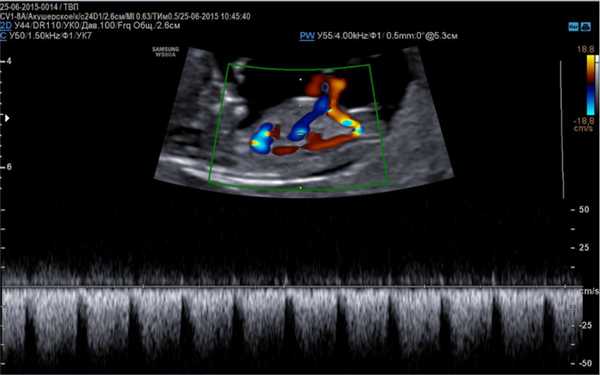
Венозный проток является основным маркером при выявлении дефектов ёще при прохождении первого скрининга
В случае подтверждения порока сердца родителям будущего малыша необходимо выяснить степень тяжести патологических проявлений, поскольку некоторые дефекты не приносят существенного вреда. Так, незначительные дефекты в мышечном или мембранном слое межжелудочковой перегородки считаются менее опасными. Данный вид дефекта наиболее часто встречается на эхокардиографии, однако отверстия могут закрыться до момента рождения плода или после него. Дети находятся на учете и постоянно проходят осмотр кардиолога до момента закрытия дефекта.
Выявление порока конотрункуса, основы для построения аорты и легочной артерии вместе с желудочками, чаще всего имеет неблагополучный прогноз и требует неотложного хирургического вмешательства.
Специалист, чтобы определить наличие порока на эхо кг плода при беременности, должен провести осмотр, согласно лекции Международного сообщества гинекологов, по следующим пунктам:
- Определение расположения плода в полости матки.
- Обозначение оси сердца.
- Установление соотношения окружности грудной клетки к переднезаднему размеру сердца.
- Срезы органа.
- Способность перегородок отражать звуковые волны.
- Функциональное состояние створок клапанов.
- Артерии, обеспечивающие доступ крови к сердцу и другим органам.
Если у беременной на эхокардиографии идентифицировали тяжелую сердечную патологию, то необходимо провести дополнительный скрининг для исключения или подтверждения диагноза через 7-10 дней.
Как осуществляется процедура?
Сделать эхо кг можно с помощью цветного аппарата ультразвуковой диагностики и прибором для допплерографии. На ранних сроках вынашивания ребенка применяется вагинальный метод исследования матки. Длительность процедуры составляет около 40-45 минут, однако при подозрении на патологию диагностика может несколько продлиться.
При правильном расположении плода в матке женщине достаточно занять горизонтальное положение на спине
Алгоритм того как, делают эхо кг плода:
- Женщина принимает горизонтальное положение на спине с вытянутыми ногами.
- На область живота наносится небольшое количество геля, улучшающего качество визуализации органов на мониторе.
- Затем на животе беременной закрепляется датчик.
Тактика ведения при выявлении патологии
В зависимости от результатов скрининга специалисты могут применить следующие подходы в ведении беременной:
- Прерывание беременности (при тяжелых дефектах, которые не совместимы с жизнедеятельностью ребенка вне утробы).
- Неотложное оперативное вмешательство (совместимые с жизнью, тяжелые патологии, при которых требуется срочная операция в специализированных учреждениях).
- Постоянный мониторинг состояния плода (незначительные патологические изменения требуют постоянного контроля и коррекции привычного образа жизни женщины).
Таким образом, данный вид исследования достаточно результативный, так как обладает высокой чувствительностью. Он позволяет снизить риск рождения детей с несовместимыми с жизнью патологиями сердца, а также дает возможность проведения своевременной операции.
Отзывы
Екатерина, 25 лет
При прохождении второго скрининга на 20-й неделе врач выявил дополнительную хорду. Гинеколог отправила пройти эхо кг, спустя 7 дней после УЗИ. Процедура заняла около 15 минут, после чего выдали заключение на руки. По результатам скрининга оказалось, что это особенность строения сердца, а так все параметры в норме.
Валентина, 36 лет
Данный скрининг проходила на 24-й неделе беременности, поскольку относилась к группе риска (у меня сахарный диабет). Процедуру делала в специализированной платной клинике, где работает высококвалифицированный кардиолог. Мне сделали допплер эхокардиографию, она показала не только строение сердца, но и ток крови по артериям, ведущим к сердцу. По результатам пороков не выявлено.
Анна, 27 лет
При прохождении УЗИ на 22-й неделе врач выявил дефект в межжелудочковой перегородке. Мне выписали направление на эхокардиографию, которую я прошла спустя 12 дней. По результатам скрининга диагноз подтвердился, у ребеночка определили малый мембранозный дефект ДМЖП. Меня поставили на учет к кардиологу, у которого я постоянно проходила обследование. Сразу после рождения дефект самопроизвольно закрылся, так как был небольшой в диаметре.
Эхокардиография плода

Показания
ЭХоКГ назначается при высоком риске развития сердечной патологии у плода. На такой риск может указывать наличие ВПС у родителей или ближайших родственников, случаи рождения в семье детей с врожденной патологией сердца, выявление хромосомных аномалий у плода (например, синдрома Дауна, синдрома Патау). Факторами, которые могут повышать вероятность формирования дефектов сердца у плода, служат внутриутробные инфекции (краснуха, токсоплазмоз, цитомегалия и др.); прием в процессе беременности антибиотиков, противоэпилептических средств; наличие у матери эндокринных и системных заболеваний (сахарного диабета, СКВ, ревматоидного артрита); употребление наркотиков и алкоголя; возраст беременной старше 38 лет.
Дополнительная фетальная эхокардиография показана в тех случаях, когда при скрининговом УЗИ была выявлена задержка внутриутробного развития плода, мало- или многоводие, водянка плода, нарушения сердечного ритма (тахикардия, брадикардия, аритмии), кардиомегалия или аномалии строения сердца, множественные пороки развития внутренних органов.
С помощью эхокардиографии в пренатальном периоде могут быть идентифицированы такие ВПС, как
- гипоплазия левых отделов сердца
- атрезия легочной артерии
- дефекты МЖ и МП перегородок
- транспозиция магистральных сосудов
- аномальный дренаж легочных вен и мн. др.
Их дородовая диагностика позволяет специалистам (акушеру-гинекологу, неонатологу, кардиохирургу) грамотно спланировать тактику ведения беременности, выбрать лучший способ родоразрешения, провести необходимую предоперационную подготовку новорожденного и кардиохирургическую операцию в оптимальные сроки. Достоверность ЭхоКГ в обнаружении врожденных аномалий строения и функционирования сердца составляет 90%. Тем не менее, сразу после рождения с целью подтверждения диагноза в обязательном порядке проводится УЗИ сердца ребенку.
Виды исследования
При выполнении ЭхоКГ используются различные режимы сканирования, позволяющие детально визуализировать сердце плода:
- двухмерная эхокардиография - используется для оценки анатомии основных структур сердца (камер, клапанов, главных артерий и вен). Изображение выводится в виде двухмерного среза.
- М-эхокардиография - позволяет наблюдать интракардиальные структуры (стенки камер сердца, створки клапанов) в режиме движения, оценивать систолическую функцию желудочков.
- Допплерэхокардиография - используется для изучения гемодинамики в сосудах и камерах сердца, а также оценки сердечного ритма. Проводится в режиме ЦДК и импульсной допплерографии.
Методика проведения
Стандартное эхографическое исследование включает оценку четырехкамерного среза сердца (положения сердца в грудной полости, строения желудочков и предсердий, сформированности межжелудочковой и межпредсердной перегородок, движений створок митрального и трикуспидального клапанов), главных артерий (взаиморасположение и диаметр аорты и легочного ствола), характеристик сердечной деятельности (ЧСС, ритмичности предсердно-желудочковых сокращений). С протоколом эхокардиографии плода в обязательном порядке должен быть ознакомлен акушер-гинеколог, наблюдающий беременность, который прокомментирует женщине результаты диагностики, объяснит все имеющиеся риски.
Качество ультразвуковой визуализации зависит от уровня квалификации и опыта специалиста, типа используемого оборудования, срока гестации, положения плода, мало- или многоводия, толщины подкожно-жирового слоя на передней брюшной стенке беременной.
Преимущества
Эхокардиография плода позволяет производить детальное изучение анатомии и функционирования сердца плода с помощью высокочастотных ультразвуковых волн. Оценка сердечной деятельности плода может проводиться посредством аускультации, фонокардиографии, кардиотокографии. Эхокардиография не относится к числу обязательных УЗИ при беременности и назначается только в тех случаях, когда другие исследования дают основания заподозрить наличие у ребенка ВПС или тяжелых нарушений ритма.
При выявлении у плода сердечных дефектов, несовместимых с жизнью, беременность рекомендуется прервать. В случаях, когда врожденные пороки сердца подлежат хирургической коррекции, операция может быть выполнена вскоре после рождения. Эхокардиография плода, как методика пренатальной диагностики, незаменима для выработки стратегии ведения беременности, родов и раннего неонатального периода.
Аритмия у плода ( Фетальные аритмии )
Аритмия у плода - это любое нарушение ритма сердца, возникающее в фетальном периоде внутриутробного развития. Провоцирующими факторами выступают врожденные пороки и другие заболевания сердца, осложненное течение беременности, аутоиммунные нарушения в организме матери. Патология не вызывает клинических проявлений, поэтому выявляется только при плановом ультразвуковом исследовании у акушера-гинеколога. Дополнительно для диагностики аритмии у плода проводят магнитокардиографию и кардиотокографию. Лечение неосложненных форм не требуется, в других случаях назначают сердечные гликозиды и антиаритмические медикаменты по индивидуальным протоколам.
МКБ-10



Общие сведения
Нарушения сердечного ритма у плода (фетальные аритмии) встречаются в 1-2% всех беременностей. Около 10-15% из них представляют серьезную угрозу жизни и здоровью ребенка, требуют комплексной терапии в антенатальном периоде. Патология одинаково часто регистрируется у плодов мужского и женского пола, зачастую она сопряжена с наличием других осложнений беременности или экстрагенитальных болезней у матери. Фетальные аритмии представляют серьезную междисциплинарную проблему, которая осложнена трудностями своевременной диагностики и отсутствием четких протоколов лечения.

Причины
Аритмии у плода рассматриваются как неспецифический признак многих кардиоваскулярных болезней, поэтому определение их этиологической структуры представляет сложности для детской кардиологии. Важными предрасполагающими факторами называют незрелость проводящей системы и других структур сердца, нарушения вегетативной нервной регуляции сердечного ритма. Непосредственными причинами фетальных аритмий выступают:
- Врожденные пороки сердца. До 50% случаев патологии связано со структурными аномалиями сердца, которые проявляются в виде дефекта межпредсердной и межжелудочковой перегородок, аномалии Эбштейна, коарктации аорты. Значимую роль играет наличие дополнительных проводящих путей при синдроме Вольфа-Паркинсона-Уайта (WPW).
- Другие кардиологические заболевания. Типичным провоцирующим фактором является миокардит, связанный со внутриутробной инфекцией. Чаще всего он наблюдается при заражении возбудителями TORCH-комплекса. Реже аритмия сопряжена с фиброэластозом сердца плода, аневризмой первичной межпредсердной перегородки.
- Осложнения беременности. Предиктором нарушений ритма является расстройство фетоплацентарного кровотока, которое сопровождается внутриутробной гипоксией плода. К факторам риска также относят предлежание плаценты, аномалии строения пуповины.
- Аутоиммунные реакции. Важное значение в развитии аритмий имеет повреждающее влияние материнских антител на проводящие волокна сердца у плода. Вероятность патологии повышается при наличии у матери аутоиммунных заболеваний: системной красной волчанки, антифосфолипидного синдрома, различных форм васкулитов.
Патогенез
Развитию болезни способствуют особенности фетального кровообращения и работы сердца во внутриутробном периоде. Синусовый узел формируется уже в 1-м триместре беременности, тогда как атриовентрикулярный узел, отвечающий за сокращение желудочков, образуется позже из эмбриональных клеток и затем соединяется с проводящими волокнами. Поэтому пороки, которые затрагивают область АВ-борозды, сопряжены с повышенным риском фетальных желудочковых аритмий.
Еще одним важным моментом патогенеза называют особенности регуляции частоты сердечных сокращений (ЧСС) в фетальном периоде. К 9-й неделе беременности ЧСС составляет 175 ударов в минуту, к концу беременности снижается до 140-150 уд/мин. Такие параметры поддерживаются за счет спонтанной активности синусового узла, вегетативной регуляции. При нарушении равновесия между симпатическим и парасимпатическим отделами возрастает риск фетальной аритмии.

Классификация
При систематизации фетальных аритмий используются те же принципы, что и в классической аритмологии. Самым распространенным вариантом является экстрасистолия, которая представляет собой единичные внеочередные сокращения сердца, составляет более 90% от всех случаев заболевания и не несет угрозы жизни плода. К жизнеугрожающим формам относят наджелудочковую тахикардию, которая занимает около 5% случаев, атриовентрикулярную блокаду 2-3 степени (2,5%) и др.
Симптомы аритмии у плода
Сложность диагностики патологии заключается в том, что фетальные нарушения ритма развиваются бессимптомно. При отсутствии других акушерско-гинекологических осложнений беременность у женщины протекает абсолютно нормально, развитие ребенка соответствует гестационному возрасту. Ухудшение самочувствия матери, уменьшение частоты и интенсивности шевелений плода, задержка внутриутробного развития — симптомы осложненных вариантов фетальной аритмии.
Осложнения
Стойкая фетальная тахикардия сопряжена с риском развития водянки, которая наблюдается более чем в 40% случаев. Интенсивный отек связан с венозным застоем и возрастанием давления крови в венах, что приводит к оттоку значительного объема жидкостей в лимфатическую систему. Водянка возникает на фоне высокой гидрофильности тканей, характерной для плода, и усугубляется изменением содержания электролитов и белков в плазме крови.
Показатель антенатальной и интранатальной смертности при аритмиях у плода достигает 8%. При наличии водянки риск летального исхода возрастает до 20-30%. Подавляющее большинство смертей происходит внутриутробно, завершаясь мертворождением либо плодоразрушающими операциями. Также возможна гибель ребенка в процессе родов, обусловленная критической гипоксией, нарушениями работы сердца, тяжелыми электролитными сдвигами.
Диагностика
Поскольку аритмии у плода не имеют клинических проявлений, их зачастую обнаруживают при плановом осмотре беременной женщины. Наивысшая частота выявляемости патологии наблюдается в 3-м триместре, что связано с увеличением размеров плода, возможностью более точно исследовать структуры сердечно-сосудистой системы, частыми посещениями женщиной кабинета гинеколога. Диагностика фетальной аритмии включает следующие исследования:
- УЗИ беременности. При стандартном сканировании в М-режиме удается одновременно зарегистрировать частоту и ритм сокращений предсердий и желудочков, оценить атриовентрикулярное проведение импульса. Методика дополняется импульсно-волновой допплерографией камер сердца, легочных сосудов, сосудов пуповины.
- Кардиотокография. Данные КТГ используются для анализа частоты и ритмичности сердечных сокращений у плода. Исследование фиксирует желудочковые комплексы, поэтому информативно для выявления вентрикулярной тахикардии. Кардиотокография также используется для оценки общего состояния плода, решения вопроса о возможности пролонгирования беременности либо необходимости экстренного родоразрешения.
- Магнитокардиография. Исследование используются реже, однако показывает максимальную эффективность при дифференцировке суправентрикулярных и желудочковых форм тахикардии. С его помощью удается определить источник эктопического ритма и оценить электрическую активность предсердий, что особенно важно при злокачественных формах фетальной аритмии.
Дифференциальная диагностика
Аритмии у плода, как неспецифические синдром, не требуют дифференциальной диагностики и устанавливаются по данным инструментального обследования. Важное значение приобретает дифференциация между разными причинами нарушения ритма, что необходимо для определения прогноза и решения вопроса о пролонгировании беременности. При комплексном обследовании следует исключить хромосомные и другие врожденные заболевания, которые сопряжены с кардиологической патологией и представляют угрозу для жизни плода.

Фетальная аритмия. Показаны два преждевременных сокращения предсердий (стрелки), за которыми следуют два преждевременных сокращения желудочков (звездочки).
Лечение аритмии у плода
Консервативная терапия
Врачебная тактика зависит от вида нарушения ритма, показателей внутриутробного развития ребенка. При неосложненных формах аритмии у плода, в частности при единичных экстрасистолиях, лечение не требуется. Беременным назначают более частые визиты к гинекологу, которые сопровождаются выполнением УЗИ и КТГ, начиная с 32-й недели гестации. В большинстве случаев ограничиваются динамическим наблюдением, родоразрешение происходит без особенностей.
Злокачественные формы аритмии и нарушения ритма, сопровождающиеся задержкой развития плода, требует медикаментозной терапии. Препаратами выбора считаются сердечные гликозиды, которые водятся матери и затем достигают фетоплацентарного кровотока. Дозировка и длительность их применения подбирается индивидуально с учетом клинической ситуации. Также используют другие варианты антиаритмических препаратов, учитывая их безопасность для ребенка.
Родоразрешение
В большинстве случаев удается пролонгировать беременность и провести родоразрешение на сроке более 37 недель. При отсутствии противопоказаний у матери и хорошем состоянии ребенка роды проводят через естественные родовые пути. Показания к кесареву сечению определяются индивидуально по данным осмотра, инструментальной и лабораторной диагностики. Ведение ребенка в неонатальном периоде может потребовать реанимационных мероприятий, коррекции электролитного баланса и гипоксии.
Прогноз и профилактика
Более 85% аритмий у плода не представляют никакой угрозы здоровью, поэтому ребенок рождается в срок и без серьезных патологий кардиоваскулярной системы. Оставшиеся 15% случаев имеют менее благоприятный прогноз, который определяется тяжестью аритмии, своевременностью ее диагностики и ответом на проводимое лечение. Заболевание отличается сложным механизмом развития и не до конца установленными причинами, поэтому эффективные меры профилактики не разработаны.
3. Фетальные аритмии: антенатальная ультразвуковая дифференциальная диагностика, прогнозирование постнатальных результатов и перинатальная практика/ И.Н. Сафонова// SonoAce Ultrasound. - 2014. - №6.
4. Фетальные аритмии: результаты диагностики и лечения/ Е.Л. Бокерия, Е.Д. Беспалова// Анналы аритмологии. - 2008. - №2.
Читайте также:
- Эффективность раннего обнаружения рака прямой кишки.
- Рентгенограмма, КТ при обструктивной непроходимости тонкого кишечника
- Рекомендации по анализу рентгенограммы тазобедренного сустава в ПЗ проекции в позе лягушки (модифицированный метод Кливза)
- Гипопитуитаризм. Изменения органа зрения при гипопитуитаризме
- Травмы бадминтона. Травмы водного пола
