УЗИ, ЭхоКГ при рабдомиоме сердца плода
Добавил пользователь Валентин П. Обновлено: 01.02.2026
Позгалёва Н.В., Борисова А.А., Быкова Е.В., Гаврилова Е.С.
Научный руководитель: к.м.н., доцент Панина О.С.
ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского Минздрава РФ Кафедра госпитальной педиатрии и неонатологии
Резюме
В течение многих веков первичные новообразования сердца считались редкой патологией. Благодаря развитию новых технологий в диагностике, мы, к сожалению, не можем с этим согласиться.
У плода пренатально выявлены множественные рабдомиомы, которые не влияли на ритм сердца. Постнатально вышеперечисленные образования не препятствовали кровотоку. Однако, сразу после рождения отмечалась выраженная тахикардия, неподдающаяся подсчету. Симптомы были купированы «Кордароном», в назначенной кардиологом дозе. После кратковременного лечения малыша смогли перевести в отделение физиологии новорожденных.
Ключевые слова
Статья
Актуальность. Опухоли сердца у детей до последнего времени представляли собой малоизученную область детской кардиологии, что объясняется редкостью данной патологии, особенно в детском возрасте, ее чрезвычайно полиморфной клинической картиной и сложностью прижизненной диагностики.
В течение длительного времени опухоли сердца выявлялись преимущественно на аутопсиях или как случайная находка при кардиохирургических вмешательствах. Считалось, что редкость развития сердечных неоплазм объясняется особенностями метаболизма миокарда, кровотоком внутри сердца и ограниченностью числа лимфатических сосудов сердца. Кроме того, в ответ на повреждение в сердце происходят дегенеративные изменения, а не регенерация.
Но, по мере накопления клинического опыта, а также внедрения новых неинвазивных методов исследования (трансэзофагеальная и пренатальная эхокардиография, компьютерная томография и магнитно-резонансная томография) и определение возрастных, генетических и эпидемиологических факторов риска развития данной патологии дали возможность чаще выявлять опухоли сердца у новорожденных и детей первого года жизни. Прижизненная диагностика новообразований сердца в этой возрастной группе стала более доступной, а также частым явлением в клинической практике неонатологов, кардиологов, педиатров и онкологов.
Частота встречаемости первичных доброкачественных новообразований сердца у новорожденных и детей первого года жизни, по данным 11 000 аутопсий, составляет 0,27%. По некоторым данным, в последние 15 лет частота регистрации опухолей сердца увеличилась в 15 раз.
Диагностика данной патологии у новорожденных и детей первого года жизни сложна, так как сопровождается полиморфной, а подчас асимптомной клинической картиной. Еще сложнее выявить эту аномалию пренатально, так как опухолевидные включения либо не привлекают внимания, либо воспринимаются как вторичная гипертрофия миокарда функционального порядка. В то же время не следует забывать, что в 50% случаев множественные врожденные новообразования сердца являются одним из признаков такого тяжелого генетического синдрома, как туберозный склероз. Современная неинвазивная диагностика, в частности метод комплексной эхокардиографии, позволяет выявить эту врожденную патологию не только после рождения ребенка, но и в период его внутриутробного развития.
А.С. Шарыкин отмечал, что частота встречаемости различных опухолей у детей составляет: рабдомиомы - 63,0 %; фибромы - 18,9 %; миксомы - 3,9 %; гемангиомы - около 3,9 %; тератомы, опухоли клеток Пуркенье, липома составили - 3,3 %, 2,2 % и 1,1 %, соответственно; злокачественные опухоли - около 7,0 %.
Около 75 % всех первичных опухолей по своему гистологическому строению являются доброкачественными, остальные 25 % — злокачественными. В детском возрасте на долю доброкачественных опухолей приходится около 90 % первичных новообразований. Среди первичных доброкачественных опухолей наиболее часто выявляются миксомы, которые доминируют у взрослых пациентов. У детей превалируют другие доброкачественные опухоли сердца, которые могут содержать клетки мышечной ткани (рабдомиомы), соединительной ткани (фибромы), ткани зародышевого происхождения (тератомы). Фибромы и рабдомиомы, как правило, растут в толще сердечной мышцы.
Рабдомиома образуется из эмбриональных мышечных клеток (специализированных, типа клеток Пуркинье, или клеток сократительного миокарда), обнаруживается в полостях, как правого, так и левого желудочка сердца и межжелудочковой перегородке. У 1/3 детей рабдомиома поражает миокард, на клапанах сердца практически не встречается. В 50 % случаев рабдомиома имеет внутриполостной рост, приводя к обструкции камер желудочков. Почти в 1/3 и более случаев рабдомиома сочетается с врожденным дефектом развития коры головного мозга — туберозным склерозом, который клинически выражается умственной отсталостью, эписиндромом, внутричерепными обызвествлениями. Возможно также сочетание с поликистозом почек. Рабдомиомы, располагающиеся в миокарде желудочков, нередко сопровождаются прогрессирующим ухудшением сердечной деятельности, возникновением аритмий различной формы и сложности. Клиническая картина рабдомиом сердца является неоднородной и зависит от характера их роста, размера, локализации, степени внутрисердечной обструкции или деформации проводящей системы. Выступая в просвет камер сердца, рабдомиомы нарушают сердечную гемодинамику, их течение сходно с клинической картиной порока венозных или артериальных клапанных отверстий. Уже с 16-20-й недели внутриутробного развития они могут быть обнаружены с помощью Эхо-КГ. В настоящее время удельный вес пренатальных диагнозов составляет 21-27 %. В постнатальном периоде большинство опухолей (72-77 %) диагностируют в возрасте до 1 года, что свидетельствует в пользу их врожденного характера. Установлено, что опухоль быстро увеличивается во второй половине беременности и достигает своих максимальных размеров к моменту рождения. Примерно в 75 % наблюдений пренатально диагностированная рабдомиома представлена множественными узлами.
Рабдомиомы сердца обычно не имеют тенденции к озлокачествлению, хотя описаны единичные случаи малигнизации рабдомиом в рабдомиосаркому.
Клинический случай:
Нам хотелось бы представить клинический случай рождения ребенка с пренатально выявленной рабдомиомой.
Беременная Ш. 28 лет, поступила в ГУЗ «Перинатальный центр» г. Саратова при сроке гестации 39 недель. Из анамнеза женщины известно что, данная беременность 2-ая, протекала на фоне осложненного акушерско-гинекологического анамнеза, хронической внутриутробной гипоксии плода, носительства TORCH - инфекции, врожденного порока развития плода (множественные рабдомиомы сердца). Роды 1-ые, срочные, быстрые, в головном предлежании: 1-ый период родов составил 4 часа, 2 период - 40 минут, безводный промежуток - 5 часов 10 минут, околоплодные воды светлые. Оценка по шкале Апгар 7-7 баллов. Антропометрические данные ребенка при рождении: рост 51 см, вес 3510 гр., окружность головы 36 см, окружность груди 34 см. Во время проведения первичной реанимации новорожденному в родильном зале, был зафиксирован приступ пароксизмальной тахикардии (частота сердечных сокращений подсчету не поддавалась). После проведения первичных реанимационных мероприятий ребенок был доставлен в отделение реанимации и интенсивной терапии новорожденных.
В отделении реанимации новорожденных состояние ребенка было расценено как тяжелое за счёт приступа пароксизмальной тахикардии и неврологической
симптоматики. Новорожденный на осмотр реагировал умеренно выраженной двигательной активностью, криком средней силы. С рождения у ребенка отмечалась мышечная гипотония, гипорефлексия, поза полуфлексорная. Голова имела долихоцефалическую форму, была умеренно конфигурирована, имела место умеренная родовая опухоль в лобнозатылочной области, больше слева; большой родничок 1,0х1,0 см на уровне костей черепа. Кости черепа умеренной плотности. Глаза открывал на осмотр, реакция зрачков на свет была симметрична. Кожные покровы при первичном осмотре были розовые с цианотичным оттенком, отмечался выраженный акроцианоз, периоральный цианоз. Видимые слизистые были розово-цианотичны. Объективно: Область сердца у новорожденного визуально не была изменена, левая половина грудной клетки не выбухала, не отмечалось систолического дрожания. Границы относительной сердечной тупости не были расширены: правая - по правому краю грудины, левая на 1,0 см кнаружи от левой срединно-ключичной линии, верхняя - II ребро. При аускультации обращали на себя внимание глухие сердечные тоны, выраженная тахикардия, не поддающаяся подсчёту (по данным монитора до 300 ударов в минуту). Пульс на периферических артериях отмечался средних качеств, симптом белого пятна - 3-4 сек. Мониторирование артериального давления выявило склонность к артериальной гипертензии (на левой руке 89/45 мм рт. ст, левой ноге 76/41 мм рт. ст., правой руке 94/45 мм рт. ст., правой ноге 69/45 мм рт. ст).
По остальным органам и системам патологии выявлено не было. В первом контроле кислотно-основного состояния капиллярной крови был отмечен субкомпенсированный респираторно - метаболический ацидоз, умеренная гипоксемия. Ребенку была налажена подача увлажненного кислорода через маску.
В ходе клинического обследования были выявлены следующие изменения: Д-ЭХО-КГ (осмотр на фоне приступа пароксизмальной тахикардии). В полости правого желудочка лоцируются 3-и эхоплотных образования округлой и овальной формы, размером 0,56 х 0,24 см; 0,37 х 0,35 см,1,01 х 0,37 см, два образования крепятся к передней стенке правого желудочка, одно к модераторному тракту. В полости левого желудочка одно эхоплотное образование овальной формы 0,57 х 0,33 см, прикреплённое возможно к межжелудочковой перегородке. Все вышеперечисленные образования не препятствуют кровотоку и не вызывают обструкцию выходных отделов желудочков. Умеренная гипертрофия и дилатация правого желудочка. Умеренная дилатация правого предсердия. Митральная регургитация 1-й степени. Трикуспидальная регургитация 1-й степени. Минимальная лёгочная гипертензия. Глобальная сократимость левого желудочка не нарушена. Открытое овальное окно 0,4 см, функционирующее. В левом желудочке аномально расположенная хорда.
За время пребывания в Перинатальном центре ребенок неоднократно осматривался кардиологом, а также кардиохирургом по поводу основного диагноза: ВПР. Множественные рабдомиомы сердца. Пароксизмальная суправентрикулярная тахикардия, приступный период.
Стартовая терапия приступа пароксизмальной тахикардии включала в себя внутривенное введение «Кордарона» из расчёта 3 мг/кг веса в течение 2 часов. Учитывая гемодинамически значимое нарушение сердечного ритма, была продолжена антиаритмическая терапия «Кордароном», в дозе насыщения 8,5 мг/кг/с, 2-х кратно, в течение 7 дней, с последующим переводом на поддерживающую дозу 4 мг/кг/с, однократно. Препарат принимался под контролем ЭКГ (на фоне насыщения по данным ЭКГ отслеживалось удлинение интервала QT, допустимым считался прирост не более 25% от исходного). По-поводу основного заболевания ребенок получал также «Панангин», «Элькар» 30% «Пантогам» в возрастных дозировках. Приступ пароксизмальной тахикардии купировался к 3 суткам жизни, терапия «Кардороном» была продолжена, но препарат ребенок получал реr os. Состояния на этот момент расценивалось как средне тяжелое. В неврологическом статусе ребенок стал значительно активнее, на осмотр реагировал двигательным возбуждением, крик был громкий, эмоциональный. В дополнительной оксигенации не нуждался. При аускультации тоны сердца были ритмичны, но приглушены. Пульс на периферических артериях отмечался удовлетворительных качеств. Симптом белого пятна был отрицательным. Частота сердечных сокращений, в покое составляла 129-133 в минуту, при беспокойстве до 148 в минуту. Артериальное давление, как на руках, так и на ногах - нормальные показатели. Ребенок хорошо усваивал энтеральное питание. С учетом стабилизации состояния, на 6 сутки жизни ребенок был переведен на совместное пребывание к матери, приложен к груди. Новорожденный был выписан домой по месту жительства после курса насыщения кордароном, под наблюдение кардиолога.
Рабдомиома сердца у детей
Рабдомиома сердца у детей - это доброкачественное новообразование, которое формируется из эмбриональной мышечной ткани. Причины патологии точно не выяснены, среди провоцирующих факторов на первом месте находится туберозный склероз. Заболевание имеет вариабельную клиническую картину: протекает с признаками аритмии, застойной сердечной недостаточности, обструктивных пороков сердца. Диагностика рабдомиомы требует проведения ЭКГ и ЭхоКГ, МРТ сердца, гистологического анализа опухолевых биоптатов. Лечение показано для симптоматических и осложненных форм заболевания, в основном проводится хирургическим способом.
МКБ-10


Общие сведения
Рабдомиома — самая распространенная доброкачественная опухоль сердца у детей раннего возраста и вторая по частоте среди школьников. В структуре новообразований сердца у новорожденных она занимает 58,6%, у детей старше 1 месяца —39,3%. Общая частота сердечных опухолей составляет 0,003% среди всех госпитализированных пациентов, поэтому абсолютное количество случаев рабдомиомы невысоко. Однако заболевание имеет полиморфную клиническую картину и способно вызывать тяжелые кардиоваскулярные нарушения, поэтому оно не теряет актуальности в педиатрии и детской кардиологии.

Причины
На сегодня рабдомиома сердца у детей рассматривается как врожденная патология, этиологическая структура которой пока не установлена. Среди возможных предрасполагающих факторов называют тератогенное воздействие в первом триместре беременности, экстрагенитальные заболевания у матери, осложнение текущей беременности. Одной из значимых причин развития рабдомиомы является туберозный склероз, который ассоциирован с данным вариантом опухоли сердца.
Патогенез
Новообразование возникает из 2-х типов эмбриональных мышечных клеток: сократительных волокон миокарда либо специализированных клеток Пуркинье. Заболевание представляет собой результат диспластических процессов в миокарде, происходящих в эмбриональном периоде развития ребенка. Предшественниками опухолевых клеток являются остаточные полипотентные клетки, которые способны к стремительному росту и дифференцировке в разные типы клеточных элементов.
В 90% случаев рабдомиома сердца у детей имеет множественный характер, поражает полости желудочков и межжелудочковую перегородку. Около трети случаев заболевания сопровождаются разрастанием опухоли в миокарде предсердий. Поражения сердечных клапанов встречается крайне редко. Чаще всего новообразование имеет внутриполостной рост и постепенно увеличивается в размерах, уменьшая полезный объем сердечных камер.
Новообразование имеет округлую форму, растет на ножке или на широком основании. Его диаметр составляет 1-10 см. По гистологическому строению опухоль имеет ячеистый характер. Ячейки выполнены из крупных паукообразных клеток, в которых присутствует центрально расположенное ядро и большие вакуоли с полисахаридным содержимым. При исследовании клеток под большим увеличением определяются миофибриллы и поперечная исчерченность.
Симптомы рабдомиомы сердца у детей
Клинические проявления зависят от особенностей расположения и размеров новообразования. При единичных или мелких множественных рабдомиомах значимые расстройства гемодинамики не возникают. Наблюдаются нарушения ритма и проводимости по типу наджелудочковой тахикардии, синдрома слабости синусового узла, синдрома Вольфа-Паркинсона-Уайта. Они проявляются приступами головокружения, учащенного сердцебиения, ощущения замирания или перебоев в работе сердца.
При расположении рабдомиомы в межжелудочковой перегородке возможна полная атриовентрикулярная блокада с приступами Морганьи-Адамса-Стокса. Это тяжелое состояние проявляется у детей в виде синкопальных эпизодов, судорожных пароксизмов, фибрилляции желудочков. Сердечный ритм может восстанавливаться самопроизвольно в течение 5 минут, если это не происходит и медицинская помощь отсутствует, наступает клиническая смерть.
Внутриполостные рабдомиомы сердца у детей, отличающиеся быстрым экзофитным ростом, вызывают обструктивные нарушения кровотока. Пациенты предъявляют жалобы на выраженную одышку, особенно при физической нагрузке, боли в сердце различной интенсивности, приступы головокружения и обмороки. При длительном существовании патологии у детей замедляется рост и физическое развитие. Гипоперфузия головного мозга вызывает задержку психического развития.
Опухоль на ножке, расположенная в левом желудочке, по клинической картине имитирует синдром гипоплазии левых отделов сердца либо субаортальный стеноз. При рабдомиоме правых отделов сердца симптомы схожи с правожелудочковой сердечной недостаточностью. При обструкции трикуспидального клапана возникает выраженный цианоз кожи вследствие право-левого предсердного шунтирования крови.
Осложнения
Рабдомиома сердца, которая сопровождается нарушениями гемодинамики либо тяжелыми аритмиями, со временем приводит к развитию декомпенсированной сердечной недостаточности. Фибрилляция желудочков, атриовентрикулярная блокада и другие формы аритмии без экстренного лечения становятся причиной нарушений сознания и внезапной сердечной смерти. У детей рабдомиома зачастую сочетается с другими врожденными пороками сердца.
Более трети пациентов с множественными опухолями страдают от туберозного склероза. Поражение нервной системы при этом заболевании проявляется судорогами, задержкой интеллектуального развития вплоть до олигофрении, расстройствами поведения: агрессивностью, СДВГ, аутизмом. На теле возникают кофейные пятна, участки шагреневой кожи, мягкие дерматофибромы. Характерна гамартома зрительного нерва, множественные поражения внутренних органов.
Диагностика
Первичное обследование проводится у неонатолога или педиатра, после чего показана консультация детского кардиолога. Сначала необходимо уточнить анамнез беременности и родов, оценку новорожденного по шкале Апгар, показатели физического и психического развития в раннем возрасте. При физикальном осмотре выявляют признаки кардиальной патологии, в том числе врожденных пороков. Для постановки диагноза рабдомиомы необходимы следующие виды диагностики:
- Эхокардиография. УЗИ сердца — основной метод визуализации, с помощью которого определяют размеры и форму образования, выясняют его взаимоотношения с клапанным аппаратом, контролируют динамику роста. Эхокардиография более информативна для диагностики внутриполостных рабдомиом. ЭхоКГ проводится не только в постнатальном периоде, но и антенатально с 26-й недели гестации.
- Электрокардиография. При проведении ЭКГ определяют неспецифические знаки кардиальной патологии: гипертрофию миокарда предсердий и желудочков, смещение сегмента ST относительно изолинии, отклонение электрической оси сердца. По данным электрокардиограммы диагностируют вид и степень тяжести нарушений ритма.
- МРТ сердца. Магнитно-резонансная томография — «золотой стандарт» для диагностики апикальных опухолей. Исследование дополняется применением радиоактивных меток и контрастированием, чтобы четко разграничить здоровые и опухолевые ткани. Под контролем МРТ выполняется прицельная биопсия подозрительного новообразования.
- Гистологический анализ. Исследование биоптатов путем электронной микроскопии - основной метод верификации диагноза, который позволяет отличить рабдомиому сердца от других вариантов опухолей. Диагностически значимым является определение клеток с поперечной исчерченностью, крупными ядрами, полисахаридными включениями.
Дифференциальная диагностика
При постановке диагноза необходимо исключить другие типы доброкачественных опухолей, характерных для детского возраста. Дифференциальная диагностика проводится с фибромами, миксомами, гемангиомами и интраперикардиальными тератомами. Подозрение на инвазивный рост образования требует дифференцировки со злокачественными процессами: рабдомиосаркомой, тератобластомой, фибросаркомой. При постановке диагноза у новорожденных исключают ряд врожденных кардиоваскулярных пороков.

Лечение рабдомиомы сердца у детей
Консервативная терапия
Этот тип сердечного новообразования имеет склонность к спонтанному регрессированию, поэтому при отсутствии симптоматики ограничиваются динамическим наблюдением за пациентом. Показаны регулярные консультации детского кардиохирурга с проведением контрольных ЭхоКГ. Нарушения сердечного ритма подлежат симптоматической антиаритмической терапии. Новорожденным назначают простагландин Е1 для ликвидации гемодинамических сдвигов.
Хирургическое лечение
При внутриполостном расположении опухоли и наличии клинической симптоматики необходимо оперативное вмешательство. Объем операции включает полное или частичное удаление рабдомиомы, после которого новообразование не рецидивирует, поскольку имеет доброкачественный тип роста. При интрамуральной локализации опухолевой ткани рассматривается вопрос о трансплантации сердца, хирургических способах лечения тяжелых вариантов аритмии.
Экспериментальная терапия
В медицинской литературе описаны случаи успешного применения препарата на основе эверолимуса - иммунодепрессанта и ингибитора пролиферации. Медикамент угнетает дифференцировку, рост и миграцию клеток, благодаря чему успешно применяется при различных опухолевых процессах. Он используется у детей с сочетанной рабдомиомой и туберозным склерозом, чтобы запустить регресс объемного образования.
Прогноз и профилактика
Исход зависит локализации, размеров, клинических проявлений и возможностей лечения новообразования. Некрупные бессимптомные или подлежащие хирургическому удалению опухоли имеют благоприятный прогноз, в остальных случаях возможны жизнеугрожающие осложнения. Эффективные меры профилактики не разработаны. Если семейный анамнез будущих родителей отягощен по туберозному склерозу, обязательны прицельные ЭхоКГ плода для исключения сердечных рабдомиом.
1. Естественное течение рабдомиомы сердца у детей/ А.А. Свободов, В.П. Докторова, А.А. Купряшов, М.Р. Туманян// Педиатрия, Журнал им. Г.Н. Сперанского. - 2017. - №3.
2. Опыт лечения рабдомиом сердца в сочетании с нарушениями ритма у детей/ Л.А. Бокерия, О.Л. Бокерия, П.П. Рубцов, А.А. Ахобеков и др.// Анналы аритмологии. - 2014. - №4.
3. Рабдомиома сердца у детей/ Е.В. Бордюгова, А.В. Дубовая, А.А. Бурка, И.Ю. Мокрик и др.// Здоровье ребенка. - 2012. - №2.
Эхокардиография плода
Показания
ЭХоКГ назначается при высоком риске развития сердечной патологии у плода. На такой риск может указывать наличие ВПС у родителей или ближайших родственников, случаи рождения в семье детей с врожденной патологией сердца, выявление хромосомных аномалий у плода (например, синдрома Дауна, синдрома Патау). Факторами, которые могут повышать вероятность формирования дефектов сердца у плода, служат внутриутробные инфекции (краснуха, токсоплазмоз, цитомегалия и др.); прием в процессе беременности антибиотиков, противоэпилептических средств; наличие у матери эндокринных и системных заболеваний (сахарного диабета, СКВ, ревматоидного артрита); употребление наркотиков и алкоголя; возраст беременной старше 38 лет.
Дополнительная фетальная эхокардиография показана в тех случаях, когда при скрининговом УЗИ была выявлена задержка внутриутробного развития плода, мало- или многоводие, водянка плода, нарушения сердечного ритма (тахикардия, брадикардия, аритмии), кардиомегалия или аномалии строения сердца, множественные пороки развития внутренних органов.
С помощью эхокардиографии в пренатальном периоде могут быть идентифицированы такие ВПС, как
- гипоплазия левых отделов сердца
- атрезия легочной артерии
- дефекты МЖ и МП перегородок
- транспозиция магистральных сосудов
- аномальный дренаж легочных вен и мн. др.
Их дородовая диагностика позволяет специалистам (акушеру-гинекологу, неонатологу, кардиохирургу) грамотно спланировать тактику ведения беременности, выбрать лучший способ родоразрешения, провести необходимую предоперационную подготовку новорожденного и кардиохирургическую операцию в оптимальные сроки. Достоверность ЭхоКГ в обнаружении врожденных аномалий строения и функционирования сердца составляет 90%. Тем не менее, сразу после рождения с целью подтверждения диагноза в обязательном порядке проводится УЗИ сердца ребенку.
Виды исследования
При выполнении ЭхоКГ используются различные режимы сканирования, позволяющие детально визуализировать сердце плода:
- двухмерная эхокардиография - используется для оценки анатомии основных структур сердца (камер, клапанов, главных артерий и вен). Изображение выводится в виде двухмерного среза.
- М-эхокардиография - позволяет наблюдать интракардиальные структуры (стенки камер сердца, створки клапанов) в режиме движения, оценивать систолическую функцию желудочков.
- Допплерэхокардиография - используется для изучения гемодинамики в сосудах и камерах сердца, а также оценки сердечного ритма. Проводится в режиме ЦДК и импульсной допплерографии.
Методика проведения
Стандартное эхографическое исследование включает оценку четырехкамерного среза сердца (положения сердца в грудной полости, строения желудочков и предсердий, сформированности межжелудочковой и межпредсердной перегородок, движений створок митрального и трикуспидального клапанов), главных артерий (взаиморасположение и диаметр аорты и легочного ствола), характеристик сердечной деятельности (ЧСС, ритмичности предсердно-желудочковых сокращений). С протоколом эхокардиографии плода в обязательном порядке должен быть ознакомлен акушер-гинеколог, наблюдающий беременность, который прокомментирует женщине результаты диагностики, объяснит все имеющиеся риски.
Качество ультразвуковой визуализации зависит от уровня квалификации и опыта специалиста, типа используемого оборудования, срока гестации, положения плода, мало- или многоводия, толщины подкожно-жирового слоя на передней брюшной стенке беременной.
Преимущества
Эхокардиография плода позволяет производить детальное изучение анатомии и функционирования сердца плода с помощью высокочастотных ультразвуковых волн. Оценка сердечной деятельности плода может проводиться посредством аускультации, фонокардиографии, кардиотокографии. Эхокардиография не относится к числу обязательных УЗИ при беременности и назначается только в тех случаях, когда другие исследования дают основания заподозрить наличие у ребенка ВПС или тяжелых нарушений ритма.
При выявлении у плода сердечных дефектов, несовместимых с жизнью, беременность рекомендуется прервать. В случаях, когда врожденные пороки сердца подлежат хирургической коррекции, операция может быть выполнена вскоре после рождения. Эхокардиография плода, как методика пренатальной диагностики, незаменима для выработки стратегии ведения беременности, родов и раннего неонатального периода.
Рабдомиома сердца
Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Первичные опухоли сердца в большой референсной детской клинике встречаются с частотой 0,001-0,003% от всех госпитализированных и не более чем в 0,01% всех случаев аутопсий с равным распределением по полу [1, 2], из них 40-60% у детей раннего и младшего возраста приходится на рабдомиому [3]. Рабдомиома сердца - самая частая опухоль сердца у детей дошкольного возраста, является гамартомой из кардиомиоцитов, не метастазирует. В более старшем возрасте на первое место выдвигаются фибромы, миксомы, тератомы, рабдомиосаркомы и др. [4].
Рабдомиомы сердца часто являются проявлением туберозного склероза, одной из форм факоматозов, наследуются аутосомно-доминантно, могут появляться спорадически. Рабдомиомы сердца выявляются более чем у половины пациентов с туберозным склерозом. У 51-86% детей с рабдомиомой сердца имеются признаки туберозного склероза либо в семейном анамнезе, либо его клинико-радиологические признаки [5].
Известны 2 гена, определяющие туберозный склероз: TSC1 на хромосоме 9q34 (определяет синтез гамартина) и TSC2 на хромосоме 16p13 (определяет синтез туберина). Гамартин и туберин ответственны за рост и развитие кардиомиоцитов, подавляя неконтролируемый рост и предупреждая развитие опухолей. Нарушение их синтеза ведет к развитию туберозного склероза и рабдомиомы сердца. Фенотип заболевания не зависит от того, какой из генов, TSC1 или TSC2, подвергся экспрессии. TSC1 или TSC2 обнаруживаются только у 80% больных туберозным склерозом. Причина каждого пятого случая остается неизвестной. Истинная частота туберозного склероза, факоматозов вообще и рабдомиомы сердца не определена. Гены туберозного склероза обнаруживаются с частотой 1:6000-1:9000 населения, а манифестные случаи заболевания регистрируются редко: с частотой 1:150 000 населения [6].
Клиническая картина рабдомиомы сердца очень неспецифична и определяется временем манифестации новообразования (плод, новорожденный, ребенок, подросток, взрослый), скоростью роста новообразования, числом опухолей сердца, их расположением. Рабдомиома сердца, вытесняя функционирующий миокард или располагаясь в области выносящих и входящих потоков, способна привести к перегрузке предсердий, полых вен, отекам, сердечной недостаточности. Возможны нарушения ритма, особенно при расположении опухоли в кавоатриальных и атровентрикулярных областях. Опухолевые клетки могут выступать как дополнительный путь проведения импульса. Сдавление опухолью коронарных сосудов приводит к инфарктоподобной картине на ЭКГ. Рабдомиомы сердца, формирующиеся уже у плода, могут привести к его гибели, при небольших размерах опухоли они выявляются при плановых скрининговых обследованиях в акушерских центрах [7]. Но рабдомиомы сердца могут формироваться на протяжении жизни.
Широкое внедрение в практику ультразвуковой диагностики позволило перейти от аутопсийной статистики к прижизненному выявлению. Эхокардиография - первый метод выявления рабдомиомы сердца и контроля состояния пациента в динамике. Учитывая очень большое число семейных случаев, необходимо обследование всех ближайших родственников, особенно при наличии у них пятен цвета кофе с молоком, депигментированных по типу шагреневой кожи, параунгвальных и параореолярных фибром, ранних миом матки, инфантильных спазмов, судорожных припадков и других признаков факоматозов. При семейных обследованиях рабдомиомы сердца могут выявляться у совершенно бессимптомных носителей (рис. 1, 2).
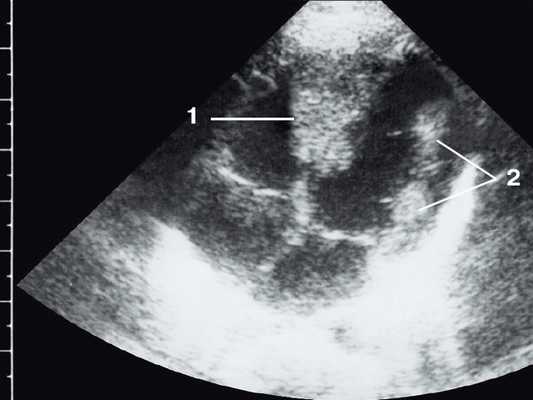
Рис. 1. Эхокардиограмма ребенка (девочки) с рабдомиомой. Крупный узел рабдомиомы в межжелудочковой перегородке (1) и менее крупные узлы в задней стенке левого желудочка (2). Эхоплотность образований выше, чем миокарда.
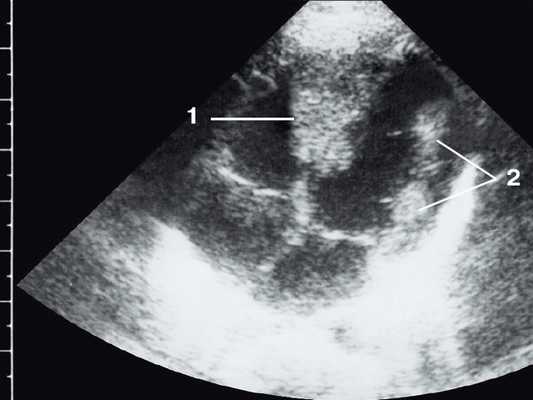
Рис. 2. Эхокардиограмма матери этого же ребенка. В межжелудочковой перегородке несколько эхоплотных образований (стрелки).
Рабдомиома сердца эхографически выглядят как достаточно четко очерченные образования. Чаще всего располагаются в миокарде левого желудочка, реже - в правом, еще реже - в предсердиях, кавоатриальных и атриовентрикулярных соединениях, эпикарде. Метастазирование не типично [8]. Наличие двух и более рабдомиом четко коррелирует с туберозным склерозом, одиночные рабдомиомы сердца такой связи, как правило, не имеют. По нашему опыту (18 пациентов), чем меньше объем новообразования, тем выше акустическая плотность, приближающаяся к эталонной эхоплотности (эндо-, эпи- и перикард). Эхоплотность больших рабдомиом практически не отличается от эхоплотности миокарда. В толще новообразования выявляются мелкие эхонегативные очажки (области некрозов) и эхопозитивные очажки (отложения кальция) (рис. 3).
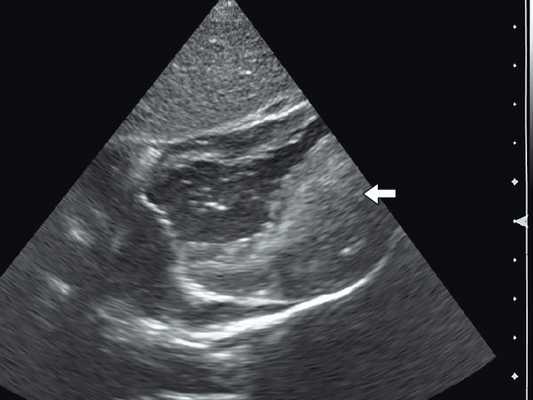
Рис. 3. Эхокардиограмма гигантской рабдомиомы (стрелка) у девочки марфаноидного статуса без признаков туберозного склероза (субксифоидальный доступ).
Рост рабдомиомы сердца медленный. Описаны случаи обратного развития одиночных рабдомиом сердца [9]. Рабдомиомы сердца, сопровождающиеся нарушениями ритма, гемодинамики, подвергаются оперативному лечению. При невозможности резекции опухоли, ее прогрессировании, угрозе фатальных нарушений ритма и некурабельной сердечной недостаточности не исключена трансплантация сердца [3, 9]. Приводятся сведения об эффективности такого мощного противоопухолевого препарата, как эверолимус, подавляющего пролиферацию, дифференциацию, рост и миграцию клеток [10].
Заключение
Рабдомиома сердца - относительно нередкое новообразование у детей и подростков, во многих случаях семейное, что требует обязательного обследования родственников. Первый метод диагностики - эхокардиография. Этот же метод незаменим для динамического контроля. Прогноз при множественных рабдомиом сердца, при расположении опухолевого узла в области привносящих или выносящих трактов, нарушающих функцию клапанов, с упорными и тяжелыми нарушениями ритма - плохой. Прогноз во многом определяется и неврологическими поражениями при туберозном склерозе. Хирургическое лечение сводится к иссечению участка опухоли, выступающего в полость камеры сердца. Удалить опухоль радикально невозможно. При больших рабдомиомах сердца не исключена трансплантация донорского органа. Химиотерапия применяется ограниченно.
Литература
УЗИ сканер HS60
Опухоли сердца у детей
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Введение
По данным секционных исследований, опухоли сердца выявляются в 0,0017 - 0,28% всех аутопсий. Метастатические (вторичные) опухоли встречаются в 10-40 раз чаще [1].
Возможности современных методов визуализации, достижения кардиохирургии перевели проблему в разряд клинических. Самая большая группа опухолей сердца представлена доброкачественными рабдомиомами, фибромами, тератомами и миксомами. Злокачественные опухоли встречаются в 3 раза реже. Обычно это саркомы, из них чаще регистрируется ангиосаркома, поражающая преимущественно мальчиков, быстро и массивно метастазирующая по кровеносным сосудам [2].
Несмотря на значительные успехи в выявлении опухолей сердца, внедрение в повседневную практику эхокардиографии, магнитно-резонансной томографии, опыт прижизненной диагностики этой патологии в детском возрасте незначителен. Мы располагаем собственными данными успешной диагностики опухолей сердца, которые представлены в настоящей работе.
Доброкачественные опу холи встречаются в 75% всех случаев первичных опухолей сердца.
Рабдомиомы - самые частые опухоли сердца у детей. В 50-80% случаев они сочетаются с туберозным склерозом. Гистологически представлены крупными веретеновидными вакуолизированными клетками с большими запасами гликогена, сдвинутым на периферию ядром и гранулярной цитоплазмой. Макроскопически рабдомиомы нередко множественные, серо-желтого цвета, размером от мелкой горошины до гигантского относительно сердца узла, поражают стенки камер сердца и перегородки, могут распространяться как в полость желудочка (рис. 1), так и экстракардиально (рис. 2).
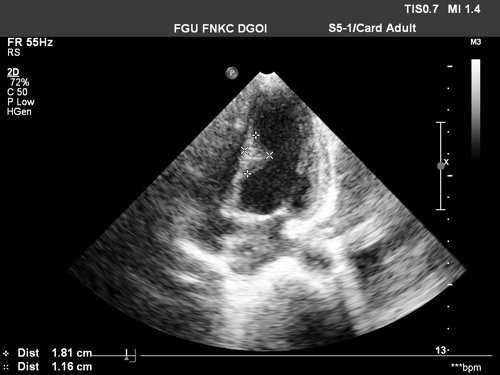
Рис. 1. Опухоль сердца (обозначена маркерами), исходящая из межжелудочковой перегородки в полость левого желудочка.
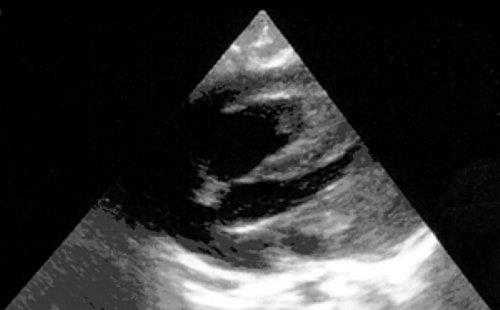
Рис. 2. Опухоль левого желудочка, распространяющаяся в основном экстракардиально и исходящая из стенки левого желудочка с переходом на межжелудочковую перегородку.
Тератомы сердца редко бывают злокачественными. Опухоль построена из всех трех эмбриональных тканей и, как правило, растет в переднее средостение, исходя обычно из перикарда. Тератомы могут формироваться в межкамерных перегородках сердца, правых предсердии и желудочке. У новорожденных объем опухоли может превышать объем сердца.
Фибромы выглядят как одиночные образования в свободной стенке левого желудочка (редко - межжелудочковой перегородки), в 40% обнаруживаются у детей 1-го года жизни.
Миксомы построены из перегруженных липидами многоядерных клеток, погруженных в миксоидную строму, богатую гликозаминогликанами. Клетки располагаются группами вокруг сосудов. В 10% случаев в опухоли обнаруживаются депозиты кальция. Миксомы свойственны подросткам (рис. 3), у детей встречаются редко. Более 80% всех миксом исходят из межпредсердной перегородки и митрального клапана. Миксома может быть как спорадической (90% случаев), так и семейной опухолью (10%), наследуемой аутосомно-доминантно (миксомный синдром) в рамках синдрома Карнея [3, 4]. При семейном варианте миксома обычно множественная и склонна к рецидивированию [5, 6].
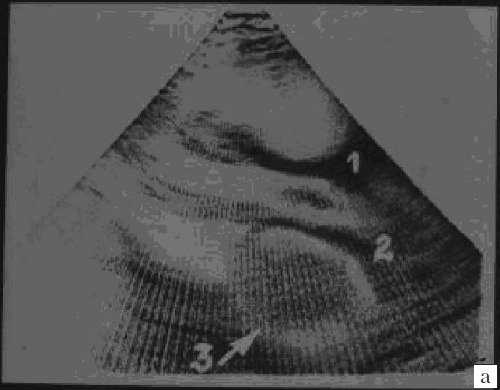
Рис. 3. Миксома левого предсердия.
а) 1 и 2 - стенка аорты, 3 - миксома.
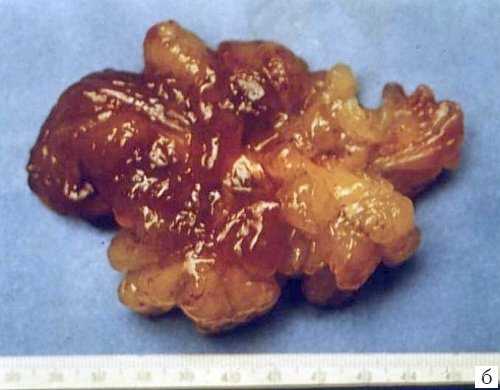
б) Макропрепарат удаленной миксомы.
В противоположность спорадическим вариантам миксомы, семейные случаи чаще регистрируются у детей и у лиц женского пола. 70-75% всех случаев синдрома Карнея обусловлены мутацией онкосупрессорного гена PRKAR1A на хромосоме 17q23-q24, действующего за счет белка 1А регуляторной субъединицы протеинкиназы А. Реже синдром Карнея обусловлен мутацией на хромосоме 2p16. Фенотипически различий двух генетических вариантов синдрома нет. У больных с синдромом Карнея и миксомой обнаруживается мутация гена протеин киназы А 9. Синдром проявляется множественным лентигенезом с преимущественным расположением пигментных пятен на лице, веках, конъюнктиве, слизистой рта. Характерна эндокринная гиперактивность. Собственно миксома, кроме сердечной недостаточности может проявляться лихорадкой, болями в суставах, одышкой, грубым диастолическим шумом и "опухолевым щелчком": ударом опухоли о створки клапана. Рыхлость миксоматозной ткани часто ведет к эмболиям.
Ангиомы (гемангиомы или, крайне редко, лимфангиомы) происходят из пролиферирующих эндотелиальных клеток [10, 11]. Инфильтрация межжелудочковой перегородки может привести к полной блокаде проводящей системы. Осложнением гемангиом является геморрагическая тампонада сердца.
Липомы, лейомиомы, мезотелиомы, фиброэластомы встречаются крайне редко.
Злокачественные опу холи составляют 25% первичных опухолей сердца. Саркомы происходят из мезенхимальных клеток, чаще возникают в правом предсердии, у детей встречаются редко. Для них типичны гистологическое разнообразие, агрессивный рост, интенсивность метастазирования. Очень редко встречаются рабдомиосаркомы, характеризующиеся инвазивным ростом и метастазированием. Подавляющее большинство всех случаев рабдомиосарком обнаруживается у детей, что объясняется их происхождением из эмбриональных клеток. Фибросаркомы построены из сплетающихся тяжей веретеновидных клеток с удлиненными ядрами и многочисленными митозами, поражают несколько камер сердца, в узлах опухоли четко определяются очаги кровоизлияний и некрозов. Ангиосаркомы, самые частые злокачественные опухоли сердца, построены из многочисленных сосудистых канальцев разного диаметра, образованных атипичными эндотелиоцитами.
В единичных случаях описаны лимфомы, гистиоцитомы, лейомиоскаркомы, липосаркомы и остеогенные саркомы 12.
Клиническая картина опухолей сердца неспецифична и определяется не столько гистологическим типом, сколько локализацией и паранеопластическими реакциями, имитирующими системные заболевания. В наших наблюдениях первоначально ошибочными диагнозами были ревматоидный артрит, геморрагический васкулит, эпилепсия, пневмония. Доброкачественные опухоли, расположенные в области выносных трактов или в области притока, изменяя естественное течение крови, могут дать более яркую симптоматику, чем злокачественные. Опухоли в правых отделах сердца быстро проявляются общей слабостью, одышкой, югуллярным пульсом, синдромом нижней полой вены, отеками, асцитом. Опухоли левых отделов сердца манифестируют непродуктивным кашлем, лихорадкой, ознобами, одышкой, головокружениями, холодными потами при нагрузке или ночью. Опухоль, расположенная в полости левых желудочка или предсердия, способна быть источником эмболов с неожиданными эпизодами ишемии мозга с судорогами или нарушением кровообращения по периферическим сосудам. Первыми общими симтомами у детей грудного и младшего возраста могут быть беспокойство, потеря аппетита, замедление развития. В любом возрасте типичны периоды бледности, тахикардии, одышки, кровохарканье, обмороки. Инвазивный рост опухоли может быть причиной нарушений ритма, проводимости и коронарного кровотока [15]. У нашей 4-месячной пациентки на ЭКГ регистрировались инфарктоподобные изменения миокарда в переднебоковой стенке и верхушке левого желудочка.
Результаты клинического обследования зависят от локализации опухоли. Общими проявлениями опухолей сердца могут быть лихорадка, сердечная недостаточность, возникновение нового шума в сердце, усиление или появление нового тембра уже существовавшего шума, нарушения ритма, перикардиальный выпот. Праворасположенные опухоли быстро манифестируют сердечной недостаточностью, отеками, югуллярным пульсом, перикардиальным выпотом, асцитом, гепатомегалией, синдромом нижней полой вены, эмболией сосудов легких. Леворасположенные опухоли могут манифестировать обмороками, нарушениями мозгового кровообращения, эмболизацией периферических сосудов. У подростков возможны непродуктивный кашель и кровохарканье. Для миксомы левого предсердия характерен диастолический хлопок (за счет удара миксомы о створки клапана) или диастолический шум при внедрении миксомы в левое атриовентрикулярное отверстие. В наших наблюдениях 45% всех случаев опухолей сердца приходились на детей первых 3 мес жизни и все опухоли сердца у детей первых 7 лет жизни были представлены рабдомиомами. Миксомы встречались у детей 10 лет и старше.
Электрокардиография выявляет неспецифические изменения: изменения сегмента ST-T (нередко регистрируются при обструктивных вариантах рабдомиом или фибром), снижение вольтажа QRS (особенно при перикардиальном выпоте), нарушения ритма (при опухолях аритмии очень плохо отвечают на терапию) и проводимости.
Лабораторные исследования информативны только при дифференциальной диагностике. При опухолях сердца возможно повышение СОЭ, параспецифические сдвиги в формуле крови. При застое в большом круге кровообращения повышается активность печеночных трансаминаз. Активность миокардиальной фракции креатинкиназы отражает прежде всего дисфункцию миокарда, но не злокачественность или доброкачественность опухоли.
Дифференциальная диагностика проводится с пороками сердца, кардитами, кардиомиопатиями, фиброэластозом миокарда, идиопатической легочной гипертензией и другими состояниями, проявления которых могут симулироваться опухолью сердца.
Рентгенография грудной клетки позволяет выявить увеличение размеров сердца, застой в малом круге кровообращения, кальцинаты.
Эхокардиография (ЭхоКГ) - первый и ведущий метод диагностики опухолей сердца. При минимальных стоимости исследования и временных затратах возможно получение полной информации о наличии объемного образования сердца, распространении его в полости сердца, экстракардиально или инвазивно внутримиокардиально, размерах образования, состоянии оболочек сердца, клапанного аппарата, степени дисфункции миокарда. Эхографически опухоль выглядит как деформация стенки сердца или, в случаях внутриполостных миксом, как объемное образование. При наличии ножки миксома может пролабировать в соседнюю камеру под действием потока крови. В таких случаях ранее при М-режиме изображения описывали в период диастолы множественные линейные эхосигналы (феномен "монетных столбиков") между створками митрального клапана. Трудности возможны при небольших опухолях, особенно внутримиокардиальных, для которых и характерны упорные нарушения ритма. Но само по себе эхографическое заключение не позволяет абсолютно достоверно говорить о типе объемного образования. Например, обнаружение округлого образования в левом предсердии с высокой достоверностью свидетельствует в пользу миксомы, но возможен и шаровидный тромб.
Магнитно-резонансная томография (МРТ) наиболее информативная визуализирующая методика диагностики опухолей сердца [16], позволяющая точнее, чем ЭхоКГ, установить размеры и распространенность опухоли, представить объемную реконструкцию и дифференцировать опухоль от тромба.
Таким образом, первичные опухоли сердца у детей и подростков характеризуются неспецифической полиморфной клинической картиной. Первым методом диагностики является УЗИ сердца, способное выявить объемное образование, оценить его размеры, связь со структурами сердца. По данным ЭхоКГ, без клинической интерпретации, других визуализационных методик и гистологического исследования делать безоговорочные заключения о типе объемного образования невозможно. Клиническая интерпретация полученных данных позволяет провести дифференциальную диагностику и выбрать наиболее оправданный метод лечения.
УЗИ сканер HS50
Читайте также:
- УЗИ при патологии плодного яйца и его содержимого
- Септический артрит у детей: клиника, диагностика, лечение
- Доступ, техника остеотомии бугристости большеберцовой кости (антеромедиализации и дистализации)
- Борьба с травматизмом и ее профилактика в прокатном цехе металлургической промышленности
- Эндогенные инфекции. Причины роста актуальности эндогенных инфекций в эпидемиологии.
