УЗИ, МРТ при омфалоцеле у плода
Добавил пользователь Skiper Обновлено: 10.01.2026
Российская медицинская академия последипломного образования;
Тушинская детская городская больница, Москва
Кафедра неврологии факультета усовершенствования врачей и кафедра нервных болезней педиатрического факультета Российского государственного медицинского университета, Москва
Тушинская городская детская больница, Москва
ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России, Москва, Россия
Современная диагностика агенезии мозолистого тела у детей
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2017;117(1): 63‑66
В статье представлены наблюдения авторов, касающиеся основных нейровизуализационных (МРТ) проявлений агенезии мозолистого тела (АМТ). Этому предпослан обзор литературы по строению МТ в норме и патологии. Подчеркивается, что часть случаев изолированной АМТ выявлена при рутинном пренатальном УЗИ. Пренатальная МРТ более эффективна в этом отношении. В 74% наблюдений у больных с АМТ результаты МРТ совпадают с данными УЗИ и КТ. МРТ обладает преимуществом в диагностике врожденных пороков развития МТ, а также дифференциации сопутствующих аномалий ЦНС.
Мозолистое тело (МТ) — самая крупная церебральная комиссура, располагающаяся по срединной продольной линии головного мозга. Оно соединяет филогенетически наиболее молодые участки больших полушарий мозга, обеспечивая межполушарную передачу информации [1].
Агенезия мозолистого тела (АМТ) — отсутствие пересечения средней линии комиссуральными волокнами М.Т. По классификации врожденных пороков развития головного мозга и черепа D. Harwood-Nash [2] АМТ относится к группе нарушений органогенеза и занимает 10-е место среди всех других пороков развития ЦНС. Частота АМТ составляет 0,3—0,7% в общем населении и 2—3% — среди инвалидов с умственной отсталостью [3].
В сочетании с АМТ могут встречаться такие пороки развития, как липомы МТ, полимикрогирия, шизэнцефалия, межполушарные кисты, мальформация Денди—Уокера и др. Как правило, АМТ не имеет самостоятельной клинической картины, что обусловливает сложности ее диагностики [4]. Прижизненная визуализация АМТ стала возможной благодаря внедрению в клиническую практику магнитно-резонансной томографии (МРТ) головного мозга.
Механизмы формирования МТ до настоящего времени остаются предметом дискуссий. Известно, что нервная система развивается из медуллярной трубки. На 4-й неделе гестации образуются три первичных мозговых пузыря, на 6—7-й неделе — пять. МТ образуется из первого мозгового пузыря и формируется из покровной части конечной пластинки Гиса, дорсальный конец которой утолщается, образуя так называемый поперечный вал [5]. Согласно результатам ряда исследований [5—7], на 15—17-й неделе внутриутробного развития появляются комиссуральные волокна МТ, соединяющие большие полушария мозга. По данным G. Davilla-Gutierrez [8], вначале МТ увеличивается рострально, затем каудально, при этом волокна ростральной части пересекаются приблизительно на 74-й день, а на 115-й день происходит его утолщение. L. Richards и соавт. [7], напротив, указывают, что часть каудальных аксонов МТ, зависящих от гиппокампа, может одновременно пересекаться с ростральными аксонами МТ. К 20-й неделе МТ практически сформировано [9]. У недоношенных детей его формирование замедляется [10]. У младенцев к 8—10-му месяцу жизни происходит окончательная миелинизация ростральной части МТ [11].
АМТ может быть результатом недостаточного развития комиссуральной пластинки, агенезии или деструкции третьего слоя нейронов [12]. Есть данные, подтверждающие, что первичная АМТ формируется до 12—16-й недели внутриутробного развития [13]. После 18—20-й недели происходит вторичное повреждение МТ, являющееся следствием энцефаломаляции на более поздних этапах развития плода [14]. При вторичной АМТ чаще происходит недоразвитие задней части (валик) МТ, а передняя или средняя части МТ (колено, клюв и часть корпуса) отсутствуют [12].
Определенные трудности в диагностике АМТ сохраняются и в наши дни. Время ее внутриутробного обнаружения напрямую зависит от стадии онтогенеза МТ.
По данным R. Achiron и соавт. [15], которые обследовали 270 беременных между 16-й и 37-й неделями гестации, при ультразвуковом исследовании (УЗИ) плода удалось измерить длину, ширину и толщину МТ в 258 случаях. Это позволило выявить линейную зависимость между увеличением роста МТ и гестационным возрастом плода, а также установить, что на 19—21-й неделях гестации происходит его максимальное увеличение. A. Barkovich и соавт. [16] предположили, что определенные подтипы АМТ зависят от пола. Это нашло подтверждение в экспериментах на животных: у лабораторных животных (мыши) линии BALB/cCF с нарушениями развития МТ было выявлено преобладание самок [17].
Согласно исследованиям P. Govaert и L. de Vries [11], после 20-й недели беременности на УЗИ определяются следующие признаки АМТ: вентрикуломегалия; высокое расположение III желудочка; отсутствие полости прозрачной перегородки, а по данным С.М. Воеводина [18], на УЗИ плода при условии технической чистоты получения сагиттальной проекции АМТ выявляется на сроках 15—36 нед беременности. К сожалению, значительная доля случаев изолированной АМТ при рутинном пренатальном УЗИ не улавливается.
Пренатальная МРТ наиболее эффективна при диагностике АМТ [11]. В 74% наблюдений у больных с АМТ результаты МРТ совпадают с данными УЗИ и КТ-диагностики [19].
Постнатальная ультразвуковая картина АМТ характеризуется отсутствием изображения МТ; исчезновением нормальной архитектоники борозд и извилин в сагиттальной плоскости сканирования; веерообразным отхождением борозд от крыши III желудочка; широким расположением боковых желудочков с изменением ориентации передних рогов в коронарных плоскостях и смещением вверх или расширением III желудочка. На К.Т. определяются параллельный ход и увеличение расстояния между телами боковых желудочков, расширение задних рогов и преддверий боковых желудочков (кольпоцефалия) [11].
В данной публикации приведены собственные наблюдения АМТ и анализ соответствующих данных прижизненной нейровизуализации мозга.
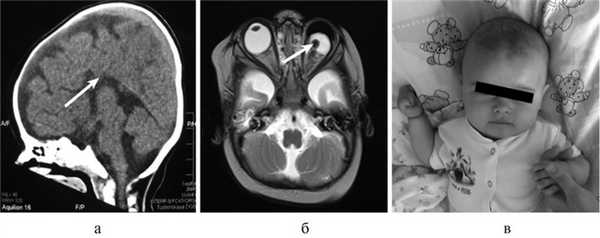
Рис. 1. КТ и МРТ головного мозга (сагиттальная, фронтальная проекции) и внешний вид больной Т., 8 мес. а — КТ: АМТ (стрелка); б — микрофтальм слева на МРТ (стрелка); в — внешний вид пациентки с множественными стигмами дизэмбриогенеза.
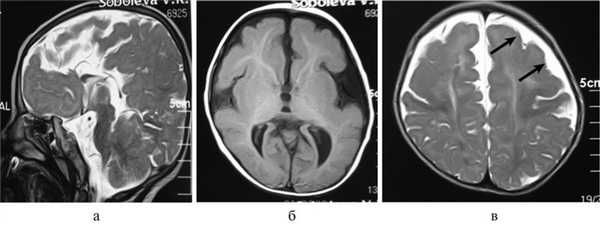
Рис. 2. Результаты обследования больной С., 8 лет. а, б, в — МРТ головного мозга (сагиттальная и аксиальная проекции): сочетание АМТ и диффузной пахигирии (стрелки).
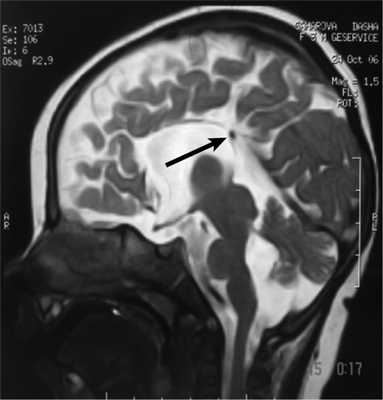
Рис. 3. МРТ головного мозга (сагиттальная проекция) больной С., 7 лет. АМТ (стрелка).
Важной находкой при АМТ на МРТ является параллельная ориентация тел боковых желудочков по отношению друг к другу (рис. 4, а), расширенные фронтальные отделы желудочков, так называемый «симптом ухвата».
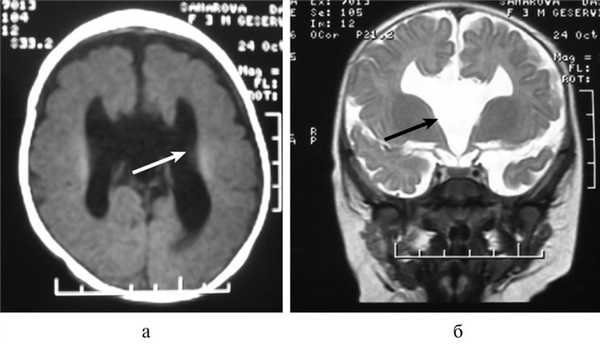
Рис. 4. МРТ головного мозга больной К., 4 года. АМТ. Аксиальная проекция: а — аномальная параллельная ориентация тел боковых желудочков по отношению друг к другу (стрелка); б — фронтальное сечение: деформация передних и задних рогов боковых желудочков, своеобразный U-образный характер фронтальных отделов боковых желудочков (стрелка).
При МРТ мы обращали внимание также на описанное в литературе [12] изолированное расширение задних рогов — кольпоцефалию, обусловленную гипоплазией ассоциативных трактов белого вещества затылочных долей. Диагностический ряд на МРТ дополняют отсутствие нормально сформированных перикаллезных извилин (рис. 5, а) и радиальная центростремительная позиция борозд медиальной поверхности теменной доли (рис. 5, б).
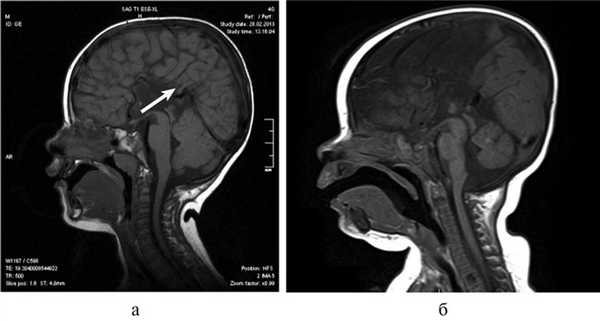
Рис. 5. МРТ головного мозга больного А., 3 года. АМТ. а — сагиттальная проекция. Отсутствие нормально сформированных перикаллезных извилин (стрелка), б — высокое положение III желудочка, радиальная центростремительная направленность борозд медиальной поверхности теменных долей.
Появилась также новая нейровизуализационная технология — магнито-резонансная морфометрия, которая помогает оценить степень поражения М.Т. Можно вычислить каллозальный индекс — отношение площади МТ к площади внутреннего сечения черепной коробки, оценить размер, общую площадь, толщину колена, корпуса, перешейка и валика МТ [22—24].
Нередко изменения структуры МТ обнаруживаются случайно, при КТ- или МРТ-исследованиях по поводу других заболеваний. Так, описано [25] наличие АМТ у пациента с ювенильной болезнью Гентингтона в сочетании с множественными соединительнотканными дисплазиями, остеохондропатией.
Таким образом, среди множественных врожденных пороков развития ЦНС, которыми страдают около 1% детей [26], одно из ведущих мест принадлежит АМТ. В настоящее время совершенствуются методы нейровизуализации, такие как МРТ плода, применяются методики ультразвукового сканирования плода во внутриутробном периоде на ранних сроках гестационного развития, позволяющие заподозрить тот ли иной наследственный синдром в пренатальном периоде.
Адекватное и своевременное распознавание врожденных пороков развития МТ представляет собой непростую задачу, решение которой требует владения новейшими методиками нейровизуализационной диагностики. В данной статье представлены основные нейровизуализационные проявления АМТ.
Омфалоцеле
Омфалоцеле - врожденная аномалия передней брюшной стенки, при которой органы брюшной полости выходят за ее пределы в составе грыжевого мешка. Клинически патология проявляется эвентрацией петель кишечника, желудка, печени и других органов, прикрытых висцеральной брюшиной, через грыжевые ворота в участке пупочного кольца. Антенатальная диагностика включает в себя УЗИ ОБП, определение уровня α-фетопротеина, амниоцентез с дальнейшим кариотипированием. Лечение хирургическое, предусматривает радикальное или поэтапное погружение содержимого грыжевого пешка обратно в брюшную полость с последующей пластикой передней брюшной стенки.
Общие сведения
Омфалоцеле (эмбриональная грыжа, грыжа пупочного канатика) - аномалия развития, при которой происходит выпячивание органов брюшной полости, укрытых висцеральной брюшиной, сквозь переднюю брюшную стенку. Впервые данную патологию описал французский хирург А. Паре в 1634 году. В среднем заболеваемость составляет порядка 2,2:10000 новорожденных. Точную частоту, с которой встречается омфалоцеле, установить невозможно, поскольку в большинстве случаев такие беременности прерываются. У мальчиков данная патология возникает в 1,5 раза чаще, чем у девочек. Наибольшая склонность наблюдается у представителей европеоидной расы - 85% от всех случаев омфалоцеле. Для представителей негроидной расы этот показатель составляет 13%, монголоидной - 2%. Примерно 55% случаев патологии диагностируется при беременности у женщин в возрасте старше 35 лет. Общая летальность зависит от сопутствующих расстройств и колеблется от 9 до 60% новорожденных. При изолированной форме и адекватном лечении прогноз для жизни и здоровья ребенка благоприятный.
Причины омфалоцеле
Омфалоцеле - это гетерогенное заболевание, при котором нарушается процесс внутриутробного вправления физиологической пупочной грыжи. Патогенетически это может быть результатом пороков развития пупочного кольца и передней брюшной стенки, генетических аномалий, неполного погружения органов обратно в брюшную полость или дефектов строения кишечника.
При внутриутробном развитии кишечника плода, а именно - в процессе его трансформации от первичной кишечной трубки до зрелых петель происходит его физиологической разворот. Данный процесс начинается с 5 недели беременности. От этого момента и до 10 недели кишечник сильно увеличивается в объеме, из-за чего не помешается в брюшной полости. Петли давят на брюшную стенку, формируя физиологическую пупочную грыжу. К концу 10 недели абдоминальная полость стремительно прибавляет в объеме, на фоне чего происходит самостоятельное вправление эвентрации. Если данный механизм нарушается силу различных патологических изменений, возникает омфалоцеле.
Способствовать возникновению данной патологии могут вредные привычки матери (алкоголь, курение, наркотики), нерациональный прием медикаментов, беременность после 35 лет, при которой растет риск хромосомных аномалий - синдромов Патау, Эдвардса. Довольно часто омфалоцеле выступает в роли одного из симптомов таких патологий, как синдром Беквита-Видемана, пентада Кантрелла, синдром амниотических тяжей, порок развития стебля тела, OEIS комплекса. Крайне редко удается установить наследственную склонность, что свидетельствует о возможной генетической предрасположенности.
Классификация и симптомы омфалоцеле
В педиатрии в зависимости от размера дефекта и его содержания выделяют следующие формы омфалоцеле:
- Малая. Диаметр - до 5 см. Наиболее распространенная форма. Содержит 1-2 кишечные петли. В основном выступает в роли проявлений хромосомных аномалий.
- Средняя. Размер дефекта пупочного кольца - от 5 до 10 см. В составе грыжевого мешка содержатся 2-4 кишечные петли.
- Большая. Дефект передней брюшной стенки составляет более 10 см. Помимо петель кишечника через него выходит часть печени, желудок и другие органы.
По наличию сопутствующих патологий выделяют:
- Изолированное омфалоцеле. Грыжа пупочного канатика - единственная развившаяся внутриутробная патология.
- Сочетанная форма. Помимо дефекта пупочного кольца у ребенка присутствуют хромосомные мутации (25-35%), пороки развития сердечно-сосудистой (15-50%) и мочеполовой систем (до 15%). Характерны грыжи пищеводного отверстия диафрагмы и дисплазии тазобедренных суставов, другие скелетные аномалии.
Омфалоцеле является врожденной патологией, которая диагностируется еще в антенатальном периоде. После родов общее состояние ребенка зависит от сопутствующих заболеваний и срока гестации. При омфалоцеле характерны преждевременные роды, масса тела ребенка 1500г и меньше. Объективные признаки визуализируются уже с момента рождения. Определяется дефект передней брюшной стенки, который локализирован по срединной линии на уровне пупочного кольца. В этом месте находится образование, представленное петлями тонкого и толстого кишечника, возможно - желудком и печенью, покрытыми висцеральными листком брюшины. В 10-20% наблюдается анте- или интранатальный разрыв грыжевого мешка. Пуповина также входит в состав омфалоцеле. Абдоминальные мышцы развиты нормально. Другие возможные пороки развития зависят от сопутствующих патологий и могут включать в себя деформации позвоночного столба и конечностей, макроглоссию, макросомию, атрезию ануса и т. д.
Диагностика омфалоцеле
В современных условиях наличие омфалоцеле определяется еще в I триместре беременности благодаря инструментальным и лабораторным методам исследования. Ведущую роль играет УЗ-диагностика. В зависимости от аппарата установить наличие данной патологии можно уже на 11-14 неделе. Основной признак - эвентрация петель кишечника, печени, желудка за пределы брюшной полости в участке крепления пуповины к брюшной стенке. Все вышедшие органы покрыты мембраной, состоящей из брюшины, вартонового студня и амниотической оболочки. Наличие данной мембраны важно для проведения дифференциальной диагностики с гастрошизисом. При внутриутробном разрыве грыжевого мешка петли кишечника прикрывает только амнион. Также на потенциальное развитие омфалоцеле может указывать размер ворот физиологической грыжи, составляющий свыше 7 мм в диаметре. УЗИ позволяет выявить другие проявления присутствующих генетических патологий. Повторные исследования проводятся каждые 2-3 недели, т. к. возможно самостоятельно закрытие дефекта в более поздние сроки.
Лабораторная диагностика омфалоцеле осуществляется при помощи биохимического исследования крови с измерением уровня α-фетопротеина. При врожденных пороках развития этот показатель будет значительно выше нормы для имеющегося срока беременности. Для подтверждения генетических аномалий показано проведение амниоцентеза с дальнейшим кариотипированием.
Лечение омфалоцеле
При антенатальной постановке диагноза омфалоцеле роды проводятся в специализированном перинатальном центре в условиях развернутой операционной. При малых и средних размерах дефекта пупочного кольца и отсутствии угрожающих жизни матери и ребенка состояний родоразрешение может осуществляться через естественные родовые пути. Во всех других ситуациях показано кесарево сечение в связи с большим риском интранатального разрыва грыжевого мешка. Дальнейшая терапевтическая тактика зависит общего состояния ребенка, размеров пупочной грыжи и сопутствующих патологий.
Консервативная терапия используется при невозможности провести хирургическое вмешательство. Как правило, она применяется при больших формах омфалоцеле и комбинации с множественными тяжелыми аномалиями развития. Лечение заключается в формировании плотной корки и рубца, что трансформирует данную патологию в массивную вентральную грыжу, которую в дальнейшем оперируют. С этой целью применяют дубящие средства (5% перманганат калия, нитрат серебра), которые наносят на вертикально зафиксированный за пуповину грыжевой мешок 2-3 раза в день. Консервативное лечение используется крайне редко, т. к. при нем имеется большая вероятность инфицирования и сепсиса, риск разрыва оболочек, массивной спаечной болезни в дальнейшем. Предпочтение отдается раннему оперативному вмешательству.
Хирургическая тактика при омфалоцеле напрямую зависит от размеров дефекта брюшной стенки, операции могут проводиться в один или несколько этапов. Начинают такое лечение на протяжении первых 1-2 дней жизни ребенка. При одномоментном вмешательстве выполняется погружение содержимого грыжевого мешка в абдоминальную полость и послойное зашивание брюшной стенки с ее пластикой и формированием пупка. Такая тактика - метод выбора, при омфалоцеле малых и средних размеров с минимальной торакоабдоминальной диспропорцией. В других случаях прибегают к поэтапному лечению. Первый этап - подшивание силиконового мешка с силопластиковым покрытием и помещением в него содержимого грыжевого мешка. По мере постепенного погружения органов в абдоминальную полость данный мешок перевязывают, уменьшая его в объеме. На 5-15 день выполняется второй этап - удаление мешка и формирование минимальной вентральной грыжи посредством ушивания дефекта. В возрасте 5-7 месяцев эта грыжа удаляется, после чего осуществляется полноценная пластика брюшной стенки.
После первого этапа или одноэтапной операции ребенок помещается в кувез для поддержания температурного режима, применяются обезболивающие, антибиотики широкого спектра действия. Режим питания парентеральный. При необходимости выполняется декомпрессия желудка через назо- или орогастральный зонд, проводится инфузионная терапия и ИВЛ. После проведенного лечения следует длительный реабилитационный период, в течение которого осуществляется коррекция всех послеоперационных осложнений.
Прогноз и профилактика омфалоцеле
В целом прогноз для детей с омфалоцеле сомнительный. Исход зависит от срока гестации, сопутствующих хромосомных аномалий и анатомических пороков развития, диаметра дефекта пупочного кольца, объема и содержания грыжевого мешка, результатов проведенного лечения. Как правило, при адекватной терапии и отсутствии сопутствующих патологий, несовместимых с жизнью, вероятность благоприятного исхода достаточно велика. При изолированной форме омфалоцеле малого размера, несмотря возможные отдаленные осложнения хирургического лечения (ГЭРБ, спаечная болезнь, пупочная грыжа), дальнейший рост и развитие ребенка не будут отличаться от возрастной нормы. На протяжении всего периода реабилитации показано диспансерное наблюдение у лечащего педиатра, хирурга и семейного врача.
Профилактика заключается в медико-генетическом консультировании семейных пар, планировании беременности, полном отказе матери от вредных привычек. С целью ранней диагностики омфалоцеле необходимо регулярно посещать женскую консультацию и проходить соответствующие обследования: УЗИ и измерение α-фетопротеина крови.
Омфалоцеле - это аномалия развития, при которой имеется центральный дефект передней брюшной стенки в области пупочного кольца, через который из брюшной полости эвентрируются (выпячиваются) внутренние органы (обычно петли тонкой и толстой кишки, желудок, печень), покрытые грыжевым мешком. Этот порок развития возникает в результате нарушения возвращения петель кишечника назад в брюшную полость после их миграции в пупочный канатик на 10-й неделе внутриутробного развития. Омфалоцеле часто сочетается с другими пороками развития, такими как пороки сердца, желудочно-кишечного тракта, мочевыделительной системы. Нередко отмечаются хромосомные аномалии. Частота встречаемости данного порока 1 случай на 4000 -10000 живорожденных детей (К.У. Ашкрафт 1998 г).
Антенатальная диагностика этой аномалии развития возможна с 14 неделе внутриутробного развития. При УЗИ плода вне брюшной полости определяются петли кишечника, покрытые грыжевым мешком. Уровень алфа-фетопротеина у женщины повышен. При подозрении на омфалоцеле показано тщательно обследовать плод на наличие сопутствующих аномалий. Необходимо выполнение амниоцентеза и кариотипирование плода, так как часто (30% случаев) омфалоцеле сочетается с хромосомными аномалиями. Если принято решение о сохранении беременности, необходимо четко согласовать действия родителей, педиатров, акушеров и неонатальных хирургов. При омфалоцеле малый и средних размеров возможно родоразрешение естественным путем, при большом омфалоцеле показаны оперативные роды путем Кесарева сечения, в виду опасности разрыва оболочек.
После рождения скобу на пуповину необходимо накладывать на расстоянии не менее 10 см от кожи, чтобы не повредить находящиеся в мешке петли кишечника.
Классифицируются омфалоцеле по размеру дефекта передней брюшной стенки на
- Малые - дефект передней брюшной стеки до 4 см, размеры грыжевого мешка до 5 см, содержимым грыжевого мешка являются петля кишки, часто незаращенный желточный проток;
- Средние - дефект передней брюшной стеки до 4-7 см, размеры грыжевого мешка до 5-10 см, содержимым грыжевого мешка являются петли кишечника и долька печени;
- Большие - дефект передней брюшной стеки до 7-10 см, размеры грыжевого мешка более 10 см, содержимым грыжевого мешка являются петли кишечника, желудок, печень.
При установке диагноза ребенка необходимо перевести в специализированный стационар. Во избежание травматизации оболочек накладывается стерильная фиксирующая повязка.
Для подтверждения диагноза выполняется обзорная рентгенография брюшной полости в вертикальном положении и УЗИ, при которых в оболочках пуповины определяются петли кишечника. Выполняются дополнительные методы обследования для исключения сопутствующих аномалий развития.
Проводится предоперационая подготовка в условиях отделения интенсивной терапии, включающая инфузионную и антибактериальную терапию. Выбор метода лечения при омфалоцеле зависит от размеров грыжевого выпячивания, сопутствующих пороков развития, состояния ребенка.
При малых и средних размерах грыжи выполняется погружение органов в брюшную полость и пластика передней брюшной стенки. Если нет значительной разницы между соотношением объема брюшной полости и объемом грыжи выполняется ушивание передней брюшной стенки местными тканями. При значительной разнице в объемах и высоким риском повышения внутрибрюшного давления для закрытия дефекта используют вставки из различных синтетических материалов. При гигантских грыжах и наличия тяжелых сопутствующих пороков развития применяют консервативное лечение, заключающееся в фиксации грыжевого мешка в вертикальном положении, постепенной обработке грыжевого мешка дубящими растворами, добиваясь формирования плотной корки с последующей эпителизацией. Таким образом формируется вентральная грыжа, которую оперируют в возрасте 2-3 года.
В послеоперационном периоде ребенок находится на искусственной вентиляции легких, ему проводится инфузионная терапия с элементами парентерального питания, антибактериальная терапия, после восстановления функции кишечника начинается кормление в желудок.
Прогноз зависит от общего состояния ребенка, размеров омфалоцеле, сохранности оболочек, а также сопутствующих пороков развития.
Версия для слабовидящих
Государственное бюджетное учреждение здравоохранения города Москвы «Морозовская детская городская клиническая больница Департамента здравоохранения города Москвы
Колл-центр с 08:00-20:00
Патологии передней брюшной стенки плода, видимые на УЗИ при беременности
К патологиям передней брюшной стенки можно отнести гастрошизис, омфалоцеле и асцит. Первые две патологии имеют одинаковое происхождение. Разница заключается в том, что при омфалоцеле печень и желудок размещены не в брюшной полости, а под кожей в оболочке из пуповины. При гастрошизе кишечник плода выходит наружу без какой-либо оболочки.
Гастрошизис, омфалоцеле
Обе патологии формируются на 3-6 неделе беременности, однако обнаружить их на УЗИ можно не ранее чем на 2 скрининге. Гастрошизис проявляется в виде гипоэхогенного образования на передней брюшной стенке круглой или овальной формы. Место локализации расположено в районе пупка, петли кишечника обычно вздуты, на них визуализируются спайки.
К дополнительным признакам гастрошиза относят много- или маловодие, отставание плода от стандартных параметров, увеличение объёма животика. В 16% случаев обнаруживаются тяжёлые пороки сердца. Анализ крови беременной показывает повышение альфа-фетопротеина.
Омфалоцеле диагностируется на сроке 15 недель беременности. На экране монитора видны петли кишечника, расположенные на передней брюшной стенке. В основном причиной патологии являются хромосомные отклонения, сопровождающиеся пороками других органов.
Асцит плода
Это скопление жидкости в тканях всего организма плода. Возникает на фоне резус-конфликта между матерью и ребёнком, а также ввиду иммунологических отклонений. На УЗИ асцит визуализируется на 2 скрининге на сроке от 12 недель.
Его признаками являются:
- отёчная плацента;
- многоводие;
- увеличение размеров живота плода;
- подкожно-жировой слой плода имеет двойной контур из-за отёка;
- размеры сердца увеличены;
- стенки кишечника утолщены;
- печень и селезёнка увеличены в размерах;
- плод почти неподвижен.
Выводы
Большинство беременностей с данной патологией заканчивается самопроизвольным абортом либо гибелью плода на поздних сроках. При обнаружении асцита женщине предлагают прервать беременность.
УЗИ при беременности в СПБ: расшифровка терминов
УЗ-исследование — единственная неинвазивная (проводимая без вмешательства в организм) методика, позволяющая полноценно наблюдать за ростом и развитием плода. Своевременно проведенное УЗИ при беременности выявляет свыше 95% тяжелых пороков развития плода и осложнений беременности.

Важные факты про УЗИ беременных
- УЗИ — лучший способ отслеживать состояние матери и ребенка. Этот метод точный, дешевый и самый объективный, так как наблюдение ведется визуально с фиксацией результатов на снимках и видео.
- Каждая беременная женщина обязательно должна три плановых УЗИ: УЗИ в первом триместре , УЗИ во втором триместре , УЗИ в третьем триместре . Также могут проводиться внеплановые (внескрининговые) УЗИ .
- Исследование со 100% точностью выявляет опасные для жизни состояния — внематочную и замершую беременности, проблемы, угрожающие жизни малыша — патологии плаценты и пуповины, показывает недоразвитие органов и конечностей, хромосомные патологии у плода.
- УЗИ проводится как минимум 3 раза за беременность, если есть подозрения на патологии или есть необходимость отслеживать развитие плода, исследование выполняется столько раз, сколько это необходимо.
- Безопасность УЗИ при беременности доказана исследованиями и временем. Метод используется более 30 лет, через него прошли несколько поколений мам и детишек. До сих пор нет ни одного факта, свидетельствующего против методики. Об этом же говорят выводы авторитетного в научном мире учреждения — Американского Института Ультразвука в Медицине.
- Обследование может проводиться в разных режимах: 2Д, 3Д и 4Д, с использованием датчика доплера. На первых этапах информативен 2D формат, затем (вторая половина беременности) к 2D добавляются 3Д УЗИ и 4Д УЗИ .
- Качество УЗИ при беременности гарантируется только при проведении обследования с помощью новых аппаратов и специалистами, имеющими специальный сертификат.
В клинике Диана установлен новый аппарат УЗИ 3Д, 4Д С ДОПЛЕРОМ ОТ SAMSUNG MEDISON. Видео УЗИ можно посмотреть ЗДЕСЬ . Обследование проводят опытные специалисты — члены Российской ассоциации специалистов УЗИ в акушерстве, гинекологии, перинатологии.
А теперь рассмотрим, что означают те или иные диагнозы, которые часто ставят беременным на УЗИ.
Единственная артерия пуповины: стоит ли волноваться?
Бывает, что на УЗИ врач ставит диагноз «единственная артерия пуповины». Беременные женщины, прочитав заключение, нервничают и задают вопросы: что это, опасно ли это, что теперь делать? Чтобы на них ответить, давайте рассмотрим это состояние в подробностях.
Обычно пуповина включает в себя три сосуда, проводящие кровь, разной толщины: 2 сосуда крупные — это артерии и один тонкий — вена. Диагноз «единственная артерия пуповины» говорит о том, что в пуповине вместо 2-х артерий сформирована одна. Т.е. пуповина состоит из двух сосудов — одной артерии и одной вены. Так как такое строение не соответствует норме, его признают пороком развития пуповины.
Всегда ли это опасно? Нет! Если на УЗИ не обнаруживается дополнительных проблем, плод развивается нормально, то можно не беспокоиться. На самочувствии новорожденного патология никак не скажется, так как одна артерия может обеспечивать плод всем необходимым всю беременность в полной мере.
Бывает и наоборот — эта патология пуповины говорит о наличии серьезных проблем, поэтому нужно провести очень тщательное обследование и следить за развитием плода придется всю беременность.
О чем может говорить эта патология:
- О проблемах с сердечно-сосудистой системой . При сочетании пороков сердца и сосудов, возможно слабое развитие плода и рождение малыша с патологиями сердечно-сосудистой системы. Поэтому необходимо тщательное обследование с упором на изучение состояния сердца и сосудов.
- Возможность задержкивнутриутробного роста и развития . Патологии отслеживают на плановых скринингах и внескрининговых УЗИ , первое из которых нужно обязательно пройти в 28 недель беременности.
- Синдром Дауна или др. хромосомные патологии у плода . Этот признак — субъективный, т.е. он не может служить основанием для постановки диагноза. Малые маркеры, вроде этого, относятся к признакам лишь потому, что они встречаются вместе с серьезными патологиями, что может быть просто совпадением.
Вывод. Если на УЗИ обнаружена единственная артерия пуповины, нужно пройти внеплановое обследование в 28 недель, где гинеколог оценит темпы роста и развития плода, и уделить больше внимания генетическому скринингу и обследованию сердечно-сосудистой системы малыша.
Кисты сосудистых сплетений у плода
Сосудистые сплетения — первые зачатки головного мозга у плода. При нормальном развитии формируется два сосудистых сплетения из которых впоследствии развиваются две половины мозга. В сосудах сплетения находится питательная жидкость, необходимая для развития спинного и головного мозга, поэтому значение этой структуры сложно переоценить
Вывод. При обнаружении кист сосудистых сплетений, нужно пройти дополнительное контрольное УЗИ в 28 недель. Если кисты не рассосались, врач должен убедиться, что это именно кисты, а не другие новообразования. Другие новообразования потребуют дальнейшего обследования.
Маркеры хромосомной патологии плода
Маркерами называют признаки хромосомной патологии плода . Они бывают объективными и субъективными (малыми). Все маркеры, обнаруженные на УЗИ не являются основанием для постановки диагноза, и тем более не служат основанием для аборта .
Если гинеколог обнаруживает на УЗИ объективные маркеры хромосомных патологий, он направляет беременную женщину на дополнительное обследование — инвазивную пренатальную диагностику. Она покажет истинную картину состояния плода.
Инвазивной пренатальной диагностикой называется микроскопическое исследование клеток плода — хорионбиопсия/плацентобиопсия.
- Хорионбиопсию делают до 14-ти недель беременности, пока существует хорион.
- Плацентобиопсию проводят после 14 недель, когда из хориона развивается плацента.
Методика выполнения в обоих случаях одинакова.
У беременной, методом прокола брюшной стенки, берут ворсинки из хориона плода (орган из которого образуется плацента) и подсчитывают в них количество хромосом. Если хромосомы в клетках соответствуют нормам, хромосомные патологии у плода исключаются на 99%. При плацентобиопсии берут клетки плаценты. Результативность анализа — такая же.
Бояться процедуры не нужно. Риск инфицирования во время хорионбиопсии сводится к нулю, а риск выкидыша (прерывания беременности) не превышает 1%.
Вывод: Учитывая, что пропустить хромосомную патологию у плода гораздо страшнее, ведь это практически всегда неизлечимая болезнь, пройти диагностику нужно. Тем более, что в настоящее время хорионбиопсия (плацентобиопсия) — единственный метод, гарантирующий точность диагноза без внутриматочного вмешательства.
Расширение почечных лоханок (пиелоэктазия)
Почечные лоханки — полости, в которых собирается моча, поступающая из почек. Далее урина уходит через мочеточники в мочевой пузырь. Причина пиелоэктазии — препятствие на пути оттока мочи из-за чего лоханки раздуваются и растягиваются. При легкой форме плоду ничего не грозит, при тяжелой форме пиелоэктазии отток мочи из почек ухудшается — такая патология опасна.
Умеренная пиелоэктазия в большинстве случаев не опасна, так как орган при созревании мочеполовой системы восстанавливается до нормальных значений. Выраженное расширение (от 10 мм) приводит к атрофии почечной ткани, далее присоединяется пиелонефрит - воспаление почки. В итоге почка, в обязанности которой входит фильтрация мочи, слабо функционирует, и продукты распада урины отравляют организм.
Расширение лоханок почек — субъективный маркер синдрома Дауна, поэтому основанием для постановки такого диагноза не является.
Вывод. Врачи настоятельно рекомендуют при выявленной пиелоэктазии пройти контрольное УЗИ в 32 недели. Если расширение почечных лоханок значительное, лечение малышу будет назначено сразу после родов. При умеренной патологии, ребенка нужно будет показывать урологу каждые 3 месяца. Если болезнь будет прогрессировать, назначается малотравматичная операция с целью устранения препятствия, закрывающего выход моче.
Гиперэхогенный кишечник
Эхогенность — это способность тканей отражать ультразвуковые волны. Чем плотнее ткань, тем выше эхогенность. На снимках УЗИ эхогенность выражается цветом, в частности гиперэхогенные органы самые яркие. Следовательно гиперэхогенный кишечник — это не диагноз, ведь такого заболевания нет, это характеристика тканей органа.
Эхогенность здорового кишечника всегда выше эхогенности печени, легких, почек, но в умеренном варианте. При гиперэхогенности плотность ткани соответствует плотности костей плода, что уже не нормально.
Опасно ли это? Если этот признак временный и при изучении плода в динамике исчезает, повода для волнений нет. В остальных случаях требуется дополнительное обследование.
- Гиперэхогенность кишечника один из симптомов синдрома Дауна. Поэтому, заметив повышенную эхогенность, доктор тщательно исследует анатомию плода. При этом только по повышенной эхогенности ставить такой диагноз нельзя: как было сказано выше, такое состояние встречается у абсолютно здоровых малышей.
- Гиперэхогенность кишечника может говорить о внутриутробной инфекции плода. Это опасное состояние, приводящее к выкидышам, замиранию беременности или рождению больного малыша. Поэтому гинеколог обязательно назначит дополнительные анализы.
- Повышенная эхогенность кишечника может быть симптомом задержки внутриутробного развития. В этом случае УЗИ покажет недостаточный рост и отставание физического развития плода от норм по срокам беременности. Часто параллельно выявляются нарушения кровотока в сосудах и маловодие.
Вывод . При диагнозе гиперэхогенность кишечника нужно пройти дополнительные обследования: биохимический тест на генетические патологии, анализы на ТОРЧ-инфекции, внеплановое УЗИ через месяц, чтобы оценить темпы развития плода.
Гиперэхогенный фокус желудочка сердца
Гиперэхогенный фокус - это участок сердечной мышцы, имеющий повышенную плотность. Как и в случае с гиперэхогенностью желудка (см. выше) — это не диагноз, а показатель плотности ткани. Плотность в желудочке сердца у плода может повышаться из-за скопления в этом месте солей кальция.
- Если этот симптом не связан ни с какими патологиями, и в динамике исчезает, можно не переживать — соли кальция не приводят к порокам сердца и не мешают органу работать.
- Иногда такое состояние отмечается при синдроме Дауна, однако этот малый маркер не является поводом для постановки этого серьезного диагноза.
Вывод. Если доктор отмечал на УЗИ повышенный гиперэхогенный фокус сердечной мышцы у плода, то нужно пройти внеплановое УЗИ с целью детального обследования сердца на 32-34 неделе. Также нужно более внимательно отнестись к диагностике хромосомных патологий. Если гиперэхогенность желудочка сохранилась, но других признаков патологии сердца нет, малышу ничего не грозит.
Где пройти экспертное УЗИ при беременности в СПБ
Приглашаем будущих мам на обследование в специализированный медицинский центр Диана. Здесь вы сдадите все анализы, в том числе на генетику и инфекции, и пройдете УЗИ плода, получив расшифровки тестов на руки. На УЗИ проводится видеозапись результатов на диск. Также к вашим услугам консультации гинеколога, уролога, эндокринолога и онколога.
Читайте также:
