УЗИ при добавочной доле плаценты
Добавил пользователь Alex Обновлено: 22.01.2026
Здравствуйте. УЗИ: в матке 1 плод, тазовое предлежание, положение продольное. Бпр- 50 мм, окр гол 191 мм, лобно-затылочный размер в 5 мм, окр живота 159 мм. Длина обеих бед костей 36 мм, длина обеих костей голени 33 мм, длина обеих плечкосых костей 29 мм. Размер плода соотв.21 над. Анатомия плода N. Преимущественная локализация плаценты передняя стенка матки, добавочная доля по задней стенке матки. Толщина плаценты нормальная до 21 мм. Структурность плаценты однородная 0ст зрелости. Индекс амниот.жидкости 12 мм. Пуповина имеет 3 сосуда. Врож.пороков не обнар. Обнаружены добавочная доля по зад.стенке матки, планета от внутр.зева 20 мм. D шейки 50 мм, d внутр.зева до 5 мм, гипертонус зад.ст.матки. УЗИ признаки прог.бер-ти 21 нед, угроза прерывания бер-ти, низкая плаценация, добавочная доля плаценты. Что делать, что это значит и чем опасно? Спасибо
Добрый день! Угроза прерывания опасна прерыванием беременности. У 8% беременных женщин при УЗ-исследовании могут обнаруживаться добавочные дольки плаценты. Они представляют собой отдельно лежащие участки плацентарной ткани, которые соединяются с основной плацентой сосудами, проходящими между оболочками. Весьма важным является установление диагноза добавочных долек плаценты до родов, поскольку при их наличии может возникнуть ряд осложнений. Добавочная долька может задержаться в полости матки, что приведет к возникновению кровотечения в послеродовом периоде. Кроме того, предлежание добавочной дольки или питающих ее сосудов, которые могут повреждаться, приводит к угрожающему кровотечению из плодовых сосудов. Низкое расположение плаценты также довольно часто встречается на сроке беременности до 26 недель. Как правило к 30 неделям беременности край плаценты "поднимается" выше от внутреннего зева за счет роста матки. Но на момент выявления низкого расположения плаценты сохраняется риск прерывания беременности, кровотечения ввиду отслойки плаценты. Вам необходимо проконсультироваться с Вашим лечащим врачом. С уважением, Бондаренко Екатерина Николаевна
Консультация врача гинеколога на тему «УЗИ 21 нед низкая планцентарность добавочная доля плаценты» дается исключительно в справочных целях. По итогам полученной консультации, пожалуйста, обратитесь к врачу, в том числе для выявления возможных противопоказаний.
УЗИ при добавочной доле плаценты
Плацента формируется из базальной части децидуальной оболочки и разросшихся ворсин ветвистого хориона. Большинство ворсин «плавают» в крови матери, циркулирующей в межворсинчатом пространстве. Поверхность ворсин покрыта синцитиотрофобластом, поверхность которого имеет микроворсинки для резорбции. Цитотрофобласт образует сплошной слой в первой половине беременности, во второй половине беременности ворсины утрачивают цитотрофобласт.
Материнская часть плаценты представляет собой утолщенную часть децидуальной оболочки. В ней образуются углубления, в которых циркулирует материнская кровь и в которые погружаются ворсины. Между углублениями образуются выступы (перегородки), в которых проходят спиральные маточные артерии и к которым прикрепляются якорные ворсины. Клиническая картина многих осложнений беременности, развивающихся во II—III триместрах беременности, часто служит проявлением патологического процесса, сформировавшегося еще в период плацентации.
В современной литературе относительно возможностей оценки структуры и функции плаценты существуют совершенно полярные точки зрения — от традиционной приверженности к оценке ее структуры до полного отрицания данной оценки. В разные годы проводились попытки при помощи структуры плаценты уточнить степень зрелости внутриутробного плода, выявить течение внутриутробной инфекции. Большинство из предложенных критериев имеет ограниченное значение в диагностике антенатальной патологии и может быть интерпретировано только в совокупности данных, полученных при УЗИ. Во многих ситуациях выявляемые при эхографии нарушения структуры плаценты бесспорны и играют важную роль в оценке и прогнозировании течения гестации.
Аномалии локализации. Низкое расположение плаценты: край плаценты определяется менее чем на 6 см от уровня внутреннего зева во II и III триместрах беременности. Предлежание плаценты определяют в случае, если ткань плаценты перекрывает внутренний зев шейки матки. Виды предлежания: полное, частичное, краевое [2, 3].
Особенности структуры. Старение плаценты — инволютивно-дистрофические процессы, которые происходят с увеличением срока беременности, имеют эхографические признаки. По классификации P. Grannum, при неосложненном течении беременности плацента последовательно проходит степени созревания от 0 до III. Степень обнаруживается в сроке до 30 нед; I степень в 27—36 нед; II степень в 34—39 нед; III степень после 36 нед. Ультразвуковые признаки преждевременного созревания плаценты: обнаружение II степени до 32 нед; III — до 36 нед (цит. по [4]). Если нет задержки роста и нарушений гемодинамики плода, кальциноз плаценты следует рассматривать как фактор риска снижения функциональной активности плаценты.
Приращение (врастание) плаценты. По данным литературы [5—10], placenta creta является редкой формой плацентарных аномалий — около 15% случаев среди всех наблюдений приросшей плаценты. Заболеваемость возросла в 10 раз за последние 50 лет, что отражает быстро растущее число кесаревых сечений. Врастание плаценты является результатом частичного или полного отсутствия губчатого слоя децидуальной оболочки вследствие атрофических процессов в эндометрии. Различают три варианта инвазии плаценты: pl. accreta, pl. increta, pl. percreta. Эта классификация условная, поэтому в настоящее время рекомендуют употреблять термин creta [11].
Ультразвуковые признаки аномального прикрепления плаценты: расположение плаценты в зоне рубца на матке; истончение или отсутствие миометрия на отдельных участках в зоне расположения плаценты; лакуны в структуре, диффузное утолщение плаценты; диффузный или локальный интраплацентарно-лакунарный кровоток с высокоскоростным турбулентным потоком венозного типа; типичный хориальный кровоток в атипичном месте; патологическое сосудистое соединение плаценты с мочевым пузырем с низкорезистентным артериальным плацентарным кровотоком; расширение периферических субплацентарных васкулярных каналов с венозным пульсационным потоком над шейкой матки [5—10].
Ретрохориальные гематомы, отслойки плаценты. Отслойка плаценты возникает вследствие нарушения ее прикрепления к стенке матки, что приводит к кровотечению из сосудов децидуальной оболочки.
Частота преждевременной отслойки нормально расположенной плаценты (ПОНРП) колеблется от 20,0 до 45,1% [12—14].
Среди причин ПОНРП называют гипертоническую дисфункцию миометрия [15], гипертоническую болезнь, травмы живота, курение, отслойки и субхориальные гематомы в анамнезе [16—18]; восходящий амниохорионит, многократные аборты, привычное невынашивание, преэклампсию, аутоиммунные заболевания [13, 19], а также аденомиоз плацентарного ложа и хронический эндометрит [15].
Современная гипотеза ПОНРП [16, 17] предполагает участие в отслойке в условиях дефицита протеина C и протромбина гемореологических и генетических факторов в сочетании с доминированием генетических дефектов гемостаза — мутации фактора V Лейдена. Утверждают, что первичные гемореологические нарушения в плаценте обусловлены структурными изменениями микроворсинок или щеточной каемки синцитиотрофобласта (СЦТБ), с нарушением их целостности, высоты и регулярности распределения на поверхности клеток в условиях нарушенного гемостаза [20]. Деструкция микроворсин сочетается с недостаточностью первой, второй волны инвазии цитотрофобласта и децидуализации, а также склерозом базального эндометрия, возникающего в исходе эндометрита [20, 21]. Развившийся дисбаланс между гиперкоагуляционными возможностями материнской крови и противосвертывающей системой микроворсинок сопровождается нарушениями маточного и плацентарного кровообращения. Изменения гемостаза — причина и следствие ПОНРП. В развитии ПОНРП большое значение придают антифосфолипидному синдрому (АФС), генетическим дефектам гемостаза (мутация фактора V Лейдена, дефицит ангиотензина-II, дефицит протеина C и пр.), предрасполагающим к тромбозам. Тромбофилия, развивающаяся вследствие этих нарушений, препятствует полноценной инвазии трофобласта, способствуя дефектам плацентации, ПОНРП [20].
Выявлено 4 взаимосвязанных механизма развития ПОНРП. Первые 2 предусматривают расстройства гемодинамики в маточно-плацентарной области в период нидации, имплантации и плацентации, сочетающиеся с нарушением инвазии цитотрофобласта и, следовательно, незавершенным ремоделированием спиральных артерий. Последующие механизмы ПОНРП включают нарушение целостности СЦТБ ворсин с локальным снижением активности антикоагуляционных механизмов, а также приобретенные и врожденные тромбофилии. Указанные механизмы приводят к морфологическим нарушениям в последе и нарушениям кровообращения в межворсинчатом пространстве [22].
В ранние сроки беременности при отслойке амниотических оболочек прогноз более благоприятный, чем при отслойке ворсистого хориона. Если площадь отслойки плодного яйца занимает менее ¼ площади — прогноз благоприятный; при гематомах, отслаивающих 1/3 площади хориона и более, может наступить внутриутробная гибель эмбриона [23].
Типы отслойки плаценты. По отношению к амниотическим оболочкам:
— ретроплацентарный — между плацентой и миометрием;
— субхориальный — между плацентой и амниотической оболочкой (не имеет клинической симптоматики).
По месту формирования гематомы:
— центральная отслойка плаценты;
— краевая отслойка, чаще встречается при низком расположении, предлежании плаценты;
— субамниотические гематомы, которые формируются вследствие разрыва хориальных сосудов около корня пуповины.
Утолщение плаценты чаще всего происходит при иммунных конфликтах, инфекционных процессах, сахарном диабете, тромбофилических состояниях.
Расширение межворсинчатого пространства — один из самых частых ультразвуковых симптомов при структурных изменениях плаценты. При УЗИ выявляются множественные гипоэхогенные включения в плаценте различной локализации, неправильной формы, с ламинарным током крови в них. Расширение межворсинчатого пространства может быть проявлением патологии свертывающей системы крови, плацентарной недостаточности [22].
Добавочная доля плаценты (placenta bilobata). Диагностируется на основании выявления участков плацентарной ткани, между которыми имеется свободная зона. В послеродовом периоде может осложниться отрывом добавочной дольки, ее задержкой в полости матки и послеродовым кровотечением [23].
Кольцевидная плацента (placenta membranacea). Развивается вследствие нарушения дифференциации на ворсинчатый и гладкий хорион. Характеризуется большой площадью прикрепления, в том числе в области внутреннего зева, притом ее толщина даже в конце беременности не превышает 10 мм. Может сочетаться с патологическим прикреплением, задержкой роста плода (ЗРП), преждевременными родами, антенатальной гибелью плода [24].
Плацента, окруженная валиком (placenta circumvallata). Относится к экстрахориальному типу плацентации, при котором плодовый край плаценты поднят, завернут, а амниальные оболочки отходят не от края плаценты, а от ее внутренней (материнской) поверхности. При эхографии чаще всего визуализируется перетяжка между полюсами плаценты, так называемая плацентарная полка, состоящая из амниальных оболочек. Данный ультразвуковой признак визуализируется во II триместре и не визуализируется в III триместре беременности. Оптимальный срок для выявления — 13—14 нед, первое скрининговое УЗИ. При данной патологии несколько чаще встречаются ЗРП, гипоксия плода, дородовое излитие околоплодных вод, преждевременные роды, кровотечение в родах [25].
Субамниотические кисты плаценты. Анэхогенные однокамерные образования над плодовой поверхностью плаценты. Размеры от 5 до 7—8 см, чаще всего являются следствием субамниотических гематом, возникающих в конце I или начале II триместра.
Хорионангиома плаценты. Доброкачественная опухоль плаценты, размеры которой могут варьировать от нескольких миллиметров до 7—8 см, как правило, одиночная, но может быть представлена несколькими мелкими узлами. Обычно она располагается на плодовой поверхности плаценты.
При УЗИ представляет собой образование с четкими контурами, неоднородной эхоструктурой с кистозным и солидным компонентом. Иногда хорионангиомы бывают гомогенными с множественными перегородками или пониженной эхогенности с неоднородной структурой. В ряде случаев хорионангиома имеет эхографическое сходство с миоматозными узлами, гематомами в стадии организации, липомой плаценты. При цветовом допплеровском картировании (ЦДК) внутри опухоли визуализируются сосуды разного калибра. Осложнения хорионангиомы зависят от ее размеров [26].
Пузырный занос — это перерождение ворсин хориона в пузырьки с жидкостью, разрастание эпителия ворсин, особенно синцития.
Полный пузырный занос (ППЗ) — генетически обусловленное тотальное поражение трофобласта, хромосомный набор чаще диплоидный, 46ХХ, обе хромосомы — отцовские. В 3—13% встречается комбинация 46ХУ, где все хромосомы — отцовские. ППЗ характеризуется отсутствием признаков зародышевого и эмбрионального развития. Злокачественная трансформация возникает в 20% наблюдений, при 46ХУ чаще развивается метастатическая опухоль.
Неполный пузырный занос — частичное перерождение плаценты, при котором эмбрион продолжает развиваться, всегда триплоидный, с 1 материнской хромосомой (чаще — 69ХХУ, 69ХХХ, реже — 69ХУУ), имеются фрагменты нормальной плаценты и плода [27]. Эхографические критерии полного пузырного заноса: увеличение размеров матки, несоответствие сроку беременности, эмбриона и его частей в полости матки нет, содержимое полости — бесформенные гиперэхогенные структуры с множеством кистозных образований, граница опухоли и миометрия отчетливая, ровная, возможна визуализация расширенных сосудов миометрия.
Мезенхимальная дисплазия плаценты (МДП) — редкое нарушение, связанное с необычной аномалией стволовых ворсинок плаценты, характеризуется плацентомегалией, кистозной дилатацией и образованием везикул, сосудистыми аномалиями [28].
Ультразвуковая картина МДП достаточно характерна и заключается в диффузном утолщении плаценты, множественных кистозных полостях, занимающих часть плаценты или всю ее площадь. Кистозные полости при МДП имеют существенные отличия от частичного пузырного заноса: размеры кист позволяют дифференцировать их в виде отдельных округлых анэхогенных структур с ровными четкими контурами, гладкой внутренней поверхностью. Архитектоника сосудистой сети не нарушена, топография плацентарных сосудов соответствует строению нормальной сосудистой сети плаценты. Извитые, расширенные сосуды стволовых ворсин могут четко определяться при ЦДК.
Вирусные инфекции. Изучение плаценты при вирусной инфекции проводится уже несколько десятилетий. Впервые еще в 1965 г. [29] отмечен ряд изменений морфологической картины плаценты при ее инфицировании вирусами простого герпеса: неровные контуры ядра с неравномерно распределенным хроматином; крупные, гиперхромные, бесструктурные ядра, цитоплазма амниоцитов оксифильная либо слегка базофильная, ацидофильный некроз значительных участков амниона, отечность стромы [30, 31]. В хориальной пластинке и ворсинчатой строме обнаруживаются группы клеток с гиперхромными ядрами, скопления лимфоидных клеток [31]. Поражение сосудов ворсинчатого хориона разного калибра проявляется отеком, утолщением стенок, очаговыми или диффузными инфильтратами стенок, сужением или даже облитерацией сосудов. В межворсинчатом пространстве — небольшие скопления лимфоидных клеток и плазмоцитов, отложения фибрина и реже кровоизлияния. В части ворсин обнаруживались мелкие пылевидные или более крупные глыбки кальция. Характерно также наличие кальциноза, фиброза, образования кист. В оболочках плаценты изменения были такого же рода. Они характеризовались прогрессирующим поражением плаценты с наличием в инфильтратах плазмоцитов, периваскулярным или диффузным фиброзом стромы ворсин. В сосудах отмечался тромбоз с облитерацией просветов и кальцинозом. Число капилляров в ворсинах резко снижено. При герпесе в ткани плаценты возникают характерные структурные изменения всех слоев с поражением как эпителиальных структур, так и сосудистого русла [31, 32].
При УЗИ плаценты при инфекционных заболеваниях картина неспецифична: в структуре плаценты определяются мелкие расширения межворсинчатых пространств, утолщение плаценты, преждевременное старение и кальциноз [32].
Вирусный гепатит. Среди всех известных нозологических форм наиболее актуальными являются гепатиты В и С [33]. В литературе описаны следующие морфологические изменения в плаценте: гипоплазия плаценты — в 24% наблюдений, нарушение созревания ворсин — в 32%, диссоциированное созревание, инфаркты, псевдоинфаркты — в 30%, аномалии развития сосудов пуповины — в 8%, плацентит — в 17%, хориоамнионит — в 52% [28]. Ультразвуковые признаки также неспецифичны и характерны для плацентарной недостаточности: увеличение или уменьшение толщины плаценты (диффузное или локальное утолщение плаценты, «тощая» плацента); изменение индекса амниотической жидкости (многоводие или маловодие); преждевременное старение и кальциноз плаценты [34].
Такие же изменения характерны и для других инфекционных заболеваний, таких как цитомегаловирусная инфекция [32].
Сахарный диабет. Для последов родильниц с сахарным диабетом (СД) характерной морфологической картиной является незрелость ворсинчатого дерева с отложением фибpинoидa мeжду вopcинками. При этом частота диссоциированного и преждевременного созревания ворсин (6,5% против 6,4%) одинакова при наличии или в отсутствие диабетической фетопатии. Состояние сосудистого дерева плацент у беременных с СД характеризуется наличием облитерационной ангиопатии, которая чаще встречается при СД 1-го типа (52,4%), реже при гестационном СД (38,1%) и СД 2-го типа (9,5%). При эхографии отмечаются утолщение плаценты и расширение межворсинчатых пространств без специфических структурных изменений [35—37].
Тромбофилии. Беременность всегда сопровождается состоянием гиперкоагуляции, что связано с повышением уровня фибриногена, протромбина, развивается так называемая гравидарная тромбинемия, значительно — на 50—80% — возрастает уровень FVIII, FIX, FX факторов свертывания крови. Одновременно снижается активность системы фибринолиза и физиологических антикоагулянтов: повышается активность ингибитора активатора плазминогена с одновременным повышением уровня активаторов плазминогена — t-PA, u-PA, FXII [38—41]. На фоне тромбофилии происходят также изменения в плаценте: нестойкость баланса гемостаза в системе мать—плацента возникает в течение осложненной беременности, когда под влиянием ряда факторов появляются многочисленные повреждения эпителиального покрова ворсин плаценты, приводящие к нарушению щеточной каймы, оголению базального слоя и даже стромы ворсин и высвобождению дополнительных плацентарных коагулирующих агентов. Последнее сопровождается активацией внешней системы свертывания, а в дальнейшем запускает внутренний путь коагуляции материнской крови в межворсинчатом пространстве.
Морфологические исследования последа при тромбофилии у матери выявили многочисленные структурные изменения, связанные с гиперкоагуляцией: в интервиллезном пространстве — очаги отложения фибриноида с замуровыванием ворсин; псевдоинфаркты, тромбы, кровоизлияния в децидуальной базальной пластине; увеличение объемной плотности межворсинчатого фибриноида в 5—10 раз; уменьшение объемной плотности терминальных ворсин в 2—3 раза; уменьшение объемной плотности базальной пластины в 1,4—1,2 раза, что может способствовать развитию преждевременной отслойки плаценты.
При наследственной тромбофилии в плаценте была выявлена незрелость ворсин (варианты промежуточных дифференцированных ворсин и диссоциированного созревания котиледонов) [42—44].
В настоящее время ультразвуковая картина плаценты при тромбофилии не описана, хотя логично предполагать, что эти патологические процессы будут отражаться в структурных особенностях плаценты при эхографии. Клиническую целесообразность данных исследований подтверждают слова А.Н. Дробинской и соавт. [44]: «Возможность клинико-морфологической диагностики наследственной тромбофилии позволяет определить причину осложнений и прогноз беременности, а при своевременной коррекции гемореологических нарушений у беременных с тромбофилией они имеют шанс выносить беременность. Знание морфологических основ плацентарной недостаточности при наследственной тромбофилии необходимо для совершенствования методов своевременной коррекции гемореологических нарушений».
Заключение
Таким образом, структурные изменения в плаценте при УЗИ во многих ситуациях играют важную роль в оценке и прогнозировании течения беременности, например при аномалиях локализации и прикрепления, гематомах, отслойках и кистах плаценты, трофобластических заболеваниях. Однако большинство эхографических критериев встречаются при самых различных патологических состояниях и могут быть интерпретированы только при анализе совокупности данных, полученных при УЗИ. Кроме того, представляет научный интерес и имеет большое практическое значение изучение особенностей изменений в плаценте при наследственной тромбофилии, которые могут быть выявлены при ультразвуковом (допплерометрическом) исследовании.
Сведения об авторах
Добавочная доля плаценты на УЗИ по беременности
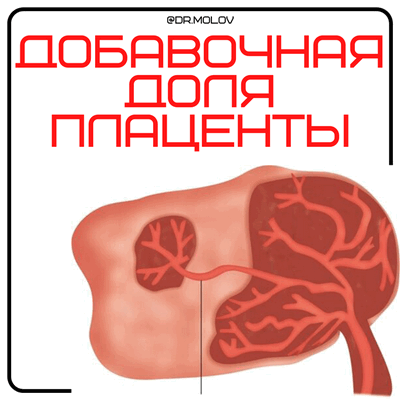
?Добавочная долька плаценты(ДДП) — Состояние при котором вместе с основной долей с корнем пуповины, появляются еще несколько долек, располагающиеся на этой же или на другой стенке матки, соединенных сосудами с основной долей.
На приеме пациентка 20 недель беременности, жалоб нет, скрининги все в норме.
?При осмотре привлекает внимание расположение основной плаценты и корня пуповины по передней стенке, дополнительная долька по задней стенке соединенная веной и артерий с основной долей. Самое интересное что основная доля по передней стенке меньшим размером чем добавочная долька. Возможно со временем соотношение размеров измениться.
?Добавочная долька плаценты(ДДП) — Состояние при котором вместе с основной долей с корнем пуповины, появляются еще несколько долек, располагающиеся на этой же или на другой стенке матки, соединенных сосудами с основной долей. Частота составляет 3-1000 случ бер и возникает чаще у беременных в возрасте, после ЭКО.
?Такое состояние опасно тем что эти добавочные дольки, из-за нарушения кровоснабжения могут вызывать задержку развития, отслаиваться, вызывая гибель плода. Также при прохождении соединяющих сосудов в области зева возникает предлежание сосудов,(Vasa previa) которая является очень грозным состоянием возможен риск разрывов этих сосудов во время родов.
?Также наличие ДДП опасно и в послеродовом периоде. Они могут остаться в полости матки, вызывая кровотечение или воспалительные осложнения.
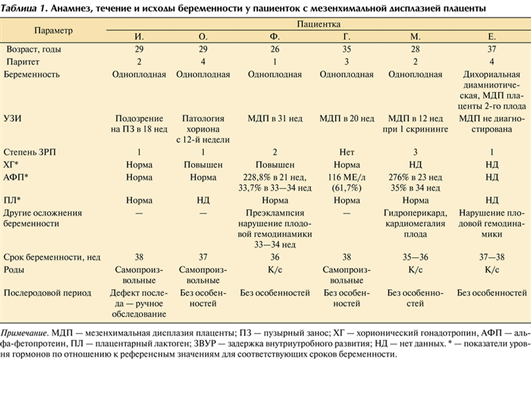
Возраст женщин с одноплодной беременностью составил 26—35 лет (табл. 1), Таблица 1. Анамнез, течение и исходы беременности у пациенток с мезенхимальной дисплазией плаценты Примечание. МДП — мезенхимальная дисплазия плаценты; ПЗ — пузырный занос; ХГ — хорионический гонадотропин, АФП — альфа-фетопротеин, ПЛ — плацентарный лактоген; ЗВУР — задержка внутриутробного развития; НД — нет данных. * — показатели уровня гормонов по отношению к референсным значениям для соответствующих сроков беременности. во всех случаях беременность наступила спонтанно. Одна женщина была первородящей, остальные имели в анамнезе срочные самопроизвольные роды (масса новорожденных 3180—4040 г, все дети здоровы).
Пациентка 37 лет с двойней имела в анамнезе срочные оперативные роды и 2 внематочные беременности; настоящая беременность наступила в результате экстракорпорального оплодотворения и переноса эмбриона.
Течение настоящей беременности у первородящей пациентки осложнилось преэклампсией умеренной степени, еще у одной пациентки отмечены кардиомегалия и гидроперикард плода. Задержка внутриутробного развития разной степени отмечена в 5 наблюдениях.
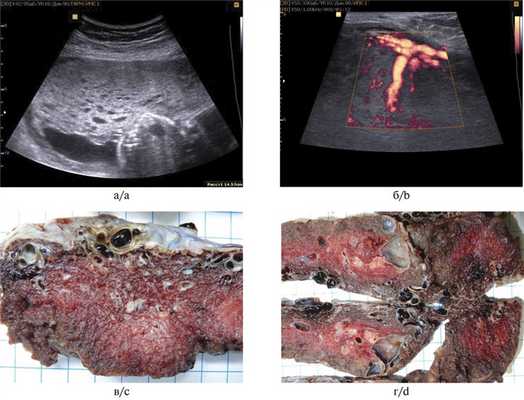
Изменение плаценты было впервые диагностировано по результатам УЗИ на разных сроках беременности — 12—31 нед. В большинстве случаев был первично поставлен диагноз ЧПЗ или подозрение на него. При обследовании в МОНИИАГ по результатам УЗИ диагностирована МДП (рис. 1, а, Рис. 1. Мезенхимальная дисплазия плаценты. а, б — ультразвуковые признаки: а — диффузное утолщение и множественные кистозные включения в плаценте. Структура плаценты изменена, имеется множество жидкостных включений различного диаметра от 4 до 12 мм. Включения в основном овоидной и округлой формы, границы ровные, четкие. Граница плацентарной ткани и миометрия отчетливая; б — в структуре плацентарной ткани множественные локусы кровотока. Плацентарные сосуды большого диаметра. Архитектоника сосудов плаценты не изменена; в, г — макроскопические изменения плацент: крупные сосуды хориальной пластинки и стволовых ворсин, кисты разных размеров. б).
Уровень чХГ был нормальным у 2 пациенток, повышенным — у 2. К сожалению, показатели еще 2 пациенток не известны. Уровень АФП у 3 пациенток был нормальным, у 2 имел сходную динамику: высокий уровень белка (до 275%) на сроке 21—23 нед со снижением до 33—35% к сроку 33—34 нед (см. табл. 1).
Роды самопроизвольные в 3 случаях, в 3 произведено кесарево сечение, показаниями к которому явились: нарастание тяжести преэклампсии, нарушение гемодинамики плода, несостоятельность рубца после кесарева сечения (пациентка с двойней). Срок родоразрешения составил 35—38 нед. У 1 пациентки проведено ручное обследование в связи с дефектом последа, других осложнений послеродового периода у пациенток не отмечено.

Лишь 1 ребенок родился с нормальной массой (3580 г при сроке беременности 38 нед), в остальных случаях отмечена задержка роста плода 1—3-й степени (табл. 2). Таблица 2. Состояние новорожденных и макроскопическая характеристика плацент при мезенхимальной дисплазии Примечание. ЗВУР — задержка внутриутробного развития; РДС — респираторный дистресс-синдром; ДМПП — дефект межпредсердной перегородки; ППК — плацентарно-плодовый коэффициент; НД — нет данных. * — масса девочки 1-й из двойни 2820 г, длина 47 см. Оценка по шкале Апгар у 4 детей составила 8—9 баллов, у 2 — 7—8 баллов. Соотношение полов м/ж составило 3:3. Ранний неонатальный период протекал без осложнений у 3 детей, у 3 было диагностировано перинатальное поражение ЦНС 1-й степени, у одного из них в сочетании с респираторным дистресс-синдромом, у второго — с респираторным дистресс-синдромом и дефектом межпредсердной перегородки.
Масса плацент при МДП была существенно выше средней от 771 до 1498 г, что составило 95,8—100‰ (см. табл. 2). Лишь в 1 случае, у пациентки с преэклампсией, масса плаценты соответствовала средним показателям, составляя 51‰. Выраженные различия выявлены между плацентами новорожденных из двойни (масса одного плода 2820 г, плаценты 489 г, масса второго плода 2560 г, плаценты 771 г при сроке беременности 37—38 нед). В 3 случаях имелось краевое или оболочечное прикрепление пуповины. Несмотря на большую массу плацентарного диска, во всех наблюдениях толщина пуповины не превышала 1,5 см, а в половине случаев была менее 1 см. Хориальная пластинка с выбухающими резко извитыми сосудами с широким просветом, в паренхиме определялись кистозные полости со светлым прозрачным содержимым, белесоватые тяжи с крупными сосудами в них. Степень изменений значительно варьировала (см. рис. 1, в, г).
При микроскопическом исследовании основные изменения наблюдались в стволовых ворсинах: резкое увеличение их размеров, отек стромы разной степени выраженности во многих случаях с формированием кистозных полостей (рис. 2, а, б). Сосуды в пораженных ворсинах присутствовали, но их количество и размеры значительно варьировали (см. рис. 2, в, г). Периферические отделы ворсинчатого дерева были сформированы правильно, представлены дифференцированными промежуточными и терминальными ворсинами в разных соотношениях (см. рис. 2, д).
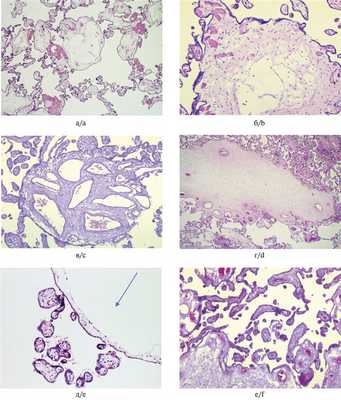
Рис. 2. Микроскопические изменения плацент при мезенхимальной дисплазии. а, б — отечные кистозно-измененные стволовые ворсины с сохранными сосудами, без пролиферации трофобласта; в, г — разная степень васкуляризации и отека гигантских ворсин; д — нормально сформированные терминальные ворсины рядом с кистозно-измененной стволовой ворсиной (указана стрелкой); е — плацента пациентки с преэклампсией: в левом нижнем углу фрагмент гигантской стволовой ворсины, терминальные ветви мелкие, хаотично ветвящиеся, с узкими немногочисленными сосудами. Окраска гематоксилином и эозином. а, г — ×50, в, е — ×100, б, д — ×200.
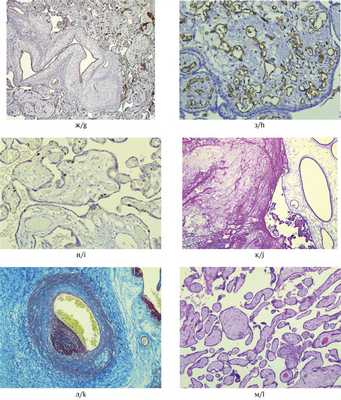
Рис. 2. Микроскопические изменения плацент при мезенхимальной дисплазии. ж, з— варианты патологического строения сосудов. Иммуногистохимическая реакция с антителами к СD34; и — иммуногистохимическая реакция с антителами Ki-67. Позитивная ядерная реакция в единичных клетках цитотрофобласта и стромы ворсин; к — скопление фибрина в межворсинчатом пространстве. Окраска гематоксилином и эозином; л — пристеночный тромб в сосуде хориальной пластинки. Окраска MSB; м — фетальная тромботическая васкулопатия, группа бессосудистых ворсин. Окраска гематоксилином и эозином.
Существенно отличалась плацента пациентки с преэклампсией: она имела нормальную массу 409 г (51 ‰), макроскопически число кистозных образований было небольшим. При гистологическом исследовании выявлено характерное для МДП увеличение размеров стволовых ворсин, отек их был умеренно выраженным, число сосудов небольшим. Морфология концевых ветвей была типична для преэклампсии, терминальные ветви представлены тонкими ветвящимися структурами с малочисленными узкими сосудами и большим числом синцитиальных узлов (см. рис. 2, е).
Строение и степень васкуляризации ворсин значительно различались как в разных отделах одной плаценты, так и между плацентами. В ряде случаев отмечены гигантские, извитые сосуды не только в хориальной пластинке, но и в стволовых ворсинах (см. рис. 2, ж). В других ворсинах имелись многочисленные узкие сосуды, нередко неправильной формы (см. рис. 2, з). Васкуляризация промежуточных и терминальных ворсин в большинстве случаев соответствовала норме, но в отдельных участках встречался хорангиоз. Экспрессия Ki-67 наблюдалась в немногочисленных клетках цитотрофобласта и стромы ворсин (см. рис. 2, и). Существенных особенностей экспрессии гладкомышечного актина и десмина в плацентах при МДП не выявлено.
Наблюдения подтвердили высокую частоту тромботических осложнений со стороны как матери, так и плода. В большинстве наблюдений в межворсинчатом пространстве был увеличен объем фибриноида, имелись тромбы разной давности (см. рис. 2, к). В четырех плацентах имелись признаки тромботической фетальной васкулопатии (см. рис. 2, л, м).
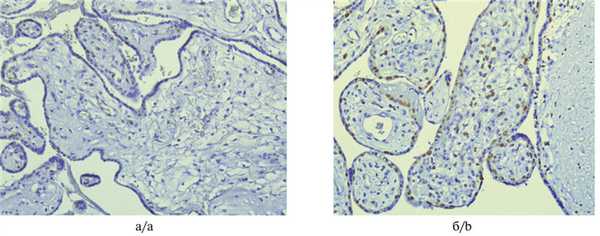
Экспрессия р57 в исследованных плацентах была вариабельной (рис. 3). Рис. 3. Варианты экспрессии р57 при МДП, иммуногистохимическая реакция. а — единичные позитивные клетки цитотрофобласта, ×100; б — позитивные клетки в цитотрофобласте и строме ворсин, ×200. В 3 наблюдениях реакция была положительной в клетках ворсинчатого цитотрофобласта при отсутствии экспрессии в строме ворсин. В 2 других наблюдениях экспрессия была очаговая: типичная для нормальной плацентарной ткани экспрессия р57 (окрашивание клеток цитотрофобласта и стромы ворсин) чередовалась с участками с полным отсутствием данного маркера. В одном наблюдении распределение р57-позитивных клеток соответствовало таковому в нормальной плаценте.
Типичные морфологические признаки МДП: аномалия сосудов хориальной пластинки и стволовых ворсин, увеличение размеров и отек стволовых ворсин при нормальном формировании концевых ветвей ворсинчатого дерева, отсутствие пролиферации ворсинчатого трофобласта отмечены во всех наблюдениях. Плацентомегалия выявлена в 5 из 6 наблюдений. Плацента пациентки с преэклампсией и типичными ультразвуковыми и морфологическими признаками МДП имела также и существенные отличия от остальных изученных плацент. В данном наблюдении не выявлено плацентомегалии и отмечены характерные для преэклампсии изменения промежуточных и терминальных ворсин. Указанные особенности следует учитывать при анализе наблюдений МДП в сочетании с преэклампсией.
Сопоставление результатов ультразвукового исследования с морфологической картиной заболевания свидетельствует о наличии характерных для МДП ультразвуковых признаков, которые следует учитывать при дифференциальной диагностике с пузырным заносом.
Изменения показателей уровня хорионического гонадотропина и альфа-фетопротеина явились непостоянными признаками, таким образом не могут быть критериями для дифференциального диагноза МДП.
Высокая частота тромботических осложнений как в межворсинчатом пространстве, так и в фетальных сосудах, задержка внутриутробного развития плода, наличие внутриутробной гипоксии и нарушений периода адаптации новорожденных при МДП должны учитываться при определении тактики ведения пациенток и новорожденных.
Мы выявили значительную вариабельность экспрессии р57 при МДП, что ограничивает возможности определения данного маркера для диагностики МДП, а также косвенно свидетельствует о генетической гетерогенности указанной патологии. Следует настоятельно рекомендовать проведение генетического исследования при МДП в связи с данными о возможном наличии мозаицизма не только в плаценте, но и в тканях плода.
Аномалии плаценты
Аномалии плаценты - это нарушения нормальной локализации, прикрепления или формы последа. Могут протекать бессимптомно, характеризоваться признаками фетоплацентарной недостаточности со второго триместра беременности, проявляться угрозой преждевременных родов или кровотечением. Диагностика проводится по данным УЗИ, фетометрии и кардиотокографии плода. Специфическое лечение не разработано. Терапия направлена на поддержание кровотока, устранение признаков гипоксии и пролонгирование беременности. По показаниям после родов проводится ручное отделение плаценты, гистерэктомия.
МКБ-10

Общие сведения
Аномалии плаценты встречаются с различной частотой. Низкая плацентация, предлежание плаценты в третьем триместре наблюдается у 3% беременных. Плотное прикрепление последа, приращение к миометрию чаще встречается у беременных с рубцами на матке, перенесших большое количество абортов и выскабливаний, с высоким паритетом родов. За последние десятилетия отмечается увеличение количества приращений последа в 50 раз, что связывают с ростом показаний для кесарева сечения. Аномалии плаценты ведут к повышению частоты кровотечений в последовом и послеродовом периоде, осложнениям со стороны плода.
Причины
Аномалии плаценты возникают как результат компенсаторно-приспособительных реакций при патологических состояниях эндометрия и миометрия. Врастание, низкая плацентация и изменение формы происходят по одним и тем же причинам. Чаще всего развитие аномалии наблюдается при наличии следующих предрасполагающих факторов:
- Патология эндометрия. Воспалительные заболевания в анамнезе, частые аборты потенцируют дистрофические изменения слизистой оболочки, нарушение рецептивных свойств эндометрия. Бластоциста в поиске оптимального места имплантации может спуститься из дна матки в нижний сегмент, а плацента - плотно прикрепиться.
- Дистрофические изменения в матке. При миоме отмечаются нарушения кровотока, провоцирующие глубокое проникновение ворсин хориона. У женщин после кесарева сечения в месте рубца образуется неполноценный базальный слой слизистой, что приводит к глубокому врастанию плаценты. Если из-за недостатка питания происходит гибель части ворсин хориона, формируется двудолевой послед.
- Чрезмерная активность хориона. Глубокое врастание ворсин связывают с выделением зародышем большого количества хорионического гонадотропина. Повышение уровня гормона в первом триместре может быть связано с хромосомными аномалиями плода, в норме наблюдается при беременности двойней.
- Гормональные нарушения. Рост ворсин хориона сдерживается эстрогенами. При гормональной недостаточности происходит их врастание в мышечный слой матки и формирование приращения плаценты.
- Kiss1-ген. Открыт в 1999 году, выявляется во многих злокачественных опухолях, а также клетках синцитиотрофобласта. Ген стимулирует глубокую инвазию клеток синцитио- и цитотрофобласта в миометрий. Активность гена возрастает при использовании прогестагенов для сохранения беременности на ранних сроках.
Патогенез
Аномалии плаценты являются результатам патологий матки, возникших до наступления беременности. Воспалительные процессы и дистрофические изменения приводят к недостаточной васкуляризации отдельных участков децидуальной оболочки. Это вызывает гибель некоторых ворсин хориона на раннем сроке вынашивания. Формируются участки истончения плаценты и различные дефекты. При полной гибели ворсинчатого хориона образуются очаги без плацентарной ткани (окончатая плацента). При наличии уходящих в сторону сосудов выявляется добавочная долька, которая располагается на отдалении от края детского места.
В маточном дне кровоток усилен за счет ветвей яичниковой артерии. Но в случаях, когда бластоциста имплантируется в нижнем сегменте, она испытывает дефицит кровоснабжения, что потенцирует глубокую инвазию ворсин хориона в миометрий, поэтому низкая плацентация может сопровождаться врастанием плаценты. Иногда предлежание связано с чрезмерным увеличением размеров последа при многоплодной беременности. При гистологическом исследовании отмечаются преждевременные инволюционно-атрофические изменения, вызванные недостаточным кровотоком и перерастяжением нижнего сегмента.
Классификация
Единая классификация аномалий последа не разработана. Патологию условно разделяют на три типа, которые связаны между собой патогенетически. Из-за общего механизма развития различные аномалии могут сочетаться, что ухудшает прогноз и течение беременности. Специалисты в сфере акушерства выделяют следующие варианты аномалий плаценты:
- Нарушения локализации. Включают низкую плацентацию и предлежание плаценты. Полное предлежание диагностируется в 12 недель, практически не устраняется самостоятельно. Низкая плацентация к 3 триместру может сменяться нормальным прикреплением из-за увеличения объема матки и миграции плаценты.
- Аномалии прикрепления. Различают плотное прикрепление и приращение плаценты. Редко наблюдается сквозное прорастание с инвазией хориона в соседние органы. Также оно может быть диффузным (от стенки матки не отделяется все плодное место) или очаговым (врастание происходит на определенном участке).
- Аномалии формы. Плацента, состоящая из двух частей, называется двудолевой. При избыточном истончении диагностируется пленчатый тип. Поясной вид характеризуется образованием по краю плодного места вала, который является участком круговой отслойки или воспаления с отложением гиалина.
Симптомы аномалии плаценты
Данное состояние не всегда сопровождается клиническими симптомами. При двудолевой и окончатой разновидности плодного места, а также добавочной дольке признаки патологии во время беременности отсутствуют, сложности возникают в родах. Добавочная долька может отрываться и сохраняться в полости матки. Определяется гипотония, осложняющаяся кровотечением в раннем послеродовом периоде. Кровотечение в третьем периоде родов развивается при плотном прикреплении плаценты. Признаки отделения последа отсутствуют, а приемы, ускоряющие этот процесс, оказываются неэффективными.
Низкая плацентация сопровождается симптомами угрозы прерывания. Женщина периодически ощущает тянущие боли внизу живота, повышается тонус матки. При полном предлежании со 2 триместра наблюдаются периодические мажущие, иногда умеренные кровянистые выделения из влагалища. Опасность представляет массивное кровотечение, которое быстро приводит к острой гипоксии плода и геморрагическому шоку у беременной.
Осложнения
Патологии последа иногда провоцируют развитие плацентарной недостаточности и хроническую гипоксию плода. Ребенок отстает в росте, рождается с низким весом, хуже переносит период адаптации. Кровотечение при предлежании плаценты может начаться на любом сроке беременности. При несвоевременной помощи оно становится причиной внутриутробной гибели плода, а у матери возникает геморрагический шок и ДВС-синдром. Иногда аномалии прикрепления становятся показанием для экстирпации матки.
Диагностика
Скрининговое УЗИ-обследование проводится в 11 недель беременности, методика позволяет выявить первые признаки аномалии. Результаты повторного обязательного исследования в 21 и 32-34 недели указывают на прогрессирование патологии или уменьшение ее проявлений. Диагностика состояния проводится акушером-гинекологом и базируется на данных следующих методов:
- Физикальный осмотр. При фетоплацентарной дисфункции может определяться несоответствие размера живота сроку гестации. На предлежание плаценты указывает мягкая губчатая ткань над цервиксом. При осмотре в зеркалах могут обнаруживаться сгустки крови или жидкие выделения, которые являются признаком кровотечения.
- УЗИ матки. Патологическое расположение диагностируется уже в конце 1 триместра, но подтверждается только при последнем исследовании в 3 триместре. На полное предлежание указывает расположение последа сразу над внутренним зевом шейки. Нарушения прикрепления определяются по аномальному лакунарному кровотоку в толще миометрия.
- Фетометрия плода. Исследуется размер частей тела плода при помощи УЗИ. Недостаточность фетоплацентарного комплекса проявляется в отставании длины бедренной кости, плеча, копчико-теменного размера и головы. Может уменьшаться окружность живота. Параметры могут уменьшаться равномерно (симметричный тип задержки развития) или неравномерно (асимметричный тип).
- Кардиотокография. Оценивается сердечный ритм плода, его изменения при шевелении, маточных сокращениях. При хронической гипоксии снижается базальный ритм, количество акцелераций, увеличивается число децелераций, становится низкой вариабельность. Тяжесть гипоксии оценивается по балльной системе.
Лечение аномалии плаценты
Повлиять на аномалии локализации, формы или прикрепления медикаментозными или другими способами невозможно, поэтому лечение направлено на пролонгирование беременности, выбор оптимального срока и метода родоразрешения. Необходимо обеспечить улучшение питания плода и минимизировать последствия гипоксии. Аномалии прикрепления требуют экстренной хирургической помощи.
Консервативная терапия
При патологической локализации, выявленной на первом скрининговом УЗИ, применяются медикаментозные средства, улучшающие плацентарный кровоток. При повышении тонуса матки проводится токолитическая терапия раствором магнезии, назначается курс витамина В6 в сочетании с магнием. Мажущие выделения из половых путей при предлежании детского места являются показанием для экстренной госпитализации в отделение патологии беременных.
Консервативная терапия после родов может применяться при приращении последа, которое не удалось устранить ручным способом. Обязательным условием для медикаментозного лечения является отсутствие кровотечения. Используют цитостатики из группы антиметаболитов и ингибиторов фолиевой кислоты. Лекарственные средства вызывают самостоятельную резорбцию последа и позволяют сохранить матку, но не влияют на показатели гемостаза.
Хирургическое лечение
Хирургическая помощь необходима при таких аномалиях, как кровотечение, вызванное предлежанием плаценты, плотное прикрепление или истинное приращение, гипотоническое кровотечение при добавочной дольке. Предлежание, сопровождающееся кровотечением, является показанием для экстренного кесарева сечения вне зависимости от срока гестации. В остальных случаях применяются следующие методы:
- Ручное отделение последа. Используется при отсутствии признаков самостоятельного отделения, а также при гипотонии матки и кровотечении в последнем периоде родов. Манипуляция проводится под общей анестезией в родовом зале в присутствии анестезиолога-реаниматолога.
- Оперативное удаление плаценты. После предварительного лигирования сосудов матки, эмболизации маточных артерий или наложения компрессионных швов на матку плацента отделяется от стенки. Деваскуляризация матки позволяет избежать массивного кровотечения.
- Гистерэктомия. При неудачных попытках отделения последа с аномалиями прикрепления и продолжающемся кровотечении решается вопрос об удалении матки с сохранением придатков. Вмешательство проводится под эндотрахеальным наркозом.
Прогноз и профилактика
Аномалии формы детского места редко ухудшают прогноз течения беременности, иногда диагностируются случайно после родов. При аномалии прикрепления необходимо врачебное наблюдение для предупреждения осложнений. Профилактика заключается в отказе от абортов или использовании медикаментозных способов прерывания беременности. Женщинам рекомендуется применять барьерные методы контрацепции для защиты от инфекций, своевременно лечить воспаление половых органов. Кесарево сечение следует проводить строго по показаниям.
1. Акушерство. Национальное руководство/ Ппод ред. Айламазяна Э.К., Кулакова В.И., Радзинского В.Е., Савельевой Г.М. - 2009.
2. Морфологическая классификация повреждений плаценты/ Веропотвелян Н.П., Веропотвелян П.Н., Цехмистренко И.С., Бондаренко А.А., Усенко Т.В.// Здоровье женщины. - 2016 - №8 (114).
4. Диагностика, профилактика и органосохраняющие методы родоразрешения беременных с врастанием плаценты/ Хасанов А.А.// Казанский медицинский журнал. - 2016.
Читайте также:
- УЗИ, ЭхоКГ при брадиаритмии у плода
- Жилищный вопрос при шизофрении. Шизофрения и трудоустройство
- Гастринома (синдром Золлингера-Эллисона)
- Техника, этапы операции Латарже при передней плечелопаточной нестабильности в сочетании с костным дефицитом суставной впадины или головки плеча
- Примеры гемангиобластомы сетчатки у пожилых и при синдроме Маршалла-Стиклера
