УЗИ при солидном образовании придатков матки
Добавил пользователь Дмитрий К. Обновлено: 21.01.2026
Диагностика новообразований придатков матки является одной из самых сложных задач в практической гинекологии. В области придатков матки могут располагаться как истинные опухоли, так и опухолевидные образования, а также образования, исходящие из других орг
Abstract. Diagnosis of ovarian neoplasms is one of the most difficult tasks in practical gynecology. In the area of the uterine appendages, both true tumors and tumor-like formations, as well as formations emanating from other organs of the abdominal cavity and small pelvis, can be located. Difficulties in the timely diagnosis of ovarian tumors lie in the absence of clinically expressed precancerous conditions and are aggravated by their complex pathogenesis. Due to the high risk of malignant rebirth of ovarian tumors and the inability to diagnose a precancerous condition, the problem of early detection of ovarian neoplasm seems to be the most relevant. Today, it is possible to classify a tumor as malignant and determine its stage only after surgical operation with subsequent histological examination of removed tissues. Further patient treatment are based on the results of a histological examination. The description of this clinical case may help to enhance the capabilities and knowledge of practitioners in their approach to differential diagnosis of ovarian tumors. Patient N., 33 years old in April 2020, turned to the hospital named after D.D. Pletnev in the direction from the women's consultation with a diagnosis: left ovarian cyst, pain syndrome. The subject of interest of this clinical case is the differential diagnosis of ovarian neoplasm. Taking into account the results of the preliminary examination, we can think about a malignant ovarian neoplasm, relapse of the ovarian dermoid cyst, ovarian fibroma, uterine myoma with subserosal localization of node. That’s why an important task is to create optimal algorithms for diagnosing and routing patients in case of suspicion of an adnexal tumor. Modern diagnostics of ovarian tumors cannot be based on one research method, but requires a whole range of diagnostic measures that determine the tactics of introducing patients in each specific case. For citation: Safonova N. Е., Podzolkova N. М., Osadchev V. В., Babkov K. V., Fadeev I. Е. Differential diagnosis of ovarian neoplasm using contrast-enhanced ultrasound (clinical case) // Lechaschi Vrach. 2022; 5-6 (25): 14-19. DOI: 10.51793/OS.2022.25.6.002
Резюме. Диагностика новообразований придатков матки является одной из самых сложных задач в практической гинекологии. В области придатков матки могут располагаться как истинные опухоли, так и опухолевидные образования, а также образования, исходящие из других органов брюшной полости и малого таза. Трудности своевременной диагностики опухолей яичников заключаются в отсутствии клинически выраженных предопухолевых состояний и усугубляются их сложным патогенезом. Ввиду высокого риска злокачественного перерождения опухолей яичников и невозможности диагностировать предраковое состояние проблема раннего выявления новообразования яичника представляется наиболее актуальной. На сегодняшний день отнесение опухоли к категории злокачественной и определение ее стадии возможно только после оперативного вмешательства c последующим гистологическим исследованием удаленных тканей. Дальнейшая тактика ведения больной основывается на результатах гистологического исследования. Описание данного клинического случая может помочь расширить возможности и знания практикующих врачей в подходе к дифференциальной диагностике новообразований придатков. Пациентка Н., 33 лет, в апреле 2020 года обратилась в гинекологическое отделение ГБУЗ ГКБ им. Д. Д. Плетнёва по направлению из женской консультации с диагнозом: киста левого яичника, болевой синдром. Предметом интереса данного клинического случая является проведение дифференциальной диагностики новообразования яичника. Принимая во внимание результаты предварительного обследования, в плане дифференциальной диагностики можно думать о злокачественном новообразовании яичника, рецидиве дермоидной кисты яичника, фиброме яичника, миоме матки с субсерозным ростом узла. Поэтому важной задачей является создание оптимальных алгоритмов диагностики и маршрутизации пациенток при подозрении на опухоль придатков. Современная диагностика опухолей яичников не может основываться на одном методе исследования, а требует целого комплекса диагностических мероприятий, определяющих тактику ведения пациенток в каждом конкретном случае.
Диагностика новообразований придатков матки остается одной из самых сложных в практической гинекологии [1]. Ввиду высокого риска злокачественного перерождения опухолей яичников и невозможности диагностировать предраковое состояние, проблема раннего выявления новообразования яичника представляется наиболее актуальной [2]. Учитывая отсутствие выраженных клинических проявлений, в большинстве случаев пациентки откладывают посещение врача на неопределенный срок [3]. Диагностика образований придатков основывается на данных анамнеза, физикального и инструментального обследований. Физикальное исследование остается наиболее распространенным методом ранней диагностики [4]. При гинекологическом исследовании определяется наличие опухоли, ее локализация, величина, консистенция, подвижность, чувствительность, характер поверхности и взаимоотношение с органами малого таза. Проведение ректовагинального исследования позволяет исключить прорастание опухоли в смежные органы. В области придатков матки могут располагаться как истинные опухоли, так и опухолевидные образования, а также образования, исходящие из других органов брюшной полости и малого таза.
Трудности своевременной диагностики опухолей яичников заключаются в отсутствии клинически выраженных предопухолевых состояний и усугубляются их сложным патогенезом [5]. Несмотря на наличие таких высокотехнологичных методов диагностики, как компьютерная и магнитно-резонансная томография (КТ и МРТ), имеют место ошибки в установлении правильного диагноза. Ученые доказали, что это связано со многими факторами, в том числе человеческим [5]. Памятуя блестящее высказывание Е. М. Тареева: «Частые болезни встречаются часто, а редкие — редко», врач после исключения жизнеугрожающих и неотложных состояний акцентирует внимание на наиболее часто встречающихся заболеваниях. Редко встречающаяся патология способна сбить с толку не только молодых специалистов, которые не всегда сталкиваются с ней, но и опытных наставников.
На сегодняшний день отнесение опухоли к категории злокачественной и определение ее стадии возможны только после оперативного вмешательства c последующим гистологическим исследованием удаленных тканей. Дальнейшая тактика ведения больной основывается на результатах гистологического исследования.
Описание данного клинического случая способно помочь расширить возможности и знания практикующих врачей в подходе к дифференциальной диагностике новообразований придатков.
Клинический случай
Пациентка Н., 33 лет, в апреле 2020 г. обратилась в гинекологическое отделение ГБУЗ ГКБ им. Д. Д. Плетнёва по направлению из женской консультации с диагнозом: «Киста левого яичника, болевой синдром».
Из анамнеза: наследственность не отягощена. Хронических заболеваний не выявлено. Аллергический анамнез не отягощен.
Менструальная функция: менархе с 13 лет. Менструации регулярные, обильные, болезненные. Менструальный цикл по 7 дней через 27-28 дней. Последняя менструация - 23.03.2020 г.
Половая функция: замужем. Брак первый. Начало половой жизни с 18 лет. Боли, дискомфорта, контактных выделений не было.
Репродуктивная функция: беременностей не было. Контрацепция - прерванный половой акт.
Из перенесенных гинекологических заболеваний у пациентки - коагуляция эктопии шейки матки. В 2011 г. произведена лапароскопическая резекция левого яичника по поводу дермоидной кисты, диагноз подтвержден гистологически.
Общий осмотр: телосложение правильное, нормостенического типа. Рост - 177 см. Вес - 73 кг. ИМТ - 23,3 кг/м2.
Кожные покровы и видимые слизистые физиологической окраски, умеренной влажности. АД - 120/70 мм рт. ст. Пульс - 72 уд./мин.
Из анамнеза данного заболевания известно, что пациентка регулярно посещает гинеколога, раз в год проходит профилактический осмотр, планирует беременность. С февраля 2020 г. отмечает жалобы на периодическую тянущую боль внизу живота, усиливающуюся накануне и во время менструации. При гинекологическом осмотре - оволосение по женскому типу, наружные половые органы развиты правильно. Шейка матки конической формы, слизистая бледно-розовая, наружный зев точечный. При бимануальном влагалищном исследовании в малом тазу тело матки не увеличено, плотное, безболезненное, подвижное. Правые придатки не увеличены, область их безболезненная. В области левых придатков определяется чувствительное, плотное, ограниченно подвижное образование размером до 5-6 см. Инфильтрации параметрия нет. Своды глубокие, безболезненные. Выделения из половых путей слизистые, светлые.
Результаты клинико-лабораторного обследования, включающего общий и биохимический анализы крови, гемостазио-грамму, общий анализ мочи, находились в пределах нормы. Концентрация β-цепи хорионического гонадотропина человека (β-чХГ) в сыворотке крови составила < 1 МЕ/мл.
По данным ультразвукового исследования (УЗИ) органов малого таза матка anteversio, -flexio, с четкими, ровными контурами, размерами 52,2 × 45 × 57,4 мм. Стенки не утолщены, структура миометрия однородная. Полость матки не деформирована. М-эхо - 14,5 мм, соответствует 2-й фазе менструального цикла. В проекции левых придатков определяется округлое гипоэхогенное образование размерами 52 × 50 × 50 мм с четкими контурами, с кровотоком по периферии и в центральных зонах, индекс резистентности IR = 0,58, максимальная скорость кровотока (Vmax) - 10 см/с. К образованию прилежит овоидное образование 21 × 15 × 17 мм, объем - V = 2,85 мл. Правый яичник визуализируется, размерами 34 × 29,5 × 31 мм, V = 16 мл, определяются единичные фолликулы до 5 мм. Свободной жидкости в малом тазу до 30-50 мл (рис. 1).
По данным гастро- и колоноскопии - патологии не выявлено.
Предметом интереса данного клинического случая является проведение дифференциальной диагностики новообразования яичника (НЯ). Принимая во внимание результаты предварительного обследования, в плане дифференциальной диагностики можно думать о злокачественном новообразовании (ЗНО) яичника, рецидиве дермоидной кисты яичника, фиброме яичника, миоме матки с субсерозным ростом узла.
С целью исключения ЗНО яичника пациентке выполнено дообследование с применением УЗИ с внутривенным конт-растным усилением (КУУЗИ). После пункции кубитальной вены введен катетер, через который вводился контрастный препарат Соновью, разведенный в 10 мл физиологического раствора натрия хлорида (0,9%). В течение 102 секунд после внутривенного болюсного введения контрастного препарата в дозе 2,0 мл (в артериальную фазу) определяется стойкое контрастное усиление новообразования. Определен тип васкуляризации - существенная смешанная периферическая и центральная васкуляризация. По отношению к окружающим тканям вымывание замедленно до 2,5 минут (150 сек). Также при введении контрастного препарата отмечается контрастирование «ножки» образования, позволяющее предположить, что оно связано с маткой и является субсерозным миоматозным узлом на тонком основании (рис. 2).
Учитывая отсутствие убедительных клинико-инструментальных данных за злокачественную природу новообразования, преимущественно основываясь на данных КУУЗИ, было принято решение о выполнении лапароскопии в условиях гинекологического отделения. Лапароскопию выполняли по традиционной методике. При ревизии органов брюшной полости и малого таза обнаружили, что печень, сальник, видимые петли кишечника без видимой патологии. Спаечного процесса нет. В латеральных карманах - без видимой патологии. Матка в размерах не увеличена, серозная оболочка бледно-розового цвета, гладкая, блестящая. В позадиматочном пространстве - серозный выпот до 50 мл. Маточные трубы - без видимой патологии. Правый яичник подпаян к заднему листу широкой связки, после мобилизации в размерах несколько увеличен, содержит желтое тело диаметром 20 мм. Образование, определяющееся в области левых придатков, представляет собой миоматозный узел с субсерозным ростом, диаметром до 6 см, на тонком основании, расположенный в области левой собственной связки яичника (рис. 3). Питающая ножка и сам узел содержат сосуды диаметром до 0,5 см. Это объясняет выраженный кровоток в образовании по данным УЗИ с внутривенным контрастированием. При осмотре левого яичника - уменьшен в размерах до 1,5 см (последствие ранее перенесенной операции), фолликулярный аппарат выражен слабо. Ножка основания миоматозного узла скоагулирована биполярным электородом, узел отсечен, отправлен на гистологическое исследование (рис. 4).
По данным гистологического исследования - миома матки с низкой пролиферативной активностью.
Исследование экссудативной жидкости малого таза (цитологическое исследование) - атипических клеток не обнаружено.
Послеоперационный период протекал без осложнений, проводилась антибактериальная, инфузионная, симптоматическая терапия. В удовлетворительном состоянии пациентка была выписана на 4-е сутки после операции под наблюдение гинеколога. Были даны рекомендации о контрацепции в течение 6 месяцев после оперативного лечения, ведению последующей беременности с ранних сроков под наблюдением акушера-гинеколога ввиду высокого риска акушерских осложнений.
В настоящее время при выявлении опухоли яичника исследуют уровень онкомаркеров, таких как СА 125, СA 199, HE4. CA 125 наиболее чувствителен при раке яичников. Тем не менее уровень CA 125 может быть повышен при ряде относительно доброкачественных гинекологических заболеваний, таких как миома матки, эндометриоз, воспалительные заболевания органов малого таза 7. Некоторые исследователи показали, что у пациенток с диффузной формой аденомиоза или по крайней мере при наличии одного крупного миоматозного узла (диаметром ≥ 5 см) отмечалось превышение нормальных значений уровня СА 125. При миоме матки уровень СА 125 зависит от размера опухоли и наличия аденомиоза. Превышение нормальных значений онкомаркера СА 125 может быть связано непосредственно с большим размером миоматозного узла и раздражением брюшины [6, 17]. Также авторами показано значение определения онкомаркера СА 125 в дифференциальной диагностике миомы и саркомы матки, при которой достоверно повышается уровень СА 125 [9, 10].
УЗИ рекомендуется в качестве первоначального исследования для клинически заподозренной опухоли яичника. Если образование по данным УЗИ имеет характерные черты злокачественного или доброкачественного, то применение МРТ излишне. МРТ полезна при подозрении на злокачественность объемного образования или неоднозначности его трактовки по данным УЗИ [11].
Проблема топической диагностики и взаимоотношения органов в настоящее время решается с помощью применения КТ и МРТ [19].
В связи с тем что УЗИ остается доступным и высокоинформативным методом диагностики новообразований придатков, многие исследования сегодня направлены на повышение чувствительности и специфичности именно этого метода. К таким методам относятся УЗИ в режимах цветового допплеровского картирования (ЦДК), 3D-сонография, энергетический допплер, а также внутривенное контрастное усиление [12].
Исследование с контрастным усилением повышает диагностическую точность УЗИ при изучении сосудистого компонента, в частности для дифференциальной диагностики доброкачественных и злокачественных опухолей, преимущественно обладающих более развитой и аномальной сосудистой сетью [20, 21]. Проблемой КУУЗИ является объективность полученных результатов, так как оно относится к визуализирующим методикам, подобно энергетическому допплеру [13, 18].
Также одним из современных и изучаемых методов является создание математических моделей (LR2, Simple Rules, ADNEX) с помощью УЗИ Международной группой по стандартизации анализа диагностики опухолей яичников «The International Ovarian Tumor Analysis» (IOTA) [14]. Условия функционирования прогностических моделей поддерживаются стандартизированной терминологией УЗИ образования яичника, определяемой группой IOTA [14, 15]. Использование прогностической модели, разработанной группой IOTA, соответствует субъективным оценкам опытных исследователей и должно быть принято в качестве основного критерия для характеристики как доброкачественных, так и злокачественных образований [14, 16].
Зачастую только проведение диагностической лапароскопии на сегодняшний день позволяет установить правильный диагноз.
Важной задачей является создание оптимальных алгоритмов диагностики и маршрутизации пациенток при подозрении на опухоль придатков.
Заключение
Современная диагностика опухолей яичников не может основываться на одном методе исследования, а требует целого комплекса диагностических мероприятий, определяющих тактику введения пациенток в каждом конкретном случае 15. Наиболее актуальна эта проблема у женщин репродуктивного возраста, так как любая операция на яичниках приводит к снижению репродуктивной функции.
СОГЛАСИЕ ПАЦИЕНТА. Пациент добровольно подписал информированное согласие на публикацию персональной медицинской информации в обезличенной форме (именно в этом журнале).
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
PATIENT'S CONSENT. The patient voluntarily signed an informed consent to the publication of personal medical information in an impersonal form (in this journal).
CONFLICT OF INTERESTS. Not declared.
Литература/References
1 Федеральное государственное бюджетное образовательное учреждение дополнительного профессионального образования Российская медицинская академия непрерывного профессионального образования Министерства здравоохранения Российской Федерации; 125993, Россия, Москва, ул. Баррикадная, 2/1, стр. 1
2 Государственное бюджетное учреждение здравоохранения города Москвы Городская клиническая больница имени Д. Д. Плетнёва Департамента здравоохранения города Москвы; 105077, Россия, Москва, ул. 11-я Парковая, 32
3 Государственное бюджетное учреждение здравоохранения города Москвы Городская клиническая больница имени И. В. Давыдовского Департамента здравоохранения города Москвы; 109240, Россия, Москва, ул. Яузская, 11
Сведения об авторах:
Information about the authors:
Дифференциальная диагностика новообразования придатков матки с использованием контраст-усиленного ультразвука (клиническое наблюдение)/ Н. Е. Сафонова, Н. М. Подзолкова, В. Б. Осадчев, К. В. Бабков, И. Е. Фадеев
Для цитирования: Сафонова Н. Е., Подзолкова Н. М., Осадчев В. Б., Бабков К. В., Фадеев И. Е. Дифференциальная диагностика новообразования придатков матки с использованием контраст-усиленного ультразвука (клиническое наблюдение) // Лечащий Врач. 2022; 5-6 (25): 14-19. DOI: 10.51793/OS.2022.25.6.002
Теги: женщины, миома, киста яичника, опухоль придатков
Клинико-гистологическая характеристика доброкачественных образований яичников
На сегодняшний день частота выявления доброкачественных образований яичников не снижается, что объясняется широким применением в гинекологии современных информативных методов исследований.
На сегодняшний день частота выявления доброкачественных образований яичников не снижается, что объясняется широким применением в гинекологии современных информативных методов исследований. В течение нескольких десятилетий для дифференциации опухолей матки и придатков с успехом применяется ультразвуковая диагностика [1]. Однако не всегда при трансвагинальной эхографии можно определить характер опухоли, особенно на ранних стадиях развития опухоли яичника [2]. Возможность дифференциации доброкачественных и злокачественных образований яичников появилась с применением цветного доплеровского картирования [1, 3].
Длительность существования доброкачественной опухоли яичника и ее способность к малигнизации имеют самый различный диапазон и частоту. Так, известно, что малигнизации подвергается каждая третья серозная кистома яичника [2, 3, 4, 5]. Вместе с тем не исключено и длительное существование этих опухолей без каких-либо пролиферативных изменений в капсуле.
Известно, что образования яичников небольших размеров часто принимаются за опухолевидные образования и подвергаются консервативной противовоспалительной терапии. Отсутствие же эффекта от лечения рассматривают как показание для оперативного вмешательства. Однако распознать грань перехода пролиферации эпителия капсулы в атипический эпителий и своевременно предотвратить опасное для жизни заболевание является довольно сложной задачей. Окончательный диагноз о характере образования яичника устанавливается путем гистологического исследования удаленной капсулы.
Целью исследования явилось изучение клинических проявлений и морфологических особенностей доброкачественных опухолей яичников для своевременного решения вопроса о необходимости их оперативного лечения. Материал и методы исследования. Нами изучено клиническое течение доброкачественных образований яичников у 170 больных, поступивших в гинекологическое отделение акушерского комплекса № 9 г. Ташкента по поводу объемного образования яичника на оперативное лечение.
Возраст обследованных женщин колебался от 25 до 45 лет. Наиболее частым возрастом выявления опухолей яичников у наших пациенток является 20-29 лет (около половины), затем возрастная группа 30-39 лет. Меньше всего среди больных было пациенток в возрасте до 20 лет (около 5%).
Дооперационное обследование включало ультразвуковое исследование с цветовым доплеровским картированием сосудов яичника и определение в крови онкомаркера СА-125. Онкомаркер СА-125 является антигеном, определяемым с помощью моноклональных антител к клеткам рака яичников, и наиболее специфичным маркером при опухолях яичников, особенно в постклимактерическом периоде [5, 6]. Интерпретация результатов определения величины онкомаркера СА-125 проводилась в соответствии с результатами гистологического исследования.
При резко повышенных показателях проводилось повторное исследование в послеоперационном периоде и после реабилитационного лечения. Верификация диагноза проводилась в послеоперационном периоде гистологическим исследованием капсулы кистомы.
Для гистологического исследования из резецированных стенок кист готовили гистологические препараты по общепринятой методике. Результаты исследования и их обсуждение. Наиболее частой жалобой пациенток было бесплодие. Из 77 (45,3%) больных с нарушением репродуктивной функции у 46 (60,0%) пациенток наблюдалось первичное бесплодие длительностью от двух до шести лет, у 31 (40%) — вторичное бесплодие длительностью от двух до четырех лет.
Второй по частоте жалобой были ноющие боли внизу живота и альгоменорея (у 71 больной — 41,8%). Около одной трети больных (55 пациенток — 32,4%) до поступления в стационар получали консервативную противовоспалительную терапию без особого успеха.
Нарушения менструаций были отмечены чаще у больных с опухолевидными образованиями воспалительного характера, что было подтверждено результатами гистологического анализа удаленной капсулы образования. Из нарушений менструально-овариального цикла, кроме альгоменореи, были выявлены гиперменорея (12,3%), гипоолигоменорея (16,8%), в некоторых случаях — дисфункциональные кровотечения в анамнезе (у 9,2%).
Доплерометрические исследования кровотока характеризовались низкой скоростью кровотока в маточных и яичниковых сосудах и повышенными значениями индекса резистентности. Определение онкомаркера СА-125, проведенное до операции, показало, что, несмотря на разброс цифр (от 8,3 до 60,3), средняя цифра не превышала принятую норму 35 Ед/мл. Оперативное лечение проведено практически всем женщинам путем лапароскопии. Послеоперационное реабилитационное лечение зависело от результатов гистологического исследования и величины онкомаркера.
Интерес представляет также полиморфизм гистологических изменений в капсуле удаленных образований. Большую часть (33%) составили опухолевидные образования (фолликулярные и лютеиновые кисты). Доброкачественные эпителиальные опухоли составили 25% случаев, из них в 11,7% случаев — серозные и в 13,3% случаев — эндометриоидные. В 5% случаев наблюдали герминогенную опухоль в виде зрелой тератомы. Вместе с тем в двух случаях гистологическое исследование выявило аденокарциному яичника. Значительная часть кистозных образований (31,7%) не имела эпителиальной выстилки, что затрудняло установление гистогенеза и характера новообразования яичника.
Фолликулярные кисты были представлены чаще как одностороннее однокамерное и тонкостенное образование с гладкой внутренней стенкой. Гистологически соединительнотканная стенка была выстлана многорядным фолликулярным эпителием, под которым располагаются клетки theca interna, в некоторых случаях наблюдалась ее гиперплазия и лютеинизация.
Лютеиновые кисты чаще выявлялись в виде двусторонних и одиночных образований. Внутренняя поверхность стенки кисты выстлана слоем текалютеиновых клеток, под которыми расположена гранулеза без лютеинизации.
Среди эпителиальных опухолей чаще встречались серозные и муцинозные. Серозные опухоли были представлены серозной цистоаденомой, обычно крупных размеров. Капсула опухоли в основном была грубоволокнистой, выстилающий стенку эпителий был однорядным кубическим или уплощенным, в некоторых случаях обнаруживался цилиндрический эпителий.
Муцинозные опухоли были представлены муцинозной цистоаденомой (или сецернирующая муцинозная кистома), обычно многокамерной и крупных размеров. Внутренняя поверхность стенки выстлана однорядным высоким призматическим эпителием, цитоплазма которых содержала слизь.
Эндометриоидные опухоли яичников были схожи с опухолями эндометрия и характеризовались выстилкой стенки кисты однорядным низким цилиндрическим эпителием эндометриального типа. Вокруг стенки часто наблюдались кровоизлияния и накопление гемосидерина.
Зрелая кистозная тератома (или дермоидная киста) яичника была обычно однокамерной и заполнена салом и волосами. Гистологически обнаруживались кожа, волосяные фолликулы, сальные и потовые железы, редко — хрящ.
Аденокарциномы яичников были представлены серозной папиллярной цистоаденокарциномой. Нами выявлены две больные с аденокарциномой, у которых онкомаркер СА-125 был соответственно в 11 и 15 раз выше нормы.
Таким образом, исследования показали, что доброкачественные опухоли и опухолевидные образования яичников чаще встречаются среди женщин активного репродуктивного возраста — от 20 до 39 лет, что несколько отличается от данных литературы [4, 5]. Клиническая картина доброкачественных опухолей неспецифична и проявляется в некоторых случаях нарушениями менструального цикла, бесплодием. Наши исследования показали, что определение онкомаркера СА-125 позволяет в предоперационном периоде с высокой степенью вероятности прогнозировать характер образования яичника и определить хирургическую тактику, что подтверждается результатами других исследователей [6].
Выводы:
Скудная и неспецифичная клиническая симптоматика объемных образований и многообразие их гистологических форм указывают на необходимость тщательного дооперационного обследования, включая определение онкомаркера СА-125.
Необходимо проведение экспресс-диагностики во время операции лапароскопии для решения вопроса об объеме оперативного вмешательства и дальнейшей тактики.
Литература
Сидорова И. С., Гуриев Т. Д., Саранцев А. И., Капустина И. Н., Ардус Ф. С. Цветное доплеровское картирование в предоперационной диагностике и прогнозировании при объемных образованиях придатков матки / Акуш. и гинек. 2003. № 3. С. 41-46.
Соломатина А. А., Степанов К. И., Курбатская О. И., Демина Л. Н., Пашкова А. В. Цветное доплеровское картирование в диагностике опухолей и опухолевидных образований яичников / Акуш. и гинек. 2003. № 2. С. 54-57.
Патолого-анатомическая диагностика опухолей человека. Руководство для врачей. Под редакцией Н. А. Краевского, А. В. Смолянникова, Д. С. Саркисова: М.: Медицина, 1993. В 2-х томах.
Серов С. Ф., Иржанов С. И., Бейсебаев А. А. Эпителиальные опухоли яичников. Алма-Ата: Казахстан. 1991.
Zeimet A. G., Muller-Holzner E., Marth C. Tumor marker CA-125 in tissuer of the female reproductive tract and serum during the normal menstrual cycle // Fertil. Steril. 1993.
Л. М. Абдуллаева, кандидат медицинских наук Ташкентская медицинская академия, Ташкент
Особенности ультразвуковой картины органов репродуктивной системы у женщин в постменопаузальном периоде
Постменопаузальный период начинается с момента стойкого прекращения менструальной функции, которое в среднем наступает в возрасте 50,8 лет и длится до смерти женщины. Данный период жизни женщины характеризуется прогрессированием инволютивных
Постменопаузальный период начинается с момента стойкого прекращения менструальной функции, которое в среднем наступает в возрасте 50,8 лет и длится до смерти женщины. Данный период жизни женщины характеризуется прогрессированием инволютивных процессов: во всех органах репродуктивной системы происходят атрофические изменения, которые и обуславливают специфику ультразвуковой картины органов малого таза.
В постменопаузальном периоде отмечается уменьшение массы матки. Уменьшение размеров матки наиболее интенсивно протекает в первый год менопаузы. За это время матка уменьшается в длину и ширину на 1 см, переднезадний размер — на 0,5 см. Средние колебания размеров матки у здоровой женщины в зависимости от длительности менопаузы представлены в таблице.
Вторая важная эхоморфологическая характеристика матки в постменопаузе — изменение эхоструктуры миометрия. При ультразвуковом исследовании визуализируется неоднородная эхоструктура миометрия за счет точечных или линейных гиперэхогенных включений (рис. 1). Данные изменения УЗИ-картины обусловлены процессами инволюции: атрофией дифференцированных тканей с последующей заменой соединительной тканью.
При физиологическом течении постменопаузального периода толщина эндометрия при ультразвуковом исследовании в среднем составляет 3,1 мм. По мнению большинства специалистов, толщина М-эхо в постменопаузе не должна превышать 5 мм. При УЗИ у большинства женщин в постменопаузе М-эхо визуализируется в виде тонкой гиперэхогенной полоски толщиной 0,1-0,2 см (рис. 2).
В отдельных наблюдениях у здоровых женщин в постменопаузе можно визуализировать расширенную полость матки до 0,2-1 см. Согласно мнению Schresel P., данное наблюдение обусловлено функциональной окклюзией цервикального канала и скоплением серозной жидкости. Это подтверждается тем, что периодически происходит частичное или полное опорожнение серозометры (рис. 3). Измерение толщины эндометрия заслуживает особого внимания у женщин в постменопаузе, поскольку именно в этот период наиболее часто встречается рак эндометрия (по данным Бохмана Я. В., пик заболевания раком матки приходится на 59 лет, и только в 16% случаев он встречается в репродуктивном возрасте).
Яичники в постменопаузе постепенно уменьшаются в размерах за счет развития соединительной ткани. Объем яичников в постменопаузальный период составляет в среднем 3 см 3 , после пяти лет менопаузы — около 2,5 см 3 , свыше 10 лет — около 1,5 см 3 (объем яичников у женщин репродуктивного возраста равен 8,2 см 3 ). Следует подчеркнуть, что выявление у женщин в постменопаузе яичников объемом более 5 см 3 является признаком патологии. Разница в объеме правого и левого яичника не должна превышать 1,5 см 3 . Во время УЗИ необходимо обращать внимание на асимметричное увеличение одного из яичников более чем в два раза, так как в постменопаузе это является одним из признаков малигнизации. В связи с постепенным угасанием гормональной функции яичников наличие единичных маленьких фолликулов в течение первых пяти лет менопаузы не должно расцениваться как патологический процесс. После пяти лет менопаузы фолликулы не выявляются, а их персистенция должна вызывать определенную настороженность.
Методом выбора для проведения УЗИ органов малого таза в постменопаузе является трансвагинальное сканирование. Используя только трансабдоминальный доступ обследования, нельзя достоверно оценить толщину и эхоструктуру эндометрия, к тому же на 30-50% снижается возможность визуализации постменопаузальных яичников.
При трансвагинальном исследовании частота визуализации уменьшенных яичников может достигать 80-90%, а если это же исследование проводить при частично наполненном мочевом пузыре, то точность выявления яичников возрастает до 93,5%. Актуальность вопроса о выявлении яичников при УЗИ определяется тем, что у женщин старше 40 лет возрастает частота возникновения рака яичников.
Врач УЗ-диагностики, проводящий обследование женщин в постменопаузе, должен понимать важность правильной интерпретации выявленных изменений и четко различать, какие особенности ультразвуковой картины относятся к физиологическим процессам, а какие к патологическим.
Солидный рак
Опухоли — это патологические образования, которые образуются из-за нарушения роста и дифференцировки клеток. Они могут развиваться практически из любой ткани: эпителиальной, нервной, соединительной, кроветворной и др. В зависимости от того, из какой ткани развилось новообразование выделяют солидные опухоли и гемобластозы.
К группе гемобластозов относят лейкозы, лимфомы и миеломы. Их особенностью является повсеместное распространение по организму, без образования локализованных очагов.
Все остальные опухоли относятся к солидным (от английского solid — твердый). Солидная опухоль - это такая, которая имеет вид разрастаний в виде уплотнений или утолщений. Сам термин «солидный» не является характеристикой, определяющей агрессивность заболевания — он может иметь как высокий, так и низкий уровень злокачественности. Сам термин лишь определяет его состояние.
Еще существует такое понятие, как кистозно-солидное образование - это такое состояние, когда в органе встречаются сразу два типа образований. Одни из них плотные, другие представляют собой кисты - полости, внутри которых находится жидкость или другое содержимое. Например, пациент часто спрашивают, что такое кистозно-солидное образование яичника или щитовидной железы, потому что такие образования выявлены у них во время обследования. Такие изменения не обязательно оказываются злокачественными. В окончательном диагнозе помогает разобраться биопсия и гистологическое исследование ткани.

Солидные опухоли могут быть доброкачественными и злокачественными.
- Доброкачественные опухоли состоят из высокодифференцированных зрелых клеток, растут относительно медленно, не прорастают в окружающие ткани, не дают метастазов и чаще всего не представляют смертельной опасности, за исключением опухолей головного и спинного мозга. Иногда они могут самопроизвольно исчезать. Некоторые доброкачественные опухоли могут озлокачествляться (малигнизироваться) и превращаться в рак.
- Злокачественные солидные опухоли (саркомы, карциномы, глиомы) состоят из низко или умеренно дифференцированных клеток. Они быстро увеличиваются в размерах, прорастают окружающие ткани, разрушая их, а также могут давать метастазы (очаги отсеивания, расположенные вдали от первичного новообразования) и оказывают системное воздействие на организм. Они опасны для здоровья и несут смертельную угрозу. Иногда, как мы упомянули выше, такое образование визуализируется во время обследования как кистозно-солидная опухоль (иногда еще можно услышать термин « солидная киста »).
Кроме того, термин «солидный рак» используется в гистологии. Мироскопически он является разновидностью эпителиальной злокачественной неоплазии. В толще новообразования злокачественные клетки располагаются компактными группами, разделенными прослойками соединительной ткани. Злокачественные клетки не дифференцированы, поэтому такой рак отличается быстрым ростом, ранним метастазированием и склонностью к рецидивированию. В целом, это агрессивная форма неоплазии, которая сложно поддается лечению.
Как диагностируют солидный рак
Методы диагностики солидного рака можно разделить на несколько групп:
Методы, позволяющие обнаружить наличие образования. В некоторых случаях, если солидная опухоль располагается поверхностно, её можно увидеть во время осмотра или пропальпировать. В остальных случаях на помощь приходят методы медицинской визуализации — УЗИ, КТ, МРТ, рентгенологическое исследование, ПЭТ, эндоскопическое исследование и другие. В некоторых случаях обнаружить рак помогают лабораторные анализы, в частности определение онкомаркеров — особых молекул, количество которых повышается при возникновении той или иной формы новообразования.

Методы, позволяющие верифицировать диагноз. Окончательный диагноз можно поставить только после морфологического исследования опухолевой ткани. Для этого фрагмент новообразования изучают под микроскопом после специального окрашивания. В ряде случаев для уточнения диагноза и определения молекулярно-генетического профиля образования проводят дополнительное тестирование, например, иммуногистохимическое исследование, молекулярно-генетическое тестирование. Это позволит подобрать оптимальную схему лечения, учитывая прогностические особенности рака.
После постановки диагноза необходимо определить стадию заболевания. Здесь на помощь приходят методы лучевой диагностики (то же УЗИ, КТ, МРТ), которые позволяют верифицировать размеры рака, его взаимоотношения с рядом расположенными тканями, вовлечение в процесс лимфатических узлов и наличие метастазов.
В каких органах чаще всего развивается солидный рак
Солидный рак может развиться в любом органе, в котором есть эпителиальные ткани. Чаще всего диагностируются опухоли молочной железы, легких, предстательной железы, желудочно-кишечного тракта.
Способы лечения солидного рака
В рамках лечения солидного рака применяются те же подходы, которые используются во всей онкологии. Ключевыми методами является хирургия, лучевая терапия и химиотерапия.
Хирургическое лечение
Хирургические операции в онкологии делятся на две большие группы — радикальные и паллиативные.
Радикальные операции
Радикальные вмешательства предполагают полное удаление опухоли в пределах здоровых тканей и зоны возможного метастазирования. Здесь выделяют:
- Типовые операции — удаление ткани пораженного органа в оптимальном объеме для достижения радикальности. Также выполняется необходимая лимфодиссекция.
- Комбинированные радикальные вмешательства — удаляется первично пораженный орган, и проводится частичная резекция соседних органов и тканей, на которые распространился рак.
- Расширенные операции — помимо затронутых органов и стандартных групп лимфатических узлов, на которые распространяется рак, удаляют дополнительные группы лимфатических узлов.
Раньше проведение обширных радикальных операций зачастую приводило к инвалидизации больного. Сейчас же идет тенденция не только к его излечению, но и сохранению приемлемого качества жизни. Поэтому совершенствуются хирургические технологии органосохраняющих методик и реконструктивных операций после удаления рака.
Нерадикальные операции
- Паллиативные вмешательства. Они проводятся при наличии отдаленных метастатических очагов. На первом этапе предполагается удаление первичного опухолевого очага в радикальном объеме. Вторым этапом проводятся попытки лечения метастазов, если это возможно. В целом такие операции не подразумевают полного излечения и проводятся для улучшения состояния больного и облегчения тягостных симптомов.
- Симптоматические паллиативные операции. Они выполняются по жизненным показаниям, при развитии осложнений рака. Ликвидации опухоли они не предусматривают и направлены восстановление жизненно важных функций, например, дыхания, отведение кишечного содержимого, возобновление пассажа желчи, остановку кровотечения и др.
Лучевая терапия
Лучевая терапия предполагает использование ионизирующего излучения в дозировках, приводящих к гибели раковых клеток. Все методы можно разделить на три большие группы — дистанционная лучевая терапия, контактная лучевая терапия и системная лучевая терапия.
При дистанционной лучевой, терапии источник ионизирующего излучения находится за пределами тела пациента на определенном расстоянии. При таком лечении используется сложное высокотехнологичное оборудование, которое генерирует определенный вид ионизирующего излучения (ИИ). При помощи специальных технологий производят распределение его дозы таким образом, чтобы максимально полно облучить рак и минимально затронуть не вовлеченные в процесс ткани.
Контактная лучевая терапия
При контактной лучевой терапии ИИ располагается либо непосредственно возле раковой опухоли, либо в ее толще. Здесь выделяют:
- Аппликационную ЛТ. Таким методом лечатся поверхностно расположенные опухоли, например, рак кожи, рак вульвы или рак влагалища.
- Внутриполостная ЛТ — ИИ вводят в полость полого органа (матка, желудок, мочевой пузырь и др.) с помощью специального аппликатора, заполненного радиоактивным материалом. Таким методом лечится рак полых органов.
- Внутритканевая ЛТ — ИИ вводят непосредственно в раковую опухоль с помощью игл или трубочек, заполненных радиоактивным материалом. Таким методом может лечиться рак простаты, рак тела матки, рак шейки матки, рак желудка и др.
Как правило, контактную лучевую терапию сочетают с дистанционной ЛТ, что позволяет максимально сфокусировать воздействие ионизирующего излучения на раковой опухоли, при этом минимально затронув окружающие ткани.
Системная радионуклидная терапия
Эффективность этого метода лечения основана на том, что опухоли захватывают определенные молекулы и используют их для своего дальнейшего роста. Если на эти молекулы присоединить радиоактивные изотопы, они избирательно накопятся в опухолевой ткани и разрушат ее. Как правило, таким образом проводят лечение отдаленных метастазов.
Химиотерапия при раке
Для лечения рака разработано большое количество химиотерапевтических препаратов. По оказываемому эффекту их разделяют на цитостатические и цитотоксические препараты. Цитостатики нарушают процессы размножения раковых клеток, что в конечном итоге приводит к их гибели. Цитотоксические препараты направлены на непосредственное уничтожение клеток. Химиотерапия при раке предполагает несколько курсов лечения, которые чередуются с перерывами. Это связано с двумя моментами:
- Раковые клетки имеют жизненный цикл, который состоит из активной фазы и фазы покоя. Химиотерапия действует только на активные клетки.
- Химиотерапия оказывает токсическое действие на организм, поэтому нужно время для его восстановления.
Химиотерапии солидного рака проводится в рамках комбинированного лечения совместно с хирургией или лучевой терапией. Ее преимуществом является системное воздействие на организм, что помогает уничтожить как злокачественные клетки, которые остались в первичном очаге после удаления опухоли, так и метастазы.
Иммунотерапия
Иммунотерапия является одним из новых методов лечения солидного рака. Суть метода заключается в коррекции противоопухолевого иммунного ответа, что позволит организму уничтожить рак с помощью собственных ресурсов. Вторым направлением иммунотерапии является работа с самой опухолью, которая вырабатывает определенные вещества, делающие ее незаметной для иммунной системы. Если рак демаскировать, иммунитет его уничтожит.
Чем опасен солидный рак
Солидный рак зачастую характеризуется агрессивным течением и, за редким исключением, метастазированием. При отсутствии лечения, первичная опухоль будет разрастаться, захватывая новые ткани и нарушая работу вовлеченных органов. Это чревато самыми разнообразными осложнениями, начиная от кровотечений и заканчивая кишечной непроходимостью, нарушением дыхания, болевым синдромом, неврологическими проявлениями.
По мере нарастания опухолевой массы, рак оказывает системное воздействие на организм — развивается истощение и слабость. В конце концов при отсутствии специальной помощи человек погибает.
Прогнозы на выздоровление при солидном раке
Прогноз на выздоровления при солидных опухолях определяется видом рака, степенью его дифференцировки и стадией на момент установки диагноза. Чем раньше начато лечение, тем более благоприятный прогноз.
Возможности современных ультразвуковых методик в диагностике рака эндометрия
ФГУ Российский научный центр радиологии и хирургических технологий Росмедтехнологии, Санкт-Петербург.

Журнал "SonoAce Ultrasound"
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Введение
Согласно мировой статистике, рак тела матки занимает 7-е место среди злокачественных заболеваний. Анализ онкологической ситуации в последнее десятилетие в России свидетельствует о неуклонном росте заболеваемости раком эндометрия, который к 2007 г. занял 2-е место среди всех злокачественных опухолей у женщин. Доля рака тела матки в структуре заболеваемости злокачественными новообразованиями на 100 000 женского населения России в разных регионах колеблется от 4,5 до 22,5. Прослеживается неуклонное возрастание частоты заболеваемости с 9,8 в 1990 г. до 13,9 в 2005 г., что соответствует 3-му месту по величине показателей прироста заболеваемости злокачественными новообразованиями [1]. В настоящее время увеличение числа впервые выявленных случаев рака тела матки не уступает таковому при опухолях молочной железы. В странах третьего мира риск развития рака тела матки в целом ниже, при этом уровень смертности остается высоким. В странах Северной Америки и Европы данное заболевание встречается значительно чаще, являясь наиболее распространенной злокачественной опухолью женской половой системы, и занимает 4-е место среди всех злокачественных новообразований после рака молочной железы, легких и толстой кишки. Заболеваемость раком эндометрия в возрасте от 40 до 54 лет резко повышается, пик заболеваемости приходится на возраст 60-64 года. Частота распространения рака эндометрия и ее динамика в разных странах с учетом влияния миграционных процессов и возраста указывают на специфические особенности заболевания и зависимость его возникновения от комплекса причин эндо- и экзогенной природы [2].
Среди факторов риска развития рака тела матки обращают на себя внимание малое число родов или бесплодие, ожирение, поздняя менопауза, сахарный диабет, преимущественно 2-го типа. В большинстве случаев риск развития рака эндометрия ассоциируется с различными формами гиперплазий эндометрия - 81,3%, дисфункцией на фоне поликистоза яичников - 25%, полипозом эндометрия - 5,3-25%, миомой матки - 1,6-8%. В последнее время отмечается существенное увеличение местнораспространенных форм рака эндометрия, что связано с неэффективными мероприятиями первичной диагностики. Вопросы уточняющей диагностики рака эндометрия являются предметом пристального изучения [3].
В патогенезе заболевания ведущее значение имеет теория избыточной эстрогенной стимуляции эндометрия, сочетающейся с недостаточностью прогестерона. Как полагают, избыточное влияние эстрогенов может приводить к гиперплазии эндометрия, которая способна прогрессировать в атипический вариант и в 20-25% случаев к переходу в аденокарциному. В то же время существующая зависимость между степенью пролиферации эндометрия и концентрацией эстрогенов в крови отмечается до определенного, порогового значения и даже интенсивная пролиферация не во всех случаях сопровождается злокачественной трансформацией эндометрия. Обнаруженная корреляция между содержанием эстрогенов и повреждением ДНК в нормальном и малигнизированном эндометрии заставляет обращать больше внимания на роль молекулярногенетических и морфологических факторов при формировании разных типов рака тела матки. Рак эндометрия характеризуется гетерогенной природой, что проявляется на уровне как факторов риска, так и его патогенеза, чем определяются особенности формирования групп риска при данном заболевании.
В настоящее время для выявления патологии эндометрия в основном используются диагностическое выскабливание полости матки, гистероскопия и аспирационноцитологическое исследование, а также методы лучевой диагностики, среди которых ведущее значение имеет ультразвуковое исследование (УЗИ) 5. При этом отсутствуют единые методически обоснованные эхографические критерии инвазивного роста опухоли. Внедрение в программы интегрированного обследования больных новых ультразвуковых технологий, таких как импульсная допплерометрия, ультразвуковая ангиография и трехмерная реконструкция изображений, позволило существенно повысить эффективность первичной диагностики и мониторинга больных раком эндометрия в процессе специфической терапии [7, 8].
Целью настоящей работы было изучение возможностей комплексного УЗИ с применением цветового допплеровского и энергетического картирования (ЦДК и ЭК), импульсной допплерометрии и трехмерной реконструкции изображений в первичной и уточняющей диагностике рака эндометрия.
Материал и методы
Обследованы 139 пациенток в возрасте от 21 года до 87 лет с подозрением на рак эндометрия в пери- и постменопаузальном периоде. У 34 больных были выявлены гиперпластические процессы эндометрия, у 105 - злокачественные процессы эндометрия. Средний возраст больных с доброкачественной патологией составил 42,6±7,2 года, больных раком эндометрия - 65,4±7 лет. Во всех случаях получена гистологическая верификация диагноза.
Все больные были комплексно обследованы ультразвуковым методом с использованием трансабдоминального (конвексным датчиком 3,5 МГц) и трансвагинального (датчиком 6,5-7 МГц) доступов на современных ультразвуковых аппаратах Logiq S6 (GE, Healthcare) и Accuvix-XQ (Medison) по определенной программе с применением новейших ультразвуковых методик, включающих допплерометрию маточных сосудов, ЦДК и ЭК с трехмерной реконструкцией изображений. При трансабдоминальном исследовании у пациенток с наполненным мочевым пузырем оценивали состояние матки и яичников, определяли объемы тела и шейки матки, ширину М-эхо. При трансвагинальном УЗИ (ТВУЗИ) методами допплерометрии проводили измерение кровотока и индекса резистентности в маточных артериях, оценивали интенсивность внутриопухолевого кровотока. На всех этапах исследования определяли состояние структуры эндо- и миометрия, их взаимоотношение и однородность. При выявлении очаговых изменений определяли их размеры, степень распространенности и взаимоотношение с окружающими органами и структурами, проводили сравнительную оценку толщины маточной стенки в зоне опухоли и вне зоны локализации опухолевого очага. По возможности точно определяли линейные и объемные параметры опухоли, четкость ее контуров, оценивали состояние прилежащей к ней слизистой оболочки. Основным параметром оценки эндометрия остается изменение его толщины [9]. Объем эндометрия также используется для наиболее ранней диагностики заболевания. Его значения более достоверны в дифференциальной диагностике рака и доброкачественных гиперпластических процессов, чем измерения ширины эндометрия. Критериями злокачественного поражения эндометрия являются значения объема эндометрия превышающие 13 см 3 . При этом обеспечиваются 100% чувствительность и 92% предсказуемость положительного теста в диагностике рака эндометрия [10].
Важнейшими характеристиками новообразования эндометрия являлись степень и характер его васкуляризации, которую с целью получения наиболее полного и наглядного представления оценивали в режиме кино-петли. Проводили качественную оценку кровоснабжения по количеству цветовых сигналов от сосудов новообразования: гиповаскулярный, умеренноваскулярный, гиперваскулярный. Нами использовалась технология Multi-Slice View c преобразованием объемных данных в серию последовательных срезов толщиной до 0,5 мм. Целенаправленный выбор определенных сечений из 3D объемных данных позволял выделить оптимальные срезы тела и полости матки и максимально точно оценить их размеры, определить взаимосвязь выявленных изменений с состоянием окружающих органов и тканей. Технология Volume CT View позволяла на основе 3D сканирования оценить контуры и структуру эндометрия, характер его кровоснабжения, а применение опции гистограммы - точно определить индекс васкуляризации [11].
Особое внимание уделяли оценке глубины миометральной инвазии, возможному переходу злокачественного процесса на цервикальный канал и состоянию регионарных лимфатических узлов, что имело решающее значение при определении стадии заболевания и выборе тактики лечения [12].
Результаты и обсуждение
В результате проведенного исследования у 34 пациенток выявлены гиперпластические процессы эндометрия, которые были выделены нами в отдельные нозологические формы, соответствующие рекомендациям ВОЗ. В табл. 1 представлено распределение больных в зависимости от морфогенеза выявленных гиперпластических процессов эндометрия.
| Количество больных | ||
|---|---|---|
| абс. | % | |
| Морфологическая форма гиперпластических процессов эндометрия | 34 | 100 |
| Железисто-кистозная гиперплазия | 19 | 56 |
| Железисто-фиброзные полипы | 5 | 15 |
| Атипическая гиперплазия | 10 | 29 |
Гиперпластические процессы эндометрия проявлялись нарушениями менструального цикла по типу менометроррагии, анемией I-II степени. При доброкачественной патологии эндометрия у 24 (71,4%) пациенток методом УЗИ в режиме серой шкалы определялось увеличение толщины М-эхо в среднем 14,6±3,2 мм. При трансвагинальной эхографии железисто-кистозная гиперплазия определялась как образование повышенной эхогенности, однородной структуры, с множественными точечными гипо- или анэхогенными включениями до 1,5 мм, иногда с эффектом акустического усиления. При атипической гиперплазии в полости матки выявлялась неоднородная гиперэхогенная солидная структура. Полипы определялись как округлые, овальные или продолговатые, в ряде случаев на длинной ножке, гиперэхогенные образования разных размеров, деформирующие полость матки и отчетливо дифференцирующиеся на фоне жидкостного содержимого полости матки. С помощью импульсного допплеровского режима были количественно оценены показатели гемодинамики в маточных артериях, которые составили: МСС - 9,3±2,1 см/с, индекс резистентности - 0,56±0,05 [13].
Методикой цветовой допплерографии внутриопухолевый кровоток при железисто-кистозной гиперплазии регистрировался в виде единичных сигналов от сосудов, расположенных по периферии. При фиброзно-железистых полипах визуализировался умеренно выраженный венозный и артериальный периферический кровоток со средними показателями периферического сосудистого сопротивления. У 2 пациенток с железистой гиперплазией определялась выраженная гиперваскуляризация эндометрия. При атипической гиперплазии регистрировался центральный и периферический внутриопухолевый кровоток умеренной интенсивности. У 5 больных с железисто-кистозной гиперплазией при атрофическом эндометрии кровоток не регистрировался. Характерными признаками доброкачественности новообразования даже при наличии множественных полиповидных разрастаний являлись сохранение формы полости матки, четкое определение наружного контура эндометрия и равномерное распределение сосудов миометрия (рис. 1 и 2).
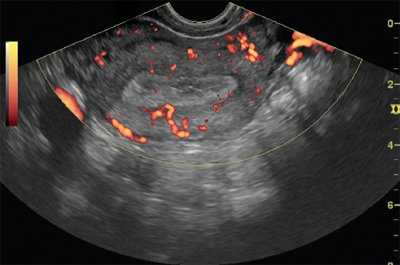
Рис. 1. ТВУЗИ, режим энергетического картирования. Железисто-кистозная гиперплазия эндометрия.
Читайте также:
