Вазодилататорная и гипоксическая теория регуляции кровотока в органах и тканях
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Много раз мы слышали, как вредно находиться в помещении с повышенным уровнем углекислого газа и как важно нормальное содержание кислорода в воздухе, которым мы дышим. Вместе с тем, всем известно, что кислород в организм должен попадать бесперебойно и в достаточном количестве, в противном случае снижение кислорода в крови (гипоксемия) и накопление углекислого газа (гиперкапния) приводят к развитию состояния, называемого гипоксией. И коль гипоксия имеет место, то уже ясно, что без гиперкапнии и гипоксемии тоже не обошлось, поэтому их считают универсальными симптомами дыхательной недостаточности (ДН).
Различают две формы острой дыхательной недостаточности: гиперкапническую, обусловленную повышенным уровнем углекислого газа, и гипоксемическую форму ОДН, когда проблемы возникают вследствие низкой оксигенации артериальной крови. Для острой дыхательной недостаточности характерно и то, и другое: и повышенная концентрация углекислого газа, и низкое содержание кислорода, то есть, и гиперкапния, и гипоксемия, но все же их нужно отделять друг от друга и разграничивать при выборе методов лечения, которые хоть, в принципе, и похожи, но могут иметь свои особенности.
Свято место пусто не бывает
Гиперкапния - повышение уровня углекислого газа (СО2) в крови, гипоксемия - снижение содержания кислорода (О2) там же. Как и почему это происходит?
Известно, что транспорт кислорода из легких с артериальной кровью осуществляют красные кровяные тельца (эритроциты), где кислород находится в связанном (но не очень прочно) с хромопротеином (гемоглобином) состоянии. Гемоглобин (Hb), несущий кислород к тканям (оксигемоглобин), по прибытию на место назначения отдает О2 и становится восстановленным гемоглобином (дезоксигемоглобин), способным присоединять к себе тот же кислород, углекислый газ, воду. Но так как в тканях его уже ждет углекислый газ, который нужно с венозной кровью доставить в легкие для выведения из организма, то гемоглобин его и забирает, превращаясь в карбогемоглобин (HbСО2) - тоже непрочное соединение. Карбогемоглобин в легких распадется на Hb, способный соединиться с кислородом, поступившим при вдохе, и углекислый газ, предназначенный для вывода из организма при выдохе.
Схематично эти реакции можно представить в виде химических реакций, которые, возможно, читатель хорошо помнит еще из школьных уроков:
- Hb (в эритроцитах) + О2 (приходит при вдохе с воздухом) → HbО2 - реакция идет в легких, полученное соединение направляется в ткани;
- HbО2 → Hb (дезоксигемоглобин) + О2 - в тканях, которые получают кислород для дыхания;
- Hb + СО2 (отработанный, из тканей) → HbСО2 (карбогемоглобин) - в тканях, образованный карбогемоглобин направляется в малый круг для газообмена и обогащения кислородом;
- HbСО2 (из тканей) → в легкие: Hb (свободен для получения кислорода) + СО2↑ (удаляется с выдохом);
- Hb + О2 (из вдыхаемого воздуха) - новый цикл.
Однако следует отметить, что все так хорошо получается, когда кислорода хватает, избытка углекислого газа нет, с легкими все в порядке - организм дышит чистым воздухом, ткани получают все, что им положено, кислородного голодания не испытывают, образованный в процессе газообмена СО2 благополучно покидает организм. Из схемы видно, что восстановленный гемоглобин (Hb), не имея прочных связей, всегда готов присоединить любой из компонентов (что попадается, то и присоединяет). Если в легких на тот момент окажется кислорода меньше, чем может забрать гемоглобин (гипоксемия), а углекислого газа будет более, чем достаточно (гиперкапния), то он заберет его (СО2) и понесет к тканям с артериальной кровью (артериальная гипоксемия) вместо ожидаемого кислорода. Пониженная оксигенация тканей - прямой путь к развитию гипоксии, то есть, кислородному голоданию тканей.
Очевидно, что трудно разделить такие симптомы, как гипоксия, гиперкапния и гипоксемия - они лежат в основе развития острой дыхательной недостаточности и определяют клиническую картину ОДН.
Тесные связи
Привести ткани к кислородному голоданию могут различные причинные факторы, однако, учитывая неразрывную связь гипоксии, гиперкапнии и гипоксемии, эти категории целесообразно рассматривать, не отрывая друг от друга, тогда читателю будет понятно, что из чего вытекает.
Итак, гипоксию по ее происхождению делят на две группы:
Экзогенная гипоксия - кислородное голодание, возникающее вследствие снижения парциального давления О2 в воздухе, который мы вдыхаем и, соответственно, к недостаточному насыщению артериальной крови кислородом (менее 96% - гипоксемия). Такая форма гипоксии хорошо известна любителям полетов на больших высотах, покорения высоких гор, а также лицам, чья профессия связана с различными системами, обеспечивающими дыхание в необычных условиях (акваланг, барокамера), или людям, случайно попавшим в зону сильного загрязнения атмосферы вредными для человека газообразными веществами.
- Респираторную гипоксию, формирующуюся в результате альвеолярной гиповентиляции, которая возникает при различных обстоятельствах: травмах грудной клетки, непроходимости дыхательных путей, уменьшении поверхности легких, осуществляющих дыхательную деятельность, угнетении дыхательного центра, например, лекарственными средствами, воспалительных процессах и отеке легких. Это - различные заболевания органов дыхания: пневмония, эмфизема, пневмосклероз, ХОБЛ (хроническая обструктивная болезнь легких), а также поражение органов дыхания агрессивными ядами: фосгеном, аммиаком, сильными неорганическими кислотами (соляная, серная) и др.;
- Циркуляторную форму, в основе которой лежит острая и хроническая недостаточность системы кровообращения (врожденные пороки сердца, при которых венозная кровь, не заходя в малый круг кровообращения, попадает в левые отделы сердца, что случается, например, при открытом овальном окне);
- Тканевой вариант гипоксии, который имеет при отравлениях, затормаживающих передачу тканям кислорода, поскольку из-за подавления функциональной активности дыхательных ферментов те перестают его принимать и усваивать;
- Гемическую (кровяную) гипоксию - результат уменьшения в циркулирующей крови красных кровяных телец (эритроцитов) или снижения уровня красного пигмента (гемоглобина), связывающего кислород. Такая форма, как правило, характерна для различного рода анемичных состояний (острая кровопотеря, ЖДА, гемолитические анемии).
Тяжелую форму гипоксии легко отличить по таким признакам, как цианоз, учащенное сердцебиение, снижение артериального давления, возможны судороги и потеря сознания, что чревато быстрым развитием сердечно-сосудистой недостаточности, которая, если немедленно не ликвидировать первопричину, так же быстро может привести к гибели больного.
Излишнее накопление делает этот газ вредным для организма
В основе развития гиперкапнии находится нарушение соотношения между альвеолярной вентиляцией и накоплением СО2 в тканях и в крови (HbСО2) (показатель этого накопления - РаСО2, который в норме не должен превышать 45 мм. рт. ст.).
К гиперкапнии приводят следующие обстоятельства:
- Расстройства вентиляции, вызванные патологическим состоянием органов дыхания (обструкция) или нарушения, формируемые самим пациентом при попытке снизить дыхательный объем за счет глубины дыхания, поскольку вдох вызывает дополнительные болевые ощущения (травмы грудной клетки, операции на органах брюшной полости и др.);
- Угнетение дыхательного центра и нарушение регуляции в результате этого (травмы, опухоли, отек головного мозга, деструктивные изменения в тканях ГМ, отравление отдельными лекарственными средствами);
- Ослабление мышечного тонуса грудной клетки в результате патологических изменений.
Таким образам, к причинам возникновения гиперкапнии относят:
- ХОБЛ;
- Ацидоз;
- Инфекции бронхо-легочной системы;
- Атеросклероз;
- Профессиональную деятельность (пекари, сталевары, водолазы);
- Загрязнение воздуха, длительное пребывание в непроветриваемых помещениях, курение, в том числе, и пассивное.
рисунок: уровень углекислого газа в помещении и влияние на человека
Признаки увеличения в крови концентрации двуокиси углерода:
- Увеличивается частота сердечных сокращений;
- Проблема - уснуть ночью, зато сонливость днем;
- Кружится и болит голова;
- Тошнит, иной раз доходит до рвоты;
- Повышается внутричерепное давление, возможно развитие отека ГМ;
- Стремится вверх артериальное давление;
- Трудно дышать (одышка);
- Болит в груди.
При быстром увеличении содержания углекислого газа в крови существует опасность развития гиперкапнической комы, которая, в свою очередь, грозит остановкой дыхания и сердечной деятельности.
Факторы, тормозящие оксигенацию
Основу гипоксемии составляет расстройство насыщения кислородом артериальной крови в легких. Узнать, что в легких кровь не оксигенируется можно по такому показателю, как парциальное напряжение кислорода (РаО2), значения которого в норме не должны опускаться ниже 80 мм. рт. ст.
Причинами снижения оксигенации крови являются:
- Альвеолярная гиповентиляция, возникающая в результате влияния различных факторов, в первую очередь, недостатка кислорода во вдыхаемом воздухе, что влечет его снижение в альвеолах и приводит к развитию экзогенной гипоксии;
- Расстройство вентиляционно-перфузионных соотношений, возникающих при хронических заболеваниях легких - это самый частый причинный фактор развития гипоксемии и респираторной гипоксии;
- Шунтирование справа налево при нарушении кровообращения и попадании венозной крови сразу в левое сердце без посещения легких (пороки сердца) с развитием циркуляторной гипоксии;
- Нарушение диффузных способностей альвеолярно-капиллярной мембраны.
Чтобы читатель мог представить роль вентиляционно-перфузионных отношения и значение диффузных способностей альвеолярно - капиллярной мембраны, следует разъяснить суть данных понятий.
Что происходит в легких?
В легких человека газообмен обеспечивается вентиляцией и током крови по малому кругу, однако вентиляция и перфузия происходит не в равной степени. К примеру, отдельные зоны вентилируются, но не обеспечиваются кровью, то есть, в газообмене не участвуют или, наоборот, на каких-то участках кровоток сохранен, но они не вентилируются и тоже исключены из процесса газообмена (альвеолы верхушек легких). Расширение зон, не участвующих в газообмене (отсутствие перфузии), приводит к гипоксемии, которая чуть позже повлечет за собой и гиперкапнию.
Нарушение легочного кровотока вытекает из различных патологических состояний жизненно важных органов и, в первую очередь - кровеносной системы, которые становятся причинами гипоксемии:
пример развития гипоксемии при ТЭЛА
Диффузная способность альвеолярно-капиллярной мембраны, зависящая от многих параметров, может менять свои значения (увеличиваться и уменьшаться) в зависимости от обстоятельств (компенсаторно-приспособительные механизмы при нагрузке, изменении положения тела и др.). У людей взрослых молодых людей (за 20 лет) она снижается естественным образом, что считается физиологическим процессом. Чрезмерное уменьшение этого показателя наблюдается при заболеваниях органов дыхания (воспаление легких, отек, ХОБЛ, эмфизема), которые значительно снижают диффузионную способность АКМ (газы не могут преодолеть длинные пути, образованные в результате патологических изменений, а кровоток нарушается из-за уменьшения количества капилляров). По причине подобных нарушений начинают проявляться основные признаки гипоксии, гипоксемии и гиперкапнии, указывающие на развитие дыхательной недостаточности.
Признаки снижения О2 в крови
Признаки снижения кислорода могут проявиться быстро (концентрация кислорода падает, но организм пытается компенсировать потерю собственными силами) или запаздывать (на фоне хронической патологии основных систем жизнеобеспечения, компенсаторные возможности которых уже закончились).
- Синюшность кожных покровов (цианоз). Цвет кожи определяет тяжесть состояния, поэтому при слабой степени гипоксемии до цианоза обычно не доходит, но бледность, тем не менее, имеет место;
- Учащенное сердцебиение (тахикардия) - сердце пытается компенсировать недостаток кислорода;
- Снижение артериального давления (артериальная гипотензия);
- Обморочные состояния, если РаО2 падает до очень низких значений (менее 30 мм.рт. ст.)
Снижение концентрации кислорода в крови, конечно, ведет к страданиям головного мозга с нарушением памяти, ослаблением концентрации внимания, расстройствам сна (ночное апноэ и его последствия), развитием синдрома хронической усталости.
Небольшая разница в лечении
Гиперкапния и гипоксемия настолько тесно связаны между собой, что разобраться в лечении может только специалист, который проводит его под контролем лабораторных показателей газового состава крови. Общим в лечении этих состояний являются:
- Вдыхание кислорода (оксигенотерапия), чаще газовой смеси обогащенной кислородом (дозы и методы подбираются врачом с учетом причины, вида гипоксии, тяжести состояния);
- ИВЛ (искусственная вентиляция легких) - в тяжелых случаях при отсутствии сознания у больного (кома);
- По показаниям - антибиотики, препараты, расширяющие бронхи, отхаркивающие лекарственные средства, диуретики.
- В зависимости от состояния больного - ЛФК, массаж грудной клетки.
При лечении гипоксии, вызванной снижением концентрации кислорода, или повышением содержания углекислого газа нельзя забывать о причинах, повлекших данные состояния. По возможности стараются устранить их или хотя бы минимизировать влияние негативных факторов.
Биологическая роль эндотелия в условиях нормы
В работе предствлены современные данные отечественной и зарубежной литературы относительно биологической роли эндотелия сосудов в условиях нормы, участия эндотелия в регуляции сосудистого тонуса, коагуляционного потенциала крови, регуляции адгезии лейкоцитов, регуляции проницаемости сосудов и их реэндотелизацию за счет факторов роста
Ключевые слова
Обзор
Агабеков А.И., Рзаева Т.Ш.
Научные руководители: д.м.н., проф. Чеснокова Н.П., д.м.н., проф. Барсуков В.Ю
Кафедра патологической физиологии им. А.А. Богомольца
Введение
Эндотелиальные клетки имеют.гетерогенную структуру, обладающую многообразными функциями, а нарушение структуры и функций эндотелия является инициирующим фактором развития различных форм патологии. Эндотелиальная выстилка сосудов весьма разнообразна, в ряде органов и тканей имеет плотные межклеточные контакты, носит непрерывный характер, что свойственно для гематоэнцефалического барьера. В других органах и тканях, в частности, в почках, ряде эндокринных желез, эндотелий носит фенестрированный, синусоидальный характер, и тем самым обеспечивает селективную проницаемость для различных веществ (З. А. Лупинская, А. Г.Зарифьян, Т. Ц. Гурович, С. Г. Шлейфер 2008)
Сосудистый эндотелий, по мнению ряда авторов, является эндокринным органом, и выполняет многочисленные функции, в частности, регуляцию коагуляционного потенциала крови, а также сосудистого тонуса. Эндотелиальные клетки опосредуют воспалительные и иммунные процессы; регулируют адгезию лейкоцитов; модулируют окисление липидов; регулируют проницаемость сосудов, их реэндотелизацию за счет факторов роста.
Целью данной работы явился анализ данных литературы отечественных и зарубежных авторов относительно роли эндотелия в регуляции функциональной активности сосудистой стенки в условиях нормы.
Эндотелиальные факторы, регулирующие сосудистый тонус.
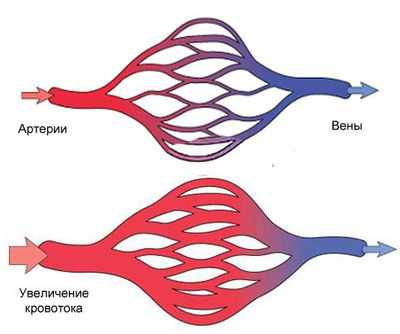
Среди эндотелиальных факторов, влияющих на сосудистый тонус, выделяют вазодилатирующие факторы, к которым относятся NO, EDHF (эндотелиальный гиперполяризующий фактор), простациклин, адреномедуллин, моноокись углерода, пуриновые основания, эндогенные каннабиоиды, Na-уретический пептид С, кинины и ряд других. К вазоконстрикторным факторам, продуцируемым эндотелиальными клетками, относятся тромбоксан А2, эндотелины, 20-HETE (20-гидрооксиэйкозотетраеновая кислота), ангиотензин II. Балланс между факторами релаксации и констрикции определяет тонус сосудов и соответственно величину местного кровотока. (Каде А.Х., Занин С.А., Губарева Е.А. и др. , 2011)
Вазодилатирующие факторы, продуцируемые эндотелием
Касаясь биологических эффектов ряда вазодилатирующих соединений, синтезируемых в эндотелиальных клетках, следует прежде всего остановиться на эффектах NO.
NО образуется в клетках эндотелия из L-аргинина под действием фермента NO-синтетазы. Имеются два уровня секреции NO — базальный и стимулированный. Тонус сосудов в покое осуществляется постоянной базальной секрецией. Некоторые химические вещества: ацетилхолин, АТФ, брадикинин, а также гипоксия или механическая деформация увеличивают синтез NO. Стимулируя гуанилатциклазу, NO увеличивает образование цГМФ в гладкомышечных клетках, тромбоцитах, что обусловливает расслабление сосудов, ингибирует пролиферацию гладкомышечных клеток и тормозит активность тромбоцитов и макрофагов. (В. Ф. Киричук, А. П. Ребров, С. И. Россошанская, 2005)
Простациклин синтезируется преимущественно в эндотелии. Основным механизмом, регулирующим его образование, является активность ферментов циклооксигиназ. Простациклин оказывает вазодилатирующее действие за счет стимуляции специфических рецепторов, локализованных на гладкомышечных клеток сосудов, что ведет к повышению активности в клетках аденилатциклазы и увеличение образования цАМФ. (Дзгоева Ф. У., Кутырина И. М. 2000)
При блокировании действия NO и простациклина вазодилатацию вызывает эндотелиальный фактор гиперполяризации (EDNF). Данный фактор выделяется только под действием некоторых стимулов: ацетилхолина, брадикинина, тромбина, гистамина, субстанции Р, АДФ, АТФ. EDNF является мощным вазодилататором, воздействующим на Cа ++ -зависимые К + -каналы гладкомышечных клеток сосудов, стимулируя выход из них ионов калия, который вызывает их гиперполяризацию и расслабление.
Пуриновые основания, эндогенными источниками которых являются тромбоциты, эндотелиоциты, нейроны и другие клетки, действуют на различные рецепторы клеток сосудистой стенки: при воздействии на рецепторы эндотелия, происходит стимуляция образования основных вазодилатирующих факторов: простациклина, оксида азота, эндотелиального гиперполяризующего фактора; при воздействии на рецепторы гладкомышечных клеток сосудов пуриновые нуклеотиды вызывают эндотелий-независимую вазодилатацию.
К эндогенным каннабиоидам относят анаидамид и 2-арахидонилглицерин, источниками которых являются клетки эндотеия, тромбоциты, лейкоциты, макрофаги, а также периваскулярные нервные окончания. Анаидамид и 2-арахидонилглицерин образуются в больших количествах при активации тромбоцитов и моноцитов и участвуют в механизмах снижения артериального давления при различных патологических состояниях. (Чурюканов М. В., Чурюканов В. В., 2004)
Известны еще два фактора, выделяемые эндотелием и вызывающие дилатацию сосудов: натрийуретический пептид С-типа (НПС) и адреномедуллин. Натрийуретический пептид С вызывает релаксацию сосудов и угнетает пролиферацию гладкомышечных клеток. Большей частью НПС синтезируется в эндотелии, воздействует на рецепторы гладкомышечных клеток, вызывая увеличение образования цГМФ, приводящего к расширению сосуда. Адреномедуллин действует как прямой вазодилататор за счет увеличения продукции цАМФ. В результате активации аденилатциклазы образуется из препроадреномедуллина в эндотелиальных и гладкомышечных клетках сосудов. Доказано. что сосудорасширяющее действие адреномедуллина связано как с эндотелий-зависимыми, так и с эндотелий-независимыми механизмами. Предполагается наличие специфических рецепторов к адреномедуллину. (Kitamura K. et al. Adrenomedullin, 1993)
Моноокись углерода образуется из гема под действием двух изоформ гемоксигеназ (НО-1 и НО2). Образуется СО в различных регионах, но преимущественно - в эндотелии сосудов мозга (Faraci F.M., Heistad D.D., 1998), где участвуют в регуляции кровотока, непосредственно вызывая расслабление мозговых сосудов. (Черток В. М., Коцюба А. Е., 2012)
Калликреин-кининовая система. Вазодилатирующий эффект кининов связан с активацией В2 рецепторов на эндотелии и образованием основных эндотелиальных вазодилатирующих факторов - NO, простациклина, EDHF.
Вазоконстрикторные факторы, продуцируемые эндотелием
Эндотелиальные факторы вызывают сужение сосудов, что связано с отсутствием высвобождения факторов релаксации и с продукцией констриктивных агентов. К вазоконстрикторам, синтезирующимся в эндотелиальных клетках относят эндотелины, тромбоксан А2, 20-HETE (20-гидрооксиэйкозотетраеновая кислота), ангиотензин II.
Эндотелины - наиболее мощные вазоактивные вещества. Самый изученный представитель данной группы - эндотелин-1. В физиологических концентрациях он действует на эндотелиальные рецепторы, вызывая высвобождение факторов релаксации, а в более высоких - активируют рецепторы на гладкомышечных клетках, стимулируя стойкую вазоконстрикцию и пролиферацию медии. (Дремина Н. Н., Шурыгин М. Г., Шурыгина И. А., 2016)
Тромбоксан А2 преимущественно синтезируется в тромбоцитах, но некоторое его количество образуется в эндотелии. Специфические рецепторы к нему расположены на гладкомышечных клетках сосудистой стенки. Сокращение гладкомышечных клеток при стимуляции тромбоксаном связано со снижением активности аденилатциклазы и повышением содержания внутриклеточного кальция. (Дзгоева Ф. У., Кутырина И. М., 2000)
Ангиотензин ||, образуется в результате активации ренин-ангиотензиновой системы и является одним из наиболее сильных вазоконстрикторов. Активация данной системы может происходить как на системном уровне при выделении ренина клетками юкстагломерулярного комплекса почек, так и локально, на уровне эндотелия, в котором образуется ренин и ангиотензин-превращающий фермент. (Бабак О. Я., Кравченко Н. А. 2005)
Вазоконстрикторную функцию выполняет 20-гидроксиэйкозотетраеновая кислота (20-НЕТЕ) - продукт обмена арахидоновой кислоты по монооксигеназному пути. 20-НЕТЕ, действуя на гладкомышечные клетки сосудов, вызывает деполяризацию клеточных мембран. Его образование увеличивается под действием ангиотензина 2 и эндотелина-1, а также при гипероксии и является одним из ведущих факторов высокого артериального давления. Увеличение его образовния сопровождается включением тормозных регуляторных механизмов активацией синтеза простациклина, т.е. сохраняется принцип антагонистической регуляции.
Роль эндотелия в регуляции коагуляционного потенциала крови
Одной из важных функций эндотелия является обеспечение тромборезистентности сосудистой стенки, а с другой стороны ее тромбогенности. К числу тромбогенных факторов, стимулирующих процессы адгезии и агрегации тромбоцитов относится vWF (фактор Виллебранда), PAF (фактор активации тромбоцитов), АДФ, тромбоксан А2 Адгезия тромбоцитов к эндотелию - это начальный этап процессов гемостаза и тромбоза, что приводит к формированию тромбоцитарного тромба, активации плазменных прокоагулянтов с последующим образованием тромбина. К ингибиторам синтеза тромбина относятся: тромбомодулин, протеогликаны, предотвращающие избыточное фибринообразование. Тромборегуляторы оказывают влияние не только на гемостаз, но и проницаемость сосудов, вазомоторные реакции, ангиогенез, клеточную пролиферацию. (Петрищев Н.Н., Власов Т.Д. 2003)
Как указывалось выше, при гипоксии и действии медиаторов, увеличивающих синтез NO, в эндотелиальных клетках, медии и адвентиции синтезируется простациклин. Простациклин активирует аденилатциклазу, следствием чего является увеличение содержания цАМФ, который, помимо выполнения вазодилатирующей функции, препятствует активации тромбоцитов и вызывает релаксацию сосудов. Нарушение синтеза простациклина или снижение его поступления в кровь создает тромбогенную опасность. NO подавляет адгезию и агрегацию тромбоцитов. Этот процесс ассоцирован с увеличением содержания в тромбоцитах цГМФ.
Тромбогенный риск повышается по мере снижения содержания в плазме крови активных антитромбинов, в первую очередь АТ III, при одновременном наличии предрасполагающих факторов — гиперлипидемии, ожирения, диабета, сердечной недостаточности. (Suck G., Traut W. 2000)
Эндотелий играет важную роль в развитии фибринолиза за счет секреции тканевого и урокиназного активаторов плазминогена и его ингибиторов, которые могут или быстро нейтрализовать плазмин, или препятствуют активации плазминогена. Под влиянием гемодинамических факторов, пристеночного напряжения сдвига, трансмурального давления и ряда других факторов возникает динамическое изменение синтеза и секреции тромбогенных и атромбогенных субстанций эндотелия. В физиологических условиях выделение атромбогенных субстанций преобладает над тромбогенными. (Петрищев Н.Н., Власов Т.Д. 2003)
Физиологический антикоагулянтный комплекс - это система протеина С (Pr C), в которую входит тромбомодулин, протеин С, протеин S, тромбин (активатор Pr C) и ингибитор Pr C. Функцией данной системы является ингибирование факторов свертывания крови Va и VIIIa, инактивация ингибитора тканевого активатора плазминогена. (Айламазян Э. К., Мозговая Е. В. 2008)
В регуляции гемостатической функции эндотелия большое значение имеют гормоны вазопрессин, эстрогены, цитокины: интерлейкин-1, TNF- α, гемодинамические факторы. К факторам эндотелиального происхождения, ингибирующим адгезию и агрегацию тромбоцитов, относят простациклины, простагландины Е2, NO.
Значение эндотелия в регуляции адгезии лейкоцитов
Исключительно важную роль играет эндотелий в развитии адгезии лейкоцитов. К адгезивным молекулам эндотелия относятся Р-селектин, GMP-140, ELAM-1, ICAM. Повышение адгезивности эндотелия имеет большое значение в патогенезе воспалительных процессов, атеросклерозе, септическом шоке. Однако до настоящего момента остается не изученным значение нарушения адгезивных свойств сосудистой стенки в патогенезе неоплазий различной локализации и развитии метастазирования малигнизированных клеток.
Значение эндотелиальных клеток в процессе ангиогенеза
Эндотелию принадлежит значительная роль в процессе ангиогенеза в условиях патологии. В стабильном состоянии эндотелиоциты пролиферируют лишь раз в 10 лет. Под действием ангиогенных факторов происходит пролиферация эндотелиоцитов, которая заканчивается их дифференцировкой и реэндотелизацией сосудов. Эндотелий активно участвует в процессе кооперации между эндотелиоцитами и окружающими клетками, выделяя факторы роста (VEGF, FGF-2), вызывая таксис и пролиферацию гладкомышечных клеток и фибробластов.
Эндотелиальная дисфункция является одним из универсальных патогенетических факторов развития таких форм патологии как атеросклероз, гипертоническая болезнь, сахарный диабет, тромбогеморрагический синдром и канцерогенез. Причинами эндотелиальной дисфункции могут быть ишемия, гипоксия тканей, свободно-радикальное повреждение, цитокины и ряд других факторов.
Заключение
В патогенезе заболеваний различного генеза большое значение имеют нарушения функциональной активности сосудистой стенки, являющейся, по существу, эндокринным органом, регулирующим состояние сосудистого тонуса, коагуляционного и тромбоцитарного-сосудистого звеньев системы гемостаза, фибринолиз, адгезивно-агрегационные способности эндотелия, процессы ангиогенеза, экспрессирующие белки МНС I и II классов, участвующих в ряде случаев в представлении антигенов-аллергенов, а также продуцирующим различные цитокины локального и системного действия. В патогенезе заболеваний различной этиологии важная роль относится эндотелиальной дисфункции, в связи с этим абсолютно необходимо знание многочисленных функций сосудистой стенки в условиях нормы и маркеров эндотелиальной дисфункции, свидетельствующих о развитии патологии.
Литература
1. Петрищев Н.Н., Власов Т.Д. Физиология и патофизиология эндотелия/Дисфункция эндотелия. Под ред. Н.Н. Петрищева. СПбГМУ 2003: стр. 4—38.
2. Киричук В. Ф., Ребров А. П., Россошанская С. И. Тромбоз. Гемостаз. Реология./Функции эндотелия сосудистой стенки 2005 №2: стр. 23
3. Каде А.Х., Занин С.А., Губарева Е.А., Туровая А.Ю., Богданова Ю.А., Апсалямова С.О., Мерзлякова С.Н. Физиологические функции сосудистого эндотелия // Фундаментальные исследования. - 2011. - № 11-3. - С. 611-617;
4. Барсуков В.Ю., Чеснокова Н.П., Агабеков А.И., Бизенкова М.Н. Показатели эндотелиальной дисфункции и состояния коагуляционного потенциала крови как объективные критерии инициации и малигнизации клеток при раке толстой кишки // Современные проблемы науки и образования. - 2015. - № 6.;
5. Агеев, Ф.Т. Роль эндотелиальной дисфункции в развитии и прогрессировании сердечно-сосудистых заболеваний / Ф.Т. Агеев // ЖСН. 2004.-Т. 4, № 1.-С. 21-22.
6. Чурюканов М. В., Чурюканов В. В. Функциональная организация и терапевтический потенциал эндогенной каннабиноидной системы //Экспериментальная и клиническая фармакология. - 2004. - Т. 67. - №. 2. - С. 70-78.
7. Воскобой И. В., Семенов А. В., Мазуров А. В. и др. Активность тромбоцитов и функциональное состояние эндотелия у больных с нестабильной стенокардией с благоприятным и неблагоприятным исходом (проспективное исследование) / // Кардиология. — 2002. — № 9. — С. 4-11
8. Бокерия, Л.А. Современное общество и сердечно-сосудистая хирургия / Л.А. Боке-рия // Тез. докл. V Всерос. съезда сердечно-сосудистых хирургов. М., 1999. - С.З-6.
9. Дзгоева Ф. У., Кутырина И. М. Тромбоксан А2 и простациклин у больных хроническим гломерулонефритом и ишемической болезнью сердца в условиях нефротоксического действия рентгеноконтрастных средств //Протективное действие антагонистов кальция. Тер. арх. - 2000. - Т. 6. - С. 42-45.
10. Айламазян Э. К., Мозговая Е. В. Гестоз: теория и практика //М.: МЕДпресс-информ. - 2008. - Т. 272.
11. Черток В. М., Коцюба А. Е. Эндотелиальный (интимальный) механизм регуляции мозговой гемодинамики: трансформация взглядов //Тихоокеанский медицинский журнал. - 2012. - №. 2 (48).
12. Бабак О. Я., Кравченко Н. А. Роль ренин-ангиотензиновой системы в ремоделировании сердца и сосудов //Укр. терапевт. журн. - 2005. - №. 2. - С. 89-96.
13. Дремина Н. Н., Шурыгин М. Г., Шурыгина И. А. Эндотелины в норме и патологии //Международный журнал прикладных и фундаментальных исследований. - 2016. - №. 10-2. - С. 210-214.
14. Kitamura K. et al. Adrenomedullin: a novel hypotensive peptide isolated from human pheochromocytoma //Biochemical and biophysical research communications. - 1993. - Т. 192. - №. 2. - С. 553-560
15. Suck G., Traut W. TROMB, a new retrotransposon of the gypsy-Ty3 group from the fly Megaselia scalaris //Gene. - 2000. - Т. 255. - №. 1. - С. 51-57.
16. Baylis C., Vallance P. Measurement of nitrite and nitrate levels in plasma and urine—what does this measure tell us about the activity of the endogenous nitric oxide system? Curr Opin Nephrol Hypertens 1998 Jan;7(l):59-62.
17. Moncada S., Vane J,R. Pharmacology and endogenous roles of prostaglandin endoperoxides, thromboxane A2 and prostacyclin. Pharmacol Rev 1979;30:293-331
18. Faraci F. M., Heistad D. D. Regulation of the cerebral circulation: role of endothelium and potassium channels //Physiological reviews. - 1998. - Т. 78. - №. 1. - С. 53-97.
Вазодилататорная и гипоксическая теория регуляции кровотока в органах и тканях
Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского, Москва
Российский научный центр восстановительной медицины и курортологии Минздравсоцразвития, Москва
Некоторые молекулярные эффекты физических упражнений
Журнал: Вопросы курортологии, физиотерапии и лечебной физической культуры. 2014;91(6): 62‑67
Долгов И.М., Бадтиева В.А. Некоторые молекулярные эффекты физических упражнений. Вопросы курортологии, физиотерапии и лечебной физической культуры. 2014;91(6):62‑67.
Dolgov IM, Badtieva VA. Certain molecular effects of physical exercises. Voprosy kurortologii, fizioterapii, i lechebnoi fizicheskoi kultury. 2014;91(6):62‑67. (In Russ.).
Согласно современным наблюдениям, физические тренировки - простое и эффективное средство снижения риска как возникновения, так и осложнений сердечно-сосудистых заболеваний. Среди многочисленных эффектов - влияние регулярных физических тренировок на ангиогенез и артериогенез, реологические свойства крови, гипертрофию и ремоделирование миокарда левого желудочка. В обзоре представлены некоторые современные представления о молекулярных механизмах, лежащих в основе влияния физических упражнений на указанные процессы: активацию продукции оксида азота, влияние на функцию прогениторных клеток, стимуляцию резидентных стволовых клеток миокарда.
Физические тренировки - наиболее доступный и очень эффективный метод снижения риска сердечно-сосудистых заболеваний. Американский колледж кардиологов и Американская ассоциация сердца рекомендуют ежедневную 30-минутную умеренную физическую нагрузку (50-70% от максимальной ЧСС) для снижения риска сердечно-сосудистых заболеваний [1].
В многочисленных исследованиях, например таком крупном, как исследование Aerobics Center Longitudinal Study (более 25 тыс. мужчин и 7 тыс. женщин, прослеженных в среднем в течение 8 лет), подтверждено, что физическая активность является основой снижения влияния всех факторов риска и уменьшения летальности, в том числе и от сердечно-сосудистых причин [2].
Регулярные аэробные упражнения улучшают функцию сердечно-сосудистой системы не только у здоровых субъектов, но и у пациентов с ИБС [3, 4]
В последние 15-20 лет выясняются генные и молекулярные механизмы, лежащие в основе этих влияний, и то, каким образом физические нагрузки модифицируют ход этих процессов.
Физические тренировки и дисфункция эндотелия
«Наш возраст - это возраст наших артерий» - утверждал Рудольф Альтшуль [5] в 1954 г. в своей книге «Эндотелий - его развитие, морфология, функция и патология». Со временем это научное предвидение стало многократно подтвержденным фактом: эндотелиальная дисфункция - обязательный этап в развитии раннего атеросклероза. Риск сердечно-сосудистых осложнений значимо - в 3-4 раза возрастает у людей с эндотелиальной дисфункцией [6].
Адекватно функционирующая эндотелиальная нитроксидсинтаза (eNOS) - ключевой показатель интактного эндотелия. Синтез оксида азота (NO) происходит из L-аргинина. Путем диффузии короткоживущие молекулы NO достигают гладкомышечных клеток медии и вызывают вазодилатацию через циклический гуанозинмонофосфатный (цГМФ) путь. Возможными причинами развития эндотелиальной дисфункции могут быть: уменьшение количества субстрата или кофакторов [7], снижение количества или активности eNOS или инактивация NO за счет активных форм кислорода [8].
В условиях недостаточного количества субстрата (L-аргинина), повышения уровня асимметричного диметиларгинина (ингибитора синтеза) либо снижения уровня кофакторов (тетрагидробилптерин) результатом деятельности eNOS вместо молекул NO становятся активные формы кислорода (супероксид). Очевидно, что такое изменение направления синтеза приводит к нарушению контроля сосудистого тонуса. В экспериментах показано, что физические нагрузки увеличивают содержание тетрагидробиоптерина, снижают концентрацию асимметричного диметиларгинина [9] и восстанавливают нормальную функцию eNOS.
Физические нагрузки влияют непосредственно на концентрацию eNOS в субстрате. Так, в эндотелии внутренней грудной артерии пациентов, получавших физические тренировки в течение четырех недель перед операцией, содержание eNOS было в 2,5 раза, а ее активность - в 4 раза выше, чем в контроле [10].
Биодоступность NO также зависит от количества активных форм кислорода. В экспериментальных и клинических исследованиях установлено, что физические тренировки увеличивают сосудистую экспрессию антиоксидантных энзимов (таких, как супероксиддисмутаза, глютатионпероксидаза) [11] и уменьшают экспрессию энзимов, связанных с продукцией активных форм кислорода (НАДФ-оксидаза, ксантиноксидаза) [12]. Физические нагрузки в течение четырех недель снижают экспрессию рецепторов к ангиотензину II, которые, в частности, регулируют активность НАДФ-оксидазы [13].
Для поддержания целостности слоя клеток эндотелия абсолютно необходимо присутствие эндотелиальных прогениторных клеток (ЭПК). Количество и функциональная активность прогениторных клеток коррелирует с количеством факторов риска и тяжестью сердечно-сосудистой патологии и является предиктором осложнений и смерти. Эти клетки мобилизуются из костного мозга при физических нагрузках, как сопровождающихся [14], так и не сопровождающихся ишемией [15]. На интенсивность процесса напрямую влияет активность eNOS - ключевого механизма мобилизации ЭПК. Физические нагрузки за счет стимуляции eNOS увеличивают выделение NO, который, активируя матриксную металлопротеазу-9 в костном мозге, увеличивает число циркулирующих ЭПК [16].
Влияние физических нагрузок на функцию эндотелия коронарных артерий подтверждено в клинических исследованиях: тренировки на выносливость в течение четырех недель вызывали существенный (до 80%) прирост кровотока по коронарным артериям в ответ на введение ацетилхолина [17, 18].
Физические тренировки и регуляция сосудистого тонуса
В настоящее время выявлен ряд механизмов, участвующих в регуляции сосудистого тонуса, в том числе эндотелий-зависимая потокиндуцированная вазодилатация, миогенный контроль и метаболическая вазодилатация. Вклад каждого из этих механизмов в вазодилатацию коронарных артерий различен и зависит от диаметра сосуда. Эндотелий-зависимая дилатация наиболее выражена в артериях диаметром до 150 мкм, миогенный и метаболический контроль доминирует в резистивных артериях меньшего диаметра [19, 20].
На стенку артерии действуют две основные силы: радиальной направленности в результате прохождения по сосудистому руслу пульсовой волны давления и ламинарное напряжение сдвига, связанное с трением крови о стенку артерии. Увеличение радиальных напряжений (при повышении артериального давления) увеличивает атерогенный риск, в то время как напряжение сдвига - результат пульсирующего постоянного потока крови - положительный сигнал для эндотелиальных клеток. На молекулярном уровне напряжение сдвига задействует множественные сигнальные пути [21], в том числе фосфоинозитолкиназу-3, митогенактивируемую протеинкиназу-7 и оксид азота [22]. В трансформации механического сигнала в биохимический участвует цитоскелет эндотелиальной клетки и целый ряд ферментных систем (белки адгезии, рецепторы фактора роста эндотелия сосудов (VEGFК2), трансмембранная тирозинкиназа и др.). VEGFК2 активирует фосфоинозитолкиназу-3, которая участвует в активации эндотелиальной NO-синтазы. Такой ответ на напряжение сдвига возникает только при ламинарном течении по сосуду. Любые изменения потока - турбулентный поток, разрывы потока или его реверсия, малая скорость или наличие градиента - ведут к пролиферации и апоптозу эндотелиальных клеток, увеличению продукции активных форм кислорода и экспрессии маркеров воспаления, т.е. трансформации сосуда в преатеросклеротический фенотип [23]. При наличии факторов риска - гипертензии, диабета, дислипидемии - атерогенез значительно ускоряется.
Метаболическая регуляция сосудистого тонуса обеспечивает соответствие коронарной перфузии (концентрации кислорода) метаболизму миокарда. Предполагается, что имеются кислородные (метаболические) сенсоры, сопряженные с эффекторными механизмами, влияющими на тонус сосудов [24]. Основную роль в метаболической вазодилатации отводят аденозину. Установлено, что содержание аденозина в межклеточной жидкости является необходимым условием адекватного кровоснабжения здорового сердца [25]. Аденозин легко проходит через мембрану кардиомиоцита в межклеточное пространство и вызывает расслабление мышечных клеток в стенках коронарных артерий. При регулярных физических нагрузках увеличивается содержание и активность фермента нуклеотидазы, участвующей в гидролизе АМФ, что ведет к образованию дополнительного количества аденозина и возрастанию защитного «дилатационного» потенциала коронарного русла [26].
Миогенная регуляция сосудистого тонуса (эффект Бейлиса-Остроумова) основана на реакции гладкомышечных клеток сосудов на растяжение. Колебания АД изменяют растяжение стенки и гладкомышечных клеток сосудов. При повышении АД растяжение гладкомышечных клеток возрастает, но в ответ на растяжение происходит их сокращение и тонус артерий возрастает, они суживаются, сосудистое сопротивление увеличивается. Благодаря этому механизму повышение АД сопровождается сокращением гладкой мускулатуры артериол органов, в результате чего не допускается гиперперфузия органов. Напротив, при снижении АД растяжение стенки сосудов ослабевает, гладкие мышцы сосудов расслабляются, что позволяет поддерживать региональное кровообращение в этих условиях. В физиологических условиях миогенный тонус определяется кальциевыми каналами L-типа и активностью протеинкиназы С [27]. Повышенный миогенный тонус у тренированных животных обусловлен изменением экспрессии протеинкиназы С, что в итоге увеличивает количество внутриклеточного кальция [28].
Влияние физических тренировок на ангиогенез и артериогенез
Ангиогенез - образование новой сосудистой сети от уже существующих сосудов, в результате чего увеличивается плотность капиллярной сети в ишемизированных тканях и уменьшается периферическое сосудистое сопротивление, что необходимо для обеспечения перфузии тканей и органов. Основной стимул процесса - гипоксия или ишемия (физиологическая или патологическая). Недостаток кислорода приводит к увеличению количества фактора, индуцируемого гипоксией (HIF-1). Данный фактор (помимо других функций - в частности, модуляции эритропоэза) стимулирует высвобождение белков VEGF. Циркулирующий белок VEGF связывается с VEGF-рецептором на клетках эндотелия и запускает ангиогенез. Процесс включает активацию эндотелиальных клеток, экспрессию в них протеаз, деградацию внеклеточного матрикса, пролиферацию и миграцию этих клеток, образование ими первичных высокопроницаемых сосудистых структур, последующую стабилизацию и «созревание» этих структур за счет привлечения перицитов и гладкомышечных клеток и организации их в сложную трехмерную сосудистую сеть [29]. Помимо деления существующих эндотелиальных клеток в процессе участвуют ЭПК костного мозга, которые способны формировать отдельные локусы неоваскуляризации, в том числе у пациентов, перенесших острый инфаркт миокарда [30].
У пациентов с ИБС снижены количество и функциональная активность циркулирующих ЭПК, причинами чего могут быть возраст, курение, сахарный диабет и гипертоническая болезнь, причем это снижение тем более выражено, чем большее количество факторов риска имеется у пациента [31]. Нагрузки стимулируют оба звена ангиогенеза [32] как у здоровых людей, так и у больных ИБС [33, 34]. Другие обнаруженные механизмы влияния физических упражнений на ангиогенез - это гиперэкспрессия фактора роста эндотелия сосудов в миокарде [35] и уменьшение уровня эндостатина в плазме [36].
Артериогенез - формирование коллатеральных сосудов из предсуществующих, но не функционирующих артериолярных соединений. В отличие от ангиогенеза, артериогенез происходит в условиях нормальной оксигенации тканей. При окклюзии крупного сосуда увеличивается кровоток по коллатералям, в них растет внутрисосудистое давление и увеличивается напряжение сдвига, являющееся ключевым фактором сосудистой трансформации. Запускаются по меньшей мере два процесса: инициация клеточного цикла эндотелиальных и гладкомышечных клеток и привлечение клеток костного мозга. Изменяются свойства гладкомышечных клеток сосудов: они приобретают, взамен сократительной, способность к синтезу, пролиферации и образованию неоинтимы [37].
Происходит протеолиз эластических компонентов сосудистой стенки, внесосудистого матрикса и неделящихся гладкомышечных клеток. Такая контролируемая деструкция структурных препятствий обеспечивает предпосылки к росту коллатеральных сосудов [38]. Вырабатываемые эндотелиальными клетками компоненты увеличивают мобилизацию и привлечение прогениторных клеток костного мозга в зону артериогенеза.
Физические нагрузки увеличивают диаметр больших и малых артериол. Эксперименты на животных и клинические наблюдения показывают значительную корреляцию между регулярностью нагрузок и увеличением диаметра коронарных артерий. В экспериментальных исследованиях показано, что физические нагрузки значимо увеличивают поперечное сечение коронарного русла. Аналогичные эффекты наблюдаются и в скелетных мышцах. Хорошо известно, что тренировки на выносливость увеличивают капиллярные русла у животных и человека [39, 40].
Физические тренировки и микроциркуляция
Оксид азота в организме образуется четырьмя изоформами нитроксидсинтазы, одной из которых является эритроцитарная нитроксидсинтаза (RBC-NOS). В экспериментах было показано, что постоянная деформация сдвига активирует RBC-NOS и увеличивает продукцию NO [41].
Физические тренировки увеличивают напряжение сдвига в сосудистом русле. Эти напряжения активируют RBC-NOS, увеличивая продукцию NO. Один из эффектов NO - улучшение такого качества эритроцитов, как способность к деформации [42]. Это качество облегчает эритроцитам прохождение по сосудам, что в итоге увеличивает кровоток по микроцикуляторному руслу и улучшает снабжение тканей кислородом при возрастании потребности в нем. Эритроциты содержат большое количество АТФ. Степень выделения АТФ эритроцитами напрямую зависит от степени их деформации: чем больше деформация эритроцитов, тем больше выделяется АТФ и сильнее расслабляются сосуды, облегчая движение эритроцитов [43]. Таков один из механизмов влияния физических тренировок на микроциркуляцию.
Влияние физических нагрузок на репаративные процессы в миокарде
Взрослое сердце млекопитающих долгое время рассматривалось как постмитотический орган, который имеет относительно постоянное число кардиомиоцитов, прекращающих деление после рождения. В ответ на функциональный стресс сердце может лишь увеличивать свою мышечную массу (миокард) за счет клеточной гипертрофии.
Работами последних лет показано, что принципиально существуют две возможности реализации репаративных процессов в миокарде: за счет эндогенных стволовых клеток сердца и ЭПК, мобилизуемых из костного мозга.
Обнаружение в миокарде взрослых особей резидентных стволовых/прогениторных клеток стало новым шагом в биологии сердца. Подтверждается гипотеза о том, что эти клетки, трансформируясь в кардиомиоциты, участвуют в процессе гипертрофии миокарда при физических нагрузках [44].
Положительное влияние физических упражнений заключается не только в снижении факторов риска, но и в прямом воздействии на структуру и функцию сердца, в том числе образование кардиомиоцитов [45]. Показано, что физические тренировки на тредмиле приводят к активации стволовых/прогениторных клеток с формированием новых кардиомиоцитов и микрокапилляров, т.е. физиологическая адаптация сердца к стрессу, обусловленному физическими нагрузками, является комбинацией гипертрофии и гиперплазии кардиомиоцитов [46].
Такие прогениторные клетки, как CD45 + /CD34 + - и CD45 + /CD133 + -стволовые клетки, способны к пролиферации, миграции и дифференцировке в различные виды взрослых клеток [47]. Установлено, что на количество таких клеток напрямую влияют физические тренировки: при выполнении регулярных, на уровне переносимости (появления симптомов ишемии) физических нагрузок отмечено временное повышение количества и увеличение функциональной активности циркулирующих прогениторных клеток, улучшаются миграционные и колониеобразующие способности этих клеток [48].
Заключение
Физические нагрузки - мощнейший и легкодоступный метод воздействия с доказанной клинической эффективностью. Несмотря на множество еще не решенных вопросов, прогресс в понимании молекулярных механизмов влияния физических упражнений на сердечно-сосудистую систему - залог совершенствования существующих и разработки новых методик физической реабилитации пациентов.
Чурсин В.В. Клиническая физиология кровообращения (методические материалы к лекциям и практическим занятиям)
Чурсин В.В. Клиническая физиология кровобращения. Методические материалы к практическим и семинарским занятиям, - 2011. - 44 с.
Содержит информацию о физиологии кровообращения, нарушениях кровообращения и их вариантах. Также представлена информация о методах клинической и инструментальной диагностики нарушений кровообращения.
Данные материалы являются переработанным вариантом предыдущих изданий (1999г., 2003г.), первым автором которых являлся В.Ф.Туркин - доцент кафедры анестезиологии и реаниматологии АГИУВ.
Предназначается для врачей всех специальностей, курсантов ФПК и студентов медвузов.
Введение
Академик В.В.Парин (1965г.) дает такое пояснение: «Клиническая физиология исходит из положения, что в организме при болезни многие возникающие реакции являются приспособительными. Под влиянием чрезвычайных раздражителей приспособительные реакции резко изменяются и, приобретая опасное для организма значение, становятся реакциями патологическими. Переход приспособительных реакций в патологические является узловым звеном в патогенезе заболеваний. А его детальное изучение является одной из главных задач клинической физиологии кровообращения».
Исходя из этого пояснения, можно отметить, что значение клинической физиологии любой системы предполагает:
Более образно это можно представить в следующем виде (рисунок 1).
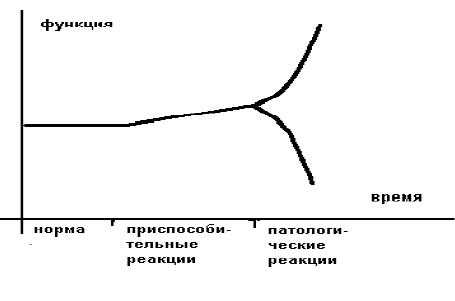
Приспособительные реакции обеспечивают компенсацию, а патологические реакции обуславливают декомпенсацию страдающего органа или страдающей системы. В общем виде отличием (границей) между нормой и приспособлением является изменение свойств приспосабливающего органа или приспосабливающейся системы.
Границей между приспособлением и патологией является резкое изменение ("излом") приспособительной реакции по направлению и величине.
Различают срочные приспособительные реакции и долговременные. Врачам интенсивной терапии чаще приходится иметь дело с острыми расстройствами, поэтому необходимы знания срочных приспособительных реакций и их переход в патологические.
Кровообращение - определение, классификация
Кровообращение - это непрерывное движение (обращение) крови по замкнутой системе, именуемой сердечно-сосудистой.
- 2 - аорта и крупные артерии, имеют много эластических волокон, представляются как буферные сосуды, благодаря им резко пульсирующий кровопоток превращается в более плавный;
- 3 - прекапиллярные сосуды, это мелкие артерии, артериолы, метартериолы, прекапиллярные жомы (сфинктеры), имеют много мышечных волокон, которые могут существенно изменить свой диаметр (просвет), они определяют не только величину сосудистого сопротивления в малом и большом кругах кровообращения (поэтому и называются резистивными сосудами), но и распределение кровопотока;
- 4 - капилляры, это обменные сосуды, при обычном состоянии открыто 20-35% капилляров, они образуют обменную поверхность в 250-350 кв.м., при физической нагрузке максимальное количество открытых капилляров может достигать 50-60%;
- 5 - сосуды - шунты или артериоло-венулярные анастомозы, обеспечивают сброс крови из артериального резервуара в венозный, минуя капилляры, имеют значение в сохранении тепла в организме;
- 7 - вены, крупные вены, они обладают большой растяжимостью и малой эластичностью, в них содержится большая часть крови (поэтому и называются емкостными сосудами), они определяют "венозный возврат" крови к желудочкам сердца, их заполнение и (в определенной мере) ударный объём (УО).
Объем циркулирующей крови (ОЦК)
Вопрос объема имеет важное значение. Прежде всего потому, что определяет наполнение камер сердца и таким образом влияет на величину УО.
По классическому представлению ОЦК составляет у мужчин 77 и у женщин 65 мл/кг массы тела 10%. В среднем берётся 70 мл/кг.
Необходимо чётко представлять, что ОЦК является «жидким слепком сосудистой системы» - сосуды не бывают полупустыми. Ёмкость сосудистой системы может изменяться в достаточно больших пределах, в зависимости от тонуса артериол, количества функционирующих капилляров, степени сдавления вен окружающими тканями («наполненность» интерстиция и тонус мышц) и степенью растянутости свободно расположенных вен брюшной полости и грудной клетки. Разница в ОЦК, определяемая изменением состояния вен, предположительно составляет примерно 500-700 мл у взрослого человека (А.Д.Ташенов, В.В.Чурсин, 2009г.). Мнение, что венозная система может вместить, кроме ОЦК, еще 7-10 литров жидкости, можно считать ошибочным, так как излишняя жидкость достаточно быстро перемещается в интерстиций. Депо ОЦК в организме является интерстициальное пространство, резервная-мобильная емкость которого составляет примерно ещё 1 литр. При патологии интерстиций способен принять около 5-7 литров жидкости без формирования внешне видимых отеков (А.Д.Ташенов, В.В.Чурсин, 2009г.).
Особенностью интерстициальных отеков при некорректной инфузионной терапии является то, что жидкость при быстром поступлении в организм прежде всего уходит в наиболее «мягкие» ткани - мозг, легкие и кишечник.
Последствием этого является наиболее наблюдаемые недостаточности - церебральная, дыхательная и кишечная.
Физиологи на сегодняшний день считают, что практически у среднего человека номинальной величиной ОЦК принимается 5 литров или 5000 см 3 . В ОЦК различают две составных части: объем заполнения (U) и объем растяжения (V) сосудистой системы. U составляет 3300 см., V составляет 1700 см 3 . Последний, объем растяжения имеет непосредственное отношение к давлению крови и скорости объемного потока крови в сосудах.
Избыточная, особенно быстрая, инфузия растворов ведет к увеличению объема, прежде всего в сосудах легких, чем в других органах. При быстрой инфузии, особенно крупномолекулярных растворов (декстраны, ГЭК, СЗП, альбумин) жидкость не успевает переместиться в интерстиций, и при этом жидкость депонируется в первую очередь в легочных венах. Имеются сведения о том, что легочные вены могут дополнительно вместить еще примерно 53% общего легочного объема крови. При дальнейшей избыточной инфузии в действие вступает рефлекс Китаева. При этом рефлексе импульсы с рецепторов перерастянутых легочных вен, возбуждающе действуя на мускулатуру легочных артериол, суживают их, предотвращая таким образом переполнение легочных венозных сосудов.
Из-за спазма легочных артериол при дальнейшей избыточной инфузии наступает объемная перегрузка правых отделов сердца, в первую очередь правого желудочка. При его чрезмерной перегрузке в действие вступает рефлекс Ярошевича. Импульсы с рецепторов легочных артерий, возбуждающе действуя на мускулатуру в устьях полых вен, суживают их, предотвращая таким образом переполнение правых отделов сердца.
Здесь граница, за которой далее приспособление может перейти в патологию. В случае продолжения избыточной инфузии - вследствие избыточного давления в правом предсердии и его перерастяжения возникают следующие условия.
Во-первых ухудшается отток в правое предсердие значительной части крови из коронарных вен. Затруднение оттока по коронарным венам приводит к затруднению притока крови по коронарным артериям и доставки кислорода к миокарду (боль в области сердца).
Во-вторых, может возникнуть рефлекс Бейнбриджа (подробнее - раздел регуляции кровообращения), он вызывает тахикардию, которая всегда увеличивает потребность миокарда в кислороде.
У лиц со скрытой коронарной недостаточностью (что почти никогда не выявляется у больных перед операцией из-за недостаточного обследования) и у лиц с явной ишемической болезнью сердца (ИБС) все это может обусловить возникновение острой коронарной недостаточности вплоть до возникновения острого инфаркта миокарда (ОИМ) с дальнейшим развитием острой сердечной лево-желудочковой недостаточности (ОСЛН).
Если компенсаторные возможности коронарного кровообращения не скомпрометированы и не реализуется рефлекс Бейнбриджа, то дальнейшая объемная перегрузка приводит к растяжению полых вен. При этом с рецепторов, расположенных в устьях полых вен, импульсация поступает к центрам осморегуляции в гипоталамусе (супраоптическое ядро). Уменьшается секреция вазопрессина, приводящая к полиурии (выделению мочи более 2000 мл/сут), что отмечается утром дежурным врачом (и, как правило, безотчётливо) - больной спасает себя. Хорошо, если у больного регуляция водного баланса не нарушена и почки функционируют, в противном случае больной будет «утоплен» с благими намерениями.
Не затрагивая вопросов о «хроническом» уменьшении ОЦК, когда это обусловлено хроническим уменьшением потребления жидкости, коснемся вопроса уменьшения ОЦК, обусловленного именно острой кровопотерей, с чем чаще всего имеют дело врачи анестезиологи-реаниматологи.
По современным представлениям отмечаются следующие приспособительные изменения функции сердечно-сосудистой системы.
Когда ОЦК снижается на 10-20%, то такая кровопотеря представляется компенсируемой. При этом первой приспособительной реакцией является уменьшение емкости венозных сосудов за счёт сдавления их окружающими тканями. Вены из округлых становятся сплющенными или почти полностью спадаются, и таким образом емкость сосудов приспосабливается к изменившемуся объему циркулирующей крови. Венозный приток крови к сердцу и его УО поддерживаются на прежнем уровне. Компенсаторную реакцию организма можно сравнить с ситуацией, когда содержимое неполной 3-х литровой банки переливают в 2-х литровую и она оказывается полной.
Компенсаторным механизмом является и перемещение жидкости из интерстиция за счёт уменьшения венозного давления и увеличения скорости кровотока (укорочения времени изгнания даже без развития тахикардии) - жидкость как бы засасывается из интерстиция. Этот компенсаторный механизм можно наблюдать у доноров при донации, когда экстракция 500 мл крови не приводит к каким-либо изменениям кровообращения.
С уменьшением ОЦК до 25-30% (а это уже потеря растягивающей части ОЦК - V) кровопотеря представляется не компенсируемой за счёт критического уменьшения ёмкости венозной системы. Начинает уменьшаться венозный приток к сердцу и страдает УО. При этом развивается приспособительная (компенсаторная) тахикардия. Благодаря ей поддерживается достаточный уровень сердечного выброса (СВ за минуту = МСВ) за счёт уменьшенного УО и более частых сердечных сокращений. Одновременно с тахикардией развивается сужение периферических артериальных сосудов - централизация кровообращения. При этом ёмкость сосудистой системы значительно уменьшается, подстраиваясь под уменьшенный ОЦК. При сниженном УО и суженных периферических артериальных сосудах поддерживается достаточный уровень среднего артериального давления (АДср) в сосудах, направляющих кровь к жизненно важным органам (мозг, сердце и лёгкие). Именно от величины АДср зависит степень перфузии того или иного органа. Таким образом, развивается приспособительная централизация кровообращения за счет уменьшения кровоснабжения периферических тканей (кожа, скелетные мышцы и т.д.). Эти ткани могут переживать ишемию (I фазу нарушения микроциркуляции) и кислородную недостаточность в течение более продолжительного времени.
Эта реакция аналогична процессу воспаления, при котором организм, образуя грануляционный вал и отторгая омертвевшее, жертвует частью во имя сохранения целого.
Когда ОЦК снижается более чем на 30-40% и восполнение кровопотери задерживается, то такая кровопотеря переходит в разряд некомпенсированной и может стать необратимой. При этом несмотря на тахикардию, СВ уменьшается и снижается АДср. Из-за недостаточного транспорта кислорода в организме усиливается метаболический ацидоз. Недоокисленные продукты метаболизма парализуют прекапиллярные сфинктеры, но периферический кровоток не восстанавливается из-за сохраняющегося спазма посткапиллярных сфинктеров.
Развивается II фаза нарушений микроциркуляции - застойной гипоксии. При этом за счёт ацидоза повышается проницаемость капилляров - плазматическая жидкость уходит в интерстиций, а форменные элементы начинают сладжироваться, образуя микротромбы - развивается ДВС-синдром. К моменту, когда на фоне нарастающего ацидоза парализуются и посткапиллярные сфинктеры (III фаза нарушений микроциркуляции) капиллярное русло уже необратимо блокировано микротромбами.
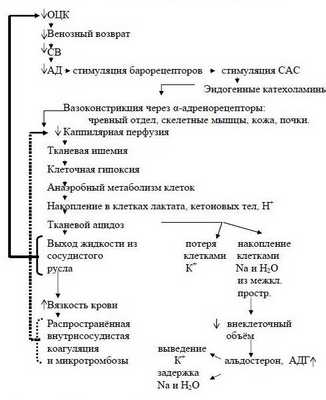
Наступает несостоятельность тканевой перфузии. Во всех случаях затянувшегося синдрома малого СВ присоединяется преренальная анурия. Всё это клиническая форма шока с классической триадой: синдром сниженного СВ, метаболический ацидоз, преренальная анурия. При этом во многих органах, как отмечает профессор Г.А.Рябов, "наступают необратимые изменения и даже последующее восполнение кровопотери и восстановление ОЦК не всегда предотвращает смертельный исход из-за осложнений, связанных с необратимыми изменениями в некоторых органах" - развивается полиорганная недостаточность (ПОН) или мультиорганная дисфункция (МОД).
Последовательность в нарушениях гомеостаза при кровопотере схематически представлена на рисунке 2 (Р.Н.Лебедева и сотр., 1979 г.).
Таким образом, при абсолютном снижении ОЦК практически любого происхождения границей перехода приспособления в декомпенсацию является увеличение частоты сердечных сокращений (ЧСС) с одновременным снижением СВ и АДср.
Данное положение не применимо к случаям, когда имеется относительное уменьшение ОЦК за счет патологической вазодилятации.
Следует учитывать и то, что очень часто острая кровопотеря сопровождается болью и это вносит разлад в последовательность компенсаторных механизмов - раньше чем нужно и в большем количестве выбрасываются эндогенные катехоламины. Централизация развивается быстрее и времени на спасение больного остается меньше.
Читайте также:
