Влияние микроорганизмов на рецепторы клеток при воспалении.
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026
В кишечнике обитают миллионы бактерий, которые в совокупности известны как микробиом. Это сообщество микроорганизмов играет центральную роль в сохранении здоровья человека, «обучая» иммунные клетки поддерживать иммунный гомеостаз. Микробиота кишечника разнообразна и состоит из множества различных видов бактерий. Согласно данным проекта «Микробиом человека» (The Human Microbiome Project), в кишечнике содержится до 10 тысяч различных видов, насчитывающих триллионы клеток: полезные комменсальные бактерии, такие как Bifidobacterium и Lactobacillus, нейтральные штаммы, а также некоторые потенциально вредные бактерии, такие как Clostridia.
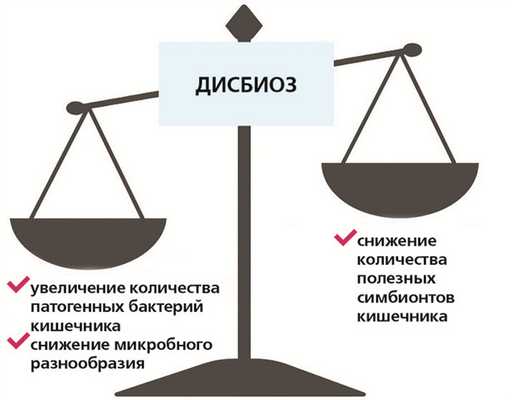
В зависимости от разнообразия и баланса бактерий кишечника микробиом может ингибировать либо способствовать развитию иммунного ответа. Несбалансированный микробиом, известный как дисбиоз, связан с хроническим воспалением и может увеличить риск развития воспалительных заболеваний кишечника, аутоиммунных патологий и других болезней. Однако воздействуя на микробиом кишечника, можно предотвратить развитие воспалительных реакций.
Регуляция баланса микроорганизмов

Состав микробиоты кишечника имеет две характеристики: разнообразие (количество видов микроорганизмов, присутствующих в кишечнике) и богатство (общее количество присутствующих микроорганизмов). Нарушение хотя бы одной из них нередко приводит к заболеваниям.
Ключ к созданию и управлению здоровой микробиотой кишечника и таким образом к реализации ее полезного воздействия на здоровье человека — в регуляции баланса между полезными и патогенными микроорганизмами.
Диета играет решающую роль, не только обеспечивая сбалансированность поступления энергии, но и поставляя определенные питательные вещества, которые непосредственно влияют на состав микробиоты.
Добавление пребиотиков необходимо для оптимальной функции кишечной микробиоты. Положительное влияние пребиотиков на рост и активность микробиоты хорошо изучено, в частности, способность питать полезные комменсальные бактерии, одновременно помогая подавлять вредные.
Роль микробиоты
Ключевые функции бактерий кишечника связаны с метаболизмом, синтезом многих веществ, защитой от инвазии патогенов и регуляцией иммунной системы.
Если бы не кишечный микробиом, организму не хватало бы ряда полезных для него веществ, включая витамины и аминокислоты. Одной из важнейших ролей кишечного микробиома является способность к ферментации неперевариваемых волокон. Эти волокна выступают питательными веществами для группы, производящей короткоцепочечные жирные кислоты (КЦЖК). Наиболее необходимые производимые КЦЖК — ацетат, пропионат и бутират.
Бутират является важным источником энергии для клеток внутренней оболочки толстой кишки (колоноцитов). Считается, что недостаток КЦЖК играет ключевую роль во многих проблемах, связанных с микробиомом, а также приводит к запуску местного воспаления. Бутират выполняет ряд функций в организме человека, включая способность вызывать апоптоз клеток рака толстой кишки, участвует в активации кишечного глюконеогенеза, что имеет значение для энергетического баланса и связано с патогенезом сахарного диабета. Кроме того, он также может стимулировать «иммуноуспокаивающие» Treg клетки.
Пропионат необходим для контроля уровня глюкозы, поскольку он регулирует глюконеогенез в печени и участвует в передаче сигналов о насыщении.
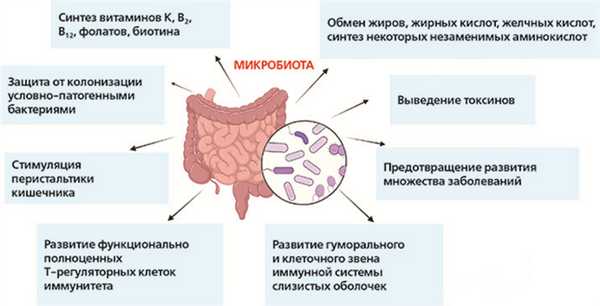
Ацетат участвует в регуляции метаболизма внекишечных тканей, включая метаболизм холестерина и липогенез.
Связь между кишечником и иммунной системой
Пищеварительную систему называют первичной системой иммунной защиты, поскольку она является основным звеном между внешней средой и внутренними системами нашего организма. Иммунная система и микробиота кишечника находятся в симбиотических отношениях, чтобы поддерживать и регулировать друг друга. Значимость этого взаимодействия подчеркивается тем фактом, что 70-80 % иммунных клеток организма находятся в кишечнике.
Микробиота кишечника формируется у новорожденных и сохраняется на протяжении всей жизни. По мере развития организма микробиота участвует в формировании иммунной системы, а та в свою очередь влияет на состав микробиоты. Здоровый пищеварительный тракт защищает организм от внешних факторов.
Помимо «обучения» иммунных клеток, кишечные бактерии и их метаболиты могут «успокаивать» иммунную систему или вызывать развитие воспалительных реакций. Новые исследования также показывают, что состав микробиома может влиять на выработку интерлейкина-10, мощного противовоспалительного цитокина.
С другой стороны, некоторые бактерии производят провоспалительные вещества, активируя цитокины и Т-хелперы, запуская иммунный ответ.
Грамотрицательные бактерии содержат липополисахариды в своей внешней оболочке, эндотоксин, который способствует воспалительной реакции. Когда грамотрицательные бактерии погибают, эндотоксины выделяются в окружающую среду. Если эти соединения пересекают слизистую оболочку кишечника и попадают в кровоток, они могут привести к хроническому и системному воспалению.
В частности, дисбаланс в микробиоме связан с повышенной проницаемостью эпителиального барьера кишечника, более известной как «дырявый кишечник». Липополисахариды бактерий могут попасть в системный кровоток, вызывая развитие воспалительных реакций со стороны рецепторов клеток иммунитета.
В отличие от генов микробиом динамичен и реагирует на диету и образ жизни. Поэтому мы можем поддержать иммунное здоровье, соблюдая диету, богатую пребиотическими растительными волокнами и с низким содержанием жиров. Таким образом стимулирется выработка противовоспалительных метаболитов, таких как бутират.
Дисбаланс в кишечнике может стать активатором болезни
Изменения в микробиоте кишечника коррелируют почти со всеми известными иммунологическими заболеваниями, но в большинстве случаев остается неясным, являются ли эти изменения причиной или следствием заболевания либо просто отражением эпидемиологических различий между группами. Представители микробиоты кишечника участвуют в модуляции иммунитета организма, а также в развитии и прогрессировании множества заболеваний: атеросклероза, ожирения, СД 1-го типа, воспалительных заболеваний кишечника, синдрома раздраженного кишечника, хронической обструктивной болезни легких, атопических заболеваний, депрессии, аутизма и др.
Есть мнение, что микробиота кишечника может быть связана с развитием таких нейродегенеративных заболеваний, как болезнь Альцгеймера и болезнь Паркинсона. Действительно, существует двунаправленная связь между кишечником и мозгом, так называемая ось «мозг — кишечник», и микробиота кишечника может влиять на взаимодействие этих органов. Вот почему наш кишечник иногда называют вторым мозгом.
Изменения микробиоты при первичных иммунодефицитах
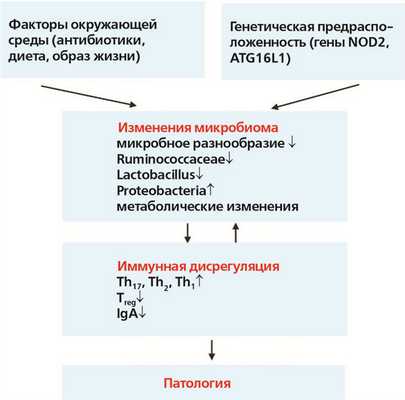
Первичные иммунодефициты (ПИД) — группа гетерогенных генетических заболеваний, приводящих к развитию как качественной и (или) функциональной недостаточности, так и к неконтролируемой активации пролиферации иммунокомпетентных клеток и формированию аутоиммунных, аутовоспалительных и аллергических заболеваний. Генетические дефекты, вызывающие ПИД, приводят к нарушениям традиционных механизмов, лежащих в основе гомеостаза в кишечнике, при этом происходит нарушение иммунного надзора за кишечным барьером, изменение кишечной проницаемости, бактериальная транслокация.
Под влиянием определенных факторов окружающей среды и генетической предрасположенности человека аберрантные взаимодействия между микробиомом и иммунной системой хозяина способствуют развитию различных иммуноопосредованных нарушений.
Например, при ВЗК-подобных патологиях, часто возникающих у пациентов с ПИД, использование антибиотиков или диетические изменения при наличии генетической предрасположенности (например, мутация NOD2) могут привести к изменениям конфигурации микробиома кишечника, включая уменьшение богатства и нарушение таксономического и метаболитного состава. Эти изменения микробиома тесно связаны с аберрантными иммунными реакциями слизистых оболочек, включая усиленные реакции клеток типа Th17, Th1 и Th2, подавление Т-регуляторных клеток и нарушение регуляции гуморального иммунитета. В конечном итоге это может привести к хроническому, клинически выраженному воспалению кишечника и повреждению тканей.
По многочисленным литературным данным, ассоциированные со здоровьем микробные сообщества истощены у пациентов с ПИД. Микробные сообщества кишечника у таких пациентов значительно отличаются от здоровых по разнообразию и составу. Одной из объединяющих характеристик микробиома при ПИД является снижение разнообразия бактерий кишечника.
Другой общей чертой исследований у пациентов с ПИД является транслокация липосахаридов (ЛПС) в воспалительных очагах и в системном кровотоке. Бактериальный ЛПС связан с хронической иммунной активацией и иммунной дисрегуляцией.
Микробиота при аутоиммунных патологиях
Данные убедительно свидетельствуют о том, что существует определенная степень взаимодействия между аутоиммунным заболеванием и здоровьем микробиома кишечника. Однако необходимы дополнительные исследования, чтобы определить, являются ли нарушения микробиома причиной аутоиммунного заболевания, следствием или и тем, и другим сразу.
Микробиом пациентов с системной красной волчанкой, по литературным данным, характеризуется значительным снижением микробного разнообразия, а также увеличением численности вида Ruminococcus gnavus. Эти изменения также коррелируют с тяжестью течения заболевания.
Существует очевидная связь между обострениями болезни Крона и численностью бактерий Ruminococcus gnavus в кишечнике. R. gnavus является типичным представителем микробиома кишечника человека, но производит вредные полисахариды, оказывающие в большом количестве воспалительное действие на организм.
При СД 1-го типа у пациентов часто наблюдается «дырявый кишечник», Исследования показывают, что дисбиоз может влиять на патогенез СД 1-го типа, воздействуя на иммунный гомеостаз и тем самым приводя к данному патологическому состоянию.
Проводятся также исследования по анализу микробиома у пациентов с рассеянным склерозом: отмечается дисбиоз, особенно при отсутствии или чрезмерном преобладании нескольких родов и видов микробов.
Среди них некоторые виды вовлечены в повышенную экспрессию генов, которые участвуют как во врожденном, так и в адаптивном иммунитете.
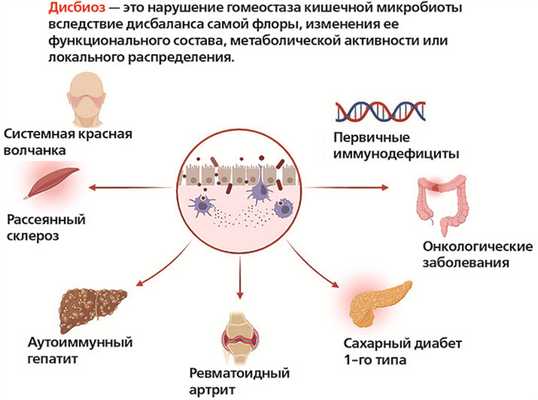
Еще одним аутоиммунным заболеванием, при котором отмечаются изменения микробиома, является ревматоидный артрит: по сравнению с составом бактерий кишечника здоровых людей, у пациентов с ревматоидным артритом отмечается повышенная численность одних бактерий и сниженное количество других, что приводит к воспалительным реакциям в кишечнике.
Микробиом и онкология
Считается, что взаимодействие между микробиотой кишечника и иммунной системой влияет на иммунный надзор за онкологическими заболеваниями. При раке толстого кишечника уничтожение опухолей естественными киллерами (NK-клетками) напрямую ингибируется присутствием вида Fusobacterium nucleatum в микроокружении опухоли.
Более высокое количество бактерий F. nucleatum при колоректальном раке связано с более низкой плотностью CD3+T-клеток — популяции клеток иммунной системы, связанной с более благоприятным клиническим исходом. В печени комменсальные бактерии рода Clostridium желудочно-кишечного тракта используют желчные кислоты в качестве мессенджеров для усиления противоопухолевого эффекта печеночных клеток CXCR6+ NKT, поражая как первичные, так и метастатические опухоли печени.
Различные мировые исследователи пришли к выводу о том, что микробиом также модулирует ответы противоопухолевой иммунотерапии. Например, более высокое содержание комменсалов Bifidobacterium longum, Collinsella aerofaciens и Enterococcus faecium стимулирует более благоприятный Т-клеточно-опосредованный ответ на анти-PD-1-терапию у пациентов c меланомой.
Описана положительная корреляция между количеством таксона Akkermansia muciniphila и эффективностью блокады PD-1 у пациентов с эпителиальными опухолями. Иммунный ответ на другие противораковые методы лечения онкологических заболеваний, включая блокаду CTLA-4 и циклофосфамид, также был связан с различными конфигурациями микробиома кишечника. Выяснение роли кишечного микробиома в противоопухолевом иммунном надзоре и иммунотерапии может иметь большие перспективы в оптимизации ответа на лечение у онкологических больных.
Влияние микроорганизмов на рецепторы клеток при воспалении.
1. Годовалов А.П., Лебединская О.В., Комарова Ю.Р. Роль эпителиоцитов в защите слизистых оболочек дыхательных путей // В мире научных открытий. - 2010. - № 4-14. - С. 9-10.
2. Ершов В.А., Вязовая А.А., Нарвская О.В., Лялина Л.В., Лисянская А.С. Повреждения плоского эпителия шейки матки при папилломавирусной инфекции // Инфекция и иммунитет. - 2013. - №6. - С. 79-82.
4. Комарова Ю.Р., Годовалов А.П., Лебединская О.В. Участие эпителиоцитов в местной защите при воспалительных заболеваниях дыхательных путей // Успехи современного естествознания. - 2010. - № 7. - С. 50-51.
5. Лоскутова К.С. Изменения слизистой оболочки антрального отдела желудка при Helicobacter Pylori-асоциированном гастрите у населения Якутии // Вестник ЯГУ. - 2006. - Т.3, №2. - С. 23-26
Известно, что эпителий является высоко дифференцированной тканью организма, которая выстилает поверхность тела и полости внутренних органов. Кроме этого, эпителиальная ткань обладает высокой регенеративной способностью. Эта ткань непосредственно контактирует с окружающей средой и является потенциальным местом проникновения различных микроорганизмов в организм человека. От целостности эпителиального слоя и его иммунных свойств зависит течение и характер инфекционного процесса.
Так по данным исследований, проведенных Годоваловым А.П., Лебединской О.В. и Комаровой Ю.Р. [4], которые изучали роль эпителиоцитов при воспалительных заболеваниях дыхательных путей, была установлена значительная пораженность (70-94%) эпителия, а также его обсемененность. Основываясь на данных, полученных в ходе исследования, был сделан вывод о высокой роли эпителиоцитов, как факторов врожденного иммунитета, а кроме того доказана роль эпителиальных клеток в стабилизации и инициации воспаления.
В ходе эволюции микроорганизмы сохраняли различные факторы, способствующие обходу этой системы защиты. Под действием этих факторов в очаге инфекции происходит количественные и качественные изменения эпителиоцитов, зачастую имеющие специфичную для конкретной инфекции картину.
Цель исследования - проанализировать накопленные литературные данные о изменениях морфологических характеристик эпителиоцитов, возникающих под влиянием некоторых микроорганизмов.
Вирус папилломы человека является представителем семейства папилломовирусов, поражающие слизистые оболочки. Его связывают с развитием такого заболевания как рак шейки матки, и некоторых других раковых заболеваний. По данным В.А. Ершова и сотрудников [2], при папилломавирусном поражении эпителия выявляют оксифильно и базофильно окрашенные клетки поверхностного и промежуточного слоев эпителия, двуядерные клетки и многоядерные симпласты, койлоциты и дискератоциты. Характерным признаком папилломавирусной инфекции считается наличие койлоцитов. Они представляют собой клетки поверхностного или промежуточного слоя многослойного плоского эпителия, для которых характерно наличие дискариоз и светлой зоны вокруг ядра, которая образовалась в результате некротических изменений. Кроме этого можно выявить клетки с мелкими единичными вакуолями в околоядерной зоне, которые ассоциированы с легкой дисплазией.
При папилломавирусной инфекции обнаруживают клетки с гиперхромными ядрами и эозинофильной цитоплазмой с различной степенью ороговения. В микропрепаратах такие клетки расположены вместе, образуют комплексы. Данные клетки получили название дискератоциты, а их появление связывают с тяжелой дисплазией.
При заражении вирусом папилломы человека эпителиоциты не способны нормально осуществлять процессы дифференцировки. Как указывают авторы [2], к данным нарушениям особенно восприимчивы клетки шиповатого слоя. В клетках данного происходит клональная экспансия, трансформация и последующая малигнизация инфицированных ВПЧ клеток базального слоя, прошедших только первичную дифференцировку. По данным исследования [2] наиболее активно синтез вирусной ДНК идет при переходе клеток их шиповатого слоя в зернистый, однако сама сборка вируса происходит только в роговом слое, затем идет его выделение и почкование прямо на поверхности эпителия или эпидермиса. Контакт именно с этими участками и приводит к инфицированию.
Helicobacter pylori - грамотрицательные бактерии, имеющие спиралевидную форму, поражают преимущественно желудочно-кишечный тракт, вызывают язвы, гастриты, опухоли и другие заболевания. Бактерии имеют различные факторы, направленные как на проникновение в эпителиоциты, так и на подавление факторов неспецифической системы организма. Например, такие ферменты как протеазы, муциназы и липазы вызывают растворение и разрушение слизи, которая содержит муцин - группа гликопротеидов слизистых оболочек, которые защищают из от действия протеолитических ферментов желудочного сока. Это нарушает трофику эпителиоцитов, что в конечном итоге приводит к воспалениям и язвам.
Helicobacter pylori не живет в условиях кислого pH. Оптимальные значения рН для жизнедеятельности микроорганизма являются нейтральными. Для того чтобы выжить в желудке бактерия вынуждена обезвреживать соляную кислоту, дабы сместить значения pH в более комфортные для себя значения. Helicobacter pylori для этих целей выделяет уреазу, которая расщепляя мочевину образует аммиак, который в свою очередь нейтрализует соляную кислоту. Аммиак довольно токсичен и губительно воздействует на эпителиальные клетки, вызывая их гибель.
Helicobacter pylori способны непосредственно влиять на клетки слизистой оболочки, путем введения в них различных эффекторных веществ. Такие вещества способны угнетать апоптоз, повышать продукцию интерлейкинов, инициировать воспаление, а также способствовать неадекватному делению и росту некоторых видов клеток.
Эндотоксин VacA, вырабатываемый Helicobacter pylori, вызывает вакуолизацию и гибель клеток эпителия желудка. Изменяется форма эпителиоцитов (клетки становятся более выпуклыми), меняется форма форма и хроматизация ядер, наблюдаются различные дегенеративные изменения в цитоплазме. Окислительный взрыв, вызываемый Helicobacter pylori приводит к апоптозу, а лейкоциты, привлеченные сюда продуктами секреции и интерлейкинами усиливают воспаление, приводя к еще более ускоренной гибели клеток слизистой оболочки.
К.С. Лоскутова изучала изменения, происходящие в эпителии антрального отдела желудка при helicobacter-ассоциированном гастрите у жителей Якутии [5]. Показано, что при НР-ассоциированном гастрите наблюдается снижение высоты покровного эпителия, ямочного эпителия и толщины слизистой оболочки с относительным увеличением глубины желудочных ямок. Полученные средние показатели у населения Якутии сопоставимы с таковыми при атрофии слизистой оболочки желудка.
Герпесвирусная инфекция - это заболевание вирусной природы, вызываемая у человека несколькими типами ВПГ. Вирус наиболее часто поражает эпидермис и органы репродуктивной системы человека.
По данным Коколевой А.С. и Ахматова Э.А. [3] в ранней стадии развития инфекции, вызванной ВПГ, наблюдается гипертрофия пораженных клеток, которые обычно одноядерны. Хроматин сконцентрирован на периферии ядра, что создает характерную картину. Ядрышки, характеризующие интенсивность синтеза белка, увеличены. В позднюю стадию заболевания, а также при рецидиве инфекции, среди пораженного эпителия обнаруживаются многоядерные клетки. Вирусное поражение настолько выражено, что можно наблюдать скопления вирусных частиц внутри ядра, в виде включений. Вокруг ядер отмечаются просветления цитоплазмы. Микроскопически в эпителии обнаруживается баллонная дистрофия с гибелью эпителиальных клеток и со скоплением серозного экссудата в эпидермисе. Наблюдается отечность дермы. В периваскулярной ткани обнаруживаются лимфогистоцитарные инфильтраты. По периферии везикул расположены многочисленные гигантские клетки. Кроме этого наблюдаются тельца Коундри, представляющие собой базофильные включения внутри ядер эпителиоцитов со светлой зоной на периферии. При электронной микроскопии в ядрах пораженных клеток можно выявить капсиды вируса, которые по мере созревания вирусных частиц поступают из ядра в цитоплазму и здесь бывают заключены в вакуоли. При гибели клетки вирусы высвобождаются.
Гонококки - грамотрицательные бактерии, имеющие форму кокков и вызывающие инфекционное заболевание, передающееся половым путем. В основном поражаются эпителий мочеиспускательного канала, канала шейки матки, яичника, маточной трубы, конъюнктивы и прямой кишки.
Пили гонококков обеспечивают адгезию и выживание гонококков на эпителиоцитах. А липополисахарид обуславливает сильные иммуногенные свойства гонококков, привлекая большое количество нейтрофилов в очаг инфекции, однако зачастую привлеченные клетки не способны адекватно противостоять бактериям и по некоторым данным сами становятся субстратом для размножения бактерий. Neisseria gonorrhoeae, прикрепляясь к эпителию, вызывают гибель его клеток и слущивание. В цитоплазме клеток эндосомы сливаются с образованием гигантских вакуолей, где гонококки размножаются, что обеспечивает их недоступность к факторам иммунной защиты. Привлеченные нейтрофилы усиливают слущивание эпителия, вызывают бурную воспалительную реакцию, однако данная ситуация имеет место далеко не всегда и чаще наблюдается бессимптомное течение гонореи, характерное в большой степени для женщин.
В целом воздействие гонококков на эпителий половых путей изучено недостаточно хорошо и требуются дополнительные исследования в этой области.
Воспаление. Особенности обмена веществ. Часть 2

Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 24.11.2020
- Reading time: 5 минут чтения
В случае воспаления метаболизм тканей имеет как количественные, так и качественные особенности.
Количественные особенности обмена веществ при воспалении
Количественные особенности особенно заметны в начале воспаления - это усиление обмена веществ, которое Саде назвал «метаболическим огнем». В этот период сильно усиливаются процессы гидролиза (гликолиз, протеолиз, липолиз) и окислительные процессы (из-за артериальной гиперемии). В воспаленных тканях увеличивается утилизация кислорода.
По мере прогрессирования нарушений периферического кровообращения (венозная гиперемия, застой) интенсивность окислительных процессов снижается, и в воспалительных тканях начинают проявляться качественные изменения обмена веществ.особенности - процессы окисления не проходят полностью, не заканчиваются выделением СО2. Процессы гидролиза преобладают над процессами окисления.
Основные причины этих метаболических нарушений - повреждение митохондрий - цикл Кребса , биологическое окисление и связанные с ним нарушения окислительного фосфорилирования - и лизосомное повреждение (лизосомы выделяют около 40 гидролитических ферментов).
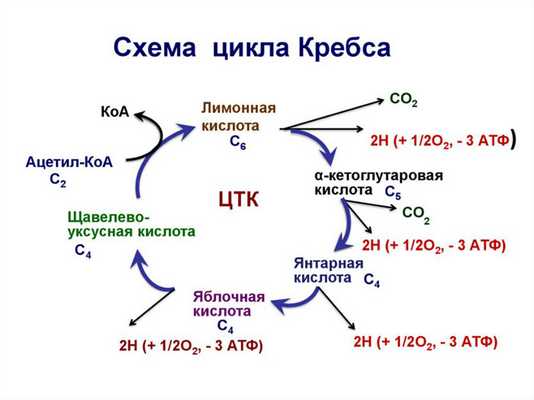
Схема цикла Кребса
Также вызывают метаболические нарушения остатки бактерий и ферменты. Например, многие бактерии продуцируют гиалуронидазу, которая деполимеризует гиалуроновую кислоту, разжижает соединительную ткань и увеличивает проницаемость сосудов. Коллагеназа приводит к разрушению волокон соединительной ткани. Стрептококковая дезоксирибонуклеаза и рибонуклеаза расщепляют нуклеиновые кислоты и активируют протеолитические ферменты.
Из-за венозной гиперемии, застоя и повреждения митохондрий в тканях остается мало кислорода. В отсутствие кислорода активность ферментов цикла Кребса снижается, и во время этого цикла (особенно в центре воспалительных очагов) образуется недостаточно CO2, но промежуточные продукты метаболизма (пировиноградная кислота, α-кетоглутаровая кислота, яблочная кислота, янтарная кислота) накапливаются из пировиноградной кислоты.
Если в присутствии монойодацетата ферменты гликолиза подавлены, воспаление слабое. Белковый обмен усиливают протеолитические процессы. Они активируются при повреждении лизосом и ядер нейтрофилов крови, макрофагов и воспаленных паренхиматозных клеток, а также дезоксирибонуклеазами и рибонуклеазами. Усиленный протеолиз приводит к пролиферации нуклеотидов, полипептидов и аминокислот.
В воспалительных условиях, когда в тканях не хватает кислорода, дезаминирование (нормальный путь окисления аминокислот) снижается, а декарбоксилирование усиливается. В этих условиях, а также в результате дегрануляции тучных клеток в тканях накапливается гистамин.
Для жирового обмена характерно усиление липолиза. В результате увеличивается количество жирных кислот и продуктов их переваривания. Поскольку интенсивность цикла Кребса уменьшается, молекулы ацетил-СоА начинают конденсироваться и взаимодействуют друг с другом с образованием ацетилуксусный-КоА, который, в свою очередь, дает кетон вещество уксусной кислоты (5-оксимасляной кислоты и ацетона).
Из - за высокого потребления O2 (особенно в артериальной гиперемии), но количество выделяемого СО2 намного меньше, тогда частота дыхания также уменьшается.
Описанные процессы диссимиляции (катаболизма) преобладают в остром периоде воспаления. В это время некоторые продукты патологически измененного обмена веществ (медиаторы воспаления) сами влияют на развитие процесса.
В более поздний период воспаления, когда тенденции к восстановлению тканей уже проявляются, на первый план выходят процессы синтеза, а именно анаболические - увеличивается синтез ДНК и РНК. Эти процессы особенно активны в гистиоцитах и фибробластах.
В этих клетках возрастает активность окислительно-восстановительных ферментов, активно происходит биологическое окисление и окислительное фосфорилирование. В результате увеличивается образование макроэргических соединений и обеспечивается повышенная функциональная активность гистиоцитов и фибробластов.
Биологически активные вещества
Биологически активные вещества играют очень важную роль в патогенезе воспаления, поэтому кратко опишем основные из них.
Гистамин образуется декарбоксилазой из гистидина. Много гистидина и гистамина находятся в коже, легких, симпатических нервных волокнах.
- Гистамин расщепляется метилтрансферазой. Этот фермент в изобилии присутствует в органах, на которые действует гистамин (легкие, кожа, желудочно-кишечный тракт).
- Второй путь расщепления гистамина - это окислительное дезаминирование гистамином (диаминоксидазой), которое обнаруживается в основном в кишечнике, печени и почках.
В клетках (лейкоцитах, тромбоцитах, тучных клетках и эндотелиальных клетках) гистамин присутствует в больших количествах в связанной форме. В тучных клетках всегда с гепарином.
Гистамин является биологически очень активным веществом. Понижает тонус прекапиллярных сфинктеров, расширяет сосуды в зоне микроциркуляции, сужает крупные сосуды. В то же время гистамин сокращает сократительные вещества эндотелиальных клеток и увеличивает поры между этими клетками. Таким образом, гистамин увеличивает проницаемость стенки кровеносных сосудов, и белковые жидкости могут выходить в интерстициальное пространство (IST). Больше всего увеличивается проницаемость стенки мелких вен. Гистамин также вызывает сокращение гладких мышц.
Серотонин (5-окситриптамин) образуется из триптофана специфической гидроксилазой. Серотонин расщепляется неспецифической моноаминоксидазой. Образуется индоксиуксусная кислота, которая способствует пролиферации клеток. Серотонин содержится в тучных клетках и тромбоцитах (из которых гистамин высвобождается в процессе свертывания крови).
Как и адреналин, серотонин повышает кровяное давление, но мало влияет на периферическое сопротивление. В отличие от адреналина серотонин вызывает бронхоспазм. В тканях серотонин выделяется алкалоидом резерпином. Серотонин также увеличивает проницаемость сосудов, но он делает отек в 200 раз более активным, чем гистамин.
Гранулы тучных клеток содержат гистамин, гепарин и серотонин. Гистамин и гепарин связаны с ферментом химазой. Кроме того, гепарин является ингибитором этого фермента и защищает гранулы от автолиза. Гистамин относительно слабо связан в этом комплексе и может высвобождаться так называемыми освободителями гистамина, веществами, которые более тесно связаны с гепарином, чем гистамином (натрий, кальций, водород и другие ионы). Следовательно, в условиях гипоксии и ацидоза количество гистамина увеличивается и его действие становится более выраженным.
Дегрануляция тучных клеток может быть вызвана воздействием тепла, ультрафиолетового и ионизирующего излучения, солевых растворов, кислот, катионных белков, синтетических полимеров и мономеров, поверхностно-активных веществ.
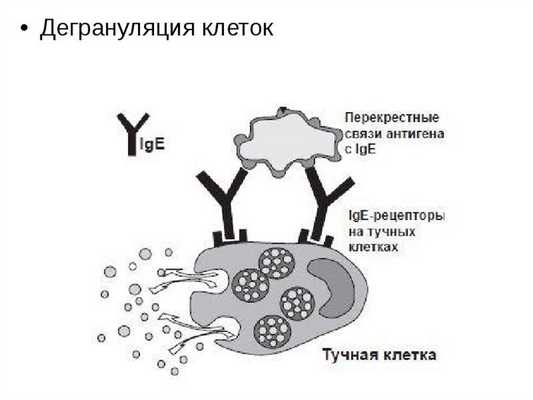
Дегрануляция тучных клеток
Дегрануляция всегда происходит за счет взаимодействия антигена и антител. Выброшенные гранулы фагоцитируются макрофагами или растворяются в межслитковой жидкости, а вазоактивные вещества переносятся лимфой или кровотоком в организм. Гистамин и серотонин расширяют кровеносные сосуды и увеличивают проницаемость их стенок, в то время как гепарин увеличивает проницаемость капилляров, препятствуя образованию фибрина.
Гипотензивные полипептиды - хинины
Хининовая система или так называемые гипотензивные полипептиды также называют местными (тканевыми) гормонами, потому что они не вырабатываются эндокринными железами и действуют в основном локально. Хинины обнаружены в крови, лимфе, моче, поджелудочной железе, слюнных железах, головном мозге, тонком кишечнике и т. д. Два хинина: калидин и брадикинин были изучены на людях.
Хинины в плазме крови и тканях образуются из неактивных α2-глобулинов (кининогенов) ферментом каликреином. Каликреины тканей (калидиногеназы) и каликреины плазмы (брадикининогеназы) происходят из прекалликреинов. Их переход в каликреины облегчается реакциями антиген-антитело, температурами выше 45 ° C, кислыми изменениями pH, лизосомальными ферментами, катепсинами, трипсином, фактором свертывания XII (фактор Хагемана), фибринолизином (плазмин).
Хининогены сначала образуют калидин. После расщепления аминопептидазы образуется брадикинин. Брадикинин - сильнейшее сосудорасширяющее средство, увеличивающее проницаемость капилляров в 10-15 раз сильнее, чем гистамин. Брадикинин стимулирует сокращение миокарда и, таким образом, увеличивает частоту сердечных сокращений, сердечный выброс и коронарное кровообращение, а также усиливает почечную клубочковую фильтрацию и выведение ионов натрия и калия.
Хинины расслабляют гладкие мышцы артериол и венозных стенок, тем самым расширяя эти кровеносные сосуды и снижая скорость их кровотока. В то же время они значительно увеличивают проницаемость стенки сосуда и способствуют эмиграции лейкоцитов из кровеносных сосудов.
Как и другие медиаторы, хинины вызывают воспаление, различные типы шока, аллергические реакции, артрит, инфаркт миокарда, инсульт, острый панкреатит и другие заболевания. Действуя на местном уровне,
Хинины вместе с системами тромбина и плазмина (фибринолизина) образуют так называемую систему факторов Хагемана, которая активируется при повреждении тканей. Свертывание крови и фибринолиз являются результатом системы факторов Хагемана.
Тромбоксан А2 и тромбоксан В2
Тромбоксан А2 и тромбоксан В2 - высоко биологически активные вещества. Тромбоксан А2 был выделен из тромбоцитов с очень короткой продолжительностью действия (период полураспада 32 с). Это вещество активно участвует в удалении медиаторов из тромбоцитов и других клеток, а также в агрегации тромбоцитов.
Система комплемента
Система комплемента состоит из 9 различных белков, обозначенных Ci, C2 и т. д. Она активируется комплексом антиген-антитело, а также эндотоксинами, и образуются продукты, которые активно участвуют в патогенезе воспаления. Наиболее активные компоненты системы комплемента - C3a (анафилатоксин I), C5a (анафилатоксин II) и C5,6, C3a - гемотаксический фактор, который увеличивает проницаемость сосудистой стенки и способствует дегрануляции тучных клеток. У Csa такое же и даже более сильное действие.
Также присутствуют в тканях ингибиторы C3a и Csa. Если дефицит этих ингибиторов передается по наследству или приобретается, активность системы комплемента может значительно возрасти, и воспалительный процесс может стать тяжелым. Было показано, что ингибиторы комплемента подавляют эмиграцию лейкоцитов.
Система комплемента также участвует в фагоцитозе и высвобождении лизосомальных ферментов и в конечном итоге вызывает иммунологический лизис клеток - смерть. Система комплемента вместе с ионами магния является частью системы пропердина, вызывающей микробный лизис в крови.
Таким образом, в случае воспаления активируются тесно связанные системы хинина, комплемента, свертывания крови, фибринолиза и другие.
Простагландины
Простагландины (PG) были обнаружены примерно в 1930 году в семенниках и сперме различных животных. Первоначально считалось, что эти биологически активные вещества происходят из простаты, поэтому их назвали простагландинами.
Теперь известно, что они являются высокоактивными фосфолипидами, образованными в клеточных мембранах из арахидоновой кислоты под действием простагландинсинтетазы. Ферменты циклооксигеназа и липоксигеназа зависят от образования PG или лейкотриенов из арахидоновой кислоты. PG присутствует во всех органах.
Простагландины
Различают несколько типов простагландинов (Ei, E2, F, I, D, A, G). У людей было обнаружено 13 простагландинов, наиболее активными из которых являются простагландины E, F и G. Действие PGE и PGF часто противоположно.
Простагландины контролируют диффузию веществ через клеточную мембрану (часть простагландина активирует аденилатциклазу и увеличивает количество цАМФ), а также регулируют активность гладких мышц и процессы секреции.
Простагландины действуют в основном локально, потому что ферментные системы мешают их общей функции. Общая эффективность наблюдается, если деградация PG ингибируется или накоплено слишком много PG. Простагландины обладают моделирующим действием - они стимулируют слабые и подавляют избыточные функции.
При воспалении особенно повышены уровни PGE2, PGE и PGI2. Эти простагландины сильно способствуют расширению сосудов, а также увеличивают проницаемость сосудистой стенки и лизосомальной мембраны, тем самым способствуя воспалению. Эти простагландины также стимулируют синтез ДНК и пролиферацию тканевых лимфоцитов. Лимфоток стимулируется в меньшей степени. С другой стороны, также наблюдалась защитная противоязвенная активность клеток простагландинов (PGE2).
Медиаторы воспаления
Помимо простагландинов, липоксигеназа арахидоновой кислоты также продуцирует лейкотриены, такие как медленно действующее вещество анафилаксии (медиатор аллергического воспаления). В случае аллергического воспаления из тканей выделяется вещество Р (проницаемость), которое увеличивает проницаемость стенки сосуда.

Медиаторы воспаления
Система адениловой кислоты содержит производные аденина (аденозин, AMF, ADF), и их количество в воспаленных тканях значительно увеличено. Эти вещества способствуют лейкоцитозу, эмиграции лейкоцитов и фагоцитозу, а также, среди прочего, увеличивают проницаемость сосудистой стенки.
Фермент клеточной мембраны аденилилциклаза катализирует переход АТФ в аденозин-3′-5 ‘- (циклический) монофосфат (цАМФ) и пирофосфат. Обычно клетки и биологические жидкости содержат очень мало cAMF. Он участвует в гуморальной регуляции - это промежуточный член между гуморальным рецептором клетки и внутриклеточными процессами.
В случае повреждения клетки увеличивается активность аденилциклазы и снижается ресинтез АТФ, поэтому количество цАМФ в поврежденной клетке увеличивается и стимулируются процессы регенерации. Печень играет ключевую роль в эвакуации и гидролизе цАМФ из плазмы крови. При заболевании печени эти функции снижены.
АМФ подавляет дегрануляцию лизосом и высвобождение лизосомальных медиаторов, тем самым подавляя дальнейшее развитие воспаления. Адреналин и норадреналин оказывают ингибирующее действие на воспаление через цАМФ.
К эндогенным медиаторам воспаления также относятся лизосомальные компоненты (катионные белки, кислотные и нейтральные протеазы) и продукты активности лимфоцитов - фактор, препятствующий миграции лейкоцитов, гемотаксический фактор, митогенный фактор и т. д. Большинство лизосомальных медиаторов высвобождаются из нейтрофилов и макрофагов.
В зависимости от места их образования, воспалительные посредники делятся на две группы:
- медиаторы, образующиеся в клетках;
- «плавающие» медиаторы, образованные в жидкостях организма, главным образом, в крови.
В первую группу входят вазоактивные амины (гистамин, серотонин), лизосомальные ферменты, катионные белки и др. Гистамин и серотонин присутствуют в клеточных гранулах, поэтому в случае повреждения клеток (тучных клеток, базофилов, тромбоцитов) они появляются первыми (в течение нескольких минут) в месте воспаления.
Однако запас вазоактивных аминов быстро истощается, поскольку эти вещества расщепляются, и вазоактивные амины исчезают из очага воспаления. Поэтому вазоактивные амины называют медиаторами короткого действия. Позже, когда активируется система калихреин-хинин, образуются калидин и брадикинин, а еще позже - простагландины. Они являются медиаторами пролонгированного действия и требуют образования ферментных систем.
Ко второй группе («плавающих») медиаторов относятся фактор Хагемана, система комплемента и тромбоксана, фибринопептиды и др.
Помимо медиаторов воспаления, вызывающих воспалительные реакции, различают и модуляторы воспаления (повреждения). Они не вызывают напрямую воспалительных реакций, но способны усиливать или уменьшать их. Такие эффекты проявляются, например, в системах простагландинов, тромбоксана и адениловой кислоты.
Воспаление. Фагоцитоз. Асептическое и острое воспаление. Часть 7
Выпускник медицинского факультета УЛГУ. Интересы: современные медицинские технологии, открытия в области медицины, перспективы развития медицины в России и за рубежом.
- Запись опубликована: 25.11.2020
- Reading time: 4 минут чтения
Фагоцитоз - это способность определенных клеток (фагоцитов) удерживать и переваривать плотные частицы. Это явление было открыто И. Мечниковым.
Фагоцитоз осуществляется микрофагами (нейтрофилами) и системой мононуклеарных макрофагов.
Мононуклеарные макрофаги
Система (MMS) включает следующие элементы:
- промоноциты (костный мозг);
- моноциты (кровь);
- тканевые макрофаги;
- гистиоциты соединительной ткани;
- печеночные клетки Куппера;
- легочные альвеолярные макрофаги;
- свободные и фиксированные макрофаги лимфатической ткани;
- плевру и перитонеальные макрофаги.
Клетки мононуклеарной системы объединяет общее происхождение гемопоэтических клеток и саморегуляция.
Моноцитопоэз
Моноцитопоэз - это стимулирующий фактор колонии фибробластов и фактор роста макрофагов, но он же подавляет (отрицательная саморегуляция) интерферон фибробластов и лейкоцитов и т. д.
Процесс фагоцитоза делится на четыре стадии:
- Приближение.
- Адгезия.
- Оседание;
- Стадия пищеварения.
Фаза приближения
Фагоцит приближается к объекту - бактериям, мервому клеточному элементу, инородному объекту. При движении под действием хемотаксиса цитоплазма фагоцита образует удлинения (псевдоподии).
Адгезия
Способствует образованию аминополисахаридов на поверхности фагоцитов и перекрытию фагоцитарного объекта белками сыворотки, особенно иммуноглобулинами. Последний механизм по сути является опсонизацией - бактерии и поврежденные клетки перекрываются с IgM, IgG и компонентами комплемента (C3, C5 и др.), что облегчает адгезию к фагоциту.
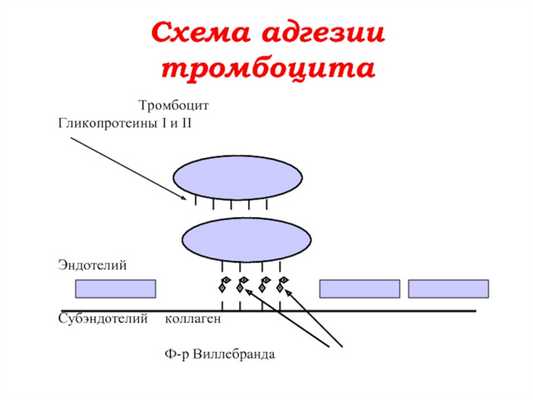
Адгезия
Поверхность фагоцита заряжена отрицательно, поэтому адгезия лучше, если объект, подлежащий фагоцитозу, заряжен положительно. Менее фагоцитарны отрицательно заряженные объекты, такие как опухолевые клетки.
Оседание
Этап фагоцитации объекта - путь инвагинации. Сначала фагоцит образует углубление, а затем фагосому - вакуоль, содержащую объект, подлежащий фагоцитозу. НАДН-зависимая оксидаза в мембране фагоцитов активируется до образования фагосом; в результате O2 превращается в O 2 ~ (супероксид-анион) и образуется H 2 O 2.
Эти продукты обладают бактерицидным действием, а также вызывают образование свободных радикалов. Под действием пероксидаз и каталаз H 2 O 2 расщепляется и высвобождается молекулярный O 2. Свободные радикалы и активный молекулярный O 2 действуют на мембрану фагоцита и объект, подлежащий фагоцитозу, активируя перекисное окисление липидов.
Липопероксиды и свободные радикалы неустойчивы к лизосомным мембранам и способствуют высвобождению лизосомальных ферментов.
Стадия пищеварения
Лизосомы присоединяются к фагосоме, содержащей фагоцитарный объект. Эти органеллы содержат все ферменты, необходимые для расщепления углеводов, белков, жиров и нуклеиновых кислот. В еще неактивной форме они попадают в вакуоль фагоцитов.
Пищеварительная вакуоль образуется при pH около 5,0, близком к оптимальному для лизосомальных ферментов. Активируются лизосомальные ферменты, и фагоцитарный объект постепенно переваривается. Во время стадии пищеварения проницаемость мембраны фагосомы увеличивается, содержимое фагосомы ускользает в цитоплазму, и микрофаг умирает (этому процессу способствует ацидоз). В этом случае фагоцитарный микроорганизм также может сохранять жизнеспособность.
Роль макрофагов в воспалительном процессе
Макрофаги начинают участвовать в фагоцитозе позже микрофагов. Макрофаги также более устойчивы к гипоксии и ацидозу, например, моноциты жизнеспособны даже при pH 5,5.
В очаге воспаления макрофаги выполняют несколько функций:
- Фагоцитируют бактериальные остатки, оставшиеся после эвакуации гноя и продуктов распада тканей - очищающая функция;
- Высвобождают лизосомальные ферменты - гиалуронидазу, аминопептидазу и др;
- Синтезируют компоненты системы комплемента и простагландины.
В то же время воспаленная тканевая среда также стимулирует образование фибробластов и фиброцитов. Постепенно появляется новая, богатая сосудами грануляционная ткань.
Фагоцитоз стимулируется продуктами повреждения тканей - внутриклеточные белки, ферменты, полипептиды, аминокислоты, электролиты и т. д., биологически активными веществами, половыми гормонами, тироксином, адреналином, лихорадкой. Но подавляется недостатком стимулирующих факторов, глюкокортикоидов, гликолортикоидов, ацетилхолина, ацетилхолина.
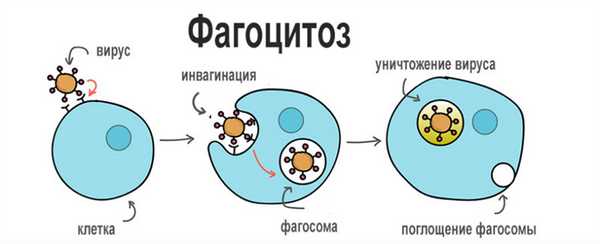
Фагоцитоз
Считается, что клетки плаценты и злокачественные опухоли способны секретировать вещество, которое подавляет функцию макрофагов, иммунологические реакции лимфоцитов и эмиграцию лейкоцитов, что приводит к значительному ослаблению или даже прекращению воспаления.
Объекты, которые фагоциты не могут переваривать, остаются в этих клетках в течение длительного времени и покрываются тонкой пленкой аминополисахаридов. После гибели фагоцитов они повторно фагоцитируются или выводятся из организма. Процесс, при котором фагоцит после переваривания высвобождает часть продуктов своего фагоцитоза в окружающую среду, называется экструзией.
Фагоцитоз - не единственный в организме механизм борьбы с воспалением. Большинство микроорганизмов погибают в условиях ацидоза, а также от ферментов, высвобождаемых во время гибели клеток и функционирования иммунокомпетентной системы.
Нейтрофилы во внеклеточном пространстве секретируют катионные белки, которые могут убивать ферменты без ферментов и фагоцитоза. Таким образом, воспалительные очаги постепенно избавляются от микроорганизмов и мертвых клеток.
Асептическое и острое воспаление
Дальнейшее течение воспаления зависит от того, является ли воспаление асептическим или бактериальным.
В асептических воспалительных условиях, например, вокруг хирургического шва, инородного тела, стенка микрофагов (нейтрофилов) начинает формироваться в течение нескольких часов, достигая максимума в течение дня.
Позже появляется следующий вал макрофагов, который достигает максимума через 2-3 раза. в день. Эмигрировавшие лейкоциты постепенно становятся неподвижными, больше не могут делиться и погибают в течение 3-5 дней. 2-3. на 5 сутки начинает формироваться стенка фибробластов, а на 5 сутки - соединительнотканная капсула.
Таким образом, в случае острого воспаления патогенный агент в организме преобразует белки, которые участвуют в реакции антиген-антитело, медиаторы и модуляторы воспаления, систему фагоцитов и миграцию клеток. В результате заканчивается острое воспаление. Однако, если инфекционные агенты попадают в участок асептического воспаления, например, в результате травмы, это воспаление становится септическим (бактериальным) воспалением.
Бактериальные воспалительные состояния бактерий и токсинов, не вызывающие гиперемии, экссудации и эмиграции лейкоцитов. Между клетками воспаленных тканей и особенно вокруг кровеносных сосудов накапливается все больше и больше микрофагов. Лизосомы микрофагов содержат множество активных ферментов, и эти клетки также начинают процесс фагоцитоза. При пальпации воспаленная ткань в это время кажется плотной, поэтому это называется стадией воспалительной инфильтрации.
По мере прогрессирования воспаления лейкоциты и те тканевые клетки, которые претерпели необратимые изменения во время воспаления, погибают. В этих клетках высвобождаются лизосомальные ферменты, которые расщепляют тканевые белки, белковые и липидные комплексы и другие структуры. Это стадия гнойного размягчения воспаления.
Эти стадии наблюдаются, например, у пациентов с гнойным воспалением перикарда (фурункул), гнойным воспалением апокринных потовых желез (гидраденит) и гнойным воспалением соединительной ткани (флегмона). При вдыхании воспаленная ткань выглядит мягкой, с характерным раскачиванием - флюктуацией. Образуется замкнутое скопление гноя - абсцесс.
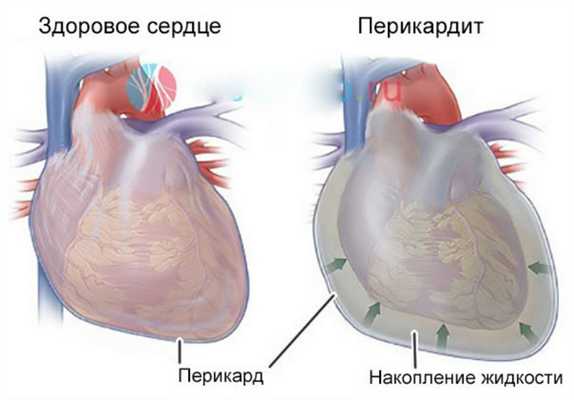
Гнойное воспаление перикарда
Гной разрывается в направлении наименьшего сопротивления (либо наружу, либо внутри тела). Если гной попадает в кровоток (пемия), в организме может развиться множество очагов гноя, но под действием микроорганизмов и токсических веществ - угрожающее общее заболевание (сепсис, септикопиемия). Поэтому важно диагностировать накопление гноя и обеспечить хирургический дренаж гноя наружу.
Роль микробиома дыхательных путей в респираторном здоровье
В предлагаемом обзоре обобщены последние достижения в области изучения респираторной микробиоты, взаимосвязи микробиома верхних дыхательных путей и легкого, обсуждения возможных механизмов влияния микробиома на астму и аллергию. Идентификация не только па
The role of the respiratory tract microbiome in respiratory health N. G. Astafieva, D. Yu. Kobzev, I. V. Gamova, I. A. Perfilova, E. N. Udovichenko, L. V. Skuchaeva, I. E. Michailova
The proposed review summarizes recent advances in the study of respiratory microbiota, the relationship between the upper respiratory tract microbiome and the lung, and a discussion of the possible mechanisms of influence of the microbiome on asthma and allergies. Identifying not only pathogenic bacteria, but also commensals in the respiratory tract and gastrointestinal tract (Gut- Lung axis) is an innovative approach to finding out their role in the development of inflammation and modulation of the immune response in respiratory allergies.
Легочный микробиом и астма
Астма является наиболее распространенной респираторной хронической патологией в любой возрастной группе. Точные механизмы, которые приводят к различным клиническим фенотипам и эндотипам и присущим специфическим воспалительным процессам при астме, по-прежнему в значительной степени неизвестны. Несмотря на это, в свете современных публикаций можно думать о том, что барьерная функция слизистой оболочки носа и микробиота носа являются ключевыми элементами, связывающими респираторный дисбиоз с клеточными и молекулярными процессами, которые приводят к воспалению и поддерживают его. Повышенная проницаемость слизистой оболочки может, в свою очередь, способствовать перемещению бактерий в подслизистый слой, где происходит встреча антигена с соответствующими иммунными клетками и его распознавание, с последующим запуском локальных или системных реакций.
У здоровых людей микробиота легкого детерминируется в основном балансом иммиграции и элиминации с относительно небольшим вкладом от дифференциального коэффициента воспроизводства микробного сообщества [36].
Основными маршрутами микробной иммиграции в легкие являются микроаспирация, вдыхание воздуха и прямая дисперсия вдоль поверхностей слизистой оболочки. Из них микроаспирация, вероятно, является доминирующим маршрутом иммиграции.
Исследования микробиомов носа, полости рта, легкого и желудка у индивидуумов иллюстрируют микробиологическую непрерывность аэродигестивного тракта у здоровых взрослых, что обосновывает микробиологическую поддержку концепции о распространенности микроаспирации у здоровых людей [37, 38]. Таким образом, даже в норме постоянно наблюдается бактериальная контаминация нижних дыхательных путей. Очищение дыхательных путей происходит за счет мукоцилиарного клиренса, кашля. Известно, что при отсутствии инфекции здоровые люди кашляют примерно один раз в час, стимулируя продвижение бактерий в глотку, где они либо проглатываются, либо отхаркиваются.
Элиминация микроорганизмов (кроме кашля и мукоцилиарного клиренса) осуществляется разнообразным арсеналом врожденной и адаптивной иммунной защиты, который избирательно распознает некоторые микроорганизмы, вызывая их гибель или тормозя размножение. Доказано, что содержание иммунных клеток в легких связано с особенностями микробиоты [39].
В отличие от других систем дыхательные пути имеют гомогенную микробиоту, которая уменьшается в биомассе от верхних отделов к нижним. Здоровое легкое не имеет обособленного микробиома, но вместо этого содержит низкие уровни бактериальных сиквенсов, которые в значительной степени неотличимы от верхней дыхательной флоры [33].
Стремительное накопление информации о микробиоме дыхательных путей из-за выраженной гетерогенности исследований не позволяет сформулировать единую четкую концепцию роли микробиома при астме, поскольку микробиом может быть как фактором риска развития астмы, так защиты от нее. Патогенез астмы разнообразен и включает экспозицию аллергенов, другие экспосомы, факторы окружающей среды, взаимодействующие с генетикой во время беременности и в первые годы жизни. Микробный дисбиоз в дыхательных путях все чаще ассоциируется с частотой и тяжестью астмы. Более точному эндотипированию пациентов с астмой может помочь дальнейший анализ состава и метаболической активности индивидуального микробиома. При разных фенотипах астмы наблюдаются отличия в формировании бактериальной колонизации дыхательных путей определенным спектром бактерий, которые можно трактовать как возможности микробиома, определять время дебюта и тяжесть астмы, чувствительность к глюкокортикостероидам (ГКС) и макролидам, коморбидностям [40].
При нейтрофильном Th17-ответе наблюдается преобладание Proteobacteria, принадлежащих к семействам Pasteurellaceae, Enterobacteriaceae и Bacillaceae [41].
Дыхательные пути пациентов с устойчивостью к ГКС и тяжелым течением заболевания колонизируются Moraxella сatarrhalis, Haemophilus или Streptococcus [42, 43].
У пациентов с ГКС-резистентной астмой в составе микробиома преобладали Neisseria, виды Haemophilus, виды Campylobacter и Leptotrichia, которые отсутствовали у пациентов с астмой, чувствительной к ГКС [44].
Использование ГКС, особенно сочетание ингаляционных и пероральных, связано с увеличением численности Proteobacteria и рода Pseudomonas и уменьшением численности видов Bacteroides, Fusobacteria и Prevotella [45].
Лечение ингаляционными глюкокортикостероидами было связано с изменениями профиля цитокинов и воспалительного ответа дыхательных путей на микробиоту. При атопической астме характер воспаления коррелировал с составом микробиоты и серьезностью обструкции дыхательных путей. У пациентов с тяжелой бронхиальной астмой наблюдались снижение концентрации ИЛ-2 и ИЛ-10, высокие концентрации ФНО-α и MIP-1β, колонизация Actinomyces, Neisseria menigiditis и Streptococcus pneumoniae.
У пациентов с более легкими вариантами бронхиальной астмы были значительно снижены концентрации ИФН-γ, ИЛ-17F и G-CSF, повышен ИЛ-2, отмечена колонизация видами Enterococcus. После терапии ингаляционными ГКС в течение 6 недель отмечалась положительная динамика в отношении бронхиальной обструкции, выявлено значительное увеличение видового разнообразия в фенотипах с выраженной и умеренной обструкцией — снижение численности патогенных видов, улучшение качественного состава микробиома [46].
Последние несколько лет привели к ключевым исследованиям, которые позволили четко связать изменения в микробиоме с повышенным риском развития астмы и аллергии. В рамках существующей концепции иммунной солидарности слизистых не только микробиом дыхательных путей несет ответственность за развитие воспаления, но и кишечный микробиом влияет на анатомически удаленные слизистые и иммунную систему в целом. Ассоциации между кишечной и респираторной микробиотой, называемые кишечно-легочной осью, играют центральную роль в динамических изменениях, происходящих при астме и аллергии [47].
«Здоровая» легочная микробиота характеризуется небольшой биомассой, но чрезвычайным разнообразием микробных видов. «Здоровая» кишечная микробита характеризуется одновременно и разнообразием микроорганизмов, и большой биомассой. Микробиота кишечника участвует в формировании лимфоидной архитектуры и иммунного ответа. Потеря кишечного микробного разнообразия (например, в результате вирусной инфекции или использования антибиотиков) может приводить к дисрегуляции ИЛ-17 или бактериальных механизмов элиминации, что потенциально может привести к дисфункции альвеолярных макрофагов и селекции микроорганизмов с патогенным потенциалом (обострение легочного заболевания).
Некоторые формы хронических заболеваний легких могут обостряться из-за транслокации и/или изменения бактериального содержимого кишечника. Воспалительное повреждение легочной ткани (например, вирусная инфекция или аспирация) могут утяжелить заболевание из-за воздействия на микробиоту легкого или кишечника. Вполне вероятно, что существует критическая взаимосвязь или равновесие между компонентами микробиома до тех пор, пока не возникнут возмущения, которые приводят к состоянию дисбиоза или «нездоровому» микробиому [48].
Микробиота кишечника питается и созревает в кишечном эпителии и участвует в иммунитете. Основная роль микробиоты легкого — ориентация и баланс аспектов иммунной и эпителиальной реакции [37].
Перенос акцента на роль эпителия нацеливает исследователей и клиницистов обращать большее внимание на защиту уязвимых дыхательных путей от воздействия окружающей среды и восстановление дефектных функций эпителия, а не только на подавление воспаления дыхательных путей или модуляции иммунного ответа [49].
Эпителиальное/мезенхимальное взаимодействие через экспрессию эпителиальных генов периостина (POSTN), регулятора хлористых каналов 1 (CLCA1) и ингибитора серпин-пептидазы B2 (SERPINB2) специфическим образом изменяется при астме и ассоциируется с ИЛ-13-связанным воспалением дыхательных путей [50]. ИЛ-13 продуцируется Т-хелперами (Th2), а также клетками врожденного иммунитета (Innate Lymphoid Cells, ILC2) [51].
Врожденные лимфоидные клетки
Врожденные лимфоидные клетки (Innate Lymphoid Cells, ILCs) — это группа лимфоцитов, которые вовлечены в быстрое цитокинзависимое реагирование организма во время воспалительного процесса [52]. В организме врожденные лимфоидные клетки (ВЛК) рассредоточены преимущественно в барьерных тканях, на границе внешней и внутренней среды (например, в слизистых). Больше всего ВЛК в месте максимальной концентрации всех иммунокомпетентных клеток нашего организма — в лимфоидной ткани слизистой оболочки пищеварительного тракта. Здесь ВЛК отвечают за контроль мирного сосуществования с населяющими слизистые желудочно-кишечного тракта бактериями «нормальной флоры». ВЛК в достаточном количестве обнаруживаются и в слизистых дыхательных путей [53].
ВЛК имеют общего предшественника, охарактеризованного как клетка, экспрессирующая транскрипторный фактор — ингибитор ДНК-связывающего белка (inhibitor of DNA binding 2, ID2).
ВЛК1 специализируются на ИФН-γ и ФНО-α (защищают слизистую от внутриклеточных паразитов и вирусов); ВЛК2 синтезируют ИЛ-4, ИЛ-5, ИЛ-9 и ИЛ-13 (защита слизистой от многоклеточных паразитов, участие в астме и аллергии); ВЛК3 — преимущественно ФНО-α, интерлейкин-17α и ИЛ-22 (быстро отвечают на инфекцию грибами и внеклеточными бактериями) [54].
ВЛК презентируют Т-лимфоцитам пептидные фрагменты антигенов бактериального происхождения в комплексе с молекулами MHC II класса. Но по причине того, что на мембране ILC-клеток нет ко-стимулирующих молекул, эта презентация носит толерогенный, а не активирующий характер. То есть ВЛК учат Т-лимфоциты «не трогать» симбиотическую флору [55]. Если удастся создать метод генетической модификации ВЛК пациентов так, чтобы усилить у них толерогенную функцию, то может появиться новый метод лечения пациентов в тех популяциях, где ВЛК играют доминирующую роль.
Изменение иммунного ответа под влиянием микробиоты может иметь контактный и дистанционный механизм через Т-регуляторные клетки (Treg), рецепторы врожденного иммунитета (TLR), метаболиты и т. д. [40]. Кишечные бактерии могут модулировать иммунный ответ, непосредственно воздействуя на Tregs через TLR. Комменсальная микробиота способствует дифференцировке индуцированных Tregs (iTreg) из наивных CD4+ T-клеток с помощью независимого механизма первичного ответа TLR и миелоидной дифференцировки TLR и MyD88. Короткоцепочечные жирные кислоты (КЦЖК, или Short-chain fatty acids, SCFA) действуют на Т-клетки через рецептор, связанный с G-белком (GPR43), и защищают макроорганизм от воспаления слизистой кишечника путем увеличения Treg. КЦЖК также способствуют генерации клеток Treg кишечника из наивных CD4+ T-клеток с помощью собственных эпигенетических механизмов Т-клеток. Диета с высоким содержанием клетчатки защищает дыхательные пути от аллергического воспаления, изменяя состав биоты, что приводит к увеличению SCFA. Резидентная микробиота может способствовать развитию Th17-зависимого типа воспаления (показано на мышиной модели астмы, вызванной овальбумином).
Перспективы развития вмешательств при астме и аллергии на основе коррекции микробиоты
Необходим дальнейший анализ влияния микробиомов на фенотипы астмы и аллергии и выявление оптимальных «стратегий, специфичных для фенотипа» (селективное таргетирирование). Полезными могут быть подходы, основанные на манипуляции микробиотой, поскольку средствами традиционной фармакологии можно в лучшем случае подавить иммунитет, но практически невозможно заниматься его регулировкой. Возможное влияние на иммунорегуляцию связывают с пробиотиками, симбиотиками, экобиотиками, синтетическими биотиками или «живыми лекарствами» (генетически модифицированными бактериями для выполнения определенной задачи), трансплантацией фекальной микробиоты, пересадкой редуцированной микрофлоры.
Является ли гипотеза использования пробиотиков при астме и аллергии перспективным направлением? Лейтмотивом исследований с пробиотиками являются доказательства их влияния на иммуномодуляцию. Есть доказательства эффективности пробиотиков in vitro, на животных моделях [56], но индустрия клинических исследований сегодня не успевает за индустрией пробиотиков.
Из-за значительной неоднородности в дизайне исследований, размеров выборки, возраста сбора образцов для изучения микробиоты, методах анализа кишечного микробиома и географического положения в настоящее время нет положительных рекомендаций от научных обществ по использованию пре- или пробиотиков для лечения пищевой аллергии, других аллергических проявлений. Исследования в этой области продолжаются, и некоторые из них показывают возможные преимущества ПБ, которые, по-видимому, практически не имеют риска. Хотя эти исследования предполагают, что использование ПБ может быть многообещающим для профилактики или лечения аллергии, необходимы дополнительные доказательства для определения его эффективности, оптимальной дозировки и штаммов, необходимых для лечения [57].
Cовременные данные не подтверждают пользы рутинного использования ПБ в качестве вмешательства для предотвращения любой формы аллергического заболевания, за исключением группы детей с высоким риском экземы — в соответствии с рекомендацией Всемирной организации по аллергии (World Allergy Organization, WAO) [58].
Оптимальные штаммы, дозы, сроки и продолжительность введения ПБ остаются неизвестными. Тем не менее исследования в этой области продолжаются и позволяют надеяться, что можно прийти к лучшему пониманию роли про-, пре- и синбиотиков в профилактике или лечении аллергии и астмы.
Заключение
В ходе реализации крупных проектов, связанных с микробиомом человека (HMP), произошло радикальное изменение представлений о сложных взаимодействиях организма человека и микрофлоры (микробиоты).
Изменения в кишечной микробиоте или наличие определенных патогенных бактерий в легких в раннем возрасте связаны с повышенным риском развития аллергии. Но несмотря на стремительный рост исследований в этом направлении остаются неясными механизмы, с помощью которых ось «кишечник-легкое» формирует врожденной и приобретенный иммунный ответ. Предстоит детально изучить, как на микробиоту легкого воздействует окружающая среда, диета, инфекции ВДП у здоровых и у пациентов с астмой, детализировать влияние на микробиоту противоастматических препаратов (длительно действующих бета-агонистов, длительно действующих антихолинергиков). Необходимо уточнить, какую роль играют антибиотики при респираторной патологии и могут ли антибиотики, применяемые при респираторных инфекциях, восстановить нарушенный баланс микробиоты легких при астме. Пока неясны механизмы, через которые микробный дисбиоз приводит к утяжелению течения астмы. Отношения между микробиомом и иммунитетом слизистой оболочки могут быть двунаправленными, то есть конкретные виды комменсальных бактерий могут играть как защитную, так и патогенную роль в развитии аллергии/астмы. Доклинические исследования показали, что изменение микробиоты может модулировать глобальный иммунный ответ хозяина, тем самым уменьшая сенсибилизацию и аллергическое воспаление. Ряд исследований, выполненных на экспериментальных моделях и в клинических условиях, показывает, что эффективная стратегия профилактики и лечения аллергии/астмы может быть связана с воздействием на микробиоту, модуляцию ее состава. Некоторые авторы приводят убедительные обоснования для использования перорального введения пробиотиков/пребиотиков в качестве дополнительных лекарств при аллергии/астме, но имеющиеся данные в этой области недостаточны, чтобы рекомендовать их в рутинной практике.
Иммунная система слизистых находится в постоянной связи с огромным разнообразием микробов, присутствующих в организме человека. Открытие новых молекулярных механизмов, обеспечивающих связь между хозяином и микробами, дает нам ключ к пониманию роли микробиома в сохранении респираторного здоровья.
Литература
Н. Г. Астафьева* , 1 , доктор медицинских наук, профессор
Д. Ю. Кобзев**, доктор медицинских наук, профессор
И. В. Гамова*, кандидат медицинских наук
И. А. Перфилова*, кандидат медицинских наук
Е. Н. Удовиченко*, кандидат медицинских наук
Л. В. Скучаева*, кандидат медицинских наук
И. Э. Михайлова*
* ФГБОУ ВО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
** Лидс Тринити университет, Лидс, Великобритания
Читайте также:
