Влияние противоопухолевых препаратов на клеточный цикл
Добавил пользователь Алексей Ф. Обновлено: 01.02.2026
С помощью лекарств сегодня лечат большинство опухолей. Это самый универсальный и самый распространенный метод лечения рака в силу его особенностей:
- простоты введения пациенту (внутривенно или перорально);
- доступа лекарства одномоментно во все клетки и ткани организма;
- возможности на любом этапе корректировать дозу и режим введения препарата или менять лекарство;
- снижения риска выживания злокачественных клеток (клеток рака) в труднодоступных и удаленных местах и возобновления роста опухоли.
Виды лекарственной терапии
С развитием нанотехнологий, молекулярной медицины и генной инженерии в портфеле онкологов появились множество новых противоопухолевых препаратов, лекарства стали более избирательными к злокачественным клеткам и менее токсичными для здоровых тканей и организма в целом. Появились прицельные лекарства, так называемые таргетированные, молекулы которых воздействуют более избирательно на клетки рака.
Все лекарства против рака по механизму действия делят на цитостатические и цитотоксические. Первые, цитостатические, тормозят размножение злокачественных клеток и вызывают их апоптоз, или программу самоуничтожения, клеточный распад. Вторые, цитотоксические, препараты вызывают гибель клеток вследствие их интоксикации, разрушения оболочки и ядра клетки, других структур, и в конечном итоге некроз опухоли.
Учитывая разные механизмы действия, в большинстве случаев онкологи подбирают комбинацию из двух-трех препаратов разных фармакологических групп.
К лекарственному лечению онкологических заболеваний относят:
- Химиотерапию.
- Гормональную терапию.
- Иммунотерапию.
- Таргетную терапию.
- Фотодинамическую терапию.
Лекарственное лечение обычно проводится курсами. Курс включает время введения препарата (от 1 до 5 дней для внутривенных препаратов, может быть дольше для таблетированных препаратов) и время перерыва для восстановления организма и снижения риска побочных эффектов лечения. Перед началом каждого нового курса обычно производится контроль анализов крови и консультация врача онколога для решения вопроса о необходимости корректировки доз препаратов и/или увеличения интервала до следующего введения препарата.
Для длительного лекарственного лечения есть понятие «линий» лечения. «Линия» лечения - последовательное назначение одинаковых курсов химио- (или других видов) терапии. «Линия» лечения проводится до достижения необходимого эффекта или до момента потери чувствительности со стороны болезни. Если опухоль продолжила расти на фоне одной схемы химиотерапии - производится смена лекарств. Продолжение лечения с использованием новой схемы химиотерапии называется «Второй (третьей, четвёртой и т.д.) линией» лечения.
Химиотерапия
Химиотерапия - наиболее распространённый вид лекарственной терапии. Химиотерапия бывает:
1. Лечебной - когда химиотерапия является основным методом лечения заболевания. Например, для многих пациентов с лейкозами, лимфомами, герминогенными опухолями яичка химиотерапия может быть основным методом лечения, который часто приводит к выздоровлению. Для большинства пациентов с распространёнными формами рака, с метастазами в различные органы, химиотерапия является основным методом лечения, дающим максимальную возможность длительно сдерживать болезнь.
2. Неоадъювантной - когда химиотерапия предшествует основному методу лечения. Чаще всего такая химиотерапия назначается перед некоторыми видами операций, с целью уменьшения опухоли и снижения активности её клеток.
3. Адъювантной - её ещё называют «профилактической». Она назначается после основного метода лечения, чаще всего после операции, с целью снижения риска возврата болезни.
- Алкилирующие антинеопластические препараты. Механизм их действия основан на внедрение алкильной группы препарата к ДНК раковой клетки: происходит нарушение структуры ДНК и она не может дальше делиться, запускается апоптоз. В эту группу входят: производные бис-B-хлорэтиламина - исторически первые цитостатические противоопухолевые средства; производные нитрозомочевины и препараты платин, содержащие двухвалентную платину.
- Алкилирующие триазины. Неклассические алкилирующие агенты, пролекарства, которые для проявления своей противоопухолевой активности должны пройти ряд метаболических превращений в организме, в результате которых образуются метилирующие агенты. Последние, внедряясь в ДНК и РНК раковой клетки, не позволяют ей дальше делиться.
- Антиметаболиты. Конкурентно вмешиваются в процесс деления клетки, вызывая ее апоптоз.
- Антрациклиновые антибиотики. Механизм их действия основан на цитотоксическом действии. Они ингибируют синтез ДНК, нарушают проницаемость клеточных мембран и другие механизмы жизнедеятельности клеток.
- Ингибиторы топоизомеразы I и топоизомеразы II, ингибиторы образования микротубул и ингибиторы веретена деления. Цитостатические препараты, избирательно нарушающие структуру ДНК и деление раковых клеток на разных этапах. Химиопрепараты в большинстве случаев вводятся внутривенно или перорально, тогда они оказывают системное воздействие на весь организм. Но могут быть использованы и местно, например, во время хирургической операции для обработки операционного поля, или регионарно, например, в желудочки головного мозга.
Гормональная терапия
Показана только для гормоночувствительных видов рака. Будет ли опухоль реагировать на лечение гормонами или нет, определят с помощью специальных анализов и лабораторных исследований клеточного материала, взятого из опухоли.
Опухоли, реагирующие на гормоны, часто обнаруживают в репродуктивной системе и железах внутренней секреции, например, это:
- рак молочной железы
- рак предстательной железы
- рак яичников
- рак эндометрия (рак тела матки).
Гормонотерапия может быть назначена до удаления опухоли с целью стабилизации ее роста или уменьшения размера, тогда она называется неоадъювантной. Или после - с целью предотвратить повторный рост или метастазирование, такую терапию называют адъювантной.
На поздних неоперабельных стадиях опухолей, чувствительных к данному лечению, гормональная терапия может использоваться в качестве основного лечения. Как паллиативное лечение некоторых видов рака она достаточно эффективна и может продлить жизнь пациента на 3-5 лет.
Иммунотерапия
Иммунитет играет важную роль в профилактике и борьбе с раком. В норме иммунные тельца распознают атипичную клетку и убивают ее, защищая организм от развития опухоли. Но когда иммунитет нарушается в силу разных причин, и раковых клеток становится много, тогда опухоль начинает расти.
Иммунотерапия при раке помогает организму справится с заболеванием за счет активизации защитных ресурсов и не допустить развития повторных опухолей и метастазов. В онкологии используют интерфероны, вакцины от рака, интерлейкины, колониестимулирующие факторы и другие иммунные препараты.
Лечение подбирает иммунолог на основе лабораторных данных о состоянии иммунной системы онкопациента совместно с лечащим врачом-онкологом и другими специалистами, участвующими в лечении конкретного пациента.
Основные механизмы иммунотерапии:
- подавление роста опухолевых клеток и их последующее уничтожение;
- профилактика рецидива опухоли и образования метастазов;
- уменьшения побочного влияния противоопухолевых средств, лучевой терапии;
- профилактика инфекционных осложнений при лечении опухолей.
Таргетная терапия
От английского target - цель, мишень. Относят к перспективным методам молекулярной медицины, будущему в лечении онкопатологий, как и разработку вакцин против рака.
Таргетные лекарства очень специфичны и разрабатываются под конкретный мутировавший ген раковой клетки данного вида опухоли. Поэтому до таргетного лечения обязательно проводят генетическое исследование материала, взятого на биопсию.
Например, разработаны эффективные таргетные препараты для лечения различных генетических форм рака молочной железы, множественной миеломы, лимфомы, рака предстательной железы, меланомы.
В силу своей специфики и целевого попадания на раковую клетку-мишень таргетные препараты более эффективны для лечения опухолей, чем например, классические противоопухолевые. И менее вредны для нормальных клеток, не обладающими характеристиками опухолевых. Многие таргетные методы относят к иммунотерапии, так как по сути они формируют нужный иммунный ответ.
Фотодинамическая терапия
Осуществляется препаратами, воздействуя световым потоком определённой длины волны на раковые клетки и разрушая их.
Побочные эффекты лекарственного лечения рака
Самое известное и пугающее онкопациентов осложнение после химиотерапии - выпадение волос. Происходит потому, что противоопухолевые препараты токсичны для молодых активно делящихся клеток, какими являются в том числе волосяные фолликулы и ногтевые пластины. На практике далеко не все виды химиотерапии вызывают выпадение волос. Это осложнение характерно для узкого спектра препаратов, многие пациенты с ним не сталкиваются. На время действия препарата может снижаться активность обновляющихся клеток организма, из-за чего перестают расти ногти и волосы, происходит выпадение волос, угнетается система кроветворения. После курса химиотерапии необходим восстановительный период, в течение которого организм приходит в норму.
Выраженные осложнения наблюдаются далеко не у всех пациентов, но риск их возрастает с увеличением продолжительности лечения.
Часто встречаются следующие побочные эффекты после проведения лекарственной терапии:
- выпадение волос, ломкость ногтей;
- тошнота, рвота;
- нарушение аппетита, изменение вкуса;
- анемия, кровотечение;
- нарушение иммунитета;
- диарея;
- бесплодие, нарушение сексуальной и репродуктивной сферы.
Большинство осложнений поддаётся корректировке, при правильном проведении лечения многие из них можно предотвратить или остановить при первом проявлении. Тяжёлые осложнения могут быть причиной увеличения интервалов между курсами химиотерапии.
Эффективность
Чем раньше обнаружен рак и точнее диагностирован тип опухолевых клеток, тем успешнее лечение рака и благоприятнее прогноз выздоровления. Поэтому следует постоянно следить за состоянием своего здоровья, проходить диагностические исследования согласно возрасту, не закрывать глаза на недомогание или периодический дискомфорт в теле. Также лучше не тратить время на попытки вылечиться самостоятельно или при помощи нетрадиционной медицины, не имеющей никаких убедительных данных об эффективности, игнорируя современные методы медицинского лечения. Так можно только запустить онкологический процесс, усугубить стадию заболевания и затруднить последующее лечение. Не теряйте драгоценное время, обследуйтесь в специализированных центрах на современном оборудовании у высококвалифицированных врачей.
Как анеуплоидия раковых клеток снижает эффективность химиотерапии и что с этим делать?
Новость
Раковые клетки легких
Anne Weston, EM STP, The Francis Crick Institute/Science Photo Library
Авторы
Редакторы
Статья на конкурс «Био/Мол/Текст»: Лечение рака — сложный многоступенчатый процесс, на успешность которого влияет множество факторов. Их изучение необходимо для того, чтобы определить наиболее действенные методы борьбы с онкологическими заболеваниями. При этом механизмы устойчивости иногда срабатывают довольно парадоксальным, на первый взгляд, образом. Так, анеуплоидия характерна для большинства раковых клеток и снижает эффективность химиотерапии. При этом анеуплоидные клетки проходят клеточный цикл куда медленнее, чем эуплоидные, а значит, опухоль растет не так активно. Новое исследование объясняет механизмы этой резистентности и на их основе предлагает способы повысить эффективность терапии.

Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
В этой статье мы расскажем об исследовании [1], которое подтвердило, что устойчивость (резистентность) раковых клеток к воздействию распространенных препаратов химиотерапии напрямую связана с анеуплоидией — ситуацией, при которой число хромосом отклоняется от нормального: их больше или меньше, чем в диплоидном наборе. Состояние, при котором одна хромосома отсутствует, называется моносомией, если есть одна лишняя хромосома — трисомией (рис. 1), если две — тетрасомией и т.д.
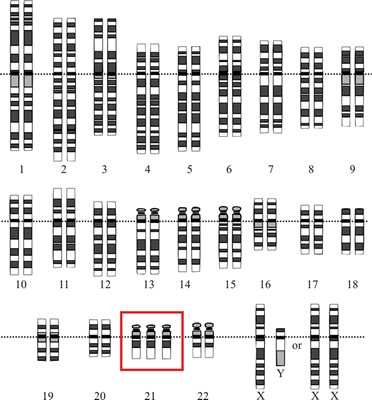
Рисунок 1. Хромосомный набор человека с синдромом Дауна — одного из самых известных проявлений анеуплоидии с трисомией по 21 хромосоме
National Human Genome Research Institute, Human Genome Project
Из-за нарушений процесса деления раковых клеток хромосомы между дочерними клетками часто распределяются аномально. Поэтому анеуплоидия характерна для 90% злокачественных образований и служит маркером рака (рис. 2) [2]. Несмотря на то, что подобные нарушения замедляют рост опухоли, обнаружение анеуплоидии ухудшает прогноз для больного с онкологией. Так, исследование итальянских ученых, проведенное в конце 80-х годов XX века, показало, что в три раза больше пациентов выживает, если клетки опухоли имеют нормальный набор хромосом [3]. Но почему? Как состояние, которое мешает благополучному развитию клетки, оказывается в итоге преимуществом для опухоли?
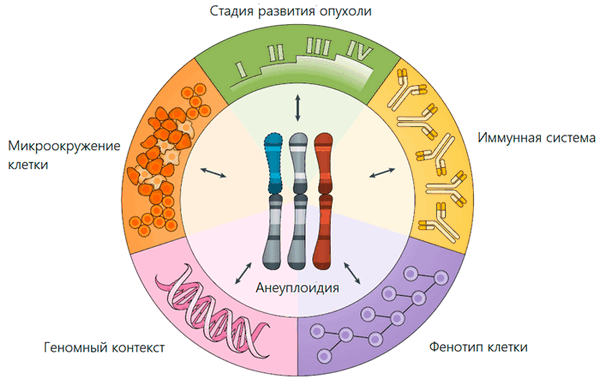
Рисунок 2. Основные факторы, определяющие адаптивную ценность анеуплоидии (то же справедливо и в обратную сторону)
Чтобы это выяснить, международный коллектив исследователей из Университета Тель-Авива, Массачусетского технологического института, Гарвардского университета и ряда других исследовательских центров США изучал, как ведут себя раковые клетки с разным набором хромосом при воздействии на них двух наиболее распространенных препаратов для химиотерапии: паклитаксела и цисплатина. Эти лекарства останавливают развитие опухоли, но имеют разные механизмы действия.
Паклитаксел (как и другие препараты из группы таксанов) влияет на сборку микротрубочек — структур внутреннего скелета клетки (см. рис. 7). Микротрубочки выполняют разные функции, в том числе формируют центриоли и веретено деления, которые разводят хромосомы к противоположным полюсам клетки во время ее деления. Паклитаксел стимулирует формирование микротрубочек, связываясь с молекулами β-тубулина — части димерного тубулина — белка, из которого построены микротрубочки. Но микротрубочки должны постоянно перестраиваться (удлиняться и укорачиваться на разных концах) за счет полимеризации тубулина или распада его полимера. А паклитаксел как раз блокирует этот распад, стабилизируя микротрубочки и предотвращая их реорганизацию. Это мешает расхождению хромосом и делает невозможным митоз — деление клетки на две генетически идентичные копии. Продолжительная задержка на этапе деления ведет к гибели клетки или возвращает ее обратно в фазу покоя. Так паклитаксел не позволяет клеткам делиться, мешая росту опухоли.
Цисплатин, в свою очередь, имеет в составе атомы платины, которые связываются с основаниями ДНК, повреждая ее. Если во время S-фазы (от англ. synthesis — «синтез») клеточного цикла, когда ДНК реплицируется — то есть на ее основе формируются две дочерних копии, — обнаружатся ее повреждения, то репликация остановится. А так как без удвоения молекулы ДНК клетка делиться не может, то в результате цисплатин предотвращает деление клеток и рост опухоли (см. рис. 7).
Итак, оба препарата нарушают клеточный цикл, но на разных его этапах. Однако при анеуплоидии механизм действия цитостатиков (таких как цисплатин и паклитаксел), предотвращающий деление клетки, не срабатывает, и опухоль благополучно растет. Почему так происходит? Авторы исследования полагают, что ключевую роль играют два фактора: замедленный рост и отложенное деление клеток с аномальным набором хромосом.
Клетки с анеуплоидией, как правило, делятся реже, чем эуплоидные (с нормальным хромосомным набором), за счет удлиненной интерфазы клеточного цикла [5], [6], которую клетка проходит между делениями (рис. 3). Точнее, затягиваются первые два этапа интерфазы: G1 (от англ. gap — «промежуток») и S, на которые приходятся многие процессы, связанные с ростом клетки. Эта задержка вызвана множественными характерными для анеуплоидии нарушениями в работе генов, влекущими за собой неправильную укладку белков, последующие нарушения их обмена и вытекающие из этого сбои в функционировании клетки — протеотоксический стресс, и нестабильность генома из-за изменений в клеточном обмене веществ. Казалось бы, медленное разрастание опухоли должно облегчать борьбу с онкологическим заболеванием, однако выходит наоборот — удлиненные фазы G1 и S связаны с бо́льшей устойчивостью клеток к препаратам.
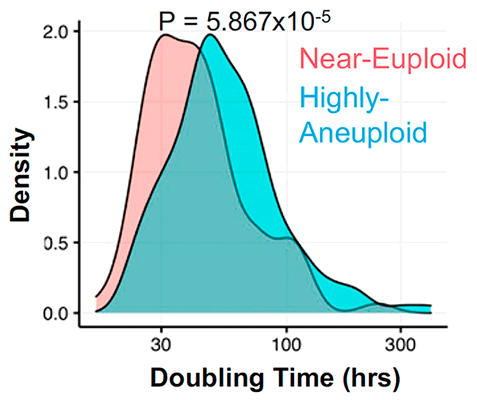
Рисунок 3. Гистограмма, иллюстрирующая, что время удвоения (doubling time) для анеуплоидных клеток выше, чем для эуплоидных. Построена на основе данных из базы Cancer Cell Line Encyclopedia (CCLE).
После воздействия на клетки цисплатином или паклитакселом ученые подсчитали количество выживших: клетки с трисомией при добавлении обоих препаратов выживали чаще, чем эуплоидные: примерно на 20-40% (рис. 4а) для цисплатина и на 10-30% для паклитаксела (рис. 4б).
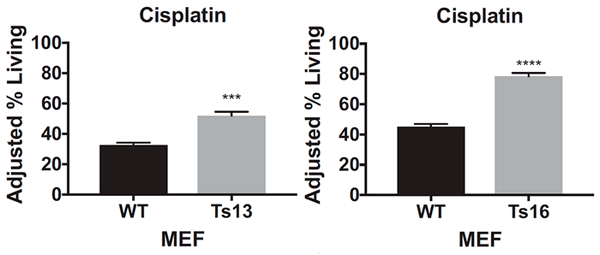
Рисунок 4а. Процент выживших клеток после воздействия цисплатином (cisplatin) на эмбриональные фибробласты мышей (MEF) с нормальным хромосомным набором (WT) и с трисомией по 13-й (Ts13) и 16-й (Ts16) хромосомам. ** — P
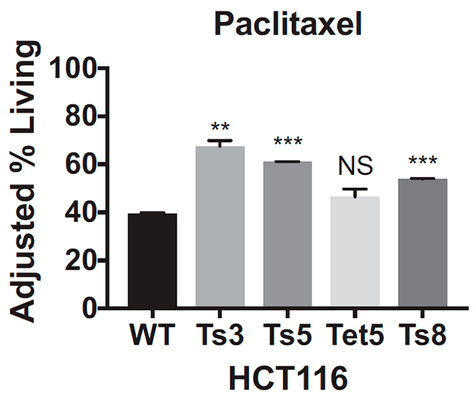
Из этих данных ученые сделали вывод, что, во-первых, оба препарата оказываются неэффективными для клеток с трисомией, а во-вторых, резистентность возникает независимо от того, по какой хромосоме анеуплоидия. Ученые также посмотрели, как ведут себя раковые клетки толстой кишки с тетрасомией по 5-й хромосоме, однако результаты, полученные на этой клеточной линии, не были статистически значимыми. К сожалению, авторы исследования никак это не прокомментировали и больше клеточные линии с анеуплоидией типов, отличных от трисомии, не проверяли, поэтому как ведут себя клетки с моносомией или тетрасомией пока неизвестно. Будем надеяться, что исследования в этой области появятся в недалеком будущем.
Уже на этом этапе изучения можно предположить, что случаи трисомии по разным хромосомам должны объединять некоторые общие нарушения, вызванные анеуплоидией, которые помогают им противостоять воздействию препарата. Такой потенциальной точкой пересечения ученые посчитали изменения в длительности клеточного цикла в виде задержки фаз G1 и S.
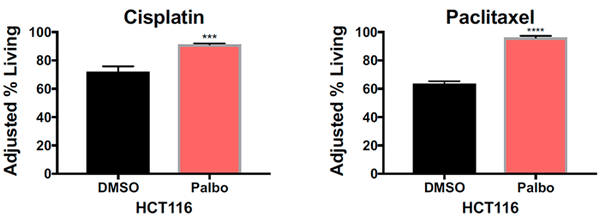
Рисунок 5. Процент выживших клеток после воздействия на псевдодиплоидные раковые клетки толстой кишки (HCT116) сначала растворителем диметилсульфоксидом (DMSO) или палбоциклибом (Palbo), а затем цисплатином (Cisplatin) или паклитакселом (Paclitaxel). *** — P
Кроме того, ученые проверили, насколько эффективно другие препараты для химиотерапии, работающие за счет вмешательства в клеточный цикл, воздействуют на различные линии раковых клеток человека в зависимости от степени их анеуплоидности (по данным Cancer Cell Line Encyclopedia). Они обнаружили, что к 29 препаратам из 34 рассмотренных анеуплоидные клетки оказывались более устойчивыми, чем эуплоидные, причем в 21 случае анеуплоидии сопутствовало замедленное деление клеток (рис. 6).
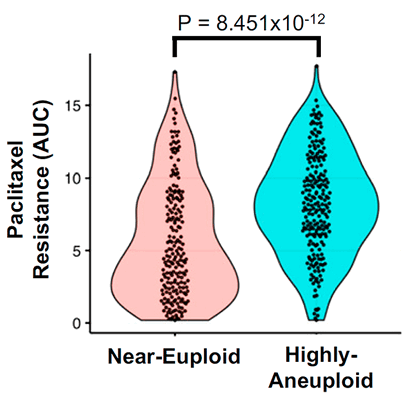
Рисунок 6. Связь между чувствительностью к паклитакселу и степенью анеуплоидности для клеточных линий. Данные взяты из базы Cancer Cell Line Encyclopedia (CCLE).
Связь между анеуплоидностью и резистентностью к цисплатину оказалась статистически незначимой, так как во всех случаях в качестве растворителя использовался диметилсульфоксид, который согласно исследованиям снижает эффективность препаратов на основе платины [9].
Таким образом, исследования подтвердили, что анеуплоидия увеличивает резистентность к очень разным по принципу действия препаратам за счет одного из своих главных последствий — замедления клеточного цикла, вызванного удлиненными фазами G1 и S. Какими механизмами это может быть вызвано?
В случае с паклитакселом все достаточно просто. Этот препарат не дает хромосомам разойтись: он предотвращает образование веретена деления, тем самым убивая клетку. Однако если она застревает в G1-фазе, то она просто не доходит до той стадии клеточного цикла, когда препарат начинает действовать, и поэтому не умирает (рис. 7). Те клетки, чей процесс деления оказывается отложенным, выживают во время терапии, а затем, после того как препарат выводится из организма, могут делиться дальше.
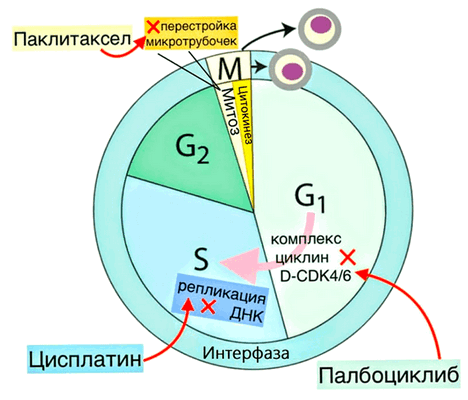
Рисунок 7. Схема клеточного цикла с указанием, в какие моменты обсуждаемые в статье препараты нарушают его работу. М-фаза включает в себя митоз и цитокинез (разделение двух дочерних клеток). Интерфаза — G1-фазу (происходит рост клетки, увеличивается количество органелл), S-фазу (репликация ДНК) и G2-фазу (рост клетки и подготовка к делению, устранение поломок в ДНК). Для перехода из G1-фазы в S-фазу в клетке должен собраться комплекс D-CDK4/6 из белков циклина D и четвертой и шестой циклинзависимых киназ (CDK4 и CDK6 от cell division protein kinase). Палбоциклиб ингибирует эти киназы, поэтому из-за его воздействия клетка уходит в фазу покоя G0, то есть не делится, — так препарат мешает росту опухоли. Цисплатин, нарушая структуру ДНК, останавливает клеточный цикл на S-фазе. Паклитаксел мешает перестройкам микротрубочек, нарушая работу веретена деления, из-за чего не происходит расхождение хромосом, и деление клетки задерживается: она либо возвращается в интерфазу, либо погибает.
С цисплатином все немного сложнее — он повреждает структуру ДНК вне зависимости от стадии клеточного цикла, однако эти повреждения оказываются критичны только во время S-фазы, когда происходит репликация ДНК. На первый взгляд, механизм резистентности может быть таким же, как в случае с паклитакселом: клетка просто не успевает дойти до нужной стадии цикла. Но авторы исследования полагают, что свою роль может играть и другой механизм. Так как цисплатин проникает в клетку за счет пассивной диффузии, то снижение потребления вещества клеткой с отложенной G1-фазой или повышение его оттока из нее приводят к уменьшению платиновых аддуктов в составе ДНК клетки, а соответственно к уменьшению повреждений. Однако для полного понимания того, как эти механизмы работают для цисплатина, необходимы дополнительные исследования.
Важно, что анеуплоидия помимо замедленного деления вызывает еще множество других последствий, которые могут повышать резистентность. Например, за счет нестабильности генома у таких клеток больше шансов приобрести мутации, которые помогут им приспособиться к неблагоприятным условиям. То, как еще анеуплоидия влияет на раковые клетки, пока что мало изучено. Несмотря на сделанный человечеством большой шаг на пути к пониманию того, как эффективно бороться с болезнью, это лишь один из множества шагов, которые нам только предстоит пройти.
Противоопухолевые препараты
Противоопухолевые препараты пугают онкологических пациентов непредсказуемостью позитивного и частого негативного действия. Большинство пациентов предпочло бы остановиться на хирургическом лечении или облучении, но эти строго локальные методы не всегда технически возможны. На все опухолевые очаги системно удается воздействовать только лекарственными препаратами, поскольку они проникают всюду, где есть кровь вне зависимости от способа введения.
Что такое противоопухолевые препараты и как они работают?
Все убивающие злокачественные клетки препараты можно называть противоопухолевыми, не смотря на существенную разнородность лекарственных молекул и механизм повреждающего действия. Большинство противоопухолевых препаратов влияет на деление клеток, нарушая структуру их ДНК или веретена, помогающего развести хромосомы в образующиеся дочерние клетки. Вероятно, цитостатики повреждают не только геном, лучше всего изучено их действие образование сшивок между частями одной нити ДНК и двумя параллельными нитями, заплетенными в спираль. У клетки есть способы для восстановления малого повреждения генетического аппарата, но при существенном нарушении она вынуждена уйти в сторону апоптоза — смерти.
Клеточные популяции в опухолевом узле очень разнородны: какие-то клетки только собираются делиться, другие уже вошли в процесс и активно синтезируют две копии структур для дочерней клеточки, некоторые находятся в покое, а часть после завершения жизненной программы устремилась к гибели. Считается, что находящиеся в состоянии покоя клеточные популяции устойчивы к агрессии противоопухолевых лекарств, зато делящиеся и планирующие войти в эту фазу — самые чувствительные к химиопрепаратам. Делящиеся клетки составляют фракцию опухолевого роста, чем она крупнее, тем агрессивнее рак и одновременно более чувствителен к противоопухолевому воздействию.
Классификация и виды противоопухолевых средств
Противоопухолевые лекарства представлены химиотерапевтическими препаратами, то есть цитостатиками, эндокринными или гормональными средствами, таргетными препаратами. Все они различаются механизмом инициации клеточной смерти.
Цитостатики используются с 1946 года и представлены несколькими группами лекарственных средств:
- алкилирущие получили свое название от химической реакции, реализующей ведущий механизм повреждения — алкилирование, то есть замену атома водорода нуклеиновых кислот нитей ДНК на алкильную группу лекарства с образованием связок и деформацией структуры;
- антиметаболиты прекращают жизнедеятельность клетки, вмешиваясь в её метаболизм и подменяя собой структурные компоненты нуклеиновых оснований ДНК и РНК или блокируя участвующие в синтезе этих оснований ферменты;
- противоопухолевые антибиотики тоже формируют ДНК-сшивки, а традиционное для антибактериальных препаратов противовоспалительное и противомикробное действие у них практически равно нулю;
- препараты растительного происхождения очень разнородны, преимущественный механизм действия — нарушение клеточного деления, общее у них одно — их выделили из растительного сырья, а позже стали синтезировать химическим способом, удешевляя и облегчая процесс производства;
- различные препараты невозможно было отнести к четырём основным группам ни по одному объединяющему критерию.
Алкилирующие средства
Это самые первые противораковые лекарства, начавшие историю химиотерапии. Ярчайшие представители группы — циклофосфамид, нитрозометилмочевина и производные платины.
Алкилирование противоопухолевыми агентами ДНК приводит к разрывам её цепи и сшиванию с закрученной в параллельную спираль второй нитью, образуемые сшивки не хаотичны — в определенном месте и с конкретным нуклеотидом. В конечном итоге предотвращается репликация, то есть сборка второго комплекта структур для разделения клетки. Принципиально алкилирование возможно в любую фазу клеточного цикла, но особенно активно осуществляется во время синтеза.
Препараты этой группы обладают широким противоопухолевым спектром, используются в терапии рака, в том числе сарком и онкогематологических процессов.
Циклофосфамид, более привычное торговое наименование циклофосфан, применяется более 60 лет в качестве компонента полихимиотерапии, в одиночку используется при злокачественных заболеваниях крови и лимфатической ткани. Вводится разными способами: в таблетках, внутривенно и внутримышечно. Для местного применения бесполезен, потому что активируется исключительно в ткани печени, куда попадает с кровью.
Редкая особенность препарата ифосфамида — наличие антидота уромитексана, защищающего слизистую мочевого пузыря от повреждений.
Первое производное платины — цисплатин было синтезировано в середине XIX века, а в клинику пришло в последней четверти прошлого века. Препарат легко проникает в клетки, потому что его молекула не заряжена ни положительно, ни отрицательно, чем и обусловлена его высокая агрессивность в отношении множества злокачественных процессов. Сегодня применяются уже три поколения платиновых производных, при неизменно высокой активности существенно различаются побочные эффекты.
Препараты нитрозометилмочевины преимущественно используются при злокачественных новообразованиях ЦНС и в онкогематологии.
Противоопухолевые препараты растительного происхождения
Вещества растительного происхождения представлены несколькими группами:
- винкаалкалоиды выделены из растения барвинок, у всех четырёх лекарственных средств идентичный механизм противоопухолевого действия — нарушение белка тубулина и вследствие этого остановка клеточного митоза;
- таксаны немногочисленны, первоначально был выделен из коры тихоокеанского тисового кустарника паклитаксел, а через 15 лет уже из игл европейского тиса добыли доцетаксел, сегодня таксаны наполовину синтетические, кроме высокой эффективности они стали первенцами среди слишком дорогих химиопрепаратов;
- камптотецины добывают из южно-китайского ниссового кустарника, препарат нарушает фермент топоизомеразу, не позволяя раскрутиться суперспирали ДНК, сегодняшние полусинтетические аналоги камптотецина топотекан используются при опухолях ЦНС, иринотекан незаменим в схемах химиотерапии карцином толстой кишки, легкого и яичников;
- эпиподофиллотоксины — полусинтетические аналоги смолы из корней американской мадрагоры и самый яркий представитель подгруппы — этопозид оказался эффективнее природного аналога.
Противораковые препараты нового поколения
Противоопухолевое действие цитостатиков обнаруживали почти случайно, таргетные препараты синтезируют на основе научных исследований. Таргетные препараты работают «точечно», блокируя важный внутриклеточный элемент, понуждая к клеточной гибели. Эту группу также называют ингибиторами за подавление ими клеточных процессов. Особенность лекарственных средств в невозможности полного уничтожения опухоли, как правило, они приостанавливают размножение популяции, поэтому используются вместе с цитостатиками.

Иммуноонкологические средства способствуют восстановлению естественной иммунной защиты организма, подавленной злокачественной опухолью. Средства отличаются от стандартных иммунных препаратов, аналогом которых были вырабатываемые организмом цитокины — интерферон и интерлейкин. Лекарства, как и таргетные, создаются целенаправленно на основе фундаментальных достижений науки. Иммунотерапия сдвинула с мертвой точки лечение меланомы, устойчивой к цитостатикам, мало чувствительный рак легкого и желудка, почечноклеточную карциному и рак печени.
Препараты на гормональной основе
Эндокринная терапия призвана снизить выработку половых гормонов или не допустить их внутрь опухолевой клетки, дабы исключить стимуляцию роста чувствительного к уровню гормонов злокачественного процесса.
Классификация эндокринных препаратов по механизму действия:
- центральные, подавляющие выработку гормонов гипофиза, регулирующих синтез эндокринных веществ половыми клетками, и главные представители группы — агонисты ЛГРГ;
- периферические — снижают функцию половых желез или нарушают в жировой ткани работу фермента ароматазы, отвечающего за трансформацию тестостерона в эстроген — группа ингибиторов ароматазы;
- клеточные — связывающиеся на мембране с рецептором и не пропускающие гормоны внутрь клетки и по своей сути антигормоны, как антиэстроген тамоксифен.
Применяются гормональные противоопухолевые лекарства при карциномах молочной и предстательной железы, а также некоторых вариантах рака тела матки, несущие на своей клеточной поверхности специальные рецепторы гормонов. Как правило, лечение рассчитано на несколько лет, поскольку реализация противоопухолевого эффекта очень медленная.
Побочные явления
Точка приложения противоопухолевых препаратов — клетка, причём не только опухолевая, но и нормальная, поэтому при противоопухолевой терапии закономерны осложнения. Спектр побочных эффектов каждого препарата изучен, но токсические проявления у отдельного пациента строго индивидуальны и непредсказуемы по интенсивности.
Даже препараты одной подгруппы при общем механизме действия имеют разные точки приложения, к примеру, очень небольшие отличия в строении алкалоидов барвинка винкристин и винбластин обернулись существенными различиями в спектре активности и токсичности, их применяют при разных болезнях. Скопированный с натурального растительного винбластина синтетический аналог виндезин, по биологическому действию и осложнениям больше походит на винкристин. Структурно схожий с природными винкаалкалоидами и полностью синтетический винорелбин по спектру действия и токсичности совсем не походит на натуральные аналоги.
Противоопухолевые лекарства не гарантируют 100% результата, раковые клетки уникальны в способности самовосстановления и скорости воспроизводства популяции.
Искусство химиотерапии — это не только умелый подбор оптимальной комбинации, обещающей максимально возможный результат, но и минимизация программных осложнений лекарственного лечения. В нашей Клинике не только помогают каждому пациенту легче перенести химиотерапию, но заблаговременно по индивидуальной программе, учитывающей все особенности организма, готовят к курсу лечения.
Препараты для химиотерапии
В настоящее время существует более сотни препаратов для химиотерапии рака (химиопрепаратов). Они различаются по химической структуре и механизмам действия, благодаря этому врач-химиотерапевт может подобрать наиболее оптимальное сочетание препаратов для конкретного пациента, в зависимости от типа, стадии рака и других факторов.
Как работают химиопрепараты?
Несмотря на разные механизмы действия, все химиопрепараты работают в одном направлении: они нарушают клеточный цикл, останавливают размножение раковых клеток и вызывают их гибель.
Противопоказания к химиотерапии
Несмотря на потенциальную пользу, которую способны принести химиопрепараты, некоторым пациентам они противопоказаны из-за высокого риска тяжелых побочных эффектов. К основным противопоказаниям относят тяжелую тромбоцитопению, острые инфекции с высокой температурой, тяжелые нарушения со стороны сердечно-сосудистой системы, легких, печени, почек, первый триместр беременности, перенесенные серьезные операции, пожилой возраст, сильное истощение.
Перед началом курса химиотерапии врач должен тщательно оценить состояние пациента, выявить имеющиеся у него проблемы со здоровьем и связанные с ними потенциальные риски.
Противопоказания к применению противоопухолевых препаратов бывают не только абсолютными, но и относительными. Химиотерапию проводить можно, но только с соблюдением некоторых условий:
- Снизить дозы, подобрать препараты, которые наиболее безопасны.
- Использовать один препарат химиотерапии вместо комбинации из двух и более.
- Перед началом курса провести лечение и устранить имеющиеся проблемы со здоровьем.
- Выждать некоторое время, например, после перенесенной операции или пока не стихнет инфекция.
В каждом случае требуется индивидуальный подход.
Типы химиопрепаратов
Препараты для химиотерапии делят на группы, в зависимости от химической структуры и механизма действия. Один и тот же препарат может работать разными способами и относиться к разным группам. Зная, к какой группе относится химиопрепарат, врач может прогнозировать лечебные и побочные эффекты, правильно спланировать курс лечения.

Цитостатики и цитотоксические препараты
Традиционно противоопухолевые препараты делят на две группы:
- останавливают размножение раковых клеток и запускают в них процесс запрограммированной клеточной смерти — апоптоз. К этой группе относят, в частности, фторурацил, цисплатин, доксорубицин.
- Цитотоксические (цитотоксины) повреждают ядро, оболочку и другие компоненты клетки, приводят к её гибели.
Также в настоящее время существуют таргетные препараты, которые нарушают жизнедеятельность и размножение опухолевых клеток путем воздействия на определенные молекулы-мишени, и иммунопрепараты, которые задействуют ресурсы противоопухолевого иммунитета.
Алкилирующие агенты
Самая старая группа средств для химиотерапии. Они так названы потому, что могут алкилировать различные молекулы, включая ДНК, РНК и белки. Препарат связывается с молекулой ДНК и приводит к ее разрыву во время удвоения в процессе деления клетки. В итоге запускается процесс запрограммированной клеточной гибели — апоптоз.
Алкилирующие агенты атакуют клетки на любой стадии клеточного цикла. Химиотерапия данными средствами эффективна при многих типах рака: легких, яичников, молочной железы, а также при саркомах, множественных миеломах, болезни Ходжкина, лимфоме, лейкемии.
Представители группы: цисплатин, карбоплатин, дакарбазин, хлорамбуцил, оксалиплатин, темозоломид.
Антиметаболиты
Эти препараты атакуют опухолевые клетки на стадии удвоения хромосом во время деления. Они нарушают синтез новых РНК и ДНК, занимая места нуклеотидов — «звеньев», из которых состоят цепочки нуклеиновых кислот. Антиметаболиты эффективны в качестве химиотерапии при раке кишечника, яичников, молочной железы, лейкемии.
Представители группы: 5-фторурацил, 6-меркаптопурин, капецитабин, гемцитабин, метотрексат.
Противоопухолевые антибиотики
Напоминают антибактериальные препараты, которые используются для лечения инфекций. Эти химиопрепараты повреждают ДНК опухолевых клеток и нарушают их размножение. Существуют разные группы антибиотиков для химиотерапии, одна из них — антрациклины. Эти препараты нарушают функции ферментов, которые необходимы для удвоения ДНК.
Представители антрациклинов: доксорубицин (адриамицин), эпирубицин, даунорубицин, идарубицин.
Представители противоопухолевых антибиотиков, не являющихся антрациклинами: блеомицин, митоксантрон, митомицин-С, актиномицин D.
Ингибиторы топоизомеразы
Молекула ДНК состоит из двух цепочек, закрученных в спираль. Для того чтобы скопировать ее во время деления клетки, спираль нужно «распутать». За эту функцию отвечает особый фермент топоизомераза. Существуют средства для химиотерапии, которые блокируют его, тем самым нарушая процессы клеточного деления. Ингибиторы топоизомеразы эффективны при раке желудка и кишечника, яичников, легких, при лейкозах.
Представители группы: топотекан, иринотекан, этопозид, тенипозид, митоксантрон.
Ингибиторы митоза
Средства для химиотерапии из этой группы имеют растительное происхождение. Они блокируют деление клеток, нарушая функцию микротрубочек и некоторых белков-ферментов. Ингибиторы митоза применяют для лечения рака молочной железы, легких, миеломы, лимфомы, лейкозов.
Представители группы: доцетаксел, паклитаксел, винбластин, винкристин.
Винкаалкалоиды
Первые ингибиторы митоза из этой группы — винбластин и винкристин — были выделены из растения барвинок розовый (Vinca rosea). Затем на основе винбластина были созданы полусинтетические соединения для химиотерапии — винорелбин и виндезин. Основной механизм действия этих препаратов состоит в том, что они связывают с белком тубулином в составе микротрубочек и не дают ему полимеризоваться. Деление клеток останавливается.
Также винкаалкалоиды нарушают другие клеточные процессы: изменяют обмен аминокислот и некоторых других веществ, влияют на синтез нуклеиновых кислот, жиров, клеточное дыхание.
Таксаны
Эти препараты начали широко применяться для химиотерапии с 90-х годов прошлого столетия. Первым был получен 1960-х годах паклитаксел из экстракта тихоокеанского тиса (Taxus brevifolia). В 1980-х годах из экстракта хвои европейского тиса (Taxus baccata) удалось выделить более мощный препарат — доцетаксел.
Таксаны тоже влияют на микротрубочки, но не так, как винкаалкалоиды. Они, напротив, ускоряют полимеризацию тубулина, впоследствии препятствуют его деполимеризации и распаду микротрубочек. Из-за этого также нарушается деление клеток.
Глюкокортикостероиды
Глюкокортикостероиды, или глюкокортикоиды, представляют собой препараты гормонов коры надпочечников. Они обладают многими функциями, в частности, принимают участие в регуляции обмена веществ, подавляют иммунные реакции и воспаление. Также эти препараты обладают противоопухолевыми свойствами. Иногда глюкокортикоиды используют для поддерживающей терапии. Они помогают устранить вызванную противоопухолевыми препаратами тошноту и рвоту, предотвратить аллергические реакции.
Представители группы: метилпреднизолон, преднизон, дексаметазон.
Лекарства для химиотерапии, которые не относятся к каким-либо группам
Некоторые химиопрепараты не входят ни в одну группу и обладают собственными механизмами действия. Например, ингибитор протеосом бортезомиб, фермент L-аспарагиназа.
Принципы применения препаратов для лечения рака
Для того чтобы обеспечить необходимую эффективность химиотерапии, нужно придерживаться некоторых правил:
- Как можно более раннее начало лечения. Пациент должен начать получать химиопрепараты сразу же, как только выявлены показания к их применению. К сожалению, в российских государственных клиниках дела с этим обстоят не лучшим образом. Зачастую не сразу удается попасть на прием к врачу и пройти необходимые обследования. Крупные онкологические центры постоянно сильно загружены, и пациентам приходится ждать своей очереди, чтобы начать лечение. Но рак не станет ждать, он прогрессирует, и со временем прогноз может ухудшиться. В «Евроонко» доступны все группы препаратов, и мы всегда начинаем терапию в кратчайшие сроки.
- Применение комбинаций препаратов. Обычно назначают 2-3 химиопрепарата с разными механизмами действия.
- Правильный подбор схемы химиотерапии. Разные типы рака обладают неодинаковой чувствительностью к тем или иным противоопухолевым препаратам. Врачи ориентируются на протоколы лечения. Эти документы составлены на основе результатов научных исследований с участием тысяч пациентов по всему миру, и в них расписаны сочетания препаратов, которые с наибольшей вероятностью будут эффективны при тех или иных злокачественных опухолях. На случай, если терапия первой линии не помогает, предусмотрены «запасные» варианты.
- В максимально короткие сроки нужно создать в тканях оптимальную концентрацию химиопрепарата и затем поддерживать её. Для этого важно правильно определиться с дозировками и частотой введений. Химиотерапию проводят циклами: больному вводят препараты, а затем дают некоторое время (обычно 1-3 недели) на «передышку». Курс может состоять из нескольких циклов.
- При неоперабельном раке лечение продолжают, пока препараты работают или не начинают вызывать тяжелые побочные эффекты.
- Пациент должен переносить химиотерапию комфортно. В «Евроонко» постоянно контролируют его состояние, проводят необходимые исследования и анализы, вводят противоопухолевые препараты под прикрытием поддерживающей терапии.
Дозировки
Подбор оптимальной дозы химиопрепаратов можно в какой-то степени сравнить с хождением по канату. Если дозировка будет слишком низкой, лечение станет недостаточно эффективным и ухудшится прогноз, а если слишком высокой, можно получить тяжелые осложнения. Ситуация осложняется тем, что «канат» у каждого пациента разной «толщины» — это зависит от размеров тела, индивидуальной способности организма метаболизировать лекарство.
Обычно дозировку химиопрепаратов рассчитывают, основываясь на площади поверхности тела или весе пациента. Также нужно учитывать общее состояние здоровья, сопутствующие заболевания.
Способы введения в организм
Чаще всего химиопрепараты вводят внутривенно или перорально (от латинского per os — «через рот»). Но существуют и другие пути введения:
- Подкожные и внутримышечные инъекции.
- Интратекально — в спинномозговую жидкость.
- Внутрибрюшинно — в брюшную полостью. При канцероматозе брюшины применяется современная методика HIPEC (гипертермическая интраперитонеальная химиотерапия), когда после удаления из брюшной полости всех крупных очагов её промывают подогретым раствором химиопрепарата, чтобы уничтожить оставшиеся мелкие очаги.
- Внутриплеврально — в плевральную полость, окружающую легкие.
- Внутриартериальная химиотерапия — непосредственно в артерию, питающую опухоль. При этом можно использовать высокие дозы химиопрепаратов: они почти не проникают в системный кровоток и не вызывают серьезных побочных эффектов.
- Введение в мочевой пузырь с помощью катетера.
Когда больному требуется лечение в течение длительного времени, в «Евроонко» применяют имплантируемые венозные порт-системы. Под кожу подшивают небольшой резервуар, одна из стенок которого представлена специальной мембраной, и соединяют его катетером с веной. В дальнейшем лекарства вводят с помощью иглы, которой прокалывают кожу и находящуюся под ней мембрану.
Эффективность препаратов, применяемых при химиотерапии
Для того чтобы судить об эффективности химиотерапии, обычно нужно провести не менее 2-3 циклов лечения. Затем выполняют исследования, которые помогают визуализировать и измерить опухоль, проводят анализы на онкомаркеры. Возможен один из четырех результатов:
- Полный ответ. Опухоль исчезла, уровень онкомаркера снизился и находится в пределах нормы.
- Частичный ответ. Опухоль уменьшилась, уровень онкомаркера при этом также может снизиться.
- Стабильное состояние: размеры и количество опухолей, уровень онкомаркера не изменились.
- Прогрессирование на фоне лечения: опухоль продолжает расти, появляются новые очаги, уровень онкомаркера повышается.
Если лечение эффективно, его продолжают по прежней схеме. В противном случае комбинации химиопрепаратов нужно менять.
Побочные эффекты применения химиопрепаратов
Химиотерапия вызывает различные побочные эффекты. Симптомы могут возникать спустя некоторое время после начала лечения и даже по завершении курса. Одни из них быстро проходят, другие сохраняются в течение длительного времени. Степень их выраженности тоже бывает разной, это зависит от многих факторов, таких как возраст, состояние здоровья пациента, тип, доза и способ введения химиопрепарата, параллельный прием других лекарств.
Вы можете подробно узнать о возможных побочных эффектах химиопрепаратов на этой странице.
Что такое персонализированная химиотерапия?
За последние годы подходы к классификации злокачественных опухолей несколько изменились. Раньше ученые могли лишь рассматривать раковые клетки под микроскопом, сейчас появилась возможность изучать их молекулярно-генетические характеристики. Клетки могут выглядеть одинаково, но иметь разный набор изменений в генах. В них вырабатываются разные вещества, которые по-разному помогают им выживать, размножаться, защищаться от агрессии иммунитета.
Если рассматривать рак на молекулярно-генетическом уровне, то окажется, что двух одинаковых опухолей практически не существует. Каждый пациент индивидуален, каждому нужен свой подход при выборе комбинации химиопрепаратов. Такое лечение называется персонализированным. Оно наиболее эффективно, так как в нем реализован важнейший принцип медицины: «лечить не болезнь, а больного».
Сейчас молекулярно-генетические исследования, которые помогают назначить персонализированную химиотерапию, доступны далеко не в каждой клинике. Но за ними — будущее онкологии.
Таргетная терапия и иммунотерапия: «усовершенствованные» химиопрепараты
Возможность изучать молекулярно-генетические характеристики рака привела к появлению относительно новой группы противоопухолевых средств — таргетных препаратов. Эти «снайперы» действуют на конкретные молекулы, которые необходимы злокачественным опухолям для роста, выживания, защиты от иммунитета. В отличие от классических химиопрепаратов, таргетные препараты не действуют на здоровые клетки, реже вызывают тяжелые побочные эффекты.
Большие надежды современные ученые и врачи-онкологи возлагают на иммунопрепараты. Эти лекарственные средства используют возможности иммунной системы, чтобы уничтожать раковые клетки.
Развитие онкологии не останавливается. Ученые продолжают работать над созданием новых противоопухолевых препаратов. Некоторые лекарства сейчас проходят клинические испытания. К сожалению, создание и проверка новых препаратов — процесс долгий и недешевый. Тем не менее, прогресс есть, а значит, есть и надежда для онкологических больных.
Препараты для восстановления после химиотерапии
Как мы уже упоминали, химиопрепараты атакуют не только опухолевые, но и здоровые клетки. После курса лечения в той или иной степени могут пострадать разные органы. Это неизбежное зло, с которым приходится мириться, чтобы уничтожить раковые клетки.
Для более быстрого и полноценного восстановления после химиотерапии каждый пациент получает индивидуальную программу лечения. В первую очередь усилия направлены на восстановление состава крови, нормализацию работы печени, почек, сердца, борьбу с депрессией и другими психоэмоциональными проблемами.
Выбор препаратов для восстановительного лечения после химиотерапии довольно большой. Важно не забывать и о таких «скучных» мерах, как правильный образ жизни, питание, полноценный сон и отдых, физическая активность. БАДы тоже могут быть полезны, но если вы решили принимать их, сначала нужно проконсультироваться с лечащим врачом.
Осложнения после химиотерапии
Осложнения после химиотерапии в той или иной комбинации симптомов разной выраженности обязательны при каждом цикле, поэтому клинические исследования учитывают эффективность химиопрепарата, спектр и частоту встречаемости побочных реакций. При противоопухолевой терапии невозможен баланс между результативностью и токсичностью, что обусловлено неизбирательным действием лекарств.
Виды осложнений после химиотерапии
Химиотерапия (ХТ) вредит каждой клетке организма, только прошедшие полноценный этап развития здоровые клетки более устойчивы к цитостатикам. Злокачественные клетки растут быстрее, пренебрегая собственной структурой, их главная задача — стремительность размножения. Первый контакт злокачественной опухоли с противораковым лекарством смертелен для её клеток, но дальше создается система защиты от ХТ, что позволяет ей выживать и захватывать новые области.
Не устойчивы к химиотерапии и быстро созревающие нормальные клетки, как лейкоциты и тромбоциты, половые и формирующие слизистые покровы, потому что их популяции не запрограммированы на длительное существование.
По механизму развития осложнения после химиотерапии подразделяются на 4 больших группы:
- обусловленные действием препарата, включая местное повреждение и системные специфичные для определенного цитостатика и характерные для всех лекарств эффекты. Пример местной реакции — цистит после иринотекана, системного специфического повреждения — пневмотит после блеомицина, неспецифического — лейкопения;
- обусловленные нарушениями иммунитета, в том числе аллергические и аутоиммунные процессы. Например, на таксаны развивается системная аллергия вплоть до анафилаксии, общее снижение иммунной защиты проявляется легкостью развития воспалительных заболеваний и активацией вируса герпеса;
- непереносимость ХТ, так отсутствие клеточного фермента приводит к необыкновенно высокой токсичности фторурацила;
- неблагоприятное взаимодействие лекарств особенно ярко проявляется при комбинированной ХТ, так таксаны с цисплатиной вдвойне вредят нервной системе.
Осложнения возникают в разное время:
- острые — во время введения цитостатика и в первые сутки после ХТ;
- ближайшие случаются на вторые сутки после цикла;
- отсроченные развиваются после 7 суток;
- отдаленные — минимально через месяц и могут появиться через годы.
Со стороны пищеварительной системы
Побочные эффекты со стороны слизистых оболочек составили химиотерапии плохую славу:
- тошнота и рвота в ближайшее время;
- отсроченные мукозиты — отсроченное разрушение слизистых ротовой полости (стоматит), пищевода (эзофагит), желудка (гастрит), тонкой кишки (энтерит), толстого кишечника (колит) и прямой кишки (ректит);
- гепатотоксичность появится в отдалённый период, после нескольких курсов терапии.
Тошноту, а особенно рвоту, можно предотвратить и уменьшить. Мукозит разнообразен по выраженности и локализации, начинается с воспаления и отека, дальше формируются участки омертвения от микроскопических до видимых. При стоматите невозможно ни пить, ни есть, эзофагит и гастрит проявляется изжогой, поражение кишки — нарушениями стула, всегда беспокоит боль, подташнивание и анорексия.
Токсическое поражение печени формируется исподволь, когда изменяется только биохимия крови, печеночная ткань сама не болит, боль вызывается растяжением капсулы при увеличении печени. В тяжелых случаях возможна желтуха с температурой и интоксикацией, но самое опасное — печеночная недостаточность острая или через несколько лет в результате фиброза печени.

Со стороны иммунной системы
Действие ХТ на иммунитет чаще всего проявляется легкостью инфицирования, когда после курса «цепляются» бесконечные простуды, активизируются безвредно живущие на слизистых оболочках грибы, приводя к затяжной молочнице. Крайний случай иммунной супрессии — пневмония.
Иммунотерапия моноклональными антителами избыточно активирует систему защиты, приводя к аутоиммунным проявлениям. Иммуноопосредованная токсичность охватывает несколько систем органов, проявляясь аутоиммунным гепатитом, пульмонитом, поражениями кожи и сосудов, как правило, с интоксикацией, температурой и ухудшением состояния.
Со стороны кровеносной системы
Особенность большинства химиопрепаратов — раздражение слизистой кровеносных сосудов, которую снижают изменением технологии внутривенного введения. В большей мере от цитостатиков страдают вены верхних конечностей, получающие контактный химический ожог.
Некоторые лекарства приходится вводить либо очень быстро — болюсом, другие, наоборот, очень медленно капельно, затрачивая на одно введение от пары часов до нескольких суток. Клинически повреждение сосудов проявляется флебитами: болью и внутренним воспалением, отеком и покраснением кожи над сосудом. Воспаленная слизистая утолщается, замедление тока крови приводит к тромбозу. После неоднократного введения цитостатика просвет вены сужается и может полностью облитерироваться.
Особый вид осложнения химиотерапии экстравазация — разрыв сосуда с выходом химиопрепарата в окружающие ткани. Это происходит не из-за неловкости медсестры, расслаивается хрупкая сосудистая стенка, неоднократно пережившая ожог цитостатиком.
Со стороны опорно-двигательного аппарата
Скелет страдает от длительной гормональной терапии, для бисфосфонатов специфичен некроз нижней челюсти. Химиотерапия повреждает слизистую суставов, аналогично мукозиту, что проявляется воспалением с отеком, болью и ограничением движений. Иммунные и таргетные препараты приводят к аутоиммунным артритам.
Поражение цитостатиками мышечного скелета опосредовано нейротоксичностью, когда мышечные судороги и боль вызываются повреждением нервов, но не самой мышечной ткани.
Со стороны нервной системы
Нейротоксичность противоопухолевой терапии заслуживает отдельного разговора. Побочный эффект присущ нескольким группам цитостатиков и проявляется повреждением периферических нервов и нечасто — головного и спинного мозга. В подавляющем большинстве нарушается чувствительность, движения страдают реже.
Определены критичные дозы лекарств, сопряженные с развитием нейротоксичности, время развития повреждения вариабельно, может появиться и через несколько месяцев после завершения лечения. Особенность — в продолжительности клинических симптомов, у некоторых пациентов полного восстановление не случается.
Органы-мишени
Некоторые препараты имеют сродство к определенным клеткам. С одной стороны, это полезное таргетное свойство, позволяющее целенаправленное убийство злокачественных клеток. В схемы терапии плоскоклеточного рака кожи включают накапливающийся в эпителии блеомицетин, но скопления метаболитов лекарства в легочном эпителии приводит к «блеомициновому легкому» с затяжной пневмонией и легочной недостаточностью.
Другой пример органа-мишени для цитостатика — повреждение почечных канальцев цисплатиной, приводящее к развитию почечной недостаточности. Аналогично работают и антрациклины, избирательно повреждающие клетки миокарда.
Орган-мишень для иммуно-онкологических препаратов — лимфоциты, их активация помогает бороться с меланомой и раком легкого, но с другой стороны они вызывают специфические иммунологические побочные эффекты, описанные выше.

Внешность
Все цитостатики «портят» не только слизистые, но и кожу, делая её бледной и вялой. Страдают придатки кожи — волосы и ногти, они плохо растут, тусклые и расслаивающиеся. Волосы выпадают и истончаются.
Большинство препаратов не вызывает тотального облысения — алопеции, но частичная алопеция с пушащимися от внутренней слабости волосками и гнездами проплешин травмирует женщину не меньше полностью лысой головы. Впоследствии волосы изменяют цвет и структуру — утолщаются и завиваются.
Иммуно-онкологические препараты вызывают специфическое воспаление кожи с последующим обильным шелушением стоп и ладоней или распространенными прыщами — акне. Все проявления уходят без следа — шрамов не остается, но до полного восстановления проходит несколько месяцев моральных страданий.
Самочувствие после химиотерапии
Самочувствие после химиотерапии зависит не только от использованной комбинации лекарств и их доз, но и от исходного состояния здоровья, пола — у женщин осложнений больше, и психологических особенностей. Однозначно, что после цикла самочувствие хуже, чем до него.
Все циклы переносятся по-разному, и побочные реакции после первой химиотерапии не похожи на токсичность последующих циклов. Негативные проявления со стороны крови, сердечной мышцы, почек и нервной системы могут усугубиться. Мукозит, наоборот, протекает легче, потому что уже погибли самые чувствительные пласты слизистых клеток и вместо них образовалась прочная рубцовая ткань.
Самочувствие можно улучшить, ускорить восстановление тканей тоже возможно, при будущем курсе часть побочных реакций удается перевести в легкую степень или серьёзно нивелировать, как это умеют делать в нашей клинике.
Степени осложнений
Побочные эффекты по выраженности классифицируют так:
Для каждого цитостатика в процентах рассчитана токсичность 3-4 степени, но использование комбинаций лекарств может привести к внеплановым последствиям.
Сколько времени длятся побочные эффекты?
Продолжительность токсических явлений зависит от скорости восстановления поврежденной ткани, стандартное время — 21 день, за этот срок полностью восстанавливается кишечная слизистая и костный мозг. Для восстановления лейкоцитов и тромбоцитов достаточно недели, эритроциты потребуют более 4 месяцев.
Мукозиты могут растянуться на пару недель, но уже к концу первой недели симптоматика уменьшается.
Восстановление печени и почек, нервной системы может занять до года без каких-либо гарантий на 100% репарацию.
Волосы начинают расти к началу следующего цикла, ногти полностью сменяться через полгода.
Обследование после химиотерапии
Диагностика осложнений химиотерапии осуществляется при осмотре и по анализу крови — биохимическому и клиническому с лейкоцитами и тромбоцитами.
Анализ крови покажет истинную степень угнетения кроветворения, поэтому его сдают часто, после восстановления показателей достаточно сделать перед следующим циклом.
Мукозит потребует дополнительного обследования только при 3-4 степени. Поражение печени и почек первоначально обнаруживают по биохимии крови.
При симптомах неблагополучия со стороны сердечно-сосудистой системы необходимо безотлагательное обследование с ЭКГ, эхокардиографией и специфическими кардиальными маркерами в крови.
Что делать после химиотерапии?
После окончания химиотерапии надо жить дальше, не замыкаясь в болезни и не погружаясь в прошедшие переживания. Дальнейшее наблюдение, возможно, потребует физической и психологической реабилитации.
Активный отдых — хорошее продолжение восстановления после химиотерапии, можно вернуться на работу, главное —уйти от неприятных воспоминаний тягот лечения.
В нашей клинике каждому пациенту составляется индивидуальный план наблюдения с графиком обследований, о которых пациента известят звонком, предлагая удобное время визита. Наблюдение после лечения злокачественного заболевания — наша забота, пациент должен жить дальше без лишних проблем.
Лечение осложнений
Лечение осложнений в традиционном плане не всегда возможно. Хорошо контролируется рвота, лекарства отлично справляются с лейкопенией, при высокой вероятности 3-4 степени угнетения белого ростка крови и до появления лейкопении — заблаговременно начинается введение колониестимулирующих факторов.
Нет специфических препаратов для купирования нейротоксичности химиотерапии, поэтому актуальна потребность в физиотерапии и разнообразных методиках нейрореабилитации.
При осложнениях со стороны органов ЖКТ, преимущественно слизистых и печени, возможно только симптоматическое лечение, поэтому так важен профессионализм врачебной команды и возможности клиники в организации интенсивной терапии и проведении вспомогательного восстановительного лечения, подборе адекватного питания.
Беременность после химиотерапии
Цитостатическая терапия не способствует репродукции и во время лечения беременность практически исключается. Немногочисленные исследования показали неопасность беременности для излечившихся от злокачественной опухоли, но ремиссия рака не совсем подходящее время для продолжения рода. После завершения химиотерапии беременность должна быть не только плановой, но и продуманной, следует помнить, что рак — хроническое заболевание, о полном излечении можно говорить по прошествии десятилетия.
Прием тамоксифена может поспособствовать неплановой беременности, поэтому молодым женщинам рекомендуется контрацепция. Адекватный способ предохранения предложит гинеколог, специализирующийся на онкологической патологии.
Секс после химиотерапии
Никаких препятствий для сексуальных отношений не существует, если купированы токсические реакции химиотерапии. При молочнице и других неблагоприятных симптомах со стороны слизистой оболочки половых путей — наследии противоопухолевого лечения у женщины, о перспективах возвращения к половой жизни необходимо посоветоваться с гинекологом.
Химиотерапия неблагоприятно сказывается на потенции, но с течением времени эректильная дисфункция должна пройти, но лучше обсудить проблемы с андрологом-урологом, сегодня выпускается достаточно средств для купирования временных проблем интимной жизни.

Месячные после химиотерапии
Средний срок восстановления менструального цикла после завершения последнего цикла химиотерапии — 6 месяцев, но до первых месячных может пройти и существенно меньший срок, всё зависит от гормонального возраста женщины. У входящей в климактерический период женщины лекарственная аменорея может плавно перетечь в постменопаузу без менопаузы — последней менструации.
Продолжительность жизни после химиотерапии
Продолжительность жизни онкологического больного определяется течением злокачественного процесса. Несмотря на устойчивый миф о высокой частоте смертности «от химиотерапии», от токсичности погибает ничтожно малое число пациентов — тысячные доли процента. Подавляющее большинство онкобольных умирает от прогрессирования заболевания, когда объем опухолевых масс уже не совмещается с продолжением человеческой жизни.
Наблюдательные исследования доказали большую частоту сердечно-сосудистых болезней и вероятность развития вторых злокачественных процессов через несколько десятилетий после лечения рака, но пока нет доказательств, что противоопухолевая терапия сокращает жизнь излечившихся от первичного злокачественного процесса.
Инвалидность после химиотерапии
Получение инвалидности после завершения радикального лечения злокачественного заболевания не обязательная опция. Инвалидность, как и пребывание на больничном, свидетельство нетрудоспособности, только более продолжительной.
Надо понимать, что инвалидность дается не на всю оставшуюся жизнь, а только на время сложной терапии и последующего восстановления. Группу без права работы могут дать на год, её снимут через год-два при отсутствии рецидива заболевания, либо присвоят «рабочую» 3-ю группу.
Если пациенту до достижения пенсионного возраста осталось менее 2 лет, можно претендовать на досрочную и пожизненную пенсию по инвалидности. Более молодым приходится возвращаться к трудовой деятельности, что очень непросто в статусе «бывшего» инвалида. Перед освидетельствованием на группу инвалидности следует основательно подумать — стоит ли это делать.
Профилактика осложнений после химиотерапии
Вероятность осложнений заложена в саму суть химиотерапии, часть побочных реакций можно ослабить, но невозможно предотвратить токсичность на 100%. В практической онкологии предупреждают рвоту и лейкопению, специфическая профилактика остальных неблагоприятных последствий не разработана. Онкологическая наука предлагает активно следить за состоянием и анализами, и при малейших неблагоприятных сдвигах начинать помогать организму пациента справляться с наименьшими потерями для здоровья.
Профессионализм химиотерапевта и лечебно-диагностические возможности клиники позволяют поддерживать защитные силы организма до начала цикла и во время него. В нашей Клинике не только проводят мониторинг показателей и самочувствия, но предлагают специальную нутритивную поддержку, разнообразные восстановительные процедуры и методики купирования токсичности.
Читайте также:
