Возбудимость сердечной мышцы. Потенциал действия миокарда. Сокращение миокарда.
Добавил пользователь Дмитрий К. Обновлено: 22.01.2026
Мембранный потенциал (МП) рабочего кардиомиоцита в покое -90мв, что заметно выше потенциала покоя (ПП) скелетной мышечной клетки (-70 мв). В связи с этим понятно, что возбудимость миокарда ниже возбудимости скелетной мышцы. Более низкая возбудимость позволяет миокарду не реагировать на несущественные раздражители, которые могли бы нарушить режим одиночного сокращения. Рассмотрим особенности потенциала действия (ПД) рабочего кардиомиоцита желудочков, который развивается после прихода импульса возбуждения от волокон Пуркинье или через вставочные диски от соседних кардиомиоцитов.
Рис. 3. Потенциал действия клетки рабочего миокарда желудочков
Быстрое развитие деполяризации (0) и продолжительная реполяризация (1, 2, 3). Замедленная реполяризация - 2 (плато) переходит в быструю реполяризацию - 3.
Вопросы для самоконтроля
1. Какова амплитуда и длительность ПД кардиомиоцитов?
2. В чём особенности протекания фазы реполяризации?
3. Чем объяснить возникновение периода "плато" во время реполяризации?
Физиология сердца Свойства сердечной мышцы
Сердечная мышца обладает следующими свойствами: 1)автоматией —способностью сердца ритмически сокращаться под влиянием импульсов, возникающих в нем самом; 2)возбудимостью —способностью сердца приходить в состояние возбуждения под действием раздражителя; 3)проводимостью —способностью сердечной мышцы проводить возбуждение; 4)сократимостью —способностью изменять свою форму и величину под действием раздражителя, а также растягивающей силы или крови.
Автоматия
Субстратом автоматии в сердце является специфическая щечная ткань, илипроводящая система сердца,которая состоит изсинусно-предсердного(синоатриального)(СА) узла,расположенного в стенке правого предсердия у места впадения в него верхней полой вены,предсердно-желудочкового(атриовентрикулярного)узла,расположенного в межпредсердной перегородке на границе предсердий и желудочков. От атриовентрикулярного узла начинается пучокГиса.Пройдя в толщу межжелудочковой перегородки, он делится на правую и левую ножки, заканчивающиеся конечными разветвлениями —волокнами Пуркинье.Верхушка сердца не обладает автоматией, а лишь сократимостью, так как в ней отсутствуют элементы проводящей системы сердца.
В нормальных условиях водителем ритма, или пейсмекером, является синоатриальный узел. Частота разрядов синоатриального узла в покое составляет 70в 1минуту. Атриовентрикулярный узел —это водитель ритма второго порядка с частотой 40 — 50в 1 минуту. Он берет на себя роль водителя ритма, если по каким-либо причинам возбуждение от СА не может перейти на предсердия при атриовентрикулярной блокаде или при нарушении проводящей системы желудочков. Если поражены все основные водители ритма, то очень редкие импульсы (20имп/с) могут возникать в волокнах Пуркинье —это водитель ритма 3-го порядка.
Следовательно, существует градиент автоматии сердца,согласно которому степень автоматии тем выше, чем ближе расположен данный участок проводящей системы к синусному узлу.
Электрическая активность клеток миокарда и проводящей системы сердца
Потенциал действия кардиомиоцитов начинается с быстрой риверсии мембранного потенциала, составляющего -90мВ и создаваемого за счет К + -потенциала, до пика ПД (+30мВ) (рис.11). Этофаза быстрой деполяризации,обусловленная коротким значительным повышением проницаемости дляNa' 1 ", который лавинообразно устремляется в клетку. Фаза быстрой деполяризации очень короткая и составляет всего 1—2мс. Начальный входNа + быстро инактивируется, однако деполяризация мембраны продолжается за счет активации медленных натрий-кальциевых каналов, а вход Са 2+ приводит к развитиюплато ПД —это специфическая особенность клеток миокарда. В этот период быстрые натриевые каналы инактивируются и клетка становится абсолютно невозбудима. Этофаза абсолютной рефрактерности.Одновременно происходит активация калиевых каналов, а выходящие из клетки ионы К + создаютфазу быстрой реполяризации мембраны.
Ускорение процесса реполяризации происходит за счет закрытия кальциевых каналов. В конце периода реполяризации постепенно закрываются калиевые каналы и реактивируются натриевые. Это приводит к восстановлению возбудимости кардиомиоцита и возникновению относительной рефракторной фазы. Длительность ПД кардиомиоцита составляет 200 — 400мс.
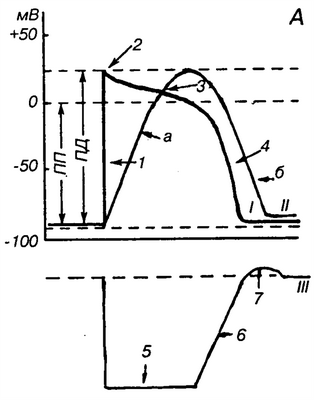
Р 11. Схемы потенциалов действия различных отделов сердца, кривой сокращения и фаз возбудимости сердечной мышцы: А —схема потенциала действия клетки миокарда (/),кривой сокращения (II)и фаз возбудимости (III) сердечной мышцы; 1 —потенциал действия клетки миокарда: / —быстрая деполяризация; 2 —пик, 3 —плато, 4 —быстрая ре поляризация;II —кривая сокращения: а —фаза сокращения,б —фаза расслабления;III —кривая возбудимости: 5 —абсолютная рефракторная фаза, б —относительная рефракторная фаза, 7 —фаза супернормальной возбудимости;Б —схема потенциала действия клетки пейсмекера (синоаурикулярного узла): МДП —максимальный диастолический потенциал; МДД —медленная диастолическая деполяризация
Калий-натриевый насос, создающий потенциал покоя или мембранный потенциал миокардиоцита, может быть инактивирован под действием сердечных гликозидов (препараты наперстянки, строфантина), которые приводят также к повышению внутриклеточной концентрации Na + , снижению интенсивности обмена внутриклеточногоCa 2+ на внеклеточныйNа + , накоплению Ca 2+ в клетке. В результате сократимость миокарда становится больше. Ее можно увеличить и за счет повышения внеклеточной концентрации Са 2+ и с помощью веществ (адреналин, норадреналин),ускоряющих вход Са 2+ во время ПД. Если удалить Са 2+ из внешней среды или заблокировать вход Ca 2+ во время ПД с помощью таких веществ —антагонистов кальция, как верапамил, нифедипин и др., то сократимость сердца уменьшается.
Клетки проводящей системы сердца и, в частности, клетки пейсмекера, обладающие автоматией, в отличие от клеток рабочего миокарда-кардиомиоцитов могут спонтанно деполяризоваться до критического уровня. В таких клетках за фазой реполяризации следует фаза медленной диастолической деполяризации. (МДД),которая приводит к снижению МП до порогового уровня и возникновению ПД. МДД —это местное, нераспространяющееся возбуждение, в отличие от ПД, который является
Таким образом, пейсмекерные клетки отличаются от кардиомиоцитов: 1)низким уровнем МП —около 50—70мВ, 2)наличием МДД, 3)близкой к пикообразному потенциалу формой ПД,4)низкой амплитудой ПД — 30-50мВ без явления риверсии (овершута).
Особенности электрической активности пейсмекерных клеток обусловлены целым рядом процессов, происходящих на их мембране. Во-первых, эти клетки даже в условиях «покоя» имеют повышенную проницаемость для ионов Na + , что приводит к снижению МП. Во-вторых, в период реполяризации на мембране открываются только медленные натрий-кальциевые каналы, так как быстрые натриевые каналы из-за низкого МП уже инактивирова-ны. В клетках синоатриального узла в период реполяризации быстро инактивируются открытые калиевые каналы, но повышается натриевая проницаемость, на фоне которой и возникает МДД, а затем и ПД. Потенциал действия синоатриального узла распространяется на все остальные отделы проводящей системы сердца.
Таким образом, синоатриальный узел навязывает всем «ведомым» отделам проводящей системы свой ритм. Если возбуждение не поступает от главного пейсмекера, то «латентные» водители ритма, т.е. клетки сердца, обладающие автоматией, берут на себя функцию нового пейсмекера, в них также зарождается МДД и ПД, а сердце продолжает свою работу.
1.1.1.2. Физиологические свойства сердечной мышцы.
1. Возбудимость. Уровень возбудимости сердечной мышцы в различные фазы кардиоцикла меняется. Раздражение сердечной мышцы в фазу ее сокращения (систолу) не вызывает нового сокращения, даже при действии сверхпорогового раздражителя. В этот период сердечная мышца находится в фазе абсолютной рефрактерности, ее длительность составляет 0,27 с.
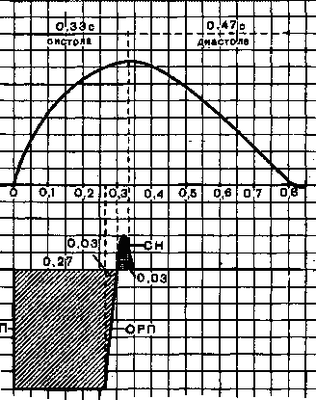
В конце систолы и начале диастолы (расслабления сердечной мышцы) возбудимость начинает восстанавливаться до исходного уровня - фаза относительной рефрактерности (0,03 с). За фазой относительной рефрактерности следует фаза экзальтации (0,05 с), после которой возбудимость сердечной мышцы окончательно возвращается к исходному уровню (рис. 1). Следовательно, особенностью возбудимости сердечной мышцы является длительный период рефрактерности (0,3 с).
Рис.1. Соотношение кривой одиночного сокращения (А) и фаз возбудимости сердечной мышцы (Б).
АРП - фаза абсолютной рефрактерности; ОРП - фаза относительной рефрактерности; СН - фаза экзальтации. Цифрами обозначена длительность фаз сердечного цикла и возбудимости.
Фазы возбудимости сердечной мышцы определяются фазами одиночного цикла возбуждения. Мембранный потенциал покоя кардиомиоцитов имеет величину 90 мВ и формируется в основном ионами калия. Потенциал действия миокарда желудочков имеет следующие фазы (рис. 2).
Рис. 2. Потенциал действия одиночной клетки миокарда желудочка: 1 - быстрая деполяризация; 2 - начальная быстрая реполяризация; 3 - медленная реполяризация (плато); 4 - конечная быстрая реполяризация.
Стрелками показаны преобладающие потоки ионов, ответственных за формирование различных фаз потенциала действия.
1 фаза - (быстрая деполяризация) обусловлена последовательным открытием быстрых натриевых и медленных натрий-кальциевых каналов. Быстрые натриевые каналы открываются при деполяризации мебраны до уровня -70 мВ, закрываются при деполяризации мембраны до -40 мВ. Натрий-кальциевые каналы открываются при деполяризации мембраны до -40 мВ и закрываются при исчезновении поляризации мембраны. За счет открытия этих каналов происходит реверсия потенциала мембраны до + 30-40 мВ.
2 фаза - (начальная быстрая реполяризация) обусловлена повышением проницаемости мембраны для ионов хлора.
3 фаза - (медленная реполяризация или плато) обусловлена взаимодействием двух ионных токов: медленного натрий-кальциевого (деполяризующего) и медленного калиевого (реполяризующего) через специальные медленные калиевые каналы (каналы аномального выпрямления).
4 фаза - (конечная быстрая реполяризация). Эта фаза обусловлена закрытием кальциевых каналов и активацией быстрых калиевых каналов.
Ионные каналы мембраны кардиомиоцита представлены потенциал - зависимыми белками, поэтому их активация (открытие) и инактивация (закрытие) обусловливаются определенной величиной поляризации мембраны (величиной трансмембранного потенциала).
Раздражение сердца во время диастолы вызывает внеочередное сокращение - экстрасистолу. Различают синусовую, предсердную и желудочковую экстрасистолы. Желудочковая экстрасистола отличается тем, что за ней всегда следует более продолжительная, чем обычно, пауза, называемая компенсаторной (рис. 3). Она возникает в результате выпадения очередного нормального сокращения, т.к. импульс возбуждения, возникший в сино-атриальном узле, поступает к миокарду желудочков, когда они еще находятся в состоянии рефрактерности, возникшей в период экстрасистолического сокращения. При синусовых и предсердных экстрасистолах компенсаторная пауза отсутствует.
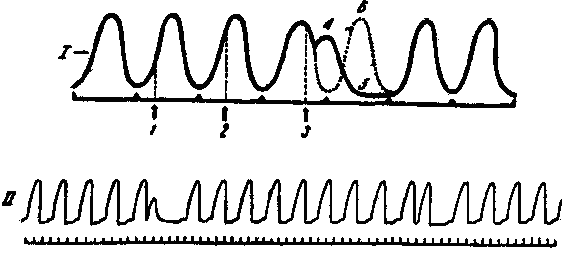
Рис. 3. Экстрасистола и компенсаторная пауза.
I - момент поступления имульсов из сино-атриального узла; 1, 2, 3 - моменты нанесения экстрараздражений; 4 - экстрасистола; 5 - компенсаторная пауза; 6 - выпавшее очередное сокращение (обозначено пунктиром).
II - кардиограмма лягушки с экстрасистолами.
2. Сократимость. Сердечная мышца реагирует на раздражители нарастающей силы по закону "все или ничего". Это обусловлено ее морфологическими особенностями. Между отдельными мышечными клетками сердечной мышцы имеются так называемые вставочные диски, или участки плотных контактов - нексусы, образованные участками плазматических мембран двух соседних миокардиальных клеток. В некоторых участках плазматические мембраны, образующие контакт, прилегают друг к другу так близко, что кажутся слившимися. Мембраны на уровне вставочных дисков обладают очень низким электрическим сопротивлением, и возбуждение распространяется от волокна к волокну беспрепятственно, охватывая миокард целиком. Поэтому сердечную мышцу, состоящую из морфологически разъединенных, но функционально объединенных мышечных волокон, принято считать функциональным синцитием.
Сердечная мышца сокращается по типу одиночного сокращения, т. к. длительная фаза рефрактерности препятствует возникновению тетанических сокращений. В одиночном сокращении сердечной мышцы выделяют: латентный период, фазу укорочения (систолу), фазу расслабления (диастолу).
Способность сердечной мышцы сокращаться только по тину одиночного сокращения обеспечивает выполнение сердцем основной гемодинамической функции - насоса. Сокращения сердца по типу тетануса делали бы невозможным ритмическое нагнетание крови в кровеносные сосуды. Именно это и происходит при фибрилляции волокон миокарда и мерцательной аритмии сердца.
Серию последовательных явлений в клетке миокарда, начинающихся с пускового механизма сокращения - потенциала действия (ПД) и завершающихся укорочением миофибрилл, называют сопряжением возбуждения и сокращения. При распространении ПД по мембране ионы кальция поступают к сократительным белкам, в основном, из межклеточного пространства и вызывают те же процессы взаимодействия актиновых и миозиновых протофибрилл, что и в скелетном мышечном волокне. Расслабление кардиомиоцита также обусловлено удалением кальция кальциевым насосом из протофибриллярного пространства в межклеточную среду.
Важным процессом в сокращении кардиомиоцита является вход ионов кальция в клетку во время ПД. Наряду с тем, что входящий в клетку кальций увеличивает длительность ПД и, как следствие, продолжительность рефракторного периода, он является важнейшим фактором в регуляции силы сокращения сердечной мышцы.
Так, удаление ионов кальция из межклеточных пространств приводит к полному разобщению процессов возбуждения и сокращения - потенциал действия остается практически в неизменном виде, а сокращения кардиомиоцита не происходит.
4. Автоматизм. Сердечная мышца обладает автоматизмом - способностью возбуждаться без видимых причин, т. е. как бы самопроизвольно. Изучение автоматизма сердечной мышцы проводилось в двух направлениях:
• поиск субстрата автоматизма, т. е. тех структур, которые реализуют это свойство;
• изучение природы автоматизма, т. е. механизмов, лежащих в его основе.
По вопросу о субстрате автоматизма существовало две группы теорий:
• нейрогенная - субстратом автоматизма является нервная ткань;
• миогенная - сама сердечная мышца.
К настоящему времени установлено, что выраженной способностью к автоматии обладают мало дифференцированные атипические мышечные волокна, которые образуют так называемую проводящую систему сердца. Проводящая система включает в себя главные узлы автоматизма: сино-атриальный, расположенный в стенке правого предсердия между местом впадения верхней полой вены и правым ушком; атрио-вентрикулярный узел, расположенный в межпредсердной перегородке на границе предсердий и желудочков. В состав проводящей системы сердца входит также пучок Гиса, который начинается от атрио-вентрикулярного узла, затем разделяется на правую и левую ножки, идущие к желудочкам. Ножки пучка Гиса разделяются на более тонкие проводящие пути, заканчивающиеся волокнами Пуркинье, которые контактируют с клетками сократительного миокарда.
Способность к автоматизму различных отделов проводящей системы сердца изучалась Станниусом путем последовательного наложения лигатур на сердце. Было установлено, что в обычных условиях генератором возбуждения в сердце является сино-атриальный узел - водитель ритма (пейсмекер) I порядка. Атрио-вентрикулярный узел является водителем ритма сердца II порядка, т. к. его способность к автоматизму примерно в 2 раза меньше, чем у сино-атриального узла. Автоматизм волокон пучка Гиса еще меньше и, наконец, волокна Пуркинье обладают наименьшей способностью к автоматии. Следовательно, существует градиент автоматизма - уменьшение способности к автоматизму различных отделов проводящей системы сердца по мере их удаления от сино-атриального узла к верхушке сердца.
Природу автоматизма пытались объяснить воздействием на клетки проводящей системы сердца эндогенных и экзогенных факторов, отсюда и теории - эндогенная и экзогенная. Эндогенные факторы возникают в самом сердце:
• накопление какого-то вещества (например, ацетилхолина, молочной и угольной кислот и др.);
• изменение электрического поля сердца во время диастолы и др.
Экзогенные факторы автоматизма находятся за пределами сердца или поступают к нему извне с током крови и могут иметь также самую разнообразную природу.
Физиологической основой автоматизма сердечной мышцы является низкая скорость ее аккомодации: при действии постепенно нарастающего по силе раздражителя порог возбудимости у сердечной мышцы почти не изменяется. Микроэлектродные исследования показали, что в клетках рабочего миокарда предсердий и желудочков мембранный потенциал покоя в интервалах между возбуждениями поддерживается на постоянном уровне. В клетках же сино-атриального узла мембранный потенциал покоя нестабилен - в период диастолы происходит постепенное его уменьшение, которое называется медленной диастолической деполяризацией (МДД). Она является начальным компонентом потенциала действия пейсмекерных клеток. При достижении МДД критического уровня деполяризации возникает потенциал действия пейсмекерной клетки, который затем распространяется по проводящей системе к миокарду предсердий и желудочков. После окончания потенциала действия вновь развивается МДД (рис. 4).
Рис. 4. Потенциал действия клеток сино-атриального узла. Стрелками показана МДД.
Ионный механизм МДД состоит в том, что во время реполяризации клеточная мембрана сохраняет относительно высокую натриевую проницаемость. В результате проникновения внутрь клетки ионов натрия и уменьшения скорости выхода из клетки ионов калия возникает МДД. Уменьшение потенциала покоя до -40 мВ приводит к открытию медленных натрий-кальциевых каналов, что приводит к возникновению быстрой деполяризации. Реполяризация обеспечивается открытием калиевых каналов. В отличие от клеток водителей ритма рабочие клетки миокарда в состоянии покоя характеризуются очень низкой проницаемостью для ионов натрия, поэтому сдвигов мембранного потенциала в них не возникает.
Как видно из рис. 4, форма потенциала действия пейсмекерной клетки сино-атриального узла отличается от формы потенциала действия сократительных кардиомиоцитов. Во-первых, для пейсмекерных клеток характерно наличие МДД. Во-вторых, МДД медленно, плавно (особенно у клеток сино-атриального узла) переходит в фазу быстрой деполяризации. В-третьих, у ПД пейсмекерных клеток нет плато реполяризации. В-четвертых, у пейсмекерных клеток отсутствует овершут (потенциал превышения). В-пятых, МПП у пейсмекерных клеток значительно ниже (-55-60 мВ), чем МПП сократительных кардиомиоцитов (-90 мВ).
Физиологические свойства сердечной мышцы
В конце систолы и начале диастолы (расслабления сердечной мышцы) возбудимость начинает восстанавливаться до исходного уровня - фаза относительной рефрактерности (0,03 с). За фазой относительной рефрактерности следует фаза экзальтации (0,05 с), после которой возбудимость сердечной мышцы окончательно возвращается к исходному уровню (рис. 20). Следовательно, особенностью возбудимости сердечной мышцы является длительный период рефрактерности (0.3 с).
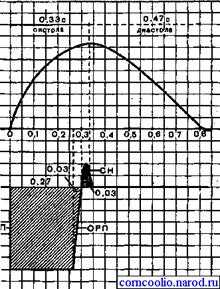
Рис.20.Соотношение кривой одиночного сокращения (А) и фаз возбудимости сердечной мышцы (Б). АРП - фаза абсолютной рефрактерности; ОРП - фаза относительной рефрактерности; СН - фаза экзальтации. Цифрами обозначена длительность фаз сердечного цикла и возбудимости.
Фазы возбудимости сердечной мышцы определяются фазами одиночного цикла возбуждения. Мембранный потенциал покоя миокардиальных клеток имеет величину 90 мВ и формируется в основном ионами калия. Потенциал действия миокарда желудочков имеет следующие фазы (рис. 21).
Рис. 21. Потенциал действия одиночной клетки миокарда желудочка: 1 - быстрая деполяризация; 2 - начальная быстрая реполяризация; 3 - медленная реполяризация (плато); 4 - конечная быстрая реполяризация.
Ионные каналы мембраны кардиомиоцита представлены потенциалозависимыми белками, поэтому их активация (открытие) и инактивация (закрытие) обусловливаются определенной величиной поляризации мембраны (величиной трансмембранного потенциала).
Раздражение сердца во время диастолы вызывает внеочередное сокращение - экстрасистолу. Различают синусовую, предсердную и желудочковую экстрасистолы. Желудочковая экстрасистола отличается тем, что за ней всегда следует более продолжительная, чем обычно, пауза, называемая компенсаторной паузой (рис. 22) . Она возникает в результате выпадения очередного нормального сокращения, т. к. импульс возбуждения, возникший в сино-атриальном узле, поступает к миокарду желудочков, когда они еще находятся в состоянии рефрактерности, возникшей в период экстрасистолического сокращения. При синусовых и предсердных экстрасистолах компенсаторная пауза отсутствует.
Рис. 22. Экстрасистола и компенсаторная пауза. I - момента поступления имульсов из сино-атриального узла; 1,2,3-моменты нанесения экстрараздражений; 4 - экстрасистола; 5 - компенсаторная пауза; 6 - выпавшее очередное сокращение (обозначено пунктиром). II - кардиограмма лягушки с экстрасистолами.
2. Сократимость. Сердечная мышца реагирует на раздражители нарастающей силы по закону "все или ничего". Это обусловлено ее морфологическими особенностями. Между отдельными мышечными клетками сердечной мышцы имеются так называемые вставочные диски, или участки плотных контактов - нексусы, образованные участками плазматических мембран двух соседних миокардиальных клеток. В некоторых участках плазматические мембраны, образующие контакт, прилегают друг к другу так близко, что кажутся слившимися. Мембраны на уровне вставочных дисков обладают очень низким электрическим сопротивлением и поэтому возбуждение распространяется от волокна к волокну беспрепятственно, охватывая миокард целиком. Поэтому сердечную мышцу, состоящую из морфологически разъединенных, но функционально объединенных мышечных волокон, принято считать функциональным синцитием.
К настоящему времени установлено, что выраженной способностью к автоматии обладают мало дифференцированные атипические мышечные волокна, которые образуют так называемую проводящую систему сердца. Проводящая система включает в себя главные узлы автоматизма: сино-атриальный, расположенный в стенке правого предсердия между местом впадения верхней полой вены и правым ушком; атрио-вентрикулярный узел, расположенный в межпредсердной перегородке на границе предсердий и желудочков. В состав проводящей системы сердца взводят также пучок Гиса, который начинается от атрио-вентрикулярного узла, затем разделяется на правую и левую ножки, идущие к желудочкам. Ножки пучка Гиса разделяются на более тонкие проводящие пути, заканчивающиеся волокнами Пуркинье, которые контактируют с клетками сократительного миокарда.
Способность к автоматизму различных отделов проводящей системы сердца изучалась Станниусом путем последовательного Наложения на сердце лигатур. Было установлено, что в обычных условиях генератором возбуждения в сердце является сино-атриальный узел - водитель ритма (пейсмекер) сердца I порядка. Атрио-вентрикулярный узел является водителем ритма сердца II порядка, т. к. его способность к автоматизму примерно в 2 раза меньше, чем у сино-атриального узла. Автоматизм волокон пучка Гиса еще меньше и, наконец, волокна Пуркинье обладают наименьшей способностью к автомат™. Следовательно, существует градиент автоматизма - уменьшение способности к автоматизму различных отделов проводящей системы сердца по мере их удаления от сино-атриального узла к верхушке сердца.
• накопление какого-то вещества (например, ацетилхолин, молочная и угольная кислоты и др.);
Физиологической основой автоматизма сердечной мышцы является низкая скорость ее аккомодации: при действии постепенно нарастающего по силе раздражителя порог возбудимости у сердечной мышцы почти не изменяется. Микроэлектродные исследования показали, что в клетках рабочего миокарда предсердий и желудочков мембранный потенциал покоя в интервалах между возбуждениями поддерживается на постоянном уровне. В клетках же сино-атриального узла мембранный потенциал покоя нестабилен - в период диастолы происходит постепенное его уменьшение, которое называется медленной диастолической деполяризацией (МДД). Она является начальным компонентом потенциала действия пейсмекерных клеток. При достижении МДД критического уровня деполяризации возникает потенциал действия пейсмекерной клетки, который затем распространяется по проводящей системе к миокарду предсердий и желудочков. После окончания потенциала действия вновь развивается МДД (рис. 23).
Рис. 23. Потенциал действия клеток сино-атриального узла. Стрелками показана МДД.
Как видно из рис. 23, форма потенциала действия пейсмекерной клетки сино-атриального узла отличается от формы потенциала действия сократительных кардиомиоцитов. Во-первых, для пейсмекерных клеток характерно наличие МДД. Во-вторых, МДД медленно, плавно (особенно у клеток сино-атриального узла) переходит в фазу быстрой деполяризации. В-третьих, у ПД пеисмекерных клеток нет плато реполяризации. В-четвертых, у пеисмекерных клеток отсутствует овершут (потенциал превышения). В-пятых, МПП у пейсмекерных клеток значительно ниже (-55-60 мВ), чем МПП сократительных кардиомиоцитов (-90 мВ).
Возбудимость и проводимость сердца
Особенности возбудимости, проводимости и сократимости сердечной мышцы
Сократительные кардиомиоциты представлены клетками длиной около 100-150 мкм и толщиной около 10-15 мкм (миокард желудочков), 40-70 мкм и 5-6 мкм соответственно (миокард предсердий). Они имеют многие общие черты строения и обладают функциями, присущими другим типам клеток, в частности клеткам скелетных мышц. В то же время кардиомиоциты характеризуются рядом особенностей строения и свойств, обеспечивающих выполнение ими функций возбуждения, проведения возбуждения и сокращения, специфических для миокарда.
Возбудимость сердечной мышцы
Важнейшими особенностями возбудимости сердечной мышцы являются:
- способность возбуждаться в ответ на поступление потенциала действия из проводящей системы сердца;
- способность более длительно находиться в состоянии возбуждения, по сравнению с волокнами скелетной мышцы;
- наличие длительного периода абсолютной рефрактерности, почти совпадающего по времени с длительностью одиночного сокращения (систолы).
Возбудимость обусловлена свойствами плазматической мембраны (сарколеммы) сократительного кардиомиоцита, в которой имеются разнообразные ионные каналы. Мембрана состоит из внутреннего слоя толщиной около 10 нм и наружного примембранного слоя гликокаликса. Основой клеточной мембраны кардиомиоцитов является фосфолипидный бислой, в котором каналообразующие белки формируют натриевые, кальциевые, калиевые и другие типы каналов. На внутренней поверхности мембраны имеются области, с которыми связано большое количество ионов кальция. Этот пул кальциевых ионов может быстро высвобождаться внутрь клетки во время возбуждения или обмениваться с внеклеточным пространством.
В состоянии покоя (в диастолу) трансмембранная разность потенциалов кардиомиоцита составляет около 85-90 мВ (фаза 4-го мембранного потенциала). Это обусловлено разностью концентраций ионов но обе стороны мембраны, высокой плотностью в ней Na+ / К+ АТФазы и примерно в 10 раз более высокой проницаемостью мембраны в покос для ионов K + , чем в миоцитах скелетных мышц. Соотношение проницаемостей в мембране сократительного кардиомиоцита Рк+: PNa+: РCI-= = 1 : 0,05: 0,1.
Поступающий из проводящей системы к кардиомиоцитам через каналы щелевых контактов потенциал действия деполяризует их мембрану. Когда величина деполяризации достигает критического уровня (около -60 мВ), изменяют свою пространственную конформацию активационные ворота быстрых потенциалзависимых натриевых каналов и через открывающиеся каналы поток ионов Na + по градиентам электрического поля и концентрации устремляется в миоцит, быстро деполяризует и вскоре перезаряжает мембрану — фаза 0 потенциала действия (рис. 1). Проницаемость мембраны для ионов Na+ за период времени, пока открыты активационные ворота, возрастает в несколько сот раз но сравнению с проницаемостью в состоянии покоя. Смена заряда на мембране, поляризованной до +20 мВ, сопровождается закрытием инактивационных ворот натриевых каналов и прекращением входа ионов Na+ в миоцит. Инактивационные ворота натриевых каналов остаются закрытыми до момента, пока мембрана клетки не будет частично реполяризована в фазу 3 потенциала действия. В течение времени от момента активации — открытия натриевых каналов в фазу 0 до их реактивации в фазу 3 мембрана кардиомиоцитов находится в состоянии абсолютной рефрактерности и, таким образом, никакие воздействия на ее в это время не могут вызвать на мембране новый процесс возбуждения и сокращения миокарда.
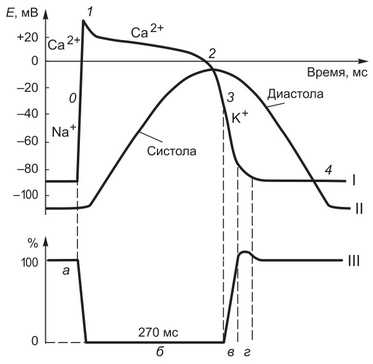
Рис. 1. Соотношение во времени процессов возбуждения, возбудимости и сокращения в сократительных миоцитах миокарда: а — исходная возбудимость; б — период абсолютной невозбудимости (рефрактерности); в — период относительной рсфрактсрности; г — период повышенной возбудимости; I — потенциал действия сократительных кардномиоцнтов (0, 1, 2, 3, 4 — фазы потенциала действия); II — сокращение миокарда; III изменение возбудимости миокарда в процессе возбуждения
Во время деполяризации мембраны наряду с активацией натриевых каналов происходит активация и открытие нескольких типов медленных потенциалзависимых калиевых каналов. Выход ионов К+ из клетки через эти каналы по концентрационному градиенту, но против градиента электрического ноля, запаздывает но отношению ко входу в клетку ионов Na + . Суммарный ноток выходящих ионов К+ начинает существенно превышать вход ионов Na+ с момента инактивации проницаемости натриевых каналов. Когда мембрана клетки приобретает изнутри избыток положительных зарядов, ионы К+ выходят из клетки уже не только но градиенту их концентраций, но и по градиенту электрического поля. Выход ионов К+ обусловливает развитие фазы быстрой реполяризации мембраны миоцита (фаза 1 потенциала действия).
Деполяризация мембраны кардиомиоцита до уровня около -70 мВ сопровождается открытием потенциалзависимых кальциевых каналов Т-типа, через которые в клетку поступает некоторое количество ионов Са 2+ . Однако плотность этих каналов в мембране кардиомиоцитов невелика. При деполяризации мембраны до уровня около -10 мВ активируются медленные потенциалзависимые кальциевые каналы L-типа. Вскоре после начала реполяризации мембраны миоцита вход положительных зарядов ионов Са 2 + по градиенту концентрации в клетку сравнивается с выходом положительных зарядов ионов К+ из клетки, скорость реполяризации замедляется, а фаза 1 потенциала сменяется фазой 2, или фазой плато потенциала действия.
Постепенно развивающаяся инактивация медленных кальциевых каналов ведет к тому, что выход положительно заряженных ионов К через калиевые каналы вновь начинает доминировать над входом ионов Са 2 + и фаза плато сменяется новым ускорением реполяризации мембраны — фазой 3 потенциала. Вскоре мембрана кардиомиоцита реполяризуется до исходного значения трансмембранной разности потенциалов около 90 мВ, характерной для диастолы миокарда (фаза 4).
Таким образом, общая длительность потенциала действия сократительных кардиомиоцитов, вследствие наличия в их мембране ионных каналов медленного типа и других особенностей проницаемости, составляет около 300 мс, что почти в 100 раз превышает длительность потенциала в миоцитах скелетных мышц. Особенно важно, что из 300 мс около 200 мс приходится на фазу плато потенциала действия, во время которой в клетку поступают ионы Ca 2 + , участвующие как в процессе возбуждения, так и в процессе сокращения.
Важное физиологическое значение в регуляции электрических и механических процессов миокарда имеет то, что процессы активации и инактивации потенциалзависимых кальциевых и других ионных каналов мембраны кардиомиоцитов могут модулироваться не только величиной трансмембранной разности потенциалов, но и действием различных сигнальных молекул. Известно, что кальциевые каналы не только потенциалзависимы, но и чувствительны к дигидропиридину. Их проницаемость модулируется при фосфорилировании цАМФ зависимой протеинкиназой А. В настоящее время создан ряд лекарственных веществ (в частности, производных дигидропиридина), с помощью которых оказалось возможным управлять потоками ионов Са 2 + и оказывать влияние на частоту, ритм, силу и другие показатели сокращений сердца.
Восстановление нормального распределения ионов Na+, К+ и Са 2 + по обе стороны мембраны, нарушенного в процессе генерации потенциала действия, осуществляется Na+ /K+ — насосом, кальциевым насосом и натрий кальциевым обменным механизмом.
Состояние возбудимости мембраны сократительного кардиомиоцита в процессе возбуждения определяет возможность возникновения нового процесса возбуждения и последующего сокращения кардиомиоцитов в ходе уже начавшегося возбуждения, т.е. в различные фазы потенциала действия.
В течение времени от начала открытия потенциалзависимых натриевых каналов (фаза 0) и примерно до середины периода конечной реполяризации (-50 мВ), когда становится возможной реактивация инактивированных натриевых каналов (фаза 3), мембрана сократительных кардиомиоцитов находится в состоянии абсолютной невозбудимости (рефрактерности). Продолжительность этого периода составляет около 240 мс при общей продолжительности потенциала действия около 300 мс (рис. 1.3). Состояние абсолютной рефрактерности мембраны кардномиоцитов имеет важное физиологическое значение. Оно заключается в том, что воздействие в этот период на сердце каких-либо стимулов, не оказывает влияния на начавшееся сокращение (систолу) миокарда. Благодаря этому сердечная мышца, в отличие от скелетных мышц, не способна к суммации одиночных сокращений и развитию тетанического сокращения, что предотвращает нарушение насосной функции сердца.
Период абсолютной рефрактерности мембраны сменяется переходом мембраны в состояние относительной рефрактерности. В конце фазы 3 потенциала уже возможно открытие натриевых каналов под действием стимула, сила которого превышает пороговую. В это время на мембране кардиомиоцита способен возникнуть потенциал действия меньшей амплитуды, но он может оказаться достаточным для запуска нового внеочередного сокращения. Период относительной рефрактерности длится около 30 мс.
За несколько десятков миллисекунд до окончания реполяризации мембраны се возбудимость может оказаться более высокой, чем в состоянии покоя. Это объясняется тем, что натриевые каналы к этому времени практически реактивированы, а разность потенциалов близка к уровню Екр. В этот период за короткое мгновение до завершения на мембране предыдущего возбуждения действие даже подпороговых стимулов может вызвать новый процесс возбуждения мембраны (период супернормальной возбудимости).Период повышенной возбудимости кардиологи называют «периодом уязвимости» сердца, так как при поступлении в это время к миокарду внеочередных потенциалов действия возникает повышенная опасность возникновения аритмии, или фибрилляции, желудочков.
Проводимость сердца
Отличается от проводимости скелетной мышцы тем, что в сердце возбуждение может передаваться от одного кардиомиоцита на другие. Таким образом, возникнув в одном участке миокарда, возбуждение может распространяться на его другие участки.
Кардиомиоциты имеют отростчатую форму и контактируют с соседними клетками через нексусы — область плотных контактов между миоцитами, в мембранах которых имеются общие для контактирующих клеток каналы. Каналы сформированы шестью молекулами белков коннексонов и имеют низ- кос сопротивление электрическому току. Они обеспечивают передачу возбуждения с одного кардиомиоцита на другой за счет перехода между клетками ионов и переноса ими электрических зарядов. В частности, через нексусы кардиомиоциты обмениваются ионами Ca 2 + , принимающими участие в передаче возбуждения и сокращения, и другими биологически активными веществами. После того как возбуждение распространилось с одного кардиомиоцита на другой через область вставочных дисков, оно распространяется далее по мембране кардиомиоцитов, благодаря наличию в них потенциалзависимых натриевых, кальциевых, калиевых и других ионных каналов. Скорость проведения возбуждения по миокарду может достигать 1 м/с.
В составе нексусов имеются десмосомы — области прочного механического прикрепления клеток друг к другу. Благодаря наличию непосредственной электрической и механической связи между кардиомиоцитами их возбуждение и сокращение оказываются синхронизированными, а способность миокарда проводить возбуждение и отвечать на него целостной сократительной реакцией получила название функционального синтиция. Поскольку кардиомиоциты способны проводить возбуждение от клетки к клетке, то нет необходимости проведения потенциала действия к каждой клетке волокнами проводящей системы сердца. Между ними и сократительными кардиомиоцитами отсутствуют синапсы.
Таким образом, потенциал действия поступает ко многим точкам миокарда с ветвящихся волокон Пуркинье, где он вызывает возбуждение сократительных кардиомиоцитов, расположенных субэндокардиально. Возникшие в них потенциалы действия распространяются на соседние участки миокарда в направлении от эндокарда к эпикарду. Возникновение возбуждения во многих точках миокарда и его распространение по сердечной мышце с высокой скоростью являются важнейшими условиями синхронизации возбуждения и сокращения не только на уровне отдельных миоцитов, но и в различных участках миокарда. Нарушение распространения возбуждения по миокарду, десинхронизация его сокращения могут быть одной из причин снижения насосной функции сердца.
Читайте также:
