Врожденные пороки сердца. Диагностика и лечение врожденных пороков сердца
Добавил пользователь Валентин П. Обновлено: 22.01.2026
В этом месяце жителям районов Савеловский, Беговой, Аэропорт, Хорошевский предоставляется скидка 5% на ВСЕ медицински.
Скидки для друзей из социальных сетей!
Эта акция - для наших друзей в "Одноклассниках", "ВКонтакте", "Яндекс.Дзене", YouTube и Telegram! Если вы являетесь другом или подписчиком стр.
Захаров Станислав Юрьевич
Врач-кардиолог, врач функциональной диагностики
Высшая квалификационная категория, доктор медицины, Член Европейского общества кардиологов и Российского кардиологического общества
Рудько Гали Николаевна
Высшая квалификационная категория, Член Российского кардиологического общества
Мы в Telegram и "Одноклассниках"
"Passion.ru", интернет-портал (март 2021г.)
"Men's Health. Советы экспертов", медицинский блог (апрель 2015г.)
Пороки сердца - это различные аномалии клапанного аппарата, перегородок, крупных сосудов и отдельных частей сердца, вызывающие нарушения кровообращения.
Существует огромное количество пороков сердца, каждый из которых по-своему опасен для здоровья человека. Практически всегда порок сердца требует хирургического вмешательства.
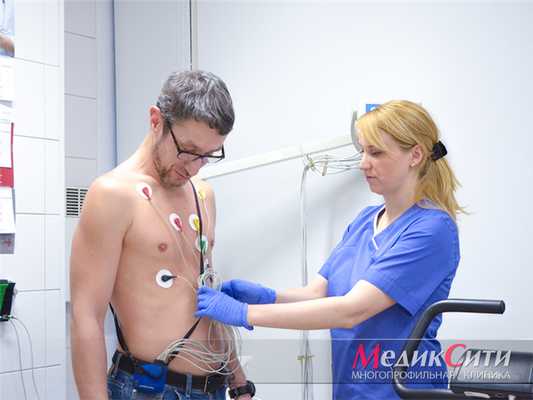
Холтер - диагностика пороков сердца

Диагностика пороков сердца

ЭКГ при пороках сердца
Структурная патология сердца может начать развиваться у человека еще в материнской утробе - это явление называется врожденным пороком сердца. Причиной, как правило, являются хромосомные нарушения или перенесенные матерью инфекции. С таким дефектом рождается от 5 до 8 младенцев из тысячи. Выявить порок можно посредством УЗИ плода.
Если же заболевание появилось как следствие травмы, перенесенной инфекции или системного заболевания, речь идет о приобретенном пороке сердца.
По своей сути, порок - собирательное название для заболеваний разных частей сердца. Оба вида пороков сердца имеют множество подвидов, обладающих разной степенью тяжести и последствий для здоровья человека.
Виды пороков сердца
В большинстве случаев, пороки сердца поражают клапанный аппарат. Появившиеся в результате этой патологии осложнения могут стать причиной ранней потери трудоспособности и даже смерти.
Основная роль клапанного аппарата - свободно пропускать кровь через себя при сокращении сердца и задерживать обратное движение крови через клапан при расслаблении, сохраняя ритмичный и непрерывный поток крови. Дефектные клапаны перестают полноценно выполнять эту работу и функции, из-за чего кровь с трудом поступает через суженный клапан в полость сердца и в полной мере не покидает камеры или поступает обратно через закрытый клапан.
Приобретенные пороки сердца:
- недостаточность клапана (неполное смыкание створок или повреждение створок) - вызывает обратный ток крови;
- стеноз клапана (сужение просвета между открытыми створками) - затрудняет кровообращение;
- пролабирование (выпячивание) клапана, в результате чего его створки выбухают в сердечную полость, и часто происходит обратный ток крови вследствие недозакрытия клапана.
В кардиологической практике часто встречаются комбинированные и сочетанные пороки, при которых поражены сразу несколько клапанов.
Чаще всего от аномальных изменений страдают митральный (митральный порок сердца) и аортальный (аортальный порок сердца) клапаны сердца.
Врожденные пороки сердца:
- дефект межпредсердной перегородки;
- дефект межжелудочковой перегородки;
- открытый артериальный проток;
- транспозиция (нарушение положения) крупных магистральных сосудов;
- коарктация аорты;
- стеноз легочной артерии и др.
Врожденные пороки сердца могут встречаться как по отдельности, так и в комбинациях друг с другом. Так, сочетание гипертрофии правого желудочка, транспозиции аорты, дефекта межжелудочковой перегородки и стеноза выходного тракта правого желудочка носит название тетрады Фалло (или синего порока сердца).
Пороки сердца у беременных
Пороки сердца у беременных — это врожденные или приобретенные анатомические аномалии сердечных клапанов, отверстий, внутрикардиальных перегородок, аорты и легочной артерии, течение которых может осложниться при гестации или ухудшить ее прогноз. Проявляются слабостью, утомляемостью, сонливостью, тяжестью в ногах, одышкой, сердцебиениями, периферическими отеками, сухим кашлем. Диагностируются при помощи эхокардиографии, ЭКГ, фонокардиографии. Для лечения используют антибиотики, гликозиды, диуретики, периферические вазодилалаторы, β-адреноблокаторы, антитромботические средства. Операции выполняют в исключительных случаях по показаниям.
МКБ-10
Общие сведения
Причины
Аномалии строения клапанного аппарата, перегородок, отверстий и отходящих магистральных сосудов обычно возникают задолго до начала гестации. Однако изменения гемодинамики, характерные для периода беременности, могут проявить кардиологическое заболевание или усугубить его клиническую картину. Наиболее распространенными причинами пороков сердца, обнаруживаемых у беременных, являются:
- Воспаление эндокарда и миокарда. В 80-85% случаев аномалии строения сердца развиваются вследствие ревматического поражения. Реже они становятся результатом инфекционного эндокардита другого генеза, сифилиса, специфических воспалительных изменений при диффузных заболеваниях соединительной ткани (склеродермии, системной красной волчанке, ревматоидном артрите).
- Врожденные дефекты. До 7,3-8,0% кардиальных пороков являются дизэмбриогенетическими либо наследуемыми по аутосомно-рецессивному, аутосомно-доминантному типам. Чаще других у беременных наблюдаются признаки открытого аортального протока, дефектов межпредсердной и межжелудочковой перегородок, стеноза легочной артерии, коарктации аорты, транспозиции магистральных сосудов.
У некоторых пациенток вторичная функциональная недостаточность клапанов возникает на фоне кардиологических заболеваний, которые сопровождаются перегрузкой желудочков или расширением фиброзного кольца клапанных структур (гипертонической болезнью, симптоматической артериальной гипертензией, дилатационной кардиомиопатией, кардиосклерозом, инфарктом миокарда).
Патогенез
Механизм развития патологических проявлений при пороках сердцах у беременных зависит от особенностей конкретной аномалии, однако в гестационном периоде возникает ряд общих нагрузочных и адаптационных гемодинамических факторов, влияющих на течение сердечно-сосудистого заболевания. С 10 по 32 неделю объем крови, циркулирующей в сосудистом русле, увеличивается на 30-35%, что в сочетании с повышением гидростатического капиллярного давления приводит к возрастанию количества внеклеточной жидкости на 5-6 л. Одновременно с этим усиливается работа левого желудочка, что сопровождается увеличением ударного и минутного объемов на 35-50%, ростом систолического и пульсового давления, снижением диастолического давления на руках. В конце второго-третьем триместрах возникает физиологическая тахикардия до 85-90 сокращений сердца в минуту.
Классификация
В зависимости от происхождения пороки сердца, выявляемые у беременных, бывают врожденными и приобретенными. С учетом локализации различают изолированные митральные, аортальные, трикуспидальные аномалии, повреждения клапанов легочной артерии, дефекты внутрисердечных перегородок, комбинированные и сочетанные поражения. По характеру патологических изменений выделяют стеноз (сужение), недостаточность (расширение), аномальные отверстия, транспозиции сосудов.
Большое прогностическое значение в систематизации пороков имеет выраженность сердечной недостаточности: при I (скрытой) стадии ее признаки появляются только при физических нагрузках, при IIА отмечаются умеренно выраженные симптомы в покое, усиливающиеся при движении, при IIБ — в покое определяются значительные нарушения гемодинамики, для III (дистрофической) характерны органные метаболические расстройства. На основании этого критерия различают четыре степени риска осложнений у беременных, страдающих пороками сердца:
- Iстепень. Риск отсутствует. Признаков сердечной недостаточности нет, давление в легочной артерии нормальное, ревматический процесс неактивен. Отделы сердца и толщина миокарда не изменены. Вероятность осложненного течения гестации не отличается от показателей в общей популяции. Беременность не противопоказана.
- IIстепень. Умеренно повышенный риск. Отмечаются скрытая сердечная недостаточность и I степень активности ревматизма, умеренное увеличение давления в системе легочной артерии. Отделы сердца незначительно или умеренно утолщены и дилатированы. Беременность допускается, но возможно ухудшение состояния пациентки.
- IIIстепень. Высокий риск акушерских и кардиологических осложнений. Определяются сердечная недостаточность IIА ст., ревматизм II-III степени активности, легочная гипертензия, нарушения ритма. Отделы сердца гипертрофированы и расширены. Большинству пациенток гестацию рекомендуется прервать до 12 недели.
- IVстепень. Крайне высокий риск материнской летальности из-за кардиологических и акушерских осложнений. Диагностируется сердечная недостаточность IIБ-III ст., значительная легочная гипертензия, выраженная систолическая дисфункция левого желудочка, цианоз. Беременность обычно прерывают независимо от сроков.
Симптомы пороков сердца у беременных
Клинические признаки зависят от типа анатомических дефектов, длительности заболевания и функциональной состоятельности миокарда. Пациентки с кардиологическими пороками жалуются на повышенную утомляемость, сонливость, ощущение слабости в мышцах, тяжесть в ногах. При нагрузках наблюдаются одышка, перебои, сердцебиения. У больных с выраженной недостаточностью кровообращения перечисленные симптомы также отмечаются в покое. Возможно появление бледности или цианотичности кожных покровов, отеков в области стоп, голеностопных суставов, голеней, возникновение приступов сердечной астмы с сухим кашлем или откашливанием небольшого количества слизистой мокроты, иногда содержащей прожилки крови.
Осложнения
Пороки со значительной декомпенсацией работы сердца являются ведущей причиной материнской смертности, которая может достигать 150-200 случаев на 100 тыс. живорождений, занимают второе место по показателям перинатальной летальности (12-29%). Основные акушерские осложнения при аномалиях строения сердца — самопроизвольные аборты, преждевременные роды, ранний токсикоз, гестозы, HELLP-синдром, дискоординация и слабость родовой деятельности, коагулопатические кровотечения в послеродовом периоде. Практически у каждой пятой беременной несвоевременно изливаются околоплодные воды.
В каждом втором случае беременности (кроме пациенток с риском I степени) отмечаются признаки задержки развития и гипоксии плода, вызванные хронической плацентарной недостаточностью. У женщин, имеющих врожденные сердечные аномалии, чаще рождаются дети с такой же кардиологической патологией. При пороках сердца повышается вероятность развития клинически значимых нарушений ритма, требующих специальной терапии, сердечно-сосудистых осложнений (тромбоэмболии, инфаркта миокарда, инсульта), эндокардита.
Диагностика
Поскольку врожденные и приобретенные пороки сердца могут протекать субклинически, в 27% случаев они впервые диагностируются именно в период беременности. Кроме традиционных физикальных исследований (перкуссии и аускультации сердца) при постановке диагноза используют современные инструментальные методы, позволяющие визуализировать анатомические дефекты и оценить функциональные возможности сердечно-сосудистой системы. Наиболее информативными для диагностики пороков сердца у беременных считаются:
- Эхокардиография. Совокупное использование различных УЗИ-методик (одномерной и двухмерной ЭхоКГ), доплеровского сканирования дает возможность исследовать состояние клапанного аппарата, оценить толщину сердечных стенок и объем полостей, выполнить фазовый анализ и оценку сократимости. С помощью этого метода также определяются пороки крупных сосудов (грудной аорты и др.).
- Электрокардиография. ЭКГ применяют для скрининга нарушений частоты и регулярности сердечного ритма, изменений проводимости, выявления возможных острых и хронических повреждений миокарда, осложняющих клиническую картину и ухудшающих прогноз беременности при пороке сердца. По показаниям исследование дополняют суточным мониторированием ЭКГ и фонокардиографией.
Из-за возможных повреждающих воздействий на плод беременным с анатомическими пороками сердца не рекомендуется проводить рентгенологические исследования и МРТ. В порядке исключения при подготовке к кардиовмешательствам допустимо зондирование полостей сердца. Для оценки состояния электролитного баланса и свертывающей системы показано определение концентрации калия и натрия в сыворотке крови, коагулограмма. Дифференциальная диагностика проводится с функциональными шумами в сердце при анемии, вегетососудистой дистонии, ИБС с развитием аневризмы, гипертонической болезнью у беременных, миокардитом, токсическими кардиомиопатиями, миокардиодистрофией, кардиомегалией. Кроме акушера-гинеколога к сопровождению беременной привлекается кардиолог. При необходимости пациентку осматривают кардиохирург, ревматолог, инфекционист, невропатолог, гематолог.
Лечение пороков сердца у беременных
При кардиологических пороках существует три критических периода гестации, во время которых рекомендована плановая госпитализация. На 10-12 неделях возможно обострение ревматизма за счет физиологического снижения иммунитета и уменьшения секреции кортикостероидов. Именно на этом сроке принимается решение о возможности пролонгации беременности. На 26-32 неделях сердечно-сосудистая система пациентки испытывает наибольшие нагрузки, что требует дополнительной коррекции терапии. За 2-3 недели до родов возможно развитие или усугубление сердечной недостаточности под действием перегрузочных гемодинамических факторов, которые следует учитывать при выборе способа родоразрешения.
Основными терапевтическими задачами являются профилактика акушерских осложнений, купирование обострений и рецидивов у больных ревматизмом, предупреждение расстройств ритма и проводимости. Адекватное медикаментозное лечение является предпочтительным для ведения большинства беременных женщин с пороками сердца, включая пациенток с сердечной недостаточностью. Лекарственные средства для фармакотерапии подбираются кардиологом индивидуально. Обычно беременным назначаются:
- Антибактериальная терапия. 10-14-дневные профилактические курсы полусинтетических пенициллинов показаны женщинам с ревматическими пороками из I и II групп риска. Антибиотики применяют по показаниям с учетом активности ревматического процесса и при необходимости дополняют глюкокортикоидами.
- Тиазидные и петлевые диуретики. Обеспечивают уменьшение объема циркулирующей крови при недостаточной сократительной активности желудочков. При левожелудочковой недостаточности средства комбинируют с препаратами, которые уменьшают приток крови в камеры сердца, и периферическими вазодилататорами.
- Сердечные гликозиды. При отсутствии легочной гипертензии такие медикаменты поддерживают сердечный выброс и адекватную перфузию различных органов и систем, в том числе фетоплацентарного комплекса. С помощью гликозидов также можно купировать тахисистолическую фибрилляцию предсердий.
- Нитраты. Благодаря депонированию крови в венах большого круга кровообращения средства этой группы снижают преднагрузку на сердце, что позволяет уменьшить признаки венозной легочной гипертензии и застоя крови в малом круге. Недостатком применения нитратов является возможное уменьшение сердечного выброса.
- β-адреноблокаторы. Препараты, снижающие силу сокращений миокарда, рекомендованы беременным с синусовой тахикардией, при которой увеличивается давление в полости левого предсердия, возникает застой крови в легочном круге кровообращения. Могут применяться при тахисистолической фибрилляции предсердий.
- Антикоагулянты. С учетом срока беременности и результатов тромбоэластограммы женщинам с сердечными пороками назначают низкомолекулярные гепарины, антиагреганты в комбинации с периферическими вазодилататорами, улучшающими капиллярный кровоток. Во время родов введение гепарина прекращают.
При наличии показаний выполняются малоинвазивные операции (эндоваскулярная баллонная дилатация аортального стеноза и пр.) и закрытая митральная комиссуротомия. Открытые хирургические вмешательства по протезированию клапанов с выключением естественного кровообращения проводятся только при угрозе жизни женщины и невозможности чрескожной коррекции аномалии.
При наличии порока сердца предпочтительны программированные естественные роды в дневное время суток с введением гормонально-энергетического комплекса для профилактики аномальной родовой деятельности и максимальным нарастающим обезболиванием с использованием масочного наркоза и эпидуральной анальгезии. Для бережного родоускорения применяется амниотомия. В родах допустимо назначение утеротоников, спазмолитиков, антигипоксантов. Потуги в период изгнания выключаются при высокой активности ревматизма, комбинированных и сочетанных пороках, стенозах, нарушениях кровообращения.
При обнаружении активного ревматического процесса, признаков нарушения кровообращений, развитии поздних гестозов, плацентарной недостаточности с хронической гипоксией или задержкой развития плода родоразрешение выполняется досрочно на 34-37 неделях. Абсолютными показаниями к проведению кесарева сечения являются терапевтически резистентная прогрессирующая сердечная недостаточность, III степень активности ревмокардита, аневризма аорты, коарктация аорты с выраженной гипертензией, полное нарушение атриовентрикулярной проводимости, использование искусственного водителя ритма, подострое течение септического эндокардита, пороки с нагрузкой преимущественно на левые отделы сердца, сопутствующая акушерская патология (крупный плод, узкий таз, неправильное положение ребенка).
Прогноз и профилактика
Исход беременности и родов при пороках сердца зависит от варианта анатомического дефекта, наличия нарушений кровообращения, активности ревматизма (при аномалиях ревматического происхождения). Абсолютными противопоказаниями к вынашиванию ребенка считаются сочетанные и комбинированные виды пороков, единый желудочек, коарктация аорты, выраженный аортальный стеноз, сочетание анатомических аномалий с бактериальным эндокардитом, тахиаритмией, легочной гипертензией 2-3 степени, синдром Эйзенменгера, синдром Марфана с увеличением диаметра корня аорты более 4,5 см, предшествующая послеродовая кардиомиопатия. Прогноз также ухудшается при выраженных степенях сужения (недостаточности) сердечных клапанов и по мере увеличения возраста беременной - после 30 лет вероятность развития недостаточности кровообращения повышается вдвое.
В остальных случаях при планировании беременности необходимо учитывать рекомендации кардиолога, на прегравидарном этапе максимально компенсировать порок и купировать ревматическую лихорадку, по показаниям выполнить операцию по коррекции порока до зачатия. Беременным показана ранняя постановка на учет в женской консультации, диетотерапия с достаточным потреблением белка, микроэлементов и витаминов, ограничением количества жидкости и поваренной соли. Рекомендованы дозированные физические нагрузки, нормализация режима работы и отдыха, профилактическое использование растительных препаратов с седативным эффектом.
1. Ведение беременных с врожденными пороками сердца/ Волчкова Н.С., Субханкулова С.Ф., Субханкулова А.Ф.// Вестник современной клинической медицины. — 2016 — Т. 9, вып. 4.
3. Врожденные пороки сердца и беременность/ Дашкевич В.Е., Кирильчук М.Е.// Международный медицинский журнал. - 2011 - №1.
Врожденные пороки сердца
Врожденные пороки сердца - группа заболеваний, объединенных наличием анатомических дефектов сердца, его клапанного аппарата или сосудов, возникших во внутриутробном периоде, приводящих к изменению внутрисердечной и системной гемодинамики. Проявления врожденного порока сердца зависят от его вида; к наиболее характерным симптомам относятся бледность или синюшность кожных покровов, шумы в сердце, отставание в физическом развитии, признаки дыхательной и сердечной недостаточности. При подозрении на врожденный порок сердца выполняется ЭКГ, ФКГ, рентгенография, ЭхоКГ, катетеризация сердца и аортография, кардиография, МРТ сердца и т. д. Чаще всего при врожденных пороках сердца прибегают к кардиохирургической операции - оперативной коррекции выявленной аномалии.
Врожденные пороки сердца - весьма обширная и разнородная группа заболеваний сердца и крупных сосудов, сопровождающихся изменением кровотока, перегрузкой и недостаточностью сердца. Частота встречаемости врожденных пороков сердца высока и, по оценке различных авторов, колеблется от 0,8 до 1,2% среди всех новорожденных. Врожденные пороки сердца составляют 10-30% всех врожденных аномалий. В группу врожденных пороков сердца входят как относительно легкие нарушения развития сердца и сосудов, так и тяжелые формы патологии сердца, несовместимые с жизнью.
Многие виды врожденных пороков сердца встречаются не только изолированно, но и в различных сочетаниях друг с другом, что значительно утяжеляет структуру дефекта. Примерно в трети случаев аномалии сердца сочетаются с внесердечными врожденными пороками ЦНС, опорно-двигательного аппарата, ЖКТ, мочеполовой системы и пр.
К наиболее частым вариантам врожденных пороков сердца, встречающимся в кардиологии, относятся дефекты межжелудочковой перегородки (ДМЖП - 20%), дефекты межпредсердной перегородки (ДМПП), стеноз аорты, коарктация аорты, открытый артериальный проток (ОАП), транспозиция крупных магистральных сосудов (ТКС), стеноз легочной артерии (10-15% каждый).
Причины врожденных пороков сердца
Этиология врожденных пороков сердца может быть обусловлена хромосомными нарушениями (5%), генной мутацией (2-3%), влиянием факторов среды (1-2%), полигенно-мультифакториальной предрасположенностью (90%).
Различного рода хромосомные аберрации приводят к количественным и структурным изменениям хромосом. При хромосомных перестройках отмечаются множественные полисистемные аномалии развития, включая врожденные пороки сердца. В случае трисомии аутосом наиболее частыми пороками сердца оказываются дефекты межпредсердной или межжелудочковой перегородок, а также их сочетание; при аномалиях половых хромосом врожденные пороки сердца встречаются реже и представлены, главным образом, коарктацией аорты или дефектом межжелудочковой перегородки.
Врожденные пороки сердца, обусловленные мутациями единичных генов, также в большинстве случаев сочетаются с аномалиями других внутренних органов. В этих случаях сердечные пороки являются частью аутосомно-доминантных (синдромы Марфана, Холта-Орама, Крузона, Нунана и др.), аутосомно-рецессивных синдромов (синдром Картагенера, Карпентера, Робертса, Гурлер и др.) или синдромов, сцепленных с Х-хромосомой (синдромы Гольтца, Аазе, Гунтера и др.).
Среди повреждающих факторов внешней среды к развитию врожденных пороков сердца приводят вирусные заболевания беременной, ионизирующая радиация, некоторые лекарственные препараты, пагубные привычки матери, производственные вредности. Критическим периодом неблагоприятного воздействия на плод являются первые 3 месяца беременности, когда происходит фетальный органогенез.
Внутриутробное поражение плода вирусом краснухи наиболее часто вызывает триаду аномалий - глаукому или катаракту, глухоту, врожденные пороки сердца (тетраду Фалло, транспозицию магистральных сосудов, открытый артериальный проток, общий артериальный ствол, клапанные пороки, стеноз легочной артерии, ДМЖП и др.). Также обычно имеют место микроцефалия, нарушение развития костей черепа и скелета, отставание в умственном и физическом развитии.
В структуру эмбриофетального алкогольного синдрома обычно входят дефекты межжелудочковой и межпредсердной перегородки, открытый артериальный проток. Доказано, что тератогенное действие на сердечно-сосудистую систему плода оказывает прием амфетаминов, приводящий к транспозиции магистральных сосудов и ДМЖП; противосудорожных средств, обусловливающих развитие стеноза аорты и легочной артерии, коарктации аорты, открытого артериального протока, тетрады Фалло, гипоплазии левых отделов сердца; препаратов лития, приводящих к атрезии трехстворчатого клапана, аномалии Эбштейна, ДМПП; прогестагенов, вызывающих тетраду Фалло, другие сложные врожденные пороки сердца.
У женщин, страдающих преддиабетом или диабетом, дети с врожденными пороками сердца рождаются чаще, чем у здоровых матерей. В этом случае у плода обычно формируются ДМЖП или транспозиция крупных сосудов. Вероятность рождения ребенка с врожденным пороком сердца у женщины с ревматизмом составляет 25 %.
Кроме непосредственных причин, выделяют факторы риска формирования аномалий сердца у плода. К ним относят возраст беременной младше 15-17 лет и старше 40 лет, токсикозы I триместра, угрозу самопроизвольного прерывания беременности, эндокринные нарушения у матери, случаи мертворождения в анамнезе, наличие в семье других детей и близких родственников с врожденными пороками сердца.
Классификация врожденных пороков сердца
Существует несколько вариантов классификаций врожденных пороков сердца, в основу которых положен принцип изменения гемодинамики. С учетом влияния порока на легочный кровоток выделяют:
- врожденные пороки сердца с неизмененным (либо незначительно измененным) кровотоком в малом круге кровообращения: атрезия аортального клапана, стеноз аорты, недостаточность легочного клапана, митральные пороки (недостаточность и стеноз клапана), коарктация аорты взрослого типа, трехпредсердное сердце и др.
- врожденные пороки сердца с увеличенным кровотоком в легких: не приводящие к развитию раннего цианоза (открытый артериальный проток, ДМПП, ДМЖП, аортолегочный свищ, коарктация аорты детского типа, синдром Лютамбаше), приводящие к развитию цианоза (атрезия трехстворчатого клапана с большим ДМЖП, открытый артериальный проток с легочной гипертензией)
- врожденные пороки сердца с обедненным кровотоком в легких: не приводящие к развитию цианоза (изолированный стеноз легочной артерии), приводящие к развитию цианоза (сложные пороки сердца - болезнь Фалло, гипоплазия правого желудочка, аномалия Эбштейна)
- комбинированные врожденные пороки сердца, при которых нарушаются анатомические взаимоотношения между крупными сосудами и различными отделами сердца: транспозиция магистральных артерий, общий артериальный ствол, аномалия Тауссиг-Бинга, отхождение аорты и легочного ствола из одного желудочка и пр.
В практической кардиологии используется деление врожденных пороков сердца на 3 группы: пороки «синего» (цианотического) типа с веноартериальным шунтом (триада Фалло, тетрада Фалло, транспозиция магистральных сосудов, атрезия трехстворчатого клапана); пороки «бледного» типа с артериовенозным сбросом (септальные дефекты, открытый артериальный проток); пороки с препятствием на пути выброса крови из желудочков (стенозы аорты и легочной артерии, коарктация аорты).
Нарушения гемодинамики при врожденных пороках сердца
В результате выше названных причин у развивающего плода может нарушаться правильное формирование структур сердца, что выражается в неполном или несвоевременном закрытии перепонок между желудочками и предсердиями, неправильном образовании клапанов, недостаточном повороте первичной сердечной трубки и недоразвитии желудочков, аномальном расположении сосудов и т. д. После рождения у части детей остаются открытыми артериальный проток и овальное окно, которые во внутриутробном периоде функционируют в физиологическом порядке.
При врожденных пороках сердца бледного типа с артериовенозным сбросом вследствие гиперволемии развивается гипертензия малого круга кровообращения; при пороках синего типа с веноартериальным шунтом у больных имеет место гипоксемия.
Около 50% детей с большим сбросом крови в малый круг кровообращения погибают без кардиохирургической помощи на первом году жизни от явлений сердечной недостаточности. У детей, перешагнувших этот критический рубеж, сброс крови в малый круг уменьшается, самочувствие стабилизируется, однако постепенно прогрессируют склеротические процессы в сосудах легких, обусловливая легочную гипертензию.
При цианотических врожденных пороках сердца венозный сброс крови или ее смешение приводит к перегрузке большого и гиповолемии малого круга кровообращения, вызывая снижение насыщения крови кислородом (гипоксемию) и появление синюшности кожи и слизистых. Для улучшения вентиляции и перфузии органов развивается коллатеральная сеть кровообращения, поэтому, несмотря на выраженные нарушения гемодинамики, состояние больного может длительное время оставаться удовлетворительным. По мере истощения компенсаторных механизмов, вследствие длительной гиперфункции миокарда, развиваются тяжелые необратимые дистрофические изменения в сердечной мышце. При цианотических врожденных пороках сердца оперативное вмешательство показано уже в раннем детском возрасте.
Симптомы врожденных пороков сердца
Клинические проявления и течение врожденных пороков сердца определяется видом аномалии, характером нарушений гемодинамики и сроками развития декомпенсации кровообращения.
У новорожденных с цианотическими врожденными пороками сердца отмечается цианоз (синюшность) кожных покровов и слизистых оболочек. Синюшность усиливается при малейшем напряжении: сосании, плаче ребенка. Белые пороки сердца проявляются побледнением кожи, похолоданием конечностей.
Дети с врожденными пороками сердца обычно беспокойные, отказываются от груди, быстро устают в процессе кормления. У них появляется потливость, тахикардия, аритмии, одышка, набухание и пульсация сосудов шеи. При хроническом нарушении кровообращения дети отстают в прибавлении веса, росте и физическом развитии. При врожденных пороках сердца обычно сразу поле рождения выслушиваются сердечные шумы. В дальнейшем обнаруживаются признаки сердечной недостаточности (отеки, кардиомегалия, кардиогенная гипотрофия, гепатомегалия и др.).
Осложнениями врожденных пороков сердца могут стать бактериальный эндокардит, полицитемия, тромбозы периферических сосудов и тромбоэмболии сосудов головного мозга, застойные пневмонии, синкопальные состояния, одышечно-цианотические приступы, стенокардитический синдром или инфаркт миокарда.
Диагностика врожденных пороков сердца
Выявление врожденных пороков сердца осуществляется путем комплексного обследования. При осмотре ребенка отмечают окраску кожных покровов: наличие или отсутствие цианоза, его характер (периферический, генерализованный). При аускультации сердца нередко выявляется изменение (ослабление, усиление или расщепление) сердечных тонов, наличие шумов и пр. Физикальное обследование при подозрении на врожденный порок сердца дополняется инструментальной диагностикой - электрокардиографией (ЭКГ), фонокардиографией (ФКГ), рентгенографией органов грудной клетки, эхокардиографией (ЭхоКГ).
ЭКГ позволяет выявить гипертрофию различных отделов сердца, патологическое отклонение ЭОС, наличие аритмий и нарушений проводимости, что в совокупности с данными других методов клинического обследования позволяет судить о тяжести врожденного порока сердца. С помощью суточного холтеровского ЭКГ-мониторирования обнаруживаются скрытые нарушения ритма и проводимости. Посредством ФКГ более тщательно и детально оценивается характер, длительность и локализация сердечных тонов и шумов. Данные рентгенографии органов грудной клетки дополняют предыдущие методы за счет оценки состояния малого круга кровообращения, расположения, формы и размеров сердца, изменений со стороны других органов (легких, плевры, позвоночника). При проведении ЭхоКГ визуализируются анатомические дефекты перегородок и клапанов сердца, расположение магистральных сосудов, оценивается сократительная способность миокарда.
При сложных врожденных пороках сердца, а также сопутствующей легочной гипертензии, с целью точной анатомической и гемодинамической диагностики, возникает необходимость в выполнении зондирования полостей сердца и ангиокардиографии.
Лечение врожденных пороков сердца
Наиболее сложной проблемой в детской кардиологии является хирургическое лечение врожденных пороков сердца у детей первого года жизни. Большинство операций в раннем детском возрасте выполняется по поводу цианотических врожденных пороков сердца. При отсутствии у новорожденного признаков сердечной недостаточности, умеренной выраженности цианоза операция может быть отложена. Наблюдение за детьми с врожденными пороками сердца осуществляют кардиолог и кардиохирург.
Специфическое лечение в каждом конкретном случае зависит от разновидности и степени тяжести врожденного порока сердца. Операции при врожденных дефектах перегородок сердца (ДМЖП, ДМПП) могут включать пластику или ушивание перегородки, рентгенэндоваскулярную окклюзию дефекта. При наличии выраженной гипоксемии детям с врожденными пороками сердца первым этапом выполняется паллиативное вмешательство, предполагающее наложение различного рода межсистемных анастомозов. Подобная тактика улучшает оксигенацию крови, уменьшает риск осложнений, позволяет провести радикальную коррекцию в более благоприятных условиях. При аортальных пороках выполняется резекция или баллонная дилатация коарктации аорты, пластика аортального стеноза и др. При ОАП производится его перевязка. Лечение стеноза легочной артерии заключается в проведении открытой или эндоваскулярной вальвулопластики и т. д.
Анатомически сложные врожденные пороки сердца, при которых радикальная операция не представляется возможной, требуют выполнения гемодинамической коррекции, т. е. разделения артериального и венозного потоков крови без устранения анатомического дефекта. В этих случаях могут проводиться операции Фонтена, Сеннинга, Мастарда и др. Серьезные пороки, не поддающиеся оперативному лечению, требуют проведения пересадки сердца.
Консервативное лечение врожденных пороков сердца может включать в себя симптоматическую терапию одышечно-цианотических приступов, острой левожелудочковой недостаточности (сердечной астмы, отека легких), хронической сердечной недостаточности, ишемии миокарда, аритмий.
Прогноз и профилактика врожденных пороков сердца
В структуре смертности новорожденных врожденные пороки сердца занимают первое место. Без оказания квалифицированной кардиохирургической помощи в течение первого года жизни погибает 50-75% детей. В периоде компенсации (2-3 года) смертность снижается до 5%. Ранее выявление и коррекция врожденного порока сердца позволяет существенно улучшить прогноз.
Профилактика врожденных пороков сердца требует тщательного планирования беременности, исключения воздействия неблагоприятных факторов на плод, проведения медико-генетического консультирования и разъяснительной работы среди женщин групп риска по рождению детей с сердечной патологией, решения вопроса о пренатальной диагностике порока (УЗИ, биопсия хориона, амниоцентез) и показаниях к прерыванию беременности. Ведение беременности у женщин с врожденными пороками сердца требует повышенного внимания со стороны акушера-гинеколога и кардиолога.
Дефект межпредсердной перегородки
Дефект межпредсердной перегородки (ДМПП) - одно или несколько отверстий в перегородке, разделяющей левую и правую предсердные полости, наличие которых обуславливает патологический сброс крови, нарушение внутрисердечной и системной гемодинамики. В кардиологии дефект межпредсердной перегородки встречается у 5-15% лиц с врожденными пороками сердца, при этом в 2 раза чаще диагностируется у женщин.
Наряду с дефектами межжелудочковой перегородки, коарктацией аорты, открытым артериальным протоком, дефект межпредсердной перегородки входит в число наиболее часто встречающихся врожденных пороков сердца. Дефект межпредсердной перегородки может являться изолированным врожденным пороком сердца или сочетаться с другими внутрисердечными аномалиями: дефектом межжелудочковой перегородки, аномальным дренажем легочных вен, митральной или трикуспидальной недостаточностью.
Причины дефекта межпредсердной перегородки
Формирование дефекта связано с недоразвитием первичной или вторичной межпредсердной перегородки и эндокардиальных валиков в эмбриональном периоде. К нарушению органогенеза могут приводить генетические, физические, экологические и инфекционные факторы.
Риск развития дефекта межпредсердной перегородки у будущего ребенка существенно выше в тех семьях, где есть родственники с врожденными пороками сердца. Описаны случаи семейных дефектов межпредсердной перегородки в сочетании с атриовентрикулярной блокадой или с недоразвитием костей кисти (синдромом Холта-Орама).
Кроме наследственной обусловленности, к возникновению дефекта межпредсердной перегородки, могут приводить вирусные заболевания беременной (краснуха, ветряная оспа, герпес, сифилис и др.), сахарный диабет и другие эндокринопатии, прием некоторых медикаментов и алкоголя во время беременности, производственные вредности, ионизирующая радиация, гестационные осложнения (токсикозы, угроза выкидыша и др.).
Особенности гемодинамики при дефекте межпредсердной перегородки
Лево-правое шунтирование крови сопровождается увеличением наполняемости малого круга кровообращения, возрастанием объемной нагрузки правого предсердия и усилением работы правого желудочка. Ввиду несоответствия между площадью клапанного отверстия легочной артерии и объемом выброса из правого желудочка, происходит развитие относительного стеноза легочной артерии.
Длительная гиперволемия малого круга кровообращения постепенно приводит к развитию легочной гипертензии. Это наблюдается только тогда, когда легочный кровоток превышает норму в 3 и более раза. Легочная гипертензия при дефекте межпредсердной перегородки обычно развивается у детей старше 15 лет, при поздних склеротических изменениях легочных сосудов. Тяжелая легочная гипертензия вызывает правожелудочковую недостаточность и смену шунта, что проявляется вначале транзиторным веноартериальным сбросом (при физической нагрузке, натуживании, кашле и др.), а затем и стойким, сопровождающимся постоянным цианозом в покое (синдром Эйзенменгера).
Классификация дефектов межпредсердной перегородки
Дефекты межпредсердной перегородки различаются по количеству, размерам и расположению отверстий.
С учетом степени и характера недоразвития первичной и вторичной межпредсердных перегородок соответственно выделяют первичные, вторичные дефекты, а также полное отсутствие межпредсердной перегородки, обусловливающее общее, единственное предсердие (трехкамерное сердце).
Вторичные ДМПП образованы недоразвитием вторичной перегородки. Обычно они имеют небольшие размеры (1-2 см) и располагаются в центре межпредсердной перегородки или в области устьев полых вен. Вторичные дефекты межпредсердной перегородки часто сочетаются с аномальным впадением легочных вен в правое предсердие. При этом типе порока межпредсердная перегородка сохранена в своей нижней части.
Встречаются комбинированные дефекты межпредсердной перегородки (первичный и вторичный, ДМПП в сочетании с дефектом венозного синуса). Также дефект межпредсердной перегородки может входить в структуру сложных ВПС (триады и пентады Фалло) или сочетаться с тяжелыми сердечными пороками - аномалией Эбштейна, гипоплазией камер сердца, транспозицией магистральных сосудов.
Формирование общего (единственного) предсердия связано с недоразвитием или полным отсутствием первичной и вторичной перегородок и наличием большого дефекта, занимающего площадь всей межпредсердной перегородки. Структура стенок и оба предсердных ушка при этом сохранены. Трехкамерное сердце может сочетаться с аномалиями атриовентрикулярных клапанов, а также с аспленией.
Одним из вариантов межпредсердной коммуникации является открытое овальное окно, обусловленное недоразвитием собственного клапана овального отверстия или его дефектом. Однако ввиду того, что открытое овальное отверстие не является истинным дефектом перегородки, связанным с недостаточностью ее ткани, данная аномалия не может быть причислена к дефектам межпредсердной перегородки.
Симптомы дефекта межпредсердной перегородки
Дефекты межпредсердной перегородки могут протекать с длительной гемодинамической компенсацией, а их клиника отличается значительным разнообразием. Выраженность симптоматики определяется величиной и локализацией дефекта, длительностью существования ВПС и развитием вторичных осложнений. На первом месяце жизни единственным проявлением дефекта межпредсердной перегородки обычно служит транзиторный цианоз при плаче и беспокойстве, что обычно связывается с перинатальной энцефалопатией.
При дефектах межпредсердной перегородки средних и больших размеров симптоматика проявляется уже в первые 3-4 мес. или к концу первого года жизни и характеризуется стойкой бледностью кожных покровов, тахикардией, умеренным отставанием в физическом развитии, недостаточным приростом массы тела. Для детей с дефектами межпредсердной перегородки типично частое возникновение респираторных заболеваний - рецидивирующих бронхитов, пневмоний, протекающих с длительным влажным кашлем, стойкой одышкой, обильными влажными хрипами и др., обусловленными гиперволемией малого круга кровообращения. У детей первого десятилетия жизни отмечаются частые головокружения, склонность к обморокам, быстрая утомляемость и одышка при физической нагрузке.
Небольшие дефекты межпредсердной перегородки (до 10-15 мм) не вызывают нарушения физического развития детей и характерных жалоб, поэтому первые клинические признаки порока могут развиться лишь на втором-третьем десятилетии жизни. Легочная гипертензия и сердечная недостаточность при дефекте межпредсердной перегородки формируются примерно к 20 годам, когда возникает цианоз, аритмии, редко - кровохарканье.
Диагностика дефекта межпредсердной перегородки
При объективном обследовании пациента с дефектом межпредсердной перегородки выявляется бледность кожных покровов, «сердечный горб», умеренное отставание в росте и весе. Перкуторно определяется увеличение границ сердца влево и вправо; при аускультации слева от грудины во II-III межреберьях выслушивается умеренно интенсивный систолический шум, который в отличие от дефекта межжелудочковой перегородки или стеноза легочной артерии, никогда не бывает грубым. Над легочной артерией выявляется расщепление II тона и акцентирование его легочного компонента. Аускультативные данные подтверждаются при проведении фонокардиографии.
При вторичных дефектах межпредсердной перегородки ЭКГ-изменения отражают перегрузку правых отделов сердца. Могут регистрироваться неполная блокада правой ножки пучка Гиса, АВ-блокады, синдром слабости синусового узла. Рентгенография органов грудной клетки позволяет увидеть усиление легочного рисунка, выбухание ствола легочной артерии, увеличение тени сердца вследствие гипертрофии правого предсердия и желудочка. При рентгеноскопии обнаруживается специфичный признак дефекта межпредсердной перегородки - усиленная пульсация корней легких.
ЭхоКГ-исследование с цветным допплеровским картированием выявляет лево-правый сброс крови, наличие дефекта межпредсердной перегородки, позволяет определить его величину и локализацию. При зондировании полостей сердца обнаруживается повышение давления и насыщения крови кислородом в правых отделах сердца и легочной артерии. В случае диагностических трудностей обследование дополняется атриографией, вентрикулографией, флебографией яремных вен, ангиопульмонографией, МРТ сердца.
Дефект межпредсердной перегородки следует дифференцировать от дефекта межжелудочковой перегородки, открытого артериального протока, митральной недостаточности, изолированного стеноза легочной артерии, триады Фалло, аномального впадения легочных вен в правое предсердие.
Лечение дефекта межпредсердной перегородки
Лечение дефектов межпредсердной перегородки только хирургическое. Показаниями к кардиохирургической операции служит выявление гемодинамически значимого артериовенозного сброса крови. Оптимальный возраст для коррекции порока у детей - от 1 до 12 лет. Хирургическое лечение противопоказано при высокой легочной гипертензии с веноартериальным сбросом крови, обусловленной склеротическими изменениями легочных сосудов.
При дефектах межпредсердной перегородки прибегают к различным способам их закрытия: ушиванию, пластике с помощью перикардиального лоскута или синтетической заплаты в условиях гипотермии и ИК. Рентгенэндоваскулярная окклюзия дефекта межпредсердной перегородки позволяет закрывать отверстия не более 20 мм.
Хирургическая коррекция дефектов межпредсердной перегородки сопровождается хорошими отдаленными результатами: у 80-90% больных отмечается нормализации гемодинамики и отсутствие жалоб.
Прогноз дефекта межпредсердной перегородки
Малые дефекты межпредсердной перегородки совместимы с жизнью и могут обнаруживаться даже в пожилом возрасте. У некоторых больных с небольшим дефектом межпредсердной перегородки возможно спонтанное закрытие отверстия в течение первых 5-ти лет жизни. Продолжительность жизни лиц с большими дефектами межпредсердной перегородки при естественном течении порока составляет в среднем 35-40 лет. Гибель пациентов может наступить от правожелудочковой сердечной недостаточности, нарушений ритма и проводимости сердца (пароксизмальной тахикардии, мерцательной аритмии и др.), реже — от легочной гипертензии высокой степени.
Пациенты с дефектами межпредсердной перегородки (оперированные и неоперированные) должны находиться под наблюдением кардиолога и кардиохирурга.
Врожденные пороки сердца (ВПС) - это аномалии развития, приводящие к нарушению морфологического строения сердца, включая клапанный аппарат и магистральные сосуды.
Общая распространенность данной группы заболеваний составляет до 5- 8 случаев на 1000 родов. Врожденные пороки могут быть связаны с хромосомными аномалиями, однако, зачастую, диагностируются именно нехромосомные врожденные пороки сердца.
Общая частота нехромосомных ВПС составляет до 7 случаев на 1000 родов, из которых до 3,5% составляют перинатальные потери, 20% диагностируются пренатально, 5,6% беременностей прерывается в связи с выявленной аномалией плода. Сложные нехромосомные пороки сердца встречаются реже, примерно 2 случая на 1000 родов. Исходом в 8% случаев становится перинатальная смерть, 40% диагностируются внутриутробно, 14% становятся причиной прерывания беременности.
Оставьте телефон -
и мы Вам перезвоним
Причины ВПС

В качестве основных ведущих причины в формировании пороков, чаще всего, выступают структурные и количественные хромосомные аномалии, и мутации, т.е. первичные генетические факторы.
Также необходимо уделять внимание потенциально тератогенным факторам внешней среды: различные внутриутробные инфекции (вирусы краснухи, цитомегаловирус, коксаки, инфекционные заболевания у матери в первом триместре), лекарственные препараты (витамин А, противоэпилептические средства, сульфазалазин, триметоприм), постоянный контакт с токсичными веществами (краски, лаки). Кроме того, нужно помнить, что отрицательное влияние на внутриутробное развитие оказывают как материнские факторы: предшествующие данной беременности репродуктивные проблемы, наличие сахарного диабета, фенилкетонурии, алкоголизма, курение, возраст, но также, и факторы со стороны отца - возраст, употребление наркотических средств (кокаин, марихуана).
Ведущая роль принадлежит мультифакториальной теории развития врожденных пороков сердца (до 90%).
Виды врожденных пороков сердца
Дефект межпредсердной перегородки (ДМПП) или открытое овальное окно - диагностируется при выявлении одного либо нескольких отверстий в межпредсердной перегородке. Один из часто встречающихся врожденных пороков сердца. В зависимости от расположения дефекта, его величины, силы тока крови определяются более или менее выраженные клинические признаки. Часто ДМПП сочетается с другими аномалиями сердца и определяться при синдроме Дауна.
Коартация аорты - сегментарное сужение просвета аорты с нарушением нормального кровотока из левого желудочка в большой круг кровообращения. Выявляется до 8% всех случаев ВПС, чаще у мальчиков, нередко сочетается с другими аномалиями.
Открытый артериальный проток - диагностируется при не заращении Баталлова протока, определяемого у новорожденных и зарастающего в последующем. В результате, происходит частичный сброс артериальной кровь из аорты в легочную артерию. При данном ВПС чаще не бывает тяжелых клинических проявлений, однако, патология требует хирургической коррекции, поскольку сопряжена с высоким риском внезапной сердечной смерти.
Атрезия легочной артерии - диагностируется недоразвитие (полное либо частичное) створок клапана легочной артерии с развитием обратного заброса крови из легочной артерии в полость правого желудочка. В последующем приводит к недостаточному кровоснабжению легких.
Стеноз клапана легочной артерии - аномалия, при которой диагностируют сужение отверстия клапана легочной артерии. В результате патологии, чаще всего, створок клапана, нарушается нормальный кровоток из правого желудочка в легочный ствол.
Тетрада Фалло - сложный сочетанный ВПС. Объединяет дефект межжелудочковой перегородки, стеноз легочной артерии, гипертрофию правого желудочка, декстрапозицию аорты. При данной патологии происходит смешение артериальной и венозной крови.
Транспозиция магистральных сосудов - также сложный ВПС. При данной патологии аорта отходит от правого желудочка и несет венозную кровь, а легочный ствол отходит от левого желудочка и несет артериальную кровь, соответственно. Парок протекает тяжело, сопряжен с высокой летальностью новорожденных.
Декстрокардия - аномалия внутриутробного развития, арактеризующаяся правосторонним размещением сердца. Зачастую, наблюдается «зеркальное» расположениее других непарных внутренних органов.
Аномалия Эбштейна - редко встречающийся врожденный порок сердца, диагностируется при изменении месторасположения створок трехстворчатого клапана. В норме - от предсердно-желудочкового фиброзного кольца, при аномалии - от стенок правого желудочка. Правый желудочек имеет меньшие размеры, а правое предсердие удлинено, вплоть до аномальных клапанов.
Методы диагностики ВПС
Диагностика ВПС основывается на сборе данных анамнеза (наличие пороков развития, в том числе врожденных пороков сердца, генетических заболеваний у ближайших родственников; информация о беременности и наличии этиологических факторов у родителей).
При сборе жалоб обращают внимание на отставание ребенка в развитии, плохую прибавку в весе, плохой аппетит, вялое сосание из груди либо бутылочки, отказ от груди, цианоз, частые респираторные инфекции.
При физикальном обследовании обращают внимание на цвет кожных покровов, определяют пульс и АД (на правой руки и любой ноге), выполняют аускультацию сердца, легких, обращают внимание на наличие периферических отеков, проводят пульсоксиметрию, определяют диурез.
Однако, ведущую роль в диагностике и подтверждении, дифференциальной диагностике ВПС играют инструментальные методы обследований: рентгенологическое обследование органов грудной клетки, электрокардиография, эхокардиография, МРТ, КТ, катетеризация полостей сердца.
Чтобы точно продиагностировать заболевание, запишитесь на прием к специалистам сети «Семейный доктор».
Методы лечения ВПС
В большинстве случаев, лечение врожденных пороков сердца - хирургическое, и в зависимости от анатомии порока, определяют сроки и вид вмешательства.
В целях стабилизации состояния перед планируемым оперативным лечением прибегают к методам терапевтического медикаментозного лечения критических состояний и осложнений ВПС.
Оперативное лечение может быть выполнено экстренно, срочно и в плановом порядке. Кроме того, оперативное лечение может быть радикальным, либо вспомогательное (т.е. проводится гемодинамическая коррекция врожденного порока).
Не занимайтесь самолечением. Обратитесь к нашим специалистам, которые правильно поставят диагноз и назначат лечение.
Читайте также:
- Неатеросклеротическая веретеновидная аневризма головного мозга на КТ, МРТ, ангиограмме
- Стрессовое расстройство (острая реакция на стресс)
- Искусственные (артифициальные, психические) дерматозы у детей
- Современный взгляд на оплодотворение и имплантацию. Достижения ЭКО
- Травматический остеомиелит челюсти после операции. Парез мимических мышц после операции
