Вязкость дыхательных смесей. Легочный поток газа
Добавил пользователь Валентин П. Обновлено: 22.01.2026
Подача газа для дыхания в аппарате может быть трех типов: с постоянной подачей газа, легочно-автоматического типа и комбинированного типа (сочетание постоянной подачи и легочно-автоматической подачи).
Аппарат, работающий на кислородно-азотной смеси, не должен быть только с легочно-автоматической подачей газа для дыхания.
В аппаратах, которые используют только постоянную подачу, поток кислорода должен быть не менее 4,0 дм 3 /мин при снижении давления в баллоне (баллонах) (см. БАЛЛОН ВЫСОКОГО ДАВЛЕНИЯ) до 5 % максимального наполняющего. При снижении давления до 1,0 МПа постоянная подача не должна превышать значения, установленного производителем, на 110 %.
В аппаратах без избыточного давления и легочно-автоматической подачей легочный автомат должен обеспечивать подачу газа не менее 10 дм 3 /мин при открывающем давлении не более 350 Па.
При разрежении не более 500 Па подача должна быть не менее 80 дм 3 /мин, при этом в баллонах должно быть давление не менее 1,0 МПа.
В аппаратах с избыточным давлением и легочно-автоматической подачей при расходе через легочный автомат 10 дм 3 /мин открывающее давление не должно быть отрицательным (давление должно быть больше или равно нулю).
В аппаратах комбинированного типа должна поддерживаться постоянная подача газа не менее 1,2 дм 3 /мин при сопротивлении на вдохе не более 100 Па.
Аппараты, работающие только с легочно-автоматической подачей, или аппараты комбинированного типа с постоянной подачей и не менее 1,2 дм 3 /мин должны иметь устройство для удаления части газовой дыхательной смеси из контура во внешнюю среду, с тем чтобы выполнялись требования.
Аппараты с легочно-автоматической подачей оборудуют устройством, которое в начале дыхания или при открывании вентиля баллона автоматически подает от 5 до 10 л газа в дыхательный контур.
Аппараты, оборудованные редуктором и (или) легочным автоматом, должны иметь ручной клапан дополнительной подачи по типу обратного клапана, обеспечивающий подачу газа не менее 30 дм 3 /мин в обход редуктора и легочного автомата при давлении в баллонах не менее 5,0 МПа. При давлении меньше 5,0 МПа подача должна быть не менее 3/5 Р (дм 3 /мин), где Р — давление в баллонах (в МПа), умноженное на 10.
Клапан дополнительной подачи должен быть защищен от случайного (непреднамеренного) открывания. Если клапан кнопочного типа, то рабочее усилие должно быть не более 20-40 Н.
Проверка подачи газа
Давление в баллоне измеряют манометром класса точности не ниже 2,5. Поток газовой дыхательной смеси измеряют реометром или ротаметром. Вакуумметрическое и избыточное давление измеряют мановакуумметром класса точности не ниже 2,5. Поток газовой дыхательной смеси создают с помощью инжектора или воздуходувки.
Проверка объемной доли кислорода, диоксида углерода и температуры вдыхаемой газовой дыхательной смеси
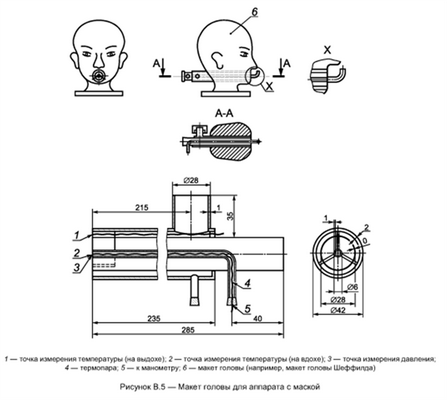
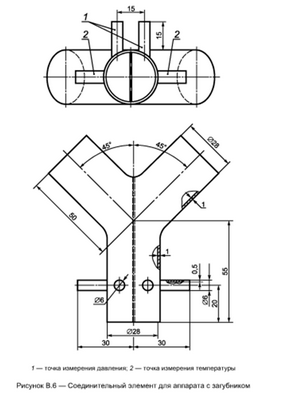
Схема размещения оборудования для данного испытания показана на рисунке В.1. Оборудование состоит из искусственных легких, двух обратных клапанов для вдыхаемой и выдыхаемой газовой дыхательной смеси, холодильника (рисунок В.2), увлажнителя (рисунок В.3), соединительной муфты (рисунки В.4-В.6), прибора для контроля подачи диоксида углерода, анализаторов для диоксида углерода и кислорода и приборов для измерения температуры (см. ТЕМПЕРАТУРА; ТЕМПЕРАТУРНЫЕ РЕЖИМЫ) и давления.
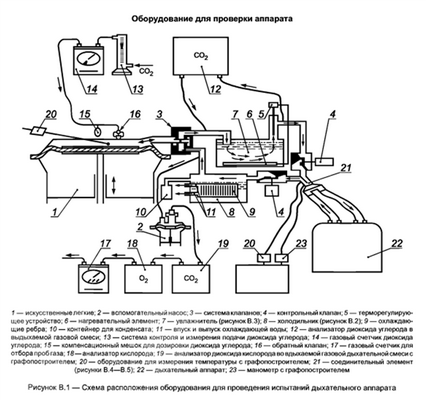
Имитацию дыхания человека создают с помощью искусственных легких. Газовая дыхательная смесь для дыхания остается в контуре, легочная вентиляция газовой дыхательной смеси, измеренная непосредственно после обратного клапана, должна соответствовать величинам, указанным в таблицах 1 и 2, при относительной влажности 95-100 % и температуре (37 + 0,5) °С. Объемная доля диоксида углерода в выдыхаемой газовой дыхательной смеси должна соответствовать величине, указанной в таблице 2, с учетом сухого диоксида углерода, подаваемого в искусственные легкие.
Таблица 1 — Объемная доля диоксида углерода
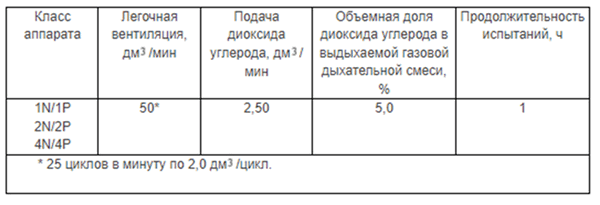
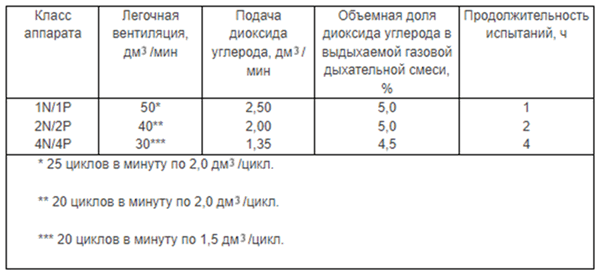
Таблица 6 — Объемная доля диоксида углерода
Диоксид углерода подают в искусственные легкие через контрольно-измерительную систему, компенсационный мешок и два обратных клапана.
Сразу же за увлажнителем небольшое количество выдыхаемой газовой дыхательной смеси постоянно отбирают для анализа объемной доли диоксида углерода и затем возвращают через анализатор в выдыхаемую газовую дыхательную смесь перед увлажнителем.
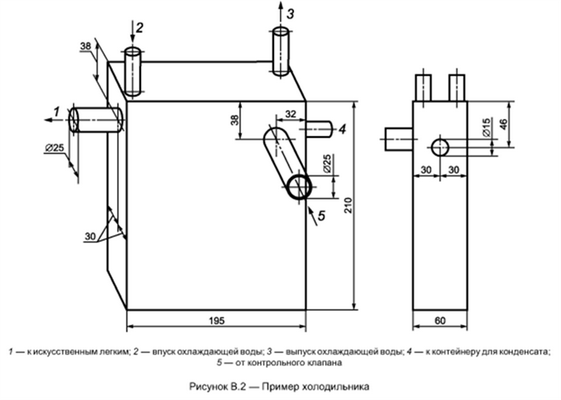
Холодильник объемом 500-1000 мл подключают, как это показано в качестве примера на рисунке В.2. Через холодильник постоянно протекает вода с расходом приблизительно 3 дм 3 /мин.
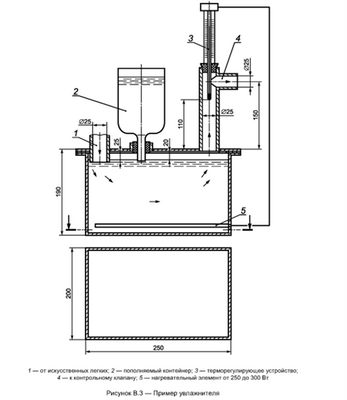
Необходимый увлажнитель показан в качестве примера на рисунке В.3. Температуру выдыхаемой газовой дыхательной смеси устанавливают и контролируют в точке измерения температуры на соединительном элементе (рисунки В.4-В.6) до начала испытаний. Для того чтобы измерить объемные доли диоксида углерода и кислорода во вдыхаемой газовой дыхательной смеси, определенное количество газовой дыхательной смеси изымают непрерывно в указанном месте (рисунок В.1) с помощью вспомогательного насоса в течение фазы вдоха и подают к кислородному анализатору и анализатору диоксида углерода. Объемная доля диоксида углерода в изъятой газовой дыхательной смеси должна соответствовать величинам, указанным в таблице 2. После анализа остаточный объем азота и диоксида углерода, который изымался непрерывно, должен быть возвращен в контур. Общий объем газовой дыхательной смеси (исключая искусственные легкие) испытательного оборудования не должен превышать 2000 мл.
В зависимости от лицевой части аппарата используют различные соединительные элементы для испытаний:
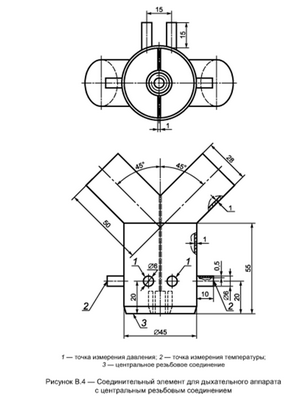
- аппарат с центральным резьбовым соединением — соединительный элемент в соответствии с рисунком В.4;
- аппарат с маской — макет головы (например, голова Шеффилда) в соответствии с рисунком В.5;
- аппарат с загубником — соединительный элемент в соответствии с рисунком В.6.
Температуру вдыхаемой газовой дыхательной смеси измеряют в точках, указанных на рисунках В.4-В.6, с помощью малоинерционной термопары (например, проволочного термоэлемента NiCr-Ni диаметром 0,2 мм).
Объемные доли кислорода и диоксида углерода, температуру вдыхаемой газовой дыхательной смеси и сопротивление дыханию измеряют и записывают непрерывно.
Испытания проводят при температуре окружающей среды (12 + 2) °С и относительной влажности воздуха 85-95 % до полного расходования запаса газа.
5.3. Мониторинг дыхания (респираторный мониторинг).
Понятие респираторного мониторинга включает мониторинг газообмена, а также мониторинг механики легких и грудной клетки.
5.3.1.Мониторинг газообмена
Мониторинг газообмена подразумевает анализ газового состава артериальной и венозной крови, а также выдыхаемого воздуха. Для оценки адекватности газообмена имеет значение определение рН, концентрации бикарбонатов и величины анионного провала. С дидактической точки зрения, можно разделить мониторинг газообмена на мониторинг оксигенации и мониторинг вентиляции.
Мониторинг оксигенации
При проведении мониторинга оксигенации врач должен получить ответы на три вопроса:
•Сколько кислорода может быть доставлено к тканям?
•Какой ценой достался этот кислород организму?
•Как его усвоили ткани?
Для ответа на первый вопрос оценивают напряжение кислорода (рaО2) и насыщения (сатурации) гемоглобина кислородом в артериальной крови (SaО2). Зная эти величины, по формуле рассчитывают содержание кислорода в артериальной крови (Cа - content arterial)
Cа = (0,00138 × SatО2 × Hb) + (0,003 × рa О2)
Умножая эту величину на величину сердечного выброса (CO - cardiac output), измеренного, например, методом термодилюции, можно рассчитать доставку кислорода (DО2 - delivery of oxygen) к тканям:
Не зная, какую долю сердечного выброса получает каждый отдельный орган (например, мозг), нельзя подсчитать, какое точное количество кислорода ему достается.
Для ответа на второй вопрос сравнивают напряжение кислорода в артериальной крови (рaО2) и в воздухе альвеол (РАО2). Величину РАО2 можно или измерить прямо, или рассчитать из так называемого уравнения альвеолярного газа. Прямое измерение возможно при помощи метода быстрой оксиметрии. При использовании этого метода непрерывно измеряют напряжение кислорода во вдыхаемом и выдыхаемом газе. Приборы, предоставляющие возможность измерения этих показателей, обладают низкой инерционностью, оцениваемой по очень быстрому времени отклика (600 мсек и менее).
Для определения РАО 2 интерес представляют конечные порции выдыхаемого газа, то есть фактически газ, выдыхаемый из альвеол. Эффективность обмена кислорода оценивается на основе расчета альвеолоартериального градиента по кислороду:
Р(А- а)О2
Этот показатель имеет нелинейный характер даже у здорового человека и зависит от содержания кислорода во вдыхаемой смеси (FiО2.): при дыхании воздухом он равен 10, при дыхании 100%-ным кислородом - около 100. Кроме того, он зависит от нарушений вентиляционно-перфузионных отношений и изменений венозной сатурации.
Для оценки эффективности кислородообмена большее практическое значение имеет расчет индексов оксигенации. Один из наиболее часто используемых индексов рассчитывается как частное от деления напряжения кислорода в артериальной крови к процентному содержанию кислорода во вдыхаемой смеси, выраженному в долях единицы:
рaО2 / FiО2
В норме этот показатель превышает 350-400 мм рт.ст. Снижение его ниже 300 мм рт.ст. является признаком острого повреждения легких, ниже 200 мм рт.ст. - острого респираторного дистресс-синдрома.
Расчет РАО 2 возможен с помощью уравнения альвеолярного газа, которое с этой целью используется в упрощенном варианте.
Немного физиологии
Уравнение альвеолярного газа в полной его форме представляет собой следующее математическое выражение:
РАО2 = РIО2 - (PAСО2 /RQ) +(PAСО2 × FiО2 × (1 - RQ)/RQ),
где РАО2 - напряжение кислорода в альвеолярном газе, PAС О2 - напряжение углекислоты в альвеолярном газе, РIО2 - напряжение кислорода во вдыхаемом воздухе, FiО2 - доля кислорода во вдыхаемом воздухе, RQ - респираторный коэффициент (respiratory quotent).
Обычно это уравнение используют для расчета респираторного коэффициента, а не РАО2. Данный коэффициент зависит от сопряжения процессов потребления кислорода и выделения углекислоты периферическими тканями, что определяется характером использующихся нутриентов - белков, жиров или углеводов. Он самый высокий при использовании углеводов (1,0), самый низкий при преимущественном поступлении в организм жиров (0,7).
Напряжение кислорода во вдыхаемом воздухе рассчитывается следующим образом:
РIО2 = (барометрическое давление - 47) × FiО2
Величины РАО2 и PAСО2 измеряют прямо в конечно-выдыхаемых порциях дыхательной смеси (то есть в альвеолярном воздухе) методами капнографии и быстрой оксиметрии.
Используя уравнение альвеолярного газа, можно рассчитать респираторный коэффициент, то есть фактически поглощение кислорода и выделение углекислоты на единицу объема вдыхаемого и выдыхаемого воздуха. Сопоставив эти показатели с величиной минутного объема вентиляции, можно оценить величину потребления организмом энергии и подобрать эффективную нутритивную поддержку.
Если величину респираторного коэффициента считать неизменной в течение коротких промежутков времени, то уравнение альвеолярного газа упрощается:
РАО2 = РIО2 - (1,25 × PAСО2),
Измеряя конечно-выдыхаемые величины PAСО2, можно вычислить РАО2. Из этого уравнения следует, что в норме при дыхании воздухом РАО2 равно 100-110 мм рт.ст., при дыхании чистым кислородом - 550 мм рт.ст.
Для ответа на третий вопрос оценивают потребление кислорода и эффективность его обмена. Потребление кислорода может быть рассчитано при помощи прямого и обратного методов Фика.
При использовании прямого метода Фика необходимо измерение напряжения кислорода в воздухе альвеол (РАО2) с помощью метода быстрой оксиметрии. Зная напряжение кислорода во вдыхаемом воздухе (РIО2) и в выдыхаемом воздухе (РА О2), измерив минутный объем дыхания с помощью спирометрии, можно рассчитать количество поступившего в организм и оставшегося в легких кислорода. Вычитая из первой величины вторую, рассчитывают потребление кислорода.
При использовании непрямого метода Фика потребление организмом кислорода является производным сердечного выброса и разницы в содержании кислорода в артериальной (Cа) и венозной (Сv) крови
Содержание кислорода в венозной крови считают по той же формуле, что и Ca, только используют показатели напряжения кислорода и сатурации гемоглобина не в артериальной, а в венозной крови.
Сv = (0,003 х рvО2) + (0,00138 х SvО2 х Hb)
Напряжение кислорода в артериальной и венозной крови, а также сатурацию гемоглобина измеряют инвазивными и неинвазивными способами. При инвазивных способах возможна дискретная и непрерывная оценка. При дискретной оценке повторно исследуют кровь из артерии или вены в газоанализаторе. Для непрерывной оценки SvО2 используют фиброоптические катетеры. Чтобы определить потребление кислорода для всего организма, этот катетер устанавливают в легочную артерию, то есть в сосуд, содержащий смешанную венозную кровь от всего организма. Необходимо предостеречь от использования для анализа крови, взятой из периферической вены. Эта кровь отражает доставку и потребление кислорода только в том периферическом участке, от которого она оттекает, и не может служить средством оценки оксигенации венозной крови в целом. В отличие от венозной, артериальная кровь практически одинакова в любой артерии, и поэтому нет разницы, что анализировать - кровь из аорты, сонной или лучевой артерии.
Кроме описанных методов, возможно также чрескожное (транскутанное) определение р О2 (как впрочем и рСО2), при помощи специальных датчиков с прогреванием кожи под ними. Показания этих датчиков хорошо согласуются с прямым определением рО2 и рСО2 в артериальной крови у детей. Однако нет единого мнения исследователей в вопросе, можно ли метод применять у взрослых пациентов.
Для неинвазивной оценки сатурации гемоглобина артериальной крови используют пульсоксиметрию. Принцип пульсоксиметрии основан на пропускании через ткани пальца или мочки уха параинфракрасного излучения. Излучение частично проходит через ткани, частично задерживается оксигенированным гемоглобином. Величина поглощенного излучения непрерывно меняется с каждым пульсовым сокращением. Анализ этой изменяющейся величины составляет основу пульсоксиметрической оценки сатурации гемоглобина артериальной крови (рис. 5.16).
Измерение потребления и доставки кислорода позволяет оценить зависимость первого показателя от второго. В норме потребление не зависит от доставки. Однако если доставка снижается, то наступает определенный момент, когда потребление тоже начинает снижаться. В тканях постепенно прекращаются зависимые от кислорода процессы (цикл трикарбоновых кислот) и нарастает накопление лактата из-за незавершенного анаэробного гликолиза. Эти взаимоотношения отображаются характерной кривой (рис. 5.17). Большинство исследователей считает, что при сепсисе эта кривая смещается вправо, отражая нарушение утилизации кислорода тканями.
Для изучения указанных процессов нужны независимые методы оценки потребления кислорода (прямой метод Фика с использованием быстрой оксиметрии и спирометрии) и доставки кислорода (непрямой метод Фика с использованием термодилюции и анализа газового состава крови). В ряде научных исследований авторы пытаются получить информацию о доставке и потреблении, используя для измерения и того, и другого показателя только один непрямой метод. Такой подход является методологически неправильным, так как нельзя изучить зависимость или независимость этих двух показателей, сам процесс измерения которых (одним методом!) делает их зависимыми друг от друга.
Мониторинг вентиляции
Мониторинг вентиляции чаще всего сводится к анализу содержания углекислого газа в выдыхаемом воздухе с помощью капнографии и прямому определению напряжения СО2 в крови с использованием газоанализатора.
При проведении анализа содержания углекислого газа нужно соблюдать ряд методологических условий. Главное из них - необходимость определенного промежутка времени перед проведением анализа после изменения параметров вентиляции легких. В организме существуют большие резервуары углекислоты с различной емкостью и скоростью наполнения и высвобождения СО2. Это приводит к значительной отсрочке стабилизации уровня СО2 - через 10 мин после гипервентиляции и 40 мин после гиповентиляции (J.J. Marini, A.P. Wheeler, 1997).
Прямое определение рСО2 в артериальной крови производят обычно одновременно с определением рО2 при заборе проб артериальной крови. Динамический контроль напряжения углекислого газа можно проводить, используя пробы венозной крови, где рСО2 обычно выше на 3-8 мм рт.ст., чем в артерии. Для анализа берут кровь из центральной вены или легочной артерии, но не из периферической вены.
При анализе выдыхаемого газа концентрация СО2 чаще всего представляют в качестве функции времени, реже - функции объема выдыхаемого газа. Изменения СО 2 во времени менее информативны, однако позволяют оценить степень нарушения вентиляционно-перфузионных отношений по форме кривой, мониторировать ритм дыхания, определить наличие гипо- и гипервентиляции (рис. 5.18). При отсутствии изменений нормальной кривой можно оценить напряжение углекислого газа в артериальной крови (рaСО2) по его напряжению в конечно-выдыхаемых (end tidal) порциях альвеолярного воздуха (рETСО 2 ). В норме величина градиента рaСО 2 - рETСО 2 равна 3-8 мм рт.ст. При развитии грубых нарушений вентиляционно-перфузионных отношений (ТЭЛА, ОРДС, аспирации крови и желудочного содержимого в трахею) этот градиент значительно возрастает. Изменяется также форма кривой напряжения углекислого газа в конечно-выдыхаемом воздухе. Минимизация величины рaСО 2 - рETСО 2 может использоваться как метод подбора оптимального РЕЕР.
Более информативно представление концентрации СО 2 в качестве функции объема выдыхаемого газа. Это позволяет определить, кроме указанных показателей, также среднюю концентрацию СО 2 в выдыхаемом газе и рассчитать величину дыхательного мертвого пространства, соотнесенного с дыхательным объемом (рис. 5.19).
Мониторинг механических свойств легких и грудной клетки
Показатели, имеющие клиническое значение для оценки динамики легочных нарушений - податливость (compliance - С), сопротивление (resistance - R), среднее давление в дыхательных путях (mPaw) и аутоРЕЕР.
Податливость.
Податливость - это изменение объема (volume, V), соотнесенное к изменениям давления (pressure, P):
С = ∆V/ ∆P.
Различают податливость легких (СL), грудной клетки (СW) и респираторной системы (СRS), но на практике оценивают обычно только последний показатель. Для расчета величины ∆V при проведении ИВЛ следует учитывать потери части дыхательного объема (VT) в контуре респиратора. Для приблизительного расчета используют специальную величину - фактор компрессии дыхательного контура (circuit compression factor - Сcf). Для большинства дыхательных контуров она считается равной 3 мл кислородно-воздушной смеси на каждый сантиметр водного столба пикового давления, подаваемого респиратором при вдохе.
Для измерения податливости нужно «выключить» с помощью медикаментов спонтанное дыхание больного и измерить давление в дыхательных путях во время пауз вдоха и выдоха (создать так называемые пассивные условия). Для чего нужны эти паузы? Нас интересует давление во всей респираторной системе, но измерить можно только давление на конце интубационной трубки. Чтобы это измеряемое давление отражало показатели давления в альвеолах, в бронхах, трахее и у конца интубационной трубки, создаются короткие паузы в конце вдоха и выдоха. Вследствие этого величины давления в разных частях респираторной системы временно уравниваются. Податливость респираторной системы определяется следующим образом:
СRS = VT × Сcf / PplatoInsp - PplatoExsp,
где PplatoInsp - давление на плато вдоха (inspiration) в условиях окончания вдоха и остановки потока, PplatoExsp - давление на плато выдоха (expiration) в условиях окончания выдоха и остановки потока (рис. 5.20). Нижняя граница нормы для величины податливости системы грудная клетка-легкие - 120-150 мл/см вод. ст. или 1,5-2 мл/см вод.ст на 1 кг массы тела.
Для раздельной оценки податливости грудной клетки и легких необходимо дополнительное измерение давления в пищеводе, которое отражает внутриплевральное давление. В настоящее время средствами раздельной оценки податливости легких и грудной клетки снабжены некоторые современные аппараты ИВЛ, что позволяет оптимизировать проведение респираторной поддержки при тяжелых дыхательных расстройствах.
Сопротивление
Различают инспираторное сопротивление дыхательных путей и экспираторное. Экспираторное сопротивление всегда больше, чем инспираторное, причем эта разница возрастает при патологии. Однако на практике обычно оценивают только инспираторное сопротивление (рис. 5.21):
RI = PD - PplatoInsp /Flow,
где RI - инспираторное сопротивление, Flow - поток (обычно пиковый поток респиратора), PD - пиковое давление в дыхательных путях, PplatoInsp - давление на плато вдоха (в условиях окончания вдоха и остановки потока). Верхняя граница инспираторного сопротивления - 5 см вод.ст./л∙сек. Увеличение инспираторного сопротивления свидетельствует об ухудшении проходимости трахео-бронхиального дерева из-за бронхоспазма, отека, скопления мокроты.
Среднее давление в дыхательных путях
С некоторой долей упрощения можно считать, что среднее давление в альвеолах (alveolar mean pressure, mPalv) соответствует среднему давлению в дыхательных путях (airways mean pressure, mPaw). Среднее давление в альвеолах - это усредненное давление, которое растягивает альвеолы и грудную клетку. Следовательно, mPalv и mPaw определяют артериальную оксигенацию и сопротивление венозному возврату. Для клинических целей нужно понимать, что mPaw увеличивается при возрастании минутного объема дыхания, положительного давления в дыхательных путях в конце выдоха (positive end-expiratory pressure, РЕЕР) и времени вдоха. Эти факторы, с одной стороны, повышают оксигенацию, с другой - снижают венозный возврат и повышают опасность баро- и волюмотравмы легких.
АутоРЕЕР
АутоРЕЕР представляет собой разницу между общим (тотальным) РЕЕР и установленным врачом на панели респиратора показателем положительного давления в дыхательных путях к концу выдоха. Тотальный РЕЕР определяют по показаниям манометра респиратора в конце вдоха при создании экспираторной паузы. Наличие аутоРЕЕР свидетельствует о затруднении выдоха (рис. 5.22). Имеется две основные причины этого состояния. Первая причина - повышение сопротивления в дыхательных путях во время выдоха, вследствие чего вдох начинается при не полностью законченном выдохе. Такая ситуация вызывает постепенное нарастание количества воздуха, задержанного в легких - так называемую дыхательную гиперинфляцию (рис. 5.23). Вторая причина аутоРЕЕР - появление активности мышц вдоха во время не полностью закончившегося выдоха. Мышечная активность отражает несинхронность работы аппарата ИВЛ и дыхательных попыток больного.
Первую причину аутоРЕЕР можно компенсировать увеличением пикового потока вдоха на панели респиратора. Это приводит к укорочению времени вдоха и удлинению времени выдоха. В результате пациент успевает выдохнуть до того, как наступит новый вдох. Причиной гиперинфляции может быть нерациональное использование паузы вдоха, что вызывает избыточное удлинение фазы вдоха. Это состояние компенсируется при исключении паузы вдоха.
Во втором случае появление аутоРЕЕР свидетельствует о нерациональном подборе режимов вентиляции, причиной чего могут быть недостаточные минутный объем дыхания, чувствительность триггера, содержание кислорода во вдыхаемой смеси, аппаратный РЕЕР. Одним из способов подбора оптимального аппаратного РЕЕР является его постепенное повышение до того уровня, когда исчезает аутоРЕЕР.
Расчет податливости, сопротивления, среднего давления в дыхательных путях и аутоРЕЕР производится на основе анализа обычных кривых, отражающих изменение давления в дыхательных путях, объема и потока газа во времени: кривые «давление в дыхательных путях - время», «поток воздуха - время», «объем воздуха - время» (рис. 5.23) Современные респираторы позволяют получать информацию также в виде петель давление-объем (P-V-петля) и поток-объем (F-V-петля) (рис. 5.24).
Принципиально новой информации они не несут, но делают ее представление более наглядным. Например, появление характерного «клюва» на петле давление-объем свидетельствует о снижении податливости легких и их перерастяжении вдуваемым дыхательным объемом. Разорванность петли поток-объем свидетельствует о наличии утечек в контуре аппарата ИВЛ.
Глава 2. Механические свойства легких и общие принципы проведения ИВЛ.
Основными характеристиками респираторной системы являются податливость (комплайнс) и сопротивление (резистанс). Величина податливости и сопротивления определяются давлением, потоком и объемом воздуха в легких. Рассмотрим эти понятия на примере объемного механического вдоха (рис. 2.1).
Для подачи заданного объема кислородно-воздушной смеси необходимо обеспечить определенный дыхательный поток. Его максимальная величина на вдохе называется пиковым инспираторным потоком, максимальная величина на выдохе - пиковым экспираторным потоком. При поступлении воздушного потока в легкие в них подается дыхательный объем и создается некоторое давление (Paw). В начале вдоха это давление максимальное, пиковое (Ppeak). Затем оно снижается. При наличии в конце вдоха паузы, во время которой нет движения воздуха в дыхательных путях, можно определить так называемое давление плато вдоха (Pplat). Отсутствие движения воздуха в дыхательной системе во время паузы вдоха приводит к уравниванию давления в трахее, бронхах, альвеолах. Измеряя величину Pplat датчиком давления, располагающимся у наружного конца интубационной трубки, можно оценить давление в альвеолах в конце вдоха (Palv). С точки зрения газообмена альвеолярное давление является очень важным параметром, поскольку отражает ту движущую силу, которая растягивает альвеолы и обеспечивает градиент давления между ними и легочными капиллярами. Кроме того, от величины Palv зависит венозный возврат к сердцу и вероятность повреждения альвеол. При выдохе происходит снижение Paw до того уровня положительного давления в конце выдоха (positive end expiratory pressure, РЕЕР), которое установлено врачом. Последняя величина называется внешним, или аппаратным РЕЕР. Кроме давления, измеренного возле проксимального конца интубационной трубки, клиническое значение имеет величина давления в нижней трети пищевода (Pes), отражающая колебания давления в плевральной полости.
Если у пациента имеется ограничение выдоха, что бывает, например, при хронической обструктивной болезни легких (ХОБЛ), то воздух может задерживаться в легких. Вследствие этого поступающие новые порции дыхательной смеси приводят к развитию перерастяжения (гиперинфляции) легких. Одним из критериев оценки гиперинфляции является величина непреднамеренного (внутреннего) РЕЕР. Необходимо учесть, что в этом случае истинный РЕЕР может существенно отличаться от внешнего. Подробнее эта проблема будет рассмотрена в разделе, посвященном проведению ИВЛ у больных с ХОБЛ.
Сопротивление дыхательных путей (R) рассчитывают как частное от деления разницы между Ppeak и РЕЕР на величину пикового потока.
R = (Ppeak - РЕЕР) : V’
где V’ - пиковый поток.
Податливость (С) определяется разницей давлений в легких во время вдоха и выдоха при введении в них определенного объема воздуха. Если в расчет принимается разница Pplat и РЕЕР, то податливость называется статической (Сstat).
Строго говоря, для того, чтобы измеряемое респиратором давление соответствовало Pplat, нужно создать достаточно длительную паузу вдоха (обычно не менее 0,5 с). За столь длительный промежуток времени можно достичь уравнивания давления в разных альвеолах. Если столь длительная пауза не выдерживается, то в расчетах используют величину Paw , примерно соответствующую Pplat. В связи с этим показатель податливости называется динамическим (Сdyn).
Величина, обратная податливости, называется эластичностью легких (E).
Величина динамической податливости больше статической и зависит не только от эластических свойств легких, но и от сопротивления дыхательных путей. Для клинической практики важно понимать, что чем меньше податливость и больше сопротивление, тем труднее ввести дыхательный объем в легкие больного. Следовательно, тем большее давление в дыхательной системе для этого нужно создать.
Однако энергия механического вдоха расходуется не только на растяжение легких, но и на преодоление эластичности окружающих структур: грудной клетки и живота, а также повязок и бандажей. На поступление воздуха в дыхательную систему влияют свойства:
1. эндотрахеальной (трахеостомической) трубки,
2. собственно легких,
3. грудной клетки.
Грудная клетка представляет собой мышечно-реберный каркас. Наиболее изменчивы характеристики этого каркаса в его нижней части, которая занята диафрагмой. Смещение диафрагмы в краниальном направлении вследствие повышения внутрибрюшного давления является одной из наиболее частых причин изменения механических свойств грудной клетки.
Поступление воздуха в легкие должно преодолеть силы эластичности. Несколько упрощая реальную ситуацию, можно выделить эластичность самих легких и эластичность грудной клетки. Соответственно раздельно рассматривают податливость легких и грудной клетки. Податливостью эндотрахеальной трубки в виду жесткости ее стенок обычно пренебрегают. Кроме того, воздух, поступающий в легкие, имеет определенную вязкость. Как всякая вязкая среда, воздушный поток преодолевает сопротивление тех структур, с которыми он контактирует. Поэтому различают сопротивление эндотрахеальной трубки и сопротивление дыхательных путей.
Раздельный учет 4 факторов - сопротивления эндотрахеальной трубки (Ret), сопротивления дыхательных путей (Raw), податливости легких (C L ) и податливости грудной клетки (CCW) - лежит в основе четырехкомпонентной модели легких. Использование этой модели полезно в клинической практике, поскольку позволяет рационально подбирать режимы ИВЛ. Влияние всех четырех компонентов приводит к формированию общего показателя - давления в дыхательной системе (Paw):
Величину Paw можно измерить с помощью имеющегося во всех респираторах датчика давления, располагающегося в контуре аппарата ИВЛ. Для оценки отдельных компонентов респираторной системы используют дополнительные датчики давления, вводимые в трахею и пищевод пациента. Раздельную оценку сопротивлений эндотрахеальной трубки и дыхательных путей проводят при сравнении показаний датчиков, располагающихся в контуре аппарата и непосредственно в трахее. Анализ изменений трахеального давления позволяет исключить влияние интубационной трубки и оценивать сопротивление только дыхательной системы (рис. 2.2).
Для определения C L и CCW используют информацию, получаемую также от двух датчиков: обычного, располагающегося у наружного конца интубационной трубки, и пищеводного, вводимого в нижнюю треть пищевода. Показания последнего соответствуют изменениям плеврального давления.
Как известно, в состоянии выдоха давление в альвеолах равняется атмосферному. В нормальной физиологии величину атмосферного давления принято рассматривать как референтную точку, т.е. принимать ее в качестве нуля. В связи с этим во время выдоха в плевральной полости давление, которое ниже атмосферного, считается отрицательным (обычно -5 см вод. ст.). Такая величина давления нужна для уравновешивания эластичности легких и грудной клетки
При вдохе динамика плеврального давления отражает разные физиологические процессы в зависимости от того, является ли вдох спонтанным или механическим. И при спонтанном вдохе, и при механическом происходит растяжение легких. В обоих случаях сила, которая движет воздух в легкие, создается за счет разницы давлений между альвеолами и окружающей средой.
При механическом вдохе давление окружающей среды, создаваемое респиратором, больше давления в альвеолах. Увеличение давления в альвеолах приводит к росту плеврального давления, которое становится положительным. Иными словами, плевральное давление отражает ту силу, с которой растягиваемые респиратором легкие расправляют грудную клетку. Динамика Paw, измеряемого возле наружного конца эндотрахеальной трубки при механическом вдохе, определяется силой, с которой респиратор растягивает суммарно легкие и грудную клетку.
Согласно законам физиологии, эластичность респираторной системы (Ers) равна сумме эластичностей легких (E L ) и грудной клетки (ECW):
Общая податливость респираторной системы (Crs) является результатом совместного влияния C L и CCW. Поскольку податливость - это величина, обратная эластичности, получаем следующую формулу:
Путем дальнейших арифметических действий можно рассчитать податливость грудной клетки:
Иная ситуация возникает при спонтанном вдохе. Градиент давления, движущий воздух в легкие, создается за счет работы мышц вдоха и увеличения грудной клетки в объеме. Отрицательное плевральное давление становится меньше, т.е. еще отрицательнее, что приводит к «засасыванию» воздуха в легкие. Иными словами, изменения плеврального давления при спонтанном вдохе отражают ту силу, с которой грудная клетка растягивает легкие. Из-за активного сокращения дыхательной мускулатуры во время спонтанного вдоха оценить отдельно податливость грудной клетки не представляется возможным. В связи с этим, во время самостоятельного вдоха величина давления, как во всей дыхательной системе, так и в плевральной полости зависит только от податливости легких (C L ).
Зачем нужны описанные физиологические характеристики практикующему реаниматологу? Они необходимы для объяснения современных подходов к проведению респираторной поддержки, которые основаны на четырех основных положениях (Artigas A. et al., 1998):
1. облегчение непереносимой больным работы дыхательной мускулатуры,
2. предупреждение повреждения легких во время ИВЛ,
3. обеспечение оксигенации,
4. поддержание вентиляции (выведения углекислоты).
Подчеркнем, что приведенная последовательность не является случайной. Приоритетными задачами являются первые две. Крайне желательно, чтобы решение остальных задач не вступало в противоречие с ними. Для облегчения непереносимой больным работы дыхательной мускулатуры необходимо создать максимальное соответствие его дыхательного паттерна и работы респиратора. С этой целью нужно подбирать режимы вентиляции, оптимизировать качество триггирования (отклика) респиратора на дыхательные попытки больного, а также использовать оценку состояния механики дыхания конкретного больного.
Для предупреждения повреждения легких во время проведения ИВЛ необходимо предотвращать избыточное повышение давления в альвеолах (баротравму легких), поступление избыточного объема воздуха в легких (волюмотравму) и повторение циклов закрытия-раскрытия альвеол (ателектотравму). Указанные принципы составляют основу лечебной доктрины, называемой «открытыми отдыхающими легкими» («open lung rest»). В многочисленных экспериментальных и клинических работах показано, что невнимание к этим факторам приводит к прогрессированию дисфункции легких и развитию не только дыхательной, но и полиорганной недостаточности из-за выброса из альвеолоцитов повреждающих медиаторов воспаления. Цепь описываемых событий имеет название биотравмы (Plцtz F. et al., 2004).
Для предупреждения баротравмы альвеолярное давление должно быть ограничено величиной 30 см вод. ст. Если у пациента нет проблем с податливостью грудной клетки, то величина давления плато в дыхательных путях соответствует альвеолярному давлению. Поэтому при проведении ИВЛ стараются не превышать давление плато более чем 30 см вод. ст. Для ограничения давления плато при снижении податливости легких приходится уменьшать вводимый дыхательный объем. Доказано, что даже для здоровых легких опасным является длительное применение дыхательных объемов 10-12 мл/кг идеальной массы тела больного и более.
Следует также учесть, что повреждающее действие на легкие оказывают повышенные концентрации кислорода (оксигенотравма). Наиболее вероятный механизм - активация перекисного окисления липидов. Кроме того, избыточное содержание кислорода приводит к низкому содержанию в альвеолах биологически инертного газа азота. Из-за отсутствия азота всасывание кислорода в кровь делает альвеолу безвоздушной, и она спадается. Возникающие при этом микроателектазы называются абсорбционными.
Указанные рекомендации не относятся к пациентам с заболеваниями и поражениями мозга и сердца, которые нуждаются не просто в нормальном, а в повышенном уровне оксигенации. Обеспечение гипероксии неизбежно приводит к использованию таких подходов к ИВЛ, которые повреждают легкие. В связи с этим приходится в каждом конкретном случае выбирать между тактикой предупреждения повреждения легких и обеспечением необходимых параметров газообмена. Обычно из-за опасений гипоксии и гиперкапнии в клинической практике величину дыхательного объема снижают чаще всего только до 7-8 мл/кг.
1. спонтанные вдохи увеличивают венозный возврат и насосную функцию здорового сердца (при левожелудочковой недостаточности наблюдается обратный эффект);
2. дополнительный объем дыхания улучшает оксигенацию артериальной крови и выведение углекислоты;
3. отсутствие борьбы с респиратором снимает избыточную работу мышц вдоха и выдоха, экономит кислород, поступающий в ограниченном количестве из-за поражения легких, и обеспечивает комфорт для больного;
4. во время спонтанного вдоха задние мышечные сегменты диафрагмы сокращаются сильнее, чем передние сухожильные, что улучшает вентиляцию дорсальных отделов легких. Поскольку при механическом вдохе сокращения диафрагмы отсутствуют, то давление органов брюшной полости приводит к преимущественному поступлению воздуха в немногочисленные вентральные альвеолы и спаданию дорсальных.
Отмеченные положительные эффекты сохранения спонтанного дыхания касаются только неглубоких вдохов. При значительной глубине спонтанного вдоха проявляются его негативные эффекты. Важнейшие из них следующие:
1. значительная нагрузка на дыхательные мышцы с нерациональным расходом кислорода;
2. пережатие полых вен перераздутыми легкими с нарушением венозного возврата;
3. значительное растяжение альвеол снаружи, со стороны плевральной полости, что в сочетании с раздуванием их респиратором изнутри приводит к повышению так называемого транспульмонального давления и повреждению легких.
Резюмируя сказанное, можно констатировать принципиальное изменение взглядов на респираторную поддержку в настоящее время. Отметим основные положения:
1. практически полный отказ от нетриггированной вентиляции с максимальным вниманием к сохранению спонтанного дыхания пациента;
2. особое внимание к предупреждению повреждения легких из-за нерационального выбора параметров ИВЛ;
3. отказ от стремления к нормализации газообмена и других показателей гомеостаза в пользу так называемых стресс-норм.
Кроме того, наметился пересмотр отношения к ИВЛ как к методике протезирования легких, которую нужно использовать по возможности реже и отказываться от нее, чем раньше, тем лучше. Отношение изменилось в пользу оценки ИВЛ как лечебного метода при заболеваниях и повреждениях легких, при кардиологических и кардиохирургических проблемах. В связи с этим показания к искусственной вентиляции легких и длительность ее проведения расширены во многих клинических ситуациях.
Отметим, что для проведения рациональной респираторной поддержки необходимо понимание не только физиологических особенностей больного, но и деталей реализации режимов ИВЛ в аппаратах различных классов и моделей. Современные респираторы предлагают врачу не альтернативные варианты проведения ИВЛ, а непрерывную гамму режимов. Цель использования разных режимов и алгоритмов ИВЛ - индивидуальный подход к конкретной клинической ситуации. В связи с этим, автор глубоко убежден, что способность реаниматолога разобраться в физиологии и патофизиологии дыхания, а также в деталях технологии респираторной поддержки является одним из маркеров его профессионализма.
Измерение газообмена
Диффузионная способность легких по монооксиду углерода
Диффузионная способность легких по монооксиду углерода (DLCO) - мера способности газа переходить из альвеол через альвеолярный эпителий и капиллярный эндотелий в эритроциты. DLCO зависит не только от области и толщины альвеолярно-капиллярной мембраны, но также от объема крови в легочных капиллярах. Распределение альвеолярного объема и вентиляции также вызывает изменение показателя.
DLCO определяется с помощью анализа воздуха на содержание монооксида кислорода (СО) в конце выдоха, после того как пациент вдыхает незначительное количество СО, задерживает дыхание и выдыхает. Определяемые показатели DLCO должны быть соотнесены с альвеолярным объемом (который оценивается разведением гелия Легочные объемыПричины снижения DLCO
Заболевания, которые прежде всего повреждают легочную сосудистую сеть, такие как первичная легочная гипертензия Легочная гипертензия Легочная гипертензия - это повышение давления в малом круге кровообращения. В большинстве случаев она является вторичной, в некоторых случаях - идиопатической. При легочной гипертензии происходит. Прочитайте дополнительные сведения и тромбоэмболия легочной артерии Тромбоэмболия Легочной Артерии (ТЭЛА) Тромбоэмболия легочной артерии - это окклюзия легочных артерий тромбами любого происхождения, чаще всего образующихся в крупных венах ног или малого таза. Факторами риска тромбоэмболии легочной. Прочитайте дополнительные сведения и легочный фиброз Идиопатический легочный фиброз Идиопатический легочный фиброз (ИЛФ), наиболее распространенная форма идиопатической интерстициальной пневмонии, вызывает прогрессирующий фиброз легких. Жалобы и симптомы появляются постепенно. Прочитайте дополнительные сведения A). Снижение DLCO также наблюдается у больных после резекции легкого, поскольку объем легких уменьшается, но DLCO соответствует или даже превышает норму при коррекции на VA, поскольку в оставшемся легком увеличивается площадь поверхности сосудов. Пациенты с анемией часто имеют более низкую DLCO, которую необходимо корректировать в зависимости от цветного показателя крови
Причины повышения DLCO
Условия, при которых значения DLCO будут выше, чем прогнозировалось, включают
Во время сердечной недостаточности DLCO увеличивается предположительно вследствие повышения объема крови в легочных капиллярах из-за повышенных легочных венозного и артериального давлений. При эритроцитемии увеличение DLCO обусловлено увеличением количества эритроцитов, а также из-за сосудистого наполнения вследствие возрастания легочного давления, обусловленного повышенной вязкостью крови. При альвеолярном кровотечении эритроциты также могут связывать монооксид углерода в альвеолярном пространстве, увеличивая DLCO. При астме увеличение DLCO связывают с увеличением перфузируемых сосудов, однако согласно некоторым данным, не исключено влияние различных факторов роста, индуцирующих неоангиогенез.
Пульсоксиметрия
Чрескожная пульсоксиметрия оценивает сатурацию кислорода (SpО2) капиллярной крови по поглощению света от светоиспускающих диодов, помещенных в клипсу для пальца или датчик на пластыре. В целом результаты чрезвычайно точные и коррелируют с сатурацией кислорода с погрешностью в пределах 5% (SaО2). Результаты могут быть менее точными у пациентов с
Очень пигментированная кожа
Выраженной системной вазоконстрикцией
Результаты пульсоксиметрии также менее точны при наличии накрашенных ногтей у пациентов.
Пульсоксиметрия способна определять содержание только оксигемоглобина или дезоксигемоглобина, но не другие формы гемоглобина (например, карбоксигемоглобин, метгемоглобин); данные фракции завышают показатели SpO2, когда их ошибочно принимают за оксигемоглобин.
Исследование газового состава артериальной крови (ГСАК)
Исследование газового состава артериальной крови проводится для получения точных значений парциального давления кислорода в артериальной крови (PaO2), парциального давления углекислого газа в артериальной крови (PaCO2) и pH артериальной крови; эти показатели, откорректированные с учетом температуры пациента, позволяют рассчитать уровень бикарбоната (который может также быть измерен непосредственно в венозной крови) и SaO2. С помощью исследования газового состава также можно точно измерить уровень карбоксигемоглобина и метгемоглобина.
Обычно для взятия образцов артериальной крови используется лучевая артерия. Поскольку артериальная пункция может в редких случаях приводить к тромбозу и ухудшению перфузии дистальных отделов, вначале выполняется тест Аллена. Он позволяет оценить адекватность коллатерального кровообращения. При выполнении этой пробы одновременно пережимаются лучевая и локтевая артерии до тех пор, пока рука пациента не станет бледной. После этого локтевую артерию отпускают, в то время как давление на лучевую артерию продолжается. Появление розовой окраски во всей руке в течение 7 секунд после ослабления давления указывает на адекватный кровоток через локтевую артерию.
В стерильных условиях игла калибром 22-25G, присоединенная к гепаринизированному шприцу, вводится проксимальнее места максимальной пульсации лучевой артерии и продвигается немного дистальнее в артерию, пока не восстановится пульсация. Систолическое артериальное давление обычно является достаточным, чтобы выдвинуть поршень шприца обратно. После забора 3-5 мл крови игла быстро извлекается, и место пункции сильно прижимается для осуществления гемостаза. Одновременно образец артериальной крови помещается в лед (для уменьшения потребления кислорода и продукции углекислого газа лейкоцитами) и посылается в лабораторию.
Оксигенация
Гипоксемия - это снижение парциального давления кислорода (PO2) в артериальной крови; гипоксия - это снижение РO2 в тканях. Исследование газового состава точно определяет наличие гипоксемии, которая обычно определяется как достаточно низкое значение РаO2, способное уменьшить SaO2 ниже 90% (т.е. РаO2 60 мм рт.ст.). Патологические формы гемоглобина (например, метгемоглобин), более высокая температура, низкий pH и высокий уровень 2,3-дифосфоглицерата уменьшают гемоглобин SaO2, несмотря на адекватный РаO2, как показано на кривой диссоциации оксигемоглобина.
Кривая диссоциация оксигемоглобина
Насыщение артериальной крови оксигемоглобином соответствует P o 2. P o 2 при сатурации 50% (P50) обычно соответствует 27 мм.рт.ст.
Кривая диссоциации смещается вправо при увеличении концентрации ионов водорода (Н + ), увеличении в эритроцитах 2,3-дифосфоглицерата, повышении температуры (Т) и увеличении P co 2.
Снижение уровня Н + , ДФГ, температуры и P co 2 вызывает смещение кривой влево.
Гемоглобин, характеризующийся смещением кривой вправо, имеет пониженное сродство к кислороду, а гемоглобин, характеризующийся смещением кривой влево, имеет повышенное сродство к кислороду.
Причины гипоксемии классифицируют в зависимости от значения (повышение или норма) альвеолярно-артериального градиента PО2 по кислороду ([A-а]DО2), который определяется как разница между альвеолярным напряжением кислорода (PAО2) и PaО2. РAO2 рассчитывается следующим образом:
где FIO2 - содержание кислорода во вдыхаемом воздухе (например, в комнатном воздухе - 0,21), Patm - барометрическое атмосферное давление (например, 760 мм рт.ст. на уровне моря), PH2O - парциальное давление водяного пара (обычно 47 мм рт.ст.), PaСО2 - измеренное парциальное давление углекислого газа в артериальной крови, R - дыхательный коэффициент, который принимают за 0,8 у пациента в состоянии покоя при обычном питании.
Для пациентов, находящихся на уровне моря при дыхания комнатным воздухом, FIO2 = 0,21 и (A-а) DO2 можно упростить следующим образом:
Гипоксемия с повышенным (А-а) DO2
Гипоксемия с повышенным (Aa)DO2 вызвана
Низкое вентиляционно-перфузионное (V/Q) соотношение (разновидность вентиляционно-перфузионного несоответствия)
Шунтирование крови справа налево
Серьезное нарушение диффузионной способности
Низкое отношение V/Q (вентиляционно-перфузный индекс) является наиболее распространенной причиной гипоксемии. Она вносит свой вклад в усиление гипоксемии при ХОБЛ Хроническая обструктивная болезнь легких (ХОБЛ) Хроническая обструктивная болезнь легких (ХОБЛ) - ограничение воздушного потока, вызванное воспалительным ответом на вдыхаемые токсины, чаще всего сигаретный дым. Менее распространенными причинами. Прочитайте дополнительные сведения и бронхиальной астме Астма Бронхиальная астма - заболевание, характеризующееся диффузным воспалением дыхательных путей с разнообразными пусковыми механизмами, которое приводит к частично или полностью обратимому бронхоспазму. Прочитайте дополнительные сведения . В норме региональная перфузия соответствует региональной вентиляции благодаря вазоконстрикции артериол, которая развивается в ответ на альвеолярную гипоксию. При патологии нарушение регуляции приводит к перфузии альвеолярных участков, которые недостаточно вентилируются (вентиляционно-перфузионное несоответствие). В результате венозная кровь проходит через легочные капилляры, не достигая нормальных уровней PaO2. Несоответствие V/Q также может возникать при увеличении кровотока даже при нормальной вентиляции, как при болезнях печени. Дополнительный кислород позволяет скорректировать гипоксемию, вызванную низким вентиляционно-перфузионным соотношением, за счет увеличения PAО2, хотя (A-a)DО2 сохраняется повышенным.
Шунтирование крови справа налево является ярким примером низкого вентиляционно-перфузионного соотношения. При шунтировании дезоксигенированная легочная артериальная кровь поступает в левую половину сердца, не пройдя через вентилируемые сегменты легкого. Шунтирование может проходить через паренхиму легкого, через патологические связи между легочными артериальными и венозными сосудами или через патологические анатомические структуры в сердце (например, открытое овальное отверстие). При наличии подобного шунтирования справа налево устранить гипоксемию с помощью кислородотерапии не представляется возможным.
Сниженная диффузионная способность редко встречается изолированно; обычно она сопровождается низким вентиляционно-перфузионным соотношениями. Поскольку кислород полностью насыщает гемоглобин только после контакта крови с воздухом, гипоксемия из-за сниженной диффузионной способности встречается только при увеличенном сердечном выбросе (например, во время физической нагрузки), при низком атмосферном давлении (например, на высоте в горах) или при разрушении > 50% легочной паренхимы. Как при низким вентиляционно-перфузионном соотношении, (A-a)DO2 увеличен, но PaO2 может быть быстро увеличен благодаря увеличению FIO2. Гипоксемия, развивающаяся вследствие нарушения диффузионной способности, корректируется с помощью кислородотерапии.
Читайте также:
