Заболевание, связанное с линейным отложением иммуноглобулина А
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Линейный IgА-зависимый буллезный дерматоз — редкое иммуноопосредованное пузырное заболевание кожи, характеризуется наличием гомогенного линейного отложения IgA на базальной клеточной мембране. Первоначально дерматоз рассматривали как разновидность герпетиформного дерматита Дюринга [1], однако в настоящее время эти заболевания четко разграничены на основании иммунопатологических и иммуногенетических признаков, а также в связи с отсутствием устойчивой ассоциации линейного IgA-дерматоза с глютенчувствительной энтеропатией.
По данным англоязычной литературы [2], частота встречаемости заболевания в европейской популяции варьирует от 0,2 до 1 случая на 1 млн населения в год. Различают детскую и взрослую формы заболевания, в детском возрасте линейный IgA-зависимый дерматоз манифестирует в первые месяцы жизни, нередко после перенесенных инфекционных заболеваний. Как правило, взрослую форму наблюдают преимущественно у лиц зрелого возраста, чаще заболевание возникает у женщин после 60 лет, нередко — у больных лимфомой, злокачественными неоплазмами внутренних органов [3]. Отмечается ассоциация дерматоза с HLA-В8 практически у всех больных [1, 2].
Клиническая картина может имитировать герпетиформный дерматит, буллезный пемфигоид и рубцующий пемфигоид [4]. Характер кожных проявлений чрезвычайно полиморфный. Патологический процесс представлен везикулами и пузырями с напряженной покрышкой, прозрачным или геморрагическим содержимым, с тенденцией к группировке, а также к образованию гирляндоподобной формы, в ряде случаев кольцевидных очертаний; высыпания располагаются на видимо неизмененном или гиперемированном участке кожи. Наряду с везикулезно-буллезными элементами наблюдают единичные уртикарные и папулезные высыпания, эрозии и геморрагические корочки. В основном высыпания локализуются на разгибательных поверхностях конечностей, туловище, ягодицах и лице (чаще в периоральной области). Больных беспокоит интенсивный зуд в местах высыпаний [1, 2]. Возможно также вовлечение в патологический процесс слизистых оболочек любой локализации (наиболее часто поражаются глаза и полость рта) [5]. Поражение слизистой оболочки ротовой полости обычно представлено болезненными эрозиями, образующимися после вскрытия пузырей. Помимо глаз и полости рта, могут поражаться слизистые оболочки других органов — гортани, глотки, трахеи, пищевода, бронхов, влагалища [1, 3].
В большинстве случаев причину развития заболевания выявить не удается, однако развитие могут провоцировать инфекционные заболевания, злокачественные опухоли, системные заболевания, прием лекарственных средств [6], интенсивная инсоляция, термические ожоги [2]. Чаще всего наблюдается ассоциация со злокачественными новообразованиями (неходжкинская лимфома с последующим хроническим лимфоцитарным лейкозом, почечно-клеточная карцинома и рак мочевого пузыря), воспалительными заболеваниями кишечника (неспецифический язвенный колит и болезнь Крона), системной красной волчанкой [2, 7].
Гистопатологическое исследование биоптата кожи у пациентов с линейным IgA-зависимым буллезным дерматозом выявляет субэпидермальный пузырь со скоплением нейтрофилов в верхних слоях дермы (микроабсцессы сосочкового слоя), также возможно присутствие мононуклеаров и эозинофилов [1]. Однако бывает трудно дифференцировать линейный IgA-дерматоз от других аутоиммунных субэпидермальных буллезных дерматозов только по клиническим и гистологическим признакам. В связи с этим рекомендовано проведение прямой (ПИФ) [8] и непрямой иммунофлюоресценции необработанной и/или расщепленной солевым раствором кожи либо иммуноэлектронной микроскопии (ИЭМ). При ПИФ обычно наблюдают линейное отложение IgA вдоль зоны базальной мембраны, реже выявляют сочетанное присутствие IgG, IgM или C3-комплемента [3, 5, 8]. Таким образом, выделяют классические случаи с преобладанием фиксации IgA (линейный IgA-дерматоз), а также смешанные формы аутоиммунных буллезных заболеваний (линейный IgG/IgA-дерматоз или линейный IgA/IgG-дерматоз). РНИФ используют для обнаружения циркулирующих IgA-аутоантител, положительный результат регистрируют у 30-50% пациентов с линейным IgA-буллезным дерматозом. ИЭМ позволяет определить точное расположение иммунных депозитов в lamina lucida или в lamina/sublamina densa [2].
Лечение линейного IgA-буллезного дерматоза проводят в зависимости от тяжести течения заболевания. При легкой форме достаточно эффективно применение топических кортикостероидных средств в качестве монотерапии. Системным препаратом терапии первой линии при более тяжелом течении является дапсон [1, 3]. При наличии противопоказаний к его применению используют сульфаниламидные препараты. При отсутствии эффективности от проводимой терапии возможно назначение системных кортикостероидных препаратов [9]. Терапия резерва включает плазмаферез и системное введение иммуноглобулинов. Лечение проводят до достижения клинической ремиссии [2, 10].
Клиническое наблюдение
Пациентка Ф., 1937 года рождения, поступила в Клинику им. В.Г. Короленко с жалобами на высыпания на коже волосистой части головы, туловища, верхних и нижних конечностей, сопровождаемые постоянным интенсивным зудом в местах высыпаний. Считает себя больной с 2007 г., когда впервые появились высыпания на коже спины на фоне погрешности в диете, в связи с чем обратилась к дерматологу по месту жительства, диагноз и проводимое лечение уточнить затрудняется. Отмечен положительный эффект после проведенного лечения. В 2009 г. высыпания распространились на кожу туловища, верхних и нижних конечностей, в связи с чем госпитализирована в дерматологический стационар (выписной эпикриз не предоставлен), где клинически, со слов, диагностирован герпетиформный дерматит Дюринга. В объеме проводимой терапии получала дапсон (дозу и кратность приема препарата уточнить затрудняется) с временным положительным эффектом. Рекомендован дальнейший прием препарата дапсон амбулаторно, который пациентка самостоятельно отменила после выписки из стационара. В дальнейшем отмечала периоды обострений кожного патологического процесса, которые самостоятельно купировала эпизодическим приемом препарата дапсон с временным положительным эффектом. Неоднократно лечилась амбулаторно и стационарно (последняя госпитализация в 2016 г. в условиях дневного стационара по месту жительства. Терапия включала преднизолон таблетированный (кратность и дозу препарата уточнить затрудняется), наружно бетаметазона дипропионат мазь) с временным положительным эффектом; рекомендован дальнейший прием преднизолона амбулаторно под контролем дерматолога по месту жительства (последний прием преднизолона в 2016 г.). В сентябре 2018 г. на фоне погрешности в диете появились высыпания на коже волосистой части головы, туловища, верхних конечностей, поэтому самостоятельно принимала дапсон по 1 таблетке 2 раза в день в течение 4 дней, с последующей отменой из-за отсутствия препарата. На фоне лечения отметила ухудшение кожного процесса в виде распространения высыпаний, усиления интенсивности зуда в местах высыпаний. Обратилась к дерматологу по месту жительства и направлена на стационарное лечение в Клинику им. В.Г. Короленко.
Локальный статус при поступлении: патологический процесс на коже носит распространенный, островоспалительный характер. На коже волосистой части головы, туловища, верхних и нижних конечностей на умеренно отечном эритематозном фоне везикуло-буллезные элементы диаметром до 1 см, полусферической формы, с плотной покрышкой, заполненные серозным прозрачным содержимым, преимущественно на коже боковых поверхностей туловища, с тенденцией к группировке, на поверхности эритематозных очагов фестончатых очертаний эрозивные дефекты с серозно-геморрагическими корочками на поверхности (рис. 1). Симптомы Никольского, Асбо-Ханзена отрицательные. Слизистые оболочки свободны от высыпаний.
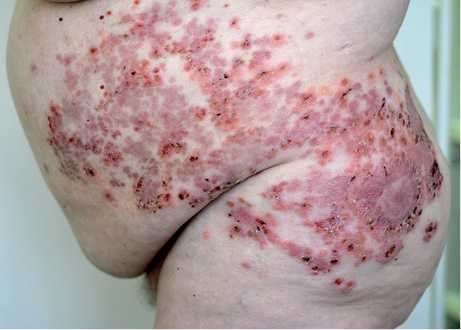
Рис. 1. Очаги поражения на боковой поверхности туловища.
Fig. 1. Lesions on the lateral surface of the trunk.
В условиях стационара с целью дообследования исследован цитоз пузырной жидкости, акантолитические клетки не обнаружены, э. 4%. Клинический анализ крови: умеренная эозинофилия до 7% (норма до 5%), остальные показатели в пределах референсных значений. Биохимический анализ крови: повышение уровня глюкозы до 6,7 ммоль/л (норма до 6,1 ммоль/л). Гликемический профиль: уровень гликемии натощак 6,9 ммоль/л, после нагрузки 9,9 ммоль/л. Проведен бактериологический посев отделяемого с элемента на коже туловища, выявлены рост Staphylococcus Cohnii (-), чувствительность к амоксиклаву, цефазолину, цефуроксиму, цефтриаксону, фузидиевой кислоте.
Консультирована терапевтом, неврологом, эндокринологом, выявлены сопутствующие заболевания: артериальная гипертензия II стадии, 2-й cтепени, риск ССО 4. ЦВБ. ХИГМ сложного генеза. Сахарный диабет II типа, компенсация.
Целевой уровень HbA1c
На основании данных анамнеза и клинической картины заболевания выставлен предварительный диагноз: герпетиформный дерматит Дюринга. Проведена терапия дапсоном в дозе 50 мг по 1 таблетке 2 раза в день, 6 дней с однодневным перерывом, десенсибилизирующими, антибактериальными, антигистаминными препаратами, наружное использование растворов анилиновых красителей, топических глюкокортикостероидных средств.
С целью верификации диагноза выполнены патоморфологическое и иммунофлюоресцентное исследования. Диагностическая биопсия кожи: в биоптате мультилокулярный субэпидермальный пузырь с нечетким дном, заполненный фибрином и нейтрофилами. В дерме периваскулярные лимфогистиоцитарные с примесью эозинофилов и нейтрофилов инфильтраты, в отдельных дермальных сосочках микроабсцессы из нейтрофилов. При проведении реакции прямой иммунофлюоресценции с мечеными FITC антителами к IgA, c3c, IgM, IgG на замороженных срезах определяется линейное свечение IgA вдоль базальной мембраны; отсутствие свечения с3с вдоль базальной мембраны; отсутствие свечения IgM вдоль базальной мембраны; отсутствие свечения IgG. Заключение: совокупность данных гистологической и иммуноморфологической картин более всего соответствует линейному IgA-дерматозу (рис. 2).
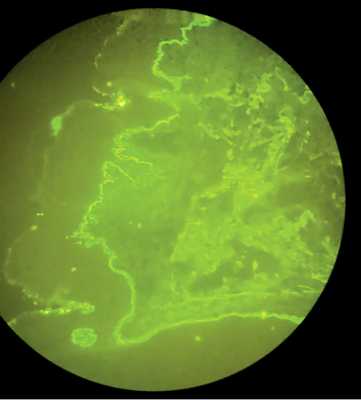
Рис. 2. IgA-линейное отложение.
Fig. 2. IgA linear deposition.
С учетом анамнеза заболевания, клинической картины, лабораторных методов исследования, данных гистологического и иммунофлюоресцентного методов исследования диагностирован линейный IgA-дерматоз.
Пациентка выписана с рекомендациями продолжить прием препарата дапсон 50 мг по 1 таблетке 2 раза в день по следующей схеме: 6 дней с однодневным перерывом и дальнейшей коррекцией дозы под строгим контролем дерматолога по месту жительства, с учетом динамики кожного процесса, контроля клинического анализа крови.
Данное клиническое наблюдение представляет особый интерес в связи с редкой встречаемостью линейного IgА-дерматоза. Клиническая картина заболевания (наличие буллезных элементов на умеренно отечном эритематозном фоне, сгруппированность пузырных элементов, присутствие интенсивного зуда) имитировала герпетиформный дерматит Дюринга, с которым пациентку наблюдали на протяжении длительного периода. Соблюдение определенного алгоритма диагностических критериев позволяет своевременно выставить диагноз. При гистологическом исследовании в сосочках дермы определены нейтрофильные микроабсцессы, что характерно и для герпетиформного дерматита Дюринга. Полученные данные подтверждают сложность дифференциальной диагностики этих дерматозов без использования иммунофлюоресцентного метода исследования. Только проведение ПИФ позволило достоверно диагностировать линейный IgA-зависимый дерматоз.
Заключение
Линейный IgA-зависимый буллезный дерматоз является гетерогенной группой везикуло-буллезных заболеваний кожи и слизистых оболочек. Диагноз в настоящее время возможно установить только на основании иммунофлюоресцентного метода. Приведенный случай представляет интерес в связи с редкостью патологии в клинической практике, тяжестью течения заболевания (большой площадью кожного патологического процесса, интенсивным зудом в местах высыпаний), сложностью дифференциально-диагностического поиска, что требует дальнейшего обобщения опыта для своевременной постановки диагноза.
Заболевание, связанное с линейным отложением иммуноглобулина А
Линейный IgA-буллёзный дерматоз (LABD), также известный как линейный IgA-дерматоз или линейное IgA -заболевание, это относительно редкое заболевание, характеризующееся везикулобуллезными субэпидермальными высыпаниями, которые могут возникнуть как у взрослых, так и детей.
У детей это заболевание известно, как "хроническая буллезная болезнь детства" и имеет ярко выраженные клинические признаки, но основной патогенез заболевания остается неизвестным. При взрослой форме заболевания необходимо тщательно изучать лекарственную этиологию (1, 2, 3).
Этиология
Основной этиологией LABD являются циркулирующие IgA-антитела к базальной мембране, направленные против 97 кДа-части BPAG2 (антиген буллёзного пемфигоида 2) в светлой пластинке (4, 5, 6).
Как уже упоминалось ранее, медикаменты являются частой основной причиной LABD у взрослых. Наиболее часто вызывающим LABD препаратом является ванкомицин, который является причиной почти в 50% случаев лекарственно-индуцированного LABD , но другие антибиотики, включая пенициллины, цефалоспорины и редко сульфаниламидные антибиотики, могут вызывать ложное образование антител IgA, усугубляющих клиническую картину LABD . Другие часто используемые лекарства включают ИАПФ (в частности, каптоприл), класс НПВП (диклофенак, напроксен и другие) и фенитоин.
Эпидемиология
LABD может возникать во всех возрастных диапазонах (у взрослых и детей), причем средний возраст начала заболевания у взрослых приходится на 2 отдельных пика: один - в подростковом и раннем взрослом возрасте, а другой - на шестом десятилетии жизни. У детей возраст начала заболевания классически относится к "дошкольным годам" (средний возраст 4,5 года). Предполагаемая заболеваемость колеблется от 0,2 до 2,3 на 1 000 000 миллионов в год.
Патофизиология
Основной причиной LABD являются циркулирующие антитела IgA к базальной мембране, направленные против 97 кДа части BPAG2 (антиген буллёзного пемфигоида 2, также известный как BP180) в светлой пластинке. Субъединица 97 кДа находится в хорошо известном домене NC16A молекулы BPAG2.
Кроме того, у некоторых пациентов могут проявляться аутоантигены по отношению к LAD-1 (укороченный домен BPAG2 на 120 кДа). При буллезном пемфигоиде (БП) циркулирующие IgG-антитела связываются с областью MCW-1 домена NC16A, которая находится ближе к амино-концу, в то время как субъединица 97 кДа находится на карбоксильном конце. Патофизиология суб-пластинчатого варианта поражения области тёмной пластинки остается малоизученной, но есть подозрение, что коллаген VII типа является основным антигеном.
Существуют различные теории относительно потенциальных причинных факторов в выработке атакующих антител IgA и включают инфекционную этиологию, аутоиммунную природу, индукцию вторичной злокачественности или желудочно-кишечное заболевание.
Генетическая предрасположенность также может быть частично ответственна за развитие хронической буллезной болезни детского возраста или LABD , и несколько типов человеческих лейкоцитарных антигенов (HLA) были вовлечены как предикторы повышенного риска развития заболевания. HLA-B8, HLA-DR3, HLA-DQ2 и HLA-cw7 хорошо известны своей ассоциацией как с детскими, так и со взрослыми вариантами LABD.
Гистопатология
Полное гистопатологическое исследование тканей пациента с подозрением на LABD должно включать в себя исследование как стандартного образца, окрашенного гематоксилином, так и эозином (H и E), а также прямую иммунофлуоресценцию (DIF). При рутинном окрашивании Н и Е наблюдается субэпидермальный буллёзный процесс с преобладанием нейтрофильного инфильтрата.
На ранних стадиях заболевания этот нейтрофильный инфильтрат может локализоваться в основном в дермальных сосочках и быть ошибочно принят за "папиллярный дермальный нейтрофильный инфильтрат", наблюдаемый при герпетиформном дерматите.
Позже в процессе заболевания, после того как субэпидермальное расщепление становится очевидным, большое количество эозинофилов может смешиваться с нейтрофильным инфильтратом в дерме. Это создает диагностическую дилемму, потому что буллезный пемфигоид может иметь сходные признаки.
Одна из подсказок, которая может помочь эксперту больше склониться к диагнозу LABD , а не ДГ или АД, - это то, как нейтрофилы, почти "выстраиваются" на базальной мембране. Как правило, окончательный диагноз LABD не может быть однозначно поставлен только на основе H и E. Таким образом, DIF по-прежнему имеет важное значение для постановки диагноза везикулобуллезного дерматоза.
Иммунопатология остается золотым стандартом для установления диагноза LABD или хронической буллезной болезни детского возраста, причем классическими признаками являются линейные отложения IgA в зоне базальной мембраны. Существуют два гистопатологических подтипа заболевания, которые классифицируются по локализации отложения IgA.
Наиболее распространенным вариантом является подтип, при котором IgA откладывается в области светлой пластинки, за которым следует вариант, при котором IgA откладывается в области тёмной пластинки.
Клиника и данные физикального обследования
LABD у взрослых может иметь различные проявления, что затрудняет его отличие от других аутоиммунных везикулобуллезных заболеваний, таких как буллезный пемфигоид (БП). У пациентов могут наблюдаться диссеминированные, напряженные буллы на фоне невоспаленной кожи, в то время как у других может развиться герпетиформный вид этих высыпаний с заметной эритемой на фоне пузырьков или булл.
Поражения обычно имеют широкое распространение и обычно затрагивают туловище и конечности, но могут также затрагивать кожу головы, область гениталий или лицо. Поражения обычно имеют широкое распространение и обычно затрагивают туловище и конечности, но могут также затрагивать кожу головы, область гениталий или лицо.
У некоторых пациентов может наблюдаться увеличение кольцевидных везикулобуллезных бляшек или даже проявления, имитирующие токсический эпидермальный некролиз (ТЭН). При хронической буллезной болезни детей классическая клиническая картина включает кольцевые эритематозные поражения с кольцом везикул, обычно называемым "короной из драгоценных камней" или "ниткой жемчуга".
У детей поражения чаще всего возникают на животе, нижней части спины, бедрах, паховой области, а также вокруг глаз и рта. "Корона из драгоценных камней" или "нитка жемчуга" встречается реже у взрослых.
Как и многие другие аутоиммунные везикулобуллезные заболевания, такие как пузырчатка обыкновенная (PV), БП и рубцовый пемфигоид (CP), LABD также может сопровождаться поражением слизистой оболочки примерно у 50% пациентов, что делает исследование поверхности слизистой оболочки, таких как слизистая оболочка полости рта, конъюнктивы, носа и области половых органов важным компонентом полного обследования у пациентов с подозрением на везикулобуллезные заболевания.
Как и при CP , вовлечение слизистой оболочки при LABD может привести к значительному рубцеванию. Наиболее часто поражаются слизистые оболочки полости рта и конъюнктивы. Интересно, что лекарственно-индуцированный LABD , особенно вызванный ванкомицином, имеет тенденцию к гораздо более тяжелому течению и может имитировать токсический эпидермальный некролиз (ТЭН) и даже иметь положительный симптом Никольского.
Как взрослая, так и детская форма LABD может варьировать симптоматически от полностью бессимптомной до проявлений легкого или сильного зуда или жжения.
Обследование
Безусловно, наиболее важным аспектом подготовки к лабораторному обследованию является получение биопсий для гистопатологического исследования. Необходимо провести две панч-биопсии: одну для рутинного окрашивания гематоксилином и эозином (H и E), а другую-для прямой иммунофлуоресценции (DIF).
Биопсия для рутинных H и E должна быть получена из очага поражения кожи, в то время как образец для DIF должен быть получен из рядом расположенных участков кожи. Дополнительное обследование может включать непрямую иммунофлуоресценцию ( IIF ) для выявления наличия или отсутствия циркулирующих антител IgA к зоне базальной мембраны, которые могут быть обнаружены у 70% пациентов с LABD , но не обнаруживаются у пациентов с DH .
В подтипе, связанным с поражением lamina lucida LABD эти антитела будут адгезироваться в salt-split skin test (эпидермальная сторона), в то время как при подтипе, связанном с поражением lamina densa антитела будут адгезироваться в нижней части (дермальная сторона).
Тщательный анамнез и физикальное обследование могут значительно помочь клиницисту поставить диагноз LABD , даже до того, как будет получено заключение патоморфолога. Полный обзор лекарств, включая все безрецептурные лекарства, а также витамины и минеральные добавки, имеет решающее значение для исключения лекарственной LABD (9, 10, 11).
Лечение / Ведение пациентов
С момента первоначального открытия LABD в 1970-х годах рассматривалось множество различных вариантов лечения, но наиболее часто используемым лекарством для лечения этого расстройства является пероральный дапсон. К счастью, имеется хорошая чувствительна к дапсону, и улучшение может быть замечено в течение 2-3 дней после начала приема препарата.
Для успешного лечения заболевания требуются относительно низкие дозы дапсона, в среднем 100 мг в день для взрослых, в то время как детям обычно требуется от 1 до 2 мг/кг в день. Пациенты, принимающие дапсон, должны находиться под пристальным наблюдением на предмет развития гемолитической анемии, агранулоцитоза, синдрома гиперчувствительности к дапсону, лейкопении, холестатической желтухи, периферической невропатии и нефротического синдрома.
Иногда пациентам также может потребоваться дополнительное введение пероральных кортикостероидов для достижения достаточного контроля над заболеванием. Сульфапиридин остается еще одним вариантом лечения (12, 13).
Интересно, что многочисленные антибиотики, такие как группа тетрациклинов, диклоксациллин и триметоприм-сульфаметоксазол, также доказали свою эффективность в терапии данного заболевания, но никакого специфического возбудителя, лежащего в основе инфекционной этиологии заболевания, никогда не было обнаружено.
У пациентов с лекарственно-индуцированным LABD , вызванным ванкомицином, можно добиться эффекта, прекратив прием ванкомицина, затем ввести другой антибиотик, такой как доксициклин, с дополнительным преимуществом относительно антимикробного спектра; он также может служить потенциальным препаратом для лечения LABD . Никотинамид 1,5 г в день может быть полезен в качестве дополнительного лечения.
Дифференциальная диагностика
Дифференциальный диагноз при LABD должен включать другие везикулобуллезные заболевания, такие как герпетиформный дерматит, буллезный пемфигоид, буллезный эпидермолиз, приобретенное буллезное импетиго или распространенная пузырчатка.
К сожалению, иногда может наблюдаться смешанное линейное отложение как IgG, так и IgA на базальной мембране, что создает диагностические трудности. Существуют различные варианты классификации этого специфического паттерна осаждения как буллезного пемфигоида, так и LABD .
Прогноз
Прогноз как для LABD , так и для его педиатрического варианта "хронической буллезной болезни детства" в целом благоприятный. Спонтанная ремиссия может наблюдаться у 30-60% взрослых пациентов, как правило, только после нескольких лет активного течения заболевания.
У детей болезнь имеет тенденцию к спонтанной ремиссии в течение 2-4 лет после начала заболевания, что является обнадёживающим фактом для родителей. Поскольку системная терапия может маскировать спонтанную ремиссию пациента, общая рекомендация состоит в том, чтобы периодически пытаться отменить эти лекарства для оценки вероятности ремиссии заболевания.
Медикаментозная LABD также имеет хороший прогноз: в большинстве случаев ремиссия наступает в течение 2-6 недель после прекращения приема стимулирующего препарата.
Консультации
Пациенты с подозрением на везикулобуллезное заболевание должны быть направлены к дерматологу. У пациента с установленным диагнозом линейного IgA -буллезного дерматоза с подозрением на ассоциированное желудочно-кишечное заболевание, аутоиммунное заболевание или злокачественное новообразование пациент должен быть направлен к соответствующим специалистам.
Другие аспекты
- Всегда следует заподозрить медикаментозную LABD у взрослых с первично установленным диагнозом LABD .
- Хроническая буллезная болезнь детского возраста имеет благоприятный прогноз, поскольку большинство случаев спонтанно разрешаются в течение нескольких лет после начала заболевания.
- Ванкомицин является наиболее распространенной причиной лекарственно-индуцированного LABD .
- Существуют ассоциации между LABD и злокачественными новообразованиями, желудочно-кишечными заболеваниями и аутоиммунными заболеваниями.
- Классические гистопатологические находки при окраске Н и Е включают субэпидермальное расщепление, богатый нейтрофильный инфильтрат +/- эозинофилы.
- Классическим методом DIF выявляется линейное отложение IgA вдоль зоны базальной мембраны.
- Классический IIF выявляет отложение циркулирующих антител IgA на эпидермальной стороне при salt-split skin (подтип с преимущественным поражением lamina lucida ) или отложение циркулирующих І g А-антител на дермальной стороне при salt-split skin (подтип с преимущественным поражением lamina densa ).
- Ванкомицин-индуцированный LABD ассоциируется с тяжелой формой заболевания, которая может имитировать ТЭН.
- Необходимо получить по крайней мере 2 биоптата: один из очага поражения для окраски H и E и другой из рядом расположенной области для DIF.
- Наиболее часто используемым методом лечения является приём дапсона.
Улучшение работы медицинского персонала
LABD имеет разнообразные проявления и много факторов этиопатогенеза. В ведеиние пациентов с этим заболеванием должны привлекаться врач разных специальностей, включая клинических фармакологов. Пациенты с подозрением на везикулобуллезное заболевание должны быть направлены к дерматологу.
У пациента с установленным диагнозом линейного IgA -буллезного дерматоза с подозрением на ассоциированное желудочно-кишечное заболевание, аутоиммунное заболевание или злокачественное новообразование пациент должен быть направлен к соответствующим специалистам.
В большинстве случаев прекращение действия агента-триггера способствует регрессу заболевания, но это может занять некоторое время.
Дефицит иммуноглобулина А
Дефицит иммуноглобулина А - группа первичных иммунодефицитных состояний, которые обусловлены нарушением синтеза или ускоренным разрушением молекул иммуноглобулинов данного класса. Симптомами заболевания являются частые бактериальные инфекции (особенно респираторной системы и ЛОР-органов), нарушения со стороны желудочно-кишечного тракта, аллергии и аутоиммунные поражения. Диагностика дефицита иммуноглобулина А производится путем определения его количества в сыворотке крови, также применяют молекулярно-генетические техники. Лечение симптоматическое, сводится к профилактике и своевременной терапии бактериальных инфекций и других нарушений. В некоторых случаях осуществляют заместительную иммуноглобулиновую терапию.
Общие сведения
Дефицит иммуноглобулина А - полиэтиологическая форма первичного иммунодефицита, при которой наблюдается недостаток этого класса иммуноглобулинов при нормальном содержании остальных классов (G, M). Дефицит может быть полным, с резким снижением всех фракций глобулина А, и селективным, с недостатком только определенных подклассов этих молекул. Селективный дефицит иммуноглобулина А является очень распространенным состоянием, по некоторым данным его встречаемость составляет 1:400-600. Явления иммунодефицита при селективном недостатке соединения достаточно стертые, почти у двух третей больных заболевание не диагностируется, поскольку они не обращаются за медицинской помощью. Врачи-иммунологи установили, что дефицит иммуноглобулина А может проявляться не только инфекционными симптомами, у пациентов также нередко наблюдаются обменные и аутоиммунные расстройства. С учетом этого обстоятельства можно предположить, что встречаемость данного состояния еще выше, чем предполагалось ранее. Современные генетики считают, что заболевание возникает спорадически или является наследственной патологией, причем в качестве механизма передачи может выступать как аутосомно-доминантный, так и аутосомно-рецессивный путь наследования.
Причины дефицита иммуноглобулина А
Этиология и патогенез как полного, так и селективного дефицитов иммуноглобулина А на сегодняшний момент до конца не определены. Пока удалось установить лишь генетически-молекулярные механизмы отдельных форм заболевания. Например, селективный дефицит иммуноглобулина А типа 2 обусловлен мутациями гена NFRSF13B, локализованного на 17-й хромосоме и кодирующего одноименный белок. Данный протеин представляет собой трансмембранный рецептор на поверхности В-лимфоцитов, отвечает за распознавание фактора некроза опухолей и некоторых других иммунокомпетентных молекул. Соединение принимает активное участие в регуляции интенсивности иммунного ответа и секреции различных классов иммуноглобулинов. По данным молекулярных исследований, генетический дефект гена TNFRSF13B, приводящий к развитию аномального рецептора, делает определенные фракции В-лимфоцитов функционально незрелыми. Такие клетки вместо продукции оптимальных количеств иммуноглобулинов А выделяют смесь из классов А и D, что приводит к уменьшению концентрации класса А.
Иммуноглобулин А отличается от других родственных молекул тем, что обуславливает самый первый этап неспецифической иммунологической защиты организма, поскольку выделяется в составе секрета желез слизистых оболочек. При его недостатке патогенным микроорганизмам становится легче внедряться в слабо защищенные нежные ткани слизистых дыхательных путей, желудочно-кишечного тракта и ЛОР-органов. Механизмы аутоиммунных, обменных и аллергических нарушений при дефиците иммуноглобулина А до сих пор неизвестны. Существует предположение, что его низкая концентрация вносит дисбаланс во всю иммунную систему.
Симптомы дефицита иммуноглобулина А
Все проявления дефицита иммуноглобулина А в иммунологии разделяют на инфекционные, обменные (или желудочно-кишечные), аутоиммунные и аллергические. Инфекционные симптомы заключаются в повышенной частоте бактериальных инфекций дыхательных путей - у больных часто возникают ларингиты, трахеиты, бронхиты и пневмонии, которые могут принимать тяжелое течение и сопровождаться развитием осложнений. Кроме того, для дефицита иммуноглобулина А характерен быстрый переход острых воспалительных процессов в хронические формы, что особенно показательно в отношении поражений ЛОР-органов - у пациентов нередко диагностируются отиты, гаймориты и фронтиты. Достаточно часто встречающийся сочетанный дефицит иммуноглобулинов А и G2 приводит к тяжелым обструктивным поражениям легких.
В меньшей степени инфекционные поражения затрагивают желудочно-кишечный тракт. При дефиците иммуноглобулина А наблюдается некоторое учащение лямблиоза, могут регистрироваться гастриты и энтериты. Наиболее характерными для этого иммунодефицита симптомами со стороны ЖКТ являются непереносимость лактозы и целиакия (невосприимчивость белка злаковых глютена), которые при отсутствии коррекции питания могут привести к атрофии кишечных ворсин и синдрому мальабсорбции. Среди больных дефицитом иммуноглобулина А также часто регистрируются язвенный колит, билиарный цирроз печени и хронические гепатиты аутоиммунного генеза. Перечисленные заболевания сопровождаются болями в животе, частыми эпизодами диареи, похуданием и гиповитаминозами (по причине нарушения всасывания нутриентов из-за мальабсорбции).
Помимо вышеописанных заболеваний желудочно-кишечного тракта, аутоиммунные и аллергические поражения при дефиците иммуноглобулина А проявляются повышенной частотой развития системной красной волчанки и ревматоидного артрита. Возможны также тромбоцитопеническая пурпура и аутоиммунная гемолитическая анемия, нередко - с тяжелым течением. Более чем у половины больных в крови определяются аутоантитела против собственного иммуноглобулина А, что еще более усугубляет явления недостатка данного соединения. У пациентов с дефицитом иммуноглобулина А часто выявляют крапивницу, атопические дерматиты, бронхиальную астму и другие заболевания аллергического происхождения.
Диагностика дефицита иммуноглобулина А
Диагностика дефицита иммуноглобулина А производится на основании данных истории болезни пациента (частые инфекции дыхательных путей и ЛОР-органов, поражения ЖКТ), но наиболее точным способом подтверждения диагноза является определение количества сывороточных иммуноглобулинов разных классов. При этом может обнаруживаться изолированное уменьшение уровня этого компонента гуморального иммунитета ниже 0,05 г/л, что свидетельствует о его дефиците. На этом фоне уровень иммуноглобулинов G и M остается в пределах нормы, иногда выявляется снижение фракции G2. При частичном дефиците иммуноглобулина А его концентрация остается в пределах 0,05-0,2 г/л. При оценке результатов анализа важно помнить о возрастных особенностях количества глобулинов в плазме крови - например, концентрация фракции А 0,05-0,3 г/л у детей до 5-ти лет носит название транзиторного дефицита и может исчезать в дальнейшем.
Иногда обнаруживается парциальный дефицит иммуноглобулина А, при котором его количество в плазме снижено, но концентрация соединения в выделениях слизистых оболочек достаточно высока. Никаких клинических симптомов заболевания у пациентов с парциальным дефицитом не выявляется. В иммунограмме следует обратить внимание на количество и функциональную активность иммунокомпетентных клеток. При дефиците иммуноглобулина А количество Т- и В-лимфоцитов обычно сохранено на нормальном уровне, снижение количества Т-лимфоцитов свидетельствует о возможном наличии общего вариабельного иммунодефицита. Среди других методов диагностики вспомогательную роль играют определение в плазме антинуклеарных и других аутоантител, автоматическое секвенирование гена TNFRSF13B и аллергологические пробы.
Лечение, прогноз и профилактика дефицита иммуноглобулина А
Специфическое лечение данного иммунодефицита отсутствует, в некоторых случаях производят заместительную иммуноглобулиновую терапию. В основном используют антибиотики для лечения бактериальных инфекций, иногда назначают профилактические курсы антибактериальных средств. Необходима коррекция рациона питания (исключение опасных продуктов) при развитии пищевой аллергии и целиакии. В последнем случае исключают блюда на основе злаков. Бронхиальную астму и другие аллергические патологии лечат общепринятыми препаратами - антигистаминными и бронхолитическими средствами. При выраженных аутоиммунных нарушениях назначают иммуносупрессивные препараты - кортикостероиды и цитостатики.
Прогноз при дефиците иммуноглобулина А в целом благоприятный. У многих больных патология протекает абсолютно бессимптомно и не требует специального лечения. При повышении частоты бактериальных инфекций, аутоиммунных поражениях и нарушениях всасывания (синдроме мальабсорбции) прогноз может ухудшаться соответственно тяжести симптомов. Для профилактики развития перечисленных проявлений необходимо использование антибиотиков при первых признаках инфекционного процесса, соблюдение правил относительно режима питания и состава рациона, регулярное наблюдение у иммунолога и врачей других специальностей (в зависимости от сопутствующих нарушений). Следует соблюдать осторожность при переливании цельной крови или ее компонентов - в редких случаях у больных наблюдается анафилактическая реакция из-за наличия в крови аутоантител к иммуноглобулину А.
Заболевание, связанное с линейным отложением иммуноглобулина А (IgA)
Линеарный IgA дерматоз - это редко встречающийся буллезный дерматоз, который отличается от буллезного пемфигоида Буллезный пемфигоид Буллезный пемфигоид - хроническое аутоиммунное заболевание кожи, в результате которого возникают генерализованные зудящие буллезные высыпания у пациентов пожилого возраста. Поражение слизистых. Прочитайте дополнительные сведения линейным отложением IgA в области базальной мембраны. Диагноз ставится на основании результатов биопсии кожи и прямым иммунофлюоресцентным исследованием. Лечение проводится местно кортикостероидами.
Буллы - это возвышающиеся над кожей, заполненные жидкостью полостные элементы диаметром ≥ 10 мм.
Линейный IgA дерматоз имеет два основных клинических варианта - буллезное заболевание детей и линейный IgA дерматоз взрослых. Хотя эти заболевания имеют незначительные клинические отличия, результаты их иммунофлуоресцентного исследования идентичны. Аутоантитела IgA воздействуют на несколько антигенов внутри дермо-эпидермального соединения.
Инфекции и пенициллины провоцируют более четверти случаев заболевания у детей и взрослых. Также в качестве причин рассматривают ванкомицин, диклофенак, нестероидные противовоспалительные препараты (НПВП), каптоприл и препараты лития. Риск заболевания линеарным IgA дерматозом возрастает у пациентов с воспалительным заболеванием кишечника Обзор воспалительного заболевания кишечника (Overview of Inflammatory Bowel Disease) Воспалительные заболевания кишечника (ВЗК), к которым относятся болезнь Крона (БК) и язвенный колит - рецидивирующие заболевания, при которых наблюдается хроническое воспаление различных отделов. Прочитайте дополнительные сведения (возможно, с соответствующей патофизиологией, влияющей на генерацию аутоантител) или лимфопролиферативным раком (у взрослых), но не с другими аутоиммунными расстройствами.
Симптомы и признаки линеарного IgA-зависимого дерматоза
При линеарном IgA дерматозе везикулезные или буллезные высыпания часто имеют герпетиформную группировку. У детей младшего возраста часто поражаются лицо и промежность, также заболевание распространяется на конечности, туловище, руки, ноги и голову. У взрослых почти всегда поражается туловище, а также часто - кожа головы, лица и конечностей. Поражения часто сопровождаются зудом и жжением. Для обеих возрастных групп общим является вовлечение слизистой оболочки; милия не характерна.
Диагностика линейного IgA-зависимого дерматоза (ЛАД)
Биопсия кожи и прямая иммунофлюоресценция
Диагноз на иммуноглобулин А-зависимый линеарный дерматоз подтверждается на основании результатов биопсии кожи и прямой иммунофлюоресценции. Гистологические особенности не специфичны, но прямая иммунофлюоресценция показывает отложения IgA линейной формы вдоль зоны базальной мембраны.
Лечение линейного IgA-зависимого дерматоза
Отмена препаратов, которые могли стать причиной болезни
При легкой форме заболевания - местные кортикостероиды
Для детей используют эритромицин
В случае, когда причиной болезни стали лекарственные препараты, необходимо постепенно их отменять.
Легкую форму заболевания можно лечить применением местных кортикостероидов. Для детей может использоваться эритромицин орально. Альтернативой для всех возрастов являются дапсон и сульфаниламиды (с использованием доз и мер предосторожности, аналогичных таковым при герпетиформном дерматите Лечение Герпетиформный дерматит является интенсивно зудящим хроническим аутоиммунным папуловезикулярным кожным высыпанием, непосредственно ассоциированным с целиакией. Типичными проявлениями являются. Прочитайте дополнительные сведенияАвторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Что показывает иммуноглобулин А
Иммуноглобулины A - это белки, обеспечивающие местный иммунитет. Они представлены в организме человека двумя фракциями: сывороточной, обеспечивающей местный иммунитет, и секреторной. Секреторная фракция содержится в молоке, респираторного и секретах кишечного тракта, слёзной жидкости и слюне, защищающих вместе с неспецифическими факторами иммунитета защиту слизистых оболочек от вирусов и бактерий.

Функции
Сывороточный иммуноглобулин A является фракцией гамма-глобулинов. Он составляет 10-15 % от общего количества всех растворимых иммуноглобулинов. В сыворотке крови иммуноглобулин A представлен в основном мономерными молекулами. Основное количество иммуноглобулина A находится не в сыворотке крови, а на поверхности слизистых оболочек. Секреторный иммуноглобулин облегчает транспорт иммуноглобулина A через эпителий. Он защищает молекулы иммуноглобулинов от расщепления ферментами пищеварительного тракта.
Основная функция сывороточного иммуноглобулина A - обеспечение местного иммунитета, защита мочеполовых, дыхательных путей и органов пищеварения от возбудителей инфекционных заболеваний. Секреторные антитела обладают выраженным противоадсорбционным действием: препятствуют прикреплению бактерий к поверхности эпителиальных клеток, предотвращают прилипание микроорганизмов, без которого бактериальное повреждение клетки становится невозможным. Также иммуноглобулины А вместе с неспецифическими факторами иммунитета обеспечивают защиту слизистых оболочек от микроорганизмов. Врождённый или приобретенный дефицит иммуноглобулина IgА может приводить к возникновению аллергии, аутоиммунных нарушений, аллергии, повторных инфекций.
Иммуноглобулин A не проходит через плацентарный барьер. Его уровень у новорожденных составляет около 1% от концентрации у взрослых. К первому году жизни ребёнка этот показатель составляет 20 % от уровня взрослых. После рождения малыша секреторные иммуноглобулины поступают в его организм с молозивом матери. Они защищают желудочно-кишечный тракт и дыхательные пути ребёнка. Возраст 3 месяца является критическим. В этот период врачи диагностируют врождённую или транзиторную недостаточность местного иммунитета. К пятилетнему возрасту ребёнка уровень иммуноглобулинов А достигает концентрации, характерной для взрослого человека.
Норма иммуноглобулина А у детей зависит от их возраста. У детей от 3 до 12 месяцев она составляет 0,02-0,05г/л, от 12 до 16 лет находится в диапазоне 0,6-3,48 г/л. У взрослых людей, старше 20 лет, нормальный уровень иммуноглобулина А варьирует от 0,9 до 4,5 г/л.
Показания
С помощью иммуноглобулинов А врачи проводят оценку течения заболеваний, протекающих с активацией иммунитета:
- острых и хронических инфекций бактериального и вирусного происхождения; бронхиальной астмы;
- онкологических заболеваний лимфатической системы (лейкозов, миеломной болезни);
- заболеваний соединительной ткани (системной красной волчанки, ревматоидного артрита).
Иммуноглобулин IgА определяют при наличии следующих заболеваний:
- рецидивирующих бактериальных респираторных инфекций (синусита, пневмонии), а также отита и менингита, бронхиальной астмы;
- хронической диареи, синдрома мальабсорбции;
- анафилактических посттрансфузионных реакций;
- синдрома Луи-Бара (атаксии - телеангиэктазии);
- опухолевых заболеваний лимфоидной системы (миеломы, лейкоза, ретикулосаркомы, лимфомы).
- хронического гепатита, цирроза печени.
С помощью исследования иммуноглобулина IgA врачи Юсуповской больницы проверяют работу печени, желудка, кишечника, лимфатической системы.
Забор биоматериала для исследования
Для того чтобы определить уровень иммуноглобулина А, производят забор венозной крови в пустую пробирку или с гелем (для получения сыворотки). Пациентам с низким уровнем иммуноглобулинов накануне исследования следует соблюдать меры профилактики бактериальной инфекции. Место венепункции придавливают ватным шариком до остановки кровотечения. Если в месте прокола вены образовалась гематома. Накладывают согревающий компресс.
Пациенту рекомендуют воздержаться от приема пищи в течение 12-14 часов до исследования. Он может пить чистую негазированную воду. Врачи отменяют лекарственные препараты, которые могут повлиять на результаты исследования. За 3 дня до взятия крови пациент должен отказаться от приёма алкоголя. Результаты анализа можно получить через 4 часа.
Причины повышения показателя
Иммуноглобулины А связываются с микроорганизмами и задерживают их присоединение к поверхности клеток. Снижение содержания иммуноглобулинов A свидетельствует о недостаточности местного и общего иммунитета. Их концентрация увеличивается при следующих заболеваниях:
- острых и хронических инфекционных процессах (грибковых, паразитарных, бактериальных);
- патологии печени;
- миеломной болезни;
- системной красной волчанке;
- моноклональной гаммапатии.
Снижается уровень иммуноглобулинов А у пациентов, страдающих заболеваниями, истощающими иммунную систему. Может быть иммуноглобулин А понижен у ребёнка с отрой вирусной инфекцией
Понижениепоказателя
Иммуноглобулин А понижен у пациентов с новообразованиями лимфатической системы, лимфопролиферативными заболеваниями, злокачественными анемиями, гемоглобинопатиями. Понижается содержание иммуноглобулина А после спленэктомии, в случае потери белка при энтеропатиях и нефропатиях. Лечение иммунодепрессантами, цитостатиками, облучение ионизирующей радиацией также могут снизить уровень иммуноглобулина IgА.
Понижать уровень иммуноглобулина А может длительная экспозиция с бензолом, толуолом, ксилолом, приём лекарственных средств: декстрана, эстрогенов, метилпреднизолона, карбамазепина, препаратов золота, вальпроевой кислоты. Получите консультацию иммунолога, записавшись на приём по телефону Юсуповской больницы. Врач проведёт обследование, назначит исследование уровня иммуноглобулина А.
Читайте также:
