Значение обучения лапароскопическим операциям в онкогинекологии
Добавил пользователь Дмитрий К. Обновлено: 21.01.2026
Хирургические методики активно применяются при лечении широкого спектра заболеваний. Однако в последнее время классические операции, при которых выполняются большие разрезы и формируется доступ к органам, постепенно замещаются современными лапароскопическими вмешательствами. Последние отличаются минимальной травматичностью, реже приводят к развитию осложнений, проще переносятся пациентами. Одной из наиболее частых разновидностей подобных операций является лапароскопия брюшной полости. Она может выполняться как с диагностической, так и с лечебной целью.
Диагностическая лапароскопия
Не всегда традиционные методы обследования брюшной полости (УЗИ, КТ, МРТ) позволяют получить достаточно информации для постановки диагноза и составления плана лечения. В некоторых случаях врачу необходимо «своими глазами» осмотреть тот или иной орган, либо выполнить различные манипуляции. В таких ситуациях назначается диагностическая лапароскопия. Кроме «живой» оценки состояния органов брюшной полости, данная операция позволяет:
- Выявить аномалии развития.
- Определить наличие спаек в брюшной полости.
- Установить точное местоположение патологического очага.
- Взять образец биологического материала для дальнейшего исследования.
В некоторых случаях непосредственно во время диагностической лапароскопии могут быть проведены и лечебные мероприятия, например, удаление спаек.
Какие заболевания брюшной полости можно устранить лапароскопически
Лапароскопия брюшной полости с лечебной целью применяется в самых разнообразных областях медицины. Такие операции могут назначаться пациентам со следующими заболеваниями:
- Желчнокаменная болезнь.
- Доброкачественные новообразования (кисты, полипы) печени, почек и других органов.
- Нефроптоз (опущение почки).
- Спайки в брюшной полости.
- Язвенная болезнь желудка и 12-перстной кишки.
- Аппендицит.
- Диафрагмальные грыжи и др.
Ход операции
Как и перед любым другим оперативным вмешательством, пациент накануне проходит определенную подготовку. Прежде всего, необходимо сдать стандартные анализы, сделать УЗИ, снять ЭКГ, проконсультироваться с врачами других специальностей. Лапароскопию выполняют под общим наркозом, поэтому в день операции следует отказаться от приема пищи и воды.
Реабилитационный период после операции сокращается в среднем в два раза (по сравнению с классическим операциями) и лучше переносится пациентами. Сроки выписки из стационара также сокращаются. Обычно пациент может вернуться домой уже через неделю после операции, но при этом необходимо строго следовать всем рекомендациям, которые дал врач.
Преимущества
Среди главных достоинств лапароскопии можно отметить:
- Минимальная травматичность и хороший косметический эффект за счет небольших разрезов на передней брюшной стенке (всего 1-1,5 см).
- Быстрое восстановление после операции.
- Меньший риск развития осложнений.
- Минимальная кровопотеря.
Несмотря на все достоинства лапароскопических вмешательств, они имеют ряд ограничений, поэтому могут применяться не всегда. Например, хирургу приходится работать в ограниченном диапазоне движений, а такая возможность имеется не всегда. Поэтому лапароскопические операции не могут полностью заменить классические хирургические вмешательства и применяются наравне с последними. Выбор точного метода лечения всегда остается за хирургом.
Значение обучения лапароскопическим операциям в онкогинекологии
Поставленная задача обучения студентов старших курсов мануальным навыкам лапароскопических вмешательств была успешно решена. В результате студенты технически выполняли операции на животных лучше врачей-интернов. Успеху в решении поставленной задачи во многом способствовала проведенная в самом начале селекция, поскольку были отобраны студенты, обладающие развитой мелкой моторикой, что облегчило освоение более сложных навыков. Подобное тестирование, проводимое на младших курсах обучения, помогает студенту правильно оценивать свои возможности и более обоснованно подойти к выбору будущей профессии. Тем самым предотвращаются возможные разочарования при освоении молодым специалистом профессии хирурга.
Тестирование в своей основе не только предполагает простой отбор студентов с лучшей мануальной моторикой, но и подразумевает выявление психологически устойчивых хирургов, способных сразу повторить однажды увиденную манипуляцию или операцию. Последнее свойство имеет очень важное значение в сокращении сроков обучения хирурга. Один хирург может приехать после мастер-класса и с одного—двух раз повторить увиденное, другой хирург для устойчивого успеха и хорошего отдаленного результата должен 10—20 раз выполнить изучаемую операцию. Задача селекции — выявить и обучить в дальнейшем первых, поскольку именно из них, на наш взгляд, следует готовить лучших хирургов. Именно с этой целью и формировались мануальные тестовые задания.
На этапах разработки программы обучения для подготовки хирургов мы использовали наряду с «сухими» тренажерами (коробками) «виртуальный» (гибридный) тренажер LapSim Центра практических навыков РязГМУ. Подобные тренажеры имеют ряд преимуществ: возможность моделирования выполнения любого базового навыка или оперативного вмешательства в полном объеме, отработки системы обратного тактильного ответа и реалистичного изображения внутренних органов и тканей, имитации негативных последствий в случае неправильных действий хирурга (кровотечение, ранение органа), возможность проведения тестирования и т. д. Однако в процессе работы мы отказались от использования «виртуального» тренажера, поскольку, на наш взгляд, эта техника не обеспечивает реальных тактильных ощущений и соответственно не способствует закреплению навыков на уровне «мышечной памяти».
На этапах разработки программы мы столкнулись с определенными проблемами. Одна из них — недостаток правового регулирования некоторых аспектов деятельности, таких как работа студентов в секционной с нефиксированным кадаверным материалом, работа студентов в операционной клинической базы. Эти направления до сих пор не регламентированы, и при отсутствии законодательной базы большая ответственность ложится на руководителя занятий. «Кадаверный» этап подготовки не менее важен, чем Wet-lab, поскольку если мануальные навыки и можно улучшить на лабораторном животном, то знание анатомии, особенно различных вариантов кровоснабжения того или иного органа, невозможно без изучения достаточного объема кадаверного материала.
Наша программа получила дальнейшее развитие. Группа студентов, прошедших все этапы, продолжает обучение. Запланировано углубленное изучение английского языка с возможной последующей стажировкой за рубежом. С целью повышения мотивации в группе хирургический кружок преобразован в «Клуб хирургов РязГМУ», где использован «спортивный» подход к ранжированию. В частности, по результатам официальных хирургических олимпиад, научных публикаций, участия в конференциях, работы в клинике и освоения программы студентам присваиваются звания «1-й разряд», «кандидат в мастера» и «мастер».
«1-й разряд» имеет «Клубный минимум» с присвоением стандартной карты клуба, что предусматривает выполнение на тренажере «Лапароскопическая коробка» на время (30 мин) следующих упражнений: формирование анастомоза, герниопластика сеткой, накидывание петли Редера; участие во Всероссийской студенческой олимпиаде по хирургии им. акад. М.И. Перельмана с международным участием; соавторство в научной статье в журнале или сборнике тезисов; ассистенция при выполнении различных операций в клинике.
Присвоение звания «кандидат в мастера» и «Серебряной клубной карты» предусматривает выполнение на лабораторном животном следующих операций: лапароскопическая аппендэктомия, герниопластика, формирование лапароскопического межкишечного анастомоза, а также наличие призового места на олимпиаде в индивидуальном зачете или в составе команды, соавторства в научной статье в журнале и не менее 5 ассистенций при выполнении различных операций в клинике.
Звания «мастер» и «Золотая карта клуба» могут быть присвоены только при выполнении на лабораторной свинье лапароскопической холецистэктомии, лапароскопической трансанальной передней резекции прямой кишки, аутотрансплантации почки с лапароскопическим ее забором, а также при наличии 1-го места на олимпиаде в индивидуальном зачете или в составе команды, соавторства в научной статье в журнале, рекомендованном ВАК, и не менее 20 ассистенций при выполнении различных операций в клинике. Переход на последующий уровень возможен только после освоения предыдущего. Претендент на звание «мастер» должен сделать все три операции (лапароскопическую холецистэктомию, лапароскопическую трансанальную переднюю резекцию прямой кишки, аутотрансплантацию почки с лапароскопическим ее забором) на одной свинье за один подход, причем наиболее сложная операция — аутотрансплантация почки — выполняется последней, уже на фоне накопленной усталости.
Имеется много исследований, касающихся роста частоты осложнений при увеличении продолжительности операций. Смысл последнего этапа подготовки — научить будущего хирурга не терять концентрацию при длительной операции, научить его «терпеть», воспитать психологическую устойчивость. Формирование анастомозов почечных сосудов с аортой и нижней полой веной при диаметре почечных сосудов 2—4 мм после 4—5 ч предыдущих операций является крайне сложной задачей даже для опытных хирургов. Благодаря этому этапу мы получаем уже практически хорошо подготовленного хирурга, умеющего оперировать (и открыто, и лапароскопически) практически на всех органах брюшной полости и забрюшинного пространства. В настоящее время только один студент соответствует всем критериям звания «мастер».
Таким образом, наш опыт показал, что разработанная система подготовки специалистов с использованием операционной Wet-lab позволяет студентам-медикам быстро и эффективно освоить наиболее распространенные лапароскопические операции. Из всех медицинских специальностей именно хирургия требует хорошо продуманной селекции студентов на младших курсах обучения. По нашему мнению, введение студентов в «большую» хирургию с ранних лет позволит подготовить хирургов высокого профессионального уровня.
ОГБУЗ «Костромской онкологический диспансер»
Кривые обучения в минимально инвазивной онкохирургии
Журнал: Эндоскопическая хирургия. 2020;26(4): 54‑58
Бурное развитие эндовидеохирургических технологий с каждым годом затрагивает все больше разделов клинической онкологии. В настоящее время самые сложные онкохирургические операции выполняются с применением минимально инвазивных методик. В связи с этим особую роль играет изучение кривых обучения в качестве маркера безопасного освоения врачами новых медицинских технологий. При этом остаются трудности, связанные с интерпретацией данных, полученных в результате построения таких графиков и их сопоставления с другими исследованиями. Нерешенным остается вопрос выбора критерия, по которому необходимо оценивать успешность внедрения новой методики. В представленном обзоре описывается концепция развития кривых обучения в минимально инвазивной онкохирургии, рассмотрены различные формы кривых обучения, предложены методы, с помощью которых можно построить кривые обучения и описать их соответствие современной медицинской практике.
Дата принятия в печать:
При освоении новых медицинских технологий общепринято отображать накопленный опыт с помощью построения графиков — кривых обучения [1, 2]. Быстрота и широкое распространение мини-инвазивных хирургических технологий в различных разделах клинической онкологии обусловливают необходимость детального изучения кривых обучения [3, 4]. Процесс освоения новых хирургических методик важно изучать, поскольку он связан с возможным негативным влиянием на исход операции [5, 6]. Отсутствие унифицированных подходов при внедрении новых хирургических технологий и, как следствие, низкий контроль качества выполняемых процедур может дискредитировать крупные рандомизированные проспективные исследования, что особенно актуально в онкологии [7]. В представленном обзоре дана историческая справка о развитии концепции кривой обучения в минимально инвазивной онкохирургии, рассмотрены различные формы кривых обучения, предложены методы, с помощью которых можно построить кривые обучения и описать их соответствие современной медицинской практике.
В 1936 г. T. Wright [8], авиационный инженер, опубликовал первое описание кривой обучения. Его тезис состоял в том, что скорость (эффективность) производства компонентов самолета увеличилась при увеличении опыта и квалификации рабочей силы. В промышленности показатели производительности часто очевидны, например время производства, затраты и контроль качества. Однако труднее оценить эффективность конкретной хирургической технологии в медицинской практике [9]. Существует множество определений кривых обучения в хирургии. Наиболее полное описание предложили I. Park и соавт. (2009) [10]: по мнению авторов, кривая обучения —это минимальное количество операций, которое должен выполнить хирург, чтобы воспроизвести хирургическую процедуру со стабильными показателями на основе сравнения с результатами, полученными в стационарах лучших практик [10].
Критерии обучения, связанные с освоением новой хирургической технологии, подразделяются на две категории: показатели самой хирургической операции и показатели эффективности выполненного вмешательства у пациента. Показатели хирургической процедуры включают такие факторы, как длительность (время) операции, величина кровопотери, частота конверсий и интраоперацонных осложнений [2]. Для онкологии помимо указанных факторов обязательно необходимо учитывать радикальность выполненного вмешательства [10]. Исходы для пациентов включают длительность (время) пребывания в стационаре, палате интенсивной терапии, частоту развития послеоперационных осложнений, летальность. При этом в онкологии такой показатель, как выживаемость, имеет очень большое значение [11]. Следует отметить, что анализ выживаемости обусловливает необходимость длительного периода наблюдения. Это приводит к тому, что потенциально негативные последствия лечения могут не выявляться в течение долго времени. Результаты непосредственно хирургической операции, как правило, легче анализировать, и, следовательно, они чаще используются для оценки кривых обучения, хотя они только косвенно связаны с результатами лечения [12, 13].
Стандартная кривая обучения в хирургии состоит из 4 основных точек (см. рисунок). Координата A — начало обучения. После начала освоения кривая обучения поднимается вверх, и характер этого подъема свидетельствует, насколько быстро улучшаются результаты. Данный отрезок может иметь ступенчатый характер, так как не во всех случаях происходит плавное освоение сложной процедуры [14]. Начальный этап обучения, как правило, характеризуется наиболее быстрым освоением методики. Затем оно замедляется, поскольку степень прогрессирования, достигаемая в каждом последующем случае, уменьшается по мере совершенствования техники. После этого наступает период, когда процедура может быть выполнена самостоятельно и компетентно (координата B). При наличии у команды специалистов дополнительного опыта конечный результат может улучшиться в еще большей степени, но не намного (координата C). Дальнейшее накопление опыта приводит к достижению плато (координата D). На графике также описана альтернативная кривая (пунктирная линия) которая демонстрирует временное ухудшение результатов после достижения технической компетентности [15]. Такое падение обусловлено попытками выполнить сложные процедуры, а также применением рискованных технических приемов в стандартных ситуациях, что может приводить к техническим ошибкам и, соответственно, к худшему результату [14]. С возрастом основные хирургические навыки ухудшаются, что приводит к снижению показателей кривой обучения (координата Е) [16].
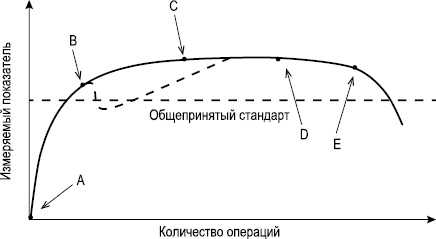
Рис. Стандартная кривая обучения в хирургии.
Характер и быстрота подъема кривой обучения, как правило, прямо пропорциональны сложности осваиваемой процедуры [17]. Хирургические методы лечения в онкологии относятся к технически сложным, и достижение компетентности (координата B) наступает в более длительные сроки [18]. Кроме того, технические приемы, необходимые для выполнения эндовидеохирургических операций, в корне отличаются от таких в традиционной открытой хирургии, что приводит к дополнительному увеличению времени освоения методики [19]. В таблице представлены наиболее распространенные в онкологии мини-инвазивные операции, указаны критерии, по которым оценивалась кривая обучения, и сроки до достижения уровня плато.
Таблица. Сравнение уровней достижения плато в кривых обучения при основных минимально инвазивных онкологических операциях
Материалы конгрессов и конференций
За последние два десятилетия в практику оперативной гинекологии широко внедрилась эндоскопическая хирургия. Развитие этой методики позволяет в настоящее время выполнять практически любую гинекологическую операцию по поводу доброкачественной патологии внутренних гениталий путем лапароскопического вмешательства.
Несмотря на то, что впервые эндоскопическую операцию по стадированию рака путем изучения состояния тазовых лимфатических узлов выполнил во Франции в 1986 г. D. Dargent, до сегодняшнего дня лапароскопическая хирургия не нашла широкого применения в онкологии. Использование лапароскопической хирургии в онкогинекологии ограничено в связи с вероятным увеличением риска диссеминации опухолевого процесса. Действительно, при несоблюдении правил абластики в ходе выполнения лапароскопической операции возникают метастазы в передней брюшной стенке в местах введения троакаров при раке яичника и аденокарциноме шейки матки (G. Lane). Кроме того, применение при наложении пневмоперитонеума углекислого газа также может способствовать рассеиванию раковых клеток.
Внедрение в клиническую практику малоинвазивной эндоскопической техники способствует более раннему выявлению злокачественного заболевания, точному установлению стадии его развития (и, соответственно, проведению адекватного лечения), дает возможность выполнять радикальное или паллиативное (в том числе и циторедуктивное) хирургическое вмешательство с более быстрым послеоперационным восстановлением, что способствует раннему началу химиолучевого воздействия, а также позволяет проводить мониторинг за эффективностью проводимого лечения.
Лапароскопический доступ имеет целый ряд существенных преимуществ перед традиционным: он обеспечивает лучшую визуализацию операционного поля за счет достаточного освещения и оптического увеличения, что в свою очередь позволяет лучше дифференцировать границы тканей, проводить прицельную биопсию, более тщательно осуществлять остановку кровотечения, меньше травмировать окружающую ткань. В то же время лапароскопия является в определенной степени «виртуальной» хирургией, которая практически полностью зависит от правильной работы аппаратуры.
В онкогинекологии в настоящее время лапароскопия может использоваться при раке шейки матки, раке эндометрия, раке яичника и раке вульвы. Однако при каждой из этих локализаций злокачественного процесса лапароскопия имеет строго отведенное ей место.
Так, при всех вышеперечисленных формах рака лапароскопический доступ может применяться для точного хирургического установления стадии заболевания путем ревизии брюшной полости, забрюшинного пространства, широкой лимфодиссекции, биопсии подозрительных участков. При раке эндометрия лапароскопически может быть выполнена и радикальная операция - тотальная лапароскопическая пангистерэктомия в сочетании с тазовой лимфаденэктомией, а при раке шейки матки - лапароскопическая расширенная гистерэктомия тип III по M. Piver (лапароскопический аналог операции Вертгейма) (D. Querleu, E. Leblanc).
Ранее в некоторых клиниках Европы при лечении рака шейки матки в протоколы лечения входила лапароскопическая тазовая лимфаденэктомия с одновременной расширенной влагалищной гистерэктомией по Шаута-Амрейху. Проведение лучевой терапии зависело от состояния удаленных лимфатических узлов.
При раке вульвы лапароскопический доступ используется для выполнения тазовой лимфаденэктомии с целью точного хирургического установления стадии заболевания или же как первый этап радикального хирургического лечения. Особое значение это имеет при уже выявленном поражении илеофеморальных лимфатических узлов.
При раке яичника, помимо уже перечисленных целей, лапароскопия может применяться для выполнения циторедуктивной операции, а также для контроля (возможно, многократного) за эффективностью проводимой адъювантной терапии - second-look лапароскопия, в том числе с использованием специальной канюли для так называемой «динамической лапароскопии».
В случае пограничных опухолей или рака яичника лапароскопия позволяет точно установить стадию заболевания и выбрать соответствующее лечение. Во время лапароскопического вмешательства проводится системная ревизия органов брюшной полости, оценивается состояние лимфатических узлов. В начале операции с особой тщательностью осматривается вся поверхность париетальной и висцеральной брюшины, особенно диафрагма, диафрагмальная поверхность печени, осуществляется забор перитонеальной жидкости или смывов из брюшной полости для последующего цитологического исследования. Из всех подозрительных участков брюшины выполняется биопсия (включая биопсию или соскоб с диафрагмы). Кроме того, при использовании лапароскопического доступа возможно удаление большого сальника на уровне поперечно-ободочной кишки.
Выполненные в США исследования у больных раком яичников (E. Surwit и J. Childers) продемонстрировали огромные возможности лапароскопии в обнаружении микроскопического злокачественного поражения в областях высокого риска: на тазовой брюшине, на большом сальнике, в тазовых и парааортальных лимфатических узлах, в смывах из брюшной полости.
При пограничных опухолях или раке яичника удаление придатков матки или резецированной ткани сохраняемого яичника проводится с соблюдением всех правил абластики с использованием пластиковых эндоскопических контейнеров, в которые помещаются придатки перед их удалением, что предотвращает диссеминацию возможного злокачественного процесса при нарушении целостности капсулы опухоли. Извлечение пластикового контейнера из брюшной полости проводится через троакар 10-12 мм или через заднее кольпотомное отверстие, которое затем зашивается эндоскопическим восьмиобразным швом.
По мнению многих ведущих авторов (D. Querleu, E. Surwit, J. Childers), надежность лапароскопического доступа при выполнении лимфаденэктомии у онкогинекологических больных не уступает таковой при чревосечении при условии выполнения операции опытным хирургом-эндоскопистом, владеющим традиционными хирургическими доступами, при соблюдении основных принципов онкохирургии.
Недавние разработки в технике и методике лапароскопических вмешательств позволили расширить зону выполнения лимфаденэктомии на область общих подвздошных сосудов и, таким образом, в настоящее время имеется возможность проводить полную тазовую лимфаденэктомию. Кроме того, при раке яичника верхней границей лапароскопической парааортальной лимфодиссекции является правая почечная вена. Однако не всем онкогинекологическим больным показана радикальная тазовая лимфаденэктомия, а при начальных стадиях рака шейки матки (IA2 и IB1 стадиях) рекомендуется только подвздошная лимфаденэктомия (D. Dargent).
Следует отметить, что при лимфаденэктомии, выполняемой при раке шейки матки, необходимо удалять запирательные, наружные, внутренние, общие подвздошные группы лимфатических узлов, а при раке эндометрия желательно удалить также парааортальные лимфатические узлы, расположенные ниже нижней брыжеечной артерии. При раке яичника парааортальная лимфаденэктомия должна выполняться от уровня почечных сосудов до малого таза. Необходимость удаления преимущественно той или иной группы лимфатических узлов объясняется особенностями оттока лимфы от органа и особенностями метастазирования опухоли.
Однако во всех случаях рака эндометрия и при начальном раке шейки матки тазовая лимфодиссекция может ограничиваться интерилиакальной областью - зоной, расположенной между наружными и внутренними подвздошными сосудами. Это объясняется тем, что необходимые для удаления лимфоузлы располагаются в этой области, а вовлечение в процесс общих подвздошных и параортальных лимфатических узлов без поражения интерилиакальных встречается довольно редко (менее 2%). Нижней границей лапароскопической лимфодиссекции при раке шейки матки является запирательная ямка.
Молодым женщинам, страдающим раком шейки матки, при выполнении радикальной операции лапароскопическим доступом целесообразно проводить транспозицию обоих яичников наверх в латеральные каналы брюшной полости - удалять их из области последующего лучевого воздействия с целью сохранения их гормонопродуцирующей функции. Причем, на яичники после их транспозиции следует накладывать рентгеноконтрастные скобки для их дальнейшей рентгенологической визуализации.
У молодых нерожавших женщин при микроинвазивном раке шейки матки и даже при наличии выраженной инвазии (стадии IB и IIA) лапароскопический доступ для выполнения тазовой лимфаденэктомии в сочетании с влагалищной радикальной трахелэктомией позволяют сохранять репродуктивную функцию. В литературе описаны более 250 подобных операций, причем в 40% случаев после операции наступила беременность. Следует отметить, что в 3,1% случаев отмечен рецидив заболевания.
К особенностям выполнения лапароскопических операций в онкогинекологии следует отнести неукоснительное соблюдение правил абластики. Так, в ходе выполнения лапароскопической лимфаденэктомии все удаленные лимфатические узлы вне зависимости от наличия или отсутствия признаков их опухолевого поражения должны быть абластично извлечены из брюшной полости без контакта с передней брюшной стенкой. С этой целью используются эндоскопические пластиковые контейнеры, которые изолируют удаленные лимфоузлы, 10 мм или 12 мм троакары, а также специальный эндоскопический инструмент - целиоэкстрактор (D. Dargent).
В отделении оперативной гинекологии НЦ АГиП РАМН накоплен собственный опыт лечения больных доброкачественными и пограничными опухолями яичника, а также пациенток, страдающих раком шейки и тела матки, в том числе и с использованием лапароскопического доступа. При хирургическом лечении больных раком тела и шейки матки в 24 случаях произведена лапароскопическая лимфаденэктомия. Среди этой группы больных у 17 был плоскоклеточный рак шейки матки IА2-IIВ стадий, а у 7 - аденокарцинома эндометрия.
Техника лапароскопической тазовой лимфаденэктомии заключалась в следующем. Операция выполнялась в условиях пневмоперитонеума 10-15 мм рт. ст. с использованием введенного через пупок лапароскопа и трех троакаров второго прокола, два из которых диаметром 5 мм располагались в подвздошных областях у латеральных краев прямых мышц живота, а один диаметром 12 мм - в надлобковой области по белой линии живота. При выполнении лапароскопической лимфаденэктомии не использовался маточный манипулятор, поскольку большинство подвергающихся этому вмешательству больных страдали раком шейки или тела матки, а сам процесс введения манипулятора мог способствовать диссеминации опухолевого процесса. Париетальная брюшина рассекалась над областью подвздошных сосудов, параллельно ходу наружных подвздошных сосудов, края ее отсепаровывались тупо. Проводилась обязательная визуализация мочеточников. Атравматичными зажимами захватывалась периадвентициальная клетчатка с лимфатическими сосудами и узлами в проксимальной части разреза и тупым путем с помощью закрытого зажима она отслаивалась от фронтальной части наружных подвздошных сосудов, от их медиальных и латеральных стенок, области бифуркации общих подвздошных сосудов. Далее скелетировалась запирательная ямка с тщательным выделением запирательного нерва и, по возможности, единым блоком удалялась клетчатка вместе с лимфатическими узлами, расположенная вокруг внутренних подвздошных сосудов. Отделенная клетчатка с лимфатическими узлами извлекалась под визуальным контролем через 12 мм троакар или помещалась в пластиковый эндоконтейнер с последующей абластичной эвакуацией из брюшной полости. С особой тщательностью выполнялась диссекция лимфатических узлов, расположенных у наружной подвздошной вены. Цепочка лимфатических узлов удалялась, по возможности, единым блоком. Завершающим этапом тазовой лимфаденэктомии было удаление жировой клетчатки с находящимися в ней лимфатическими узлами из пространства между наружной подвздошной артерией и веной. Препараты лимфатических узлов из различных зон таза отправлялись на гистологическое исследование под собственной маркировкой. В ряде случаев перед левосторонней лимфаденэктомией проводилась частичная мобилизация сигмовидной кишки для обеспечения адекватного доступа к области бифуркации общих подвздошных сосудов слева. Для снижения кровопотери при последующей гистерэктомии всегда выполнялась селективная коагуляция маточных артерий у места их отхождения от внутренних подвздошных артерий. В ходе выполнения лапароскопической лимфаденэктомии электрохирургия использовалась только на этом этапе операции.
Лапароскопическая транспозиция яичников была произведена у 3 молодых пациенток, страдающих раком шейки матки. У 1 больной операция завершилась путем чревосечения ввиду больших размеров метастаза в левый наружный подвздошный лимфатический узел и его плотного прикрепления к подвздошным сосудам и стенке таза.
Продолжительность операции составила от 125 до 195 минут, средняя кровопотеря во время вмешательства не превышала 350 мл. В среднем пребывание больной в стационаре после операции составило 7,5 дней.
Следует отметить, что обязательным условием применения лапароскопии у больных раком половых органов является тесное сотрудничество с онкогинекологами, совместный тщательный отбор пациенток для подобных операций, совместное послеоперационное наблюдение и лечение. Так, все онкологические больные, подвергнутые хирургическому лечению в отделении оперативной гинекологии НЦ АГиП, были затем консультированы и при наличии показаний переданы для дальнейшего лечения в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
Пяти больным после операции проводилась лучевая терапия (3 - низкодифференцированным раком эндометрия и 2 - раком шейки матки IB1 и IIВ стадии).
В июле 2002 г. D. Querleu представил на Международном противораковом конгрессе результаты лапароскопического лечения больных раком, где отметил, что при лапароскопии удаляется столько же лимфатических узлов, сколько и при открытой операции, а 5-летняя выживаемость больных после лапароскопических операций не отличается от таковой у пациенток, прооперированных путем чревосечения.
До настоящего времени роль эндоскопической хирургии при лечении онкогинекологических больных четко не определена, и, по видимому, сейчас среди онкогинекологов имеется больше противников, чем сторонников использования этого доступа. Хотя, без сомнения, интерес к использованию лапароскопии для выполнения лимфодиссекции у онкогинекологических больных значительно возрос, и не только за рубежом, но и у нас в стране появляются публикации о выполнении подобного вмешательства эндоскопическим доступом.
Существует множество вопросов в области применения эндоскопической хирургии в онкологии, на которые еще не даны убедительные ответы. Эта неопределенность подталкивает исследователей различных стран к разработке алгоритмов как предоперационного выбора больных для лапароскопических вмешательств, так и самой методики операции, включая использование новых инструментов и хирургических энергий.
Дискуссионными остаются вопросы о применении лапароскопии при раке яичника, поскольку отсутствуют доказательства надежной абластичности этого вмешательства. В то же время E. Leblanc, D. Querleu и D. Lanvin определяют лапароскопию как «безопасный и точный метод определения стадии заболевания» при раке яичника.
Таким образом, с накоплением хирургического опыта, получением данных о длительности безрецидивного выживания оперированных по представленным методикам больных, разработкой тактики их послеоперационной реабилитации будут даны ответы на дискуссионные вопросы, и это, возможно, позволит изменить всю философию подхода к лечению онкогинекологической патологии и значительно улучшить результаты лечения этой достаточно сложной категории пациенток, снизить затраты на сам процесс лечения и повысить качество жизни страдающих раком женщин
Тюляндина Александра Сергеевна
Заведующая отделением лекарственных методов лечения злокачественных опухолей №4 НИИ клинической онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, профессор кафедры онкологии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), председатель Комитета молодых онкологов RUSSCOjr, член правления RUSSCO, член Комитета молодых онкологов ESMO, член Flims Alumni Club, доктор медицинских наук, Москва
Совсем недавно внедрение миниинвазивных хирургических вмешательств рассматривалось как перспективное направление в лечении гинекологических опухолей. Причины, приведшие к вышеизложенной тенденции, очевидны и связаны с попыткой улучшить качество хирургического лечения, переносимость оперативного вмешательства самой пациенткой, уменьшение длительности пребывания на койке, снижение кровопотери во время операции. Эти благие намерения привели к появлению многочисленных исследований II фазы, а также публикаций собственных наблюдений после лапароскопических и робот-ассистируемых операций в онкогинекологии.
Еще совсем недавно лапароскопические вмешательства внедрялись при распространенном раке яичников. Только после публикации работ, которые показали достоверное снижение продолжительности жизни больных, эксперты полностью отказались от хирургических вмешательств из минидоступа при данной патологии [1]. Полученные результаты связаны с несколькими причинами, это отсутствие возможности выполнить адекватную ревизию брюшной полости с целью удаления всех видимых очагов болезни, что приводит к снижению числа полных оптимальных циторедукций. Лапароскопическая операция при раке яичников имеет ценность только как диагностическая манипуляция для подтверждения диагноза и оценки распространенности процесса. За редким исключением обсуждается вопрос использования лапароскопических вмешательств у больных ранним раком яичников при органосохранных операциях. Лапароскопические операции «second look», популярные в 90-х годах XX столетия, сейчас вспоминаются как историческое наследие прошлого.
С потерей широкого распространения миниинвазивных современных методик при раке яичников активное развитие лапароскопической и робот-ассистированной хирургии продолжилось при лечении рака шейки матки и эндометрия. У больных раком шейки матки это казалось обоснованным при ранних стадиях заболевания. Проведенные ранее ретроспективные анализы по сравнению расширенных доступов и лапароскопий демонстрировали равнозначную эффективность обоих методов [2]. На основании полученных данных было инициировано рандомизированное проспективное исследование LAAC, под эгидой которого прошли все гинекологические сессии и конгрессы 2018 года [3]. Работа посвящена сравнению открытой хирургии и операций из миниинвазивных доступов с использованием лапароскопических (84,4%) или робот-ассистируемых (15,6%) вмешательств. Дизайн исследования был спланирован как non-inferiority с целью доказать, что миниинвазивная техника не уступает в эффективности обычному хирургическому вмешательству. В работу включена 631 пациентка с IА1, IА2, IB1 стадиями рака шейки матки. Участие приняли 33 центра, находящиеся в большинстве случаев на территории США, а также в нескольких странах Латинской Америки. Перед включением в исследование все центры проходили аккредитацию, которая включала оценку качества выполнения операций в объеме Piver II и III лапаротомным и миниинвазивным доступами.
Набор в исследование завершился досрочно после промежуточного анализа. В марте 2018 года были доложены неожиданные результаты исследования, которые привели к многочисленным обсуждениям данной работы на всех последующих конференциях. Конечной точкой являлось 4,5-летняя безрецидивная выживаемость (БРВ), в группе открытой хирургии данный показатель составил 96,5% и в группе мининвазивной хирургии - 86%. При проведении superiority анализа было получено достоверное увеличение 3-летней БРВ в группе лапаротомии по сравнению с группой миниинвазивных вмешательств: 97,1% и 91,2% соответственно (HR=3,74; р=0,002). Та же тенденция наблюдалась и при оценке выживаемости больных: 99,0% против 93,8% (HR 6,00; 95% CI 1,77-20,30). Частота локорегиональных рецидивов была достоверно выше в группе лапароскопических вмешательств. При этом авторы не нашли взаимосвязи с определенными центрами участниками, все возникшие рецидивы распределились между 14 центрами. Даже при опухолях менее 2 см не было получено преимуществ от использования миниинвазивных операций.
Любопытные факты по оценке качества жизни были доложены на конференции IGCS 2018 в Киото. Оказалось, что качество жизни при использовании лапароскопических и робот-ассистируемых вмешательств было достоверно выше только в первые 6 дней после операции, а в течении последующих 6 месяцев наблюдения качество жизни было сопоставимо в обеих исследуемых группах. Очевидно, что расширенные операции в объеме Piver III при любой методике, если выполнены качественно, будут иметь одинаковую частоту осложнений. Это было озвучено в исследовании LAAC: частота хирургических осложнений отмечалась в одинаковом проценте случаев при лапароскопическом (10,5%) и лапартомном (11,4%) доступах.
Главные координаторы исследования P. Ramirez, M. Frumovitz и A. Obermair, являющиеся ведущими специалистами в хирургическом лечении рака шейки матки и сделавшие ставку на миниинвазивную хирургию, не ожидали полученных результатов. Детально проанализировав выводы ретроспективных работ, они нашли множество погрешностей в выполнении этих анализов, начиная от небольшой прослеженности отдаленных результатов, что могло привести к отсутствию статистических различий между группами открытой и лапароскопической хирургии. Другим объяснением может быть то, что при выполнении лапароскопической хирургии использование маточного манипулятора может увеличить вероятность «разбрызгивания» опухолевых клеток в малом тазу. Второй причиной может быть инсуффляция CO2 - этот газ может потенцировать деление опухолевых клеток, что было показано в нескольких исследованиях [4].
Данные LAAC опубликованы в NEJM в октябре 2018 года и привели к отказу от лапароскопических операций большинством экспертов. Уже в последней версии рекомендаций NCCN 2019 года прописано, что лапароскопические вмешательства при ранних стадиях рака шейки матки не исключаются, однако должны обсуждаться с пациентками возможные риски и польза от такого подхода. Вероятнее всего в ближайшее время в большинстве рекомендаций эксперты откажутся от рутинных лапароскопических вмешательств при раке шейки матки.
Сразу же за результатами исследования LAAC на ASCO 2018 были опубликованы результаты оценки 5-летней выживаемости больных раком шейки матки c IB1 стадией по данным национального регистра США [5]. В анализ включено 2830 женщин, 982 пациентки в группе открытых операций и 910 - в группе лапароскопий. 5-летняя ОВ была достоверно выше в группе лапаротомий.
Сегодня начинает казаться, что лапароскопическая и робот-ассистируемая хирургия сохраняет свои позиции только при раке эндометрия. Однако в октябре 2018 года Cochrane публикует результаты большого анализа по сравнению лапароскопий и лапаротомий при раннем раке эндометрия [6]. Анализ 9 включенных исследований и 4389 пациенток показал, что оба метода имеют одинаковую безрецидивную и общую выживаемость. Не было получено статистически значимых различий по частоте хирургических осложнений. Авторы делают выводы о низкой достоверности в пользу преимущества лапароскопических операций. Безусловно, это ретроспективный анализ, но в будущем он приведет к инициации проспективных исследований, посвященных этой проблеме.
В заключение хочется отметить, что все развивается по синусоиде. Мы наблюдали активный тренд по внедрению лапароскопических операций в онкогинекологии за последнее десятилетие. Теперь, наоборот, отмечено явное снижение интереса и моды к этому виду хирургии. Безусловно, нельзя полностью исключать миниинвазивные вмешательства из списка возможных хирургических опций. Этот подход показан определенной группе больных с большим индексом массы тела, декомпенсированной сопутствующей патологией и не должен становиться рутинным стандартом в онкологических клиниках, как это распространено во многих стационарах России.
Таким образом, 2018 год прошел под эгидой большого разочарования в миниинвазивной хирургии в онкогинекологии.
Читайте также:
