Цитомегаловирус запрет на занятость
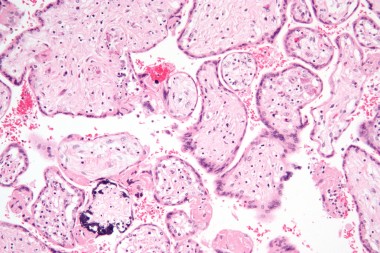
В статье проанализированы опубликованные данные по вопросам адекватной диагностики антенатальной и постнатальной цитомегаловирусной инфекции (ЦМВИ), а также лечению острых ЦМВИ у беременной, плода и новорожденного. Представлены отечественные клинические р
The article gives analysis of the data on the issues of relevance of diagnostics of antenatal and postnatal cytomegaloviral infection (CMVI), as well as treatment of acute CMVI in the pregnant, fetus and newborns. National clinical guidelines on diagnostics and treatment of congenital CMVI developed by the Russian Association of antenatal medicine in 2016, were presented; as well as the first unofficial international guidelines on the issues of diagnostics and treatment of congenital CMVI.
Цитомегаловирус (ЦМВ) — чрезвычайно распространенный вирус, поражающий людей всех возрастов и формирующий пожизненную персистенцию в организме инфицированного человека. Считается, что в большинстве случаев персистенция начинается в ранние годы жизни и протекает латентно, не оказывая выраженного патологического влияния на состояние здоровья инфицированного. С другой стороны, доказано, что персистенция вируса может сопровождаться хроническим воспалением, формировать разнообразные многочисленные иммунные дисфункции и определять развитие вторичных иммунных, аутоиммунных и дегенеративных нарушений. Различного рода иммунокомпрометации могут приводить к рецидивам размножения вируса и многообразным клиническим проявлениям с поражением любых органов и систем в любом возрасте.
Особое значение имеют врожденные инфекции детей, которые отличаются высоким риском развития тяжелых генерализованных форм и инвалидизирующих исходов заболевания, таких как потеря слуха, зрения, умственная отсталость, микроцефалия, судорожный синдром и пр. Такие пожизненные проблемы со здоровьем развиваются примерно у каждого пятого ребенка с врожденной цитомегаловирусной инфекцией (ЦМВИ), что определяет потребность в своевременном пренатальном выявлении беременных и плодов с высоким риском развития врожденной ЦМВИ и ранней диагностике и лечении инфекций у новорожденных.
Теоретические дискуссии по вопросам адекватной диагностики антенатальной и постнатальной ЦМВИ, а также лечению острых ЦМВИ у беременной, плода и новорожденного продолжаются с 1990-х гг., но отсутствие единых руководящих принципов затрудняет практическую работу врачей. Российской ассоциацией специалистов перинатальной медицины в 2016 г. выработаны отечественные клинические рекомендации по диагностике и лечению врожденной ЦМВИ. Созданная в рамках 5-й Международной конференции по ЦМВИ (Брисбен, Австралия, 19 апреля 2015) международная группа экспертов на основе консенсусных дискуссий и обзора литературы выработала первые неофициальные международные рекомендации по вопросам диагностики и лечения врожденной ЦМВИ, которые опубликованы в Lancet Infect Dis в марте 2017. Все эти рекомендации будут нуждаться в постоянном обновлении по мере поступления дополнительных данных.
ЦМВ — двухцепочечный ДНК-вирус, член семейства герпес-вирусов (β-герпесвирус человека). Синтез вирусного генома ДНК происходит в ядре клетки-хозяина. Исследования последних лет подтверждают гипотезу о том, что штаммы ЦМВ могут варьировать в их вирулентности, тропизме и патогенном потенциале, который, в свою очередь, вероятно, связан с генетической изменчивостью ключевых для патогенеза генов. Внешняя оболочка вируса содержит множественные гликопротеины, кодируемые вирусом. Гликопротеин B и гликопротеин H, по-видимому, являются основными факторами для формирования гуморального иммунитета — антитела к ним способны нейтрализовать вирус. Эти гликопротеины используют сегодня при разработке анти-ЦМВ-вакцин [3].
Вирус распространяется различными способами: через продукты крови (переливание, трансплантация органов), грудное вскармливание, пролиферацию в местах контактов (кожа, любые слизистые оболочки), перинатально и половым путем. ЦМВИ может протекать в виде первичной инфекции ранее неинфицированных (серонегативных) пациентов, реинфекции или реактивации у инфицированных (серопозитивных) людей; может вызывать острое, латентное и хроническое течение врожденных или приобретенных форм болезни [4].
При острой ЦМВ-инфекции могут поражаться практически все типы клеток человеческого организма — эндотелиальные клетки, эпителиальные клетки, клетки гладкой мускулатуры, фибробласты, нейронные клетки, гепатоциты, трофобласты, моноциты/макрофаги, дендритные клетки и пр. Все типы клеток поражаются и в мозге: нейроны, астроциты, клетки эпендимы, выстилающие желудочки, макроглия, эндотелий капилляров, оболочек, микроглия, сплетения сосудистой оболочки, дендриты и аксоны — т. е. вирус в мозге не имеет избирательной клеточной цели, что объясняет многообразие клинических форм поражения нервной системы у больных [5].
Считается, что ЦМВ реплицируется в эндотелиальных клетках с низкой скоростью, вызывая преимущественно подострые инфекции, однако истинная скорость репликации вируса в клетках определяется эффективностью цитотоксического Т-клеточного иммунитета и степенью иммуносупрессии хозяина. Так, например, на моделях ЦМВИ у животных продемонстрировано, что отсутствие CD4 Т-клеток сопровождалось более тяжелым и стремительным заболеванием ЦМВИ. Известно также, что ВИЧ-инфицированные новорожденные имеют очень высокую частоту врожденной ЦМВИ с высоким риском смерти, неврологических дефектов и прогрессии ВИЧ-инфекции [6–7].
Особое свойство ЦМВИ — способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов (ИНФ), в первую очередь ИНФ-α. Внедрение ЦМВ приводит к иммунной перестройке в виде снижения реакции лимфоцитов на вирусы в связи с угнетением экспрессии антигена макрофагами, подавлением пролиферативной активности лимфоцитов (что коррелирует с тяжестью болезни), угнетением фагоцитарной активности и завершенности фагоцитоза [7].
Доказано, что и первичные и латентные ЦМВИ сами могут индуцировать хронические воспалительные системные реакции с устойчивой иммунной активацией, запускать и поддерживать аутоиммунные процессы, усиливать аллореактивность Т-клеток после трансплантации и, возможно, участвовать в комплексе причин повышения частоты нейродегенеративных состояний с возрастом человека (Jones R. P. The debility cascade in neurological degenerative disease). Установлено также, что ЦМВ-индуцированные иммунные изменения в пожилом возрасте могут отвечать, например, за замедленную элиминацию вируса гриппа из легких, сниженный поствакцинальный иммунитет на гриппозные вакцины, измененную реакцию организма на терапию интерферонами [8].
Многие годы риск развития врожденных инфекций плода ассоциировали преимущественно с первичной инфекцией матери, однако к настоящему моменту не вызывает сомнения, что большая доля врожденных ЦМВИ (до 75%) встречается в условиях рецидивирующей во время беременности материнской инфекции. Допускаются также и экзогенные реинфекции с новыми штаммами ЦМВ — доказательства основываются на молекулярных данных, подтверждающих получение нового штамма вируса.
Вместе с тем степень риска вертикального инфицирования плода в условиях первичной инфекции матери рассматривают по-прежнему как чрезвычайно высокую — в 30–50% случаев острой первичной инфекции беременной развивается врожденная инфекция ребенка. Показано, что ранее существовавший материнский иммунитет хоть и не гарантирует полной защиты, тем не менее обеспечивает снижение риска врожденной ЦМВИ при следующих беременностях на 69% [9].
Недавними исследованиями установлено, что ЦМВ может поражать амниотическую мембрану, ухудшая цитотрофобласт-индуцированный лимфангиогенез и ремоделирование сосудов в плаценте и задерживая правильное развитие клеток — предшественников трофобласта, одновременно вызывает врожденную провоспалительную иммунную реакцию. Это приводит к гипоксии плода, задержке внутриутробного развития и возможным последующим гипоксическим повреждениям головного мозга. Степень поражения плода определяется сроками антенатального инфицирования и вирусной нагрузкой в размножающихся клетках — чем меньше гестационный возраст, тем более выражена альтерация (разрушение) тканей с формированием пороков развития [10]. Особенно быстро ЦМВ достигает максимума в астроцитарных и глиальных клетках, при этом максимальная экспрессия вируса найдена в глиальных клетках развивающегося мозга мышат (что объясняет микрогирию, микроцефалию и другие пороки ЦМВ-инфицированного мозга детей). По мере увеличения срока гестации в клинической картине инфекционного заболевания плода преобладают симптомы системного воспаления с выраженной пролиферацией и экссудацией. У 1/3 умерших от ЦМВИ новорожденных (из них 60% — недоношенные) при морфологическом исследовании выявляют различные пороки развития. У 43% — признаки генерализованной внутриутробной инфекции с геморрагическими и ишемическими инфарктами (в том числе в головном и спинном мозге) [11].
Способность вируса реплицироваться в любых клетках человеческого организма определяет многообразие клинических форм болезни; ЦМВ может вызывать как генерализованные инфекции, так и поражения отдельных органов: печени, головного мозга, сердца, легких, мочеполовых органов, желудочно-кишечного тракта и др.
У беременных острая первичная ЦМВИ протекает чаще бессимптомно (25–50%) или малосимптомно — с неспецифическими проявлениями (обычно лихорадка, астения и головная боль).
Как первичная, так и рецидивирующая ЦМВИ матери может стать причиной антенатальных ультразвуковых признаков поражения плода в результате трансплацентарной инфекции. Самые частые УЗИ-признаки: задержка роста плода, вентрикуломегалия, микроцефалия, перивентрикулярная гиперэхогенность, кальцификаты в мозге, плевральный выпот или асцит, гепатоспленомегалия, гиперэхогенный кишечник и мекониальный илеус и др. Эти УЗИ-аномалии эмбриона прогнозируют тяжелую генерализованную манифестную врожденную ЦМВИ новорожденного с высоким риском формирования инвалидизирующих исходов болезни и смерти. Поэтому первичная острая ЦМВИ во время беременности может являться показанием к ее искусственному прерыванию. Установлено, что около 4% детей с антенатальной ЦМВИ умрут в утробе матери или вскоре после рождения, среди остальных около 60% будут иметь когнитивные дефекты, нейросенсорную потерю слуха и другие неврологические и прочие проблемы [11–12].
Сегодня установлено также, что нейросенсорная тугоухость является прогрессирующим заболеванием и может формироваться в течение 5–6 лет жизни даже у детей, родившихся с бессимптомной ЦМВИ (это связывают с многолетней репликацией ЦМВ в перилимфе), что требует соответствующей длительности наблюдения ребенка.
При инфицировании в поздние сроки гестации ЦМВИ у новорожденного может проявляться и как генерализованная инфекция, и как поражение отдельных органов с нетяжелыми транзиторными симптомами болезни, например, умеренной гепатомегалией, изолированным снижением количества тромбоцитов или повышенным уровнем аланинаминотрансферазы. Возможна и клинически бессимптомная ЦМВИ с изолированной нейросенсорной тугоухостью.
У 10% всех новорожденных в течение первого месяца жизни возникают инфекционные заболевания в результате в основном семейных контактов, в том числе грудного вскармливания. Экскреция ЦМВ с грудным молоком в течение первых недель после родов бывает низкой, достигает максимума к 4–8 неделям, завершается к 9–12 неделям. Считается, что риск трансмиссии вируса коррелирует с вирусной нагрузкой в молоке, передача максимальна при высокой экскреции. У доношенных детей в результате инфицирования ЦМВ через молоко матери формируется, как правило, субклиническое течение инфекции без остаточных явлений; в клинической картине более вероятно развитие энтероколита и транзиторного холестатического гепатита с минимальным цитолизом. Недоношенные дети (вес
И. Я. Извекова 1 , доктор медицинских наук, профессор
М. А. Михайленко
Е. И. Краснова, доктор медицинских наук, профессор
ФГБОУ ВО НГМУ МЗ РФ, Новосибирск
Цитомегаловирусная инфекция в практике врача: современный алгоритм диагностики и лечения/ И. Я. Извекова, М. А. Михайленко, Е. И. Краснова
Для цитирования: Лечащий врач № 4/2018; Номера страниц в выпуске: 90-95
Теги: новорожденные, беременность, инфекция, персистирование
Все авторы участвовали в рассмотрении и обсуждении предмета. Главным автором был Азеведо Л.С. Pierrotti LC и Yasuda MAS рассмотрели рукопись.
Цитомегаловирусная инфекция является частым осложнением после трансплантации. Эта инфекция возникает из-за передачи из трансплантированного органа из-за реактивации скрытой инфекции или после первичной инфекции у серонегативных пациентов и может быть определена следующим образом: латентная инфекция, активная инфекция, вирусный синдром или инвазивное заболевание. Это состояние происходит в основном между 30 и 90 днями после трансплантации. При трансплантации гемопоэтических стволовых клеток, в частности, инфекция обычно возникает в течение первых 30 дней после трансплантации и в присутствии заболевания трансплантата против хозяина. Основными факторами риска являются то, что реципиент является серонегативным цитомегаловирусом, а донор является серопозитивным, а также когда используются истощающие лимфоциты антитела.
Существует два метода диагностики цитомегаловирусной инфекции: анализ антигеномии рр65 и полимеразная цепная реакция. Серология не имеет значения для диагностики активной болезни, тогда как гистология пораженной ткани и анализ бронхоальвеолярного лаважа полезны при диагностике инвазивного заболевания.
Цитомегаловирусную болезнь можно предотвратить профилактикой (введение противовирусных препаратов всем или в подгруппу пациентов с повышенным риском репликации вируса) или путем превентивной терапии (ранняя диагностика вирусной репликации до развития заболевания и назначение противовирусных препаратов лечение, чтобы предотвратить появление клинического заболевания). Используемый препарат является внутривенным или оральным ганцикловиром; оральный валганцикловир; или, реже, валацикловир. Профилактика должна продолжаться от 90 до 180 дней. Лечение всегда указывается при цитомегаловирусной болезни, а стандартом на основе золота является внутривенный ганцикловир. Лечение следует назначать на 2 — 3 недели и его следует продолжать в течение еще 7 дней после первого отрицательного результата для виремии.
Цитомегаловирус (ЦМВ) является вездесущим вирусом герпеса, который поражает до 60-100% людей в зрелом возрасте и является одним из основных агентов, участвующих в инфекционных осложнениях после трансплантации. CMV, подобно другим вирусам герпеса, создает скрытую инфекцию после первичной инфекции. В иммунокомпетентном хозяине начальная инфекция обычно протекает бессимптомно, но может присутствовать как неопределенный фебрильный, гриппоподобный или мононуклеоз-подобный синдром. В редких случаях инфекция представляет собой системный синдром, затрагивающий многие органы. Кроме того, иммунокомпетентные взрослые могут позднее проявить клинический синдром в результате реактивации скрытого вируса или из-за новой инфекции другим вирусным штаммом. Заболевание, вызванное посттрансплантационной ЦМВ (ПТ-ЦМВ), происходит из-за передачи из трансплантированного органа из-за реактивации скрытой инфекции или после первичной инфекции у пациентов с серонегативными трансплантатами 1-5.
ЦМВ-инфекцию и болезнь можно определить следующим образом:
латентная инфекция — после первоначального иммунного ответа вирус сохраняется в скрытом состоянии, главным образом в клетках миелоидной линии, и использует различные механизмы для уклонения от иммунной системы и для выживания.
активная инфекция — наличие вирусной репликации, диагностированной путем выращивания вируса in vitro; путем обнаружения внутрицитоплазматических и внутриядерных включений, которые являются характеристиками вируса; путем идентификации вируса посредством окрашивания тканей биопсийным материалом; или путем обнаружения доказательств вирусной репликации, обнаруженной антигенетическим анализом или молекулярными методами.
болезнь — свидетельство заражения симптомами, приписываемыми ей.
вирусный синдром — наличие признаков и симптомов заболевания и подтверждение репликации вируса в периферической крови (обнаружено с помощью антигенетического анализа или молекулярных методов).
инвазивное заболевание — наличие специфических симптомов в органе-мишени и гистологические данные, демонстрирующие цитопатический эффект вируса в ткани. В этих случаях могут быть или не быть свидетельства вирусной репликации в периферической крови.
Наиболее распространенной клинической картиной в пересаженном хозяине является вирусный синдром, характеризующийся лихорадкой и недомоганием, а также лейкопенией, тромбоцитопенией и повышенными ферментами печени. Эти знаки появляются с 3 по 4 неделю, с пиком с 6 по 16 неделю, и становятся редкими после 6-го месяца. Симптомы верхнего пищеварительного тракта и, главным образом, боль, являются общими. Диарея, иногда содержащая кровь, является более необычной и указывает на участие толстой кишки. Дыхательные симптомы указывают на более тяжелое заболевание и могут потребовать приема в отделение интенсивной терапии. Кроме того, клинический гепатит, менингоэнцефалит, панкреатит и миокардит встречаются редко. В отличие от того, что обнаружено у ВИЧ-инфицированных пациентов, хориоретинит очень редок у пересаженных пациентов.
Возникновение заболевания, вызванного ЦМВ у трансплантированных пациентов без профилактики, варьируется в зависимости от типа трансплантации, серологического соответствия между донором и реципиентом, используемых иммунодепрессантов (у пациентов с ингибиторами mTOR наблюдается очень низкая частота ЦМВ) и интерференция дополнительных факторы риска болезни. Заболеваемость выше у пациентов, перенесших трансплантацию легкого или сердца и легких (частота 50-75%), и у пациентов, перенесших трансплантацию поджелудочной железы или почек поджелудочной железы (около 50%). Заболеваемость ЦМВ составляет от 9 до 23% после трансплантации сердца, от 22 до 29% после трансплантации печени и от 8 до 32% после трансплантации почки 7. Более того, 30% пациентов, подвергшихся аллогенной трансплантации гемопоэтических стволовых клеток (HSCT), и приблизительно 5% пациентов, подвергшихся аутологичному HSCT, развивают заболевание ЦМВ.
При трансплантации твердых органов (SOT) наибольший фактор риска заболевания ЦМВ представляет собой серологическое рассогласование между донором и реципиентом (получатель серонегативный ЦМВ и донор серопозитивный) (ЦМВ D + / R-). Кроме того, трансплантация CMV D + / R + и трансплантация CMV D- / R + считаются промежуточным риском развития болезни, а трансплантация CMV D- / R-трансплантата считается низким риском ( 2000 копии / мл цельной крови 35,36. Эволюция вирусной нагрузки во времени может быть более важной для прогнозирования развития болезни, чем любые абсолютные значения вирусной нагрузки. Предел обнаружения варьируется в зависимости от различных тестов на вирусную нагрузку, и более низкий предел обнаружения более 1000 копий / мл (с использованием цельной крови или плазмы) может быть недостаточным для выявления заболевания, поскольку некоторые тяжелобольные пациенты могут проявлять очень низкие вирусные нагрузки. Однако очень чувствительный тест (ограничение обнаружения 100 дней после трансплантации) произошло у 24% пациентов, проходящих профилактику, по сравнению с 0% пациентов, подвергающихся превентивному лечению. В другом исследовании Kliem et al. 66 обнаружили значительное снижение заболеваемости ЦМВ за 12 месяцев (17% в группе профилактики и 50% в группе с преимущественным лечением). Пациенты по профилактике развивали инвазивные инфекции позже (135 против 39 дней после трансплантации). В краткосрочной перспективе не было существенной разницы в почечной функции. Тем не менее, частота потери трансплантата на 4-й год после трансплантации была выше у пациентов с упреждающим лечением (78% против 92%). Witzke et al. 68 выявили соответствующие показатели виремии 38,7% против 11% и инвазивные показатели ЦМВ-заболеваний 19,2% против 4,4% в группах превентивного и профилактического лечения. Spinner et al. 69 не обнаружили долгосрочных (4 лет) различий в отношении острого отторжения, потери почек или смерти у пациентов при профилактике или при упреждающем лечении. Reischig et al. 36 была обнаружена сходная частота заболевания ЦМВ с преимущественным лечением и профилактикой (6% против 9%), а появление виремии произошло при 37 по сравнению с 187 днями после трансплантации. Острый отказ был более частым в группе упреждающих (36% против 15%). В двух исследованиях сравнительные затраты были оценены и были одинаковыми в двух схемах, учитывая стоимость противовирусных препаратов и мониторинг с помощью ПЦР 35,58. Примечательно, что затраты на антигенетическое тестирование ниже, чем у RT-PCR.
Существует также гибридная стратегия, используемая некоторыми центрами трансплантации в случаях D + / R: профилактика с последующим превентивным лечением, чтобы предотвратить появление позднего инвазивного заболевания 28.
Использование противовирусных препаратов должно основываться на стандартизированных дозах с соответствующими алгоритмами коррекции уровня почечной функции (таблицы 2 и 3).
Согласно действующим правилам 28,70, варианты профилактики включают внутривенный ганцикловир, оральный валганцикловир и высокие дозы орального валацикловира у реципиентов почечной трансплантации. Был использован оральный ганцикловир, хотя в нескольких исследованиях были получены менее оптимальные результаты.
Хотя валганцикловир является лучшим препаратом для профилактики, потому что он эффективен и доступен в устной форме, его высокая стоимость ограничивает его использование, и он часто недоступен. Таким образом, внутривенный ганцикловир можно рассматривать, поскольку он дешевле и широко доступен, несмотря на необходимость внутривенного использования. Этот препарат использовался даже в виде трехкратного еженедельного приема 71. Валацикловир, хотя и менее эффективен, также доступен в устной форме и может быть альтернативой никакому лекарству вообще 72, 73.
Что касается профилактики заболевания ЦМВ, лечение пероральным CMX001 в дозе 100 мг два раза в неделю уменьшало частоту случаев ЦМВ у реципиентов HSCT, а диарея была распространенным побочным эффектом в дозе 200 мг, назначаемой дважды в неделю 74.
Лечение всегда проявляется при вирусном синдроме, в присутствии заболевания ЦМВ (свидетельство ЦМВ-инфекции с признаками и симптомами заболевания), а также при повреждении тканей и органов при гистологических и иммуногистохимических изменениях. Во время эпиднадзора за превентивным лечением антивирусные препараты следует начинать, как только наличие реплицирующего вируса обнаруживается либо антигенетией, либо RT-PCR-тестированием.
Стандартным лекарственным средством для лечения является внутривенный ганцикловир. Существует ограниченное доказательство того, что оральный валганцикловир также эффективен 75. Поэтому внутривенный ганцикловир является выбором для тяжелой инфекции, но для легкой и умеренной инфекции можно использовать лечение валганцикловиром. Ацикловир и валацикловир не указаны для лечения. Сопутствующее применение микофенолята, азатиоприна, ингибиторов mTOR или сульфаметоксазол-триметоприма может способствовать лейкопении. Следует также избегать модификаций установленных терапевтических режимов, за исключением случаев отмеченной лейкопении. В таких случаях указывается filgrastim.
Рекомендуемая продолжительность лечения определяется недельным мониторингом вирусных нагрузок ЦМВ; лечение должно быть непрерывным до тех пор, пока вирусная эрадикация не будет достигнута в течение одного или двух анализов через минимум две недели. Использование иммунных анализов может иметь потенциальную клиническую полезность для определения длины лечения и выявления пациентов с отрицательными результатами анализа в конце лечения, которые могут воспользоваться вторичной профилактикой 24,28,59.
Факторы риска, которые указывают на необходимость длительного лечения, включают высокую виремию в начале лечения и рецидив ЦМВ. Факторы риска для резистентности включают длительное противовирусное лекарственное воздействие при продолжающейся активной репликации вируса, высокий уровень иммуносупрессивной терапии и неадекватные противовирусные дозы 28. Сопротивление лекарственным средствам следует подозревать в сохранении или увеличении вирусной нагрузки в присутствии профилактики ЦМВ как постоянная репликация вируса и / или клиническая прогрессия после двух-трех недель лечения 28,73.
Фоскарнет является альтернативным вариантом для резистентных к ганцикловиру ЦМВ, хотя частые побочные эффекты и главным образом нефротоксичность ограничивают его использование 44,76.
По завершении лечения острой инфекции консенсус не был достигнут в отношении использования вторичной профилактики. Однако некоторые авторы рекомендуют этот подход для пациентов с высоким риском 28.
Реактивация ЦМВ может возникать у 30% пациентов с ГСКТ и у 70% пациентов с высоким риском, таких как у пациентов с положительной серологией, которые получали трансплантат от отрицательного донора 77. В общей сложности 30% пациентов, подвергающихся аллогенной трансплантации, и приблизительно У 5% пациентов, перенесших аутологичную трансплантацию, развивается заболевание ЦМВ. В HSCT реактивация обычно происходит в течение первых 30 дней после трансплантации и у тех, кто развивает РТПХ. ЦМВ можно реактивировать на протяжении всего периода применения иммуносупрессивного препарата 78,79. Смертность у пациентов с пневмонией или распространенным заболеванием может достигать 90%. Реактивация ЦМВ может также представлять собой задержку приживления. Превентивное лечение уменьшает заболеваемость и смертность этого агента в этой популяции пациентов. Ljungman et al. 79 показали, что заболеваемость ЦМВ-болезнью у пациентов, получавших преимущественное лечение, составила 1,8% через 100 дней после трансплантации и 6,3% через год после трансплантации.
ЦМВ-отрицательные пациенты с ЦМВ-негативными донорами должны получать только продукты с обедненной лейкоцитами крови или переливания от ЦМВ-негативных доноров. Превентивное лечение показано как при аутологичной, так и при аллогенной трансплантации. Лечение начинается при кондиционировании и сдаётся на 100-й день после трансплантации. Также проводятся два недельных обследования (антигенэмия или RT-ПЦР-тестирование). У педиатрических пациентов с аутологичной трансплантацией лечение начинается после приживления и назначается до 60-го дня после трансплантации, с недельными обследованиями (антигенэмия или RT-ПЦР-тестирование). При аллогенных трансплантациях лечение начинается на 10-й день после трансплантации и продолжается до 100-го дня. Лечение также предоставляется пациентам, которые развивают РТПХ. Сравнение между испытанием на вирусную нагрузку и тестом на антигенэмиссию для рекомендации по упреждающему лечению у получавших ХСКТ показало, что использование тестирования на вирусную нагрузку значительно сократило число пациентов, которым требуется преимущественное лечение, без увеличения ЦМВ-заболевания. Сопоставимые данные недоступны для SOT.
Заболеваемость ЦМВ-инфекцией и заболеванием выше у реципиентов трансплантации легких, чем у других реципиентов SOT с частотой от 54% до 92% у пациентов без профилактики ЦМВ 80. В дополнение к прямой заболеваемости и смертности ЦМВ-инфекция ассоциируется с эпизодами острого клеточного отторжения, а также с хронической дисфункцией аллотрансплантата, которая является основным ограничивающим фактором для долгосрочного успеха трансплантации легкого 81. Хотя ни одно исследование не сравнило профилактику и превентивную терапию при трансплантации легких, высокая частота этих осложнений после операции, трансплантация делает использование профилактики ЦМВ существенным в реципиентах трансплантации легких.
В 2005 году консультативный комитет экспертов ЦМВ учредил следующие рекомендации для центров трансплантации легких 82:
Все получатели трансплантации легких должны пройти профилактику ЦМВ, как показано ниже:
1-Профилактику следует проводить с помощью валганцикловира 900 мг / сут (доза, скорректированная на скорость клубочковой фильтрации) в течение не менее 100 дней;
2-Длительная профилактика (более 180 дней) может быть рассмотрена всеми центрами с учетом снижения заболеваемости / заболевания и косвенных последствий ЦМВ;
3-Профилактика должна сочетать противовирусные препараты и CMV-иммуноглобулин, который эффективен для профилактики ЦМВ-инфекции / заболевания и должен рассматриваться для групп высокого риска (D + / R-пациентов и пациентов, использующих ATG);
4 — В течение первых 6 месяцев после трансплантации, включая период профилактики, мониторинг виремии ЦМВ должен проводиться каждые 2 недели (путем тестирования антигенетий RT-PCR или pp65) в соответствии с местными протоколами, и через 6 месяцев мониторинг должен выполняются ежемесячно до конца первого года после трансплантации.
Не сообщалось о потенциальном конфликте интересов.
Определения: синдром ЦМВ и болезнь, поражающая различные органы 19-22.
Доказательства активного ЦМВ в крови: положительность антигенэмии или ОТ-ПЦР-тестирование.
Противовирусные лекарственные дозы, рекомендованные для профилактики в соответствии со скоростью клубочковой фильтрации, которая оценивается на основе клиренса креатинина.
1 таблетка = 500 мг
1 таблетка = 450 мг
некоторые авторы рекомендуют 450 мг / день 2
рекомендуется использовать внутривенный ганцикловир
Примечание: валацикловир и валганцикловир следует давать во время еды
Противовирусные лекарственные дозы, рекомендованные для лечения в соответствии со скоростью клубочковой фильтрации, которая оценивается на основе клиренса креатинина.
1 таблетка = 450 мг
рекомендуется использовать внутривенный ганцикловир
Примечание: валацикловир и валганцикловир следует давать во время еды
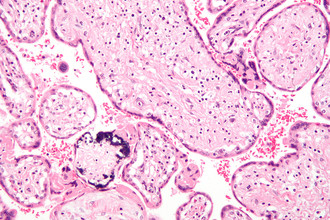
Скрытая угроза: цитомегаловирус
Цитомегаловирус — скрытый бич нашего времени, поражающий новорожденных гораздо чаще нашумевшего вируса Зика. Хотя у здоровых людей заражение часто протекает бессимптомно, вирус вызывает тяжелые осложнения у людей с ослабленным иммунитетом. К сожалению, вылечивать и тем более предотвращать инфицирование современная медицина еще не умеет.
Цитомегаловирус — крупный вирус размером в 150–200 нм, что делает его одним из самых больших по размеру вирусов, известных современной науке. Его геном представлен двухцепочечной ДНК, содержащей информацию для производства более 230 белков.
После заражения вирусные белки начинают синтезироваться в клетке хозяина с вирусной ДНК — ЦМВ так распространяется и поддерживает свою жизнедеятельность.
Один из таких белков (ДНК-полимераза, необходимая для прохождения жизненного цикла вируса) играет роль мишени для использующихся сейчас противовирусных препаратов.
Встречаемость вируса высока везде. Однако этот показатель колеблется в зависимости от возраста, места проживания и социально-экономического статуса: зараженность выше в развивающихся странах и неблагополучных группах населения. Согласно результатам обследований, в среднем в США половина населения от 6 до 49 лет инфицирована ЦМВ. Среди 75–80-летних американцев носителями являются уже девять человек из десяти. В развивающихся же странах среди детей от одного года до пяти лет инфицирован примерно каждый пятый, а у пожилых людей этот показатель может достигать 90–100%.
Поскольку вирус может вызывать врожденные дефекты у детей, эти цифры заставляют специалистов бить тревогу.
Судя по статистике, в группу риска заражения попадает практически любой. Однако серьезные осложнения от вируса грозят в основном людям с пониженной функцией иммунитета: например, пациентам с трансплантированными органами, со СПИДом или новорожденным. Особенно восприимчивы к инфицированию недоношенные дети с низким весом, поскольку их иммунные системы еще не до конца сформированы. Более того, ученые выяснили, что уязвимость для вируса могут повысить некоторые генетические мутации.
Вирус может передаться через выделения из организма инфицированных больных: через слюну, слезы, мочу, фекалии, грудное молоко, сперму и т.д.
Также заразиться можно при переливании крови либо трансплантации органов. Кроме того, на некоторых поверхностях ЦМВ остается жизнеспособным до шести часов, и поэтому изредка можно заразиться и через контакт с предметами.
У здоровых людей симптомов заражения часто нет, и вирус не дает о себе знать. Однако вирус может реактивироваться, и тогда болезнь может проявлять себя в осложнениях различной степени тяжести, от неспецифической фебрильной лихорадки до даже смертельного исхода.
Более того, некоторые ученые считают, что на самом деле вирус сильно недооценен и связан с гораздо большим количеством осложнений, чем можно найти в стандартном описании для врачей.
Клиническую диагностику ЦМВ можно за короткие сроки провести в лаборатории, причем методов обнаружения вируса множество. Диагностика вируса улучшилась и у беременных женщин, хотя, согласно самым последним исследованиям, стандартный тест выявляет отнюдь не все случаи заражения. Одобренного лечения для будущих матерей сейчас нет. Новорожденным с умеренным проявлением симптомов заражения обычно прописывают валганцикловир. Здоровые люди, зараженные ЦМВ, чаще всего не нуждаются в лечении. Лечение обычно назначают пациентам с ослабленной иммунной системой.
Главную угрозу ЦМВ представляет для детей в утробе. Хотя он и уступает по известности вирусу Зика, на самом деле именно цитомегаловирус — самая частая вирусная причина инвалидности и врожденных дефектов у детей в США. Внутриутробное заражение проявляется во многих формах, включая недоношенность, задержку внутриутробного развития, микроцефалию и потерю слуха. Бремя болезни у детей с пожизненной инвалидностью из-за врожденного вируса оценивается в $1,86 млрд в год.
Как отмечает Эми Армстронг-Хеймсот из Университета Северной Аризоны, лишь 13% женщин слышали об этом вирусе. Про то, что его передача от матери ребенку может обернуться трагедией, исследовательница узнала от коллеги с недиагностированным ЦМВ.
Особое внимание направлено на женщин и с ВИЧ, и с ЦМВ, поскольку при таком двойном вирусном заражении риск инфицирования младенца вырастает в разы. Согласно исследованиями, ВИЧ-инфицированные женщины с ЦМВ в моче при родах в пять раз чаще передают ВИЧ младенцам, чем женщины с ВИЧ, но без ЦМВ. Также они в 30 раз чаще заражают новорожденных ЦМВ.
Лучшим методом борьбы с вирусом в перспективе специалисты называют вовсе не лекарства, а вакцины. Они помогут контролировать вирус на уровне популяции — с помощью всеобщей иммунизации. В первую очередь такая стратегия была бы направлена на женщин детородного возраста для предотвращения заражения плода. Однако, конечно, они необходимы и для пациентов с трансплантированными органами и гематопоэтическими стволовыми клетками.
Хотя вакцины пока нет, у исследователей, по-видимому, уже есть достаточное количество фундаментальных знаний для ее создания.
Разработок с различными стратегиями сейчас много — занимаются ими даже такие гиганты фармбизнеса, как Merck и GSK.
Удивительно, как борьба с цитомегаловирусом еще не стала одним из приоритетов международных здравоохранительных учреждений. Разработки вакцин можно было бы ускорить привлечением общественного внимания к этой проблеме и обращением к политическим и экономическим организациям за помощью. Остается надеяться, что многочисленные разработки ученых по созданию эффективной и безопасной вакцины уже близки к успеху — ведь они избавят многие семьи от бремени последствий заражения вирусом и спасут множество жизней.
Читайте также:
- Хронический гепатит неустановленной этиологии что это
- Мед при гриппе детям до года
- Вирус эбола лабораторная диагностика
- Что будет если все время пить при гепатите с
- Вирус зика в беларуси


