Что такое атрофия мышц после инсульта
Мышечная атрофия — это потеря мышечной массы, которая может вызвать серьезные проблемы со здоровьем, в том числе затруднение передвижения и даже правильное дыхание. Часто атрофия мышц происходит из-за крайне малоподвижного образа жизни и других проблем со здоровьем, которые могут привести к потере мышечной массы.
В дополнение к тому, что такое мышечная атрофия, давайте рассмотрим основные симптомы этого состояния и обсудим, какие методы лечения доступны в настоящее время.
- Что такое атрофия мышц?
- Типы мышечной атрофии
- Причины атрофии мышц
- Причины атрофии вследствие недостатка движения
- Причины нейрогенной атрофии
- Другие причины
- Симптомы
- Осложнения состояния
- Диагностика
- Лечение
- Как предотвратить атрофию
- Заключительные советы
Что такое атрофия мышц?
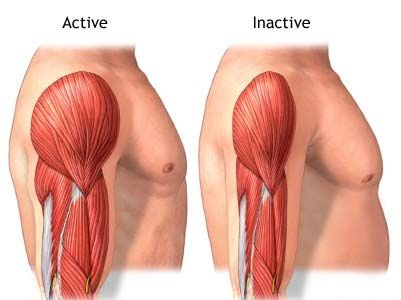
Мышцы — это большой запас белка в нашем организме. Мышечная масса предназначена не только для того, чтобы тело было в форме. Основная физиологическая функция мышц состоит в том, чтобы запасаться источниками энергии для использования её телом при необходимости. То есть, если человек лишен питательных веществ или подвержен серьезному и изнурительному заболеванию (например, рак, серьезные ожоги, аутоиммунные заболевания и сердечная недостаточность), организм ищет другие доступные источники энергии, такие как белок, хранящийся в мышцах.
Он очень полезен в чрезвычайных ситуациях, но не в качестве постоянного источника энергии.
Таким образом, наличие запаса белка в организме полезно для стимулирования здорового старения, предотвращения возникновения метаболических нарушений и обеспечения энергией в условиях стресса жизненно важных органов, таких, например, как сердце, мозг и печень.
Таким образом, мышечная атрофия характеризуется чрезмерной деградацией белков в организме, что ухудшает функцию мышц, а также может нарушать другие функции обмена веществ. Чрезмерная потеря мышечной массы может ухудшить снабжение организма человека энергией в среднесрочной и долгосрочной перспективе и привести к смерти.
Типы мышечной атрофии
Существует 2 основных типа мышечной атрофии, которые различаются по своим причинам. Кроме того, атрофия может затронуть как одну, так и несколько мышц, в зависимости от тяжести и причины.
1. Атрофия из-за недостатка движения.
Это тип мышечной атрофии, при которой потеря мышечной массы происходит из-за недостатка мышечной массы.
Это может произойти из-за чрезвычайно сидячего образа жизни или из-за некоторых медицинских или медицинских состояний, которые мешают кому-либо заниматься физическими упражнениями и даже выполнять простые движения.
Например, люди с ревматоидным артритом или остеоартритом имеют больший риск развития мышечной атрофии, особенно если они никогда не упражняются. Другие медицинские состояния, такие как сломанная кость или сильный ожог (чьё выздоровление происходит медленно) и люди с параличом тела могут стать жертвами мышечной атрофии первого типа.
2. Нейрогенная атрофия.
Нейрогенная атрофия — это тип атрофии вызван проблемами нервной системы. Основными причинами являются нервно-мышечные заболевания, такие как спинальная мышечная атрофия, рассеянный склероз, боковой амиотрофический склероз и синдром Гийена-Барре. Другая проблема со здоровьем, которая может вызвать атрофию, — диабетическая нейропатия.
В таких случаях происходит прерывание нервных сигналов мышцы, нарушая ее нормальное функционирование.
Причины атрофии мышц
Помимо отсутствия физической активности, которое приводит к истощению мышц и упомянутых выше заболеваний, существуют и другие причины, которые могут ухудшить здоровье мышц.
Некоторые другие заболевания и травмы, которые мешают или ограничивают движения, могут вызвать атрофию. Есть даже случаи, когда мышечная атрофия является симптомом серьезного недоедания или мышечного заболевания, связанного со злоупотреблением алкоголем. Даже у астронавтов, которые проводят много времени в космическом путешествии, может также начать развиваться мышечная атрофия из-за недостатка гравитации.
Возможные причины мышечной атрофии из-за недостатка движения:
- госпитализация или длительный отдых из-за болезни или операции;
- временные травмы, такие как перелом руки или ноги;
- недоедание, при котором мышцам не хватает питательных веществ, что приводит к постепенному ослаблению и невозможности использовать мышцы должным образом;
- дерматомиозит, при котором возникает мышечное воспаление, проявляющееся сыпью;
- мышечная дистрофия, наследственное заболевание, которое вызывает прогрессирующую потерю мышечной ткани и порождает мышечную слабость;
- остеоартроз, тип артрита, который вызывает боль и затруднение передвижения;
- ревматоидный артрит, хроническое аутоиммунное заболевание, при котором возникает воспаление в суставах;
- полимиозит, генерализованное воспаление, вызывающее слабость мышц;
- отсутствие физической активности;
- сильные ожоги.
Возможные причины нейрогенной мышечной атрофии:
- миопатия, связанная со злоупотреблением алкоголем;
- рассеянный склероз, поражающий нервную систему, головной и спинной мозг, вызывающий нарушение равновесия, нарушение координации, слабость и другие симптомы;
- боковой амиотрофический склероз или болезнь Лу Герига, тяжелое нервно-мышечное состояние, которое приводит к мышечной слабости и затруднению контроля произвольного движения мышц;
- диабетическая нейропатия, осложнение диабета, связанное с высоким уровнем сахара в крови;
- повреждение шеи, периферических нервов или спинного мозга;
- атрофия спинного мозга, генетическое заболевание, вызывающее снижение мышечной функции;
- воздействие токсинов или соединений, вредных для организма в виде ядов;
- синдром Гийена-Барре, аутоиммунное нервное расстройство, которое вызывает воспаление нерва и мышечную слабость;
- спинальная мышечная атрофия или болезни Верднига-Гоффмана, генетическое заболевание, которое ослабляет и атрофирует мышцы, и ухудшает движения.
- естественный процесс старения;
- длительное использование кортикостероидов;
- сосудистое поражение головного мозга;
- проблемы с глотанием;
- нейропатия, болезнь, которая вызывает повреждение одного или нескольких нервов;
- полиомиелит, вирусное заболевание, влияющая на мышечную ткань и вызвающая паралич.
Симптомы
Симптомы мышечной атрофии могут варьироваться в зависимости от причины. Тем не менее, наиболее часто наблюдаемые симптомы:
- боль;
- ощущение, что одна конечность меньше другой, например, одна рука выглядит тоньше другой;
- нечувствительность;
- отек;
- мышечная слабость в любой конечности тела;
- трудность выполнения простых движений, таких как сидение или ходьба;
- проблемы с глотанием и речью;
- дыхательная недостаточность;
- мышечные спазмы или тремор;
- проблемы с костями и суставами, такие как сколиоз;
- проблемы координации движений;
- усталость;
- жесткость мышц.
Некоторые симптомы могут указывать на другие более серьезные проблемы со здоровьем. Поэтому, если вы заметили любой из следующих симптомов, обратитесь за медицинской помощью как можно скорее:
- изменение уровня сознания, например, обморок;
- искаженная и затянутая речь;
- неспособность говорить;
- изменения зрения, такие как потеря зрения или боль в глазах;
- внезапная слабость или онемение только на одной стороне тела;
- невозможность двигать частью тела.
Эти более серьезные симптомы могут указывать, например, на возникновение рассеянного склероза или инсульта. При рассмотрении любого из этих отклонений необходимо обратиться за помощью.
Осложнения состояния
Мышечная атрофия может быть признаком более серьезного заболевания. Таким образом, отсутствие надлежащего лечения может привести к серьезным осложнениям и необратимому повреждению организма.
Некоторые из осложнений атрофии — это снижение подвижности, снижение физической работоспособности, постоянные проблемы с осанкой, потеря силы и паралич.
Таким образом, пациент должен знать, что как только у него на руках будет диагноз, он должен сразу же начать лечение, чтобы остановить болезнь.
Диагностика
Диагноз состоит из оценки симптомов, истории болезни и запроса на дополнительные обследования. Также важно упомянуть любой тип старой или недавней травмы и рассказать врачу о лекарствах или пищевых добавках, которые вы принимаете.
Врач может запросить некоторые исследования, такие как анализ крови, рентген, МРТ, компьютерная томография, электромиография, биопсия мышц и нервов, а также исследование нервной проводимости, чтобы исключить возможные причины и завершить диагностику.
Лечение
В некоторых случаях, например, у тех, у кого мышечная атрофия возникла вследствие малой подвижности, состояние можно изменить путем лечения, которое включает сбалансированную диету в сочетании с физическими упражнениями и/или физической терапией.
Люди с нейрогенной атрофией мышц не могут быть полностью вылечены, но могут следовать специально разработанному лечению, чтобы снизить симптомы и улучшить качество жизни.
Лечение мышечной атрофии из-за малой подвижности.
Лечение доступно как часть полного курса или как отдельные методы терапии:
Физические упражнения и физиотерапия.
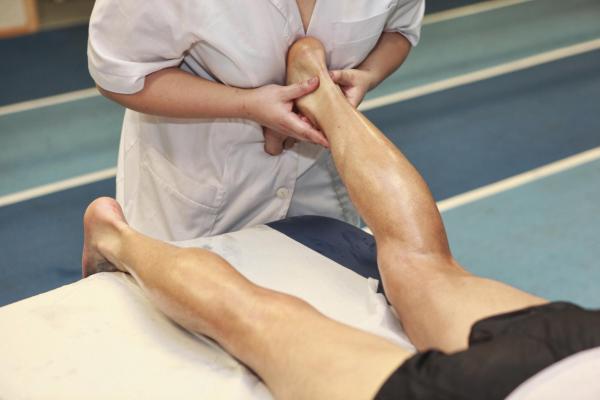
Вам рекомендуется как можно больше двигаться. В дополнение к простым упражнениям, таким как ходьба, рекомендуется заниматься бодибилдингом, если это возможно, и водными упражнениями, такими как аквааэробика, которые оказывают меньшее воздействие на суставы.
Если вам очень трудно заниматься физическими упражнениями, обратитесь за помощью к физиотерапевту, который поможет определить свои физические ограничения и научит правильному выполнению физических упражнений, делая физическую активность более легкой и приятной.
В тех случаях, когда человек не может двигаться в одиночку, необходима физиотерапия, чтобы не дать мышцам атрофироваться еще больше и даже восстановить некоторые повреждения.
Изменения в диете.
Чтобы избежать и лечить атрофию, вызванную малой подвижностью, необходимо правильно питаться. В дополнение к использованию здоровой пищи, важно обеспечить хорошее количество белка, чтобы организм мог восстановить атрофированные мышцы. В некоторых случаях могут быть назначены добавки, но обычно изменения в еде уже поможет восполнить всё необходимое организму.
Другие возможности методы лечения:
- Ультразвуковая терапия. Это неинвазивная терапия, при которой используются звуковые волны для лечения травм, вызывающих атрофию мышц.
- Альтернативные методы лечения. Альтернативные методы лечения, такие как остеопатия и хиропрактика могут помочь уменьшить симптомы.
- Электрические стимулы. При длительных госпитализациях, когда человек не может встать с постели, необходимо, чтобы мышцы работали искусственно с помощью электрических стимулов и/или с помощью медсестер, профессионального терапевта или физиотерапевта, чтобы сохранить мышечную массу. В подобных случаях устройство генерирует электрический ток, который при воздействии на кожу вызывает непроизвольное сокращение мышц.
- Хирургия: В тех случаях, когда хирургическое вмешательство может помочь, назначается операция, после рассмотрения плюсов и минусов вмешательства.
Лечение нейрогенной мышечной атрофии.
В случаях нейрогенной мышечной атрофии, состояние также должно лечиться с использованием лекарств. Это потому, что при этом типе атрофии повреждение нерва не может быть обращено вспять. Часто эти люди не могут выполнять физические нагрузки или испытывают большие трудности с контролем именно движений.
Таким образом, лечение с физиотерапевтами имеет важное значение, чтобы помочь в выполнении упражнений. Кроме того, можно стимулировать мышцы и генерировать непроизвольные сокращения с использованием таких методов, как нервно-мышечная электростимуляция, которая с помощью электрических импульсов, воздействующих на нервы и мышцы, вызывает непроизвольные сокращения мышц, которые помогают движению мышц и лечению атрофии мышц в определенной области.
Поскольку существует несколько типов нейрогенной атрофии, важно выявить правильный диагноз и лечить состояние в соответствии с медицинскими рекомендациями. Как правило, в дополнение к физиотерапии, врачи указывают на использование противовоспалительных кортикостероидов, чтобы уменьшить воспаление и боль и уменьшить компрессию пораженных нервов.
Как предотвратить атрофию
Поскольку мышечная атрофия может возникать и в пожилом возрасте, важно знать способы предотвращения истощения мышц.
Лучший совет — вести активную жизнь. Недостаток физической активности является одним из основных факторов, способствующих атрофии мышц. Поэтому больше занимайтесь спортом, занимайтесь силовыми тренировками не менее 2 раз в неделю, плавайте, танцуйте, бегайте, гуляйте с домашним животным в парке. Важно почаще двигаться!
Другой важный совет — правильно питайтесь. Ешьте натуральные продукты. Это поможет не только сохранить мышцы здоровыми, но и остальную часть тела.
Заключительные советы
За исключением тех случаев, когда вы действительно не можете, правило таково — встань и двигайся. Это могут быть простые движения, но важно не поддаваться трудностям, связанным с атрофией мышц.
Даже если ваша атрофия не может быть обращена вспять, важно следить за ходом лечения и стараться оставаться активным до тех пор, пока это возможно. Это поможет повысить самооценку и качество жизни. Лечение очень важно, и с увеличением количества доступных в медицине ресурсов, можно хорошо жить, имея мышечную атрофию.
Инсульт у мужчин относится к категории тяжелых и опасных заболеваний, требующих незамедлительной квалифицированной помощи больному и проведения обязательных реабилитационных мероприятий, заключающихся в восстановительном лечении, направленном на профилактику рецидивов и осложнений этого тяжелого недуга.
Неутешительны данные статистики и об инвалидизации больных после перенесенного обширного инсульта — после такого приступа из 100 человек только 20 могут вернуться к своей предыдущей работе, а остальные частично или полностью становятся нетрудоспособными и получают одну из трех групп инвалидности.
Масштабы риска
Последствия при инсультах любой тяжести и видов часто связаны с нарушением двигательных функций и, к сожалению, это далеко не все осложнения этого опасного заболевания… Именно поэтому лечение таких пациентов должно проходить под пристальным вниманием врачей различных специальностей в условиях специализированных санаториев и реабилитационных центров. Полный возврат больного к прежнему уровню функционирования организма бывает не всегда возможным. У перенесших инсульт больных могут отмечаться головные боли, нарушения речи, памяти, мочеиспускания и дефекации, зрения, глотания и чувствительности.
Независимо от тяжести последствий перенесенного приступа инсульта больному приходится сталкиваться с необходимостью посторонней помощи. В результате у него изменяется привычный уклад жизни, и такие изменения, направленные далеко не в лучшую сторону, оказывают влияние не только на его уровень благосостояния, но и на жизнь его близких и родных. В подавляющем большинстве случаев последствия после этой болезни бывают достаточно серьезными, т. к. в результате наступивших патологических изменений страдает головной мозг.
Вероятность устранения последствий инсульта с наименьшими потерями в первую очередь зависит от области (см. рис. 1), масштабов поражения ткани головного мозга и своевременности оказания помощи больному. Немаловажное значение в успешности реабилитации больного имеет его возраст и общее состояние здоровья. Более медленно проходит выздоровление пациентов пожилого возраста, т. к. их организм уже не так крепок и молод. Однако и в молодом возрасте масштаб последствий инсульта и скорость выздоровления больного во многом зависят от тяжести поражения ткани головного мозга и места их локализации.

Рис. 1 — Последствия инсульта у мужчин зависят от места его возникновения в головном мозге.
По данным статистики в России только 20% больных, которые перенесли инсульт, поступают в специализированные санатории или реабилитационные центры. Остальные 80% или проводят лечение на дому, или вообще не проходят программ всесторонней реабилитации.
Последствия инсульта
Наиболее характерными последствиями инсультов, которые сопровождают больного на протяжении длительного времени и требуют всестороннего лечения и наблюдения, считают:
Двигательные расстройства — парезы и параличи. Наблюдаются наиболее часто и обычно протекают в виде односторонних гемипарезов. Для восстановления двигательных функций в большинстве случаев необходимо от 3 до 6 месяцев. Более сложные профессиональные и бытовые навыки могут восстанавливаться в более длительные сроки.
Устранение таких последствия достигается при помощи кинезотерапии, включающей в себя ЛФК и обучение ходьбе, дополняющимися массажем, методиками электростимуляции нервно-мышечного аппарата и способов биоуправления с обратной связью (использование слуховых, зрительных, тактильных и других стимулов-сигналов, воспроизводимых при помощи компьютерной или микропроцессорной техники, для получения информации об изменении физиологических процессов).
Расстройства чувствительности. Такие последствия часто сопровождаются двигательными расстройствами. Наиболее значимую роль при восстановлении двигательных нарушений имеет устранение патологических изменений мышечно-суставного чувства. Оно наблюдается примерно у 1/3 части больных и существенно мешает выполнению целенаправленных действий, т. к. совершение любого целенаправленного движения требует постоянного контроля, который при расстройстве мышечно-суставного чувства становится невозможным. Такое последствие инсульта у мужчин в значительной мере затрудняет процесс восстановления многих бытовых навыков по самообслуживанию и ходьбы и делает невозможным совершение тонко направленных действий.
Исправление нарушений чувствительности достигается при помощи специальных курсов ЛФК и методик биоуправления с обратной связью.
Речевые расстройства — афазия, дизартрия. Наблюдаются примерно у 1/3 больных. Афазия может быть:
- сенсорной (нарушается понимание речи);
- моторной (нарушается собственная речь);
- амнестической (больной забывает некоторые слова — названия некоторых действий или предметов);
- сенсомоторной (нарушается и воспроизведение и понимание речи);
- тотальной (полное отсутствие собственной речи и непонимание речи окружающих).
Речевые нарушения часто сопровождаются нарушением чтения и/или письма. При дизартрии у больного сохраняется понимание речи окружающих, они могут читать и писать, но из-за поражения тканей мозга у них происходит расстройство артикуляции.
Основным способом восстановления речи становятся систематизированные и длительные занятия с логопедом-афазиологом, направленные на восстановление речи, письма и чтения. Они должны начинаться как можно раньше (уже в остром периоде болезни) и дополняться приемом ноотропов (Энербола, Ноотропила). Восстановление при нарушениях речи происходит в более длительные сроки, чем нарушение двигательных функций, и занимает годы.
Изменения тонуса мышц. Как правило, такие последствия инсульта происходят по спастическому типу. В некоторых случаях у больного возникает гипотонус мышц (чаще в ноге). Спастическое напряжение мышц осложняет двигательные нарушения и может нарастать в первые месяцы после перенесенного инсульта.
Для устранения такого нарушения больному назначаются миорелаксанты (Лиорезал, Сирдалуд, Баклофен, Мидокалм) и методики физического воздействия (специальный массаж, иглорефлексотерапия, пассивная гимнастика, специальные укладки конечностей, парафинотерапия, гидротерапия, точечный массаж, аппликации из озокерита, криотерапия). Для устранения мышечной гипотонии проводят методики активирующего массажа, прозеринотерапию (подкожное введение Прозерина с постепенным повышением дозы) и электростимуляцию.
Центральный болевой синдром. Выражается в возникновении болей центрального происхождения, наблюдается у 3% больных. Чаще наблюдается наличие очагов поражения в зоне зрительного бугра — таламический синдром. Обычно он развивается не сразу после приступа, а спустя несколько месяцев, и имеет склонность к дальнейшему усилению болевого синдрома. У больного появляются жгучие интенсивные боли в теле и лице с противоположной очагу поражения стороны. Они становятся сильнее при изменениях погоды, надавливании, прикосновении или психоэмоциональном перенапряжении. У больных на фоне частых болей появляются частые колебания настроения, и развивается астено-депрессивный синдром.
Для лечения назначаются антидепрессанты, Финлепсин и транскраниальная электростимуляция.
Трофические нарушения (артропатии суставов, атрофия мышц, синдром болевого плеча, пролежни). Наиболее часто у больных после инсульта наблюдается синдром болевого плеча, который выражается артропатией плечевого сустава и выпадением головки плечевого сустава под тяжестью пораженной парезом руки. У больного появляются боли, которые могут возникать уже в первые дни после приступа. Они усиливаются при отведении или смещении (кпереди или кзади) руки.
Для лечения этого и других трофических нарушений применяются специально разработанные программы, которые включают в себя назначение анаболических гормонов и проведение обезболивающих электропроцедур, вакуумного массажа, озокерито- или парафинолечения, турбулентного гидромассажа и кинезотерапии. При выпадении головки плечевой кости больным показано ношение специальной фиксирующей повязки и проведение электростимуляции мышц плечевого пояса и плеча.
Зрительные нарушения. Нарушения зрительных функций появляются при поражении находящегося в затылочной доле мозга зрительного анализатора и зрительных путей. Они выражаются в виде одностороннего выпадения левого (при поражениях правого полушария) или правого (при поражениях левого полушария) полей зрения. При наличии очагов поражения в полушариях или стволе головного мозга у больного возникают параличи взора, а при повреждении верхних отделов ствола — двоение в глазах.
Бульбарные и псевдобульбарные нарушения. Бульбарные последствия инсульта у мужчин выражаются в нарушениях глотания, артикуляции звуков, а псевдобульбарные — в появлении спонтанного насильственного плача или смеха (т. е. плач и смех появляются беспричинно и не могут подавляться волей больного).
Для устранения бульбарных расстройств используется электростимуляция мышц гортани, языка и мягкого неба, и выполняются упражнения, назначенные логопедом. При выраженном нарушении глотания проводится зондовое кормление больного. Для устранения насильственного плача или смеха назначается прием Клоназепама или Амантадина (Симметрел, Мадантан).
Расстройства высших психических функций. Инсульт может приводить к появлению ухудшения памяти, снижения интеллекта и концентрации внимания, эмоционально-волевых расстройств, дезориентации в пространстве, нарушению выполнения (при отсутствии парезов) сложных движений, нарушению гнозиса (процессов узнавания, распознавания и сопоставления образов) или способности к выполнению целенаправленных двигательных актов.
Таким больным показано проведение длительных курсов приема ноотропов (Энеброл, Ноотропил) и других нейротрофических средств (Церебролизин, Пикамилон), назначение методик кинезотерапии и психотерапии. При появлении астении и депрессии показан прием антидепрессантов и психотерапия.
Расстройства координации и равновесия. Эти последствия возникают при поражениях мозжечка и часто затрудняют восстановление ходьбы и навыков самообслуживания.
Для их устранения применяются специально разработанные для каждого пациента программы ЛФК и методы биологической обратной связи.
Постинсультная эпилепсия. Такое последствие инсульта развивается через 6 месяцев или спустя 2 года у 6-8% больных, перенесших полушарный инсульт.
Для предупреждения и устранения эпиприпадков применяются такие лекарственные препараты как Финлепсин, Депакин и Фенобарбитал.
В каких случаях можно предполагать положительный результат от проводимого реабилитационного лечения?
Острый период при инсульте длится примерно около 28 дней. После этого больному предстоит пройти через период раннего восстановления, который составляет около 6 месяцев. Период полного восстановления после перенесенного инсульта займет около 2-3 лет (в зависимости от степени тяжести инсульта), а остаточные явления могут давать о себе знать на протяжении всей оставшейся жизни.
В каких случаях восстановление после перенесенного заболевания может быть наиболее полным?
- Восстановление после перенесенного приступа инсульта проходит быстрее у больных молодого возраста.
- Эффективность реабилитации во многом зависит от точности диагностики (КТ, МРТ), полноты и правильности оказания первой помощи и раннего начала лечения, которое должно быть не только своевременным, но и квалифицированно-всесторонним.
- Если острый период заболевания был легким или средней тяжести, то восстановление будет более полным.
- Инсульт, локализирующийся в области бассейна позвоночных артерий, проходит без остаточных очаговых последствий — у больного проходит головокружение, исчезает шаткость походки и речевые нарушения.
- Организация правильного ухода за больным и постоянная психологическая поддержка со стороны родных и близких на всех этапах лечения и реабилитации во многом помогает снизить риск наступления последующей инвалидизации.
Во многих случаях восстановление речевых и двигательных функций после перенесенного приступа инсульта происходит не так быстро и устранение этих последствий инсульта у мужчин требует упорной и длительной реабилитации. Она должна включать в себя такие направления:
- правильная организация ухода за больным;
- медикаментозная терапия;
- диетотерапия;
- эрготерапия;
- массаж;
- иглорефлексотерапия;
- мануальная терапия;
- ЛФК;
- физиотерапия;
- речевая терапия;
- обучение бытовым навыкам;
- психотерапия;
- гирудотерапия и др.
Комплексные реабилитационные программы должны дополняться частыми прогулками на свежем воздухе, внимательным отношением со стороны медицинского и обслуживающего персонала и постоянной заботой и поддержкой больного со стороны родных и близких. Такой всесторонний подход и совместные усилия реабилитологов, врачей поликлиник, работников социальных служб и близких людей помогают провести более полное восстановление и избежать усугубления тех последствий, которые инсульт внес в жизнь больного. Помните об этом и будьте здоровы!
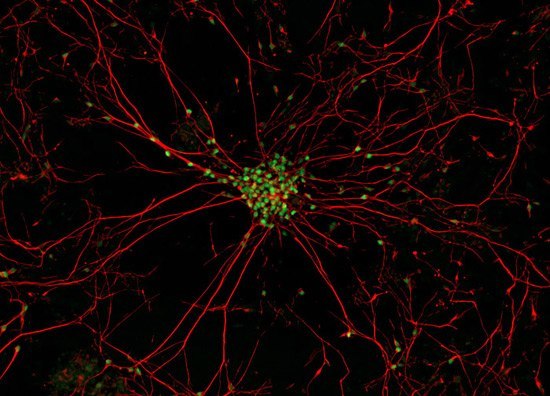
Настоящее фото мотонейрона (двигательного нейрона в передних рогах спинного мозга) - закупорка межсинаптических щелей (зелёные точки) - блокада передачи импульсов через медиаторы (вещества для передачи импульсов) в синапсы (места соединения) отростков нервных клеток.
В центре - тело мотонейрона.
Красные линии -длинные отростки мотонейрона - аксоны и короткие -дендриты.
Причина появления блокады передачи импульсов в межсинаптических щелях учёными мира не найдена. Предположительно - мутация гена,кодирующего фермент передачи этих импульсов через нейромедиаторы - супероксиддисмутазы. (СОД).
Предрасположенность к мутациям гена может иметь наследственный характер по аутосомно-рецессивному типу.
Эндемические (массовые вспышки) случаи этого заболевания зафиксированы у групп военных, живущих в островах на тихом океане. Чаще болеют мужчины от 40 до 60 лет.Следовательно не исключается инфекционная причина развития заболевания.
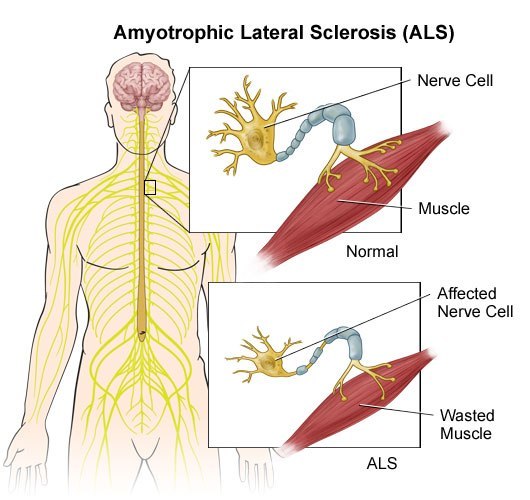
Боковой амиотрофический склероз. (БАС)..
Показано истончение нервных волокон в случае БАС и нарушение иннервации (передачи нервных импульсов) к мышцам. Как следствие - уменьшение работы мышцы и её последующая атрофия. (уменьшение размеров, обратное развитие.)
Блокада передачи нервных импульсов к мышцам (как к поперечно-полосатым которыми мы управляем сами своей волей так и к к гладким, работающим, независимо от нашего сознания, усилий и воли) пищеварительной и дыхательной системы ведёт к смерти из-за невозможности совершать эти жизненно важные моменты работы мускулатуры.
Две статьи из медицинских источников:
1) Теория аксостаза бокового амиотрофического склероза. Аксональная теория бокового амиотрофического склероза
Теория аксостаза основана на анализе патологических процессов, происходящих в аксональном транспорте мотонейронов [Chou S., 1992]. Наибольшими нейронами организма являются двигательные мотонейроны передних рогов спинного мозга и пирамвды Беца. Они должны поддерживать интеграцию дендритов, часто протяженностью более 1 см, и аксон, достигающий 100 см. В аксоне имеются непрерывные потоки, через которые клеточное тело направляет структурные и функциональные белки на периферию и получает обратные сигналы. Ортоградный транспорт бывает 2 видов: а) быстрый — 400 мм в день, идущий в обоих направлениях и транспортирующий связанные с мембраной белки и гликопротеиды, б) медленный — несколько миллиметров в день, транспортирующий сети микрофиламентов, микротрубочек, нейрофиламентов, как компонент "а" (0,1—2 мм в день), а также большой комплекс растворимых белков, как компонент "б" (2—4 мм в день). Ретроградный аксональный транспорт несет эндогенные (аминокислоты, фактор роста нервов) и экзогенные (токсин столбняка, вирус полиомиелита, простого герпеса, бешенства, лектин пероксидазы хрена и др.) субстанции от терминальных аксонов к клеточному телу со скоростью свыше 75 мм в день. Морфологические исследования аксонального транспорта в биоптатах двигательных веточек периферических нервов больных боковым амиотрофическим склерозом выявили уменьшение скорости ретроградного аксонального транспорта и, следовательно, связи терминального аксона с перикарионом [Bieuer A. et al., 1987]. В межреберных нервах больных АБС еще до развития признаков нейрональной дегенерации появляются изменения белков микротрубочек [Binet S. et al., 1988].
Улыраструктурные исследования проксимального аксона и аксонального бугорка мотонейронов переднего рога спинного мозга больных, умерших от бокового амиотрофического склероза [Sasaki S. et al., 1996], показали нарушение быстрого аксонального транспорта. Гладкий эндо-плазматический ретикулум теряет структуру: происходит скопление митохондрий, лизосом, Леви-подобных телец, эозино-фильных и гиалиновых включений, липофусциновых гранул, особенно в аксональном бугорке. Присутствие этих необычных структур является отражением дисфункции аксонального транспорта. Применительно к возможной этиологии АБС еще ранее выдвинута концепция "аксостаза" [Chou S., 1992]. Ней-ротоксические факторы путем ретроградного транспорта избирательно поражают нейрон, создавая феномен "суицидцального транспорта". Ухудшение медленного транспорта в аксоне сопровождается скоплением нейрофиламентов, набуханием проксимального аксона и последующей дистальнои аксональной атрофией, а также вторичной демиелинизацией, характерной для центральной дистальнои аксонопатии или "ретроградного умирания" — "dying back". Определенную значимость в развитии ранних морфологических изменений мотонейронов при АБС имеет теория аутоиммунитета [Smith R. et al., 1996], основанная на появлении антител к зарядам входа кальциевых каналов. Пассивный перенос фракций, содержащих иммуноглобулин, мышам вызывает изменения нервно-мышечных соединений, сходные с таковыми при спорадическом АБС. У животных эти изменения отражают расстройства внутриклеточного Са2+ гомеостаза, и раннее повреждение пластинчатого комплекса в мотонейронах в форме набухания и фрагментации. Иммуноглобулины от больных спорадическим боковым амиотрофическим склерозом вызывают зависимый от Са2+ апоптоз клеток вследствие оксидативных повреждений. Апоптоз, обусловленный иммуноглобулином от указанных больных, регулируется присутствием связанных белков, которые могут модулировать избирательную ранимость нейронов при спорадическом АБС.
2) Боковой амиотрофический склероз
Несмотря на более чем 100-летнее изучение, боковой амиотрофический склероз (БАС) остается фатальным заболеванием центральной нервной системы. Заболевание характеризуется неуклонно прогрессирующим течением с избирательным поражением верхнего и нижнего мотонейронов, что приводит к развитию амиотрофий, параличей и спастичности. До настоящего времени вопросы этиологии и патогенеза остаются невыясненными, в связи с чем не разработаны специфические методы диагностики и лечения этого заболевания. Рядом авторов отмечено повышение частоты встречаемости заболевания среди лиц молодого возраста (до 40 лет).
МКБ-10 G12.2 Болезнь двигательного неврона
ЭПИДЕМИОЛОГИЯ
Боковой амиотрофический склероз дебютирует в возрасте 40 – 60 лет. Средний возраст начала заболевания 56 лет. БАС - болезнь взрослых, и не наблюдается у лиц моложе 16 лет. Несколько чаще заболевают мужчины (отношение мужчины-женщины 1,6-3.0: 1).
БАС является спорадическим заболеванием и встречается с частотой 1,5 – 5 случая на 100 000 населения.
В 90% случаев БАС носит спорадический, а в 10% - семейный или наследственный характер как с аутосомно-доминантным (преимущественно), так и с аутосомно-рецессивным типами наследования. Клинические и патоморфологические характеристики семейного и спорадического БАС практически идентичны.
В настоящее время возраст является основным фактором риска при БАС, что подтверждается нарастанием заболеваемости после 55 лет, и в этой возрастной группе уже не наблюдается различий между мужчинами и женщинами. Несмотря на достоверную связь БАС с возрастом, старение является только одним из предрасполагающих факторов развития патологического процесса. Вариабельность заболевания как в различных возрастных группах, так и среди лиц одного возраста предполагает существование определённых факторов риска: дефицит, или наоборот, наличие определённых нейропротективных факторов, к которым в настоящее время относят: нейростероиды или половые гормоны; нейротрофические факторы; антиоксиданты.
Некоторые исследователи отмечают особо благоприятное течение заболевания у молодых женщин, что подтверждает несомненную роль половых гормонов, в особенности эстрадиола и прогестина, в патогенезе бокового амиотрофического склероза. Подтверждением этому являются: большая частота встречаемости БАС у мужчин до 55 лет (при этом у них отмечается более раннее начало и быстрое прогрессирование заболевания по сравнению с женщинами); с наступлением менопаузы женщины болеют также часто, как и мужчины; единичные случаи заболевания боковым амиотрофическим склерозом во время беременности. К настоящему времени существуют единичные работы по изучению гормонального статуса больных с боковым амиотрофическим склерозом, и ни одной, посвящённой определению концентраций гормонов у молодых пациентов.
Этиология заболевания не ясна. Обсуждается роль вирусов, иммунологических и метаболических нарушений.
В развитии семейной формы БАС показана роль мутации в гене супероксиддисмутазы-1 (Cu/Zn-супероксиддисмутазу, SOD1), 21q22-1 хромосома, выявлен также БАС, связанный с 2q33-q35 хромосомой.
Синдромы, клинически не отличимые от классического БАС, могут возникать в результате:
•опухоли большого затылочного отверстия
•спондилез шейного отдела позвоночника
•артериовенозная аномалия спинного мозга
•бактериальные - столбняк, болезнь Лайма
•вирусные - полиомиелит, опоясывающий лишай
Интоксикации, физические агенты:
•токсины - свинец, алюминий, другие металлы.
Читайте также:


