Что такое рефрактерная инфекция

Представлен случай ревматоидного артрита (РА) высокой степени активности, рефрактерного к проводимому лечению, а также развитие токсического поражения печени в виде лекарственного гепатита. Авторы обсуждают проблемы преодоления неэффективности лечения, ра
A case of rheumatoid arthritis (RA), with high extent of activity, refractory to therapy, and the development of toxic liver injury in drug-induced hepatitis was presented. The authors discusses the problem of overcoming the ineffectiveness of treatment, development of complications and selection of optimal therapy of RA.
Известно, что для лечения РА используется широкий спектр препаратов, обладающих противовоспалительной и иммуносупрессивной активностью [2, 3]. Однако, несмотря на рациональное применение синтетических лекарственных средств (базовых противовоспалительных препаратов, БПВП), позволившее существенно улучшить прогноз и отсрочить развитие инвалидности, более чем у половины пациентов с РА не удается надежно контролировать прогрессирование заболевания.
При отсутствии эффекта от традиционной терапии с применением БПВП и сохранении высокой активности иммуновоспалительного процесса больным РА назначаются генно-инженерные биологические препараты (ГИБП) [4]. Перечень ГИБП постоянно расширяется, однако наиболее изученными и чаще всего используемыми в клинической практике остаются ингибиторы фактора некроза опухоли-α (ФНО-α) — основного цитокина, определяющего развитие иммуновоспалительного процесса и костных деструкций при РА, а также анти-В-клеточные моноклональные антитела против антигена CD20, находящегося на поверхности зрелых В-лимфоцитов (ритуксимаб). К препаратам, блокирующим стимуляцию Th1-лимфоцитов путем связывания молекул CD80/86, находящихся на поверхности антигенпрезентирующих клеток, которые взаимодействуют с рецепторами CD28 Т-лимфоцитов, относится абатацепт. Также применяется гуманизированное моноклональное антитело к человеческому рецептору интерлейкина-6 — тоцилизумаб [4, 9, 11].
Несмотря на высокую клиническую эффективность ГИБП у пациентов с тяжелым РА, опыт длительного применения этих препаратов в реальной клинической практике свидетельствует, что 30% пациентов рефрактерны к этой терапии [9].
Следует подчеркнуть, что и синтетические БПВП, и ГИБП в равной степени способны токсически воздействовать на различные системы организма, включая сердечно-сосудистую, гепатобилиарную, вызывая развитие тяжелых состояний, что является существенным ограничением для применения данного вида терапии [1, 4].
Больная С., 59 лет, с апреля 2010 г. наблюдается в ревматологическом отделении клиники СЗГМУ им. И. И. Мечникова. На основании критериев ACR (1987 г.) верифицирован РА высокой степени активности (DAS28 = 5,8). Показатели функции печени на тот момент находились в пределах нормальных значений. Проведена пульс-терапия высокими дозами глюкокортикоидов и цитостатиков с улучшением, базисная терапия лефлуномидом 20 мг в сутки совместно с глюкокортикоидами (метилпреднизолон 12 мг в сутки). От приема метотрексата решено воздержаться в связи с имеющимся участком фиброателекталаза S5 правого легкого и участков локального пневмофиброза обоих легких.
В августе 2010 г. активность РА высокая (DAS28 = 6,4), впервые отмечается повышение уровня печеночных ферментов до 7–8 норм, прием лефлуномида отменен.
С ноября 2010 г. начата ГИБП — препаратом выбора стал тоцилизумаб (моноклональное антитело к рецептору интерлейкина-6). После первых трех инфузий лабораторная активность заболевания остается высокой. Параллельно проводилась пульс-терапия, плазмаферез без эффекта, а также начата базисная терапия азатиоприном 100 мг в сутки. В декабре 2010 г. уровень аланинаминотрансферазы (АЛТ) составлял 12 норм, аспартатаминотрансфераза (АСТ) 17 норм, в связи с чем азатиоприн отменен.
В связи со стойкой высокой активностью РА, отсутствием эффекта от неоднократной комбинированной пульс-терапии, инфузий тоцилизумаба, непереносимости базисной терапии лефлуномидом, метотрексатом, в марте 2011 г. начата анти-В-клеточная терапия ритуксимабом. Первые 2 инфузии препарата по 500 мг выполнены без осложнений. После лечения значительного улучшения больная не отмечала, сохранялись боли в суставах, синовиты, длительная утренняя скованность, субфебрильная лихорадка.
В июле 2011 г. активность РА сохраняется высокая (DAS28 = 6,19) и принято решение о переводе больной на биологическую терапию модуляторами Т-клеточной костимуляции — препарат абатацепт. Первое введение без осложнений, показатели функции печени находились на высоком уровне. Пациентке регулярно проводилось обследование на вирусные гепатиты, неоднократно проводилось ультразвуковое исследование (УЗИ) брюшной полости, компьютерная томография (КТ) брюшной полости, но размеры и структура печени находились в пределах нормы.
На фоне терапии абатацептом впервые отмечалось улучшение самочувствия и регресс суставного синдрома. В декабре 2011 г. после пятой инфузии абатацепта уровень печеночных ферментов стабильно высокий и дальнейшее лечение данным препаратом прекращено.
В июле 2012 г. начата базисная терапия циклофосфаном внутримышечно в дозе 200 мг 2 раза в неделю, но попытка однократного введения препарата вызвала тошноту, слабость, головокружение, сердцебиение, кардиалгии, боли в животе. От дальнейшего введения циклофосфана также было решено отказаться. Лабораторное обследование в это время демонстрировало стабильно высокий уровень печеночных ферментов (до 8 норм) при отсутствии повышения уровня билирубина. Для уточнения состояния печени больной проведена эластометрия печени, сцинтиграфия скелета, печени, селезенки, компьютерная томография брюшной полости, расширенное вирусологическое обследование, но патологии не выявлено. На фоне массивного курса гепатопротекторной терапии добиться значимого снижения уровня биохимических показателей не удавалось. В ноябре 2012 г. проведена биопсия печени, по результатам которой обнаружен лобулярный гепатит минимальной степени активности, данных за вирусное поражение не получено. К лечению в это время добавлена урсодезоксихолевая кислота (УДХК) в дозировке 1000 мг в сутки. Все изменения биохимических показателей были расценены как проявления лекарственного токсического гепатита. На фоне приема УДХК в феврале 2013 г. наблюдалась практически полная нормализации уровня ферментов. Обсуждался вопрос о назначении биологической терапии блокаторами ФНО-α (инфликсимаб), но больная отказалась от этого лечения.
До июня 2015 г. пациентка наблюдалась амбулаторно с коррекцией дозы метилпреднизолона (максимально до 16 мг в сутки). От приема базисной терапии, а также терапии биологическими препаратами и проведения пульс-терапии решено воздержаться.
Последнее стационарное обследование в декабре 2015 г. Сохраняется умеренная активность РА (DAS28 — 5,1) и нормальный уровень ферментативной активности печени. Значимых изменений и ухудшений со стороны внутренних органов не выявлено. До настоящего времени для лечения РА больная получает метилпреднизолон 8 мг в сутки, НПВП (рис.).
Преодоление неэффективности остается одной из актуальных проблем клинической ревматологии, в связи с чем разрабатываются лекарственные средства нового поколения для лечения данной патологии [6].
На сегодняшний день активность РА у больной сохраняется на высоком уровне, что требует поиска решения проблемы дальнейшей тактики ее ведения. В мае 2016 г. после расширенного комплексного обследования планируется начать терапию с применением ингибиторов янус-киназ (тофацитиниб (Яквинус)) согласно рекомендациям Европейской противоревматической лиги (European League Against Rheumatism, EULAR) 2013 г. [10] совместно с поддерживающей дозой препарата УДХК [7, 8].
Литература
Е. А. Трофимов, кандидат медицинских наук
А. С. Трофимова 1
ФГБОУ ВО СЗГМУ им. И. И. Мечникова МЗ РФ, Санкт-Петербург

Рефрактерная анемия относится к одному из самых опасных видов заболеваний крови. В большинстве случаев на фоне патологии развивается острый лейкоз, спасти от которого человека не всегда возможно. Элементы крови при заболевании из костного мозга в кровоток поступают в незрелой форме, из-за чего их нормальное функционирование оказывается невозможным.
Что такое рефракторная анемия

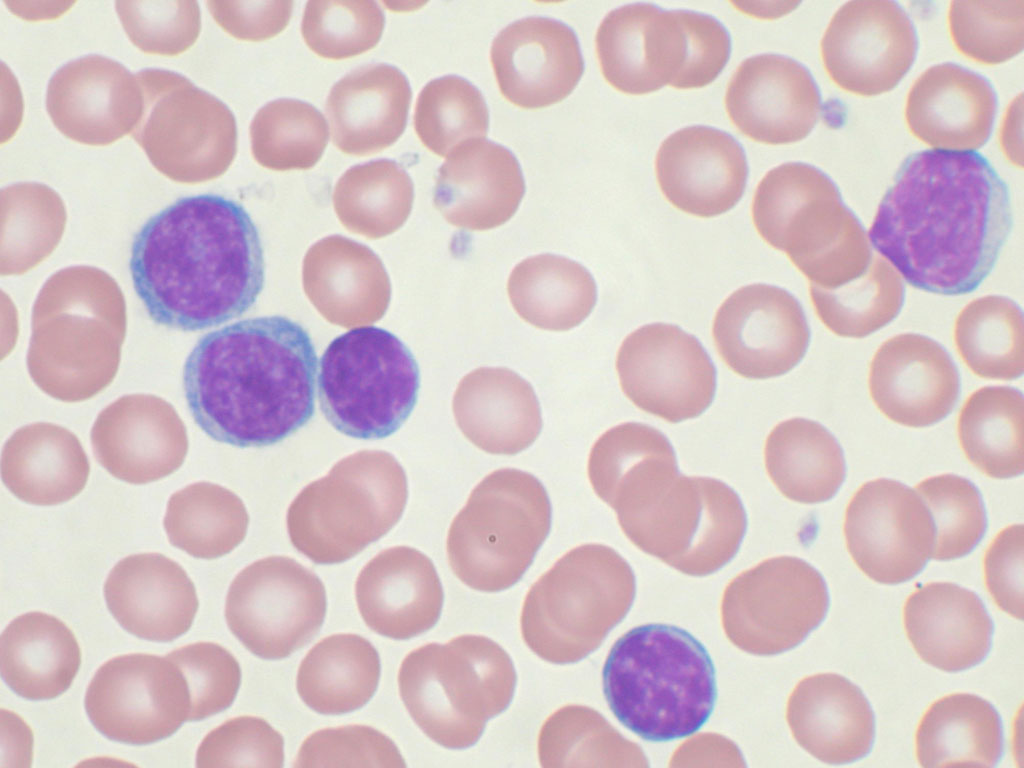
Анемия в мазке крови
Заболевание относится к приобретённым патологиям костного мозга из группы гетерогенных. Кроветворная функция в организме нарушается не только в количественных показателях, но и в качественных. Патология отличается стойкостью к терапевтическому воздействию, которое эффективно против иных видов патологии. Заболевание диагностируется с равной частотой у женщин и мужчин.
При рефрактерной анемии происходит нарушение в выработке ферментных элементов в костном мозге, из-за чего концентрация эритроцитов значительно снижается. При заболевании отмечается резкое падение гемоглобина и понижение количества не только эритроцитов, а также и тромбоцитов и лейкоцитов. Изменения, которые происходят в костном мозге, необратимые. Особая опасность патологии заключается в том, что в течение длительного времени заметной для больного симптоматики не возникает, и о наличии болезни становится известно только в момент острого лейкоза.
Симптомы

Могут иметь место частые беспричинные обмороки
Симптоматика возникает, когда заболевание уже достаточно сильно развито. Первичные симптомы, такие как единичные точечные кровоизлияния под кожей, появление синяков от незначительных ударов и бледность, редко замечаются больным. Когда состояние становится тяжёлым, развиваются следующие признаки болезни:
- слабость, приводящая к непереносимости физических нагрузок,
- частые обмороки, которые происходят без видимых на то причин,
- сильные головокружения,
- регулярные обильные кровотечения из дёсен и носа,
- сильная бледность,
- подверженность инфекционным заболеванием и грибковым поражениям,
- образование синяков даже от простого нажима,
- одышка,
- быстрое исхудание,
- сильные боли в области тазобедренного сустава,
- выраженная дрожь в теле,
- нарушения дыхания,
- боли неопределённого характера,
- нервозность,
- сильная потливость,
- высыпания на коже.
При развитии симптоматики состояние больного ухудшается стремительно, и обойтись без обращения за врачебной помощью в такой ситуации нельзя.
Причины возникновения

Причиной анемии может стать длительный контакт с пестицидами
По причине появления заболевание разделяется на две группы — первичную и вторичную. Первичное нарушение диагностируется у пожилых людей, и причина его развития остаётся пока неизвестной. Вторичная форма нарушения развивается в любом возрасте на фоне длительного проведения радиотерапии или химиотерапии при раке; а также на фоне следующих факторов, вызывающих нарушения в работе костного мозга:
- нахождение в регионе с повышенным радиационным фоном;
- длительное воздействие неблагоприятной экологии;
- длительный и частый контакт с пестицидами, бензином и химическими растворителями;
- наследственные болезни крови;
- длительный приём ряда лекарственных препаратов.
Заболевание в некоторых случаях развивается на фоне приёма противоопухолевых средств, которые могут разрушать не только патологические клетки, но и здоровые. В результате этого нарушается состояние системы кроветворения, из-за чего картина крови резко ухудшается, в значительной степени усугубляя состояние больного.
Диагностика

Жалобы и анамнез дополняются лабораторными тестами
Предположительный диагноз обычно ставится на основании анамнеза и жалоб пациента. Далее для его подтверждения проводится лабораторная диагностика, при которой осуществляются общий анализ крови и исследование тканей костного мозга, полученных при пункции. Также требуется физикальное исследование для оценки тяжести состояния больного.
При изучении тканей костного мозга оценивается их клеточность, соотношение ростков кроветворения, наличие атипичных клеток. Именно данное исследование является основной мерой для диагностики патологии.
Лечение рефрактерной анемии

При выявлении признаков анемии пациенты подлежат лечению
Терапия при заболевании направлена на снижение интенсивности его проявлений, так как вылечить болезнь невозможно. Также при лечении ставится задача не допустить развитие осложнения, которым является острый лейкоз. При выборе терапии учитывается причина появления нарушения, возраст больного и наличие прочих патологий. Основное поддерживающее лечение сводится к следующему:
- внутривенное вливание дефицитных компонентов из состава крови;
- гормональные препараты, стимулирующие образование ростков кроветворения;
- корректировка прочих патологий;
- использование иммуносупрессорных препаратов.
У молодых пациентов при высоком риске появления острого лейкоза проводится курс химиотерапии. Полное выздоровление больного возможно только после операции по пересадке костного мозга, но эффективность метода не 100%.
Осложнения и прогноз

Своевременное лечение помогает достигнуть благоприятных прогнозов
Основное осложнение заболевания — развитие острого лейкоза. Прогноз для больных зависит от стадии патологии и эффективности поддерживающей терапии. При хорошем прогнозе продолжительность жизни составляет до 11 лет, в то время как при плохом больной редко проживает более 6 месяцев. Заболевание относится к категории злокачественных болезней крови.
Профилактика
Эффективные методы профилактики заболевания не разработаны. Единственное, что рекомендуют врачи для снижения риска появления проблем с системой кроветворения, это поддержка иммунитета, полноценное питание и отказ от вредных привычек. Также важно не допускать присутствия факторов, способствующих развитию патологии, и при первых же признаках нарушения обращаться за врачебной помощью.
Заболевания крови составляют многочисленную и разнообразную группу синдромов, формирующихся при нарушениях качественного и количественного состава крови. Все они систематизируются, исходя из поражения какого-либо компонента крови. Гематологические заболевания делят на три основные группы:
- патологии, характеризующиеся снижением уровня гемоглобина;
- гемобластозы;
- гемостазиопатии.
Рефрактерная анемия – одна из разновидностей малокровия, отличающаяся нарушением созревания клеток красного ростка.
Миелодиспластический синдром – это что?
Группу заболеваний и состояний с нарушением процесса образования эритроцитов, моноцитов, тромбоцитов, гранулоцитов в миелоидной ткани (миелоидное кроветворение) с высокой вероятностью развития опухолевого поражения кроветворной системы в медицине именуют миелодиспластическим синдромом (МДС).
Одно из заболеваний группы миелодиспластического синдрома – рефракторная анемия. Данная патология, как и все остальные, объединенные МДС, относится к гематологическим заболеваниям, характеризующимися цитопенией (снижением уровня определенного вида клеток в крови) и патологическими изменениями костного мозга.
Классификация миелодиспластического синдрома
В международную классификацию болезней были внесены некоторые изменения, которые коснулись и гематологических заболеваний. Систематизация схожа с предложенной ранее ВОЗ, но отличается от FAB количеством вариантов определения заболеваний:
- D46.0 - рефрактерная анемия без сидеробластов.
- D46.1 - РА с кольцевыми сидеробластами. Незрелые кровяные клетки в крови не обнаруживаются.
- D46.2 - рефракторная анемия с избытком бластов 1. В анализе крови цитопения, превышение уровня моноцитов, тельца Ауэра отсутствуют.
- D46.3 - рефракторная анемия (РА) со множеством бластов с трансформацией.
- D46.4 - РА неуточненная.
- D46.5 - рефракторная цитопения со многолинейной дисплазией.
- D46.6 - миелодиспластический синдром, ассоциированный с делецией 5q.
- D46.7 - другие миелодиспластические синдромы.
- D46.9 - миелодиспластический синдром неуточненный.
Особенности рефрактерной анемии
Refractorius в переводе с латыни означает "невосприимчивый", "трудноизлечимый". Заболевание относится к гематологическим и характеризуется нарушением развития эритроцитного ростка в крови, продуцируемого костным мозгом. При синдроме рефрактерной анемии сначала снижается содержание эритроцитов в крови, а потом и остальных клеток, поражается орган кроветворной системы, отвечающий за гемопоэз.
Основная опасность патологии заключается в том, что она не поддается лечению, основанному на применении железосодержащих препаратов. Данный вид анемии часто протекает практически бессимптомно и выявляется при диагностике других патологий. Болезнь быстро прогрессирует и ведет к развитию острого лейкоза.
Рефракторная анемия с избытком бластов
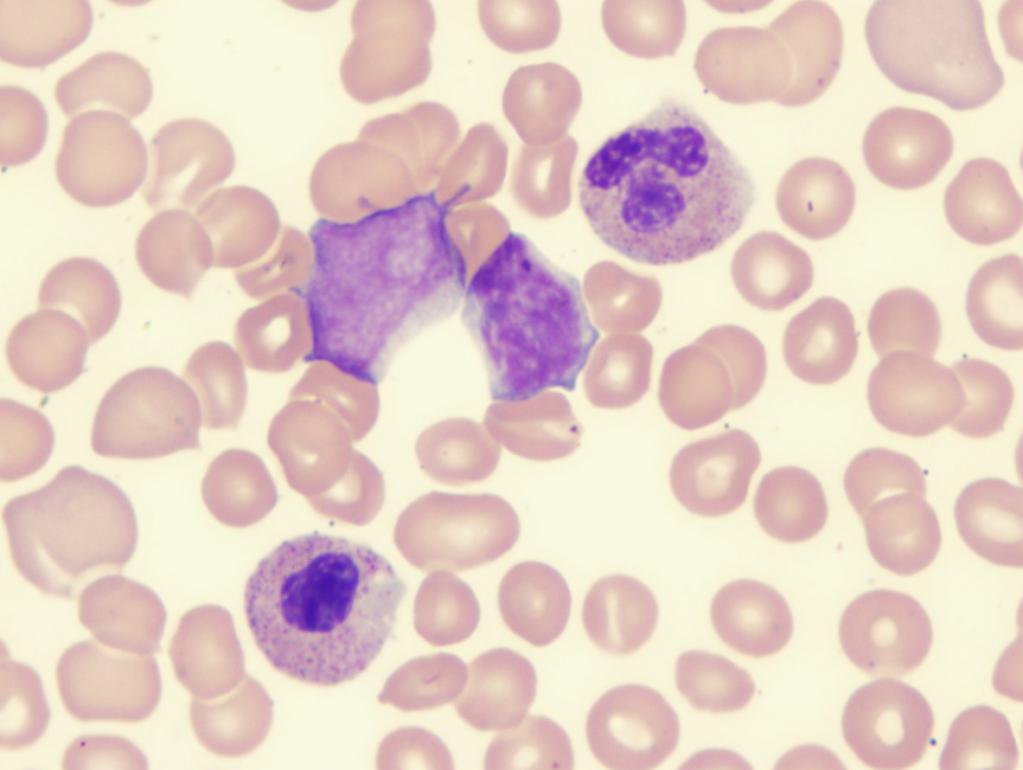
Исходя из статистических данных, людей с подобным диагнозом около 1 015 000. Заболевание чаще всего встречается у мужчин 75-80 лет, а у женщин в возрасте 73-79 лет. Патологию делят на два типа:
- РАИБ-1 – характеризуется цитопенией, увеличением числа моноцитов в крови. Палочковидные красные белковые включения в цитоплазме моноцитов (тельца Ауэра) не обнаруживаются. В костном мозге наблюдается дисплазия одной клеточной линии, бластов (незрелые кровяные клетки) около 5-19 %.
- РАИБ с трансформацией – анализ крови показывает повышенное содержание моноцитов, выявляются тельца Ауэра. Содержание бластов около 30 %. В костном мозге обнаруживаются дисплазии сразу нескольких клеточных линий. Подобная картина способствует развитию острого миелолейкоза.
Смертность от данной патологии составляет около 11 %.
Причины возникновения патологии
Точные причины развития заболевания до сих пор не выявлены. Разделяют два типа синдрома, и по каждому из них установлены факторы риска.
Первичный (идеопатический) выявляется в почти 90 % случаев. Факторы риска:
- Курение.
- Превышенный уровень радиации.
- Проживание в неблагоприятной экологической зоне.
- Регулярное вдыхание паров бензина, органических растворителей, пестицидов.
- Врожденный нейрофиброматоз Реклингхаузена (развитие опухолей из нервной ткани).
- Наследственная анемия Фанкони.
- Синдром Дауна.
Вторичный тип рефрактерной анемии (МДС) наблюдается в 20 % случаев, может развиваться в любом возрасте. Основные причины развития:
- Химиотерапия или радиотерапия.
- Долговременное применение некоторых групп лекарственных средств: циклофосфаты, антрациклины, ингибиторы топоизомеразы, подофиллотоксины.
Вторичный вариант отличается высокой резистентностью к терапии и большой вероятностью формирования острого лейкоза и, как следствие, неблагоприятным прогнозом.
По каким признакам определить заболевание?

Часто патология развивается без каких-либо симптомов, что мешает начать лечение на ранних этапах и в мягких формах. Как правило, диагностируется рефрактерная анемия в тяжелой степени при плановом обследовании пациента.
Но выявить заболевание на ранних этапах все же можно. Первые его признаки имеют много общего с проявлениями, возникающими при патологиях печени, аутоиммунных заболеваниях и любой другой анемии. К ним относятся:
- Бледность, прозрачность кожи, в особенности на лице.
- Чрезмерное утолщение рогового слоя эпидермиса на локтях и коленях.
- Образование гематом, которые долго проходят.
- Постоянные трещины на слизистой рта.
- Ломкость ногтей.
- Изменение обоняния и вкуса: пристрастие к резким запахам, желание есть землю, мел.
- Быстрая утомляемость.
- Частые ОРВИ с тяжелым течением.
При обнаружении подобных симптомов следует обратиться к врачу.
Клинические проявления тяжелой степени патологии

Клиническая картина анемии состоит из двух фаз: хроническая гемодепрессия и тяжелая (финальная) стадия.
При гемодепрессии наблюдаются следующие проявления:
- Значительное повышение температуры, лихорадка.
- Резкий упадок сил.
- Общее плохое самочувствие.
- Снижение веса.
- Увеличение внутренних органов: селезенки, печени.
- Увеличение и болезненность лимфатических узлов.
Подобные состояния затяжные, с периодами ремиссии.
Симптомы тяжелой степени рефрактерной анемии (миелодиспластический синдром) такие же, как при остром лейкозе. Болезнь развивается стремительно. Одной из ее особенностей является обнаружение бластов в анализе крови. Заболевание сопровождается следующими симптомами:
- Гематомы, даже при незначительных ушибах.
- Кровоточивость десен.
- Гингивит.
- Бинокулярное смещение глазного яблока.
- Упорные повторные воспалительные процессы в носоглотке.
- Нагноение царапин, небольших ран.
- Боли в области позвоночника.
У пациентов пожилого возраста возникают вторичные заболевания, чаще поражается сердечно-сосудистая система. Пациенты испытывают боли при ходьбе в нижних конечностях.
Диагностические мероприятия
При первых подозрительных симптомах необходимо обратиться к доктору. Диагноз "миелодиспластический синдром" или "рефрактерная анемия с избытком бластов" ставится только после прохождения ряда лабораторных исследований. Они включают:
- Клинический анализ периферической крови.
- Цитологические исследования аспирата костного мозга.
- Трепанобиопсия заключается во взятии биоматериала из костного мозга путем прокола большеберцовой кости.
- Цитогенетический тест. Анализ выявляет хромосомные нарушения, является обязательным.
В зависимости от клинической картины заболевания могут быть назначены дополнительные диагностические мероприятия:
- УЗИ брюшной полости.
- Эзофагогастродуоденоскопия желудочно-кишечного тракта.
- Анализ на специфические онкомаркеры.
Методы терапии
Выбор способа лечения рефрактерной анемии обусловлен выраженностью клинических проявлений и результатами лабораторных исследований. Схемы терапии довольно сложны и определяются врачом. Пациенты с небольшим количеством бластов находятся в группе низкого риска. Они получают заместительное и поддерживающее лечение и могут вести практически обычный образ жизни. Приблизительная схема лечения такова:
Прогнозирование
Прогноз рефрактерной анемии (миелодиспластический синдром) зависит от клинической картины, ответной реакции организма на терапию, своевременности обращения за медицинской помощью. Исход заболевания обусловлен выраженностью дефицита определенных клеток, наличие и профиль хромосомных отклонений, количество бластов и их тенденцию к развитию в крови и костном мозге.
Профилактика

Ввиду того что сущность, обстоятельства и механизмы развития патологии до конца еще не исследованы, то и действенные профилактические методы назвать практически невозможно. Врачи советуют придерживаться следующих рекомендаций по сохранению здоровья:
- Правильно сбалансировано питаться.
- Включать в рацион продукты с высоким содержанием железа.
- Чаще совершать прогулки на свежем воздухе.
- Отказаться от вредных привычек, в частности курения.
- При работе с пестицидами или органическими растворителями применять средства защиты.
Рефракторная анемия – опасное гематологическое заболевание, переходящее в онкологию. Чтобы избежать тяжелых стадий заболевания и серьезных последствий, необходимо регулярно проводить плановый осмотр. При обнаружении патологии необходимо полностью пройти курс терапии, многим пациентам это помогло не только улучшить, но и продлить жизнь.
УТВЕРЖДАЮ
Министр здравоохранения Российской Федерации
УТВЕРЖДАЮ
Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека
М.А. Мурашко
А.Ю. Попова
Временные методические рекомендации
ПРОФИЛАКТИКА, ДИАГНОСТИКА И ЛЕЧЕНИЕ НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИИ (2019-nCoV)
Версия 1 (29.01.2020)
Введение
1. Этиология и патогенез…. . 2
2. Эпидемиологическая характеристика…. 4
3. Диагностика коронавирусной инфекции . 6
3.1. Алгоритм обследования пациента с подозрением на новую
коронавирусную инфекцию, вызванную 2019-nCoV…. 6
3.2. Клинические особенности коронавирусной инфекции . 9
3.3. Лабораторная диагностика коронавирусной инфекции . 10
4. Лечение коронавирусной инфекции . 12
4.1. Этиотропная терапия…. 12
4.2. Патогенетическая терапия…. 14
4.3. Симптоматическая терапия . 17
4.4. Особенности клинических проявлений и лечения заболевания у
детей…. 17
4.4.1. Особенности клинических проявлений…. 17
4.4.2. Особенности лечения…. 20
4.5. Терапия неотложных состояний при коронавирусной инфекции…. 24
4.5.1. Интенсивная терапия острой дыхательной недостаточности….
4.5.1.1 Проведение неинвазивной и искусственной вентиляции легких….
4.5.1.2 Проведение экстракорпоральной мембранной оксигенации….
4.5.2. Лечение пациентов с септическим шоком…. 26
5. Профилактика коронавирусной инфекции…. 27
5.1. Специфическая профилактика коронавирусной инфекции…. 27
5.2. Неспецифическая профилактика коронавирусной инфекции…. 28
5.3. Медикаментозная профилактика коронавирусной инфекции…. 30
6. Маршрутизация пациентов и особенности эвакуационных мероприятий больных или лиц с подозрением на новую коронавирусную инфекцию, вызванную 2019-nCoV…. 30
6.1. Маршрутизация пациентов и лиц с подозрением на новую коронавирусную инфекцию, вызванную 2019-nCoV…. 30
6.2. Особенности эвакуационных мероприятий больных или лиц с подозрением на новой коронавирусную инфекцию, вызванную 2019— nCoV, и общие принципы госпитализации больного, подозрительного на заболевание коронавирусной инфекцией . 34
Приложение 1-4. 44
1
ВВЕДЕНИЕ
Появление в декабре 2019 г. заболеваний, вызванных новым коронавирусом (2019-nCoV), поставило перед специалистами в области охраны здравоохранения и врачами трудные задачи, связанные с быстрой диагностикой и клиническим ведением больных c этой инфекцией. В настоящее время сведения об эпидемиологии, клинических особенностях, профилактике и лечении этого заболевания ограничены. Известно, что наиболее распространенным клиническим проявлением нового варианта коронавирусной инфекции является пневмония, у значительного числа пациентов зарегистрировано развитие острого респираторного дистресс— синдрома (ОРДС).
Рекомендации, представленные в документе, в значительной степени базируются на фактических данных, опубликованных специалистами ВОЗ, китайского и американского центра по контролю за заболеваемостью, а также Европейского Центра по контролю за заболеваемостью в материалах по лечению и профилактике этой инфекции.
Методические рекомендации предназначены для врачей лечебно— профилактических учреждений инфекционного профиля, а также врачей— реаниматологов отделений интенсивной терапии инфекционного стационара.
1. ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Коронавирусы (Coronaviridae) – это большое семейство РНК— содержащих вирусов, способных инфицировать человека и некоторых животных. У людей коронавирусы могут вызвать целый ряд заболеваний – от легких форм острой респираторной инфекции до тяжелого острого респираторного синдрома (ТОРС). В настоящее время известно о циркуляции среди населения четырех коронавирусов (HCoV-229E, -OC43, -NL63 и —
HKU1), которые круглогодично присутствуют в структуре ОРВИ, и, как правило, вызывают поражение верхних дыхательных путей легкой и средней тяжести.
По результатам серологического и филогенетического анализа коронавирусы разделяются на три рода: Alphacoronavirus, Betacoronavirus и Gammacoronavirus. Естественными хозяевами большинства из известных в настоящее время коронавирусов являются млекопитающие.
До 2002 года коронавирусы рассматривались в качестве агентов, вызывающих нетяжелые заболевания верхних дыхательных путей (с крайне редкими летальными исходами). В конце 2002 года появился коронавирус (SARS-CoV), возбудитель атипичной пневмонии, который вызывал ТОРС у людей. Данный вирус относится к роду Betacoronavirus. Природным резервуаром SARS-CoV служат летучие мыши, промежуточные хозяева – верблюды и гималайские циветты. Всего за период эпидемии в 37 странах по миру зарегистрировано более 8000 случаев, из них 774 со смертельным исходом. С 2004 года новых случаев атипичной пневмонии, вызванной SARS-CoV, не зарегистрировано.
В 2012 году мир столкнулся с новым коронавирусом MERS (MERS— CoV), возбудителем ближневосточного респираторного синдрома, также принадлежащему к роду Betacoronavirus. Основным природным резервуаром коронавирусов MERS-CoV являются верблюды. С 2012 года зарегистрировано 2494 случая коронавирусной инфекции, вызванной вирусом MERS-CoV, из которых 858 закончились летальным исходом. Все случаи заболевания географически ассоциированы с Аравийским полуостровом (82% случаев зарегистрированы в Саудовской Аравии). В настоящий момент MERS-CoV продолжает циркулировать и вызывать новые случаи заболевания.
Новый коронавирус 2019-nCoV (временное название, присвоенное Всемирной организацией здравоохранения 12 января 2020 года) представляет собой одноцепочечный РНК-содержащий вирус, относится к семейству Coronaviridae, относится к линии Beta-CoV B. Вирус отнесен ко II группе патогенности, как и некоторые другие представители этого семейства (вирус SARS-CoV, MERS-CoV).
Коронавирус 2019-nCoV предположительно является рекомбинантным вирусом между коронавирусом летучих мышей и неизвестным по происхождению коронавирусом. Генетическая последовательность 2019— nCoV сходна с последовательностью SARS-CoV по меньшей мере на 70%.
Патогенез новой коронавирусной инфекции изучен недостаточно. Данные о длительности и напряженности иммунитета в отношении 2019— nCoV в настоящее время отсутствуют. Иммунитет при инфекциях, вызванных другими представителями семейства коронавирусов, не стойкий и возможно повторное заражение.
2. ЭПИДЕМИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА
Пути передачи инфекции: воздушно-капельный (при кашле, чихании, разговоре), воздушно-пылевой и контактный. Факторы передачи: воздух, пищевые продукты и предметы обихода, контаминированные 2019-nCoV.
Установлена роль инфекции, вызванной2019-nCoV, как инфекции, связанной с оказанием медицинской помощи. По состоянию на 23.01.2020 в одной из больниц г. Ухань выявлено 15 подтвержденных случаев заболевания среди врачей, контактировавших с больными 2019-nCoV.
Стандартное определение случая заболевания новой коронавирусной инфекции 2019-nCoV
Подозрительный на инфекцию, вызванную 2019-nCoV, случай:
— наличие клинических проявлений острой респираторной инфекции, бронхита, пневмонии в сочетании со следующими данными эпидемиологического анамнеза:
— посещение за последние 14 дней до появления симптомов эпидемиологически неблагополучных по 2019-nCoV стран и регионов (главным образом г. Ухань, Китай);
— наличие тесных контактов за последние 14 дней с лицами, находящимися под наблюдением по инфекции, вызванной новым коронавирусом2019-nCoV, которые в последующем заболели;
— наличие тесных контактов за последние 14 дней с лицами, у которых лабораторно подтвержден диагноз 2019-nCoV.
Вероятный случай инфекции, вызванной 2019-nCoV:
— наличие клинических проявлений тяжелой пневмонии, ОРДС, сепсиса в сочетании с данными эпидемиологического анамнеза (см. выше).
Подтвержденный случай инфекции, вызванной 2019-nCoV:
1.Наличие клинических проявлений острой респираторной инфекции, бронхита, пневмонии в сочетании с данными эпидемиологического анамнеза (см. выше).
2. Положительные результаты лабораторных тестов на наличие РНК 2019-nCoV методом ПЦР.
3. ДИАГНОСТИКА КОРОНАВИРУСНОЙ ИНФЕКЦИИ
3.1. АЛГОРИТМ ОБСЛЕДОВАНИЯ ПАЦИЕНТА С ПОДОЗРЕНИЕМ НА НОВУЮ КОРОНАВИРУСНУЮ ИНФЕКЦИЮ, ВЫЗВАННУЮ 2019-NCOV
Диагноз устанавливается на основании клинического обследования,
данных эпидемиологических анамнеза и результатов лабораторных исследований.
1. Подробная оценка всех жалоб, анамнеза заболевания,
эпидемиологического анамнеза. При сборе эпидемиологического анамнеза обращается внимание на посещение в течение 14 дней до первых симптомов, эпидемически неблагополучных по 2019-nCoV стран и регионов (в первую очередь г. Ухань, Китай), наличие тесных контактов за последние 14 дней с лицами, подозрительными на инфицирование2019-nCoV, или лицами, у которых диагноз подтвержден лабораторно.
2. Физикальное обследование, обязательно включающее:
— оценку видимых слизистых оболочек верхних дыхательных путей,
— аускультацию и перкуссию легких,
— пальпацию лимфатических узлов,
— исследование органов брюшной полости с определением размеров печени и селезенки,
— термометрию,
с установлением степени тяжести состояния больного.
3. Лабораторная диагностика общая:
-выполнение общего (клинического) анализа крови с определением уровня эритроцитов, гематокрита, лейкоцитов, тромбоцитов, лейкоцитарной формулы;
-биохимический анализ крови (мочевина, креатинин, электролиты, печеночные ферменты, билирубин, глюкоза, альбумин). Биохимический анализ крови не дает какой-либо специфической информации, но обнаруживаемые отклонения могут указывать на наличие органной дисфункции, декомпенсацию сопутствующих заболеваний и развитие осложнений, имеют определенное прогностическое значение, оказывают влияние на выбор лекарственных средств и/или режим их дозирования;
-исследование уровня С-реактивного белка (СРБ) в сыворотке крови. Уровень СРБ коррелирует с тяжестью течения, распространенностью воспалительной инфильтрации и прогнозом при пневмонии;
— пульсоксиметрия с измерением SpO2 для выявления дыхательной недостаточности и оценки выраженности гипоксемии. Пульсоксиметрия является простым и надежным скрининговым методом, позволяющим выявлять пациентов с гипоксемией, нуждающихся в респираторной поддержке и оценивать ее эффективность;
— пациентам с признаками острой дыхательной недостаточности (ОДН) (SрO2 менее 90% по данным пульсоксиметрии) рекомендуется исследование газов артериальной крови с определением PaO2, PaCO2, pH, бикарбонатов, лактата;
— пациентам с признаками ОДН рекомендуется выполнение коагулограммы с определением протромбинового времени, международного нормализованного отношения и активированного частичного тромбопластинового времени.
4. Лабораторная диагностика специфическая:
4. ЛЕЧЕНИЕ КОРОНАВИРУСНОЙ ИНФЕКЦИИ
Читайте также:
- Креон при ротавирусной инфекции у взрослых
- Бифидумбактерин капсулы при дисбактериозе
- Пенсия в инфекционном отделении на украине
- На члене шишки инфекция
- Лихорадка и сыпь на ногах


