Энцефалит майерса что это
Аутоиммунный энцефалит – это неврологическое заболевание. Оно опасно для человека, так как достигнуть полного выздоровления невозможно. Врачи применяют симптоматическую терапию, направленную на облегчение страданий пациента. Болезнь проявляется выработкой антител (клеток иммунной системы), которые направлены не против чужеродных микроорганизмов, а на собственные структуры тела (в данном случае нервную ткань).
Патогенез (механизм развития)
В результате воздействия повреждающего фактора, которым часто является вирус, иммунная система начинает вырабатывать Т-киллеры (клетки, уничтожающие вирусы и инфекции). Если их производится слишком много, иммунный ответ становится агрессивным, он начинает действовать против собственных клеток.
При уничтожении клеток серого и белого вещества головного мозга (ГМ), происходит уменьшение органа. В нем начинаются процессы атрофии (уменьшение питания сосудами, снижение функции). Болезнь затрагивает одно из полушарий. При некрозе астроцитов (отростков нервных клеток), связь между нейронами нарушается. Сигнал не передается, поэтому информация из внешнего мира не доходит до человека.
Уничтожение нейронов – это необратимый процесс, поэтому заболевание не излечивается. Так как головной мозг отвечает за функциональность всех систем организма, симптоматика аутоиммунного энцефалита ярко выражена, врач заподозрит ее по клиническим проявлениям и подтвердит с помощью лабораторных и инструментальных анализов.
Причины развития патологии
Точных причин развития аутоиммунного энцефалита не установлено. Это связанно с тем, что мозг плохо изучен. Выделяют факторы, которые влияют на образование аутоиммунных антител:
- повторные заболевания головного мозга (воспаление, травмы, кисты);
- врожденные и приобретенные нарушения иммунитета (иммунодефицит);
- аутоиммунные заболевания других органов (системная красная волчанка, артериит, ревматоидный артрит);
- частые вирусные болезни (эпидемический паротит, вирусный гепатит, ВИЧ);
- раковые заболевания головного мозга;
- генетические нарушения;
- дегенеративные нарушения мозга, которые характеризуются снижением передачи импульсов по нервным клеткам, их некрозом;
- попадание инфекции через гемоэнцефалический барьер (сеть кровеносных сосудов и лимфоузлов, которая у здорового человека не дает чужеродным агентам пройти к органу);
- отравление тяжелыми металлами, ядами.
Классификация
Для каждого типа аутоиммунного энцефалита характерна своя симптоматика и место повреждения нейронов. Поэтому выделяют несколько видов заболевания.
Аутоиммунный лимбический энцефалит
Характеризуется уменьшением интеллектуальных способностей личности. Больной перестает узнавать людей, путает слова, то есть уменьшается когнитивная функция. Невралгические симптомы развиваются в виде головных болей, приступов эпилепсии, дискинезии (неспособности управлять мышечными движениями, они становятся резкими). Если поврежден участок мозга, ответственный за функцию эндокринной системы (гипофиз), произойдут гормональные сбои.
Так как заболевание не излечимо, оно проходит в двух формах, которые сменяют друг друга (острая и хроническая). Аутоиммунный рецепторный энцефалит является вариантом лимбической формы. Образуется у женщин с новообразованиями яичников. Проявляется психическими нарушениями (галлюцинации, агрессия, паранойя). Человеку трудно дышать из-за нарушений дыхательного центра, сознание нарушается, появляются судороги. Пациент впадает в вегетативное состояние.
Аутоиммунный стволовой энцефалит
Развивается при попадании иммунных комплексов в ствол головного мозга. Характеризуется поражением глаз (веко опускается, появляется непроизвольное движение глазных яблок). Утрачивается функция вкусовых рецепторов языка. Работа вестибулярного аппарата утрачивается, человек не держит равновесие. Аутоиммунный энцефалит ствола мозга нарушает функцию слуха (полностью или частично).
Энцефалит Шильдера
Проявляется дегенеративными процессами (состояние, характеризующееся потерей функции нейронов различных отделов головного мозга) белого вещества, моста и мозжечка. Ткань этих структур воспаляется. Болезнь начинает развиваться с 4 лет и достигает пика к 15 годам. Симптоматика схожа с другими воспалительными и раковыми поражениями ГМ, поэтому диагностика затруднена. У детей быстро утрачиваются умственные способности, появляется тремор (дрожь) конечностей, судороги, головные боли. Со временем ребенок перестает узнавать людей. Лечение не разработано.
Энцефалит Расмуссена
Опасное заболевание, которое не поддается терапии. Причины до конца не ясны. Появляется в подростковом возрасте из-за нестабильности иммунной и других систем. Прогрессирует быстро. Распространяется на одно или оба полушария мозга. Одно из них полностью атрофируется. Этот вид энцефалита характеризуется эпилептическими припадками, которые не купируются лекарственными средствами.
Симптомы
Симптоматика аутоиммунного энцефалита ярко выражена. По ней врач заподозрит наличие заболевание, которое подтверждается с помощью анализов.
- Мышцы начинают непроизвольно сокращаться, из-за этого дергаются конечности, человек падает при ходьбе. У некоторых пациентов появляются судороги языка, что затрудняет речь или полностью ее купирует.
- С возрастом сигнал из головного мозга перестает доходить до ног, поэтому они теряют чувствительность. Это постепенно приводит к параличу.
- Походка на ранних стадиях шаткая, неуверенная, движения не координированы (размашистые, не четкие).
- Когнитивные функции (интеллектуальные, направленные на общение) постепенно ослабевают. У пациента спутано сознание, слабо развита речь, он перестает узнавать близких людей. Память ухудшается, развивается слабоумие.
- Наблюдаются расстройства речи. Афазия — человек путает слова, не может их произнести, меняет буквы местами.
- Развиваются апраксические расстройства, то есть не способность делать произвольные движения.
- Постоянно меняется настроение. Человек бывает агрессивным, подавленным или счастливым, не зависимо от окружающей обстановки.

В симптомокомплекс также входят следующие состояния:
- судороги, припадки, схожие на эпилептические;
- температура тела периодически достигает 38°;
- головная боль, головокружения;
- рвота без причины, тошнота;
- нарушение зрения (появляется при поражении височной доли): функция утрачивается полностью или частично (при нарушении части зрительного нерва), перед глазами появляются искры;
- нистагм — это состояние, проявляющееся непроизвольным движением глаз (из стороны в сторону или по кругу);
- светобоязнь, резь в глазах;
- диплопия — раздваивание в глазах;
- птоз — опущение верхнего века;
- утрата чувства собственного тела (пациент уверен, что у него появилось больше пальцев или нет ноги);
- усталость, сонливость (человек спит по несколько дней с небольшими перерывами на бодрствование).
Диагностика
Первый этап диагностики аутоиммунного энцефалита основывается на сборе анамнеза. Это опрос жалоб, поиск симптомов. Если пациент не может говорить, опрашиваются его родственники или опекуны.
По выявленным симптомам врач дает направления на лабораторные и инструментальные исследования. Так как у больных аутоиммунным энцефалитом выражены неврологические признаки, терапевт направит пациента к неврологу. Он смотрит на следующие симптомы:
- степень сознания (полное или его отсутствие);
- способность к мышлению, интеллект;
- качество речи;
- степень развития рефлексов;
- зрение и движение глаз.
Проводится исключение неврологической симптоматики: судороги, тремор, головная боль, нечленораздельная речь. После этого назначаются лабораторные анализы, позволяющие оценить состояние организма и исключить некоторые заболевания:
- Общий анализ крови, биохимия (оценка состояния крови, выявление С-реактивного белка, количество гемоглобина, число лейкоцитов, скорость оседания эритроцитов, позволяющая выявить воспаление).
- Общий анализ мочи (проводится для постановки на учет).
- МРТ или КТ головного мозга (проводится только одно из исследований, чтобы уменьшить радиоактивный эффект) выявляет строение ГМ, очаги атрофии, воспаления, демиелинизации волокон (отсутствие миелиновой защитной оболочки), новообразования, кровотечения.
- Люмбальная пункция — метод изъятия спинномозговой жидкости, осуществляется с помощью пункции между позвонками, позволяет выявить воспаление, инфекцию, грибы.
Важно! Постановка такого сложного диагноза, как аутоиммунный энцефалит, возможна только при осуществлении всех методов, так как, основываясь только на одном из них, можно спутать диагнозы.
Дифференциальный диагноз
Дифдиагноз проводится на основе методов диагностики. Необходимо исключить инфекцию, микозы, травмы, опухоли, вирусы, которые вызывают такие же признаки невралгии, как и аутоиммунный энцефалит. Схожей симптоматикой обладают наследственные нарушения структур ГМ, аутоиммунные заболевания других органов, воспаления сосудов (васкулит) мозга, склерозирующие состояния ГМ.

Главной отличительной чертой аутоиммунного энцефалита является наличие воспаления в крови, спинномозговой жидкости, лейкоцитоз (повышение лейкоцитов), отсутствие бактериального очага. Других данных по лабораторным признакам не выявляется. На КТ и МРТ видны очаги воспаления мозга на ранних стадиях, атрофия одного из полушария — на поздних. С возрастом добавляется характерная симптоматика неврологического расстройства.
Лечение
Лечение аутоиммунного энцефалита сводится к улучшению качества жизни, снижению тремора, болевых ощущений. Полного излечения нет.
Применяют следующие принципы терапии:
- Постельный режим.
- Прогулки на свежем воздухе.
- Обильное питье.
- Жаропонижающие препараты при повышении температуры тела свыше 38°.
- Обезболивающие анальгетики (при сильных судорогах появляются боли мышц).
- Противоэпилептические средства.
- Диета, содержащая много жирных кислот и уменьшенное количество белков и углеводов.
- Очищение крови от иммунных комплексов с помощью плазмафереза (жидкость из сосудов переливается в специальный препарат, очищается, возвращается обратно пациенту через катетер).
- Лекарства, улучшающие качество сосудистой стенки (ангиопротекторы).
- Улучшение питания ГМ с помощью ноотропных средств (чем больше крови поступает в орган, тем более эффективно он работает, риск атрофии уменьшается).
- Гормональная терапия (при поражении гипофиза).
- Препараты, ингибирующие (подавляющие) иммунитет.
- Кортикостероиды.
Осложнения
Последствия аутоиммунного энцефалита возникают всегда. Но при отсутствии терапии появляются раньше. К ним относят:
- короткие или долгосрочные потери сознания;
- вегетативное состояние организма (человек без сознания, подключен к искусственной вентиляции легких);
- снижение интеллекта;
- грубые неврологические расстройства (отсутствие чувствительности ног, тремор рук, нистагм);
- летальный исход.
При появлении одного из симптомов неврологического расстройства, необходимо немедленно обратиться к врачу. Своевременная терапия позволит улучшить качество жизни пациента, предотвратит летальный эффект в раннем возрасте. Самолечение не допустимо, пациент должен строго придерживаться терапии, назначенной лечащим врачом. Она должна осуществляться на протяжении жизни, прекращение приема препаратов чревато осложнениями и гибелью. Прогноз аутоиммунного энцефалита не утешителен. Пациенты на поздних стадиях не могут ходить, впадают в вегетативное состояние, после этого наступает смерть.
04 сентября 2018
- 3416
- 2,7
- 0
- 5
На изображении видны изменения в метаболизме базальных ганглиев и медиальных височных областей при одном из типов аутоиммунного энцефалита
В настоящее время все больше внимания уделяется тому, как иммунитет влияет на разные процессы в нашем организме. Обнаруженные в новых исследованиях нарушенные иммунные реакции становятся недостающим звеном патогенеза. Это стимулирует поиск новых лекарств и других профилактических и лечебных воздействий. В этом тексте мы обсудим особый иммунный статус мозга — его изолированность от системных процессов иммунитета. Кроме этого поговорим о расстройствах, которые нарушают иммунный суверенитет центральной нервной системы — об аутоиммунных энцефалитах.
Привилегированный орган
Мозг — это орган, примечательный во многих отношениях [1]. Бесконечная сложность устройства, его функциональные возможности и связь нашей жизни с его состоянием приковывают к мозгу внимание исследователей. Взаимоотношения мозга с иммунной системой нашего организма тоже носят особенный характер: мозг является иммуннопривилегированным органом. Иммунные реакции, которые легко развиваются в остальных тканях (клетках печени, мышцах, жировой клетчатке), в мозге возникают редко. Вместе с мозгом в таких особых отношениях с иммунной системой оказались щитовидная железа, яички и некоторые ткани глаза, в частности, роговица.
Длительное время считалось, что основой иммунной привилегии головного мозга является наличие гемато-энцефалического барьера (ГЭБ). ГЭБ — это комплекс клеточных и внеклеточных структур, которые отделяют кровь, текущую в капиллярах, от нейронов паренхимы мозга. Клетки стенок сосудов, базальная мембрана, на которой они лежат, астроциты участвуют в формировании ГЭБ. Иммунная привилегированность частей центральной нервной системы хорошо согласовывалась с распространенностью ГЭБ внутри нее. Паренхима головного мозга надежно защищена ГЭБ, и в ней редко возникают воспалительный процессы (энцефалиты). Хориоидные сплетения, продуцирующие спинномозговую жидкость, и оболочки головного мозга не имеют такого прикрытия, и их воспаление (хориоидит, менингит) встречается гораздо чаще (рис. 1).
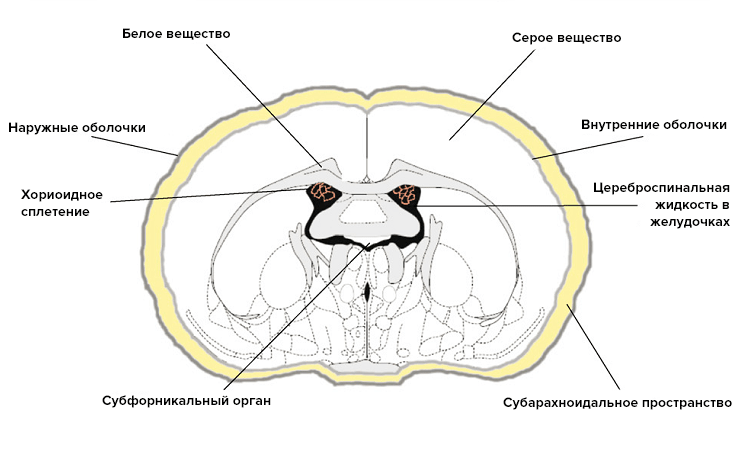
Рисунок 1. Строение центральной нервной системы. К частям, которые хорошо защищены ГЭБ, относятся серое и белое вещества. Другие компоненты не имеют такой защиты.
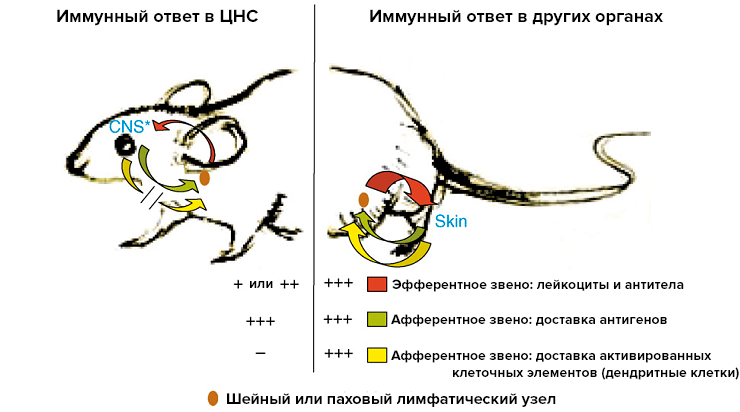
У мозга возникают сложности при доставке активированных клеток иммунитета в шейные лимфатические узлы. За работу с антигенами в головном мозге отвечают дендритные клетки. В других органах они распознают антиген, а затем предоставляют информацию о нем T- и B-лимфоцитам в лимфоузлах. При воспалении в мозге такого процесса не происходит: дендритные клетки не мигрируют в лимфоузлы и не представляют антиген. Иммунный ответ становится локальным, и дендритные клетки регулируют его в паренхиме головного мозга. Если в других органах клеточные элементы иммунитета после презентации антигена устремляются в место проникновения бактерий [6], то при развитии воспаления в паренхиме мозга этого не происходит. Мозгу приходится рассчитывать на самого себя. Подобная локальность иммунного ответа наблюдается в паренхиме, но не в хориодиных сплетениях и оболочках мозга.
Аутоиммунные энцефалиты
После разговора об особом иммунном статусе мозга мы перейдем к теме аутоиммунных энцефалитов — группе заболеваний, которые связаны с поражением мембранных и внутриклеточных структур нейронов собственным иммунитетом организма. В современной практике аутоиммунные энцефалиты диагностируются редко. Это объясняется тем, что первые случаи подробно описали только в 2005 году [10]. Можно предположить, что на самом деле случаев этого заболевания больше, чем регистрируется специалистами. Некоторым пациентам с аутоиммунным энцефалитом могут устанавливать диагноз других расстройств, например, шизофрении или инфекционного энцефалита. Это связано с тем, что врачи мало осведомлены об этом заболевании. Врачи диагностируют только те болезни, которые им известны. Чем больше арсенал диагнозов в запасе у врача, тем точнее диагностика и правильнее лечение.
Аутоиммунные энцефалиты можно разделить на две группы:
- заболевания, вызванные активированными T-клетками (нечто похожее происходит при рассеянном склерозе [11]);
- заболевания, которые возникают при воздействии антител на внутри- и внеклеточные компоненты нейрона, например, ионные каналы.
Для первой группы аутоиммунных энцефалитов характерно повреждение клеток антителами и активированными Т-лимфоцитами [12]. Эти энцефалиты носят более тяжелый характер и требуют интенсивных лечебных вмешательств в отличие от представителей второй группы.
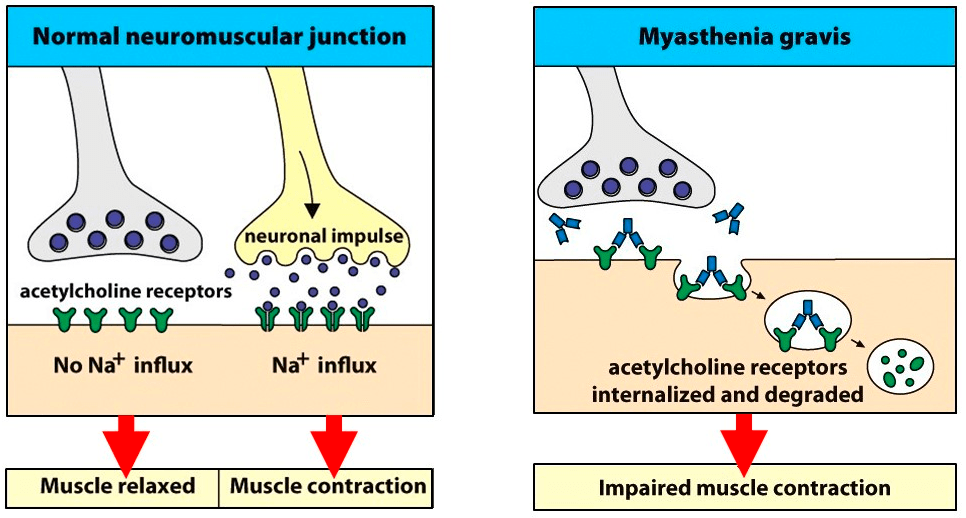
Антитела проникают снаружи, из-за пределов ГЭБ, или производятся проникшими в головной мозг и активированными B-лимфоцитами [15]. В тех случаях, когда антитела направлены против внутриклеточных структур, атаку на нейроны возглавляют цитотоксические T-лимфоциты. При помощи перфорина и гранзима B они повреждают мембрану нейронов, что приводит к их гибели [16], [17]. ГЭБ, о котором мы говорили выше, в этом свете представляется надежной крепостной стеной, защищающей тихий город, который отвык воевать. Если в стене возникнет брешь, то город быстро падет: нервные клетки окажутся слишком чувствительны к воздействию иммунных факторов.
Признаки аутоиммунных энцефалитов очень разнообразны, но можно выделить три типа симптомов.
- Психиатрические симптомы: психозы, агрессивные действия, сексуальная расторможенность, панические атаки, навязчивые действия, чувство эйфории или страха.
- Двигательные симптомы: повышение тонуса мышц и его неравномерность, мышечные подергивания и повторяющиеся движения конечностей.
- Припадки: генерализованные эпилептические припадки, эпилептический статус.
Начальными проявлениями аутоиммунного энцефалита могут быть симптомы психического расстройства: нарушение памяти, галлюцинации или появление бредовых идей. Например, при аутоиммунном поражении глутаматных NMDA-рецепторов у 80% пациентов были выявлены симптомы психических заболеваний, а больше 60% первоначально были госпитализированы в психиатрические отделения [18], [19]. Врачи-психиатры должны уметь выявлять пациентов с аутоиммунными энцефалитами или хотя бы заподозрить это заболевание, чтобы вовремя отправить пациента на соответствующие обследования и консультации к другим врачам.
- Лимфоцитарный плейоцитоз или появление олигоклональных полос при электрофорезе ЦСЖ.
- Эпилептические припадки.
- Фациобрахиальные дистонические припадки.
- Подозрение на злокачественный нейролептический синдром.
- Отклонения на МРТ.
- Отклонения на ЭЭГ.
- Сниженный уровень сознания.
- Нарушение позы и движений.
- Нестабильность вегетативной нервной системы.
- Очаговая неврологическая симптоматика.
- Нарушения речи (афазия и дизартрия).
- Быстрое, несмотря на лечение, прогрессирование психоза.
- Гипонатриемия.
- Кататония.
- Головные боли.
- Наличие других аутоиммунных заболеваний, в том числе тиреоидитов.
Кроме совокупности ранее описанных симптомов, диагноз аутоиммунного энцефалита должен быть подтвержден лабораторными исследованиями и другими диагностическими процедурами [21]. Например, можно выполнить анализ на антитела к конкретным рецепторам. При аутоиммунном энцефалите, поражающем глутаматные NMDA-рецепторы, можно обнаружить повышение титра антител к ним. Интересно, что при энцефалите увеличивается количество иммуноглобулинов класса G, а при шизофрении — классов А и М [22]. В настоящее время установлено соответствие между антителами, поражающими конкретные структуры нейрона, и симптоматикой энцефалита (табл. 1). При проведении магнитно-резонансной томографии (МРТ) могут быть обнаружены изменения в структуре головного мозга, а электроэнцефалографическое исследование (ЭЭГ) в случае аутоиммунного энцефалита может показать нарушение функционирования головного мозга.
| Структура, к которой вырабатывается антитело | Психиатрические симптомы | Другие симптомы | Типичный пациент |
|---|---|---|---|
| NMDA-рецептор | Психоз, шизофреноподобные расстройства, кататония, агрессия | Эпилептические припадки, дискинезия, вегетативная нестабильность, нарушение речи и сознания | Молодые женщины, частая связь с тератомой яичника |
| Caspr2 | Бессонница, панические атаки, депрессия, шизофреноподобные расстройства | Синдром Морвана, нейромиотония, мышечные спазмы, фасцикуляции | Пациенты среднего и старшего возраста, возможна связь с тимомой |
| LGI1 | Амнезия и другие нарушения памяти, спутанность, депрессия | Лимбический энцефалит, фациобрахиальные дистонические припадки, гипонатриемия | Пациенты среднего и старшего возраста, соотношение мужчин и женщин 2:1, возможна связь с тимомой |
| Глициновый рецептор | Поведенческие изменения, шизофреноподобный синдром | Синдром мышечной скованности, прогрессирующий энцефаломиелит с ригидностью, миоклонус, гиперэкплексия | Пациенты среднего и старшего возраста, возможна связь с тимомой и лимфомой |
| Синаптические антигены (GAD) | Шизофреноподобный синдром, аутизм, синдром дефицита внимания и гиперактивности | Лимбический энцефалит, синдром мышечной скованности, припадки, стволовая дисфункция, атаксия | Пациенты среднего и старшего возраста, возможна связь с мелкоклеточным раком легких |
| Онконевральные антигены (Yo, Hu, CV2, Ri, Ma2) | Поведенческие нарушения | Лимбический энцефалит, мозжечковая дегенерация, сенсорная нейропатия | Пожилые пациенты, часто со злокачественными опухолями |
В некоторых случаях аутоиммунное поражение центральной нервной системы вызвано развитием паранеопластического синдрома, который может сопровождать появление в организме злокачественной опухоли. При паранеопластическом синдроме опухоль может начать самостоятельно вырабатывать гормоны и гормоноподобные вещества, нарушая регуляцию различных процессов в организме. Кроме этого паранеопластический синдром может проявляться в виде аутоиммунного заболевания, например, аутоиммунного энцефалита.
По этой причине при диагностике аутоиммунных энцефалитов отдельное внимание уделяется поиску опухоли в организме пациента. Удаление опухоли в случаях паранеопластического генеза аутоиммунного энцефалита приведет к значительному улучшению состояния пациента. Пока же опухоль находится в организме человека, антитела продолжают вырабатываться, а состояние пациента ухудшаться.
Если терапия первой линии не работает, то переходят к использованию ритуксимаба и циклофосфамида. Ритуксимаб — это моноклональные антитела к рецептору CD20, который обнаруживается на поверхности B-лимфоцитов [23]. В-лимфоциты производят самые разные антитела, в том числе и аутоантитела против нервных клеток, и их уничтожение может привести к улучшению состояния. Рецептор CD20 появляется на поверхности нормальных B-лимфоцитов и B-лимфоцитов, которые прошли процесс малигнизации (озлокачествления). Благодаря этому свойству ритуксимаб эффективен при аутоиммунных заболеваниях и B-клеточных лимфомах. Лекарство присоединяется к рецептору CD20 на поверхности лимфоцита и дает возможность другим компонентам иммунной системы уничтожить клетку.
На примере аутоиммунных энцефалитов можно рассмотреть два важнейших тренда в современной медицине. Первый тренд — изучение влияния иммунных процессов на функционирование нервной системы человека и попытки вмешаться в этот процесс при лечении неврологических и психических заболеваний. Сейчас мы близки к пониманию того, что мозг — это не просто электрохимическая лаборатория под черепной коробкой, но и особый иммунный мир со своими правилами. В наших интересах изучить эти правила и начать играть по ним в свою пользу. Второй же тренд — это биологизация психиатрии, поиск конкретных биологических изменений в организме, которые приводят к нарушению психического здоровья. Психиатрия — это часть медицины, большой отрасли, где соединяются теоретические знания и их практическое применение. Без биологической основы медицина перестанет быть научной. Если игнорировать биологические законы и знания внутри одной из медицинских специальностей, то с ней произойдет то же самое. Психиатрия должна становиться биологической, чтобы оставаться научной и выполнять свои медицинские задачи.
В последнее время исследователи и врачи все больше внимания уделяют реакциям врожденного иммунитета при развитии нейродегенеративных заболеваний (болезни Альцгеймера [24], болезни Паркинсона [25], хореи Гентингтона [26]) и психических расстройств [27]. Накопление бета-амилоида, который сам, вероятнее всего, вовлечен в иммунные реакции центральной нервной системы [28], связано с нарушением баланса между его накоплением и элиминацией (удалением). Последний процесс отчасти зависит от того, как экспрессируется толл-подобный рецептор 2 (TLR2) [29]. На мышиных моделях показано: чем ниже уровень экспрессии TLR2, тем хуже удаляется бета-амилоид [30]. Снижение элиминации бета-амилоида приводит к его накоплению в нервных клетках и последующему нарушению их функции и гибели. Изучение внутренних иммунных процессов мозга может стать основой для поиска новых препаратов при нейродегенеративных заболеваниях. Сейчас фармацевтические компании тестируют моноклональные антитела для терапии болезни Альцгеймера, но успехи остаются скромными.
Точная этиология заболевания неизвестна. Первоначально были выдвинуты 3 ключевых фактора, которые инициируют и поддерживают прогрессирование патологического процесса в центральной нервной системе: вирусы, аутоиммунные антитела и аутоиммунные цитотоксические Т-лимфоциты. [4] [5] [6] Возможна роль цитомегаловирусов, которые были выделены из коры головного мозга взрослых пациентов. [2]
В настоящее время все больше ученых склоняются к аутоиммунной концепции патогенеза энцефалита, [7] непосредственную роль в котором играют цитотоксические Т-лимфоциты. Среди прямых родственников больных энцефалитом Расмуссена также встречаются больные с другими аутоиммунными болезнями, например, болезнью Бехчета, что предполагает вовлечение общих генетических факторов таких, как HLA-галотипы. [8]
В 90-е годы XX века появились некоторые доказательства связи энцефалита Расмуссена с антителами к глутаматному рецептору GRIA3 (GluR3), [9] [10] но недавние исследования не нашли этому подтверждение [11] . Возможно, в патогенез заболевания вносят вклад аутоантитела к ε2-субъединице глутаматных NMDA-рецепторов (GluRepsilon2), которые были обнаружены в сыворотке крови и ликворе больных энцефалитом Расмуссена, причем их титр напрямую коррелировал с частотой эпилептических припадков. Rougier A. с соавт. (2007), наоборот, полагают, что пока не выявлено прямой связи между эпилептическими и воспалительными процессами. [12] Обнаруженные аутоантитела возможно станут диагностическим маркёром энцефалита Расмуссена, [13] однако они, как и антитела к GluR3 и другим нейромолекулам, не являются специфичными для энцефалита Расмуссена. Например, у больного аутоиммунным менингоэнцефалитом были обнаружены антитела как к ε2-, так и δ2-субъединице (GluRdelta2), что клинически проявлялось электрическим эпистатусом, малыми изменениями на МРТ и хорошим ответом на пульс-терапию метилпреднизолоном. Однако эти клинические особенности в корне отличаются от таковых при энцефалите Расмуссена. [14] Антитела к GluRepsilon2 определялись в течение 6 месяцев от начала манифестации эпиприпадков у всех больных энцефалитом Расмуссена, и лишь у некоторых пациентов — в хронической стадии. Это позволяет предположить, что антитела к GluRepsilon2 вовлечены в патологические процессы лишь на начальной стадии. [15]
Другие авторы исследовали экспрессию про- и антивоспалительных цитокинов и охарактеризовали подтипы Т-лимфоцитов у больных энцефалитом. Osorio I. с соавт. (2007) в ходе своих экспериментов установили, что энцефалит Расмуссена опосредован через Tc2 поляризацию иммунного ответа, и иммуногистопатология, естественное течение и эволюция клинической картины (хроническая, ступенеобразная прогрессия) отражают двойственность/плеотротность действия интерлейкина-10, которое, в зависимости от состояния активации иммунной системы, может быть либо цитолитическим, либо иммуносупрессивным. Они также нашли, что лимфоцитарный инфильтрат в пораженных участах мозга состоит, в основном, из CD3 + и CD8 + Т-клеток. [16]
Патоморфология
Действующие гистопатологические критерии энцефалита Расмуссена включают: преобладание Т-клеточной инфильтрации, активация микроглии, гибель нейронов (апоптоз с последующим значительным снижением их количества) и астроцитарная активация. Апоптоз астроцитов и последующая их гибель как в коре, так и в белом веществе, являются специфичным для энцефалита Расмуссена. Подобная особенность не найдена при других болезнях (паранеопластический энцефаломиелит, склероз аммонова рога, очаговая дисплазия коры). Эксперименты in vitro предположили, что гибель астроцитов обусловлена антителами к GluR3, однако исследования in vivo дают основания думать о специфической атаке цитотоксических Т-лимфоцитов как о возможном механизме гибели астроцитов. Гибель астроцитов ведет к дисфункции нейронов, индукции припадков и ускоренной смерти нервных клеток. [17]
В головном мозге больных недавно обнаружена обширная активация Iba1 + микроглии, особенно в участках, значительно измененных склерозом, причем она была более выражена при энцефалите Расмуссена, чем при корковой дисплазии и туберозном склерозе. Однако, не выявлено качественной связи между иммуноокраской на Iba1 и присутствием CD8 + цитотоксических Т-лимфоцитов, а также статистической связи с клиническими вариациями эпилепсии такими, как длительность припадков и их частота. [18]
Клиническая картина
Энцефалит Расмуссена характеризуется резистентными к лечению фокальными эпилептическими припадками, часто сопровождается кожевниковской эпилепсией (epilepsia partialis continua — на фоне постоянного гиперкинеза появляются генерализованные эпилептические припадки с потерей сознания), прогрессирующим односторонним двигательным дефектом (гемипарез), нарушением речи (при поражении доминантного полушария), слабоумием. На ЭЭГ регистрируется медленная активность над всей поверхностью пораженного полушария. Нейровизуализация выявляет очаговую гиперинтенсивность в белом веществе и атрофию коры островковой доли. [6] На начальных стадиях болезни могут возникнуть сложности с интерпретацией данных нейровизуализации, например, они могут напоминать очаговую корковую дисплазию. Однако исследования в динамике помогают поставить правильный диагноз. [19]
В дополнение к хорошо изученным клиническим проявлениям энцефалита недавно были выявлены некоторые особенности, характерные для больных из развивающихся стран: изолированная кожевниковская эпилепсия языка, которая исчезала после кортикальной резекции, двустороннее поражение мозга, атрофия скорлупы и отсутствие гемипареза, несмотря на длительное течение болезни. [20] Описаны гистологически подтвержденные случаи благоприятного течения энцефалита без прогредиентности, которые проявлялись в основном фокальными эпиприпадками без существенного двигательного дефицита и хорео-дистоническими гиперкинезами. У большинства больных дебют заболевания при этом был в поздним. [21]
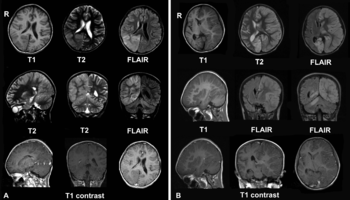

Согласно Европейскому консенсусу по патогенезу, диагностике и лечению энцефалита Расмуссена (2005), [1] выделают 3 стадии болезни: продромальную, острую и резидуальную. Продолжительность продромальной стадии составляет в среднем 7 месяцев (от 0 до 8 лет), проявляется неспецифическими симптомами, единичными эпиприпадками; гемипарез, причем легкий, бывает очень редко. После продрома все больные переходят в острую стадию, хотя в 1/3 случаев первая стадия отсутствует. Острая стадия характеризуется частыми эпиприпадками, главным образом, парциальными (простые моторные обычно в форме кожевниковской эпилепсии). Ухудшение неврологического статуса манифестирует прогрессирующим гемипарезом, гемианопсией, когнитивными нарушениями и афазией (при поражении доминантного полушария). Средняя продолжительность стадии 8 месяцев (от 4 до 8 мес.), после этого больные переходят в резидуальную стадию со стойким и стабильным неврологическим дефицитом, эпиприпадками, но не столь частыми, как в острой стадии. В этой стадии не все больные имеют гемипарез. Большой временной разброс по длительности стадий указывает на значительную вариабельность темпа и тяжести деструктивного процесса у различных больных. Гемипарез является наиболее удобным маркёром для клинического мониторинга, так как он с наибольшей постоянностью обнаруживается и поддается количественной оценке даже у детей. В силу того, что гемипарез может дополнительно усугубляться преходящим постиктальным парезом у больных с моторными припадками, необходимо проводить обследования в динамике, особенно в периоды, когда припадки становятся редкими. Это важно для надежной оценки степени постоянной моторной дисфункции. Периодическое нейропсихологическое обследование рекомендуется для выявления когнитивных нарушений, особенно у пациентов без явного гемипареза, например, с поражением височной доли.
Европейский консенсус [1] также выделил следующие особенности эпилепсии при энцефалите Расмуссена: 1) полиморфизм припадков у конкретного больного; 2) частое возникновение кожевниковской эпилепсии; и 3) резистентность припадков, особенно кожевниковской эпилепсии, к лекарственным препаратам. Различная семиология припадков, часто выявляемая при наблюдении за пациентом на протяжении длительного времени, лучше всех объясняется маршем эпилептического очага по полушарию мозга, что подтверждено серийными нейровизуализационными исследованиями. За исключением редких случаев двустороннего энцефалита, все припадки происходят лишь из одного полушария. Парциальные простые моторные припадки, вовлекающие одну сторону тела, и последующие вторично-генерализованные тонико-клонические судороги являются наиболее типичными. Реже бывают парциальные сложные (с автоматизмами или с последующим односторонним моторным вовлечением), постуральные и соматосенсорные припадки.
Epilepsia partialis continua возникает у 56-92% больных на каком-либо этапе течения энцефалита. Первоначально ее описал российский невролог А.Я. Кожевников в 1895 г. у взрослых, переболевших клещевым энцефалитом. Особенности кожевниковской эпилепсии: 1) не поддается лечению антиконвульсантами; 2) не имеет общей тенденции к распространению в отличие от других моторных припадков (как, например, это бывает при джексоновской эпилепсии, хотя и кожевниковская эпилепсия время от времени может проявляться джексоновскими припадками); 3) не прекращается после обычно короткого периода фокальных моторных припадков.
Несмотря на то, что формы с поздним началом могут походить на ранние, симптомы при этом прогрессируют медленно и неврологический дефицит более вариабельный. Для взрослой формы характерно вовлечение затылочной доли, двустороннее поражение полушарий, клиника височной эпилепсии, наличие двигательных расстройств в начале болезни. Хирургическое лечение (см. ниже) не столь эффективно, как у детей, [22] однако внутривенное введение иммуноглобулина дает хорошие результаты. [3] У взрослых возможно двухфазное течение энцефалита: например, у больного в дебюте были припадки и левосторонняя дискинезия, а через год присоединились нарушения речи. Серийная МРТ и ПЭТ показали в начале поражение правого полушария, а затем вовлечение левого. [23]
Описаны случаи энцефалита Расмуссена, сочетающегося с нейровисцеральной порфирией, острой перемежающейся порфирией, [26] а также после острого диссеминированного энцефаломиелита. [27] Фармакорезистентные случаи эпилепсии, синдром Леннокса-Гасто требуют более углубленных обследований на нейровисцеральные порфирии, включая острую перемежающуюся порфирию, наследственную копропорфирию и пёструю порфирию южно-африканского типа. При наличии этих генетических заболеваний следует избегать антиэпилептической политерапии и назначения порфириногенных препаратов (фенобарбитал, вальпроаты и другие индукторы цитохрома P450). Диагностика обычно затруднена у детей, нуждающихся в ферментном или ДНК-тестировании на эти болезни.
Диагностика
Диагноз энцефалита Расмуссена основывается на клинических, электрофизиологических (ЭЭГ) и морфологических критериях (МРТ, в некоторых случаях — гистопатология). У большинства хронических больных (т.е. с длительностью заболевания более 1 года) дифференциальный диагноз не сложен. Однако практическое значение имеет ранняя диагностика энцефалита, т.е. перед тем, как прогрессирующие гемиатрофия и неврологический дефект станут явными. Ранняя диагностика также необходима для начала иммуносупрессивной терапии, которая может быть наиболее эффективна на начальной стадии болезни. Поэтому формальные диагностические критерии должны быть доступны как для идентификации ранних, так и хронических случаев. Возраст дебюта болезни не включен в эти критерии, хотя следует подчеркнуть, что энцефалит, главным образом, начинается в детстве.
В 1994 году были предложены формальные диагностические критерии энцефалита Расмуссена. [28] В последующем они были дополнены Европейским консенсусом [1] и являются действующими в настоящее время. Эти критерии имеют следующие цели: 1) позволяют диагностировать энцефалит на всех стадиях; 2) делают доступной раннюю диагностику и, следовательно, раннее решение о начале специфического лечения (хирургическое или иммуннотерапия); и 3) ограничивают использование биопсии мозга только теми случаями, при которых точный диагноз не может быть поставлен посредством других методов. Для достижения этих целей был создан двуступенчатый подход, представленный в таблице 1.
Дифференциальную диагностику обычно следует проводить с: 1) другими односторонними неврологическими синдромами; 2) другими причинами кожевниковской эпилепсии; 3) другими воспалительными или инфекционными болезнями, имитирующими энцефалит Расмуссена. Возможные заболевания и диагностические шаги для их исключения приведены в таблице 2.
Лечение
При наличии резистентных к терапии припадков, сочетающихся со стойким неврологическим дефицитом (гемиплегия, афазия), показано хирургическое лечение — удаление или перерезка связей пораженной части мозга (анатомическая или функциональная гемисферэктомия). Антиэпилетические препараты и кетогенная диета (богатая жирами и бедная углеводами) могут быть рекомендованы на начальной стадии, однако в большинстве случаев они малоэффективны. В 2008 г. для лечения кожевниковской эпилепсии предложена транскраниальная магнитная стимуляция, которая на непродолжительное время способна остановить припадки. [33] Альтернативное лечение включает антивирусные препараты, плазмаферез, иммуноадсорбцию, иммуносупрессию (глюкокортикоиды и др.) и иммуномодуляцию (иммуноглобулин внутривенно). Однако, в виду отсутствия большого количества исследований, в настоящее время не существует устоявшейся стратегии лечения. [4]
Прогноз
Прогноз при энцефалите Расмуссена вариабельный. Нелеченная болезнь может привести к стойкому и значительному неврологическому дефициту, включая умственную отсталость и параличи. У некоторых пациентов хирургическое лечение может уменьшить частоту припадков. Однако большинство больных остаются с парезами и нарушениями речи. Есть сообщения в литературе, что чем в более раннем возрасте дебютирует болезнь, тем она более склонна к двустороннему поражению; такие формы обычно прогностически неблагоприятны и, как правило, заканчиваются летально. Возможно это связано с незрелостью иммунной системы. [34] Описан случай развития анапластической эпиндимомы на фоне энцефалита Расмуссена, однако причинно-следственную связь между этими двумя состояниями установить пока трудно. [35]
Эпоним
Болезнь названа по имени американского нейрохирурга Теодора Рассмуссена, описавшего ее в 1958 г. [36]
Читайте также:


