Инфекции вызванные грамположительными микроорганизмами
Мир бактерий удивительно разнообразен и очень богат. Они встречаются везде: в воздухе, почве, на коже человека, на его слизистых. При определенных обстоятельствах бактерии становятся опасными для человека, вызывая серьезные заболевания. Некоторые из них легко поддаются лечению антибиотиками или даже обычными антисептиками, от других избавиться намного сложнее. Поэтому при постановке диагноза, а также при назначении лечения выделяют грамположительные и грамотрицательные бактерии. Такой метод деления микроорганизмов был предложен еще в XIX веке, но используется до сих пор.
Мир бактерий
Царство микроорганизмов настолько разнообразно и сложно устроено, что даже современная наука еще не изучила его полностью. Есть такие бактерии, которые выживают при высоких температурах и не погибают даже при длительном кипячении, другие же гибнут при малейшем изменении температуры или состава внешней среды, например после добавления обычного сахара. Некоторые микроорганизмы прекрасно себя чувствуют в горячих источниках, в кислоте, питаются метаном или другими химическими веществами.
Бактерии - это самые древние организмы и очень широко распространены в мире. Они встречаются везде: на дне океана, в воздухе, в почве - даже на большой глубине, в организме живых существ. Причем, наукой доказано, что клеток бактерий внутри человека в 10 раз больше, чем собственных. Некоторые микроорганизмы просто живут рядом с другими живыми существами, другие же активно с ними взаимодействуют. Они могут приносить пользу или вызывать различные заболевания. Причем полезных бактерий в десятки раз больше, чем патогенных.
Многие микроорганизмы приносят пользу. Например, те, которые обитают в кишечнике человека, участвуют в пищеварении и защищают его от инфекций. Это лактобактерии и бифидобактерии. В полости рта человека обитает около 40 млн видов бактерий, но всего 5 % из них патогенные. Есть микроорганизмы, которые участвуют в разложении отходов. Но, несмотря на то что полезных бактерий все же больше, патогенные их виды приносят много вреда, так как вызывают опасные болезни. До сих пор много человек во всем мире умирает от туберкулеза, холеры, столбняка, брюшного тифа, ботулизма и других инфекций. Поэтому очень важно научиться правильно взаимодействовать с миром бактерий.
Метод Грама
Человек давно ищет пути лечения инфекционных заболеваний. После того как было обнаружено существование патогенных бактерий, ученые стараются их классифицировать, чтобы выяснить, как с ними бороться. Лучший способ был предложен в 1884 году врачом Гансом Кристианом Грамом. Он довольно простой, но информативный и используется до сих пор. По этому методу различаются грамположительные и грамотрицательные бактерии.
Доктор Грам использовал при изучении микроорганизмов фиолетовый краситель и заметил, что некоторые из них поддаются окрашиванию, другие же - нет. Он выяснил, что связано это с особенностями клеточных стенок бактерий. Так как эти микроорганизмы состоят из одной, реже двух клеток, для них очень важно иметь прочную оболочку. Поэтому клеточные стенки у них имеют сложное строение. Они защищают внутреннюю среду от проникновения жидкостей. Сложнее всего строение у грамотрицательных бактерий. Они устойчивы к проникновению слюны, желудочного сока и других жидкостей.
Суть метода Грама в том, что исследуемую среду обрабатывают анилиновым красителем, фиксируют йодом, а затем смывают спиртом. При этом грамотрицательные бактерии обесцвечиваются, а грамположительные приобретают синюю окраску. После повторной обработки красным красителем отрицательные виды могут окраситься в розовый цвет, причем погибшие микроорганизмы окрашиваются ярче.

Применение метода в медицине
Метод Грама по разделению микроорганизмов на грамположительные и грамотрицательные бактерии способствовал совершенствованию микробиологических исследований. Он помогает выявлять устойчивость патогенных видов к лекарственным препаратам, разрабатывать новые антибиотики для борьбы с ними. Ведь прочная клеточная стенка грамотрицательных бактерий делает их нечувствительными к обычным антибактериальным препаратам. А оболочка грамположительных микроорганизмов, хоть и очень толстая, но проницаема для жидкостей и антибиотиков.
Грамположительные и грамотрицательные бактерии
Метод Грама позволил разделить все микроорганизмы на две большие группы. Их особенности и характеристики помогают выбрать более подходящее лечение инфекционных заболеваний. Грамположительные бактерии, которые быстро окрашиваются в синий цвет анилиновым красителем, образуют споры, экзотоксины, поэтому довольно опасны для здоровья. Но их оболочка проницаема для антибактериальных препаратов.
Как и грамположительные, грамотрицательные бактерии - возбудители серьезных заболеваний. Они не образуют спор, и во многих случаях являются условно патогенными. Но при определенных условиях начинают выделять эндотоксины и являются причиной тяжелого воспаления и интоксикации. Из-за сложного строения клеточной стенки они почти нечувствительны к антибиотикам.
В организме человека содержатся оба вида эти микроорганизмов. Правильное соотношение грамположительных и грамотрицательных бактерий поддерживает нормальную микрофлору влагалища, кишечника, полости рта. Это помогает защищать организм от инфекций.
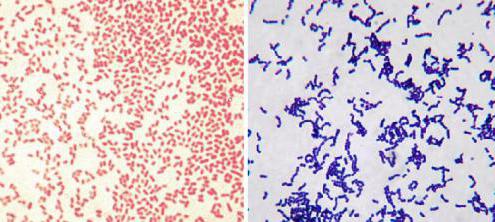
Грамположительная флора
Большинство бактерий, которые поддаются окрашиванию фиолетовым красителем, то есть имеют проницаемую клеточную стенку, опасны для человека. К ним относятся стрептококки, стафилококки, листерии, бациллы, клостридии, микобактерии, актиномицеты. Особенно опасен золотистый стафилококк, который поражает ослабленный организм и без лечения быстро приводит к смерти больного. Но к ним относятся также полезные молочнокислые лактобактерии.
Грамположительные микроорганизмы поражают дыхательные пути, сердечную мышцу, головной мозг, кожу. Они провоцируют гнойную инфекцию в ранах, заражение крови.
Заболевания, которые они вызывают
Именно грамположительные бактерии являются причиной таких распространенных инфекционных болезней, как:
- тонзиллит, фарингит;
- синусит, отит;
- ревматизм;
- заражение крови;
- пневмония;
- воспаление мозга;
- сибирская язва;
- пищевые токсикоинфекции;
- ботулизм;
- дифтерия;
- столбняк;
- газовая гангрена.

Грамотрицательные бактерии
Список их довольно большой, но среди них много таких, которые не приносят никакого вреда человеку. К ним относятся в основном условно патогенные микроорганизмы. В обычных условиях они обитают в организме человека, не причиняя ему вреда. Самыми распространенными являются следующие грамотрицательные бактерии. Виды их разнообразны:
- протеобактерии;
- псевдомонады;
- хламидии;
- менингококки;
- бруцеллы;
- спирохеты;
- гонококки;
- хеликобактерии.
Микроорганизмы, не окрашивающиеся в фиолетовый цвет, являются устойчивыми также к любым антителам и антибактериальным препаратам. Поэтому заболевания, вызываемые ими, очень сложно лечить.
Какие заболевания вызывают
При определенных условиях грамотрицательные бактерии становятся причиной серьезных болезней. Связано это с тем, что сложная оболочка этих микроорганизмов при разрушении выделяет много токсинов, которые, разносясь по кровотоку человека, вызывают сильнейшую интоксикацию. Получается, что патогенны не сами бактерии, а особенности их клеточной оболочки - липополисахаридный слой, который вызывает иммунную реакцию организма. Они приводит к развитию воспаления. Но если у человека иммунитет в порядке, он легко справляется с такими микроорганизмами, и инфекция ему не страшна.
К грамотрицательным бактериям относятся микроорганизмы, вызывающие гонорею, сифилис, менингит и респираторные заболевания. Особенно распространены такие бактерии, котрые вызывают поражение дыхательных и мочевыделительных путей, желудочно-кишечного тракта. К грамотрицательным относятся такие известные возбудители инфекций, как протей, эшерихия, энтеробактерии, сальмонеллы. Они вызывают сальмонеллез, менингит, брюшной тиф, дизентерию. Кроме того, именно такие устойчивые микроорганизмы являются причиной тяжелых внутрибольничных инфекций. Ведь они могут выжить даже после серьезной дезинфекции.
Использование этих знаний при лечении болезней
При диагностике заболевания для определения более эффективного лечения обязательно применяется метод Грама для определения того, какие микроорганизмы вызвали болезнь: грамположительные или грамотрицательные бактерии. Антибиотики назначаются в зависимости от этого. Ведь неправильно выбранное лечение может только усугубить ситуацию.
Для определения возбудителя исследуется мокрота, выделения из носа или влагалища, анализ кала, синовиальной или плевральной жидкости. Эти образцы подвергаются обследованию по методу Грама.
Сложнее всего вылечить заболевания, вызываемые грамотрицательными бактериями. В основном на них воздействуют сочетанием двух антибиотиков или же препараты нового поколения. Эфективными против них могут быть "Ампициллин" или "Амоксициллин", "Хлорамфеникол", "Стрептомицин", а также группа цефалоспоринов. Они могут справиться с внешней мембраной таких бактерий.
Знания о строении стенки бактерий позволило улучшить эффективность лечения инфекционных заболеваний.
[youtube.player]Г Л А В А 93. ПНЕВМОКОККОВЫЕ ИНФЕКЦИИ
Роберт Остриан (Robert Austrian)
Этиология. Пневмококк (Streptococcus pneumoniae) представляет собой грамположительный инкапсулированный кокк, растущий в виде пар (диплококки) или коротких цепей. У диплококков соприкасающиеся концы закруглены, а противоположные слегка заострены, что придает им вид ланцета. В окрашенных препаратах, приготовленных из экссудатов, иногда встречаются грамотрицательные формы. Вокруг колоний пневмококков на кровяном агаре или внутри него появляется зеленоватое окрашивание, вследствие чего их иногда ошибочно принимают за альфа-гемолитические стрептококки, с которыми они близко связаны. Из содержимого дыхательных путей их изолируют путем добавления гентамицина (5 мкг/мл среды). Пневмококки можно дифференцировать по их способности растворяться под воздействием желчи, вирулентности для мышей, а также при серологическом типировании. Менее сложен другой метод, специфичность которого составляет примерно 90%, основан на подавлении пневмококков импрегнированными оптохином бумажными дисками.
Содержащиеся в капсуле вещества представляют собой сложные полисахариды и служат для разделения пневмококков на серотипы. При постановке теста Нойфельда они под воздействием типоспецифической антисыворотки обусловливают положительную капсулярную преципитиновую реакцию; это позволило выделить 84 серотипа. Все они оказались патогенными для человека, однако в клинической практике чаще всего сталкиваются с типами, или группами, 1, 3, 4, 7, 8, 9 и 12. Типы, или группы, 6, 14, 19 и 23 часто вызывают пневмонию и средний отит у детей, но реже встречаются у взрослых.
Если пневмококки определяются постоянно, то их специфическое типирование играет важнейшую роль, в то же время выявление пневмококков стало иметь меньшее значение с тех пор, как в большинстве лабораторий прекратили использовать реакции на капсулярное типирование. Обнаружение пневмококкового капсулярного полисахарида в мокроте и других биологических жидкостях с помощью иммунологических методов, таких как встречный иммуноэлектрофорез или реакция латексагглютинации, служит альтернативой бактериологическим методам исследования при подозрении на пневмококковую инфекцию. Из-за перекрестных реакций между полисахаридами пневмококков и другими видами бактерий, иммунологическая диагностика по сравнению с бактериологической менее специфична.
Патогенез. Механизм повреждения пневмококками организма млекопитающего хозяина до сих пор не раскрыт, причем ни один из вырабатываемых ими токсинов, по доступным данным, не играет большой роли в развитии пневмококковой инфекции, хотя некоторые компоненты клеточной оболочки могут вызвать воспаление. Известно, что капсулярные полисахариды, хотя и нетоксичные, играют большую роль в вирулентности пневмококков и в их защите (в определенной степени) от фагоцитоза.
Пневмония обычно начинается с вовлечения в процесс нижней или средней доли правого легкого либо нижней доли левого легкого, т. е. там, где скапливается под воздействием силы тяжести слизь, аспирированная, вероятнее всего, во время сна, из вышележащих дыхательных путей. Во многих случаях фактором в развитии пневмококковой пневмонии служит закупорка бронхов инфицированным слизистым секретом. Вначале защищенные слизью от фагоцитоза бактерии размножаются, вызывая переполнение инфицированных альвеол экссудатом, который служит как питательной средой, так и средством распространения инфекции на прилежащие альвеолы. Вскоре в них из легочных капилляров мигрируют сегментоядерные лейкоциты, фагоцитирующие часть популяции пневмококков еще до появления значимого количества антител. При алкогольной интоксикации и определенных видах анестезии реакция сегментоядерных лейкоцитов задерживается, что способствует распространению инфекции. На миграцию лейкоцитов могут вл иять и глюкокортикоиды. Позднее, по мере развития пневмонии, в экссудате появляются макрофаги, удаляющие остатки фибрина и клеток. Весьма вероятно, что антитела к капсулярным полисахаридам пневмококка появляются в очагах воспаления в легких раньше, чем их можно обнаружить в крови. Они повышают эффективность фагоцитоза примерно в 2 раза и вызывают агглютинацию пневмококков и приклеивание их к стенкам альвеол, тем самым замедляя их диссеминацию в ткани легких. Таким образом, исход заболевания зависит от. скорости размножения бактерий в экссудате и их распространения, и способности микроорганизма ограничить подвижность возбудителей и разрушить их с помощью фагоцитоза. Лица с гипогаммаглобулинемией и больные с множественной миеломой (см. гл. 258), организм которых не способен вырабатывать антикапсулярные антитела, подвержены рецидивам пневмококковой пневмонии. Вызываемые одним и- тем же типом пневмококка рецидивы инфекции должны всегда служить основанием для обследования больного на дисгаммаглобулинемию.
Из-за недостаточности местных защитных механизмов в легких пневмококки распространяются по лимфатическим сосудам и поступают в прикорневые лимфатические узлы. В их синусоидах развиваются процессы, сходные с таковыми в легких. Если инфекцию не удается купировать на этой второй линии защиты, пневмококки проникают в грудной поток, а затем и в кровоток. Несмотря на возможность бактериемии, ее удается выявить только в 20—30% случаев. Она, отражая неспо собность макроорганизма локализовать легочную инфекцию, служит неблагоприятным прогностическим признаком и чревата метастазированием инфекции. Летальность при этом леченых и нелеченых больных в 4 раза превышает таковую при пневмонии, не осложненной бактериемией. Вторичные по отношению к бактериемии очаги инфекции могут развиться в мозговых оболочках, суставах, брюшине или эндокарде. В результате непосредственного распространения инфекции из легких может развиться эмпиема или перикардит.
Начало выздоровления больного совпадает обычно с появлением в крови заметного количества типоспецифических антител и быстрым и резким снижением температуры тела (так называемый кризис). Антитела способствуют выздоровлению, поскольку повышается эффективность фагоцитоза и ограничивается распространение возбудителя. Бактериостатические препараты, например сульфаниламиды, способствуют подавлению инфекции, ограничивая популяцию пневмококков, однако для полного купирования инфекции необходимо тем не менее участие защитных механизмов макроорганизма. Бактерицидные препараты, например пенициллин, губительно действуют на пневмококки в легких и эффективны также при нарушении некоторых защитных механизмов макроорганизма. По мере купирования инфекции экссудат в альвеолах разжижается, воспалительные элементы удаляются с мокротой и по лимфатическим путям, состояние легких нормализуется. Очень редко при пневмококковой инфекции происходит некроз легочной ткани. Как нозологическая единица первичный пневмококковый легочный абсцесс встречается редко, хотя его иногда ошибочно диагностируют в тех случаях, когда пневмококковая инфекция наслаивается на легочные абсцессы другой этиологии.
Наряду с пневмонией и ее осложнениями пневмококк при инфицировании носоглотки и прилежащих к ней тканей может вызвать воспаление среднего уха, мастоидит, параназальный синусит или конъюнктивит. Возможно, хотя и редко, развитие абсцессов мягких тканей.
[youtube.player]В большом мире, перефразируя классиков, делаются серьезные дела: запускаются космические корабли, покоряются земные полюса, изобретаются лекарства от неизлечимых болезней. В то же время в микромире тоже кипят нешуточные страсти: вирусы и бактерии пытаются выжить в условиях жестких реалий и тотальной медицинской охоты.
Бактерии: кто они?
Микроорганизмы широко распространены как в окружающем мире, так и внутри человеческого тела.
Отличия по Граму
Впервые термин "грамположительные и грамотрицательные бактерии" в науку ввел датский ученый Грам.
Использовав при окрашивании микроорганизмов специальный краситель генцианвиолет, бактериолог заметил, что одна группа бактерий поддается окраске, в отличие от второй. Позже ученый выяснил, что причиной этому стала клеточная стенка. Таким образом, окрашиваемые субстанции получили название грамположительные бактерии, а те, которые на краситель не реагировали – грамотрицательные.
Грамположительный мир
Эти микроорганизмы окрашиваются способом Грама в фиолетовый цвет. Смысл процедуры состоит в том, что толщина защитного слоя бактериальной клетки довольно высока, за счет чего краситель удерживается. Грамположительные бактерии представлены стафилококками, стрептококками. Кроме того, грамположительные бактерии – возбудители таких опасных недугов, как газовая гангрена, столбнячная инфекция, сибирская язва. От грамотрицательных бактерий они отличаются по строению и толщине клеточной стенки. Именно она определяет внешний вид микроорганизмов: спиралевидный холерный вибрион, шаровидная кокковая форма. Бактериальная клетка отличается от клеток млекопитающих наличием жесткого защитного каркаса, состоящего из плотного биополимерного слоя, и химическим составом. Этим обусловлена реакция бактерий на действие антибиотиков.
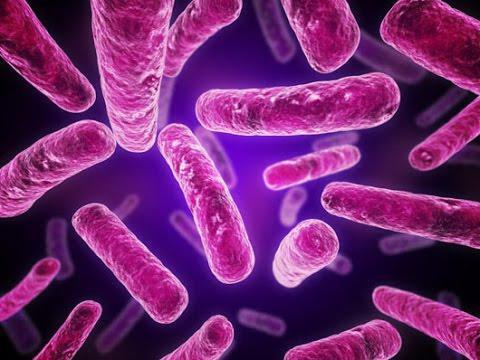
Грамположительные бактерии имеют толстый ригидный слой (клеточную стенку). Защитная оболочка состоит из полипептидов и полисахаридов. До 70% стенки составляет муреиновый мешок. В его состав входят: лизин, ацетилглюкозаминин, ацетилмурамовая кислота, диаминопимелиновая и тейхоевые кислоты.
Основные виды грамположительных бактерий
Большинство опасных для человека микроорганизмов – грамположительные бактерии. Они вызывают такие заболевания, как ботулизм или столбняк, эти болезни плохо поддаются лечению. Кроме того, микоплазму, которую не относят к этому типу, также произвели на свет грамположительные бактерии.
Виды грампозитивных микроорганизмов:
- кокки: клетки, соединенные между собой с помощью целлюлозы; в основном это анаэробные молочнокислые стрептококки;
- палочки: спорообразующие представлены анаэробными клостридиями; не способные образовывать споры – молочнокислые лактобациллы;
- коринеморфы: отличаются склонностью к изменению формы – это стрептомицетовые и пропионовокислые бактерии.
Подобные микроорганизмы вызывают массу недугов. Стафилококки провоцируют грибковые инфекции. Особенно опасен золотистый стафилококк.
Стрептококковые микроорганизмы вызывают фарингиты, рожу, реже пневмонию, сепсис.
Энтерококки часто поражают мочевыводящие пути, сердечную мышцу и провоцируют нагноения в ранах.
Заражение пневмококком зачастую проходит в сопровождении острых симптомов. Синуситы, отиты, внезапные генерализированные пневмонии – вот список заболеваний, вызванных этим возбудителем.
Что касается палочек, то самая известная из них – дифтерийная палочка, выделяющая смертельно опасные токсины и относящаяся к коринебактериям. Помимо нее, палочками вызываются сибирская язва и ботулизм.
Газовую гангрену вызывают бактерии под названием клостридии. Заболевание столбняком также обязано своим существованием этому виду бактерий. Причем столбнячные споры очень живучи: выдерживают длительное кипячение и замачивание в дезинфицирующих растворах.
Грамотрицательные микроорганизмы
В отличие от грампозитивных собратьев, они не окрашиваются в характерный цвет.
Напомним, что грамположительные бактерии, строение которых отличается более плотной клеточной оболочкой, не теряют фиолетовый цвет даже во время промывания. Тогда как грамотрицательные прокариоты поддаются полному обесцвечиванию. Но при этом контрастный сафранин окрашивает эти бактерии в розовато-красные цвета. Несмотря на более тонкую стенку, которая прочнее, нежели у иного вида бактерий, грамотрицательные микроорганизмы сложнее поддаются действию антител.
Заболевания, вызываемые грамотрицательными бактериями
Грамположительные и грамотрицательные бактерии отличаются реакцией на антибиотики. Более устойчивой к ним является вторая группа микроорганизмов.
Многие виды представляют собой объект пристального внимания медицины. Это бактерии, вызывающие венерические болезни: гонорею, сифилис, хламидийные инфекции. Грамотрицательные патогены, провоцирующие респираторные заболевания - моракселла катаралис, проблемы с дыханием - легионелла, клебсиелла. Также эти устойчивые бактерии вызывают менингит, нарушения пищеварения или язвенную болезнь желудка (сальмонелла, хеликобактер пилори, эшерихия коли). По форме бактерии довольно разнообразны: спириллы, палочки, спирохеты, вибрионы, трубчатые чехлы.
Знания о микроорганизмах – на пользу медицине
Информация о возбудителях различных болезней, как грамположительных, так и грамотрицательных, значительно упростила лечение многих недугов. Понимание того факта, что мембрана грамотрицательных бактерий прочнее остальных, позволила ученым выяснить их важное свойство: устойчивость ко многим видам антибиотиков. Кроме прочего, знания о мутациях и приспосабливании микроорганизмов к лекарственным препаратам также улучшили качество лечения бактериальных инфекций. Немаловажным аспектом является информация о том, что прежде всего влияют на организм токсины, выделяемые грамположительными и грамотрицательными видами бактерий.
Но наука не стоит на месте, и уже разработаны медикаменты, которые способны справиться с мембранной защитой грамотрицательных микроорганизмов. При этом имеет значение состояние макроорганизма в целом: его иммунный ответ и объемы воспалительных процессов.
Помимо заболеваний, бактерии приносят пользу: с их помощью можно готовить полезные кисломолочные продукты, очищать сточные воды, использовать в животноводстве.
[youtube.player]Московская медицинская академия им. И.М.Сеченова; городская клиническая больница №7, Москва
В последние два десятилетия существенно возросло значение грамположительных микроорганизмов в этиологической структуре инфекций в стационаре, особенно в отделениях реанимации и интенсивной терапии (ОРИТ); в настоящее время в 50% случаев и более инфекционные осложнения в ОРИТ вызываются грамположительными микроорганизмами [1]. Среди грамположительных микроорганизмов при нозокомиальных инфекциях ведущее этиологическое значение имеют стафилококки (Staphylococcus aureus и коагулазонегативные стафилококки – S. epidermidis, S. saprophyticus) и энтерококки (наиболее часто – Enterococcus faecalis и Enterococcus faecium). При некоторых нозологических формах стафилококки и энтерококки являются доминирующими микроорганизмами (табл. 1). В Европе почти половина всех нозокомиальных инфекций обусловлена стафилококками [2].
Сложности антибактериальной терапии грамположительных инфекций связаны с тем, что данные микроорганизмы (особенно госпитальные штаммы) часто характеризуются полирезистентностью, т.е. устойчивостью к трем и более группам антибактериальных препаратов. В настоящее время наибольшее клиническое значение имеют полирезистентные стафилококки и энтерококки. При внебольничных инфекциях важное значение сохраняют пневмококки и стрептококки (табл. 2).
Наиболее распространенными полирезистентными грамположительными микроорганизмами являются стафилококки, устойчивые к метициллину (оксациллину) – метициллинорезистентные золотистые стафилококки (MRSA) и метициллинорезистентные коагулазонегативные стафилококки. По данным международных исследований (NNIS, SENTRY), средняя частота выделения MRSA в ОРИТ в последние годы составила 40–50% [1, 3, 4]. Сходные цифры приводятся и по стационарам нашей страны. Метициллинорезистентные стафилококки характеризуются устойчивостью к оксациллину, перекрестной устойчивостью ко всем b -лактамным антибиотикам (пенициллинам, в том числе защищенным, цефалоспоринам, карбапенемам), а также ассоциированной устойчивостью ко многим другим группам антибактериальных препаратов – аминогликозидам, макролидам, линкозамидам, тетрациклинам, фторхинолонам.
Факторами риска инфекций, вызванных MRSA, являются нахождение в ОРИТ, искусственная вентиляция легких (ИВЛ), предшествующая госпитализация и антибиотикотерапия, наличие внутрисосудистых катетеров, назофарингеальное носительство MRSA, контакт с пациентами, инфицированными MRSA [5] (табл. 3).
Инфекции, вызванные MRSA, характеризуются более высокой летальностью по сравнению с инфекциями, вызванными чувствительными стафилококками [5, 6]. Хотя ванкомицин в течение многих лет рассматривался как препарат выбора при MRSA-инфекциях, он характеризуется низкой бактерицидной антистафилококковой активностью и в случае метициллиночувствительных стафилококков уступает по эффективности антистафилококковым пенициллинам [7, 8].
В конце 90-х годов стали поступать сообщения о выделении штаммов стафилококков с промежуточной чувствительностью к ванкомицину (vancomycin intermediate-susceptible S. aureus – VISA) со значениями минимальной подавляющей концентрации (МПК) 8–16 мкг/мл. В 2002 г. в США был выделен первый штамм S. aureus с высоким уровнем устойчивости к ванкомицину (МПК>128 мкг/мл). К настоящему времени в мире выделены 3 штамма стафилококка, устойчивых к ванкомицину (VRSA). Клинически важно, что высокая или промежуточная устойчивость стафилококков к ванкомицину ассоциируется с неуспехом терапии этим антибиотиком [5, 9]. Не менее важны данные, полученные в последние годы, что применение ванкомицина против стафилококков со сниженной чувствительностью к этому препарату (МПК=4 мкг/мл, что формально находится в диапазоне чувствительности) также сопровождается снижением клинической эффективности ванкомицина [10].
Широкое распространение в ОРИТ США получили в 90-е годы прошлого столетия штаммы энтерококков, устойчивые к ванкомицину (VRE). В 2000–2001 гг. частота VRE в ОРИТ достигла 25–30%, а в 2002 г. – 37,5% [1]. Инфекции, вызванные VRE, характеризуются высокой атрибутивной летальностью (30–40%) [11], что связано с задержкой назначения адекватной антибактериальной терапии вследствие низкой клинической эффективности ванкомицина в этих ситуациях [5]. Наиболее значимым фактором риска VRE-инфекций является длительная терапия ванкомицином пациентов с иммуносупрессией (см. табл. 3). Частота VRE в ОРИТ Европейских стран существенно ниже (2–3%), однако следует опасаться быстрого и глобального распространения этих штаммов в стационарах и популяции. В России в настоящее время документально подтвержден один штамм VRE из гематологического стационара, однако судить о реальном распространении VRE не представляется возможным из-за сложностей детекции этого механизма устойчивости рутинными методами и отсутствия широких эпидемиологических исследований резистентности.
К сожалению, следует констатировать неприятный и тревожный факт, что отмеченные тенденции роста устойчивости грамположительных бактерий имеют прогрессирующий характер и в ближайшей перспективе не видно реальных мер по сдерживанию этого процесса в масштабах популяции в целом.
В этой связи трудно недооценить важность внедрения в клиническую практику новых антибактериальных препаратов, направленных на решение проблемы лечения резистентных грамположительных инфекций. Интенсивные научные разработки последних лет привели к созданию ряда новых антибиотиков с повышенной активностью против грамположительных бактерий в ряду существующих классов антимикробных средств, таких как полусинтетические гликопептиды (оривантацин), кетолиды (телитромицин), стрептограмины (хинупристин/дальфопристин), липопептиды (даптомицин), цефалоспорины V поколения (BMS-247243, RWJ-54428). Однако большинство этих соединений находится на стадии доклинического или клинического изучения или недоступны в нашей стране.
Единственным новым антибактериальным препаратом для лечения грамположительных инфекций, зарегистрированным в России, является линезолид. В настоящем обзоре будут систематизированы современные данные по линезолиду с целью уточнения значения и места этого антибиотика в лечении инфекций, вызванных грамположительными микроорганизмами.
Химическая структура и механизм действия
Линезолид – первый представитель нового класса синтетических антимикробных средств оксазолидинонов. Химическая структура линезолида представлена на рисунке.
Механизм действия линезолида связан с ингибированием синтеза белка в рибосомах бактериальной клетки. В отличие от других антибиотиков, ингибирующих синтез белка, линезолид воздействует на ранних этапах трансляции (необратимое связывание с 30S- и 50S-субъединицей рибосом), в результате чего нарушаются процесс образования 70S-комплекса и формирование пептидной цепи. Благодаря уникальному механизму действия не отмечается перекрестной устойчивости микроорганизмов к линезолиду и другим антибиотикам, действующим на рибосомы (макролиды, линкозамиды, стрептограмины, аминогликозиды, тетрациклины и хлорамфеникол).
Антимикробная активность
Линезолид проявляет высокую активность в отношении грамположительных микроорганизмов – стафилококков, энтерококков, пневмококков, различных стрептококков (группы А, В, С, группы Viridans), анаэробных кокков и клостридий, а также некоторых других микробов. Грамотрицательные аэробные микроорганизмы природно устойчивы к линезолиду, за исключением Moraxella catarrhalis, Haemophilus influenzae, Bacillus pertussis, Neisseria gonorrhoeae, Legionella spp., которые проявляют умеренную чувствительность (МПК90 от 4 мкг/мл и выше). Критерии чувствительности грамположительных бактерий к линезолиду приведены в табл. 4.
Стафилококки. Линезолид проявляет хорошую активность в отношении золотистого и коагулазонегативных стафилококков со значениями МПК90 1–2 мкг/мл. К настоящему времени более 99% штаммов стафилококков проявляют чувствительность к линезолиду (МПК 100 мг/кг/сут), линезолид проявлял активность (ED50 24 мг/кг/сут); в отношении ванкомициночувствительных штаммов E. faecalis ED50 ванкомицина и линезолида составила 0,5 и 10 мг/кг/сут соответственно [24].
На модели экспериментального эндокардита, вызванного метициллинорезистентным S. aureus и ванкомицинорезистентным E. faecium, линезолид в дозе 40 мг/кг приводил к уменьшению количества бактерий в вегетациях на 2,9 log10 КОЕ/г, в то время как ванкомицин в дозе 60 мг/кг не изменял количество бактерий в вегетациях. Линезолид оказался эффективнее ванкомицина при применении в одинаковой дозе 25 мг/кг при экспериментальном энтерококковом эндокардите [12]. При экспериментальном стафилококковом эндокардите у кроликов линезолид проявлял эффективность в дозе 50 и 75 мг/кг, в то время как при дозе 25 мг/кг эффекта получено не было. Авторы отмечают, что условием положительного эффекта было поддержание концентраций линезолида в крови выше 2 мкг/мл, т.е. значений МПК для стафилококков [25].
Показана также эффективность линезолида и на других экспериментальных моделях инфекций – кожи и мягких тканей, остеомиелита, пневмонии, среднего отита, нейтропении [12, 13].
Резистентность
Резистентность к линезолиду in vitro развивается крайне медленно. Спонтанные мутации S. aureus и развитие резистентности не отмечены при экспозиции линезолида в концентрациях 2, 4 и 8 МПК. Частота спонтанных мутаций MRSA, MSSA и S. epidermidis составила менее 1 ґ 10-9 [23, 26].
Крайне низкая устойчивость клинических штаммов грамположительных микроорганизмов к линезолиду отмечена в различных многоцентровых исследованиях. В исследовании SENTRY [27] не отмечено резистентных к линезолиду штаммов энтерококков, в то время как к ампициллину и ванкомицину было устойчиво 24 и 17% штаммов соответственно. В многоцентровом исследовании в Европе также не выделено резистентных к линезолиду штаммов стафилококков, пневмококков и энтерококков; 90% штаммов стрептококков подавлялись линезолидом в концентрациях 0,25–1 мкг/мл, а стафилококков и энтерококков – 1–2 мкг/мл [28]. При исследовании 9000 свежевыделенных штаммов грамположительных бактерий линезолид оказался наиболее активным (чувствительны 99,7% штаммов) по сравнению с ванкомицином, левофлоксацином и моксифлоксацином [29].
Наиболее важные антимикробные свойства линезолида:
• высокая активность против стафилококков, как чувствительных, так и резистентных к метициллину (оксациллину);
• сохранение активности против штаммов стафилококков со сниженной чувствительностью или устойчивых к ванкомицину;
• высокая активность против пневмококков, в том числе штаммов, устойчивых к пенициллину, цефалоспоринам, макролидам и другим антибиотикам;
• высокая активность против энтерококков, включая штаммы E. faecium, устойчивые к ванкомицину;
• медленное формирование резистентности грамположительных бактерий in vitro;
• отсутствие в настоящее время в РФ клинических штаммов стафилококков, пневмококков и энтерококков, устойчивых к линезолиду.
Фармакокинетика
Линезолид применяется в виде внутривенной инфузии и в лекарственной форме для приема внутрь. Линезолид быстро и полностью всасывается при приеме внутрь, максимальные концентрации в крови достигаются через 1–2 ч и составляют в среднем около 12 мкг/мл. Абсолютная биодоступность препарата 100%. Прием пищи уменьшает максимальные концентрации в крови на 23%, но биодоступность не изменяется [30]. Объем распределения линезолида составляет 50 л, связь с белками плазмы – 31%, период полувыведения – 4,5–5,5 ч [31].
После применения линезолида внутрь в течение 7,5 дня в дозе 500 мг минимальные концентрации в крови (перед очередным приемом) в среднем составили 3,5 мкг/мл, при этом концентрации превышали 4 мкг/мл в течение 80% интервала дозирования [32]. Основные фармакокинетические параметры линезолида приведены в табл. 7.
Линезолид хорошо проникает в большинство органов и тканей человека [22]. В большинстве органов концентрации линезолида составляли 60–70% от величины сывороточных концентраций, а также высокие концентрации препарата (около 70% от сывороточных) определяются в спинномозговой жидкости [30, 31]. Линезолид накапливается в вегетациях клапанов сердца, и средние концентрации составляют 2,2 мкг/г после 5 дней применения в дозе 40 мг/кг [31].
Высокие концентрации линезолида отмечены в бронхолегочной ткани. Концентрации линезолида в жидкости, выстилающей эпителий (ЖВЭ), через 4 и 12 ч после приема последней дозы (5 доз по 600 мг с интервалом 12 ч) составили 64,3 и 24,3 мкг/мл и в среднем превышали сывороточные в 3,2 раза. Концентрации линезолида в альвеолярных клетках в эти же сроки составили 2,2 и 1,4 мкг/мл [33]. В то же время проникновение ванкомицина в бронхолегочную ткань было существенно хуже: концентрации ванкомицина в ЖВЭ колебались от 0,4 до 8,1 мкг/мл (в среднем 4,5 мкг/мл) и были в среднем в 6 раз ниже соответствующих концентраций препарата в крови [34].
Линезолид в достаточно высоких концентрациях определяется в костной ткани: концентрации колебались от 3,3 до 17,4 мкг/г (в среднем 8,5 мкг/г), что выше значений МПК90 для MRSA и других грамположительных микроорганизмов [35].
Линезолид метаболизирует в печени путем окисления с образованием двух метаболитов, обладающих очень слабой антибактериальной активностью. В крови линезолид находится преимущественно в неизмененной форме. На долю внепочечного клиренса приходится 65% экскреции препарата. После однократного приема внутрь с мочой в течение 7 дней выводится 80–85% и с фекалиями – 7–12% принятой дозы. Около 30% препарата выделяется с мочой в неизмененном виде [13, 31].
Фармакокинетика линезолида не изменяется существенно у пациентов пожилого возраста [36] и у детей старше 1 года. Период полувыведения линезолида был короче (3–3,7 ч) у детей [37]. Фармакокинетические параметры линезолида существенно не изменяются у пациентов с умеренной почечной недостаточностью и циррозом печени [38, 39]. При клиренсе креатинина более 10 мл/мин не требуется коррекция режима дозирования препарата. Линезолид частично диализирует, поэтому после сеанса гемодиализа требуется дополнительная доза 200 мг.
Наиболее важные фармакокинетические характеристики линезолида:
• полное всасывание при приеме внутрь (биодоступность 100%), пища не влияет на степень всасывания;
• препарат хорошо проникает в различные органы и ткани, где достигаются концентрации, составляющие 70–80% от сывороточных; концентрации линезолида в бронхолегочной ткани превышают сывороточные в 2,5–4 раза;
• линезолид проникает внутрь клеток макроорганизма – концентрации в альвеолярных макрофагах составляют 1,4–2,2 мкг/мл;
• препарат проникает через гематоэнцефалический барьер при менингите;
• линезолид выводится из организма двумя путями (почки и печень) и частично метаболизирует, поэтому у больных с нарушенной функцией почек или печени не требуется корректировать режим дозирования препарата;
• период полувыведения линезолида составляет около 5 ч, что позволяет назначать препарат с интервалом 12 ч.
Клиническое применение
Клиническая эффективность линезолида в контролируемых исследованиях документирована при внебольничной и госпитальной пневмонии у взрослых и детей, неосложненных и осложненных инфекциях кожи и мягких тканей, бактериемии, а также при инфекциях различной локализации, вызванных MRSA и ванкомицинорезистентными энтерококками. Линезолид не уступает по эффективности ванкомицину при инфекциях кожи и мягких тканей и превосходит ванкомицин при нозокомиальной пневмонии и инфекциях, вызванных метициллиночувствительными и метициллинорезистентными стафилококками.
Имеются исследования клинической эффективности линезолида при абдоминальных инфекциях, эндокардите и остеомиелите, вызванных грамположительными микроорганизмами, а также в случае инфекций при нейтропенических состояниях.
Документированная эффективность линезолида
Внебольничная пневмония
Эффективность линезолида изучена в двух сравнительных контролируемых многоцентровых исследованиях. Препаратами сравнения были цефподоксим проксетил у амбулаторных [40] и цефтриаксон у госпитализированных пациентов [41]. В обоих исследованиях 481 пациент получал линезолид, 470 пациентов – препарат сравнения. Клиническая и микробиологическая эффективность была одинаковой в группах сравнения: 90 и 89% при применении линезолида и 89 и 88% при применении цефалоспоринов. Одинаковый уровень эрадикации основных возбудителей заболевания – S. pneumoniae, S. aureus и H. influenzae – отмечен при применении линезолида и препаратов сравнения.
Эффективность линезолида оказалась достоверно выше в подгруппе госпитализированных пациентов с внебольничной пневмонией, осложненной пневмококковой бактериемией – 93 и 70% соответственно [42].
В открытом исследовании II фазы клиническая эффективность линезолида у детей с внебольничной пневмонией составила 95% [43].
Читайте также:


