Репродуктивно значимые инфекции это
Демографическая ситуация в России до сих пор не улучшилась. В последних документах правительства Российской Федерации и Министерства здравоохранения и социального развития в качестве основной причины ухудшения репродуктивного здоровья населения приводится
Демографическая ситуация в России до сих пор не улучшилась. В последних документах правительства Российской Федерации и Министерства здравоохранения и социального развития в качестве основной причины ухудшения репродуктивного здоровья населения приводится инфекционная заболеваемость, особенно заболеваемость урогенитальными инфекциями. Одним из успешных путей сокращения заболеваемости является качественная и своевременная диагностика не только урогенитальных инфекций, но и всех инфекций, влияющих на репродуктивное здоровье населения.
К репродуктивно значимым инфекциям относят урогенитальные инфекции. Наиболее часто это инфекции, передаваемые половым путем, а также трансплацентарные инфекции, имеющие значение исключительно для беременных женщин. Кроме того, любые инфекционные заболевания, перенесенные человеком, особенно в период становления репродуктивной функции, могут влиять и на репродуктивное здоровье.
Своевременная этиологическая диагностика репродуктивно значимых инфекций служит основанием для раннего начала этиотропной терапии, а также для информации пациентов об особенностях распространения заболевания, последствиях для обоих половых партнеров, а при беременности — о возможном заболевании плода и новорожденного ребенка.
В диагностике инфекций репродуктивного тракта большая роль отводится микробиологическим исследованиям. От точности поставленного этиологического диагноза во многом зависит успех лечения этих инфекций. Микробиологические методы диагностики способствуют правильному установлению диагноза в том случае, если врач знает заболевание, которое собирается диагностировать, правильно собирает и направляет адекватный материал на исследование, знает состав нормальной микрофлоры урогениталий и как оценить результаты исследований.
В рамках проекта разработана методология разноуровневой диагностики репродуктивно значимых инфекций. На первом уровне врач на приеме оценивает состояние пациента, проводит осмотр и микроскопическое исследование отделяемого влагалища, цервикального канала и уретры у женщин и уретры у мужчин. Второй уровень предусматривает лабораторное исследование с целью уточнения диагноза и установления этиологического фактора инфекции.
Первый уровень очень важен как для врача, так и для пациента. При первом визите врач в присутствии пациента при помощи элементарных навыков в области микроскопического исследования оценивает состояние слизистой урогенитального тракта и определяет стратегию ведения пациента (назначает лечение и, при необходимости, направляет клинический материал в лабораторию для целенаправленного исследования с целью выявления определенных возбудителей).
Цель данной статьи: рассмотреть основные методы микробиологической диагностики репродуктивно значимых инфекций и представить практически приемлемый алгоритм диагностики, терапии и контроля излеченности.
Особенности диагностики репродуктивно значимых инфекций
Материалы и методы. Для исследования на наличие возбудителей урогенитальных инфекций берут материал из уретры у мужчин; из влагалища, уретры, цервикального канала у женщин; первую порцию свободно выпущенной мочи (в основном у мужчин). Для исследования на наличие трансплацентарных инфекций — исследуют венозную кровь на наличие специфических антител.
Основные методы исследования: микроскопические, культуральные (посевы), молекулярно-биологические (полимеразно-цепная реакция (ПЦР) и другие), серологические (иммуноферментный анализ (ИФА)).
Нормальная микрофлора урогенитального тракта. Из огромного количества разнообразных микроорганизмов, которые находятся в урогенитальном тракте женщин и мужчин, очень редкие из них действительно вызывают заболевание. К патогенным микроорганизмам, при выявлении которых обязательно назначается этиотропная терапия, относят такие как Treponema pallidum, Neisseria gonorrhoeae, Haemophilus ducrei, Chlamydia trachomatis, Mycoplasma genitalium, а также простейшее Trichomonas vaginalis. Существует большая группа условно патогенных микроорганизмов, которые могут вызывать заболевание при определенных условиях — это микоплазмы (Mycoplasma hominis, Mycoplasma fermentans), уреаплазмы (Ureaplasma urealyticum, Ureaplasma parvum), энтерококки, энтеробактерии, стафилококки, стрептококки, гарднереллы (Gardnerella vaginalis), дрожжеподобные грибы (Candida spp.). Эти же микроорганизмы могут входить в состав нормального физиологического микробиоценоза гениталий.
Оценка врачом воспалительной реакции на основании физикального осмотра и микроскопического исследования позволит правильно взять адекватный материал для исследования и направить его в лабораторию для уточнения диагноза.
Выявление вируса папилломы человека (ВПЧ). В настоящее время дискутируются вопросы включения теста на ВПЧ в первичный скрининг рака шейки матки, т. к. первичный цитологический скрининг недооценивает тяжесть заболевания у 30% женщин. В основе всех рекомендаций по применению теста на вирус папилломы человека в скрининге рака шейки матки лежит тот факт, что цервикальные поражения высокой степени и рак в отсутствие вируса не развиваются. Необходимое условие развития рака шейки матки — длительная персистенция вируса, высокая вирусная нагрузка определенного типа вируса. Для выявления ВПЧ и определения концентрации вируса используется исключительно ПЦР в реальном времени [5].
Диагностика трансплацентарных инфекций. К возбудителям трансплацентарных инфекций относятся: Listeria monocytogenes, Treponema pallidum, Toxoplasma gondii, а также вирусы краснухи, цитомегалии, герпеса 1/2 типов, герпеса 3 типа — Varicella zoster, кори, парвовирус В19 и др. Следует отметить, что выявление возбудителей той или иной инфекции у беременной не всегда говорит о его передаче плоду. Так, известно, что в 100% плоду передаются листерии, в 50–70% хламидии, в 37% стрептококки группы В, в 30% микоплазмы, в 50% — вирус цитомегалии при первичной инфекции во время беременности [8, 11]. Для диагностики этих инфекций используются методы, описанные выше.
Для диагностики таких инфекций, как токсоплазмоз, цитомегалия, краснуха, используют определение антител разных классов в сыворотке крови матери. Для беременной важно выявление острой инфекции, впервые возникшей во время данной беременности. Поэтому при планировании беременности необходимо обследование на наличие только специфических IgG, свидетельствующих об иммунитете. При постановке беременной на учет в женской консультации, а также при контакте с этими инфекциями следует провести исследование сыворотки крови на наличие антител IgG, IgG-авидность и IgM [10].
Особенности терапии репродуктивно значимых инфекций
Основа терапии репродуктивных инфекций — назначение специфических антибактериальных, противовирусных или антипротозойных препаратов. Существуют международные и европейские методические рекомендации, регламентирующие назначение тех или иных терапевтических средств [7, 9, 13].
При лечении гонореи в первую очередь назначается один из следующих препаратов: цефтриаксон, ципрофлоксацин или цефиксим. Альтернативными препаратами являются cпектиномицин, офлоксацин, ломефлоксацин.
При лечении урогенитальной хламидийной инфекции, согласно международным стандартам, назначаются или азитромицин, или доксициклин, или джозамицин. Альтернативными препаратами являются: эритромицин, спирамицин, офлоксацин, рокситромицин, ломефлоксацин, кларитромицин.
В 2006 году нами суммированы данные, приведенные в международных руководствах по диагностике и терапии инфекций, передаваемых половым путем, и издано руководство для врачей [4].
Кроме того, нами проведен цикл работ, посвященных назначению тех или иных антибиотиков. На первом этапе исследований антибактериальной активности нами была отработана методика проведения теста изучения антибиотикочувствительности хламидий. При этом было показано отсутствие какой-либо корреляции между чувствительностью хламидий к антибиотикам in vitro и успехом или неудачей терапии урогенитальной хламидийной инфекции.
В дальнейшем мы провели мониторинг терапии урогенитального хламидиоза с применением двух антибиотиков (доксициклин — Юнидокс Солютаб ® и джозамицин — Вильпрафен ® ) с тем, чтобы показать, насколько быстро исчезают хламидии на фоне терапии.
Материалами для исследования служили мазки-соскобы из цервикального канала у женщин и уретры у мужчин.
Вильпрафен ® назначался внутрь по 500 мг 2 раза в день в течение 10 дней, Юнидокс Солютаб ® — внутрь по 100 мг 2 раза в день 10 дней.
Для оценки эффективности элиминации хламидий в ходе терапии пациенткам было предложено лечение одним из этих препаратов и проведение контрольных исследований во время терапии (на 2, 5, 7 и 10 день после начала лечения) и после лечения (через 1, 2, 3 недели и 1, 3 и 6 месяцев). Контрольные исследования проводили тремя методами одновременно: культуральным, методом ПЦР и методом NASBA в реальном времени.
Уже в первые дни приема Вильпрафена ® или Юнидокса Солютаба ® пациентки, обратившиеся к врачу с жалобами, отметили существенное улучшение самочувствия, а к концу лечения врачи констатировали улучшение клинической картины в большинстве случаев.
Результаты микробиологических исследований оказались следующими: на 2 день приема препарата хламидии были обнаружены культуральным методом только у 37% пациентов, в то время как все пробы были положительными при исследовании методом ПЦР. Во все остальные сроки исследований, проводимых на фоне терапии, хламидии в культуре клеток не выделялись. Уже на 7 день терапии количество пациентов, у которых хламидии выявлялись методом ПЦР, сократилось вдвое, на 10 день — втрое, а через 3 недели после окончания лечения ПЦР давала отрицательные результаты у всех пациентов. Метод NASBA в реальном времени, позволяющий определить только жизнеспособного возбудителя по наличию mРНК, показал следующие результаты: на 2 день терапии Вильпрафеном ® хламидии сохранялись у 82% женщин, на 5 день — у 45%, на 7 день — у 20%, на 10 день — у 7%. При лечении Юнидоксом Солютабом ® — динамика элиминации хламидии была такой же, как и при лечении Вильпрафеном ® . Однако при лечении Юнидоксом Солютабом ® на 10 день терапии хламидии уже не выявлялись при использовании метода NASBA. Таким образом, данные мониторинга свидетельствуют о быстрой элиминации возбудителя в ходе лечения. Курс терапии Вильпрафеном ® и Юнидоксом Солютабом ® продолжительностью в 10 дней является оправданным.
Сочетание ПЦР и культурального метода представляется нам эффективным при проведении контроля излеченности урогенитальной хламидийной инфекции. Так как нежизнеспособные хламидии могут обнаруживаться в клетках эпителия цервикального канала и уретры еще некоторое время после завершения лечения (в нашем исследовании хламидии были выявлены через 1 неделю после окончания терапии у трех пациентов), то проведение контроля излеченности можно рекомендовать не ранее чем через 2–3 недели после окончания лечения. Применение метода NASBA в реальном времени представляется перспективным как для диагностики, так и для контроля излеченности, т. к. позволяет определить жизнеспособность возбудителя.
Что касается генитальных микоплазм, то в 2007 году выработан консенсус специалистов, занимающихся вопросами диагностик и терапии инфекций, ассоциированных с микоплазмами [1]. Т. к. M. genitalium в настоящее время относят к патогенным микроорганизмам, то при выявлении этого микроорганизма всегда назначается этиотропное лечение. При выявлении U. urealyticum и M. hominis (относящихся к условно патогенным микроорганизмам) лечение следует назначать, если других бактериальных/вирусных агентов, кроме микоплазм, не выявлено при:
Лечение следует назначать при наличии у пациентов клинических проявлений воспалительного процесса и в том случае, если U. urealyticum и M. hominis выявляются в количестве более 10 4 КОЕ/мл.
Наиболее активными антибиотиками in vitro для элиминации всех видов генитальных микоплазм являются из макролидов джозамицин, из тетрациклинов доксициклин. При выявлении M. genitalium наиболее эффективны азитромицин, джозамицин, доксициклин.
При выборе метода терапии при кандидозном вульвовагините важно определиться, имеет место острый или рецидивирующий процесс. При остром вульвовагините, вызванном дрожжеподобными грибами рода Candida, согласно международным стандартам, назначают преимущественно препараты местного действия, такие как эконазол, изоконазол, клотримазол, натамицин или комплексный препарат Тержинан. В ряде случаев назначают препараты внутрь. Одним из таких препаратов является флуконазол. Этот препарат выпускается разными фирмами под разными названиями. Нами апробирован и применяется Микофлюкан ® в одноразовой дозе 150 мг при остром кандидозном вульвовагините. В настоящее время изучается действие этого препарата при лечении хронического рецидивирующего кандидозного вульвоагинита.
При лечении бактериального вагиноза, а также трихомоноза с успехом используется метронидазол (Трихопол ® ) как внутрь, так и местно во влагалище. Следует подчеркнуть, что при бактериальном вагинозе важное значение имеет восстановление нарушенного микробиоценоза влагалища и повышение местного иммунитета с помощью эубиотиков (Бифиформ, Бифидумбактерин, Ацилакт и др.).
Не следует забывать о таком комплексном препарате для местного применения, как Тержинан, который может использоваться как при лечении бактериального вагиноза, урогенитального кандидоза, так и неспецифических воспалительных заболеваний влагалища.
Заключение
Для диагностики репродуктивно значимых инфекций используются разные микробиологические методы. Важно для этой цели выбрать метод, отвечающий всем стандартам качества, высокочувствительный и высокоспецифичный. Параметры диагностической чувствительности и специфичности метода должны быть более 95%.
В результате проведенных нами исследований по оптимизации методов микробиологической диагностики репродуктивно значимых инфекций составлен алгоритм обследования, включающий использование как микроскопических, так и молекулярно-биологических методов. При рациональном использовании этих методов диагностики инфекций репродуктивного тракта возможно быстро и качественно поставить диагноз и вовремя начать лечение.
Определение ВПЧ в цервикальном канале, вирусной нагрузки, статуса вирусной ДНК может использоваться в скрининговых программах по ранней диагностике рака шейки матки.
Создание алгоритма обследования беременных и планирующих беременность женщин для диагностики острой впервые возникшей инфекции и латентной хронической (анамнестической) инфекции позволит правильно прогнозировать течение и исход беременности.
Следует подчеркнуть важность создания независимой референс-лаборатории, которая, на основании опыта научно-исследовательской работы, могла бы осуществлять валидацию, стандартизацию используемых методов диагностики репродуктивно значимых инфекций, разрабатывать стандарты диагностики, а также внедрять контроль качества деятельности лаборатории.
Лечение репродуктивно значимых инфекций регламентировано международными и европейскими стандартами. Требуется разработка федеральных стандартов по проведению диагностики и терапии инфекционных заболеваний репродуктивного тракта как женщин, так и мужчин.
Литература
А. М. Савичева, доктор медицинских наук, профессор
НИИАиГ им. Д. О. Отта РАМН, Санкт-Петербург
Для вирусов характерен дизъюнктивный (от disjuncus — разобщенный) способ репродукции-размножения. Потомство вируса возникает в результате сборки нуклеиновых кислот и белковых субъединиц, которые синтезируются раздельно клеткой хозяина.
Проникновение вируса в клетку и воспроизведение себе подобных проходит в несколько фаз:
1.проникновение в клетку хозяина,
2.синтез ферментов, необходимых для репликации вирусных нуклеиновых кислот,
3.синтез вирусных частей,
4.сборка и композиция зрелых вирионов,
5.выход зрелых вирионов из клетки.
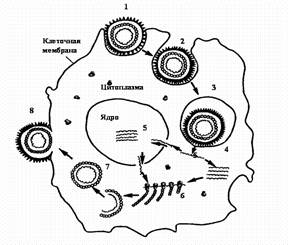
Стадии репродукции вирусов.
1 - адсорбция вириона на клетке; 2 - проникновение вириона в клетку путем виропексиса;
3 - вирус внутри вакуоли клетки; 4 - `раздевание вириона вируса; 5 - репликация вирусной нуклеиновой кислоты; 6 - синтез вирусных белков на рибосомах клетки; 7 - формирование вириона; 8 - выход вириона из клетки путем почкования.
Фаза I — адсорбция вириона на поверхности клетки.
Протекает в две стадии: первая — неспецифическая, когда вирус удерживается на поверхности клетки при помощи электростатических сил, т. е. благодаря возникновению противоположных зарядов между отдельными участками мембраны клеток и вируса. Эта фаза взаимодействия вируса с клеткой обратима, на нее оказывают влияние такие факторы, как рН и солевой состав среды.
Вторая стадия — специфическая, когда взаимодействуют специфические рецепторы вируса и рецепторы клетки, комплементарные друг другу. По химической природе рецепторы клетки могут быть мукопротеидами (или мукополисахаридами) и липопротеидами. Разные вирусы фиксируются на разных рецепторах: вирусы гриппа, парагриппа, аденовирусы — на мукопротеидах, а вирусы клещевого энцефалита, полиомиелита — на липопротеидах.
Фаза II — проникновение вируса в клетку. Электроноскопические наблюдения за процессом проникновения вирусов в чувствительные к ним клетки показали, что оно осуществляется посредством механизма, напоминающего пиноцитоз, или, как чаще называют, виропексис. В месте адсорбции вируса клеточная стенка втягивается внутрь клетки, образуется вакуоль, в которой оказывается вирион. Параллельно клеточные ферменты (липазы и протеазы) вызывают депротеинизацию вириона — растворение белковой оболочки и освобождение нуклеиновой кислоты.
Фаза III — скрытый период (период эклипса — исчезновения). В этот период в клетке невозможно определить наличие инфекционного вируса ни химическими, ни электронно-микроскопическими, ни серологическими методами. О сущности этого явления и его механизмов пока известно мало. Предполагается, что в скрытой фазе нуклеиновая кислота вируса проникает в хромосомы клетки и вступает с ними в сложные генетические взаимоотношения.
Фаза IV — синтез компонентов вириона. В этой фазе вирус и клетка представляют единое целое, вирусная нуклеиновая кислота выполняет генетическую функцию, индуцирует образование ранних белков и изменяет функцию рибосом. Ранние белки подразделяются на:
а) белки-ингибиторы (репрессоры), подавляющие метаболизм клеток
б) белки-ферменты (полимеразы), обеспечивающие синтез вирусных нуклеиновых кислот.
Синтез нуклеиновых кислот и белков протекает неодновременно и в разных структурных частях клетки. У вирусов, содержащих ДНК или РНК, эти процессы имеют некоторые различия и особенности.
Процесс формирования вирионов начинается спустя определенное время после того, как начал осуществляться синтез составляющих их компонентов. Продолжительность этого периода довольно вариабельна и предопределяется природой вируса — для РНК-содержащих обычно короче, чем для ДНК-вирусов. Например, продукция полных вирусных частиц осповакцины начинается приблизительно спустя 5—6 ч после инфицирования клеток и продолжается в течение последующих 7—8 ч, т. е. после того как синтез вирусной ДНК уже завершен.
Между нуклеиновой кислотой и соответствующим белковыми субъединицами образуются очень прочные связи, о чем свидетельствуют трудности отделения белка от вирусной нуклеиновой кислоты. Большую прочность вирусной частице придают входящие в ее состав углеводы и особенно липиды.
Формирование вирионов, так же как и синтез компонентов вируса, происходит в разных местах клетки, при участии различных клеточных структур. После завершения процесса формирования образуется зрелая дочерняя вирусная частица, обладающая всеми свойствами родительского вириона. Но иногда наблюдается образование так называемых неполных вирусов, которые состоят или только из нуклеиновой кислоты, или из белка, или из вирусных частиц, формирование которых остановилось в какой-то промежуточной стадии.
Фаза VI — выход зрелых вирионов из клетки. Существуют два основных механизма выхода зрелых вирионов из клетки:
1) выход вириона с помощью почкования. В этом случае наружная оболочка вириона происходит из клеточной мембраны, она содержит как материал клетки хозяина, так и вирусный материал;
2) выход зрелых вирионов из клетки через бреши в мембране. Эти вирусы не имеют наружной оболочки. При таком механизме выхода вирусов клетка, как правило, погибает и в среде появляется большое количество вирусных частиц.
Причиной гибели зараженной клетки могут быть три механизма:
2.защитная реакция клетки, запускающая генетическую программу ее гибели (апоптоз);
3. иммунная система организма, уничтожающая зараженную клетку.
Кроме продуктивного типа взаимодействия вируса и клетки возможно интегративное сосуществование или вирогения. Вирогения характеризуется интеграцией (встраиванием) нуклеиновой кислоты вируса в геном клетки, а также репликацией и функционированием вирусного генома как составной части генома клетки. Для интеграции с клеточным геномом необходимо возникновение кольцевой формы двунитевой ДНК вируса. Встроенная в состав хромосомы клетки вирусная ДНК называется провирусом. Провирус реплицируется в составе хромосомы и переходит в геном дочерних клеток, т.е. состояние вирогении наследуется. Под влиянием некоторых физических или химических факторов провирус может переходить в автономное состояние с развитием продуктивного типа взаимодействия с клеткой. Дополнительная генетическая информация провируса при вирогении сообщает клетке новые свойства, что может быть причиной развития опухолей, аутоиммунных и хронических заболеваний. На способности вирусов к интеграции с геномом клетки основаны персистенция (от лат. persisto - постоянно пребывать, оставаться) вирусов в организме и развитие персистентных вирусных инфекций. Например, вирус гепатита В способен вызывать персистирующие поражения с развитием хронического гепатита и часто опухолей печени.
Не нашли то, что искали? Воспользуйтесь поиском:
Содержание
Дерматология в России
- Сайт зарегистрирован как СМИ, электронное периодическое издание на русском и английском языке, ISSN 2077-3544
- Основатель и главный редактор проекта - проф. А.Ю. Сергеев
- Посещаемость сайта свыше 1500 человек в сутки (статистика). Среди более 15000 наших врачей-подписчиков 223 доктора и 1229 кандидатов медицинских наук, заведующие кафедрами, директора институтов и научных центров, руководители здравоохранения. Издание распространяется бесплатно, для использования профессиональных и интерактивных материалов необходима регистрация
- Дерматология в России выходит и обновляется практически ежедневно. Сайт предоставляет возможности коммуникации для практикующих врачей, ученых, преподавателей, представителей общественных организаций и фармацевтической индустрии
Анаэробные микроорганизмы в этиологии репродуктивно значимых инфекций
ГУ Научно-исследовательский институт акушерства и гинекологии им. Д.О. Отта РАМН, г. Санкт-Петербург
Цель: установление этиологической значимости анаэробных микроорганизмов в этиологии репродуктивно значимых инфекций.
Материалы и методы: изучение литературы по вопросам оценки значимости анаэробных микроорганизмов в этиологии репродуктивно значимых инфекций.
Результаты: для поддержания нормального физиологического микробиоценоза гениталий и для размножения нормальной эндогенной микрофлоры необходим определенный окислительно-восстановительный потенциал среды микробного окружения. Снижение этого потенциала происходит во время операций, родов, когда ткани сдавливаются, зажимаются, обескровливаются, образуется микрогематома или серозный выпот. Из-за этого сопутствующая микрофлора уменьшает окислительно-восстановительный потенциал, позволяя все большему числу видов анаэробов размножаться, что приводит к аутоэлиминации ведущихбактерий.
Значительное снижение окислительно-восстановительного потенциала инициирует анаэробную прогрессию. Вся микрофлора подвергается селективным изменениям. Микрофлора, способная размножаться в присутствии кислорода, в таких неблагоприятных условиях подвергается процессу последовательной аутоэлиминации. Этот процесс называется анаэробной прогрессией. Ее этапы можно представить следующим образом:
1-й этап: в очаге инфекции присутствуют аэробно-факультативные анаэробы: альфа-стрептококки, Lactobacillus sp., Staphylococcus epidermidis, Staphylococcus aureus, Corynebacterium sp., Enterococcus sp., Enterobacteriaceae,. 2-й этап: стрептококки группы D, Gardnerella vaginalis, Peptostreptococcus sp., Peptococcus sp.,Veilonella sp., Actinomyces sp., Eubacterium sp., Clostridium sp., Lactobacillus sp., Bacteroides sp., Prevotella sp., 3-й этап: происходит отбор микроорганизмов, исчезают факультативно анаэробные виды бактерий, размножаются обли-гатные анаробы — Peptostreptococcus sp., Peptococcus sp., Bacteroidae sp., Clostridium sp., Actinomyces sp., Prevotella sp,. 4-й этап: остаются облигатные анаэробы Peptococcus sp., Peptosteptococcus sp., Bacteroides sp., Prevotella sp., 5-й конечный этап: остается ультимативно один вид эксклюзивно анаэробного рода бактерий. На этом этапе формируется абсцесс. Это кульминация анаэробной инфекции, из материала хорошо сформированного абсцесса выделяется один вид или один род бактерий.
Анаэробная прогрессия является главным, но не единственным путем формирования анаэробного заболевания. Имеет зна-чение наличие сопутствующих заболеваний или состояний, приводящих к развитию дисбактериоза влагалища или кишечника.
В акушерстве анаэробная прогрессия способствует развитию септического аборта, послеродового эндометрита и других
послеродовых осложнений. В гинекологии в результате полимикробной анаэробной инвазии возможно развитие послеопе-
рационных абсцессов, тубовариальных образований. Классическим примером анаэробной прогрессии является гонококковый
сальпингит, при котором Neisseria gonorrhoeae начинает первую фазу, затем рекрутируется смешанная аэробно-анаэробная
Инфекции репродуктивного тракта: общая характеристика. Инфекции, передающиеся половым путем. Эндогенные и ятрогенные инфекции. Вульвовагинит. Цервицит.
В настоящее время инфекции репродуктивного тракта из-за широкой распространенности и тяжести осложнений рассматриваются как серьезная и глобальная проблема здоровья женщин и мужчин, семьи и общества. По оценке ВОЗ, ежегодно регистрируется свыше 333 млн новых случаев излечимых инфекций репродуктивного тракта. Что касается неизлечиваемых инфекций, к которым относится ВИЧ-инфекция, то только в 2000 году 5,3 млн человек стали инфицированными ВИЧ.
Инфекции репродуктивного тракта являются причиной многочисленных серьезных осложнений у женщин: воспалительных заболеваний органов малого таза, бесплодия, эктопической беременности, синдрома хронической тазовой боли. А во время беременности они приводят к внутриутробному инфицированию и осложнениям течения беременности. Кроме того, следует отметить, что некоторые инфекции могут увеличивать возможность передачи ВИЧ.
К сожалению, многие инфекционные болезни не имеют клинически выраженных симптомов и часто распознаются, когда уже имеются повреждения функции репродуктивной системы.
В настоящее время, в зависимости от пути передачи, инфекции репродуктивного тракта подразделяют на три типа: инфекции, передающиеся половым путем, эндогенные инфекции и ятрогенные инфекции (рис. 13.1).
Внутренние пол. органы: матка, фаллопиевы трубы, яичники.
Наружные пол. органы: вульва, влагалище, шейка матки

К инфекциям, передающимся половым путем, относятся вирусы, бактерии и другие микроорганизмы, которые не являются представителями нормальной микрофлоры влагалища.
Эндогенные инфекции — результат усиленного роста микроорганизмов, которые колонизируют влагалище в норме.
Ятрогенные инфекции — развиваются при попадании микроорганиизмов в репродуктивный тракт (в частности, в стерильную среду матки) при проведении медицинских манипуляций (например, введения ВМС). Эти инфекции становятся причиной серьезных осложнений, которые могут угрожать жизни женщины.
К инфекциям, пердающимся половым путем, относятся бактерии, вирусы и другие микроорганизмы (свыше 30 различных микроорганизмов), которые передаются половым путем. Входными воротами могут быть уретра, вагина, ротовая полость и анус.
Вызывают широкий спектр клинических проявлений (генитальные язвы, генитальные бородавки, патологические выделения из половых путей, воспалительные процессы органов малого таза), но часто протекают и без симптомов. К поздним последствиям такого инфицирования относятся: бесплодие (как мужское, так и женское), рак шейки матки, эктопическая беременность, спонтанный аборт, преждевременный разрыв плодных оболочек, преждевременные роды, низкий вес новорожденных, неонатальные инфекции и смерть новорожденного.
Социальные, психологические и экономические последствия инфекций, передающихся половым путем, часто разрушительны. Они поражают как мужчин, так и женщин, и могут передаваться от матерей к детям во время беременности и во время родов.
Бактериальные и протозойные инфекции лечатся соответствующими антибиотиками и химиотерапевтическими препаратами более 40 лет, вирусные ИППП в настоящее время не лечатся. Согласно данным ВОЗ, около 340 млн новых случаев ИППП регистрируюются каждый год, в том числе 170 млн — трихомониаза, 89 млн —хламидийной инфекции, 62 млн — гонореи, 12 млн — сифилиса, 7 млн — шанкроида (ВОЗ, 1997).
Вирусные ИППП, которые не поддаются лечению, составляют болььшую проблему. По оценке UN AIDS на декабрь 2001 года, 40 млн человек живут с ВИЧ-инфекцией и СПИДом (причем 90% — в развивающихся странах), 5 млн человек были инфицированы в 2001 годуу и 20 млн больных умерло от СПИДа с начала эпидемии. Согласно данным исследования, ИППП способствуют переносу и инфицированию ВИЧ-инфеекцией.

По современным данным, эндогенные инфекции могут также ассоциироваться с увеличением передачи ВИЧ-инфекции.
В нормальной вагинальной флоре здоровых женщин репродуктивного возраста доминируют лактобациллы. Поэтому эндогенные инфекции развиваются в результате усиленного роста других микроорганизмов, которые колонизируют влагалище в норме. Кандидоз — это результат усиленного роста грибов рода Candida вследствие недавнего приема антибиотиков, использования прогестеронсодержащих оральных контрацептивов или иммунной супрессии. Не доказано, что Candida передается половым путем. Отмечено, что некоторые женщины имеют склонность к кандидозу по непонятным причинам.
Бактериальный вагиноз — это дисбаланс нормальной вагинальной флоры и часто — результат повышения рН. При этом лактобациллы замещаются Gardnerella vaginalis, грамнегативными кокками и другими микроорганизмами.
Ятрогенные инфекции — результат попадания микроорганизмов (бактерий) в верхний отдел репродуктивного тракта при проведении медицинских манипуляций, таких как регуляции менструального цикла, аборты, введение ВМС или во время родов. Аборты — частая причина ятрогенных инфекций. Согласно данным ВОЗ, каждый год имеют место 20 млн абортов, из которых большая часть приходится на развивающиеся страны (ВОЗ, 2000). Частота осложнений во время абортов составляет 10-50% . Причинами развития ятрогенной инфекции являются:
— использование нестерильных материалов и медицинского инструментария (вагинального зеркала);
— присутствие эндогенных инфекций или ИППП в нижнем отделе репродуктивного тракта.
Ятрогенные инфекции могут инфицировать матку, эндометрий, фалопиевы трубы и яичники, и поэтому приводят к, серьезным осложнениям. Настораживающими симптомами являются боли внизу живота, подъем температуры тела, озноб, болезненные месячные, патологические выделения из половых путей и боли во время coitusa.
По месту локализации инфекции репродуктивного тракта подразделяют на два вида: инфекции верхнего отдела репродуктивного тракта и инфекции нижнего отдела репродуктивного тракта(рис. 13.2).
К инфекциям верхнего отдела репродуктивного тракта относятся инфекции матки, фалопиевых труб и яичников. К инфекциям нижнего отдела репродуктивного тракта относят инфекции вульвы, вагины и цервикса.

Рис. 13.2. Инфекции репродуктивного тракта
Инфекции нижнего отдела репродуктивного тракта
Инфекции репроддуктивного тракта, которые поражают наружную половую область и нижний репродуктивный тракт женщины, часто упоминаются как вульвовагинит. Кллинически это проявляется воспалением вульвы / ввагины и может сопровождаться зудом или болезнненностью при пальпации.
Причинами вульввовагинита являются эндогенные инфекции (канддидоз или бактериальный вагиноз), хотя некоторыее инфекции, передающиеся половым путем, типа трихомониаза, могут также вызывать подобные клиннические признаки.
Следует отметитть, что некоторые инфекционные агенты (например, микроорганизмы, связанные с бактериальным вагинозом) могут мигрировать по репродуктивному тракту вверх и вызывать воспалительные процессы органов малого таза, а впоследствии и более ссерьезные осложнения (эктопическую беременность, бесплодие). Распространению инфекции сспособствуют трансцервикальные процедуры — например, регуляция менструального цикла, аборты или ведение ВМС. Предшествующие воспалительные явления в фалопиевых трубах также предрасполагают к последующему инфицированию или развитию хронической инфекции.
Причиной цервицита, как правило, являются микроорганизмы, передающиеся половым путем, типа gonorrhea и chlamydia trachomatis.
Цервициты рассматриваются как более серьезные состояния, чем вагиниты, поскольку они могут чаще осложняться инфицированием верхнего репродуктивного тракта с развитием серьезных последствий. Часто они не имеют клинических проявлений и трудно диагностируются.
Инфекции верхнего отдела репродуктивного тракта
Инфицирование верхнего репродуктивного тракта, включая матку, фаллопиевы трубы и яичники, — это, как правило, результат попадания инфекционного агента из нижнего отдела репродуктивного тракта. Очень часто такими инфекционными агентами являются микроорганизмы, передающиеся половым путем, типа gonorrhea и chlamydia, которые, проникая в верхний отдел репродуктивного тракта, вызывают воспалительные заболевания органов малого таза (ВЗОТ). Результатом этого могут быть хронические тазовые боли, эктопические беременности, нарушения менструального цикла, бесплодие в результате повреждения фаллопиевых труб и длительно протекающих хронических эндометритов.
Следует отметить, что серьезным осложнением инфицирования верхнего отдела репродуктивного тракта является эктопическая беременность, которая требует оперативного вмешательства, поскольку может вызвать смерть женщины.
Самая лучшая стратегия по ограничению вредного воздействия инфекций репродуктивного тракта — это предотвращение нового инфицирования, т. е. их профилактика. Пути профилактики зависят от пути инфицирования.
Профилактика инфекций, передающихся половым путем, делится на первичную и вторичную.
Первичная профилактика заключается в изменении сексуального поведения, в первую очередь это сексуальное воздержание и задержка полового дебюта, а также уменьшение числа половых партнеров, пропаганда моногамного образа жизни, использование барьерных методов контрацепции.
Вторичная профилактика заключается в быстром выявлении и лечении инфицированных, своевременной диагностике асимптоматических инфекций, лечении половых партнеров.
Профилактика эндогенных инфекций состоит в ликвидации факторов, которые способствуют их развитию. В частности, исключить применение вагинального душа, использование низкодозированных оральных контрацептивов, устранить риск иммунодефицита. Эндогенные инфекции легко диагностируются и лечатся оральными антимикробными или местными интравагинальными кремами. И хотя они не являются инфекциями, передающимися половым путем, у половых партнеров может наблюдаться некоторый дискомфорт, связанный с кандидозом. Поэтому иногда мужчины проходят лечение, что является профилактикой реинфекции у женщин. Следует отметить, что в случае отсутствия лечения эндогенные инфекции могут быть потенциальными причинами осложнений, таких как преждевременный разрыв плодных оболочек и преждевременные роды при беременности. Бактериальный вагиноз может приводить к воспалительным процессам органов малого таза, а также ассоциируется с увеличением частоты гетеросексуальной и перинатальной передачи ВИЧ-инфекции.
Профилактика ятрогенных инфекций состоит в использовании медицинского инструментария после соответствующей стерилизации, выявлении и лечении инфекций нижнего репродуктивного тракта перед проведением трансцервикальных манипуляций.
- В настоящее время инфекции репродуктивного тракта из-за широкой распространенности и тяжести осложнений рассматриваются как серьезная и глобальная проблема здоровья женщин и мужчин, семьи и общества.
- Инфекции репродуктивного тракта являются причиной многочисленных серьезных осложнений у женщин: воспалительные заболевания органов малого таза, бесплодие, эктопическая беременность, синдром хронической тазовой боли.
- Инфекции репродуктивного тракта во время беременности могут быть причиной внутриутробного инфицирования и осложнений течения беременности.
- Некоторые инфекции могут увеличивать возможность передачи ВИЧ-инфекции.
- Инфекции репродуктивного тракта, в зависимости от пути передачи, подразделяют на три типа: инфекции, передающиеся половым путем, эндогенные инфекции и ятрогенные инфекции.
- По месту локализации инфекции репродуктивного тракта подразделяют на два вида: инфекции верхнего отдела репродуктивного тракта и инфекции нижнего отдела репродуктивного тракта.
Самая лучшая стратегия по ограничению вредного воздействия инфекций репродуктивного тракта — это предотвращение нового инфицирования, т. е. профилактика, которая зависит от пути инфицирования.
Читайте также:


