Ревматоидный артрит treat to target
- 4972
- 4,1
- 0
- 5
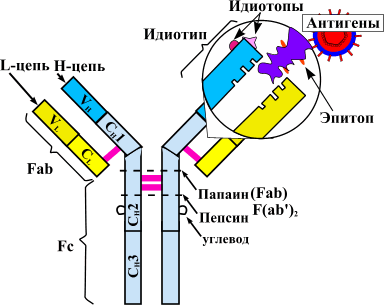
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
![]()
Анна Огородник
![]()
Антон Чугунов![]()
Андрей Панов




Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.
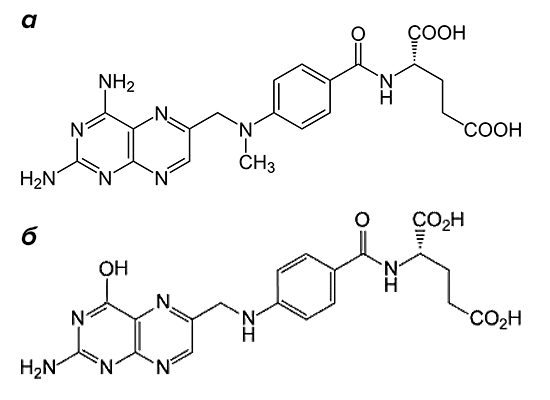
Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).
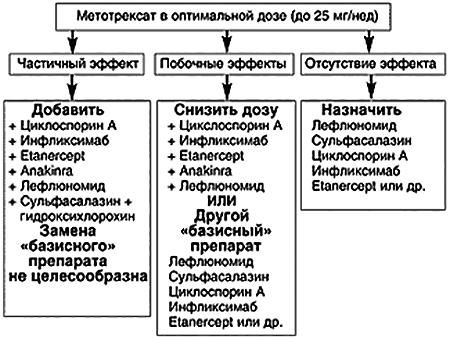
Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
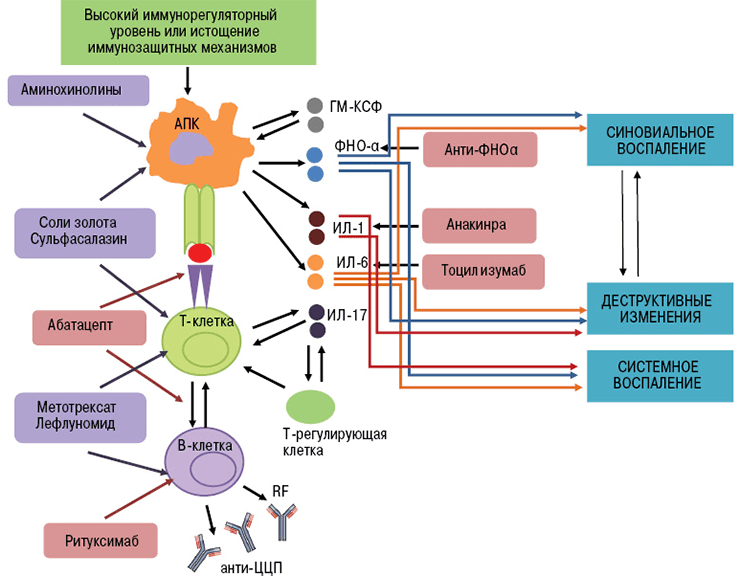
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.
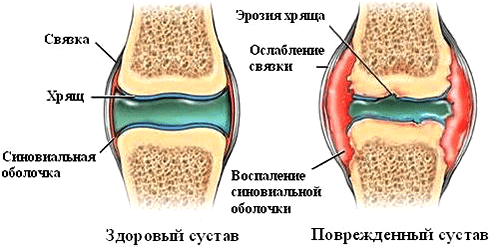
Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.
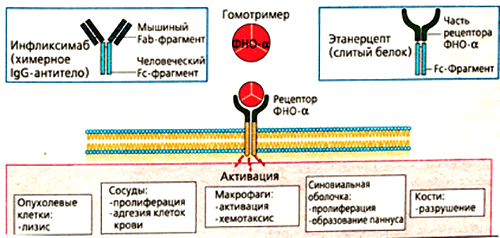
Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].
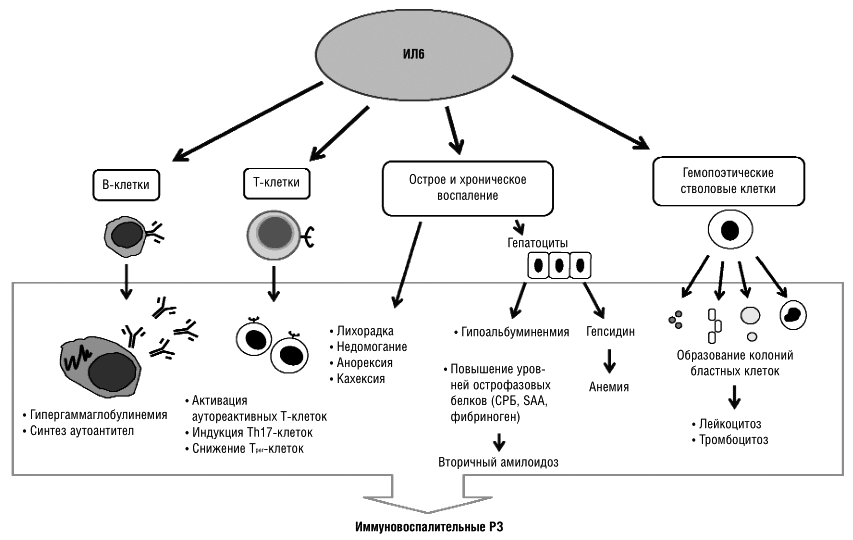
Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.
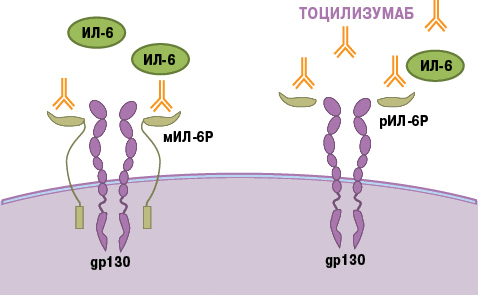
Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].
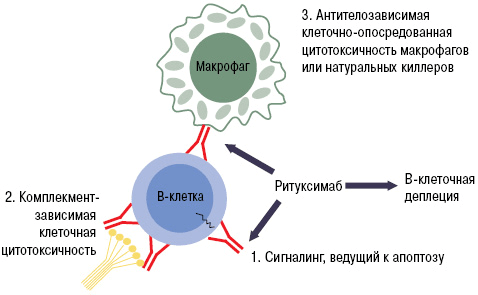
Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).
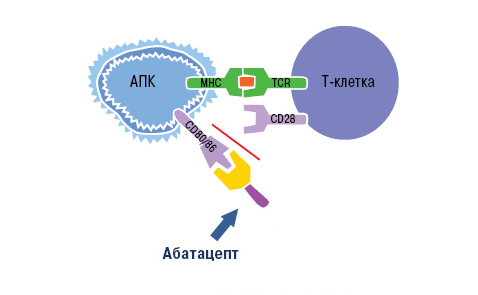
Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
По данным литературы, лефлуномид сопоставим по эффективности и безопасности с метотрексатом, в том числе у пациентов с ранним ревматоидным артритом (РА). Препарат продолжает играть важную роль в лечении больных ранним РА и может рассматриваться в качестве основного синтетического базисного противовоспалительного препарата, который должен назначаться при невозможности терапии эффективными дозами метотрексата. Комбинация метотрексата и лефлуномида, уменьшая потребность в биологической терапии, может быть одним из эффективных способов преодоления толерантности к метотрексату. Роль данной комбинации в стратегии лечения раннего РА может быть недооценена, целесообразно продолжение исследований в этом направлении.
1. Насонов Е.Л., Каратеев Д.Е., Балабанова Р.М. Ревматоидный артрит. В кн.: Ревматология. Национальное руководство. Под ред. Е.Л. Насонова, В.А. Насоновой. М.: ГЭОТАР-Медиа, 2008, 290–331.
2. Ревматология: клинические рекомендации. Под ред. Е.Л. Насонова. М.: ГЭОТАР-Медиа, 2010, 752 с.
3. Каратеев Д.Е. Ретроспективная оценка многолетней базисной терапии у больных ревматоидным артритом. Науч-практич ревматол, 2003, 3: 32–6.
5. Emery P, Salmon M. Early rheumatoid arthritis: time to aim for remission? Ann Rheum Dis, 1995, 54: 944–7.
6. Emery P. Therapeutic approaches for early rheumatoid arthritis. How early? How aggressive? Br J Rheumatol, 1995, 34(2): 87–90.
7. Combe B, Landewe R, Lukas C et al. EULAR recommendations for the management of early arthritis: report of a task force of the European Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis, 2007, 66(1): 34–45.
8. Насонов Е.Л. Фармакотерапия ревматоидного артрита с позиций доказательной медицины: новые рекомендации. РМЖ, 2002, 10(6): 294–302.
9. Насонов Е.Л. Почему необходима ранняя диагностика и лечение ревматоидного артрита? РМЖ, 2002, 10(22): 1009–14.
10. Nell VP, Machold KP, Eberl G et al. Benefit of very early referral and very early therapy with disease-modifying anti-rheumatic drugs in patients with early rheumatoid arthritis. Rheumatology (Oxford), 2004, 43(7): 906–14.
11. Lard LR, Visser H, Speyer I et al. Early versus delayed treatment in patients with recent-onset rheumatoid arthritis: comparison of two cohorts who received different treatment strategies. Am J Med, 2001, 111: 446–51.
12. Goekoop-Ruiterman YP, de Vries-Bouwstra JK, Allaart CF et al. Comparison of treatment strategies in early rheumatoid arthritis: a ran-domized trial. Ann Intern Med, 2007, 146: 406–15.
13. Grigor C, Capell H, Stirling A et al. Effect of a treatment strategy of tight control for rheumatoid arthritis (the TICORA study): a single-blind randomised controlled trial. Lancet, 2004, 364: 263–9.
14. Smolen JS, Aletaha D, Koeller M et al. New therapies for treatment of rheumatoid arthritis. Lancet, 2007, 370: 1861–74.
15. Sokka T, Hetland ML, Mäkinen H et al. Remission and rheumatoid arthritis: Data on patients receiving usual care in twenty-four countries. Arthritis Rheum, 2008, 58: 2642–51.
16. Smolen JS, Aletaha D, Bijlsma JW et al. Treating rheumatoid arthritis to target: recommendations of an international task force. Ann Rheum Dis, 2010, 69: 631–7.
17. Smolen JS, Landewe R, Breedveld FC et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann Rheum Dis, 2010, 69(6): 964–75.
18. Каратеев Д.Е., Лучихина Е.Л. Современная стратегия терапии ревматоидного артрита. РМЖ, 2012, 30: 1504–9.
19. Орлова Е.В., Каратеев Д.Е., Булгакова Н.А. Лечение ревматоидного артрита до достижения цели (Treat to Target): российская версия международных рекомендаций для пациентов. Науч-практич ревматол, 2013, 51(3): 246–54.
20. Олюнин Ю.А. Целенаправленное лечение ревматоидного артрита: рекомендации международной комиссии (Treatment to target expert committee – Экспертная комиссия по целенаправленному лечению). Соврем ревматол, 2010, 3: 7-9.
22. Aletaha D, Neogri T, Silman AJ et al. 2010 Rheumatoid arthritis classification criteria. An American College of Rheumatology/ European League Against Rheumatism collaborative initiative. Arthritis Rheum, 2010, 62(9): 2569–81.
23. Каратеев Д.Е., Олюнин Ю.А., Лучихина Е.Л. Новые классификационные критерии ревматоидного артрита EULAR/ACR 2010 – шаг вперед к ранней диагностике. Науч-практич ревматол, 2011, 1: 10–5.
24. Smolen JS, Landewe R, Breedveld FC et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update. Ann Rheum Dis, 2014, 73: 492–509.
25. Насонов Е.Л., Каратеев Д.Е., Чичасова Н.В. Рекомендации EULAR по лечению ревматоидного артрита – 2013: общая характеристика и дискуссионные проблемы. Науч-практич ревматол 2013, 6(51):609–22.
26. Чичасова Н.В., Иголкина Е.В., Насонов Е.Л., Имаметдинова Г.Р. Лефлуномид в лечении ревматоидного артрита. РМЖ, 2013, 32: 1628–35.
27. Насонов Е.Л., Амирджанова В.Н., Беневоленская Л.И. и соавт. Лечение ревматоидного артрита. Клинические рекомендации. М.: Алмаз, 2006: 118 с.
28. Smolen JS, Kalden JR, Scott DL et al. Efficacy and safety of leflunomide compared with placebo and sulphasalazine in active rheumatoid arthritis: a double-blind, randomised, multicentre trial. Lancet, 1999, 353(9149): 259–66.
29. Sharp JT, Strand V, Leung H et al. Treatment with leflunomide slows radiographic progression of rheumatoid arthritis. Results from three randomized controlled trials of leflunomide in patients with active rheumatoid arthritis. Arthritis Rheum, 2000, 43(3): 495–505.
30. Strand V, Cohen S, Schiff M et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate. Arch Int Med, 1999, 159(21): 2542–50.
31. Dougados M, Combe B, Cantagrel A et al. Combination therapy in early rheumatoid arthritis: a randomised, controlled, double blind 52 week clinical trial of sulphasalazine and methotrexate compared with the single components. Ann Rheum Dis, 1999, 58(4): 220–5.
32. Singh JA, Furst DE, Bharat A et al. 2012 Update of the 2008 American College of Rheumatology Recommendations for the Use of Disease-Modifying Antirheumatic Drugs and Biologic Agents in the Treatment of Rheumatoid Arthritis. Arthritis Care & Research, 2012, 64(5): 625–39.
33. Van der Heijde DM, van Riel PL, Gribnau FW et al. Effects of hydroxychloroquine and sulphasalazine on progression of joint damage
34. in rheumatoid arthritis. Lancet, 1989, 333: 1036–8.
35. Каратеев Д.Е. Лефлуномид в современной терапии ревматоидного артрита. РМЖ, 2010, 27: 1654–6.
36. Cohen S, Cannon GW, Schiff M et al. Two-year, blinded, randomized, controlled trial of treatment of active rheumatoid arthritis with leflunomide compared with methotrexate. Utilization of Leflunomide in the Treatment of Rheumatoid Arthritis Trial Investigator Group. Arthritis Rheum, 2001, 44(9): 1984–92.
37. Cohen S, Weaver A, Shiff M, Strand V. Two-year treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate. Arthritis Rheum, 1999, 42(Suppl.): 271.
38. Emery P, Breeveld FC, Lemmel EM et al. A com-paration ot the efficacy and safety of leflunomide and methotrexate for the treatment of rheumatoid arthritis. Rheumatology (Oxford), 2000, 39: 655–65.
39. Strand V, Tugwell P, Bombardier C et al. Function and health-related quality of life: results from a randomised controlled trial of ltflunomide vs methotrexate or placebo in patients with active rheumatoid arthritis. Arthr Rheum, 1999, 42(9): 1870–78.
40. Smolen JS, Kalden JR, Scott DL et al. Efficacy and safety of leflunomide compared with placebo and sulfasalazine in active rheumatoid arthritis: a double–blind, randomized, multi-centre trial. European Leflunomide Study Group. Lancet, 1999, 353: 259–66.
41. Kalden JR, Scott DL, Smolen JS et al. Improved functional ability in patients with rheumatoid arthritis – long–term treatment with leflunomide versus sulfasalasine. J Rheumatol, 2001, 28(9): 1983–91.
42. Scott DL, Smolen JS, Kalden JR et al. Treatment of active rheumatoid arthritis with leflunomide: two year follow up of a double-blind, placebo-controled trial versus sulfasalazine. Ann Rheum Dis, 2001, 60: 913–23.
43. Osiri M, Shea B, Robinson V et al. Leflunomide for treating rheumatoid arthritis. Cochrane Database Syst Rev, 2003, (1): CD002047.
44. Donahue KE, Gartlehner G, Jonas DE et al. Systematic review: comparative effectiveness and harms of disease-modifying medications for rheumatoid arthritis. Ann Intern Med, 2008, 148(2): 124–34.
45. Чичасова Н.В., Чижова К.А., Иголкина Е.В. и соавт. Новый базисный препарат для лечения ревматоидного артрита – (Арава (лефлуномид): опыт многомесячного применения. РМЖ, 2004, 2: 124–8.
46. Чичасова Н.В., Бродецкая К.А., Иголкина Е.В. и соавт. Опыт длительного применения лефлуномида (препарат Арава) у больных активным ревматоидным артритом. РМЖ, 2005, 13(8): 518–24.
47. Чичасова Н.В., Иголкина Е.В., Имаметдинова Г.Р., Насонов Е.Л. Лефлуномид в лечении раннего ревматоидного артрита. РМЖ, 2011, 10: 606–9.
48. Чичасова Н.В., Насонов Е.Л. Лефлуномид в лечении ревматических заболеваний. М.: МегаПро, 2010, 92 c.
49. Van der Heijde D, Kalden JR, Scott D et al. Longterm evaluation of radiologic disease progression in a subset of patients with rheumatoid arthritis treated with leflunomide beyond 2 years. Ann Rheum Dis, 2004, 63: 737–9.
50. Sharp J, Strand V, Leung H et al. Treatment with leflunomide slows radiographic progression of rheumatoid arthritis. Arthritis Rheum, 2000, 43: 495–505.
51. Kalden JR, Schattenkirchen M, Sorensen H et al. Efficacy and safety of leflunomide in patients with active rheumatoid arthritis: a five-year follow-up. Arthr Rheum, 2003, 48: 1513–20.
52. Балабанова P.M., Каратеев Д.Е., Кашеваров Р.Ю. и др. Лефлуномид (Арава) при раннем ревматоидном артрите. Научно-практическая ревматология, 2005, 5: 31–4.
53. Балабанова Р.М., Кашеваров Р.Ю., Олюнин Ю.А. Антидеструктивное действие лефлуномида при раннем ревматоидном артрите. Тер арх, 2006, 78(6): 6–10.
54. Kashevarov R, Balabanova RM, Oliunin YA et al. Level of matrix metalloproteinase 3 and joint destruction rate in early RA treated with leflunomide and methotrexate. Ann Rheum Dis, 2006, 65(Suppl II): 341.
55. Каратеев Д.Е. Лефлуномид в современной патогенетической терапии раннего ревматоидного артрита. РМЖ, 2007, 26: 2042–46.
56. Karateev DE, Luchikhina EL, Nasonov EL. High frequency of clinical remission in patient with early RA treated with leflunomide. Ann Rheum Dis, 2006, 65(Suppl 2): 341.
57. Федоренко Е.В., Лукина Г.В., Сигидин Я.А. и соавт. Сравнительная эффективность современных методов терапии раннего ревматоидного артрита (предварительные результаты). Науч-практич ревматол, 2008, 4: 36–40.
58. Cutolo M, Bolosiu H, Perdriset G, LEADER Study Group. Efficacy and safety of leflunomide in DMARD-naive patients with early rheumatoid arthritis: comparison of a loading and a fixed-dose regimen. Rheumatology (Oxford), 2013, 52(6): 1132–40.
59. Ren LM, Li R, Chen LN et al. Efficacy and safety of weekly leflunomide for the treatment of early rheumatoid arthritis: a randomized, multi-center study. Int J Rheum Dis, 2016, 19(7): 651–7.
60. Чичасова Н.В., Насонов Е.Л. Комбинированная терапия лефлуномидом и генно-инженерными биологическими препаратами. Соврем ревматол, 2011, 2: 43–9.
61. Орлова Е.В. Место лефлуномида в современной стратегии лечения ревматоидного артрита. Трудный пациент, 2015, 13(3): 20–7.
62. Keen HI, Conaghan PG, Tett SE. Safety evaluation of leflunomide in rheumatoid arthritis. Expert Opin Drug Saf, 2013, 12(4): 581–8.
63. Golicki D, Newada M, Lis J, Pol K, Hermanowski T, Tłustochowicz M. Leflunomide in monotherapy of rheumatoid arthritis: meta-analysis of randomized trials. Pol Arch Med Wewn, 2012, 122(1-2): 22-32.
64. Kellner H, Bornholdt K, Hein G. Leflunomide in the treatment of patients with early rheumatoid arthritis–results of a prospective non-interventional study. Clin Rheumatol, 2010 Aug, 29(8): 913-20. doi: 10.1007/s10067-010-1425-3.
65. Graudal N, Jü rgens G. Similar effects of disease-modifying antirheumatic drugs, glucocorticoids, and biologic agents on radiographic progression in rheumatoid arthritis: meta-analysis of 70 randomized placebo-controlled or drug-controlled studies, including 112 comparisons. Arthritis Rheum, 2010 Oct, 62(10): 2852-63. doi: 10.1002/art.27592.,
66. Katchamart W, Trudeau J, Phumethum V, Bombardier C. Methotrexate monotherapy versus methotrexate combination therapy with non-biologic disease modifying anti-rheumatic drugs for rheumatoid arthritis. Cochrane Database Syst Rev, 2010 Apr 14, 4: CD008495. doi: 10.1002/14651858.CD008495.
67. Gaujoux-Viala C, Nam J, Ramiro S, Landewé R, Buch MH, Smolen JS, Gossec L. Efficacy of conventional synthetic disease-modifying anti-rheumatic drugs, glucocorticoids and tofacitinib: a systematic literature review informing the 2013 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis, 2014 Mar, 73(3): 510-5. doi: 10.1136/annrheumdis-2013-204588.
68. Аlcorn N, Saunders S, Madhok R. Benefit-risk assessment of leflunomide: an appraisal of leflunomide in rheumatoid arthritis 10 years after licensing. Drug Saf, 2009, 32(12): 1123-34. doi: 10.2165/11316650-000000000-00000.
69. Hazlewood GS, Barnabe C, Tomlinson G, Marshall D, Devoe D, Bombardier C. Methotrexate monotherapy and methotrexate combination therapy with traditional and biologic disease modifying antirheumatic drugs for rheumatoid arthritis: abridged Cochrane systematic review and network meta-analysis. BMJ, 2016 Apr 21, 353: i1777. doi: 10.1136/ bmj.i1777.
70. Kremer JM. Methotrexate and leflunomide: biochemical basis for combination therapy in the treatment of rheumatoid arthritis. Semin Arthritis Rheum, 1999 Aug, 29(1): 14-26.
71. Weinblatt ME, Kremer JM, Coblyn JS et al. Pharmacokinetics, safety, and efficacy of combination treatment with methotrexate and leflunomide in patients with active rheumatoid arthritis. Arthritis Rheum, 1999, 42(7): 1322–1328.
72. Kremer JM, Genovese MC, Cannon GW, et al. Concomitant leflunomide therapy in patients with active rheumatoid arthritis despite stable doses of methotrexate. A randomized, double-blind, placebo-controlled trial. Ann Intern Med, 2002, 137(9): 726–733.
73. Kremer J, Genovese M, Cannon GW et al. Combination leflunomide and methotrexate (MTX) therapy for patients with active rheumatoid arthritis failing MTX monotherapy: Open-label extension of a randomized, double-blind, placebo controlled trial. J Rheumatol, 2004, 31(8): 1521–1531.
74. Lee SS, Park YW, Park JJ et al. Combination treatment with leflunomide and methotrexate for patients with active rheumatoid arthritis. Scand J Rheumatol, 2009 Jan-Feb, 38(1): 11-4. doi: 10.1080/03009740802360632.
75. Jones PB, White DH. Reappraisal of the clinical use of leflunomide in rheumatoid arthritis and psoriatic arthritis. Open Access Rheumatol, 2010 Nov 3, 2: 53-71.
76. Weinblatt ME, Dixon JA, Falchuk KR. Serious liver disease in a patient receiving methotrexate and leflunomide. Arthritis Rheum, 2000 Nov, 43(11): 2609-11.
77. Lee SW, Park HJ, Kim BK, Han KH, Lee SK, Kim SU, Park YB. Leflunomide increases the risk of silent liver fibrosis in patients with rheumatoid arthritis receiving methotrexate. Arthritis Res Ther, 2012 Oct 29, 14(5): R232. doi: 10.1186/ar4075.
78. Rodriguez-Rodriguez L, Jover-Jover JA, Fontsere O, Peña-Blanco RC, León L, Fernández-Gutierrez B, Abásolo L. Leflunomide discontinuation in rheumatoid arthritis and influence of associated disease-modifying anti-rheumatic drugs: a survival analysis. Scand J Rheumatol, 2013, 42(6): 433-6. doi: 10.3109/03009742.2013.785590.
79. Bird P, Griffiths H, Tymms K et al. The SMILE study – safety of methotrexate in combination with leflunomide in rheumatoid arthritis. J Rheumatol, 2013 Mar, 40(3): 228-35. doi: 10.3899/jrheum.120922.
80. Kaul A, O’Reilly DT, Slack RK, Collins D, Walmsley J, Duke O, Kiely PD. Tolerability of methotrexate and leflunomide combination therapy for inflammatory arthritis in routine clinical practice: results of a four-centre study. Rheumatology (Oxford), 2008 Sep, 47(9): 1430-1. doi: 10.1093/rheumatology/ken240.
81. Alves JA, Fialho SC, Morato EF, Castro GR, Zimmermann AF, Ribeiro GG, Neves FS, Pereira IA. Liver toxicity is rare in rheumatoid arthritis patients using combination therapy with leflunomide and methotrexate. Rev Bras Reumatol, 2011 Mar-Apr, 51(2): 141-4.
82. Hodkinson B, Magomero KR, Tikly M. Combination leflunomide and methotrexate in refractory rheumatoid arthritis: a biologic sparing approach. Ther Adv Musculoskelet Dis, 2016 Oct, 8(5): 172-179.
83. Sakellariou GT, Sayegh FE, Kapetanos GA, Berberidis C. Efficacy of leflunomide addition in relation to prognostic factors for patients with active early rheumatoid arthritis failing to methotrexate in daily practice. Clin Rheumatol, 2012 Jan, 31(1): 163-7. doi: 10.1007/s10067-011-1842-y.
84. Verschueren P, De Cock D, Corluy L et al. Effectiveness of methotrexate with step-down glucocorticoid remission induction (COBRA Slim) versus other intensive treatment strategies for early rheumatoid arthritis in a treat-to-target approach: 1-year results of CareRA, a randomised pragmatic open-label superiority trial. Ann Rheum Dis, 2016 Jul 18. pii: annrheumdis-2016-209212. doi: 10.1136 /annrheumdis-2016-209212. [Epub ahead of print].
85. Dougados M, Emery P, Lemmel E-M, et al. Efficacy and safety of leflunomide and predisposing factors for treatment response in patients with active rheumatoid arthritis: RELIEF 6-month data. J Rheumatol, 2003, 30(12): 2572–2579.
86. Dougados M, Emery P, Lemmel EM, Zerbini CAF, Brin S, van Riel P. When a DMARD fails, should patients switch to sulfasalazine or add sulfasalazine to continuing leflunomide? Ann Rheum Dis, 2005, 64(1): 44–51.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:





