Роспотребнадзор реестр возбудителей инфекционных заболеваний
Наличие лицензии для лабораторных исследований микроорганизмов переносчиков инфекционных заболеваний (ПБА) III-IV групп патогенности, требуется в том случае, если лаборатория проводит:
- диагностические исследования, хранение микроорганизмов, их производственных, музейных штаммов и материала зараженного или с подозрением на зараженность III—IV групп патогенности
- диагностические исследования, хранение простейших, их производственных, музейных штаммов и материала зараженного или с подозрением на зараженность III—IV групп патогенности;
- диагностические исследования (за исключением отбора проб продукции животного происхождения для лабораторных исследований и обязательной трихинеллоскопии, проводимых в рамках ветеринарно-санитарной экспертизы организациями, подведомственными уполномоченным в области ветеринарии органам исполнительной власти субъектов Российской Федерации), хранение гельминтов, их производственных, музейных штаммов и материала зараженного или с подозрением на зараженность III—IV групп патогенности;
- диагностические исследования, хранение санитарно-показательных микроорганизмов III—IV групп патогенности.
Лицензия на III-IV группу патогенности подтверждает возможность лаборатории изучать:
- микроорганизмы, представляющие достаточно высокую индивидуальную опасность, но низкую общественную. Они способны вызывать достаточно серьезные заболевания, но не передаются от одного организма к другому (III группа);
- возбудители, представляющие умеренную индивидуальную и ограниченную общественную опасность (IV группа).
Выполнение такой работы требует соблюдения целого ряда стандартов, наличия высококвалифицированных специалистов и современного оборудования. Только в этом случае может быть проведено лицензирование микробиологической лаборатории. Эта процедура достаточно сложная и требует тщательной подготовки. В первую очередь следует собрать пакет документов для предоставления в уполномоченную инстанцию.
Он включает:
Скачать санитарно-эпидемиологические правила СП 1.3.2322-08 "БЕЗОПАСНОСТЬ РАБОТЫ С МИКРООРГАНИЗМАМИ III - IV ГРУПП ПАТОГЕННОСТИ (ОПАСНОСТИ) И ВОЗБУДИТЕЛЯМИ ПАРАЗИТАРНЫХ БОЛЕЗНЕЙ".
Для вашего удобства приводим перечень основных нормативных документов по данному вопросу:
Проходит лицензирование микробиологической лаборатории для работы с вирусами III-IV группы патогенности в несколько этапов. При рассмотрении документов может возникнуть необходимость в проведении дополнительных проверок.
Проверки необходимы:
- при работе с уникальными культурами, применении нестандартных методик, оборудования и приборов;
- если необходимость получения разрешения на осуществление данного вида деятельности обоснована недостаточно;
- при поступлении соответствующих запросов от государственных или общественных организаций.
Помощь в оформлении

Если предстоит лицензирование микробиологической лаборатории, то лучше всего доверить эту процедуру квалифицированным специалистам, имеющим опыт и хорошо знающим все нюансы данной сферы. При самостоятельной подготовке документов неизбежны ошибки и неточности. Результатом может стать отказ в выдаче разрешения. А это - потеря времени и денег. Поэтому лучший вариант - обратиться к профессионалам.
Наша компания готова предоставить Вам весь комплекс услуг в этой области. Благодаря помощи компетентных специалистов, лицензирование микробиологической лаборатории для работы с вирусами III-IV группы патогенности пройдет без осложнений. Вы можете воспользоваться следующими услугами:
- получение консультаций по всем интересующим вопросам, включая информацию по сбору и оформлению необходимой документации;
- проведение юридической экспертизы. Она даст возможность определить, насколько подготовленные бумаги соответствуют существующим требованиям;
- помощь в исправлении выявленных несоответствий;
- подготовка пакета документации и его подача в уполномоченный орган;
- получения подтверждения принятия заявления и других документов;
- взаимодействие наших специалистов с сотрудниками Роспотребнадзора и контроль хода лицензирования;
- получение разрешения, подтверждающего право работы с возбудителями инфекционных заболеваний.
Важные замечания
Чтобы получить разрешение на диагностические исследования микроорганизмов возбудителей инфекционных заболеваний III - IV групп патогенности требуется иметь СЭЗ. Сроки действительности которых определяет Постановление Главного государственного врача РФ от 30 апреля 2003 г. № 85 "О введении в действие санитарно-эпидемиологических правил СП 1.2.1318-03" п.п. 4.8.:
| "Заключение о возможности проведения работ с ПБА I - IV групп выдают на срок до 5 лет , а на возможность работы с аэрозолями ПБА I - IV групп - до 2 лет ." |
См. также: "Санитарно-эпидемиологические правила СП 1.2.1318-03
"Порядок выдачи санитарно-эпидемиологического заключения о возможности проведения работ с возбудителями инфекционных заболеваний человека I - IV групп патогенности (опасности), генно-инженерно-модифицированными микроорганизмами, ядами биологического происхождения и гельминтами"
(утв. Главным государственным санитарным врачом РФ 24 апреля 2003 г.)
Новые требования на переоформление разрешения
Всем лабораториям, у которых имеется разрешение на диагностические исследования микроорганизмов возбудителей инфекционных заболеваний III - IV групп патогенности необходимо их переоформить по новым требованиям! Для этого в лицензирующий орган необходимо предъявить:
- Пояснительную записку, в которой указаны технология проведения работ, выполняемые операции, объемы биомассы (для экспериментальных и производственных работ), наличие и размещение аппаратуры в помещениях, наличие инженерно- технологических систем обеспечения техники безопасности, средств ликвидации аварий;
- Графический материал (копии поэтажного плана со схемой планировок подразделений, указанием площади каждого помещения, его назначения, размещения оборудования, схем движения ПБА и персонала);
- Приказ о допуске персонала к работам с ПБА;
- Приказ о допуске сотрудников к работе с автоклавами;
- Приказ о создании комиссии по контролю соблюдения требований биологической безопасности;
- Приказ о назначении ответственного лица за хранение коллекционных ПБА
- Приказ о допуске инженерно-технического персонала
- План ликвидации аварии;
- Журнал по проведению инструктажа по соблюдению требований биологической безопасности сотрудников лаборатории;
- Журналы по контролю работы паровых и воздушных стерилизаторов;
- Журнал учета работы бактерицидных ламп.
- Журнал посещения инженерно-технического персонала
- Договор на обслуживание аппаратуры, используемой в производственной лаборатории;
- Технические паспорта и инструкции на лабораторное оборудование (документация производителя оборудования), свидетельства о государственной поверке оборудования;
- Заключение о результатах прохождения профилактического медицинского осмотра сотрудниками лаборатории с данными о проведенных прививках;
- Программу производственного контроля, утвержденную руководителем
- Обучение персонала (диплом, свидетельства, удостоверения)
- Документы, по учету, движению и хранению ПБА
Тем же лабораториям, которые проходят лицензирование на деятельность в области исследования микроорганизмов возбудителей инфекционных заболеваний человека и животных 3-4 групп патогенности впервые, кроме выше перечисленных документов, в соответствии с последними дополнениями требуется предоставить Проект и экспертные заключения на него от СЭС и МЧС! По всем этим моментам Вы можете рассчитывать на нашу помощь!
Ну и в заключении приводим выдержку из Санитарно-эпидемиологических правил СП 1.3.2322-08 "Безопасность работы с микроорганизмами III-IV групп патогенности (опасности) и возбудителями паразитарных болезней":
Соблюдение требований санитарных правил является обязательным для юридических лиц независимо от организационно-правовых форм и форм собственности и индивидуальных предпринимателей, проводящих работу с патогенными биологическими агентами (ПБА):
III группы:
- диагностические с целью обнаружения и выделения возбудителя, экспериментальные и производственные работы;
- ПЦР-диагностику;
- диагностические исследования на холеру и ботулинический токсин, выполняемые с целью профилактики этих инфекций;
- иммунологические исследования с ПБА III группы;
- иммунологические исследования по обнаружению в крови людей антигенов микроорганизмов II группы патогенности (без накопления возбудителя) и/или антител к ним;
- экспериментальные и производственные работы с вакцинными штаммами возбудителей I-II групп патогенности, официально отнесенными к III группе;
- исследования по контролю объектов окружающей среды и качества продукции.
- IV группы:
- диагностические с целью обнаружения и выделения возбудителя, экспериментальные и производственные работы;
- иммунологические исследования с ПБА III группы (без накопления возбудителя);
- исследования по контролю объектов окружающей среды и качества продукции на наличие санитарно-показательных микроорганизмов;
- ПЦР-исследования.
Любая лаборатория, которая проводит работы с микроорганизмами III-IV групп патогенности (опасности) должна получить лицензию на деятельность, связанную с использованием возбудителей инфекционных заболеваний III-IV группы патогенности (это медицинские, ветеринарные и пищевые лаборатории (например, производственные лаборатории молочных предприятий, осуществляющие работы с санитарно-показательными микроорганизмами).
Если в этом списке Вы нашли работы, которые проводит ваша лаборатория, то обращайтесь! Мы занимаемся лицензированием всех лабораторий!
[youtube.player]ФЕДЕРАЛЬНАЯ СЛУЖБА ПО НАДЗОРУ В СФЕРЕ ЗАЩИТЫ
ПРАВ ПОТРЕБИТЕЛЕЙ И БЛАГОПОЛУЧИЯ ЧЕЛОВЕКА
от 5 мая 2014 г. N 384
УПРАВЛЕНИЯМИ РОСПОТРЕБНАДЗОРА ПО СУБЪЕКТАМ РОССИЙСКОЙ
ФЕДЕРАЦИИ, ПО ЖЕЛЕЗНОДОРОЖНОМУ ТРАНСПОРТУ ДЕЯТЕЛЬНОСТИ
В ОБЛАСТИ ИСПОЛЬЗОВАНИЯ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИОННЫХ
ЗАБОЛЕВАНИЙ ЧЕЛОВЕКА И ЖИВОТНЫХ (ЗА ИСКЛЮЧЕНИЕМ СЛУЧАЯ,
ЕСЛИ УКАЗАННАЯ ДЕЯТЕЛЬНОСТЬ ОСУЩЕСТВЛЯЕТСЯ В МЕДИЦИНСКИХ
ЦЕЛЯХ) И ГЕННО-ИНЖЕНЕРНО-МОДИФИЦИРОВАННЫХ ОРГАНИЗМОВ
III И IV СТЕПЕНЕЙ ПОТЕНЦИАЛЬНОЙ ОПАСНОСТИ,
ОСУЩЕСТВЛЯЕМОЙ В ЗАМКНУТЫХ СИСТЕМАХ
В соответствии с постановлением Правительства Российской Федерации от 30.06.2004 N 322 "Об утверждении Положения о Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека" (Собрание законодательства Российской Федерации, 2004, N 28, ст. 2899; 2006, N 22, ст. 2337, N 52, ст. 5587; 2008, N 40, ст. 4548, N 46, ст. 5337; 2009, N 30, ст. 3823; N 33, ст. 4081; 2011, N 14, ст. 1935; N 43, ст. 6079; 2012, N 27, ст. 3729; 2013, N 5, ст. 405; N 22, ст. 2812), в целях реализации постановления Правительства Российской Федерации от 16.04.2012 N 317 "О лицензировании деятельности в области использования возбудителей инфекционных заболеваний человека и животных (за исключением случая, если указанная деятельность осуществляется в медицинских целях) и генно-инженерно-модифицированных организмов III и IV степеней потенциальной опасности, осуществляемой в замкнутых системах" (Собрание законодательства Российской Федерации, 2012, N 17, ст. 1991) приказываю:
1. Возложить на управления Роспотребнадзора по субъектам Российской Федерации, по железнодорожному транспорту:
1.1. Организацию и осуществление лицензирования деятельности в области использования возбудителей инфекционных заболеваний человека и животных (за исключением случая, если указанная деятельность осуществляется в медицинских целях) и генно-инженерно-модифицированных организмов III и IV степеней потенциальной опасности, осуществляемой в замкнутых системах, при осуществлении соискателем лицензии следующих выполняемых работ и оказываемых услуг, составляющих деятельность в области использования возбудителей инфекционных заболеваний человека и животных (за исключением случая, если указанная деятельность осуществляется в медицинских целях) и генно-инженерно-модифицированных организмов III и IV степеней потенциальной опасности, осуществляемой в замкнутых системах:
- диагностические исследования, хранение микроорганизмов, их производственных, музейных штаммов и материала зараженного или с подозрением на зараженность III - IV групп патогенности;
- диагностические исследования, хранение простейших, их производственных, музейных штаммов и материала зараженного или с подозрением на зараженность III - IV групп патогенности;
- диагностические исследования (за исключением отбора проб продукции животного происхождения для лабораторных исследований и обязательной трихинеллоскопии, проводимых в рамках ветеринарно-санитарной экспертизы организациями, подведомственными уполномоченным в области ветеринарии органам исполнительной власти субъектов Российской Федерации), хранение гельминтов, их производственных, музейных штаммов и материала зараженного или с подозрением на зараженность III - IV групп патогенности;
- диагностические исследования, хранение санитарно-показательных микроорганизмов III - IV групп патогенности.
1.2. Ведение реестра лицензий на деятельность в области использования возбудителей инфекционных заболеваний человека и животных (за исключением случая, если указанная деятельность осуществляется в медицинских целях) и генно-инженерно-модифицированных организмов III и IV степеней потенциальной опасности, осуществляемой в замкнутых системах, выданных управлением Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека по субъекту Российской Федерации, по железнодорожному транспорту.
1.3. Контроль за соблюдением лицензиатами, осуществляющими деятельность в области использования возбудителей инфекционных заболеваний человека и животных (за исключением случая, если указанная деятельность осуществляется в медицинских целях) и генно-инженерно-модифицированных организмов III и IV степеней потенциальной опасности, осуществляемой в замкнутых системах, лицензионных требований, установленных Положением о лицензировании деятельности в области использования возбудителей инфекционных заболеваний человека и животных (за исключением случая, если указанная деятельность осуществляется в медицинских целях) и генно-инженерно-модифицированных организмов III и IV степеней потенциальной опасности, осуществляемой в замкнутых системах, утвержденным постановлениями Правительства Российской Федерации от 16.04.2012 N 317 "О лицензировании деятельности в области использования возбудителей инфекционных заболеваний человека и животных (за исключением случая, если указанная деятельность осуществляется в медицинских целях) и генно-инженерно-модифицированных организмов III и IV степеней потенциальной опасности, осуществляемой в замкнутых системах".
1.4. Проведение лицензионного контроля за соблюдением лицензиатами, получившими лицензию в Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека, осуществляющими деятельность в области использования возбудителей инфекционных заболеваний человека и животных (за исключением случая, если указанная деятельность осуществляется в медицинских целях) и генно-инженерно-модифицированных организмов III и IV степеней потенциальной опасности, осуществляемой в замкнутых системах, на территории соответствующего субъекта Российской Федерации, железнодорожном транспорте, лицензионных требований, установленных Положением о лицензировании деятельности в области использования возбудителей инфекционных заболеваний человека и животных (за исключением случая, если указанная деятельность осуществляется в медицинских целях) и генно-инженерно-модифицированных организмов III и IV степеней потенциальной опасности, осуществляемой в замкнутых системах, утвержденным постановлением Правительства Российской Федерации от 16.04.2012 N 317 "О лицензировании деятельности в области использования возбудителей инфекционных заболеваний человека и животных (за исключением случая, если указанная деятельность осуществляется в медицинских целях) и генно-инженерно-модифицированных организмов III и IV степеней потенциальной опасности, осуществляемой в замкнутых системах". Отчеты о результатах лицензионного контроля направляются в Роспотребнадзор ежеквартально.
2. Установить, что:
2.1. Оформление лицензий осуществляется на бланке установленной формы, являющемся защищенной полиграфической продукцией.
2.2. Реестр выданных лицензий ведется в форме электронной базы данных, защищенной от повреждения и несанкционированного доступа. Ведение Реестра осуществляется с помощью специализированного программного обеспечения, обеспечивающего хранение и обмен информацией.
2.3. Предоставление в Реестр информации о выданных лицензиях (формирование отчетов о выданных лицензиях, подготовка и передача информации в Реестр) осуществляется в срок не позднее трех дней со дня подписания лицензии.
3. Возложить на федеральное бюджетное учреждение здравоохранения "Информационно-методический центр" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека:
3.1 Обязанности по организации изготовления и распространения бланков лицензии и приложения к лицензии, используемых управлениями Роспотребнадзора по субъектам Российской Федерации, железнодорожному транспорту;
3.2. Ведение реестра выданных лицензий на основании информации, представляемой управлениями Роспотребнадзора по субъектам Российской Федерации, железнодорожному транспорту.
4. Признать утратившим силу приказ Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека от 03.03.2005 N 243 "О лицензировании территориальными управлениями Роспотребнадзора деятельности, связанной с использованием возбудителей инфекционных заболеваний" .
Признан не нуждающимся в государственной регистрации (письмо Минюста России от 07.04.2005 N 07/2593-ВЯ).
5. Контроль за выполнением настоящего приказа оставляю за собой.
[youtube.player]На сегодняшний день законодательством установлены санитарные нормы и обязательства, которые должно соблюдать население РФ.
Роспотребнадзор (РПН) — госорган, осуществляющий проверку и контроль за выполнением утвержденных санитарно-эпидемиологических норм, связанные с жизнью и здоровьем человека, а также с обстановкой в окружающей среде. Кроме этого, в обязанности РПН входит защита прав потребителей.
Для чего нужно?
Санитарно-эпидемиологическое заключение (СЭЗ) необходимо для подтверждения:
- установленных санитарных и гигиенических правил;
- норм продукции;
- видам деятельности;
- технических норм;
- эксплуатационной документации и т.д.
Иными словами — это документ, который подтверждает безопасность товаров и услуг, что они не противоречат стандартам, установленных законодательством.
Реестр, в зависимости от оказания определенных услуг, типов товаров и продукции, бывает следующих видов:
- Свидетельства о гос. регистрации.
- Свидетельства, разрешающие использование возбудителей заболеваний и источников излучения (генерирующих).
- Дезинфекционных средств.
- Продукции, которая прошла государственную регистрацию.
- СЭЗ о соответствии или несоответствии определенных видов деятельности требованиям установленных правил и нормативов.
- Заключения на продукцию, которая прошла санитарную экспертизу.
- Раздел, содержащий заключения и свидетельства о гос.регистрации продукции, которая изготовлена из наноматериалов и нанотехнологий.
- Заключения о пестицидах и агрохимикатах.
- Заключения на проектную документацию.
СЭЗ на вид деятельности — документ, подтверждающий, что на данном объекте (или в помещении) разрешено осуществлять заявленную деятельность, и оно имеет соответствие всем санитарным требованиям.
Перечень деятельностей, для осуществления которых необходимо получение СЭЗ (Приказ № 224):
- Изготовление новых видов продукции, пищевых добавок или сырья.
- Деятельность в сфере образования.
- Выпуск и продажа спиртосодержащей продукции.
- Использование возбудителей инфекций.
- Изготовление лекарств.
- Фармацевтика.
- Медицина.
- Сбор, перевозка и обезвреживание опасных отходов.
- Изготовление, использование, хранение, обслуживание и утилизация источников излучения ионов.
- Эксплуатация водных объектов для питьевого и хозяйственного водоснабжения, а также для отдыха и лечебных целей.
Документ подтверждает, что проектная документация соответствует принятым санитарным нормам. Только при наличии такого документа можно начинать осуществлять внедрение проекта.
Также заключение потребуется для проектов:
- При изменении границы защитных зон.
- Связанных с транспортировкой и размещением отходов.
- ПДВ, за счет которых происходит декларирование планируемых выбросов вредных веществ в окружающую среду.
- НДС, содержащие сбросы различных вредных веществ в водные среды.
- ЗСО, предполагающие установку водозаборных узлов.
Порядок ведения единого реестра экспертных санэпидзаключений
Ведение осуществляется согласно регламенту Роспотребнадзора, утвержденному приказом № 775 от 18 июля 2012 года. Реестр ведется в СУБД (электронная система управления базами данных). Информация для реестра собирается в каждом субъекте Российской Федерации.
СУБД невозможно взломать или получить к ним несанкционированный доступ, его ведение происходит за счет специального ПО обеспечивающее хранение информации и ее обмен.
- Для поступления данных в реестр инициатору необходимо лично обратиться в РПН или территориальный отдел по месту регистрации или жительства юр. лица или ИП.
- Также ИП могут подавать заявления в МФЦ или с помощью почтовых услуг, обязательно с объявленной ценностью.
Однако лучше подавать документы лично, чтобы работник организации проверил ошибки, которые могли возникнуть при заполнении, комплектность поданной документации, а также проконсультировал по интересующим вопросам.
Далее документы передаются экспертам в отдел данных госреестра, которые выдают оценку и только после этого руководитель РПН принимает решение о выдаче или отказе СЭЗ. На основании п. 71 Приказа Роспотребнадзора № 775, внесение информации в реестр субъекта Российской Федерации происходит в течение 3-ех трех дней после подписания документа.
Какие данные содержатся в федеральном реестре СЭЗ?
Реестр содержит достаточно большой объем данных, которые практически всегда полезны для потребителей. Самые востребованные разделы:
- Проверка магазинного чека.
- Проверка маркировки товара.
- Служба поддержки, отвечающая на вопросы граждан.
- Перечень продукции, не соответствующей санитарным нормам.
Также в реестре содержится информация, которая заполняется после выполненных задач Роспотребнадзора, в этом перечне содержатся следующие данные:
- Продажи конкретных видов товаров.
- Контроль соблюдения санитарных норм в соответствии с законодательством.
- Надзор по соблюдению правил торговли.
- Контроль наличия обязательной информации на упаковках продаваемой продукции (состав, производитель, маркировка, энергетическая ценность продукта и т.д.).
- Контроль соответствия информации, указанной на продукте с техническими документами.
- Надзор за качеством питьевой воды.
- Химические и биологические вещества, несущие опасность для граждан.
- Выявление причин, из-за которых возникла эпидемия либо массовые отравления.
- Передача данных в гос.органы.
- Разработка нормативов и правил.
- Проведение анализов и экспертиз.
- Оказание услуг по уничтожению различных вредителей и многое другое.
Кроме этого, в реестре содержатся сведения о заключениях на продукцию, их можно найти по любому из следующих критериев:
- Наименование продукта.
- Изготовитель.
- Номер СЭЗ и т.д.
Ответственность за нарушение требований
Законодательством предусмотрен особый порядок привлечения к административной ответственности лиц или организаций, совершившие проступок в санитарно-эпидемиологической области, который отрицательно повлиял на благополучие населения.
Правила, применяющиеся к административной ответственности, отличаются от других оперативным реагированием и быстрым выявлением нарушения, и имеют особый порядок к привлечению ответственности, который установлен приказом Минздравсоцразвития России от 19 октября 2007 г. № 658.
За нарушение санитарно-эпидемиологический требований и правил, в качестве административного наказания применятся простое предупреждение или выписывается штраф, сумма которого не превышает:
- 5 000 рублей для граждан;
- 50 000 — для должностных лиц;
- 1 000 000 руб. — для юр. лиц.
Статья 236 УК РФ устанавливает уголовную ответственность при нарушении санитарных норм и правил, которые повлекли за собой отравления людей, массовые заболевания или смерть.
Реестр санитарно-эпидемиологических заключений Роспотребнадзора доступен абсолютно для любого гражданина, а это значит, что к нему можно обращаться за помощью или решением практически любого вопроса, касающегося товаров, услуг, документации и многого другого.
Реестр осуществляет не только защиту и контроль прав граждан, но содержит в себе информацию по каждому типу документа, благодаря чему является полезным и востребованным.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
[youtube.player]Что должен сделать медицинский работник, который выявил у пациента инфекционную болезнь?
Как регистрируются инфекционные заболевания в Москве?
ФЕДЕРАЛЬНЫЕ ТРЕБОВАНИЯ К МЕДИЦИНСКИХ РАБОТНИКАМ ИНФОРМИРОВАТЬ ОБ ИНФЕКЦИОННЫХ (ПАРАЗИТАРНЫХ) БОЛЕЗНЯХ
Медицинские работники в случае выявления у пациента инфекционной (паразитарной) болезни, носительства возбудителей инфекционной (паразитарной) болезни или подозрения на инфекционную (паразитарную) болезнь, а также в случае смерти от инфекционной (паразитарной) болезни, обязаны:
- в течение 2 часов сообщить о нем по телефону;
- затем в течение 12 часов представить экстренное извещение в учреждение, осуществляющее федеральный государственный санитарно-эпидемиологический надзор[1].
Таким образом, в случае постановки инфекционного диагноза или подозрения на заболевание медицинский работник обязан сделать запись о выявленном случае в Журнале учета инфекционных заболеваний (форма № 060/у), которая также утверждена Приказом № 1030, и информировать об этом учреждение, осуществляющее государственный санитарно-эпидемиологический надзор.
В дальнейшем полученная информация систематизируется, группируется по временному, территориальному, социально-возрастному признаку, проводится анализ данных, в том числе с применением статистического инструментария.
Обратите внимание!
Выявленные закономерности в характере течения эпидемического процесса учитываются в принятии управленческих решений, направленных на снижение рисков возникновения и распространения новых случаев инфекционных заболевания среди населения.
При больших объемах поступающей информации о случаях инфекционных и паразитарных заболеваний среди населения (например, среди жителей крупного мегаполиса) специалисты неизбежно сталкиваются с трудностями своевременной и корректной обработки полученных данных, сопряженных с ограничением времени и большими трудозатратами. Расскажем о том, как проводится такая работа в Москве.
ИНСТРУКЦИЯ О ПОРЯДКЕ РЕГИСТРАЦИИ СЛУЧАЕВ ИНФЕКЦИОННЫХ И ПАРАЗИТАРНЫХ ЗАБОЛЕВАНИЙ В МОСКВЕ
Москва — крупнейший город Европы, численность постоянного населения приближается к 13 млн чел.
В связи с этим в Москве регистрируется высокая заболеваемость инфекционными болезнями.
Порядок регистрации в Москве случаев инфекционных заболеваний определен Приказом Управления Роспотребнадзора по городу Москве от 16.03.2018 № 29.
Приказом утверждена Инструкция о порядке регистрации случаев инфекционных и паразитарных заболеваний в Москве ( далее — Инструкция).
Инструкция предназначена и обязательна к исполнению:
• для всех медицинских организаций;
• медицинских работников учреждений иного профиля, в том числе учреждений начального общего, основного общего, среднего (полного) общего образования, учреждений начального профессионального, среднего профессионального, высшего профессионального и послевузовского профессионального образования, специальных (коррекционных) для обучающихся, воспитанников с отклонениями в развитии, учреждений для детей-сирот и детей, оставшихся без попечения родителей, учреждений социальной защиты, других учреждений независимо от форм собственности и ведомственной принадлежности.
Рассмотрим общие положения Инструкции.
1. Ответственным за полноту, достоверность и своевременность регистрации инфекционных заболеваний, а также оперативное сообщение о них в установленном порядке является руководитель организации, выявившей больного. Если организация крупная и имеет несколько подразделений (филиалов) — руководитель подразделения (филиала).
2. В каждой медицинской организации (филиале) приказом руководителя назначается лицо, ответственное за передачу оперативной информации о выявленных больных инфекционными заболеваниями, передачу экстренных извещений об инфекционном заболевании и ведение Журнала учета инфекционных и паразитарных заболеваний (ф. № 060/у).
Обратите внимание!
Приказом должен быть также определен сотрудник, заменяющий ответственное лицо на время его отсутствия. Приказ обновляется ежегодно, а также при смене ответственного лица.
3. В образовательных и других организациях ответственность за передачу оперативной информации о выявленных больных инфекционными заболеваниями, передачу экстренных извещений и ведение Журнала учета инфекционных и паразитарных заболеваний возлагается на медицинского работника, обслуживающего данное учреждение.
4. Журнал учета инфекционных заболеваний — основная учетная форма в организации, предназначенная для персонифицированной регистрации больных инфекционными заболеваниями и последующего контроля полноты и сроков передачи информации.
Обратите внимание!
Вести Журнал учета инфекционных заболеваний можно и в электронном виде.
Нумерация записей ведется с начала года раздельно по каждой нозологической форме. На каждое инфекционное заболевание (или носительство одного типа возбудителя) отводятся отдельные листы журнала. На массовые заболевания могут быть заведены отдельные Журналы.
Обратите внимание!
В медицинских учреждениях в Журнал должны быть внесены сведения не только о случаях заболевания, выявленных в самом учреждении, но и случаях заболевания у прикрепленного населения, выявленных в других учреждениях, в том числе в стационарах.
Все данные о больном, включая эпидемиологический анамнез и сведения о контактных, заносят в основную медицинскую документацию медицинской организации или иную медицинскую документацию, соответствующую специфике учреждения.
5. В Инструкции определен Порядок регистрации и оперативного оповещения о заболеваниях, подлежащих индивидуальной регистрации.
• инфекционного и паразитарного заболевания;
• подозрения на эти заболевания;
• носительства возбудителей инфекционных и паразитарных заболеваний, поствакцинальных осложнений;
• укусов, ослюнений и оцарапываний животными;
• укусов (присасываний) клеща;
• инфекций, связанных с оказанием медицинской помощи (далее — инфекционные заболевания).
Регистрации подлежит не только случай заболевания, но и подозрение на случай инфекционного заболевания. Инструкция регламентирует в ряде случаев передачу положительных результатов лабораторных исследований, но об этом далее.
Обратите внимание!
Информация передается вне зависимости от места проживания (регистрации, прописки) больного, т. е. регистрации подлежат в том числе случаи у иногородних, иностранцев, мигрантов, лиц без определенного места жительства и др.
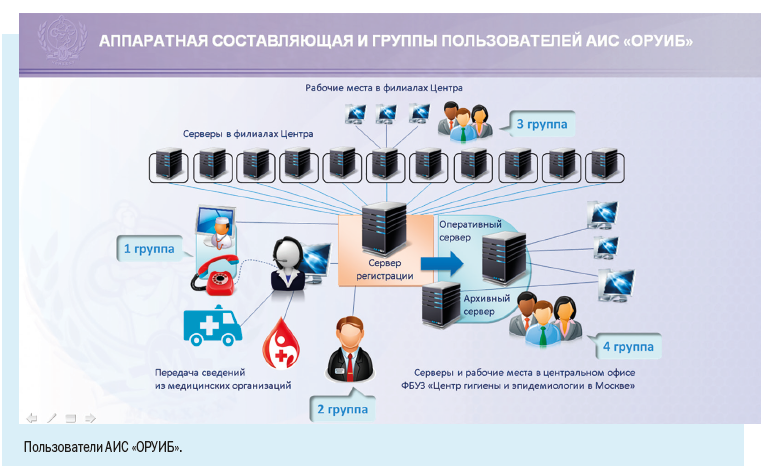
Мы уже говорили о том, что в Москве регистрируется высокая заболеваемость инфекционными болезнями — ежегодно около 3 млн случаев, а число случаев персонифицированного учета — порядка 1500 в день.
При наличии столь многочисленного и постоянно растущего населения и как следствие — высокой заболеваемости основным направлением совершенствования обеспечения эпидемиологического надзора в мегаполисе является широкое внедрение информационных технологий в повседневную работу врача-эпидемиолога.
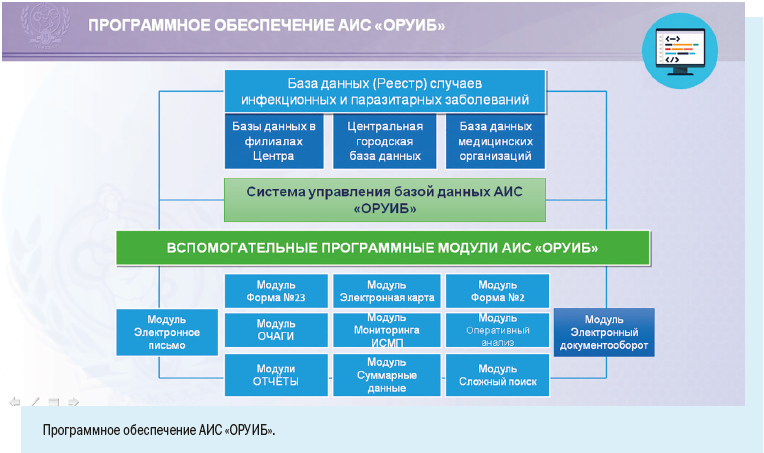
Установка рабочих мест информационной системы позволила ввести ряд полезных функций для самой медицинской организации: регистрировать случаи заболевания можно в круглосуточном режиме, что позволяет соблюдать регламентные жесткие сроки передачи информации, создавать собственный реестр больных, вести статическую обработку сведений и их анализ.
Суммарному (количественному) учету подлежат только острые респираторные вирусные инфекции, кроме госпитализированных случаев и случаев с летальным исходом — для них предусмотрена персонифицированная регистрация.
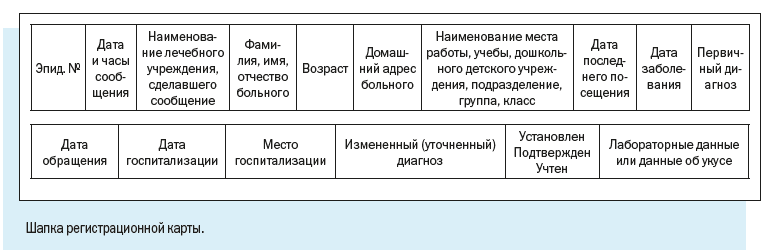
Персонифицированный учет болезней ведут с помощью специально разработанной Регистрационной карты инфекционного больного.
В отличие от Экстренного извещения Регистрационная карта предусматривает более широкий набор учитываемых признаков.
Как видим, в электронной регистрационной карте есть следующие регистрационные блоки:
1. Эпидемиологический номер — идентификатор, который в обязательном порядке присваивается регистрационной карте/случаю патологического состояния;
Эпидномер состоит из 8 цифр: первые две указывают на год регистрации случая, следующие 6 — порядковый номер случая в текущем году.
2. Имя текущего пользователя, дата и время работы с картой.
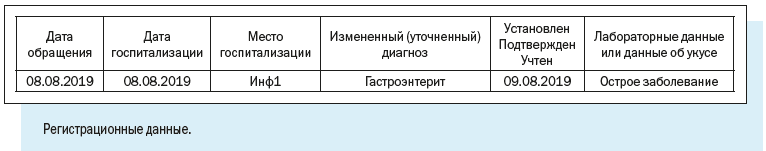
3. Регистрационные данные — наименование медицинской организации, где зарегистрирован случай, даты заболевания и обращения в медицинскую организацию, фамилия и номер телефона регистратора, дата и время регистрации случая.
4. Диагноз — текущий и окончательный диагнозы, даты установления, характер течения и тяжести заболевания.
5. Информационный блок, содержащий сведения о пациенте, — паспортные данные, принадлежность к социально-возрастной, профессиональной группе, место работы или учебы больного, место жительства с указанием признака проживания.
Регистрационная карта содержит также блок ссылок на дополнительные окна, содержащие сведения о больном.
Например, при заболевании в медицинской организации, кроме даты госпитализации больного и наименования медицинской организации, регистрируются такие сведения, как диагноз при поступлении, наличие парентерального вмешательства и его суть, характер заражения, принятые меры.
В случае летального исхода учитываются данные медицинского свидетельства о смерти с подробными сведениями о результатах секции и патологоанатомических диагнозах.
Состав и объем регистрируемых данных зависит от конкретной инфекционной болезни, например:
• при регистрации острых кишечных инфекций в Карте фиксируется информация о подозрительных пищевых продуктах и месте их приобретения;
• при инфекциях, управляемых средствами специфической иммунопрофилактики, — данные прививочного анамнеза;
• при зоонозных инфекциях и укусах — сведения о животном и сырье;
• при поствакцинальном осложнении — подробные сведения о характере реакции, препарате и условиях его применения.
Таким образом, в основу перечня учитываемых показателей положена привязка оценки эпидемического процесса к конкретной группе инфекционной патологии, что определяет структуру эпидемиологического надзора.
Важно!
Все регистрируемые сведения носят официальный характер и должны быть основаны на первичной документации медицинских организаций.
1. В амбулаторно-поликлиническом учреждении.
Если больной госпитализируется с направлением от врача амбулаторно-поликлинического учреждения, случай заболевания регистрируется также сотрудниками амбулаторно-поликлинического учреждения.
2. В стационаре.
3. На вызове к больному бригадой скорой помощи.
Сведения о диагнозе, а также информация о передаче сообщения в территориальное амбулаторно-поликлиническое учреждение заносятся в Карту вызова скорой медицинской помощи (ф. № 110/у).
4. В школе или ДДУ медицинским работником.
5. В оздоровительных учреждениях, а также в студенческих, строительных и иных коллективах медицинскими работниками.
Порядок регистрации и оперативного оповещения о случаях заболевания туберкулезом, заразными кожными инфекциями, венерическими заболеваниями, инфекцией, вызванной ВИЧ, имеет ряд особенностей, так как может быть установлен только врачом-специалистом, а также при регистрации и учете данных нозологий имеются дополнительные утвержденные регистрационные формы.
Регистрация случаев (подозрения) на заболевание парентеральными вирусными гепатитами В, С, D, TTV, G (далее — ПВГ) осуществляется в описанном выше порядке, однако есть одна особенность.
- персонала организаций, осуществляющих заготовку, переработку, хранение и обеспечение безопасности донорской крови и ее компонентов;
- персонала центров, отделений гемодиализа, трансплантации органов, гематологии;
- персонала клинико-диагностических и биохимических лабораторий;
- персонала хирургических, урологических, акушерско-гинекологических, офтальмологических, отоларингологических, анестезиологических, реаниматологических, стоматологических, инфекционных, гастроэнтерологических стационаров, отделений и кабинетов поликлиник (в том числе перевязочных, процедурных, прививочных);
- персонала диспансеров, перинатальных центров, станций и отделений скорой помощи, центров медицины катастроф, фельдшерско-акушерских пунктов, здравпунктов;
- персонала учреждений с круглосуточным пребыванием детей или взрослых;
- доноров крови (ее компонентов), костного мозга, органов и тканей, спермы;
- лиц, относящихся к группам риска (потребители инъекционных наркотиков).
Регистрация инфекций, связанных с оказанием медицинской помощи (далее — ИСМП) также имеет ряд особенностей.
Важным критерием отнесения инфекционного заболевания к ИСМП является срок его возникновения после пребывания в медицинской организации. Так, регистрация внутрибольничных гнойно-воспалительных заболеваний осуществляется в течение 30 дней после операционного вмешательства и 1 года после установления имплантата. Регистрации подлежат заболевания родильниц гнойно-воспалительными заболеваниями, связанными с родами, выявленные в период пребывания в акушерском стационаре и/или в течение 30 дней после родов. Регистрации подлежат заболевания новорожденных, выявленные в период пребывания в акушерском стационаре и/или в течение 7 дней после выписки, независимо от предполагаемого характера инфицирования (внутрибольничного, внутриутробного, интранатального). Генерализованные формы (сепсис, остеомиелит, менингит) подлежат регистрации, если заболевание выявлено в течение месяца после рождения.
[youtube.player]Читайте также: