Симптомы отторжения костного мозга
Рубрика МКБ-10: T86.0
Содержание
- 1 Определение и общие сведения
- 2 Этиология и патогенез
- 3 Клинические проявления
- 4 Отторжение трансплантата костного мозга: Диагностика
- 5 Дифференциальный диагноз
- 6 Отторжение трансплантата костного мозга: Лечение
- 7 Профилактика
- 8 Прочее
- 9 Источники (ссылки)
- 10 Дополнительная литература (рекомендуемая)
- 11 Действующие вещества
Точный риск зависит от источника стволовых клеток, возраста пациента, метода кондиционирования и профилактики реакции.
а) Первичная терапия:
Стероиды +/- ингибитор кальциневрина являются основой современной терапии оРТПХ. Все другие варианты терапии в настоящее время исследовательские. Ее эффективность составляет 30-60%. Терапия должна начинаться с момента появления первых признаков РТПХ и продолжаться до их полного разрешения. Однако необходимо помнить, что длительная иммуносупрессия повышает риск инфекций. Метилпреднизолон в дозе от 0,5 до 2 мг/кг в сутки чаще всего назначается от 1 до 2 мг/кг при стадии РТПХ от II до IV. При разрешении РТПХ снижение дозы должно происходить постепенно: обычно рекомендуется уменьшать дозу на 10% начальной каждую неделю - при отсутствии признаков прогрессии РТПХ в течение месяца. Осложнения стероидной терапии могут включать гипергликемию, кушингоидный синдром, психомоторное возбуждение, бессонницу, мышечную слабость, асептический некроз головок бедренных костей, язвенное поражение желудка. При умеренно выраженной кожной форме РТПХ возможно применение стероидов в качестве местной, несистемной терапии в сочетании с ингибиторами кальциневрина.
б) Вторичная терапия (рефрактерность к стероидам):
Критерии рефрактерности к стероидам. Прогрессия РТПХ в течение 3 дней от начала терапии глюкокортикоидами в дозе 2 мг/кг в сутки. Отсутствие положительной динамики в течение 7 дней терапии глюкокортикоидами 2 мг/кг в сутки. Неполный ответ в течение 14 дней терапии глюкокортикоидами 2 мг/кгв сутки. Рефрактерная к стероидам РТПХ имеет высокий уровень летальности: выживает около 20-25% пациентов. Для лечения рефрактерной к стероидам РТПХ используют увеличение доз глюкокортикоидов в комбинации с микофенолата мофетилом. Обычная доза - 15 мг/кг каждые 12 ч, с постепенным увеличением дозы, что позволяет понизить вероятность побочных эффектов (дискомфорт в животе, диарея). Такролимус и циклоспорин могут использоваться как монотерапия или в комбинации с другими препаратами. Иммуноглобулин антитимоцитарный при РТПХ используется в дозе 15-20 мг/кг в сутки в течение 5-7 дней.
Инфликсимаб представляет собой моноклональные анти-TNF антитела (анти-CD25). Блокируя рецепторы к TNF-альфа, этот препарат обрывает клеточные взаимодействия в процессе развития РТПХ. Его исследования в клинических испытаниях еще продолжаются, информации о его эффективности пока недостаточно. Сходный механизм действия имеет этанерцепт, связывающий TNF-альфа. Обычная доза - 25 мг подкожно дважды в неделю. Препарат не обладает печеночной или почечной токсичностью.
Пентостатин способен индуцировать Т-клеточный апоптоз, подавляя фермент аденозиндезаминазу. В I фазе клинических испытаний его максимально переносимая доза - 1,5 мг/м 2 в 1-й и 3-й дни. Возможно его повторное введение на 15-й и 17-й дни. Необходима коррекция дозы при почечной недостаточности: если клиренс креатинина составляет от 30 до 50 мл/мин, необходимо редуцировать дозу на 50%, т.е. 0,75 мг/м2 в сутки. При клиренсе креатинина менее 30 мл/мин терапия пентостатином противопоказана. Побочными эффектами пентостатина могут быть также лимфопения, умеренная тромбоцитопения и нарушение печеночной функции. Есть данные, что при рефрактерной к стероидам форме РТПХ может быть полезен экстракорпоральный фотоферез. Его преимуществом является невыраженная иммуносупрессия.
в) Сопроводительная терапия оРТПХ:
При кишечной форме оРТПХ может быть эффективно использование, помимо системных стероидов, местной стероидной терапии неадсорбирующимися препаратами. Будесонид назначается в дозе 9 мг/сут, 3-кратный прием. При печеночной форме РТПХ может быть эффективно использование урсодезоксихолевой кислоты, что способствует снижению уровня билирубина и помогает при диарее. Антидиарейным эффектом обладает также октреотид, он назначается в дозе 10-20 мкг/сут. Следует учитывать, что пациенты с оРТПХ нуждаются в антибактериальной, антивирусной, противопневмоцистной и противогрибковой профилактике. Важна адекватная гемотрансфузионная терапия, при кишечном кровотечении нужно стремиться поддерживать уровень тромбоцитов не менее 50 тыс./мкл. Компоненты крови должны быть подвергнуты гамма-облучению.
Медикаментозная профилактика, часто комбинированная, направлена на блокирование тех патологических механизмов, которые приводят к развитию РТПХ. Наиболее частое сочетание - ингибитор кальциневрина и метотрексат. Доза и возможное сочетание препаратов подбираются индивидуально. Доказано, что сочетание такролимус/метотрексат или циклоспорин/метотрексат более эффективны, чем монопрофилактика. Доза метотрексата обычно невысока, что позволяет избежать метотрексатового мукозита.
Для пациентов, которые не могут получать терапию метотрексатом, альтернативой является сочетание такролимус/микофенолата мофетил или циклоспорин/микофенолата мофетил. Сочетания сиролимус/ такролимус/метотрексат или сиролимус/такролимус позволяют снижать дозу метотрексата или полностью его исключать, хотя это может привести к развитию ВОБ, особенно если использовался миелоаблятивный режим кондиционирования.
Определение и общие сведения
Диагностика
Диагноз основывается на клинических и морфологических данных (выполняется биопсия кожи, тест Шримера, биопсия печени, слизистой рта, толстой, прямой кишки). Необходима также оценка лабораторных и инструментальных данных.
Терапией первой линии является преднизолон (1-2 мг/кг в сутки). При отсутствии улучшения симптомов - комбинация с такролимусом или циклоспорином.
а) Терапия второй линии:
такролимус в дозе 0,05 мг/кг каждые 12 ч, под контролем концентрации в крови (должна составлять 5-10 нг/мл).
Циклоспорин - 5 мг/кг каждые 12 ч, плазменная концентрация циклоспорина должна составлять 200-400 нг/мл.
Микофенолата мофетил: обычная доза 15 мг/кг перорально каждые 12 ч, назначается в небольшой дозе с постепенным увеличением для предупреждения побочного действия на ЖКТ. Может использоваться в комбинации со стероидами.
б) Симптоматическая и поддерживающая терапия:
Поражение полости рта:
при локальном поражении полости рта эффективны стероидные гели. Также используется местная форма такролимуса. Пациентам со значительными изъязвлениями и воспалительными изменениями слизистой полости рта рекомендуется полоскать рот дексаметазоном. Следует избегать приема еды и питья в течение 30 мин после процедуры. Для обработки полости рта используется также водный раствор триамцинолона.
Ксеростомия (поражение хРТПХ слюнных желез):
У пациентов с ксеростомией отмечается повышенная чувствительность к холодной, горячей, острой, кислой пище.
Лечение включает рекомендации часто полоскать рот водой и растворами антисептиков, не содержащими спирт, использовать мягкие зубные щетки, своевременно санировать полость рта. Для увеличения саливации используются агонисты холинергических рецепторов (пилокарпин) при отсутствии таких противопоказаний, как глаукома, астма, кардиальные заболевания. При болезненности при приеме пищи, разговоре должна использоваться местная аналгезия, в том числе растворами лидокаина.
При хРТПХ чаще всего поражается пищевод:
часто проявляется дисфагией, болью, чувством распирания, болезненностью за грудиной.
С диагностической целью используется эзофагогастродуоденоскопия, эзофагография с барием. Эндоскопически нередко выявляются десквамация эпителия, образование грануляций. В тяжелых случаях возможна обструкция пищевода, приводящая к хронической аспирации и рецидивирующим пневмониям. Симптомами хРТПХ также могут быть периодическая диарея, спастические боли в животе, потеря массы тела из-за нарушения всасывания. Известно, что более 40% пациентов с хРТПХ имеют недостаточную массу тела, некоторые из них нуждаются в парентеральном, иногда - зондовом питании. При поражении печени хРТПХ, как правило, назначается урсодезоксихолевая кислота.
Поражения глаз:
В лечении используется гипромеллоза. При воспалительных поражениях глаз используются антибиотики, локально - стероиды под контролем офтальмолога.
Поражение влагалища:
Поражение влагалища при хРТПХ нередко приводит к сухости слизистых оболочек, их слипанию и стенозу.
В лечении используется заместительная гормональная терапия, местная стероидная терапия. При умеренных проявлениях вульвовагинита стероидная терапия назначается местно. При развернутой клинической картине, прогрессии клинических проявлений, признаках поражения других органов необходима системная терапия РТПХ.
Легочная форма хРТПХ:
Такие осложнения, как облитерирующий альвеолит/бронхиолит, могут развиваться от 100-го дня после ТГСК до 1 года и сопряжены с высоким уровнем летальности. С одной стороны, данные осложнения могут быть спровоцированы вирусной инфекцией, периодической аспирацией желудочного содержимого на фоне поражения пищевода, с другой - сами способствуют развитию тяжелых пневмоний.
В терапии применяются системные стероиды, ингаляционные стероиды и бронходилататоры, кислородная поддержка, антибактериальная, противогрибковая терапия.
Гематологические изменения при хРТПХ:
Включают цитопении, особенно тромбоцитопении, эозинофилии.
В лечении цитопенических осложнений могут быть эффективны иммуноглобулины внутривенно, ритуксимаб.
Неврологические осложнения хРТПХ:
включают полинейропатию, миастению, миозиты и могут проявляться мышечной слабостью, болями в мышцах, дизестезиями, ощущением жжения, парестезиями.
Две угрозы стоят на пути выздоровления. Первая это возможность отторжения организмом трансплантата. Чтобы этого не произошло, защитное сопротивление организма подавляется мощными медикаментами. Вторая же угроза в том, что в течение двух трех послеоперационных месяцев организм пациента практически лишен иммунной системы. Малейшее инфицирование может стать смертельным. Чтобы избежать заражения, пациент помещается в специальную палату с особыми мерами защиты, он изолируется от внешнего мира.
Даже после выхода из больницы за пациентом устанавливается тщательное наблюдение, и он должен посещать ее для регулярных проверок. На нормальное восстановление иммунной системы после трансплантации уходит около года, но если самочувствие пациента ухудшится, может возникнуть необходимость в повторной госпитализации.
Химиотерапия в высоких дозах и облучение всего тела, необходимые для пересадки костного мозга, могут вызывать серьезные побочные эффекты. До того как принять решение по поводу процедуры, необходимо обсудить с лечащим врачом возможные осложнения, токсичность и другие опасности, связанные с трансплантацией. Пациента попросят подписать согласие на проведение пересадки, подтверждающее, что он получил информацию в устном и письменном виде о пользе и возможных опасностях предложенного лечения, альтернативных методах лечения, и что больной получил ответы на все вопросы.
Одними из наиболее распространенных побочных эффектов являются мукозит (воспаление слизистых) и диарея. Они вызываются повреждением быстро размножающихся клеток, таких как клетки слизистой оболочки рта и желудочно-кишечного тракта, химиотерапией и облучением. Тяжелый мукозит может привести к затруднению приема пищи, и может понадобиться внутривенное питание (полное парентеральное питание). Кроме того, как правило, необходим прием обезболивающих лекарств. В настоящее время доступен препарат для профилактики развития мукозита - KGF (Kepivance®). Одно из исследований показало, что использование Kepivance® у пациентов, проходящих аутологичную трансплантацию с облучением всего тела, значительно снижает возможность мукозита.
Потеря волос временное явление и в большинстве случаев захватывает всю поверхность тела. После завершения химиотерапии и облучения рост волос возобновляется. К сожалению, не существует лечения для предотвращения выпадения волос или для ускорения их роста.
Вероятность развития бесплодия после пересадки костного мозга зависит от вида применяемого лечения и дозы. Если пациент находится в детородном возрасте, стоит обсудить с лечащим врачом меры по снижению риска бесплодия и возможность сохранения яйцеклеток или спермы до начала лечения.
Легкие, печень и кости - подвержены наибольшему риску повреждения в результате цитотоксического лечения. У лиц, прошедшие общее облучение тела, могут возникнуть катаракты, хотя это осложнение становится все более редким с появлением современных методов облучения.
Существует небольшая вероятность появления вторичного рака после трансплантации костного мозга, вероятно в результате лечения первичного рака и лечения, связанного с пересадкой. Вторичный рак может развиться в течение нескольких лет (в среднем 3-5) после трансплантации.
У 10% до 50% больных, получивших аллогенный трансплантат, может развиться осложнение, называемое реакцией трансплантат против хозяина (РТПХ). Этот эффект может быть острым (развивается в первые 100 дней) или хроническим (развивается после 100 дней). Данное осложнение не возникает при аллогенной пересадке, когда донором является сам пациент. Понятие "трансплантат" относится к пересаженным кроветворным клеткам, а под понятием "хозяин" подразумевается организм пациента. Таким образом, РТПХ представляет собой состояние, когда трансплантированные клетки иммунной системы донора начинают атаковать органы реципиента. РТПХ, наряду с основным заболеванием, является главной угрозой успешной пересадке костного мозга. Для предотвращения реакции трансплантат против хозяина используются иммунносупрессивные препараты, антибиотики, и иногда, кортикостероиды. Для лечения развившейся РТПХ применяются большие дозы стероидных препаратов. Симптомами этой реакции могут служить сыпь, диарея, повреждение печени и другие проявления, в зависимости от пораженных органов.
Отторжение трансплантата редкое осложнение, возникающее примерно в 1% проценте случаев после пересадки костного мозга. Риск отторжения может быть повышен при определенных видах трансплантации и источников кроветворных клеток.
Существует определенная вероятность смертности в результате лечения. Степень риска зависит от возраста, характера основного заболевания, вида трансплантата (аутологичный или аллогенный) и других факторов, таких как квалификация и опыт медицинского учреждения в проведении подобных процедур. Перед согласием на проведение пересадки важно четко представлять себе индивидуальный уровень риска в сравнении с необходимостью проведения процедуры.
Использование кроветворных стволовых клеток (КСК) при гематологических злокачественных заболеваниях, некоторых видах негематологического рака, апластических анемиях, талассемиях и определенных иммунодефицитных состояниях получает все большее распространение.
Трансплантация кроветворных стволовых клеток (КСК), полученных методами генной инженерии, может быть полезна также для генотерапии соматических клеток и при некоторых иммунодефицитах. КСК обычно получают из костного мозга, однако источником может быть и периферическая кровь после мобилизации КСК из костного мозга путем введения кроветворных факторов роста.
Болезнь трансплантат против хозяина (БТПХ) возникает в ситуации, когда иммунокомпетентные клетки или их предшественники трансплантируют иммунонекомпетентному реципиенту и перенесенные клетки распознают его аллоантигены. Обычно БТПХ возникает после трансплантации костного мозга, однако в редких случаях наблюдается после пересадки паренхиматозных органов, богатых лимфоидными клетками (например, печени), или трансфузии необлученной крови.
Когда реципиент, иммунная система которого неспособна полноценно функционировать, получает нормальные клетки костного мозга аллогенного донора, иммунокомпетентные Т-клетки, присутствующие в костном мозге донора, распознают антигены HLA реципиента как чужеродные и реагируют против них.
Чтобы снизить вероятность развития БТПХ до минимума, подбирают совместимых по HLA доноров и реципиентов, используя чувствительные методы ДНК-секвенирования для молекулярного типирования аллелей HLA.
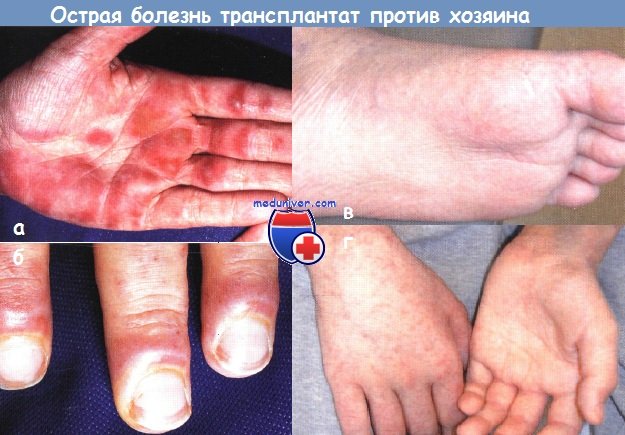
Острая форма болезни трансплантат против хозяина (БТПХ):
а,б - тяжелое кожное заболевание развилось через 3 нед. после аллогенной трансплантации костного мозга у подростка с острой миелогенной лейкемией.
Болезненные фиолетовые узлы и бляшки появились на (а) ладонях и подошвах, над пястно-фаланговыми суставными сочленениями и (б) вокруг ногтей
в,г - у подростка развилась слабо выраженная сетчатая эритема на ладонях и подошвах через 2 нед. после аутотрансплантации костного мозга.
Высыпания персистировали 4-6 нед. и разрешились без изменения схемы принимаемых медикаментов.
Острая болезнь трансплантат против хозяина (БТПХ) развивается через несколько суток или недель после пересадки аллогенного костного мозга. Возможно поражение любых органов, но основные клинические проявления обусловлены вовлечением иммунной системы и эпителия кожи, печени и кишечника. Вовлечение кожи при БТПХ проявляется генерализованными высыпаниями, в тяжелых случаях приводящими к десквамации.
Разрушение мелких желчных протоков вызывает желтуху, а изъязвление слизистой оболочки кишечника приводит к диарее с кровянистым стулом. Хотя повреждения тканей могут быть серьезными, сильная инфильтрация пораженных тканей лимфоцитами отсутствует. Предполагают, что в дополнение к прямому цитотоксическому действию Т-лимфоцитов CD8+ существенные нарушения вызывают цитокины, продуцируемые сенсибилизированными Т-клетками донора.
Хроническая болезнь трансплантат против хозяина (БТПХ) возникает вслед за острым синдромом либо развивается сначала без явных симптомов. У пациентов появляются обширные кожные поражения с разрушением придатков кожи и фиброзом дермы, напоминающие системный склероз. Хроническое заболевание печени часто проявляется в виде холестатической желтухи.

Поражение ЖКТ может привести к появлению стриктур пищевода. Иммунная система истощается, происходят инволюция тимуса и обеднение лимфоузлов лимфоцитами. В связи с этим неудивительно, что у пациентов возникают повторные, опасные для жизни инфекции. У некоторых больных наблюдаются реакции аутоиммунитета, предположительно обусловленные трансплантированными хелперными Т-клетками CD4+, взаимодействующими и стимулирующими В-клетки реципиента, среди которых некоторые способны продуцировать аутоантитела.
Поскольку болезнь трансплантат против хозяина (БТПХ) опосредуют Т-лимфоциты, содержащиеся в костном мозге донора, удаление донорских Т-клеток до трансплантации практически исключает заболевание. Однако эффективность этого подхода оказалась неоднозначной: хотя ситуация с БТПХ улучшилась, повысилась частота неприживле-ния трансплантата, развития В-клеточной лимфомы, родственной лимфоме, вызываемой EBV, и рецидивов заболевания у пациентов с лейкемией.
Иммунодефицит является частым осложнением после трансплантации костного мозга. Он может быть результатом предшествующего лечения, миелоаблативной обработки перед трансплантацией, задержки репопуляции иммунной системы реципиента и действия трансплантированных лимфоцитов на иммунные клетки реципиента. У пациентов наблюдается глубокая иммуносупрессия, и они становятся легковосприимчивыми к инфекциям, вызванным разнообразными микроорганизмами.
Среди них особенно важен цитомегаловирус. Вызываемая им инфекция обычно представляет собой результат активации уже существовавшей латентной инфекции. Индуцированный этим вирусом пневмонит может стать летальным осложнением.
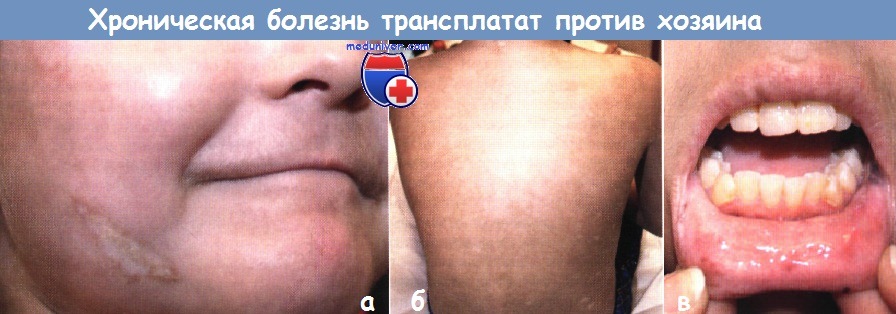
Хроническая форма болезни трансплантат против хозяина (БТПХ):
а,б - у 6-летней девочки развились диффузные склеродермаподобные изменения и диспигментация, типичные для БТПХ, через год после трансплантации костного мозга по поводу острой лимфоцитарной лейкемии
в - у нее также наблюдались лихеноидные изменения с эрозиями в полости рта.
- Рекомендуем ознакомиться со следующей статьей "Первичные иммунодефициты и их характеристика"
Осложнения после трансплантации гемопоэтических стволовых клеток
После трансплантации гемопоэтических стволовых клеток (ТГСК) в течение первой недели у пациента отмечается низкий уровень эритроцитов, лейкоцитов и тромбоцитов.
В связи с этим необходимо назначение антибиотиков для предупреждения инфекций (антибиотикопрофилактика), обычно в комбинации с антибактериальными, антивирусными и противогрибковыми препаратами.
Такая терапия проводится до восстановления нормального уровня лейкоцитов.
Многие пациенты с высокой лихорадкой требуют длительной терапии. Трансфузии эритроцитов и тромбоцитов необходимы до восстановления работы костного мозга; при этом компоненты крови должны облучаться в суммарной общей дозе 24 Грей. Тромбоконцентрат обязательно применяют при количестве тромбоцитов ниже 20,0х10 7 л.
Побочные эффекты при трансфузии стволовых клеток бывают крайне редко и в основном обусловлены наличием диметилсульфоксида, который применяется при замораживании стволовых клеток. При применении стволовых клеток без предварительного замораживания таких реакций не бывает.
Другие реакции непосредственно после ТГСК могут быть следующими: повышение температуры тела, затруднение дыхания, чувство сдавления и боли в грудной клетке, снижение артериального давления (АД), кашель, гипоанурия, диаррея. Обычно эти реакции слабо выражены и бывают редко.
В течение года или более длительного периода после ТГСК могут возникать поздние побочные реакции: РТПХ (после алло-ТГСК), инфекционные осложнения, пневмония и пульмониты, нарушения со стороны почек, печени и сердца, снижение функции щитовидной железы, ожирение, снижение толерантости к физнагрузкам, эмоциональный стресс, потеря памяти и снижение концентрации внимания, изменения отношений с окружающими, нарушения роста и развития, катаракта, репродуктивные и сексуальные проблемы, развитие вторичных опухолей.
В течение 6 недель после ТГСК могут развиваться серьезные инфекции, поскольку пациент находится в состоянии нейтропении. Более часто это бактериальные инфекции, однако могут активизироваться и вирусные инфекции, которые контролировались иммунной системой, а также грибковые инфекции.
Часто бывают пневмонии, обусловленные Pneumocysta Carinii и цитомегаловирусом. В большинстве случаев пациенты были вирусоносителями до ТГСК, однако возможна и передача вируса от донора. После приживления трансплантата риск инфекционных осложнений меньше, однако он более высок при наличии РТПХ.
Антимикробная терапия при наличии инфекции приведена ниже (табл. 39).
Таблица 39. Алгоритм антимикробной терапии при ТГСК

В течение первых 100 дней после ТГСК могут развиться пневмониты (абактериальные воспаления легких), но они могут возникать и позже - в течение двух лет после ТГСК и позже. Их причиной может быть лучевая терапия, РТПХ или химиотерапия; диагноз устанавливается при рентгенографии легких.
РТПХ развивается вследствие того, что при алло-ТГСК иммунные клетки донора относятся к клеткам пациента как чужеродным. Поскольку иммунная система пациента разрушена при кондиционировании, иммунная система после ТГСК представлена стволовыми клетками донора. РТПХ бывает острой (развивается у 30-50% пациентов в течение 10-90 дней после ТГСК) или хронической (развивается в течение 100-400 дней после ТГСК и тянется длительно).
Острая РТПХ реже бывает у молодых пациентов при полной HLA-совместимости между донором и реципиентом. Ее признаками являются тошота, рвота, спазм пищевода, диаррея, потеря аппетита, желтушность кожи и склер, абдоминальные боли, потеря веса.
Риск острой РТПХ снижен при деплеции Т-лимфоцитов в стволовых клетках донора перед выполнением ТГСК. Предупреждение острой РТПХ проводится стероидами, метотрексатом, циклоспорином, такролимусом с целью снижения иммунного ответа. Однако это повышает риск вирусных инфекций, частоту рецидива и отторжения трансплантата. Разрабатывается метод очистки донорского трансплантата от алло-активированных Т-лимфоцитов, что может снизить тяжесть РТПХ и оставить возможность Т-лимфоцитам донора уничтожать любые опухолевые клетки.
- Циклоспорин 3 мг/кг/сут в/венно.
- Метилпреднизолон 2 мг/кг в/венно ежедневно с 50% редукцией дозы каждые 5 дней при хорошем ответе.
- Циклоспорин 3 мг/кг/сут в/венно;
- Метилпреднизолон 5 мг/кг в/венно ежедневно с 40% редукцией дозы каждые 5 дней при хорошем ответе;
- АТГ в/венно ежедневно в суточной дозе 20мг/кг - при неполном ответе или при прогрессировании до получения эффекта;
- Мофетила микофенолат- перорально 1 г 2 раза/сут.
- Такролимус - в/венно постоянной инфузией в суточной дозе 0,05-0,1 мг/кг.
Первыми признаками хронической РТПХ являются зуд и шелушение кожи ладоней и подошв, которые быстро распространяются. В тяжелых случаях появляются пузыри, как при ожогах; может быть лихорадка.
Другие симптомы хронической РТПХ включают снижение аппетита, спазм кишечника, диаррею, потерю массы тела, желтушность кожи и склер, увеличение печени, боли в правом подреберье, повышенный уровень печеночных ферментов, уплотнения кожи, сухость склер, язвенный стоматит, бактериальные инфекции, бронхиолит.
Начальными проявлениями являются желтушность кожи и склер, темный цвет мочи, напряжение мышц в правом подреберье, и быстрое увеличение веса за счет развития асцита. Снижает риск развития ВОБ печени применение бусульфана внутривенно в процессе кондиционирования.
Отторжение трансплантата происходит, если в организме пациента нет приживления трансплантированных стволовых клеток. Чаще это бывает при частичной HLA-совместимости донора и реципиента, при сохранении Т-лимфоцитов в организме реципиента, а также при малом количестве трансплантированных стволовых клеток.
Заподозрить отторжение трансплантата можно, если нет восстановления костномозгового кроветворения в течение 3-4 недель после ТГСК костного мозга или периферической крови, а также в течение 7 недель после ТГСК пуповинной крови. В таких случаях показано введение второй дозы стволовых клеток.
После ТГСК необходимо исключить контакт с растениями и цветами, аквариумными рыбками, экзотическими животными, рептилиями, употреблять только термически обработанные фрукты и овощи, поскольку они могут содержать бактерии и грибки.
Осложнения после ТГСК зависят от многих факторов, таких как тип трансплантата, режим кондиционирования, общее состояние здоровья пациента, возраст пациента во время ТГСК, длительность и степень иммуносупрессии, наличия хронической РТПХ. Возможные отсроченные риски ТГСК включают поражение органов (печени, почек, легких, сердца, костей и суставов), рецидив лейкоза, вторичные опухоли, аномальный рост лимфоидной ткани, стерильность, гормональные изменения (поражения щитовидной и других желез), катаракту.
Наблюдение пациентов после трансплантации гемопоэтических стволовых клеток
Кратность осмотров после алло-ТГСК: до + 100 дней - 1 раз в неделю; до + 180 дней - 1 раз в 2 недели; до 1 года - 1 раз в месяц.
- анализ крови с подсчетом лейкоцитарной формулы, тромбоцитов, ретикулоцитов, СОЭ;
- биохимическое исследование крови: определение концентрации глюкозы, общего белка и белковых фракций, мочевины, креатинина, билирубина, калия, натрия, кальция, магния; определение активности АлАТ, АсАТ, ЛДГ, ГГТП, гемоглобина плазмы, гаптоглобина;
- уровень циклоспорина или такролимуса крови;
- исследование показателей гемостаза;
- общий анализ мочи;
- протеинограмма + иммуноглобулины крови;
- по показаниям - определение наличия вирусов простого герпеса, цитомегаловируса, вируса Эпштейн-Барр и других методом ПЦР;
- рентгенограмма органов грудной полости;
- УЗИ органов брюшной полости - 1 раз в месяц;
- диагностическая костно-мозговая пункция (день +100 -далее по показаниям);
- диагностическая люмбальная пункция (по показаниям);
- исследование крови на эритроцитарный и/или лейкоцитарный химеризм;
- вирусологическое обследование: гепатиты В, С; герпес; ЦМВ; ЭБВ - 1 раз в месяц;
- ЭКГ + УЗИ сердца - по показаниям;
- иммунологические исследования.
Одним из важных разделов проблемы ТГСК является лабораторный контроль функционирования трансплантата в организме реципиента. С целью контроля приживления трансплантата и выбора групповой принадлежности трансфузируемых компонентов крови (в случаях несовместимой по системе АВО ТГСК) проводится динамическое исследование эритроцитарных антигенов, титров изогемагглютининов и цитогенетический анализ лейкоцитов периферической крови реципиентов по следующей схеме:
Рецидивы могут развиться в период от нескольких месяцев до нескольких лет и значительно реже спустя 5 лет после ТГСК. При рецидиве возможности терапии ограничены. Многое зависит от состояния здоровья пациента и типа рецидива. Терапия включает химиотерапию или таргетную терапию.
Хотя есть возможность рецидива первичного варианта лейкоза после ТГСК, у пациентов нередко развиваются вторичные опухоли. Риск их развития в 4-11 раз выше, чем в среднем в популяции; пациенты после алло-ТГСК имеют больший риск развития вторичных опухолей, чем при других вариантах ТГСК.
Спустя 1-6 месяцев после ТГСК чаще развиваются В-клеточные лимфомы; в их развитии большое значение придается вирусу Эпштейн-Барр. В норме такая вирусемия контролируется иммунной системой пациента, которая супрессирована при кондиционировании. Другой патологией гемопоэтической системы является развитие миелодиспластических синдромов (МДС), который может у части пациентов трансформироваться в острый лейкоз.
Вторичные опухоли, развивающиеся спустя много лет после ТГСК, включают солидные опухоли, часто опухоли кожи, полости рта, головного мозга, печени, гортани, молочных желез, щитовидной железы и костей. Факторами риска для развития вторичных опухолей являются лучевая терапия или высокодозная химиотерапия как часть режима кондиционирования; предыдущая химио- или лучевая терапия, не связанная с ТГСК; нарушения иммунной системы (РТПХ, иммуносупрессивная терапия, HLA-несовместимость); возраст старше 40 лет во время выполнения ТГСК; вирусные инфекции (вирус Эпштейн-Барр, цитомегаловирус, вирусы гепатитов В и С).
Эти заболевания вообще после алло-ТГСК бывают редко и чаще возникают при деплеции Т-лимфоцитов, при HLA-несовместимости или при трансплантации гемопоэтических стволовых клеток от неродственных доноров, а также у пациентов, которые получали антитимоцитарный глобулин (лошадиный) или анти-CD3 моноклональные антитела для лечения острой РТПХ. Пациенты, которые получали стволовые клетки от пожилых доноров или имели тяжелую иммунную патологию перед ТГСК, также имеют повышенный риск развития лимфопролиферативных новообразований.
Многие пациенты после трансплантации гемопоэтических стволовых клеток неспособны к деторождению. Причиной этого не является сама ТГСК как таковая, но, скорее всего, применение высокодозной химио- и лучевой терапии. Такая терапия повреждает как клетки опухоли, так и здоровые клетки, в том числе клетки репродуктивных органов.
У женщин после проведенной терапии возможны нерегулярные месячные или наступает менопауза, у мужчин нарушается сперматогенез, что делает навозможным наступление беременности во время и после выполнения ТГСК. Поэтому у мужчин рекомендуется забор спермы до ТГСК, ее замораживание и хранение в банке спермы. У женщин также рекомендуется забор яйцеклеток до ТГСК, их замораживание и использование в дальнейшем для деторождения, возможно, с вариантом суррогатного материнства.
Читайте также:


