Смешанная кишечная инфекция у молодняка
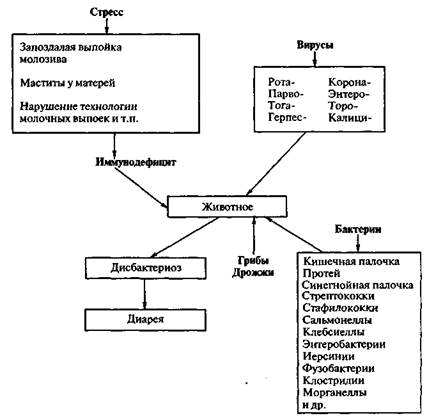
На крупных фермах диареи молодняка сельскохозяйственных животных протекают как смешанные инфекции (вирус-вирус, вирус-микробы, вирус-микробы-простейшие, вирус-простейшие), осложненные грибами, что значительно затрудняет постановку диагноза. При смешанных инфекциях кишечное расстройство протекает более тяжело в отличие от симптомов при каждой из моноинфекций, входящих в ассоциацию.
При смешанных инфекциях трудно определить роль того или иного инфекционного агента, выделяемого от больных острым кишечным заболеванием животных, что приводит к выбору неэффективных средств лечения и профилактики. Обнаружение возбудителя в пробах от больных новорожденных с диареей не доказывает его этиологическую роль в патологии. На фермах с большой концентрацией молодняка в одном помещении создается ситуация, при которой могут одновременно или последовательно циркулировать несколько возбудителей, относящихся к разным таксономическим группам. Наиболее широкое распространение имеют рота- и коронавирусные инфекции, обусловливающие желудочно-кишечные патологии как в скотоводстве, так и в свиноводстве (см. схему 3).
Промышленные условия с высокой концентрацией животных обусловливают наличие факторных инфекций. Невыб-ракованные и неизолированные из стада гипотрофики, отстающие в росте и развитии переболевшие диспепсией новорожденные, т.е. животные в состоянии иммунодефицита, служат объектом персистенции, размножения и накопления вирулентных свойств сапрофитных или, так называемых, условно-патогенных микроорганизмов.
Условно-патогенная микрофлора, или аутоинфекция — это заражение организма микробами, находящимися в нем и при определенных условиях приобретающими болезнетворные свойства. Эта инфекция лежит в основе многих болезней с первичной локализацией в коже (например, при пролежнях), в респираторном и желудочно-кишечном трактах. Аутоинфекция чаще проявляется, как уже отмечалось, вторичным процессом, но может протекать и самостоятельно, приводя к массовому падежу животных.
Развитие факторных инфекций изменяет эпизоотическую ситуацию, и на сегодняшний день уже нередкими являются диагнозы — протейная инфекция молодняка, или псевдомоноз молодняка сельскохозяйственных животных, или клебсиеллез. Отмечают случаи клинического проявления кишечных патологий и септицемии у телят, вызванных патогенными морганеллами, шигеллами и иерсиниями.
В условиях крупных комплексов изменяется и эпизоотический процесс при некоторых инфекционных заболеваниях. Например, актинобациллезная плевропневмония регистрировалась спорадическими вспышками в свиноводческих хозяйствах. На многотысячном производстве в условиях кормового дисбаланса (нарушения поставки кормов) и зоогигиенических отклонений роль этой инфекции в общей структуре патологий свиней возросла. Все чаще регистрировали энзоотические и эпизоотические вспышки. В настоящее время при низкой заполненности свиноводческих комплексов и тенденции к развитию малых хозяйств эпизоотическая значимость актинобациллезной плевропневмонии вновь снизилась.
Необходимо отметить, что в производственных условиях стресс может стать пусковым механизмом эпизоотии с максимальной степенью заболеваемости при таких болезнях, для которых характерна спорадичность. Например, отмечались случаи 100%-ной заболеваемости телят 1—8-месячного возраста парагриппом-3 при повышении концентрации вредных газов и относительной влажности вследствие двухдневной задержки удаления навоза (сломался транспортер), или регистрировались вспышки колиэнтероток-семии с 60%-ной заболеваемостью после кастрации хрячков-отъе-мышей.
Часто приходится наблюдать переход кишечной формы заболевания в респираторную или случаи комбинирования их. Смешанная форма пневмогастроэнтеритов более сложна в лечении, нередко переходит в септическую форму и заканчивается летально.
Факультативно-патогенный характер большинства возбудителей заразных болезней молодняка затрудняет определение истинных источников инфекции. К тому же возбудители этих заболеваний могут находиться в организме клинически здоровых животных.
Инфекционные заболевания молодняка различных видов имеют много общего в отношении предрасполагающих, этиологических, патогенетических факторов и клинического проявления. Наряду с этим у животных разных видов наблюдается и своеобразие в патологических явлениях даже при некоторой общности возбудителя (эшерихиоз). Успех в борьбе с бактериальными и вирусными болезнями молодняка зависит от своевременно поставленного точного диагноза, проведения комплексных организационных, лечебно-профилактических и ветеринарно-санитарных мероприятий.
В основу постановки диагноза и его дифференцирования должны быть положены:
изучение санитарно-зоогигиенических условий выращивания молодняка, полноценности, сбалансированности и техники его кормления;
выяснение эпизоотологических факторов, способствовавших возникновению и распространению болезней молодняка;
подробная фиксация патологоанатомических изменений при вскрытии павших или вынужденно-убитых животных;
оценка эффективности проводимых обработок средствами профилактики и терапии.
При терапии инфекционных заболеваний молодняка сельскохозяйственных животных необходимо руководствоваться принципами комплексности и приоритетов. Как правило, в производственных условиях мероприятия по борьбе с инфекцией необходимо начинать:
с изоляции животных первой группы — больных (с выраженными клиническими признаками);
со специфической лечебной обработки животных второй группы — условно больных, или подозрительных по заболеванию (с предвестниками болезни, невыраженной клинической картиной, или находившихся в прямом контакте с животными первой группы);
с профилактической (специфической или неспецифической) обработки животных третьей группы — условно здоровых, или подозреваемых в заражении (остальных животных неблагополучной фермы).
Смешанные инфекции телят
Узбекский научно-исследовательский институт ветеринарии.
Смешанные бактериальные, вирусно-бактериальные пищеваритель-ных и респираторных органов телят приобретают актуальность в хозяйст-вах. При эпизоотологических обследованиях хозяйств у телят установили болезни респираторных органов и органов пищеварения которые в подав-ляющем большинстве имели полиэтиологическую природу и многих от-ношениях, до наших исследовании можно сказать не были изучены.
По нашим наблюдениями, смешанная инфекция протекает в первые недели жизни телят в острой или подострой формах поражается кишечник, понос и истечение из носа, кашель, угнетены. У телят старшего возраста в подавляющем большинстве протекают хронически, задерживается рост и развитие, температура тела в начале болезни часто в пределах нормы при значительным развитии она может подниматься до 40,0-42,0.
Следует отметить что инфекционные болезни молодняка телят, моно-инфекции и смешанные инфекции, как правило, проявляются и протекают с примерно одинаковыми симптомами, хотя их этиология весьма неодина-кова, что связано с одинаковой схемой развития болезни. Это обычно за-трудняет их дифференцирование.
Как было сказано выше течение смешанных инфекций в естественных условиях изучено на 15-и телятах в хозяйствах Республики. При этом они были разделены на 2 группы, первая 8 телят 5 – 15-дневного возраста, вто-рая 7 телят 1-2 месячного возраста.
У телят первой группы наблюдали кровавый понос, повышение тем-пературы тела до 40,5-41,0 С, отеки в области шеи, живота и паха, увели-чение подчелюстных и предлопаточных лимфоузлов, а также болезнен-ность в области живота.
Вторая группы в начале болезни также наблюдаются тяжелые клини-ческие признаки. При этом установили слизистое истечение из носа, ане-мичность видимых слизистых оболочек, повышение температуры тела 41,0-42,0 С ускорении пульса и дыхания, кровавый понос. Некоторые жи-вотные становятся слабыми и долга лежат.
Течение и сложность патологоанатомических изменений и их принад-лежность тому или другому заболеванию зависят от вида и вирулентности возбудителей а также возраста животных.
Первый группа 5-15 дневного телята в основном, истощенные, конь-юнктива у них гиперемирована, шерсть взъерошена, вокруг ануса испачка-на желтоватыми каловыми массами. При вскрытии у них в брюшной по-лость обнаруживаются желтовато-красная жидкость в пределах 150 мл. У некоторых телят кутикулярный слой желудка легко отторгается, под кото-рым обнажаются различные геморрагии.
У телят, болевших в течение 8-10 дней часто в сычуге и тонком ки-шечнике развиваются эрозия и язвы. Печень, селезенка и почки увеличены, очень часто с мелкоточечными кровоизлияниями и некротическими очага-ми, легкие отечные, сосуды застойные, бронхи заполнены пенистым экс-судатом. У некоторых телят развивается некротическая плевропневмония.
Вторая группа 1-2-месячные телята. Здесь смертность несколько меньше, чем в первой группе. В большинстве случаев заболевание проте-кает хронически и телята отстают в росте.
При вскрытии все сосуды подкожной клетчатки застойные, область шеи, предлопаток и паха гиперемированы и инфильтрированы желтой слизистой массой. Большинство лимфоузлов увеличены, некоторые с диа-педезными геморрагиями. В грудной и брюшной полостях скопление жел-товатой жидкости. Сосуды желудка застойные, на слизистой пятнистые кровоизлияния, в у некоторых животных эрозия и язвы. Печень и селезен-ка увеличены, на поверхности сосуды застойные. В кишечные возникают точечные и пятнистые кровоизлияния, эрозия и язва а также катарально-геморрагической воспаление.
Из 15 телят, у которых мы установили смешанных инфекции, у телят 5–15-дневного возраста изменения были свойственны колибактериозу и сальмонеллезу, а у 7 голов 1-2 месячных изменение были не очень серьез-ными и при бактериологическом исследовании выделили возбудителей пастереллеза и сальмонеллеза.
Таким образом, анализ патологоанатомических изменений у живот-ных, заболевших смешанным инфекциями в естественных условиях, пока-зал что развитие и проявление патологоанатомических процессов при этом отличаются от процессов, свойственных отдельно взятому заболеванию. Кроме того они отличаются между собой также в зависимости от возраста животных, вида и количества возбудителей.
1.1. Смешанная кишечная инфекция - остропротекающая инфекционная болезнь молодняка разных видов сельскохозяйственных животных, которая имеет полиэтиологическую природу и вызывается двумя-тремя и более видами патогенных энтеробактерий, относящимся к родам Escherichia, Citrobacter, Proteus, Morganella, Klebsiella, Salmonella. Помимо указанных микроорганизмов возбудителями болезни могут быть также бактерии других родов и семейств - Yersinia, Pseudomonas, Staphylococcus, Streptococcus, Clostridium и пр. Наряду с бактериальными агентами нередко (особенно на крупных фермах) болезнь обусловливают корона- и ротавирусы.
1.2. Болезнь возникает в первые дни и недели жизни животных и проявляется чаще в виде энзоотической вспышки, развитию которой способствуют различные факторы, связанные с несоблюдением технологических и ветеринарно-санитарных требований воспроизводства стада, а также нарушением режимов содержания и кормления молодняка.
1.3. Смешанная кишечная инфекция может протекать в кишечной (энтеритной) и септической формах. При кишечной форме возбудители болезни локализуются только в желудочно-кишечном тракте и брыжеечных лимфоузлах, регионарных поражённым участкам кишечника; при септической форме - в паренхиматозных органах, различных тканях, а также в кишечнике и брыжеечных лимфоузлах. Основными клиническими признаками болезни являются: потеря аппетита, понос, переходящий в профузный, нарастающая слабость, депрессия, учащенное дыхание и сердцебиение, обезвоживание организма (при затяжном течении); нередко наблюдается поражение центральной нервной системы (возбуждение, судороги), иногда пневмония, артриты; температура тела в пределах нормы, в отдельных случаях повышена на 0,5 - 1 °С, в предагональном состоянии она снижается ниже нормы.
1.4. Патологоанатомические изменения у погибших животных имеют картину катарального или катарально-геморрагического гастроэнтерита, на слизистой желудка, тонкого отдела кишечника и слепой кишки могут встречаться язвы, нередко отмечаются множественные точечные, полосчатые и пятнистые кровоизлияния на слизистой желудка, толстого и тонкого отделов кишечника, под капсулой селезенки, эпи- и эндокарде (клапанах); иногда отмечается очаговая катаральная пневмония и отек легких, дистрофия печени; регионарные брыжеечные лимфатические узлы как правило увеличены, отечны, на разрезе розового или красно-вишневого цвета; при вскрытии черепной коробки - гиперемия кровеносных сосудов и отек ткани головного мозга. Указанные изменения могут быть в отдельных или одновременно в нескольких органах.
1.5. Диагноз на смешанную кишечную инфекцию в хозяйствах устанавливают на основании совокупности эпизоотологических данных (возраст заболевших животных, массовость поражения, стационарность и др.), клинических признаков болезни, патологоанатомической картины и результатов бактериологического (при необходимости еще и вирусологического) исследования патологического материала от больных или погибших животных.
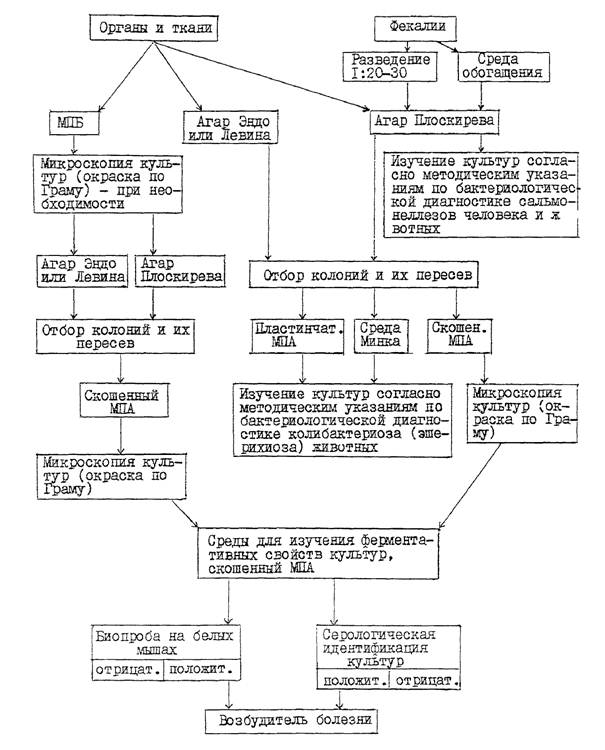
2.1. Для посмертной бактериологической диагностики в лабораторию направляют 2 - 4 свежих трупа погибших или убитых с диагностической целью больных животных (желательно не подвергавшихся лечению антибактериальными препаратами). В случае невозможности доставки целого трупа посылают следующий патологический материал: голову, трубчатую кость, сердце, перевязанное лигатурой вблизи разреза сосудов и аорты, селезенку, долю печени с желчным пузырем, брыжеечные лимфатические узлы, регионарные воспаленному участку кишечника, а также пораженный отрезок тонкого отдела кишечника, перевязанный с двух концов лигатурой (в отдельной таре или полиэтиленовом пакете). Указанный патологический материал исследуют в день поступления его в лабораторию.
2.2. Для прижизненной бактериологической диагностики в лабораторию направляют фекалии больных диареей животных, не подвергавшихся лечению антибактериальными препаратами. Пробы фекалий берут от 5 - 6 больных животных одной фермы в стерильные пробирки по 2 - 3 г непосредственно из прямой кишки с помощью прокипяченного резинового катетера. Пробирки вместе с сопроводительной запиской упаковывают в полиэтиленовый пакет или картонную коробку.
При невозможности быстрой доставки проб фекалий в лабораторию (через 3 - 4 часа после взятия) их консервируют стерильным 30 %-ным глицериновым раствором в соотношении 1:2 (см. приложение).
2.3. Пробы фекалий и содержимого тонкого отдела кишечника (в количестве не более 0,5 г) разводят в 10 см 3 стерильного 0,85 %-ного раствора хлорида натрия, тщательно размешивают и затем выдерживают 10 - 15 минут при комнатной температуре для осаждения крупных частиц. Надосадочную жидкость используют для посева на питательные среды не позднее 1 - 2 часов после приготовления взвесей. При исследовании консервированных фекалий, их тщательно размешивают, после чего разводят физиологическим раствором в 5 - 10 раз.
3.1. Патологический материал (за исключением содержимого тонкого отдела кишечника и фекалий) засевают в пробирки с МПБ и на плотные дифференциально-диагностические среды в чашках: Эндо (или Левина) и среду Плоскирева (или висмут-сульфит агар). Содержимое тонкого отдела кишечника и фекалий засевают только на указанные выше плотные среды в чашках. Кроме того для выделения из фекалий сальмонелл неразведенные пробы фекалий засевают еще в одну из сред обогащения (селенитовый бульон, магниевую, Мюллера или др.) в соотношении 1:5.
3.1.1. Посев материала в МПБ проводят пастеровской пипеткой. Посевы на плотные среды в чашках из внутренних органов и тканей, указанных в п. 2.3, делают путем отпечатков разрезанной поверхностью кусочка органа из предварительно профламбированного участка на подсушенную питательную среду или вносят материал пастеровской пипеткой на поверхность среды, а затем равномерно растирают его стеклянным шпателем.
3.1.2. Содержимое тонкого отдела кишечника, взятое путем соскоба с пораженного участка слизистой оболочки, суспендируют в 10 см 3 стерильного 0,85 %-ного раствора хлорида натрия, затем засевают суспензию бактериологической петлей на подсушенные в термостате плотные дифференциально-диагностические среды в чашках широким частым штрихом по всей поверхности среды. Аналогичным образом проводят посев разведенных фекалий.
3.2. Пробирки с посевами в МПБ из внутренних органов и тканей инкубируют при температуре 37 - 38 °С в течение 18 - 24 часов. При наличии в МПБ помутнения среды культуру микроскопируют и в случае обнаружения мелких грамотрицательных палочек пересевают ее на агар Эндо (или Левина) и среду Плоскирева (или висмут-сульфит агар) в чашках, которые помещают в термостат (37 - 38 °С ) на 18 - 24 часа.
Пересев культур, полученных в МПБ, на плотные селективные среды проводят в том случае, если отсутствует рост колоний на этих средах в первичных посевах из соответствующих органов и тканей.
При наличии на агаре Эндо (или Левина) роящегося налета, характерного для протея, пересевают его на скошенный МПА (культуры из двух-трех внутренних органов, тканей или фекалий). Чашки и пробирки с посевами инкубируют 18 - 20 часов при той же температуре.
3.4. Чашки с первичными посевами на агаре Плоскирева инкубируют при температуре 37 - 38 °С в течение 24 - 36 часов. После просмотра культур пересевают мелкие круглые колонии S-формы полупрозрачные, сероватого цвета с голубым оттенком в пробирки со скошенным МПА (по 1 - 2 колонии с культур из двух-трех внутренних органов, тканей или фекалий, каждую колонию в отдельную пробирку), которые помещают в термостат на 18 - 24 часа.
В том случае, если пересев проводят на комбинированную среду (Олькеницкого, Клиглера), то каждую колонию пересевают в одну пробирку с этой средой и в одну пробирку со скошенным МПА.
3.5. Суточные культуры бактерий на скошенном МПА или комбинированной среде, выделенные из внутренних органов, тканей или фекалий, микроскопируют (окраска по Граму) и при наличии в мазках однородных мелких грамотрицательных палочек, не образующих спор и капсул (бактерии вида Klebsiella pneumoniae образуют капсулу), используют для изучения ферментативных, патогенных, антигенных свойств, а также (при необходимости) определения подвижности в полужидком МПА. Для выявления у культур клебсиелл капсулы окраску мазков проводят по методу Гинса (тушью).
3.6. Ферментативные свойства изучают у 2 - 6 агаровых (в порядке исключения у бульонных) культур бактерий, выделенных из одного патологического материала, на наборе сред с углеводами и индикатором Андреде или полужидких средах с индикатором ВР, куда входят среды с глюкозой, лактозой, сахарозой, маннитом, мальтозой, а также на средах с мочевиной, сернокислым железом (определение сероводорода), агаре Симонса, в бульоне Хоттингера или МПБ (определение индола), мясопептонной желатине, среде с фенилаланином.
При использовании комбинированной среды Олькеницкого или Клиглера учитывают изменения, вызываемые представителями разных родов энтеробактерий в этой среде, после чего данную культуру изучают по другим необходимым биохимическим тестам.
Засеянные пробирки инкубируют при температуре 37 - 38 °С.
Предварительные результаты изучения ферментативных свойств культур учитывают через 24 часа, окончательные результаты - через 48 часов. Изучение ферментативных свойств культур энтеробактерий можно проводить также с помощью тест-системы для биохимической идентификации энтеробактерий. Родовую и видовую принадлежность культур устанавливают по показателям таблицы.
Следует учитывать, что у бактерий рода Proteus встречаются нероящиеся штаммы, образующие при росте на плотных питательных средах мелкие круглые колонии S-формы сероватого цвета. Важными признаками родовой идентификации таких штаммов является их способность дезаминировать фенилаланин и разжижать желатин.
При наличии у культур отклонений от основных показателей таблицы используют дополнительные тесты: реакции с метилротом и Фогес-Проскауэра, наличия образования оксидазы, определение подвижности и др.
СХЕМА
БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ ПАТОЛОГИЧЕСКОГО
МАТЕРИАЛА НА СМЕШАННУЮ КИШЕЧНУЮ ИНФЕКЦИЮ
Дифференциальные признаки энтеробактерий по ферментативным свойствам

Ротавирусная инфекция крупного рогатого скота (Rotavirosis infectiosa bovium) — остропротекающее контагиозное заболевание новорожденных телят, характеризующееся поражением желудочно-кишечного тракта (профузным поносом, дегидратацией организма, развитием катарального или катарально-геморрагического гастроэнтерита).
Историческая справка. Первое сообщение о выделение ротавирусов при диарее новорожденных телят в 1969г было сделано Мебусом с сотрудниками (США) , когда они выделили из фекалий больных новорожденных телят вирусный агент и воспроизвели диарею у телят- гнотобиотов, не получавших молозива. В дальнейшем О.В. Богатыренко с соавторами (1976) В.Н. Сюрин с соавторами (1979) установили ротавирусное заболевание в СССР. Исследования ротавирусной инфеции проводимые Фернелиусом и Велчем в 1971—1975гг позволили определить морфологию возбудителя, дать характеристику его нуклеиновой кислоты, установить отсутствие чувствительности вируса к липидам.
Экономический ущерб при ротавирусной инфекции складывается из падежа, вынужденного убоя больных животных, снижения продуктивности и финансовых затрат связанных с проведением мероприятий по профилактике и ликвидации болезни.
Этиология. Возбудитель ротавирусной инфекции – Rotavirus bovines, calf diarrheae (scours) virus имеет двойной капсид. Внутренний капсид — икосаэдрической симметрии, сотообразной структуры. Наружный слой толщиной 3,5-4,0 нм состоит из полых структур, закрепленных на радиально расположенных отростках капсомеров внутреннего слоя. Морфологически различают 3 типа вирионов: полные-с двойной оболочкой, диаметром 65-75 нм; только с внутренним капсидом, диаметром 50-55 нм; гексагональные нуклеоиды – с сердцевиной, диаметром 30-40нм.
Нуклеоид во всех типах вирионов может встречаться пустым -электронно-микроскопически полым. Полные вирионы по форме напоминают колесо с тонким ободком (наружный капсид), толстыми, коротким спицами (отростки внутреннего капсидного слоя) и широкой ступицей (нуклеоид и внутренний капсидный слой). Колесовидная форма вирионов дала название и роду (rota- колесо, лат.).
Активность патогенного вируса выражается образованием в организме животных нейтрализующих, преципитирующих, комплементсвязывающих антител и антигемагглютинонов.
Вирус осуществляет свою репродукцию в цитоплазме эпителиальных клеток тонкого отдела кишечника, брыжеечных лимфоузлов. Лабораторные животные не восприимчивы.
Устойчивость. Ротавирусы устойчивы к воздействию физических и химических факторов. Вирус устойчив к колебаниям рН от 3 до 10, действию концентрированных солей, жирорастворителей. Вирус сохраняется в фекалиях до 9 месяцев, в высушенном навозе до 7 лет. Для дезинфекции помещений применяют хлорсодержащие препараты, 5% раствор лизола, 7-8% раствор натрия гидроокиси, 2-5% раствор формальдегида.
Эпизоотологические данные. Наиболее широко болезнь распространена в странах с развитым промышленным животноводством. Заражаются, как правило, 100%новорожденных телят. Телята, в основном болеют, в возрасте 2-12 дней, особенно часто болеют в первые 2-6 дней жизни. Чаще болеют телочки. Смертность и выбраковка переболевших телят в хозяйстве могут достичь в среднем 40-50%. При этом важную роль играет инфицирование желудочно-кишечного тракта телят возбудителями — синергистами других заразных кишечных болезней, прежде всего коронавирусом и эшерихией коли, тогда смертность достигает 100%.
Таким образом, тяжесть болезни во многом зависит от влияния секундарной микрофлоры. Другая особенность эпизоотического процесса – увеличение заболеваемости и усиление тяжести переболевания новорожденных телят зимой и весной. Несмотря на то, что в основном болеют новорожденные телята, вспышки энтеритов ротавирусной этиологии в условиях стресса могут быть у телят старших возрастов и спонтанно у взрослых особей у которых болезнь протекает бессимптомно. К возбудителю ротавирусной инфекции восприимчив и человек.
Источником возбудителя инфекции являются больные и переболевшие животные, а также взрослые животные – вирусносители, выделяющие его в окружающую среду с экскрементами. Инфицированность взрослых животных в отдельных стадах может достигать 60 и более процентов. В 1мл фекалий больного теленка может содержаться до 1 млрд. вирионов. Хозяйство, в котором циркулирует патогенный вирус, надолго становится неблагополучным по этой болезни. Отмечена длительная персистенция вируса у лактирующих коров, имеющих высокий уровень молозивных антител.
Факторами передачи возбудителя инфекции служит инфицированная молочная посуда, станки, подстилка, вода, предметы ухода за больными животными, одежда обслуживающего персонала и т.д.
Заражение телят происходит алиментарным путем после рождения. Ротавирусы могут проходить через плаценту и инфицировать плод.
В сельскохозяйственных предприятиях большую роль в распространение болезни играют собаки, кошки, грызуны и человек.
В благополучные хозяйства ротавирусная инфекция заносится при поступление в хозяйство больных и переболевших животных, а также с инфицированными кормами.
Патогенез. Заражение молодняка происходит алиментарно. В результате репродукции ротавирусов в ворсинках эпителиальных клеток тонкого кишечника происходит нарушение пристеночного пищеварения, разрушение и десквамация цилиндрического эпителия с последующей его заменой на незрелый кубический и плоский. Ворсинки укорачиваются, становятся функционально неполноценными, что приводит к резкому снижению синтеза ферментов: гамма-глобулина, дисахаридаз, расщепляющих мальтозу, сахарозу, лактозу. Все это обуславливает накопление их в организме, а также простых углеводов и токсинов, приводящих к интенсивной рефлекторной перистальтике, развитию диареи и обезвоживанию организма.
Нарушение процесса всасывания углеводов в тонком отделе кишечника способствует их поступлению в толстый отдел, где создается повышенное осмотическое давление, которое препятствует всасыванию воды из формирующихся фекалий, но обуславливает поступление воды из тканей организма, приводя тем самым к различной степени дегидратации организма и зачастую, к летальному исходу.
Клинические признаки. Инкубационный период при ротавирусной инфекции длится 12-24ч, но может продолжаться до 2-3 суток. Заболевание проявляется в легкой, средней и тяжелой формах.
У телят симптомы болезни проявляются выделением водянистых фекалий соломенно-желтого или белого цвета и кисловатого запаха. Больные телята угнетены. Температура тела обычно нормальная, аппетит снижен. По мере развития болезни фекалии приобретают грязно-желтый цвет, с примесью слизи и крови. Отмечаем западание глаз, дегидратацию и фибрилляцию мышц конечностей, обильное истечение вязкой слюны, частый пульс слабого наполнения, достигающий 160 ударов в минуту (тахикардия). К началу 4-5 суток у больных телят может развиться коматозное состояние или патологический процесс приостанавливается, после чего может медленно наступить выздоровление.
Патологоанатомические изменения характерны для остро протекающего энтерита и дегидратации организма. Отмечают петехиальные кровоизлияния под серозной оболочкой предсердия и аорты, незначительные участки гепатизации краев долей легких, рассеянные точечные кровоизлияния на селезенке, увеличение и гиперемию брыжеечных лимфатических узлов сопредельных тонким кишкам.
Кроме деструкции ворсинок тонких кишок, на отдельных участках их отмечают полное исчезновение эпителия слизистой оболочки с признаками воспалительной реакции и некрозом ткани. Отмечаем деструктивные изменения в селезенке и брыжеечных лимфатических узлах, где не просматриваются границы фолликулов. Изменения находим также в печени, почках и легких. В целом при гистопатологическом исследовании обнаруживают признаки острого некротического энтерита и дегенеративной лимфаденопатии.
Диагноз. Для посмертной лабораторной диагностики направляют фрагменты пораженных петель кишечника с содержимым.
Для прижизненной диагностики направляют от 5 до 8 проб каловых масс от животных с клиническим проявлением заболевания, а также сыворотки крови от переболевших животных.
Диагноз на ротавирусную инфекцию крупного рогатого скота ставят на основании эпизоотологических данных, клинических признаков болезни, патологоанатомических изменений и результатов диагностических исследований. Для этого используют метод электронной и иммуноэлектронной микроскопии, РДП, сэндвич- вариант ИФА, метод полимеразноцепной реакции.
Иммунитет и средства специфической профилактики. Переболевшие животные приобретают иммунитет. Антитела к ротавирусу у животных секретируются в наибольших концентрациях в первый день и резко падают к третьему дню после рождения. Многие новорожденные животные инфицированные ротавирусами имеют антитела адсорбированные из молозива.
В целях специфической профилактики в некоторых странах иммунизируют стельных коров: первая вакцинация за 3 месяца до отела, вторая – за 8-14 дней до ожидаемого отела. Считается, что коллостральный иммунитет обеспечивает устойчивость новорожденного теленка к вирусу или снижает тяжесть переболевания. Иммунизируют вирусвакциной из аттенуированного штамма ротавируса новорожденных телят в первые сутки после рождения. Препараты используют как моновалентные, так и ассоциированные, направленные на профилактику сразу нескольких кишечных болезней.
Профилактика. Профилактика ротавирусной инфекции строится на своевременной диагностике болезни и предупреждении заноса вируса в благополучные хозяйства.
Профилактика желудочно-кишечных заболеваний у молодняка крупного рогатого скота должна начинаться в период стельности коровы. Стельных коров за 2 месяца до ожидаемого отела переводят в цех сухостоя. За 15 дней до ожидаемого отела и в течение 10 дней после родов исключают из рациона силос.
Отелы необходимо проводить в родильном отделении с соблюдением ветеринарно-санитарных правил проведения родов.
У новорожденного теленка сразу после его рождения необходимо удалить полотенцем слизь из ноздрей, рта и ушей. Пуповину дезинфицируют 5%-ным раствором йода. После этого теленка подсаживаем к корове.
Первую выпойку молозива теленку необходимо проводить в течение 1-1,5 часов после рождения. Это связано с тем, что наибольшее количество иммуноглобулинов содержится в первых порциях молозива. Обслуживающий персонал должен знать, что в это время слизистая оболочка кишечника теленка способна адсорбировать материнские антитела в неизменном виде. Молозиво новорожденным телятам выпаивают из сосковых поилок 4-6 раз в сутки. При каждом кормлении теленок зависимости от развития должен получать 1,5-3 литра молозива или молока матери в течение 7 дней, в дальнейшем допускается выпаивание сборного молока.
Наиболее важным в профилактике заболевания является вакцинация глубокостельных коров против ротавирусной инфекции.
Мероприятия по ликвидации. При установлении диагноза на ротавирусную инфекцию Постановлением Губернатора хозяйство объявляется неблагополучным и в нем вводят ограничения. По условиям ограничений запрещается:
- ввод на территорию неблагополучного пункта восприимчивых животных;
- вывод (вывоз) больных животных за пределы неблагополучной фермы;
- перегруппировку животных внутри хозяйства без разрешения ветеринарных специалистов;
- вывоз за пределы неблагополучного пункта кормов имевших контакт с больными животными;
- вход на территорию фермы лиц не связанных с обслуживанием животных неблагополучной фермы;
- использование не обезвреженной посуды и сосковых поилок для кормления телят.
В неблагополучной ферме, ветспециалисты проводят клинический осмотр с выборочной термометрией, с последующий разбивкой животных на следующие группы:
- больные;
- подозрительные по заболеванию;
- подозрительные в заражении.
Животных первой и второй групп объединяют, изолируют в отдельное помещение и подвергают лечению. Для ухода за ними закрепляют отдельный обслуживающий персонал.
Трупы павших животных утилизируют в биотермических ямах.
Ежедневно проводится дезинфекция в помещении скотных дворов.
Телят третьей группы подозреваемых в заражении вакцинируют. Дезинфекцию помещения где содержаться животные данной группы проводят после каждого случая выделения больного животного, но не реже 1 раза в 10 дней.
Навоз от животных всей фермы подвергается биотермическому обеззараживанию.
Хозяйство объявляется благополучным через 30 дней после последнего случая выздоровления, падежа, вынужденного убоя больного животного и проведения полного комплекса ветеринарно-санитарных мероприятий, включая и заключительную дезинфекцию.
Читайте также:


