Аминокислотные нейромедиаторы: кетоглутарат, глутамат, ГАМК
Добавил пользователь Владимир З. Обновлено: 29.01.2026
Понятие и классификация нейромедиаторов, их разновидности и функции. Синтез и биологическая роль серотонина, ацетилхолина, аминомасляной кислоты. Другие медиаторы ЦНС: глицин, глутамат, характер и специфика их действия на основные системы организма.
| Рубрика | Биология и естествознание |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 03.06.2014 |
| Размер файла | 360,0 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
«Нейромедиаторы»
1. Нейромедиаторы, общие понятия, классификация
нейромедиатор серотонин глутамат глицин
Нейромедиаторы или нейротрансмиттеры синаптической передачи - это разновидность биохимических медиаторов, химические соединения, которые служат средством передачи информации (посредник в передаче информации, мессенджер) от нейрона к любым клеткам: к другому нейрону, к мышечной клетке, к клетке железы или к другим видам клеток.
Содержание информации передаваемой неротрансмиттером может быть различным. Это может быть информация о цели, управляющая информация, информация о среде, информация о состоянии объекта управления, информация о результатах управления. Все эти виды информации необходимы для структурно-функциональной организации элементов субклеточных систем, клеток, совокупностей клеток, органов, систем органов. В числе химических переносчиков информации могут быть нейромедиаторы, нейромодуляторы, гормоны, иммуноглобулины и ряд других веществ.
Клетка-мишень имеет специфичные каждому из нейромедиаторов биохимические рецепторы. Нейромедиатор, взаимодействуя со своим рецептором, образует комплекс «нейромедиатор-рецептор». Этот комплекс может непосредственно или через цепь посредников специфически влиять на интенсивность тех или иных процессов метаболизма клетки, лежащих в основе её свойств и функций.
Одни нейромедиаторы через деполяризующие синапсы могут вызывать градуальную деполяризацию постсинаптической мембраны и повышение возбудимости клетки-мишени. В деполяризующих синапсах может также возникать импульсная деполяризация, потенциал действия и возбуждение клетки-мишени.
Другие нейромедиаторы через гиперполяризующие синапсы могут вызвать градуальную гиперполяризацию постсинаптической мембраны и понижение возбудимости клетки-мишени, то есть могут оказывать тормозные влияния.
Ряд веществ может осуществлять активацию или блокирование биохимических рецепторов синаптических мембран. Среди этих веществ аминокислоты, нейроактивные пептиды (нейромодуляторы и нейрогормоны), простагландины. На процесс передачи информации могут также оказывать влияние многие другие вещества.
Для того, чтобы отличить нейромедиаторы от других активных в отношении передачи информации веществ, были сформулированы вероятностные свойства синаптических структур, наличие которых свидетельствует в пользу того, что исследуемое вещество можно отнести к нейромедиаторам.
1. Предсинаптический нейрон.
(а) Наличие в синаптических терминалях предсинаптического нейрона ферментов, катализирующих синтез предполагаемого нейромедиатора, а также его ресинтез из продуктов инактивации.
(б) Наличие в терминалях предсинаптического нейрона депонированного предполагаемого нейротрансмиттера и его выведение в синаптическую щель в фармакологически идентифицируемой форме.
(в) Наличие в синаптической щели ферментов, инактивирующих предполагаемый нейромедиатор.
2. Постсинаптическая структура.
(г) Возможность воспроизведения в искусственных экспериментальных условиях с применением предполагаемого нейротрансмиттера событий, сопровождающих естественные процессы передачи информации через синапс к постсинаптической структуре, клетке-мишени.
(д) Возможность воспроизведения в искусственных экспериментальных условиях модулирующих (усиливающих или ослабляющих) действий тех факторов, которые влияют на действие предполагаемого нейротрансмиттера в естественных условиях синаптической передачи.
К настоящему времени доказано, что этими свойствами обладают по крайней мере четыре вещества: ацетилхолин, норадреналин, дофамин и серотонин. Норадреналин и дофамин составляют группу катехоламинов, а вместе с серотонином - группу моноаминов. Во многом известны процессы синтеза этих медиаторов, их хранения, высвобождения, метаболизма, инактивации, локализации, механизмов действия. Получено много данных о структурах-мишенях этих нейромедиаторов, их локализации, а также о естественных и фармакологических эффектах действия нейромедиаторов на эти структуры-мишени.
В зависимости от вида нейромедиаторов, синтезируемых и выделяемых предсинаптическими терминалями аксонов различают:
- холинергические нейроны, холинхолинергические предсинаптические терминали, холинергические синапсы.
- адренергические нейроны, адренергические предсинаптические терминали, адренергические синапсы.
- дофаминергические нейроны, дофаминенергические предсинаптические терминали, дофаминергические синапсы.
- серотонинергические нейроны, серотонинергические предсинаптические терминали, серотонинергические синапсы.
Аналогично именуются биохимические рецепторы постсинаптических мембран: холинергические (ацетилхолиновые) рецепторы, адренергические (норадреналиновые) рецепторы, дофаминергические (дофаминовые) рецепторы, серотонинергические (серотониновые) рецепторы.
2. Синтез и биологическая роль серотонина
Серотонин - нейромедиатор проводящих путей. Образуется в надпочечниках и ЦНС из аминокислоты 5-гидрокситриптофана в результате действия декарбоксилазы ароматических аминокислот. Этот фермент обладает широкой специфичностью и способен также декарбоксилировать триптофан и ДОФА, образующийся из тирозина. 5-Гидрокситриптофан синтезируется из триптофана под действием фенилаланингидроксилазы с коферментом Н4БП (этот фермент обладает специфичностью к ароматическим аминокислотам и гидроксидирует также фенилаланин).
Серотонин может превращаться в гормон мелатонин, регулирующий суточные и сезонные изменения метаболизма организма и участвующий в регуляции репродуктивной функции.
Серотонин - биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, оказывает сосудосуживающий эффект, регулирует АД, температуру тела, дыхание, обладает антидепрессантным действием. По некоторым данным он может принимать участие в аллергических реакциях, поскольку в небольших количествах синтезируется в тучных клетках.
3. Синтез и биологическая роль ацетилхолина
Ацетилхолин синтезируется в нервной ткани и служит одним из важнейших возбуждающих нейромедиаторов вегетативной нервной системы. Его предшественник - аминокислота серии:
4. Синтез и биологическая роль г-аминомасляной кислоты
В нервных клетках декарбоксилирование глутамата (отщепление б-карбоксильной группы) приводит к образованию г-аминомасляной кислоты (ГАМК), которая служит основным тормозным медиатором высших отделов мозга.
Цикл превращений ГАМК в мозге включает три сопряжённые реакции, получившие название ГАМК-шунта. Первую катализирует глутаматдекарбоксилаза, которая является пиридоксальзависимым ферментом. Эта реакция является регуляторной и обусловливает скорость образования ГАМК в клетках мозга. Продукт реакции - ГАМК. Последующие 2 реакции можно считать реакциями катаболизма ГАМК. ГАМК-аминотрансфераза, также пиридоксальзависимая, образует янтарный полуальдегид, который затем подвергается дегидрированию и превращается в янтарную кислоту. Сукцинат используется в цитратном цикле. Инактивация ГАМК возможна и окислительным путём под действием МАО.
Содержание ГАМК в головном мозге в десятки раз выше других нейромедиаторов. Она увеличивает проницаемость постсинаптических мембран для ионов К+, что вызывает торможение нервного импульса; повышает дыхательную активность нервной ткани; улучшает кровоснабжение головного мозга.
ГАМК в виде препаратов гаммалон или аминалон применяют при сосудистых заболеваниях головного мозга (атеросклероз, гипертония), нарушениях мозгового кровообращения, умственной отсталости, эндогенных депрессиях и травмах головного мозга, а также заболеваниях ЦНС, связанных с резким возбуждением коры мозга (например, эпилепсии).
5. Другие медиаторы ЦНС: глицин, глутамат
Свободные аминокислоты играют исключительно важную роль в головном мозге как предшественники белков и таких биологически активных веществ, как нейропептиды, гормоны, биогенные амины и др. Некоторые аминокислоты могут участвовать в синаптической передаче, выполняя функцию нейромедиаторов. Очень важна для головного мозга и энергетическая роль аминокислот. Содержание свободных аминокислот в головном мозге достигает ?35 мкмоль/г ткани, что значительно выше, чем в плазме крови (~3,5 мкмоль/л) и в спинномозговой жидкости. Преобладают глутаминовая кислота, глутамин, аспарагиновая кислота, глицин, ГАМК, N-ацетиласпартат и др. Аминокислоты глицин и глутамат - важнейшие нейромедиаторы.
Глутамат содержится в головном мозге в очень больших количествах (до -10 мкмоль/г ткани) и выполняет разнообразные функции:
- один из основных возбуждающих медиаторов в коре, гиппокампе, полосатом теле и гипоталамусе;
- участвует в регуляции процессов памяти;
- составная часть ряда малых и средних регуляторных пептидов мозга, таких как глутатион. В виде пироглутамата (циклическая форма) входит в целый ряд нейропепти-дов - люлиберин, тиролиберин, нейротен-зин, бомбезин и др.
- велика его энергетическая роль, так как глутамат служит поставщиком а-кетоглутарата - компонента цитратного цикла;
- участвует в обезвреживании аммиака с образованием глутамина, который в больших количествах поступает через мембраны в нейроны, где присутствует фермент глутаминаза. Под действием этого фермента вновь образуется глутамат, который используется для синтеза ГАМК. Учитывая, что биомембраны менее проницаемы для глутамата, чем для глутамина, его можно расценивать как глиально-нейрональный переносчик глутамата (а значит, и ГАМК).
Нарушение глутаматергической системы происходит при целом ряде патологических нарушений ЦНС: эпилепсии, расстройствах вестибулярной системы, ишемии и др. Глутамат и его аналоги используют как лекарственные средства при хронической недостаточности аминокислотного обмена, вегетрсосудистой дистонии, эпилепсии (в качестве предшественника ГАМК - тормозного медиатора).
Другая аминокислотанейромедиатор - глицин. Концентрация глицина в плазме крови невысока, поэтому в мозг поступают недостаточные количества этой аминокислоты. Значительная часть глицина синтезируется из глюкозы, которая поступает из крови.
Глицин - важнейший (после ГАМК) тормозной нейромедиатор в спинном мозге, промежуточном мозге и некоторых отделах головного мозга. Высокий уровень глицина в плазме крови и моче обычно свидетельствует о нарушении функций мозга.
Разрушение глицина может происходить тремя путями:
- глицина в серии под действием сериноксиметилтрансферазы;
- расщеплением глицина на аммиак, оксид углерода и метилен-Н4-фолат;
- окислением под действием оксидазы аминокислот (см. выше подраздел IV).
Гиперглицинемия развивается в раннем возрасте и сопровождается эпизодической рвотой, подавлением двигательной активности, нарушением электроэнцефалограммы и часто завершается летальным исходом. Гиперглицинемия может быть следствием нарушения обычных путей разрушения глицина в нервных клетках.
Литература
1. Биохимия: Учеб. Для вузов, Под ред. Е.С. Северина, 2003. 779 с.
2. И.В. Березин, Ю.В. Савин «Основы биохимии» Уч. Пособие.1990. 256 с.
3. Модификация: Koolman, Color Atlas of Biochemistry, 2nd ed., 2005, Thieme Medical Publishers, 2003, 476 p.
4. Ю.Б. Филлипович «Основы биохимии» 1990.
Подобные документы
Концентрация хлора внутри клетки, механизмы его переноса. Хлор-бикарбонатный обменник, калий-хлорный ко-транспорт. Механизмы накопления веществ, участвующих в синаптической передаче. Закачка медиатора в клетку. Молекулы переносчиков нейромедиаторов.
реферат [18,1 K], добавлен 24.10.2009
Гуморальная регуляция физиологических и биохимических процессов через жидкие среды организма. Синтез ацетилхолина. Виды холинорецепторов. Депонирование медиатора и хранение его в везикулах. Синтез медиатора в нервных окончаниях. Распад ацетилхолина.
презентация [1,2 M], добавлен 23.10.2013
Синтез серотонина и виды серотониновых рецепторов, их современная классификация. Связывающие свойства серотониновых рецепторов и их сопряжение с эффекторными системами клеток. Регуляция функций центральной нервной системы и периферических органов.
презентация [365,1 K], добавлен 23.10.2013
Свойства живого организма, основные положения клеточной теории. Осмотические активные вещества растительной клетки. Темновая стадия фотосинтеза, роль дыхания в обмене веществ растительного организма. Химическая природа и характер действия дегидрогеназ.
контрольная работа [58,0 K], добавлен 01.12.2011
Исследование нейрохимических и молекулярных механизмов нейрологической памяти. Пространственно-временная организация памяти, ее типы, информационная емкость, механизмы формирования, роль нейромедиаторов. Проблема переноса памяти, исследования МакКоннела.
курсовая работа [78,8 K], добавлен 27.08.2009
Органические вещества, предназначенные для управления функциями организма. Принцип действия гормонов. Воздействие на организм серотонина, мелатонина, адреналина, норадреналина, грелина, лептина, дофамина, эндорфина, эстрогена, прогестерона и тестостерона.
презентация [15,3 M], добавлен 15.12.2011
Понятие и структура белков, аминокислоты как их мономеры. Классификация и разновидности аминокислот, характер пептидной связи. Уровни организации белковой молекулы. Химические и физические свойства белков, методы их анализа и выполняемые функции.
Аминокислотные нейромедиаторы: кетоглутарат, глутамат, ГАМК
Аминокислотные нейромедиаторы: кетоглутарат, глутамат, ГАМК
Наиболее распространенный возбуждающий медиатор головного и спинного мозга — аминокислота L-глутамат. Значимый пример возбуждающих нейронов, использующих глутамат в качестве медиатора,— все нейроны, идущие от коры полушарий к белому веществу мозга, независимо от их направления в других частях коры полушарий, ствола или спинного мозга. Глутамат синтезируется из α-кетоглутарата, который, кроме того, служит субстратом для образования ГАМК.
ГАМК — самый распространенный в спинном и головном мозге тормозной медиатор, участвующий в работе приблизительно трети всех синапсов нервной системы. Миллионы ГАМКергических нейронов образуют основную часть вещества хвостатого и чечевицеобразного ядер, их также встречают в большом количестве в околоводопроводном сером веществе, гипоталамусе и гиппокампе. Кроме того, ГАМК выполняет функцию медиатора в крупных клетках Пуркинье, которые являются единственными клетками, выходящими из коры мозжечка. Аксоны клеток Пуркинье спускаются к зубчатому и другим ядрам мозжечка. ГАМК синтезируется из глутамата под действием фермента глутаматдекарбоксилазы.
Третий аминокислотный нейромедиатор — глицин. Глицин участвует в синтезе белков всех тканей организма и представляет собой простейшую аминокислоту, синтезируемую из серина в процессе катаболизма глюкозы. Этот нейромедиатор оказывает тормозное действие преимущественно в синапсах ассоциативных нейронов ствола мозга и спинного мозга.
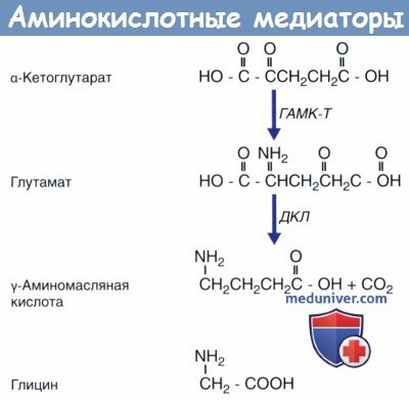
Три аминокислотных медиатора.
Глутамат синтезируется из а-кетоглутарата под действием фермента ГАМК-трансаминазы (ГАМК-Т);
γ-аминомасляная кислота (ГАМК) синтезируется из глутамата под действием декарбоксилазы глутаминовой кислоты (ДГК).
Глицин представляет собой простейшую аминокислоту.
а) Глутамат. Глутамат выполняет функцию нейромедиатора как в ионотропных, так и в метаботропных рецепторах. К ионотропным рецепторам относят АМРА-, каинат- и NMDA-рецепторы, которые получили свои названия благодаря активирующим их синтетическим агонистам: амино-метил-изоксазол-пропионовой кислоте, каинату и N-метил-D-аспартату, соответственно. Каинатные рецепторы редко встречаются изолированно; чаще всего они комбинируются с АМРА-рецепторами и входят в состав АМРА-каинатных (АМРА-К) рецепторов.
Ионотропные рецепторы глутамата. При активации АМРА-К-рецепторов на постсинаптической мембране происходят немедленное поступление большого количества ионов Na + в клетку и выход небольшого количества ионов К + из клетки, что приводит к формированию раннего компонента ВПСП нейрона-мишени, деполяризующего мембрану клетки-мишени от -65 мВ до -50 мВ. Этот процесс приводит к электростатическому «выталкиванию» катионов магния (Mg 2+ ), которые в состоянии покоя «закрывают» ионный канал NMDA-рецептора. Ионы Na+ проходят через ионный канал, происходит формирование потенциала действия.
Важно отметить, что ионы Са 2+ также проникают внутрь клетки и за счет продолжительного периода деполяризации, длительность которого достигает 500 мс от возникновения единичного потенциала действия, активируют Са 2+ -зависимые ферменты, способные изменять структуру клетки-мишени и даже количество ее синаптических контактов. Феномен синаптической пластичности в ответ на активацию рецепторов можно отчетливо проследить в экспериментальных исследованиях на культивируемых срезах гиппокампа крыс. Этот феномен считают основным механизмом развития кратковременной памяти. Например, анальгетик кетамин, блокирующий NMDA-каналы, помимо своего основного действия препятствует формированию памяти.
Характерная особенность многократно повторяющейся активации NMDA-рецепторов — долговременное потенцирование, проявляющееся возникновением ВПСП со значениями, превышающими нормальные показатели даже несколько дней спустя (см. далее — длительная депрессия).
Роль NMDA-рецепторов в развитии феномена глутаматной эксайтотоксичности подтверждена развитием ишемических инсультов у экспериментальных животных. Предполагают, что причиной гибели большого количества нейронов стало избыточное поступление ионов Са 2+ в клетку в ходе следующих событий: ишемия > избыточное поступление ионов Са 2+ в клетку > активация Са 2+ -зависимых протеаз и липаз > разрушение белков и липидов > гибель клетки. Назначение антагониста NMDA-рецепторов сразу же после первичного инсульта позволяет снизить тяжесть ишемического поражения мозга.
Метаботропные глутаматные рецепторы Выделяют более 100 различных метаботропных глутаматных рецепторов. Все метаботропные рецепторы — это внутренние мембранные белки, большинство которых располагается на постсинаптических мембранах и оказывает возбуждающее действие. Некоторые метаботропные рецепторы локализуются на пресинаптической мембране и являются тормозными ауторецепторами.
Ионотропные глутаматные рецепторы.
(1) При возникновении потенциала действия в области нервного окончания происходит (2) открытие кальциевых каналов (Ca 2+ ).
(3) Под влиянием ионов Ca 2+ синаптические пузырьки приближаются к плазматической мембране.
(4) Молекулы глутамата высвобождаются в синаптическую щель путем экзоцитоза.
(5) Медиатор связывается с AMPA-K-рецепторами, что вызывает открытие ионных каналов и поступление большого количества ионов Na + в клетку, а также выход небольшого количества ионов К + из клетки в результате чего (6) возникает возбуждающий постсинаптический потенциал (ВПСП), вызывающий деполяризацию значением 20 мВ, что делает возможной (7) активацию NMDA-рецептора глутаматом за счет «выталкивания» из ионного канала рецептора иона Mq24 Через канал NMDA-рецептора проникают ионы Na + и Са 2+ , что приводит к деполяризации клетки.
(8) ВПСП, генерированный NMDA-рецептором, достаточен для (9) усиления потенциалов действия с продолжительным периодом реполяризации за счет повышения внутриклеточной концентрации ионов Са 2+ . Лекарственные средства и ионотропный ГАМКA-рецептор. Зеленым цветом обозначено действие агонистов, красным цветом—действие антагониста.
Барбитураты, бензодиазепины и этанол вызывают гиперполяризацию клетки за счет воздействия на рецептор.
Бикукуллин—антагонист рецептора. Пикротоксин оказывает прямое действие, закрывая отверстие ионного канала. Глутаматергический и ГАМКергический синапсы мультиполярного нейрона с шипиковыми дендритами.
Продемонстрирована пространственная суммация возбуждений для каждой пары синапсов.
б) ГАМК. ГАМК-рецепторы могут быть как ионотропными, так и метаботропными.
1. Ионотропные ГАМК-рецепторы. Рецепторы, называемые ГАМКA, расположены в большом количестве в области лимбической доли головного мозга. Каждый рецептор связан с хлорным каналом. При активации ГАМКA-рецепторов хлорные каналы открываются, и ионы Cl- по градиенту концентрации поступают из синаптической щели в цитозоль. Причиной гиперполяризации, при которой достигаются значения -70 мВ и ниже, служит суммация последовательных ТПСП.
Действие седативных снотворных препаратов барбитуровой кислоты и бензодиазепина (например, диазепама) реализуется за счет активации ГАМКA-рецепторов. Аналогично действие этанола (потеря контроля социального поведения под влиянием действия этанола происходит вследствие растормаживания возбуждающих нейронов-мишеней, которые в обычном состоянии «сдерживаются» под действием ГАМКергических влияний). Механизм действия некоторых летучих анестетиков также заключается в связывании рецепторов, за счет чего ионные каналы остаются открытыми более долгое время.
Основной антагонист, занимающий активный центр рецептора, — конвульсант бикукуллин. Другой конвульсант — пикротоксин — связывается с субъединицами белка, в активном состоянии закрывающими ионный канал.
2. Метаботропные ГАМК-рецепторы. Метаботропные рецепторы, получившие название ГАМКВ, равномерно распределены во всех структурах мозга, их также обнаруживают в периферических вегетативных нервных сплетениях. Несмотря на то, что большое количество G-белков этих рецепторов выполняет роль вторичных посредников, значительная часть G-белков оказывает влияние на особый вид постсинаптических калиевых каналов — GIRK-каналы (G-белок-связанные калиевые каналы внутреннего выпрямления). При присоединении медиатора происходит отделение β-субъединицы, которая «выталкивает» ионы К + через GIRK-канал, что приводит к формированию ТПСП.
Ответная реакция этого вида рецепторов нейрона-мишени медленнее и слабее по сравнению с ионофорезом ГАМКA, и для их активации необходима стимуляция большей частоты. В связи с этим считают, что ГАМКA-рецепторы расположены не во внешнем слое синаптической щели, а внесинаптически. Это предположение может быть подтверждено наличием еще одного вида расположенных внесинаптически G-направленных каналов. Эти кальциевые каналы также потенциалозависимые и принимают участие в обеспечении клетки количеством ионов Са 2+ , необходимым для перемещения синаптических пузырьков через пресинаптическую мембрану. При активации G-Са 2+ -лигандного участка связывания происходит закрытие кальциевых каналов, что приводит к снижению влияния потенциала действия, а также к торможению исходного нейрона (источника возбуждения) и других прилежащих глутаматергических нейронов.
В некоторых случаях для лечения заболеваний, связанных с чрезмерным рефлекторным тонусом мышц (мышечная спастичность), применяют инъекции миорелаксанта баклофена (агониста ГАМКВ) в окружающее спинной мозг субарахноидальное пространство. Баклофен проникает в спинной мозг и ингибирует высвобождение глутамата из чувствительных нервных окончаний в основном за счет уменьшения поступления большого количества ионов Са 2+ в клетку, возникающего под влиянием потенциалов действия чрезмерной частоты.
Схема открытия GIRK-канала, расположенного на постсинаптической мембране, G-белком.
(А) Состояние покоя. (Б) ГАМК активирует рецептор, и βγ-субъединица G-белка перемещается по направлению к GIRK-каналу.
(В) βγ-субъединица вызывает высвобождение ионов К + , что приводит к гиперполяризации мембраны. Высвобождение медиатора и дальнейшие процессы, происходящие в ГАМКергическом нейроне.
(1) Связываясь с ГАМКA-рецепторами, медиатор вызывает гиперполяризацию мембраны нейрона-мишени за счет открытия хлорных (Cl - ) каналов.
(2) Аналогичное действие оказывают связывающиеся с GIRK рецепторы ГАМКВ за счет открытия G-белок-связанных калиевых каналов внутреннего выпрямления (GIRKS).
(3) При связывании ГАМКВ-ауторецепторов уменьшается высвобождение медиатора исходным нейроном за счет закрытия лиганд-G-белок-зависимых кальциевых (Са 2+ ) каналов.
(4) Связывание ГАМКВ-рецепторов соседнего глутаматергического нейрона оказывает аналогичное влияние, опосредованное действием ионов Са 2+ .
3. Обратный захват глутамата и ГАМК. Обратный захват глутамата и ГАМК происходит двумя путями. В левой части каждого рисунка показано, что некоторые молекулы медиатора захватываются из синаптической щели транспортными белками мембраны и помещаются обратно в синаптические пузырьки. В правых частях рисунков изображен захват молекул медиаторов прилежащими астроцитами. Находясь в астроците, глутамат под действием глутаминсинтетазы превращается в глутамин. В процессе последующего транспорта к синаптическому уплотнению глутамат достраивается под действием глутаминазы и помещается в синаптический пузырек. ГАМК превращается в глутамат под действием ГАМК-трансаминазы. В процессе транспорта глутамат трансформируется в глутамин под действием глутаминсинтетазы.
Вернувшись в область синаптического уплотнения, глутамин под действием глутаминазы превращается в глутамат, из которого под действием глутаматдекарбоксилазы синтезируется ГАМК, молекулы которой помещаются в синаптические пузырьки.
Блокирование фермента глутаматдекарбоксилазы лежит в основе известного аутоиммунного заболевания — синдрома «скованного человека».
Схема обратного захвата и повторного синтеза глутамата.
В левой части рисунка происходит обратный захват молекулы глутамата в неизменном виде.
В правой части рисунка (1) глутамат захватывается астроцитами, затем (2) под действием глутаминсинтетазы превращается в глутамин.
(3) Глутамин поступает в нервное окончание, (4) где под действием глутаминазы превращается в глутамат, который (5) возвращается в синаптические пузырьки. Схема обратного захвата и повторного синтеза ГАМК. В левой части рисунка происходит обратный захват молекулы ГАМК в неизменном виде.
В правой части рисунка ГАМК захватывается астроцитами, затем (1) под действием ГАМК-трансаминазы превращается в глутамат, который (2) под действием глутаминсинтетазы превращается в глутамин.
(3) Глутамин поступает в нервное окончание и под действием глутаминазы образует глутамат.
(4) Глутамат под действием глутаматдекарбоксилазы превращается в ГАМК, которая (5) возвращается в синаптические пузырьки.
г) Глицин. Глицин синтезируется из серина в процессе катаболизма глюкозы. Основная функция этого нейромедиатора — обеспечение отрицательной обратной связи двигательных нейронов ствола мозга и спинного мозга. При инактивации глицина (например, при отравлении стрихнином) возникают мучительные судороги.
Обратный захват. В области синаптического уплотнения при помощи аксональных белков-переносчиков осуществляется быстрый обратный захват глицина с последующим его помещением в синаптические пузырьки.
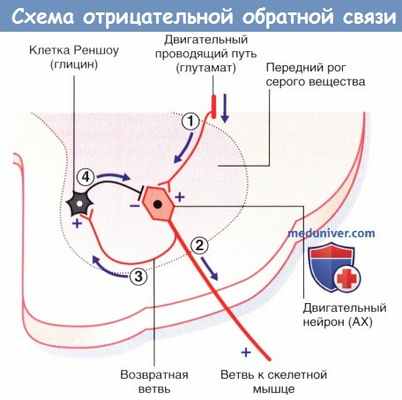
Схема отрицательной обратной связи: клетки Реншоу ингибируют избыточное возбуждение двигательных нейронов. АХ—ацетилхолин.
(1) Нейрон нисходящего двигательного проводящего пути оказывает возбуждающее действие на двигательный нейрон спинного мозга.
(2) Двигательный нейрон вызывает сокращение мускулатуры.
(3) Возвратная ветвь стимулирует клетку Реншоу.
(4) Клетка Реншоу оказывает ингибирующее влияние, достаточное для предупреждения чрезмерной активации двигательного нейрона.
Очень нервное возбуждение

Обзор
Автор
Редактор
Шестая (и последняя) статья цикла о нейромедиаторах будет посвящена глутамату. Это вещество больше знакомо нам как усилитель вкуса в продуктах, но оно играет важную роль в нашей нервной системе. Глутамат — это самый распространенный возбуждающий нейротрансмиттер в нервной системе млекопитающих вообще и человека в частности.
Молекулы и связи
Глутамат (глутаминовая кислота) является одной из 20 основных аминокислот. Кроме участия в синтезе белков он может выполнять функцию нейромедиатора — вещества, которое передает сигнал от одной нервной клетки к другой в синаптической щели. При этом нужно учитывать, что глутамат, который есть в пище, не проникает через гематоэнцефалический барьер, то есть не оказывает прямого влияния на мозг. Глутамат образуется в клетках нашего тела из α-кетоглутарата путем трансаминирования. Аминогруппа переносится с аланина или аспартата, заменяя кетоновый радикал α-кетоглутарата (рис. 1). В итоге мы получаем глутамат и пируват или щавелевоуксусную кислоту (в зависимости от донора аминогруппы). Два последних вещества участвуют во многих важных процессах: щавелевоуксусная кислота, например, — это один из метаболитов в великом и ужасном цикле Кребса. Разрушение глутамата происходит при помощи фермента глутаматдегидрогеназы, и в ходе реакции образуются уже знакомый нам α-кетоглутарат и аммиак.
У глутамата, как и у большинства других медиаторов, есть два типа рецепторов — ионотропные (которые открывают мембранную пору для ионов в ответ на присоединение лиганда) и метаботропные (которые при присоединении лиганда вызывают метаболические перестройки в клетке). Группа ионотропных рецепторов делится на три семейства: NMDA-рецепторы, AMPA-рецепторы и рецепторы каиновой кислоты. NMDA-рецепторы так называются, поскольку их селективным агонистом, веществом, избирательно стимулирующим эти рецепторы, является N-метил-D-аспартат (NMDA). В случае AMPA-рецепторов таким агонистом будет α-аминометилизоксазолпропионовая кислота, а каинатные рецепторы избирательно стимулируются каиновой кислотой. Это вещество содержится в красных водорослях и используется в нейробиологических исследованиях для моделирования эпилепсии и болезни Альцгеймера. В последнее время к ионотропным рецепторам стали также добавлять δ-рецепторы: они расположены на клетках Пуркинье в мозжечке млекопитающих. Стимуляция «классических» — NMDA-, AMPA- и каинатных — рецепторов приводит к тому, что калий начинает выходить из клетки, а кальций и натрий поступают в клетку. В ходе этих процессов в нейроне возникает возбуждение, и запускается потенциал действия. Метаботропные же рецепторы связаны с системой G-белков и участвуют в процессах нейропластичности [1]. Под нейропластичностью понимается способность нервных клеток образовывать новые связи друг другом или уничтожать их. Также в понятие нейропластичности включается способность синапсов изменять количество высвобождаемого нейромедиатора в зависимости от того, какие поведенческие акты и мыслительные процессы происходят в данный момент и с какой частотой.
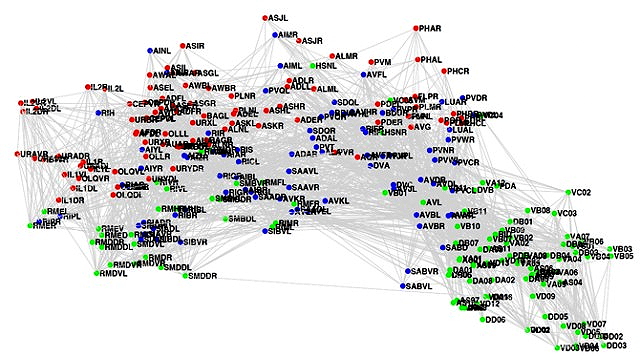
Глутаматная система неспецифична: на глутаминовой кислоте «работает» почти весь мозг. Прочие, описанные в предыдущих статьях, нейромедиаторные системы имели более или менее узкую специфику — например, дофаминовая влияла на наши движения и мотивацию [2]. В случае с глутаматом такого не происходит — слишком широко и неизбирательно его влияние на процессы внутри мозга. Сложно выделить какую-то конкретную функцию, кроме возбуждающей. По этой причине приходится говорить о глутаматной системе как о совокупности большого количества связей в головном мозге. Такую совокупность называют коннектомом. Мозг человека содержит огромное количество нейронов, которые образуют между собой еще большее количество связей. Составить коннектом человека — задача, которая на сегодняшний день науке не под силу. Однако уже описан коннектом червя Caenorhabditis elegans [3] (рис. 2). Поклонники идеи коннектома утверждают, что в человеческих коннектомах записана наша идентичность: наши личность и память. По их мнению, в совокупности всех связей прячется наше «Я». Также «связисты» считают, что после описания всех нейронных связей мы сможем понять причину множества психических и неврологических расстройств, а значит и сможем их успешно лечить.
Как мне кажется, эта идея перспективна. В упрощённом виде связи между нейронами можно представить в виде проводов, сложных кабелей, соединяющих одни нейроны с другими. При поражении этих связей — искажении сигнала, обрыве проводов — может происходить нарушение слаженной работы головного мозга. Такие болезни, возникающие при сбое в нейронных каналах связи, называются коннектопатиями. Термин новый, но за ним скрываются уже известные ученым патологические процессы. Если вам хочется узнать о коннектомах больше, рекомендую прочесть книгу Себастьяна Сеунга «Коннектом. Как мозг делает нас тем, что мы есть» [4].
Перегрузка сети
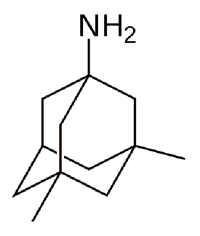
Рисунок 3. Структура мемантина. Мемантин является производным углеводорода адамантана (не путайте с адамантом). Рисунок из «Википедии».
В нормально работающем мозге сигналы от нейронов равномерно распределены по всем другим клеткам. Нейромедиаторы выделяются в необходимом количестве, и нет поврежденных клеток. Однако после инсульта (острое поражение) или при деменции (длительно текущий процесс) из нейронов в окружающее пространство начинает выделяться глутамат. Он стимулирует NMDA-рецепторы других нейронов, и в эти нейроны поступает кальций. Приток кальция запускает ряд патологических механизмов, что в итоге приводит к гибели нейрона. Процесс повреждения клеток за счет выделения большого количества эндогенного токсина (в данном случае — глутамата) называется эксайтотоксичностью.
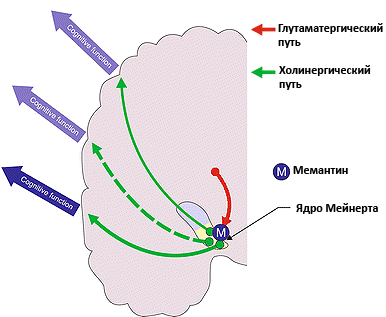
Рисунок 4. Действие мемантина при альцгеймеровской деменции. Мемантин снижает интенсивность возбуждающих сигналов, которые приходят от корковых нейронов на ядро Мейнерта. Ацетилхолиновые нейроны, составляющие эту структуру, регулируют внимание и ряд других когнитивных функций. Уменьшение избыточной активации ядра Мейнерта приводит к уменьшению симптомов деменции. Рисунок из [6].
Для того чтобы предотвратить развитие эксайтотоксичности или уменьшить ее влияние на течение болезни, можно назначить мемантин. Мемантин — очень красивая молекула-антагонист NMDA-рецепторов (рис. 3). Чаще всего этот препарат назначают при сосудистой деменции и деменции при болезни Альцгеймера. В норме NMDA-рецепторы заблокированы ионами магния, но при стимуляции глутаматом эти ионы высвобождаются из рецептора, и в клетку начинает проникать кальций. Мемантин блокирует рецептор и препятствует прохождению ионов кальция в нейрон — лекарство оказывает свое нейропротективное действие, снижая общий электрический «шум» в сигналах клетки. При альцгеймеровской деменции, помимо глутамат-опосредованных проблем, снижается уровень ацетилхолина — нейромедиатора, участвующего в таких процессах как память, обучение и внимание. В связи с этой особенностью болезни Альцгеймера психиатры и неврологи используют для лечения ингибиторы ацетилхолинэстеразы, фермента, который разрушает ацетилхолин в синаптической щели. Использование этой группы лекарств увеличивает содержание ацетилхолина в мозге и нормализует состояние пациента [5]. Специалисты рекомендуют совместное назначение мемантина и ингибиторов ацетилхолинэстеразы для более эффективной борьбы с деменцией при болезни Альцгеймера [6]. При совместном применении этих препаратов происходит воздействие сразу на два механизма развития болезни (рис. 4).
Деменция — это растянутое по времени поражение головного мозга, при котором гибель нейронов происходит медленно. А бывают заболевания, приводящие к быстрому и большому по объему поражению нервной ткани. Эксайтотоксичность — важный компонент повреждения нервных клеток при инсульте. По этой причине при нарушениях мозгового кровообращения применение мемантина может быть оправданно, однако исследования на эту тему только начинаются. В настоящее время есть работы, проведенные на мышах, где показано, что назначение мемантина в дозе 0,2 мг/кг в день уменьшает объем поражения мозга и улучшает прогноз инсульта [7]. Возможно, дальнейшие работы на эту тему позволят усовершенствовать терапию инсультов у людей.
Голоса в голове
Шизофрения — это еще одно заболевание, при котором воздействие на глутаматную систему мозга является новым и перспективным направлением терапии. В настоящее время главной причиной развития шизофрении считают нарушение дофаминовой передачи в мозге. Избыток дофамина в одних частях нервной системы приводит к бреду и галлюцинациям, а недостаток в других — к апатии, подавленности и отсутствию побуждений. Нейролептики — лекарства, блокирующие дофаминовые рецепторы — хорошо справляются с галлюцинациями и бредом, но с другой группой симптомов возникают проблемы. Ограниченность клинического эффекта нейролептиков указывает на то, что в развитие шизофрении могут быть вовлечены другие нейромедиаторные системы.
Если глутаматная система задействована при шизофрении, то можно проверить это даже на здоровых людях. Если здоровым испытуемым вводить препараты, блокирующие действие глутамата (кетамин, амфетамин), то у них развиваются симптомы шизофрении [8]. Введение кетамина больным шизофренией приводило к повторному возникновению психоза с повторением типичных для пациента симптомов, то есть кетамин вызывал не «просто психоз», а возвращал галлюцинации и бред, которые были раньше [9]. Это противоречие двух гипотез усложняет и без того непростую картину нейробиологических основ шизофрении. Психотическую симптоматику при введении кетамина можно объяснить его способностью влиять и на дофаминовые рецепторы. Другим объяснением может быть то, что дофаминовые и глутаматные нейроны способны оказывать влияние на полосатое тело. Эта часть мозга активно задействована в «производстве» галлюцинаций [10].
Самые частые галлюцинации у пациентов с шизофренией — слуховые: больной слышит «голоса» в своей голове. Голос может ругать, комментировать происходящее вокруг, в том числе и действия пациента. У одной из моих пациенток «голоса» читали вывески магазинов на улице, где она шла; другая услышала, как голос произнес: «Получишь пенсию, и пойдем в кафе». В настоящее время существует теория, объясняющая возникновение таких голосов. Представим, что пациент идет по улице. Он видит вывеску, а мозг автоматически «прочитывает» ее. При повышенной активности в височной доле, отвечающей за слуховое восприятие, у пациента возникают слуховые ощущения. Они могли бы подавляться за счет нормальной работы участков лобной коры, но этого не происходит из-за снижения их активности (рис. 5). Избыточная активность слуховой коры может быть вызвана гиперфункцией глутаматной (возбуждающей) системы или дефектом ГАМКергических структур, отвечающих за нормальное торможение в мозге человека. Вероятнее всего, недостаточная активность лобной доли в случае шизофрении также связана с нарушением нейромедиаторного баланса. Рассогласованность действий приводит к тому, что человек начинает слышать «голоса», которые явно соотносятся с окружающей обстановкой или передают его мысли. Очень часто свои мысли мы «проговариваем» в голове, что тоже может быть источником «голосов» в мозге человека, больного шизофренией [11].
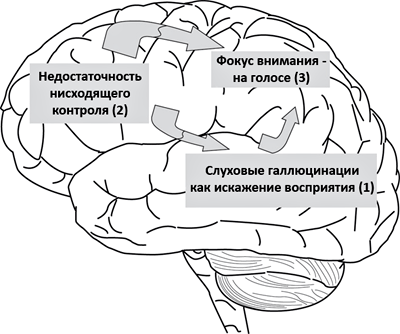
Рисунок 5. Возникновение слуховых галлюцинаций в мозге пациента с шизофренией. Первичное ощущение от автоматического «прочтения» вывесок или при возникновении мыслей, локализованное в височной коре (1), не подавляется лобной корой (2). Теменная кора (3) улавливает возникший паттерн активности в головном мозге и смещает на него фокус активности. В итоге человек начинает слышать «голос». Рисунок из [12].
На этом наше путешествие в мир нейромедиаторов закончено. Мы познакомились с мотивирующим дофамином, успокаивающей γ-аминомасляной кислотой и еще четырьмя героями нашего мозга. Интересуйтесь своим мозгом — потому что, как гласит название книги Дика Свааба, мы — это наш мозг.
Значение аминокислот глутаминовой группы в мозге:
Играют ключевую роль в метаболизме и обмене нейромедиаторов.
1. Глутамат является преобладающей АК в мозге; его концентрация достигает 5-10мМ.
Важнейшая функция глутамата – его участие в синтезе белков и биологически активных пептидов. Глутамат и глутамин составляют вместе до 10% аминокислотных остатков в гидролизате белков мозга.
2. Центральная роль глутамата в энергетическом метаболизме мозга частично объясняется большим числом реакций, связанных с соединениями ЦТК, что и позволяет считать его промежуточным продуктом энергетического метаболизма. Предшественником для синтеза глутамата в мозге является -кетоглутаровая кислота, которая превращается в глутамат путем восстановительного аминирования (при участии фермента глутаматдегидрогеназы) или переаминирования.
3. Обезвреживание аммиака в мозге не может идти поскольку в мозге не может идти в процессе мочевинообразования (мозг содержит все ферменты цикла мочевинообразования, кроме карбомоилфосфатсинтетазы, поэтому несмотря на наличие аргиназы синтез мочевины в мозге не идет), поэтому ключевую роль в обезвреживании аммиака в мозге выполняет глутамат. В ходе метаболизма аминокислот аммиак образуется в результате аденилатдезаминазной реакции. В этом цикле атом азота АК через систему глутамат-аспартат попадает в аденилат, который подвергается дезаминированию.
Большая часть аммиака используется для синтеза глутамата, а избыток азота удаляется из мозга системой глутамина. В головном мозге глутаматдегидрогеназная реакция осуществляет не столько окисление глутамата, сколько синтез его из -кетоглутарата, обеспечивая тем самым непрерывное включение свободного аммиака в аминокислоты. Глутаминсинтетаза катализирует превращение глутамата в глутамин, удаляя аммиак из ЦНС. Образование глутамина является важным механизмом детоксикации аммония, к которому мозг чрезвычайно чувствителен и накопление которого губительно для ЦНС. Фермент глутаминаза, дезаминирующая глутамин, наиболее активно в нейронах, где глутамин является главным предшественником глутамата и ГАМК. Таким образом, глутамин рассматривают и как систему транспорта глутамата в нейроны.
Основной путь окисление глутамата в мозге – через переаминирование, которое идет в митохондриях с образованием аспартата. По этому пути 90% глутамата в митохондриях подвергается переаминированию с образованием аспартата (аспартатаминотрансфераза). Взаимопревращения -кетоглутарата и глютамата в мозге обеспечивает функционирование и аспартат-малатного шунта – транспорт восстановительных эквивалентов из цитозоля в митохондрии. Глутамат в виде пироглутамата входит в состав некоторых нейропептидов: люлиберин, тиролиберин, нейротензин, бомбезин.
4. Важнейшей является нейротрансмиттерная (медиаторная) функция глутамата. Предшественником медиаторного пула глутамата являются глюкоза и -кетоглутарат, но главным источником служит глутамин (см. раздел «Биохимия синаптической передачи»
Таким образом, глутаминовая кислота выполняет чрезвычайно важную функцию, участвую в синтезе белков мозга, в энергетическом обеспечении головного мозга, которая заключается в поддержании метаболитов ЦТК на довольно высоком уровне, а также в снабжении митохондриальных синтетических процессов восстановительными эквивалентами, в процессах обезвреживания аммиака, в процессах синаптической передачи.
Одним из доминирующих компонентов пула свободных АК мозга является N-ациласпарагиновая кислота, которая образуется с участием ацетил-КоА и является источником ацетилированных концевых групп для синтеза определенных белков и пептидов мозга.
ГАМК является одним из главных компонентов пула АК головного мозга, продукт -декарбоксилирования глутаминовой кислоты. Цикл превращения ГАМК в головном мозге включает 3 сопряженные энзиматические реакции – ГАМК шунт, представляющий модификацию ЦТК:
При участии глутаматдекарбоксилазы (кофермент пиридоксальфосфат) отщепляется первый карбоксил глутаминовой кислоты с образованием гамма-аминомаслянной кислоты (ГАМК). Эта реакция лимитирует скорость синтеза ГАМК.
Второй фермент катаболизма ГАМК – ГАМК-трансаминаза (кофермент пиридоксальфосфат) осуществляет трансаминирование ГАМК с -кетоглутаратом. Реакция ведет к образованию янтарного полуальдегида и глутаминовой кислоты.
Конечный энзим ГАМК-шунта – дегидрогеназа янтарного полуальдегида – превращает последний в янтарную кислоту (сукцинат) – интермедиат ЦТК.
По этому альтернативному энергетическому пути может превращаться 10-20% альфа-кетоглутарата.
Метаболизм нуклеиновых кислот.
По сравнению с другими соматическими клетками организма крупные нервные клетки характеризуются самым высоким содержанием РНК, наиболее высокой скоростью образования нуклеиновых кислот. В процессе развития нервной клетки содержание РНК возрастает в основном за счет активного образования рибосомальной РНК в ядрышке. Одновременно увеличивается содержание белка.
Скорость метаболизма РНК зависит от характера функционирования нерва. Содержание РНК увеличивается после кратковременного интенсивного раздражения. После продолжительного раздражения содержание РНК снижается.
Синтез пиримидиновых нуклеотидов из СО2, NH3 и глутамина не может происходить в мозге из-за отсутствия карбамоилфосфатсинтетазы. В то же время здесь быстро превращается уридин в УМФ→УДФ→УТФ. В ткани мозга содержится полный набор ферментов для синтеза de novo пуринов. Все обычные пурины, пиримидины и соответствующие нуклеозиды могут проникать через ГЭБ и поступать в мозг.
Таким образом, большинство нейронов ЦНС являются диплоидными, небольшая доля нейронов в некоторых отделах ЦНС содержит избыточное по сравнению с диплоидным количество ДНК. Репликативный синтез ДНК в дифференцированных нейронах отсутствует. Репликация ДНК в мозге связана с размножением глиальных клеток. В клетках мозга активно работает система репарации ДНК, поддерживая целостность и эффективность генетического аппарата. В мозге экспрессируется огромное количество генов, обеспечивающих синтез разнообразных белков и нейропептидов в мозге.
Метаболизм липидов.
Нервная ткань характеризуется высоким содержанием и необычной гетерогенностью липидов, что существенно отличает ее от других тканей.
Для нервной ткани характерно наиболее высокое по сравнению с другими тканями содержание липидов - до 50% от сухой массы ткани. Отмечается огромное разнообразие и присутствие специфических только для мозга липидов. Фосфолипиды нервной ткани составляют до 70% суммарного содержания липидов в сером веществе и до 45-50% - в белом веществе мозга. На долю холестерина приходится 25% от суммарного содержания липидов.
Для нервной ткани характерно наличие специфических липидов: ганглиозидов, галактоцереброзидов, полифосфоинозитидов, которые в других тканях либо отсутствуют, либо обнаруживаются в незначительных количествах.
Имеющиеся в мозге в большом количестве липиды находятся в клеточных и субклеточных мембранах нейронов, в миелиновых оболочках. Липиды серого вещества мозга являются компонентами мембран нейронов, глии. В белом веществе липиды входят в состав отростков нейронов, мембран глии, миелина. Отмечается постоянство состава липидов мозга, что позволяет полагать, что скорость их обновления низка. Метаболизм холестерина, цереброзидов, ГФЛ и сфингомиелина протекает в мозге медленно. Вместе с тем фосфатидилхолин и фосфатидилинозитолы обновляются быстрее. С возрастом в мозге падает способность с синтезу ХС через снижение активности ГМГ-КоА-редуктазы (3-гидрокси3-метилглутарил-СоА). В основном ХС находится в неэстерифицированном состоянии. Эфиры ХС обнаруживаются в относительно высоких концентрациях в участках активной миелинозации. Пути синтеза фосфоглицеридов сходны с другими тканями.
Содержание свободных жирных кислот в липидах нервной ткани отличается большим разнообразием (более 50 кислот с длиной цепи от 12 до 26 углеродных атомов). Основную массу ВЖК составляют пальмитиновая, стеариновая, олеиновая и арахидоновая кислоты.
Мозг человека содержит около 120 г миелина (1/3 его сухой массы). Миелин, составляющий миелиновую оболочку - высокоорганизованная многослойная структура, состоящая из модифицированной и растянутой плазматической мембраны олигоденроглии, обеспечивает проведение импульсов в аксоне с минимальной затратой энергии. В состав миелина входит: белок - 15-30%, липиды - 70-85%, из них холестерин - 25-30%, галактолипиды - 27-30%, фосфолипиды - 41-45%, отличается низким содержание воды. Специфическими липидными компонентами миелина являются цереброзиды и сульфоцереброзиды
Особенностью нервной ткани является наличие на внешней зоне мембран специфических липидов - ганглиозидов. Ганглиозиды - кислые гликолипиды (гликосфинголипиды, содержащие сиаловую кислоту) в высоких концентрациях находятся в нервной ткани на поверхности наиболее возбудимых мембран. Функциональная роль этих специфических липидов проявляется в связывании различных катионов (Na, K, Ca), в процессах адгезии, рецепции, иммуноспецифичности.
Цикл глутамат-глутамин
Цикл глутамат-глутамин в биохимии представляет собой последовательность событий с помощью которого в центральной нервной системе поддерживается достаточное количество нейротрансмиттера глутамата. Нейроны не могут синтезировать возбуждающие нейротрансмиттер глутамат или ингибирующий ГАМК из глюкозы. Открытие пулов глутамата и глутамина в межклеточных компартментах привело к предположению о том, что цикл глутамат-глутамин работает между нейронами и астроцитами. Цикл глутамат / ГАМК – глутамин - это метаболический путь, который описывает высвобождение глутамата или ГАМК из нейронов, которые затем поглощаются астроцитами (ненейрональные глиальные клетки ). В свою очередь, астроциты выделяют глутамин, который поглощается нейронами для использования в качестве предшественника синтеза глутамата или ГАМК.
Содержание
- 1 Производство
- 1,1 Глутамат
- 1,2 ГАМК
- 2.1 Транспортировка и детоксикация
- 2.2 Аминокислотные шаттлы и перенос аммиака
- 2.2.1 Лейцин
- 2.2.2 Аланин
Производство
глутамата
Первоначально в глутаматергическом синапсе глутамат нейротрансмиттера высвобождается из нейронов и попадает в синаптическую щель. Глутамат, находящийся в синапсе, должен быть быстро удален одним из трех способов:
- захват в постсинаптический отсек,
- повторный захват в пресинаптический отсек или
- захват третьим, ненейрональный компартмент.
В ГАМКергических синапсах цикл называется ГАМК-глутаминовым циклом. Здесь глутамин, поглощаемый нейронами, превращается в глутамат, который затем метаболизируется в ГАМК глутаматдекарбоксилазой (GAD). После высвобождения ГАМК поглощается астроцитами через транспортеры ГАМК, а затем катаболизируется в сукцинат за счет совместного действия ГАМК трансаминазы и сукцинат-полуальдегиддегидрогеназа. Глутамин синтезируется из сукцината посредством цикла TCA, который включает реакцию конденсации оксалоацетата и ацетил-CoA -образующего цитрата. Затем происходит синтез α-кетоглутарата и глутамата, после чего глутамат снова метаболизируется в ГАМК с помощью GAD. Поставка глутамина в ГАМКергические нейроны менее значительна, потому что эти нейроны демонстрируют большую долю обратного захвата высвобожденного нейромедиатора по сравнению с их глутаматергическими аналогами
гомеостаз аммиака
Одна из проблем обоих глутамат-глутаминовый цикл и ГАМК-глутаминовый цикл - это аммиак гомеостаз. Когда одна молекула глутамата или ГАМК превращается в глутамин в астроцитах, одна молекула аммиака абсорбируется. Кроме того, для каждой молекулы глутамата или ГАМК, циклически поступающей в астроциты из синапса, в нейронах будет вырабатываться одна молекула аммиака. Этот аммиак, очевидно, должен будет транспортироваться из нейронов обратно в астроциты для детоксикации, поскольку повышенная концентрация аммиака пагубно влияет на ряд клеточных функций и может вызвать целый спектр нейропсихиатрических и неврологических симптомов (нарушение памяти, снижение внимания продолжительность сна, инверсия сна и бодрствования, отек мозга, внутричерепная гипертензия, судороги, атаксия и кома).
Транспортировка и детоксикация
Это может происходить двумя разными способами: сам аммиак может просто диффундировать (как NH3) или транспортироваться (как NH4 +) через клеточные мембраны во внеклеточное пространство и из него, или можно использовать челночную систему, включающую молекулы-носители (аминокислоты ). Конечно, аммиак может диффундировать через липидные мембраны, и было показано, что аммиак может переноситься с помощью ко-переносчиков K + / Cl-.
Аминокислотные челноки и перенос аммиака
Поскольку диффузия и транспорт свободного аммиака через клеточную мембрану будет влиять на уровень pH клетки, более привлекательный и регулируемый способ транспортировки аммиака между нейронами и астроцитарным компартментом - через аминокислотный челнок, которых два: лейцин и аланин. Аминокислота движется в направлении, противоположном глутамину. В направлении, противоположном аминокислоте, транспортируется соответствующая молекула; для аланина эта молекула представляет собой лактат ; для лейцина α-кетоизокапроат.
лейцин
Аммиак, фиксированный как часть ферментативной реакции глутаматдегидрогеназы в нейронах, трансаминируется в α-кетоизокапроат с образованием разветвленных - аминокислота цепи лейцин, которая экспортируется в астроциты, где процесс обратный. α-кетоизокапроат транспортируется в другом направлении.
Аланин
Аммиак, продуцируемый в нейронах, фиксируется в α-кетоглутарат в результате реакции глутамат-дегидрогеназы с образованием глутамата, затем трансаминируется аланинаминотрансферазой в пируват, полученный из лактата, с образованием аланина, который экспортируется в астроциты. Затем в астроцитах этот процесс меняется на противоположный, и лактат транспортируется в другом направлении.
Заболевания и состояния
Было опубликовано множество отчетов, указывающих на то, что цикл глутамат / ГАМК-глутамин нарушается при различных неврологических расстройствах и состояниях. Биопсия склеротической ткани гиппокампа людей, страдающих эпилепсией, показала снижение цикла глутамат-глутамин. Другая патология, при которой цикл глутамат / ГАМК-глутамин может быть нарушен, - это болезнь Альцгеймера ; ЯМР-спектроскопия показала снижение активности нейротрансмиссии глутамата и частоту циклов ТСА у пациентов, страдающих болезнью Альцгеймера. Гипераммонемия в головном мозге, обычно возникающая как вторичное осложнение первичного заболевания печени и известное как печеночная энцефалопатия, представляет собой состояние, которое влияет на цикл глутамата / ГАМК-глутамина в головном мозге. Текущие исследования аутизма также указывают на потенциальную роль глутамата, глутамина и / или ГАМК при расстройствах аутистического спектра.
Возможные мишени для лекарственных препаратов
При лечении эпилепсии, были проданы лекарственные средства, такие как вигабатрин, которые нацелены как на транспортеры ГАМК, так и на метаболизирующий фермент ГАМК ГАМК-трансаминазу, что доказывает принцип использования систем цикла нейромедиаторов в качестве фармакологических мишеней. Однако, что касается транспорта и метаболизма глутамата, таких лекарств не было разработано, потому что глутаматергические синапсы многочисленны, а глутамат нейротрансмиттера является важным метаболитом в метаболизме, что делает помехи способными к побочным эффектам. До сих пор большая часть разработок лекарств, направленных на глутаматергическую систему, по-видимому, была сосредоточена на ионотропных рецепторах глутамата в качестве фармакологических мишеней, хотя рецепторы, сопряженные с G-белком, привлекают повышенное внимание. лет.
Читайте также:
