Атипичная гиперплазия эндометрия матки. Аденокарцинома in situ матки.
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
Патологические состояния эндометрия, имеющие значение для онкологической клиники, классифицируются следующим образом [Бохман Я. В., 1985]:
I. Фоновые процессы: железистая гиперплазия, эндометриальные полипы.
II. Предраковое заболевание: атипическая гиперплазия.
III. Рак: аденокарцинома, аденоакантома (аденоакантокарцинома), светлоклеточная мезонефроидная аденокарцинома, железисто - плоскоклеточный (мукоэпидермоидный) рак, недифференцированный рак.
Согласно классификации ВОЗ, аденокарциномы эндометрия в зависимости от степени гистологической дифференцировки делят на высокодифференцированные (G1), умеренгодифференцированные, в том числе железисто-солидный рак (G2) и низкодифференцированные (G3). Учитывая существенные различия клинического течения и гормоночувствительности умереннодифференцированного и железисто-солидного рака, мы предпочитаем разделять аденокарциному эндометрия в соответствии с четырьмя степенями дифференцировки: высокодифференцированная, умереннодифференцированная, железисто-солидная и низкодифференцированная.
В литературе применяется множество синонимов гиперпластических процессов и РЭ, что создает путаницу и приводит к непониманию между морфологом и клиницистом. Так, эндометриальный полип нередко обозначается как «аденоматозный полип», а железистая гиперплазия эндометрия - как «аденоматозная гиперплазия». Это может ввести лечащего врача в заблуждение, так как термин «аденоматоз» ранее широко применялся для обозначения атипической гиперплазии эндометрия. Наиболее выраженные формы АГЭ принято обозначать термином «Са in situ», что отображает биологическую сущность этого процесса.
Железистая гиперплазия эндометрия (ЖГЭ) часто определяется у больных с ановуляторными маточными кровотечениями. Мы не усматриваем существенных различий между железистой и железисто-кистозной гиперплазией, так как кистозное расширение желез не свидетельствует о степени выраженности патологического процесса. Важнее разделить ЖГЭ в зависимости от степени пролиферативных изменений. В связи с этим случаи резкого кистозного расширения желез, выстланных атрофическим эпителием, следует относить не к гиперплазии, а к железисто-кистозной атрофии эндометрия. И наоборот, если железы и строма находятся в состоянии пролиферации, то это истинный гиперпластический процесс, надежный маркер ановуляции и гиперэстрогении.
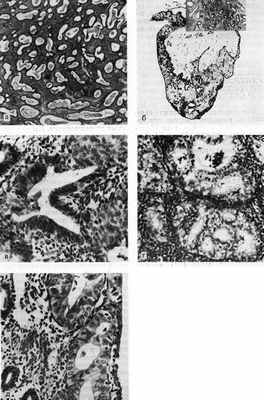
Гиперпластические процессы эндометрия:
а — железистая гиперплазия эндомитрия. х 90; б — гистотонограмма железисто-фиброзного полипа. х 120); в — атипическая гиперплазия эндометрия. x 80; г — атипическая гиперплазия зндометрия. х 50; д — атипическая гиперплазия эндометрия. Выраженная клеточная атипия. х 80
Полипы эндометрия развиваются вследствие пролиферации желез базального слоя эндометрия. Непременное анатомическое свойство полипов — наличие ножки, состоящей из фиброзной и гладкомышечной ткани. Признак «органоидности» отличает полип от полиповидной формы ЖГЭ, которую иногда неточно обозначают как «полипоз эндометрия». Полипы чаще располагаются в области дна и трубных углов матки.
Железы в полипе располагаются неравномерно, беспорядочно. Если они выстланы высокопризматическим эпителием пролиферативного типа, то реагируют на эстрогенную стимуляцию и действие прогестерона подобно нормальному или гиперплазированному эндометрию. Полипы, строма которых резко фиброзирована, а железы выстланы низкопризматическим эпителием, чаще гормононезависимы. Иногда в железах, выстилающих полип, находят атипию эпителии, которая соответствует изменениям при АГЭ. В этих случаях неверно пользоваться устаревшим термином «аденоматозный полип», нужно указывать на атипическую гиперплазию в полипе. Эндометриальные полипы малигнизируются так же редко (2—5%), как и ЖГЭ, но в постменопаузе указанная частота достигает 10%.
Атипическая гиперплазия
Макроскопическая картина АГЭ нехарактерна: она может быть обнаружена как в утолщенном (гиперплазированием), так и в истонченном (атрофическом) эндометрии и в полипах.
Атипия может быть выражена в форме и расположении желез - в этом случае ее обозначают как структурную. Если же атипия отмечается в клетках эпителия желез и строме, она называется клеточной. Принято делить АГЭ на локальную и диффузную. Микроскопическая картина АГЭ характеризуется рядом признаков, варьирующих в зависимости от степени ее выраженности. Постоянно отмечается значительное преобладание железистых элементов над стромальными, чего не бывает при ЖГЭ. Но при АГЭ цитогенная строма между атипическими железами всегда сохранена, что отличает ее от высокодифференцированной аденокарциномы. Для всех степеней АГЭ типично очень тесное расположение желез с узкими прослойками желез между ними.
Железы расположены хаотично, крайне разнообразны по размерам и форме, в их просвет часто выступают сосочки. Отдельные железы с выростами, направленными в окружающую строму, напоминают листья клевера. При выраженной АГЭ железы имеют причудливую и уродливую форму, видны структуры «железа в железе». Выстилающий железы эпителий состоит из крупных клеток с бледной эозинофильной цитоплазмой. Ядра полихромны, при выраженных формах — бледные, полиморфные, отмечается многоядерность. Выделяют 3 формы АГЭ: слабую, умеренную и тяжелую [Ferenzy, Gelfand, 1987].
Дискуссионным остается вопрос о правомерности диагноза «Са in situ эндометрия». С точки зрения биологического поведения, тяжелая АГЭ эквивалентна современным представлениям о преинвазивном раке. Но гистологический диагноз «Са in situ» при исследовании соскобов проблематичен, так как тяжелую АГЭ иногда трудно отличить от высокодифференцированной аденокарциномы. Особенно сложно судить об инвазии стромы эндометрия, так как для инвазивного рака характерен рост желез вместе с базальными мембранами. Надежной линией демаркации между «Са in situ» эндометрия и инвазивным раком служит обнаружение при последнем инвазии в миометрий. Herlig (1974) наблюдал развитие рака в 26,7% случаен слабой и в 81,8% — умеренной АГЭ. Во всех 18 наблюдениях тяжелой формы АГЭ, которую он обозначает как «Са in situ», отмечена прогрессия в инвазивный рак.
По сводным данным литературы, прогрессия АГЭ в инвазивный рак отмечается в 20—50% наблюдений (в среднем в 40%) на протяжении от одного года до 13 лет, что определяет необходимость ее выявления и безотлагательного лечения.
Атипичная гиперплазия эндометрия матки. Аденокарцинома in situ матки.
Атипичная гиперплазия эндометрия матки. Аденокарцинома in situ матки.
Гиперплазия базального слоя (базальная гиперплазия) эндометрия — редкий вариант гиперплазии, встречающийся преимущественно после 35 лет, чаще имеет очаговый характер. Гиперплазированный утолщенный базальный слой имеет густую строму, в которой лежат клубками кровеносные сосуды с утолщенными склерозированными стенками.
При данной патологии отмечают замедленное отторжение части гиперплазированного базального слоя эндометрия, и потому для нее характерны длительные, обильные и болезненные менструации. При подозрении на замедленное отторжение эндометрия диагностическое выскабливание его рекомендуется делать на 6—7-й день менструальной фазы.
Малигннзация рассмотренных вариантов гиперплазии явление исключительно редкое, и нет оснований относить указанные процессы к предраку.
Атипическая гиперплазия и очаговый аденоматоз, как и аденоматозные полипы, относятся к предраковым процессам. Предрак эндометрия встречают в любом возрасте, чаще до 50 лет. Клинически проявляется, почти как правило, ановуляторными кровотечениями.
Атипическая гиперплазия (диффузный аденоматоз, атипическая железистая гиперплазия) функционального и/или базального слоя эндометрия в отличие от железистой гиперплазии, подобно аденоматозным полипам, характеризуется более выраженными пролиферативными процессами эпителиального компонента. В практике патологоанатома чаще обнаруживают очаговые разрастания с интенсивной пролиферацией желез и/или их эпителия (очаговый аденоматоз).
Очаговый аденоматоз обычно встречают на фоне железистой или железисто-кистозной гиперплазии, реже в полипах или в малоизмененном эндометрии.
Различия предраковых изменений в структурном отношении и в отношении степени риска малигнизации служат основой для выделения нерезкой и выраженной форм. Данную работу на высоком уровне выполняют гистологи Казани, поэтому работа в патологистолических отделениях больниц считается перспективной работой. Нерезкая форма предрака характеризуется наличием многочисленных мелких и более крупных желез, которые разделены сравнительно тонкими прослойками стромы. Цилиндрический эпителий нередко многорядный, ядра его чаще всего гиперхромны, палочковидной и овоидной формы.
Аналогичный эпителий имеется в расширенных и кистозно-измененных железах; уплощения эпителия в этих железах, как это наблюдают при железисто-кистозной гиперплазии, не отмечается. При выраженной форме предрака много ядерный железистый эпителий отличается некоторым полиморфизмом, образованием папиллоподобных выростов, направленных в просветы желез. Просветы желез обычно узкие. Железы иногда настолько тесно расположены друг к другу, что строма между ними практически отсутствует. В крупных ядрах железистого эпителия нередко обнаруживают мелкие ядрышки.
Термин «аденокарцинома in situ» (преинвазивная карцинома, нулевая стадия рака) эндометрия следует оценивать критически. Критерии для постановки такого диагноза на основании исследования соскоба эндометрия отсутствуют в отличие от хорошо известных критериев преинвазивпой карциномы шейки матки. Неудачен и термин «аденоакантома in situ», используемый по отношению к выраженной форме предрака эндометрия с участками плоскоклеточной метаплазии различной формы и величины.
Строма предрака нередко богата клетками; в некоторых наблюдениях среди них обнаруживают в разном количестве крупные пенистые светлые клетки, содержащие липиды. Существует мнение, что эти клетки (они могут встречаться в строме рака и при различных гиперпластических процессах, но чаще при предраке) содержат вещества эстрогенной природы. Неблагоприятная прогностическая роль их (чем больше таких клеток, тем быстрее развивается рак) не доказана. Эти клетки следует отличать от пенистых клеток (гисгиоцитов), содержащих гемосидерин и выполняющих роль макрофагов.
Развитие рака на фоне предракового процесса наблюдают в 12—14%. В трудных случаях дифференциальной диагностики отдельных форм предрака и рака эндометрия следует рекомендовать повторное его диагностическое выскабливание. В дифференциальной диагностие учитывают атипические изменения железистого эпителия, наблюдаемые во время беременности-— феномен Ариас-Стеллы.
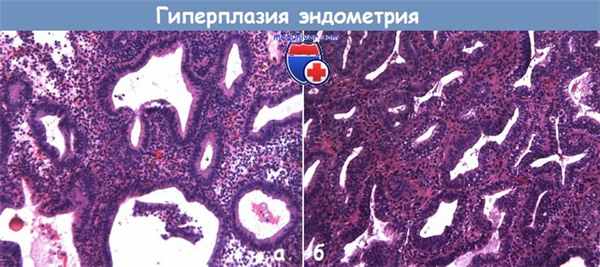
а - простая гиперплазия без атипии: эндометрий утолщен за счет железистого эпителия, что вызвано воздействием только эстрогенов, без прогестерона.
Железы характеризуются неравномерными, зачастую непредсказуемыми, очертаниями.
Строма обильная, поэтому соотношение железистая/стромальная ткань мало отличается от нормального.
Окраска гематоксилином и эозином, х10
б - сложная гиперплазия без атипии: соотношение железистая/стромальная ткань увеличено, при этом железы расположены тесно, имеют сложное строение, просветы часто неправильной формы.
Атипия ядер выражена незначительно. Окраска гематоксилином и эозином, х20
- Вернуться в оглавление раздела "гистология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Диагностика и тактика ведения больных с гиперпластическим процессом в эндометрии в постменопаузальном периоде
Диагностика имеет важное значение. Современные методы визуализации позволяют точно определить характер паталогии и ее расположение в тканях организма. Наиболее точная диагностика рака выполняется с помощью ПЭТ КТ исследования.
В обзоре литературы обобщены данные исследований, свидетельствующих о большой медико-социальной значимости гиперплазии эндометрия. Особое внимание уделено особенностям диагностики и первичной профилактики рака органов репродуктивной системы в постменопаузе.
Проблема ранней диагностики гиперпластических заболеваний и рака эндометрия остается одной из наиболее актуальных в современной медицине, поскольку наблюдается неуклонный рост их числа у женщин в постменопаузе [1, 2, 10, 14, 18].
В настоящее время установлено, что в большинстве случаев рак эндометрия является вторичным и возникает вследствие злокачественной трансформации доброкачественных новообразований эндометрия. Так, Г.М. Савельева и В.Н. Серов [12] наблюдали переход доброкачественных новообразований эндометрия в рак у 79% женщин, Я.В. Бохман [1] - у 73%. Поэтому для его профилактики основное внимание должно быть сосредоточено в первую очередь на диагностике доброкачественных новообразований эндометрия.рак эндометрия.
В постменопаузе наблюдается большой спектр внутриматочной патологии: полипы эндометрия (55,1%), железистая гиперплазия (4,7%), атипическая гиперплазия (4,1%), аденокарцинома эндометрия (15,6%), атрофия эндометрия при кровяных выделениях (11,8%), субмукозная миома матки (6,5%), аденомиоз (1,7%), эндометриальная саркома (0,4%).
Классификация патологических состояний эндометрия [Бохман Я.В., 1985].
- Фоновые процессы: железистая гиперплазия, эндо-метриальные полипы.
- Предраковые заболевания: атипическая гиперплазия эндометрия (АГЭ).
- Рак эндометрия.
Железистая гиперплазия эндометрия
Железистая гиперплазия эндометрия (ЖГЭ) часто определяется у больных с ановуляторными маточными кровотечениями. Железистая и железисто-кистозная гиперплазия - по существу равнозначные процессы. Различие между ними состоит в наличии кистозно-расширен-ных желез при железисто-кистозной форме гиперплазии и отсутствии кист при железистой гиперплазии. Расширение просвета желез (без образования кист) наблюдается и при ЖГЭ. Поэтому считают, что принципиальной разницы между указанными видами гиперплазии не существует.
Важнее разделить ЖГЭ в зависимости от степени пролиферативных процессов. В связи с этим случаи резкого кистозного расширения желез, выстланных атрофи-ческим эпителием, следует относить не к гиперплазии, а к железисто-кистозной атрофии эндометрия. И, наоборот, если железы и строма находятся в состоянии пролиферации, то это истинный гиперпластический процесс, надежный маркер ановуляции и гиперэстрогении.
Эндо-метриальные полипы
Полипы эндометрия развиваются вследствие пролиферации желез базального слоя эндометрия. Полипы имеют ножку, состоящую из фиброзной и гладкомышеч-ной ткани, чаще располагаются в области дна и трубных углов матки. Различают следующие формы полипов эндометрия: железистые, железисто-фиброзные и фиброзные. Если железы полипа выстланы высокопризматическим эпителием пролиферативного типа, то они реагируют на эстрогенную стимуляцию и действие прогестерона подобно нормальному или гиперплазированному эндометрию.
Полипы с фиброзированной стромой, с железами, выстланными низкопризматическим эпителием, чаще гормононезависимы. Если в железах полипа находят ати-пию эпителия, следует ставить диагноз не аденоматозного полипа, а атипической гиперплазии в полипе [1]. Малигнизация эндометриальных полипов составляет 2-5%, но в постменопаузе число случаев малигнизации достигает 10%.
Aтипическая гиперплазия эндометрия
АГЭ может развиваться как в утолщенном (гиперпла-зированном), так и в истонченном (атрофическом) эндометрии и в полипах. Атипия может быть структурной, если она выражена в форме и расположении желез, а также клеточной, если она отмечается в клетках эпителия желез и стромы. АГЭ может быть локальной и диффузной. Микроскопическая картина АГЭ варьирует в зависимости от степени ее выраженности. Постоянно отмечается значительное преобладание железистых элементов над стро-мальными, чего не бывает при ЖГЭ. Но при АГЭ цитогенная строма между атипическими железами всегда сохранена, что отличает ее от высокодифференцированной аденокарциномы.
Выделяют 3 формы АГЭ: слабую, умеренную, тяжелую. Дискуссионным остается вопрос о правомерности диагноза «carcinoma in situ» эндометрия [7, 9, 14]. С точки зрения онкологов, тяжелая АГЭ эквивалентна современным представлениям о преинвазивном раке. Но гистологический диагноз «carcinoma in situ» при исследовании со-скобов проблематичен, так как тяжелую АГЭ трудно отличить от высокодифференцированной аденокарцино-мы. A. Hertig (1974) наблюдал развитие рака в 26,7% случаев слабой и в 81,8% умеренной АГЭ. Во всех случаях тяжелой формы АГЭ, которую он обозначал как carcinoma in situ», отмечено прогрессирование в инвазивный рак. По данным литературы [14, 17, 19], прогрессирование АГЭ в инвазивный рак отмечается в 20-50% наблюдений (в среднем 40%) на протяжении от 1 года до 13 лет, что определяет необходимость ее выявления и безотлагательного лечения.
Диагностика
В постменопаузе гиперпластические процессы в эндометрии (как доброкачественные, так и злокачественные) могут клинически проявляться кровяными выделениями из половых путей, контактными кровотечениями, но нередко протекают бессимптомно. Последнее служит предпосылкой для поздней диагностики предраковых и раковых процессов в эндометрии. При гинекологическом исследовании в начальных стадиях заболевания патологических изменений половых органов не наблюдается. По мере прогрессирования процесса отмечается небольшое увеличение размеров матки и ее более плотная консистенция. В дальнейшем присоединяется увеличение яичников с обеих сторон (кистозное их изменение). Иногда возникают гормонально-активные опухоли яичников. Инструментальная диагностика названных заболеваний достаточно сложна и точность выявления патологии эндометрия колеблется от 52 до 89% [2, 4, 5, 16]. Поэтому нередко имеет место неадекватная терапия и наблюдается высокая частота рецидивов заболеваний. В распоряжении клиницистов нет объективных, высокоинформативных, неин-вазивных методов, позволяющих своевременно диагностировать переход доброкачественного процесса в злокачественный. В связи с этим значительно возросло число больных раком эндометрия, которые ошибочно лечились по поводу гиперпластической патологии эндометрия.
Решающим методом диагностики патологических состояний эндометрия является гистологическое изучение полного его соскоба, позволяющее определить характер морфоструктурных изменений. Тем не менее нередко возникает необходимость в доклинической диагностике гиперпластических процессов и рака эндометрия с использованием относительно простых и неинвазивных методик.
Ультразвукова диагностика
Таким образом, представленные данные свидетельствуют, что ультразвуковая диагностика ранних стадий рака эндометрия на данном этапе развития этого метода представляет значительные трудности. В настоящее время не вызывает сомнений, что гистероскопия представляет наиболее информативный инструментальный метод диагностики состояния эндометрия и полости матки [6, 11, 13]. Возможности современной гистероскопии (видеогистероскопии) широко обсуждались как в отечественной, так и в зарубежной литературе. Г.М. Савельевой [11], А.Н. Стрижаковым и А.И. Давыдовым [13] описаны особенности нормальной гистероскопической картины, однако точность диагностики составляет от 54 до 82%. При сочетании гистероскопии с прицельной биопсией точность методики возрастает до 91%. Наиболее достоверным способом диагностики патологии эндометрия является гистологическое исследование слизистой оболочки матки [6, 8, 9]. Однако для получения исследуемого материала необходимо производить диагностическое выскабливание ткани эндометрия, что далеко не безразлично для организма больной ввиду инвазивности, риска инфи-цированности (в том числе ВИЧ, вирусом гепатита), трав-матичности. Высокая степень пролиферативной активности эндометрия выявлена у 30% больных с железистой ГЭ, у 12,5% - с полипами эндометрия, у 16% - с атрофией эндометрия, сопровождающейся кровяными выделениями [13].
Другие методы диагностики
Кроме того, расхождение мнений патологоанатомов при оценке одних и тех же микропрепаратов (особенно атипической гиперплазии) может достигать 85%. Этот метод также не является достоверным, поскольку нет объективных критериев диагностики. Гистерография - рентгенологический метод исследования с предварительным введением контрастного вещества в полость матки. При гиперплазии эндометрия характерным признаком на рентгенограмме является неровность контуров полости матки. Кроме того, у многих больных могут иметься такие рентгенологические симптомы, как дефекты наложения, неравномерная интенсивность тени в полости матки.
Радиоизотопное исследование с использованием радиоактивного фосфора является весьма ценным диагностическим методом. При попадании в кровь 32 Р вначале происходит равномерное его распределение в организме, а затем накопление в отдельных органах и тканях. Степень накопления зависит от интенсивности обмена веществ, проницаемости клеточных мембран, миотической активности тканей. По данным многих авторов, происходит значительное накопление радиоактивного фосфора в гиперплазированном эндометрии [8, 20]. В норме накопление 32 Р равномерное: в области дна матки менее 300% с постепенным снижением до 100%, при аденоматозе (особенно очаговом) - более 500%. Применение этого метода целесообразно для ориентировочного определения основной локализации патологического процесса и степени пролиферации клеточных элементов. Таким образом, существующие способы диагностики гиперпластических заболеваний и рака эндометрия не дают возможности достоверно диагностировать различную патологию эндометрия, что осложняет разработку адекватной терапии у этих больных. Комплексный анализ многолетних исследований патогенеза, диагностики, методов и эффективности лечения позволил выделить группы риска возможного развития рака эндометрия и показания к оперативному лечению у пациенток с пролиферативными процессами в эндометрии в период постменопаузы [1, 8, 9, 10, 12]. В эти группы включены следующие пациентки:
1) с поздним наступлением менопаузы;
2) с ожирением, сахарным диабетом, гипертонической болезнью;
3) с рецидивирующим дисфункциональным маточным кровотечением и гиперэстрогенией в постменопаузе;
4) с ановуляторными циклами;
5) с диэнцефальным синдромом, протекающим по типу болезни Иценко-Кушинга;
6) с феминизирующими опухолями яичников;
7) с гиперпластическими процессами в эндометрии, особенно рецидивирующими и протекающими на фоне ожирения, гипертонической болезни, нарушения белко-вообразовательной функции печени, щитовидной железы;
8) с атипической гиперплазией эндометрия;
9) с синдромом Штейна-Левенталя.
Оперативное лечение
Гиперпластичеcкий процесс в эндометрии - сложный патологический комплекс, включающий не только повреждения слизистой оболочки тела матки, но и нарушения важнейших функций всего организма. Первоочередной задачей в период постменопаузы является исключение онкологической патологии, гормонпродуцирую-щих опухолей яичников, уточнение этиологии, патогенеза гиперпластических процессов и выявление сопутствующей генитальной и экстрагенитальной патологии. Показанием к оперативному лечению у этой категории больных является наличие рецидивирующих полипов эндометрия, железистой и атипической гиперплазии эндометрия, рецидивирующих кровяных выделений на фоне атрофии эндометрия, отсутствие эффекта от гормональной терапии, новообразования придатков.
Объем оперативного вмешательства при пролиферативных процессах в эндометрии в этот период жизни женщины определяется в пользу гистерэктомии. Однако до последнего времени во всем мире остается дискуccионным вопрос: удалять или не удалять придатки матки у больных с пролиферативными процессами в эндометрии во время гистерэктомии? Анализ результатов гистологического исследования удаленных яичников у больных с рецидивирующими пролиферативными процессами в эндометрии в период постменопаузы [11, 13, 15] показал, что возрастная норма имела место у 9% больных, истинные опухоли отмечены в 42% наблюдений, гиперпластические процессы в строме - у 39%, ретенционные образования - у 20% пациенток. Выявленная высокая частота патологии яичников при пролиферативных процессах в эндометрии в период постменопаузы диктует необходимость удаления яичников при оперативном лечении.
Таким образом, гиперпластические процессы в эндометрии следует рассматривать не как местный процесс, а как реакцию ткани-мишени в ответ на нарушение гормонального гомеостаза. При ведении пациенток с ГЭ в постменопаузе главным моментом является возможность развития рака эндометрия в будущем или его одновременное сосуществование с ГЭ.
Д.м.н., проф., рук. отд. С.Н. БУЯНОВА, м.н.с. Н.В. ПУЧКОВА, асп. Э.М. ГИТИНОВ
Московский областной НИИ акушерства и гинекологии (дир. - член-корр. РАМН проф. В.И. Краснопольский)
ЛИТЕРАТУРА
1. Бохман Я.В. Лекции по онкогинекологии. М: МИА 2007; 264.
2. Вострое А.Н., Трофимова Е.Ю., Новикова Е.Г. и др. Комплексная ультразвуковая диагностика рака эндометрия. Пособие для врачей. М: МНИОИ им. П.А. Герцена 2004; 27.
3. Демидов В.Н., Зыкин Б.И. Ультразвуковая диагностика в гинекологии. М 2001; 124.
4. Демидов В.Н., Гус А.И. Ультразвуковая диагностика гиперпластических и опухолевых процессов эндометрия. Клиническое руководство по ультразвуковой диагностике. Под
ред. В.В. Митькова и М.В. Медведева. М: Видар 1997; 120-
5. Демидов В.Н., Гус А.И., Огай О.Ю. Эхография органов малого таза у женщин. Компьютерная энциклопедия. М 1995-2007. Электронная версия.
6. Кулаков В.И., Адамян Л.В. Эндоскопия в гинекологии М: Медицина 2001; 5-114.
7. Новикова Е.Г., Пронин С.М. Аблация в лечении предрака и начального рака эндометрия: мед. технология. МНИОИ им. П.А. Герцена 2005; 11 - 14.
8. Новикова Е.Г., Чулкова О.В., Пронин С.М. Практическая онкология 2004; 5: 1: 53.
9. Побединский Н.М., Кузнецова И.В., Томилова М.В. Развитие гиперпластических процессов эндометрия при хронической ановуляции. Акуш и гин 2007; 1: 30.
10. Раскуратов Ю.В. Гиперпластические процессы и предраковые состояния эндометрия. Методические рекомендации. Тверь 2000; 3-24.
11. Савельева Г.М., Бреусенко В.Г. Гистероскопия. М: ГЭОТАР МЕД 2001; 156.
12. СеровВ.Н., Прилепская В.Н., Пшеничникова Т.Я. Гинекологическая эндокринология. М: Медицина 2008; 178.
13. Стрижаков А.Н., Давыдов А.И. Гистерорезектоскопия. М: Медицина 1998; 7-105.
14. Харитонова Т.В. Рак тела матки. Онкогинекология 2000; 2: 2:
15. Cavalieri E., Frenkel K., Liehr J.G. et al. Cancer of Endometrium. J Natl Cancer Inst Monogr 2000; 27: 75-93.
16. Doherty J.A., Weiss N.S., Freeman R.J. et al. Cancer of Endometrium: pathogenesis, morphologies, epidimiologies. Cancer Epidemiol Biomarkers Prev 2005; 14: 357-366.
17. Marsden D.E., Hacker N.F. Histeroscopy in practice of gynecologist. Best Practice&Research Clin Obstet Gyn 2001; 15: 3:
18. Mikhailova O.N., Gulyaeva L.F., Prudnikov A.V. et al. Conservative treatment of hyperplasia of endometrium. Pharmacogenom J
19. Modugno F., Weissfeld J.L. Laboratory diagnostics of cancer of endometrium. Clin Cancer Res 2001; 7: 3092-3096.
20. Vadlamuri S.V., Glover D.D., Turner T. et al. Postmenopause physiologies and pathologies. Cancer Lett 1998; 122: 143-150.
21. Zheng W., Xie D., Cerhan J. R. et al. Main Biomarkers of cancer of endometrium. Cancer Epidemiol Biomarkers Prev 2001; 10: 89-
Атипическая гиперплазия эндометрия и миома матки
Предраковые заболевания матки имеют риск трансформации в злокачественную опухоль.
К предраковым заболеваниям относят атипическую гиперплазию эндометрия. Атипическая гиперплазия эндометрия – процесс, который характеризуется избыточным разрастанием желез внутреннего слоя матки, причём клетки, формирующие эти железы, являются аномальными. Атипическая гиперплазия эндометрия развивается из гиперплазии эндометрия (избыточного образования желез нормального гистологического строения во внутренней оболочке матки) или из полипов эндометрия. Рак развивается приблизительно у трети женщин с атипической гиперплазией эндометрия.
Факторами риска развития этого патологического состояния являются возраст (риск увеличивается с возрастом), гормонзаместительная терапия эстрогенами, ожирение, ожирение, раннее начало менструаций (до 12 лет) и позднее наступление климакса (после 55 лет), приём тамоксифена по поводу рака молочной железы , отсутствие родов, гиперплазия эндометрия, облучение органов таза в анамнезе.
Наиболее распространенными симптомами атипической гиперплазии эндометрия являются маточные кровотечения, иногда цитологическое исследование мазков из шейки матки ( Pap-тест ) выявляет наличие комплексов атипичных клеток эндометрия.
Диагностика атипической гиперплазии эндометрия основывается на биопсии эндометрия (проводится диагностическое выскабливание полости матки).
Тактика лечения атипической гиперплазии эндометрия зависит от многих факторов: степени клеточной атипии, симптомов (длительность кровотечения и объём кровопотери), желания женщины иметь возможность забеременеть.
Для женщин после периода менопаузы одним из методов хирургического лечения является удаление матки, яичников и маточных труб.
Женщинам молодого возраста, которые хотят в дальнейшем иметь ребёнка, предлагают гормональную терапию прогестероном.
Доброкачественные опухоли матки не способны к метастазированию и инвазивному росту (росту в ткань с ее разрушением), обычно не угрожают жизни.
К доброкачественным опухолям относятся миомы и фибромиомы матки. Эти опухоли состоят из мышечных клеток, аналогичных клеткам мышечного слоя матки. К 45 годам у 70% женщин имеются миомы. Эти опухоли обычно растут в молодом возрасте и уменьшаются после менопаузы.
Факторы риска возникновения миом не изучены до конца, известна роль избыточного количества эстрогена и прогестерона в организме женщины. Эти опухоли чаще возникают у женщин, которые никогда не рожали, также существует связь с избыточной массой тела.
Симптомы миомы включают в себя ациклические или обильные маточные кровотечения (чаще при субмукозном расположении миомы), нарушение мочеиспускания, запоры, боль внизу живота, бесплодие.
Диагноз миомы может быть выставлен на основании данных осмотра гинеколога, трансвагинального УЗИ, МРТ, биопсии эндометрия (при субмукозном расположении узла), данных после удаления опухоли.
Цитологическое исследование соскобов шейки матки и цервикального канала с описанием по терминологической системе Бетесда (The Bethesda System – TBS)
Метод определения Цитологическое исследование осуществляется согласно «Номенклатуре клинических лабораторных исследований, применяемых в целях диагностики и слежения за состоянием пациентов в учреждениях Российской Федерации», утвержденной приказом Минздрава России от 21.02.2000 г. №64 и «Примерному перечню лабораторных исследований для клинико-диагностической лаборатории лечебно-профилактических учреждений» от 25.12.1997 г. №380.
Онкологические заболевания шейки матки являются серьезной проблемой здравоохранения, широко распространены, имеют надежно распознаваемую преклиническую фазу и длительный период развития. Для достоверной верификации диагноза и выбора методов эффективного лечения применяется надежный скрининг-тест – цитологическое исследование мазков, взятых из шейки матки и цервикального канала.
Цитологический метод исследования является весьма чувствительным в диагностике предрака (дисплазий) и начального преклинического рака шейки матки (карциномы in situ, микроинвазивного и скрытого инвазивного рака). Цитологический скрининг позволяет выявить пациенток в преклинической фазе заболевания, использовать щадящие методы лечения, сокращать его сроки, снижать частоту инвалидизации и смертности. Скрининговое цитологическое исследование шейки матки рекомендуется проводить ежегодно всем женщинам от 21 года (или через год от начала половой жизни), независимо от клинических показаний. При наличии клинических изменений частота цитологического исследования определяется врачом-гинекологом.
Для возникновения и развития многих патологических процессов существенное значение имеет особенность анатомического строения шейки матки и, в частности, состояние и взаимоотношение эпителиальных слоев влагалищной части шейки цервикального канала. Как правило, предраковые изменения, а затем и малигнизация, возникают в месте перехода многослойного плоского эпителия влагалищной порции шейки матки в цилиндрический эпителий цервикального канала (зоне трансформации), расположенного (в фертильном возрасте) в области наружного зева. Под влиянием гормональных факторов, травм, воспалительных процессов, диатермокоагуляции зона трансформации (зона стыка) может значительно варьировать. В период увядания овариально-менструальной функции в связи с процессами атрофии уровень стыка поднимается высоко в цервикальный канал.
В 95-97% случаев злокачественная трансформация происходит в клетках плоского эпителия, в остальных – в клетках цилиндрического эпителия цервикального канала.
Основоположником диагностической цитопатологии является Г. Папаниколау (G.N. Papanicolaou), который в 1928 г. описал раковые клетки в мазках из влагалища. Им была разработана широко используемая классификация изменения клеток влагалища и цервикального канала шейки матки. Но в этой классификации не учитываются цитологические изменения, обусловленные вирусом папилломы человека (ВПЧ). Поэтому в настоящее время Всемирная организация здравоохранения рекомендует систему, разработанную в клинике Бетесда (США).
разработана для унификации описаний результатов цитологического исследования эпителия шейки матки (с целью представления их в удобной клиницистам форме), с выделением в отдельные группы находок разной клинической значимости и оценкой адекватности исследуемого материала.
Система Бетесда включает 3 категории мазков: норма, мазки неопределенного значения (ASCUS) и внутриэпителиальные (предраковые) поражения низкой (LSIL) и высокой (HSIL) степеней.
Согласно ТБС, начальным компонентом интерпретации цервикальных мазков является оценка адекватности образца, так как его качество влияет на чувствительность цитологического метода. ТБС 2001 г. предполагает две категории образцов: «удовлетворительный» и «неудовлетворительный».
NILM – интраэпителиальные изменения и злокачественные процессы отсутствуют. В эту группу включены цитологические заключения о нормальном состоянии эпителия, а также о наличии различных не неопластических состояний (заболеваний). Уточняют их характер и, по возможности, причину:
- атрофические изменения;
- наличие клеток железистого эпителия после гистерэктомии;
- реактивные изменения, ассоциированные с воспалением, включая типичную регенерацию, лучевую терапию, применение внутриматочных контрацептивов;
- кроме того, указывают наличие микроорганизмов:
- Trichomonas vaginalis;
- грибов, по морфологическому строению соответствующих Candida spp.;
- бактерий, по морфологическому строению соответствующих Actinomyces spp.;
- коккобациллярную микрофлору, характерную для бактериального вагиноза;
- клеточные изменения, соответствующие поражению Herpes simplex virus.
У женщин 40 лет и старше при отсутствии плоскоклеточных интраэпителиальных изменений указывается также наличие эндометриальных клеток.
ASC-Н – клетки плоского эпителия с атипией неясного значения, не исключающие наличия высокой степени интраэпителиальных изменений.
LSIL – интраэпителиальные изменения плоского эпителия низкой степени, включают поражения, ассоциированные с HPV и CIN I.
НSIL – интраэпителиальные изменения плоского эпителия высокой степени, включают CIN II, CIN III, карциному in situ и случаи, подозрительные на наличие инвазии.
Читайте также:
