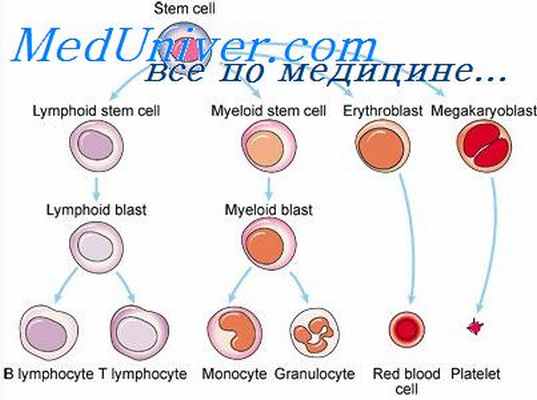
Дифференцировка лимфоидных клеток. Лимфопоэз
Добавил пользователь Алексей Ф. Обновлено: 07.01.2026
1. Белянин В.Л., Цыплаков Д.Э. Диагностика реактивных гиперплазий лимфатических узлов. – СПб – Казань, 1999. – 328 с.
2. Райт Д., Эддис Б., Леонг Э. Морфологическая диагностика патологии лимфатических узлов. – М.: Мед. лит., 2008. – С. 42-86.
3. Криволапов Ю.А., Леенман Е.Е. Морфологическая диагностика лимфом. – СПб.: Коста., 2006. – С. 45-48.
4. Шерстнева Е.С., Исаева Н.В., Загоскина Т.П. и др. Клиническое значение внутриклеточного ИЛ-8 у больных В-клеточным хроническим лимфолейкозом // Вестник гематологии. – 2007. – Т. 3, № 2. – С. 49-50.
5. Леенман Е.Е., Мухина М.С. и др. Место дендритных клеток в микроокружении при лимфоме Ходжкина. – СПб, 2010.
6. Киселева М.В. Морфо-функциональное состояние стромы лимфатических узлов при некоторых лимфопролиферативных заболеваниях. Диссертация. Санкт-Петербург, 2001.
7. Semenova N., Bessmeltsev S., Rugal V. Stromal microenvironment lymph nodes in CLL // Haematologica.17 Congress EHA Amsterdam. Abstract Book. – 2012. – Vol. 97, № S1. – Р. 521.
8. Семенова Н.Ю., Ругаль В.И. Морфофункциональные особенности стромы лимфатических узлов при ХЛЛ // Вестник гематологии. – 2011. – Т. VII, № 4. – С.45-46.
9. Tsuda H., Nishimura H., Sawada T., Takatsuki K. The roles of lymph node stromal cells in proliferation of lymphoid leukemia cells // Br.J.Cancer. – 1990. – Vol. 61. – Р. 362-364.
10. Park C-S., Choi Y.S. How do follicular dendritic cells interact intimately with B cells in the germinal centre? // Immunology. – 2005. – Vol. 114. – Р. 2-10.
11. Caligaris-Cappio F. Role of the microenvironment in chronic lymphocytic leukaemia // Br J Haematol. – 2003. – Vol. 123. – Р. 380-388.
В функциональном отношении клетки лимфоидной системы могут быть разделены на три типа: стволовые кроветворные клетки, клетки-предшественники первичных лимфоидных органов, клетки вторичных лимфоидных органов. По темпу клеточного обновления лимфоидная ткань занимает одно из первых мест в организме. Развитие лимфоидных клеток не прекращается всю жизнь – это необходимо для “подстройки” иммунитета к постоянно изменяющейся иммунологической ситуации.
Особенность всей лимфоидной системы состоит в том, что в течение всей жизни ее органы объединяют интенсивные клеточные миграции, в ходе которых осуществляется пролиферация и дифференцировка иммунокомпетентных клеток. Эти процессы происходят при условии упорядоченной миграции клеток-предшественников из одних органов кроветворной системы в другие, включая костный мозг, тимус и периферические лимфоидные органы. Стоит отметить, что дифференцировка общих предшественников в разных направлениях (например, в Т- и В-клетки) требует различных несовпадающих местных условий.
Основная функция лимфоузлов состоит в обеспечении взаимодействия антигена, который поступает туда по афферентным лимфатическим сосудам, с иммунокомпетентными клетками. В ходе иммунного ответа в структуре лимфоузла происходит ряд изменений, благодаря которым обеспечивается возможность для наибольшего количества лимфоцитов проконтактировать с антигеном и между собой. Структуры лимфатического узла создают условия для направленного, а не случайного взаимодействия разных субпопуляций лимфоцитов и для развития стимулированных антигеном клонов иммунокомпетентных клеток.
Группой экспертов ВОЗ (Котье и соавт., 1973) предложено выделять в лимфоузле следующие функциональные зоны и структуры:
1. Кортикальный слой с залегающими в нем фолликулами.
2. Паракортикальную зону.
3. Мозговое вещество с мозговыми тяжами.
Фолликулы и мозговые тяжи являются тимуснезависимыми областями (В-зона), паракортикальная зона – тимусзависимой областью (Т-зона). В-зависимые зоны – это зоны лимфоидных фолликулов лимфоузлов, селезенки, аппендикса, миндалин, лимфоидных агрегатов кишечника. Т-зависимые зоны – это паракортикальная зона лимфоузлов, периартериальные зоны селезенки, интерфолликулярные зоны в аппендиксе, миндалинах, пейеровых бляшках.
Структура и клеточный состав лимфоузлов человека исследовались многими авторами. Непаренхиматозный компонент лимфатических узлов представлен стромальными образованиями, выполняющими, в основном, опорную и трофическую функцию – фибробласты, фиброциты, миоциты, эндотелиоциты сосудов, нейральные элементамы. Также непаренхиматозные структуры лимфоидной ткани включают в себя группу ретикулярных клеток и экстрацеллюлярный матрикс, которые играют ключевую роль в формировании лимфоидного микроокружения, отвечающее за развитие лимфоидных клеток. Остальные элементы стромы играют вспомогательную роль.
Термин ретикулярные клетки носит собирательный характер и включает 4 основных морфофункциональных типа: гистиоцитарные, дендритные, интердигитирующие и фибробластические ретикулярные клетки. На светооптическом уровне с использованием рутинных окрасок дифференцировать указанные типы достаточно сложно. Определение принадлежности к определенному варианту требует гистохимических и иммуногистохимических методов анализа.
Гистиоцитарные ретикулярные клетки имеют вид фиксированных макрофагов, почти неотличимых от гистиоцитов и макрофагов костномозгового происхождения, особенно находящихся в лимфатических фолликулах.
Дендритные ретикулярные клетки преобладают в корковом веществе, главным образом в центрах первичных и вторичных лимфатических фолликулов, являясь антиген-представляющей субпопуляцией клеточных элементов лимфатического узла. Эти клетки способны длительное время удерживать антиген на своей поверхности, регулируя образование В-клеток памяти и предшественников антителоформирующих плазмоцитов. Кроме того, дендритные ретикулярные клетки образуют правильную сеть в первичных и вторичных лимфоидных фолликулах. Реализации этих функций способствуют длинные отростки цитоплазмы, которые соединены с такими же отростками соседних дендритных ретикулярных клеток. Они имеют характерные ядра: часто они двуядерные или многоядерные. Рутинными методами окраски дендритные отростки не идентифицируются, но часто они хорошо визуализируются на срезах, окрашенных на IgM, маркирующий иммунные комплексы на поверхности отростков. Их отростки также выявляются окрашиванием на CD21 и CD23. Дендритные клетки помимо длинных отростков, которыми они соединяются между собой, имеют отчетливо различимые замыкательные комплексы – десмосомы, отличающие эти клетки от интердигитирующих ретикулярных клеток.
Интердигитирующие ретикулярные клетки в наибольшем количестве присутствуют в паракортикальной зоне, определяя стимуляцию Т-клеточного ответа. Интердигитирующие ретикулярные клетки имеют бледно окрашивающиеся ядра овальной или удлиненной формы, иногда с инвагинациями довольно сложной конфигурации, и широкую цитоплазму. Эти клетки имеют большое сходство с клетками Лангерганса, но не содержат гранул Бирбека. При иммуноцитохимическом исследовании в них определяется белок S-100 и антиген HLA-DR. Интердигитирующие ретикулярные клетки, в отличие от дендритных, соединяются между собой и другими клеточными элементами при помощи пальцевидных отростков цитоплазмы, входящих между такими же структурами других клеток.
Фибробластические ретикулярные клетки характеризуются наличием в цитоплазме волокнистых структур, идущих на формирование ретикулиновых волокон.
Как и в костном мозге, система кровеносных сосудов является важным компонентом лимфатического узла, поскольку из крови в его ткань и обратно осуществляется интенсивная миграция лимфоцитов. Проникшие в узел через его ворота кровеносные сосуды ветвятся в мозговом и корковом слоях. В корковом слое располагаются мелкие венулы, в которые переходят капилляры. Эндотелий посткапиллярных венул построен из высоких клеток, в их цитоплазме часто обнаруживаются лимфоциты. В ходе миграции лимфоциты проходят как между эндотелиальными клетками, так и через их цитоплазму, затем через базальную мембрану и попадают в ткань глубокого кортекса. Эмиграция лимфоцитов из лимфоузлов осуществляется через эфферентные лимфатические сосуды, по которым лимфоциты возвращаются в кровоток. В этих взаимодействиях участвуют селектины, CD44 и интегрины, экспрессированные на лимфоцитах.
Имеется небольшое количество работ по морфологии некоторых клеточных элементов лимфоидного микроокружения при лимфопролиферативных заболеваниях. Так, при исследовании морфологических особенностей дендритных ретикулярных клеток при неходжкинских лимфомах отмечено изменение ультраструктуры ретикулярных клеток. При этом, происходило уменьшение количества лимфоцитов, контактирующих с дендритными ретикулярными клетками, увеличение межклеточных расстояний, перестройки плазматических мембран, изменения ультрацитохимических свойств клеток, в частности, снижение или полное отсутствие реакции на кислую фосфатазу. Отмечено уменьшение количества дендритных ретикулярных клеток в зависимости от гистологического варианта лимфом. Так, лимфомы фолликулярного типа сопровождаются увеличением количества ретикулярных клеток, в то время как при диффузных лимфомах отмечено уменьшение их числа и значительные деструктивные изменения. Данные о вовлечении в патологический процесс дендритных ретикулярных клеток при неходжкинских лимфомах были подтверждены при иммуногистохимических и экспериментальных исследованиях.
Известно, что строма реализует свое воздействие на гемопоэтические клетки, как путем непосредственных межклеточных контактов, так и опосредованно, с помощью гуморальных механизмов. При лимфоидных неоплазиях происходят значительные нарушения в системе межклеточных взаимодействий. Клетки микроокружения являются главным источником цитокинов – пептидов, обеспечивающих регуляцию пролиферации, дифференцировки и апоптоза гемопоэтических клеток. Отмечено, что роль цитокинов в патогенезе лимфопролиферативных заболеваний весьма значительна. К примеру, известно, что пролиферативная активность стромы лимфоузлов у больных неходжкинскими лимфомами не зависит от морфологического варианта заболевания, а связана с продукцией цитокинов, в частности ФНО-α стромальными элементами лимфатических узлов. У пациентов с хроничесским лимфолейкозом повышена секреция стромой лимфатических узлов ИЛ-6 и ИЛ-4 in vitro, что отражает участие данных веществ в патогенезе заболевания. Применение химиотерапии снижает продукцию ИЛ-4 in vivo, что может быть благоприятным фактором, учитывая особенность ИЛ-4 ингибировать апоптоз опухолевых клеток. Также были показаны различия в экспрессии внутриклеточного ИЛ-8 клетками опухолевого клона и нормальными В-лимфоцитами, что имеет клиническое значение.
Работы, посвященные изучению дендритных клеток (ДК) при некоторых формах опухолей, показали, что количество и иммунофенотип ДК, их распределение в опухолевой и непораженной ткани отражаются на прогнозе этих новообразований. ДК считаются наиболее важным фактором, определяющим состав лимфоидной популяции и влияющим на регулирование функциональной активности лимфоидных клеток. Они могут создавать не только противоопухолевые, но и проопухолевые стимулы.
Согласно данным Цыплакова Д.Э. и соавт. (1995), исследовавших влияние кровеносного микроциркуляторного русла на клеточный иммунный ответ в лимфатических узлах, регионарных к злокачественным опухолям, сосудистое русло лимфатических узлов играет двоякую роль. С одной стороны, на ранних этапах развития опухоли происходит активация Т-клеточных иммунных реакций с усилением рециркуляции лимфоцитов через посткапиллярные венулы и превращением их путем бласттрансформации в цитотоксические Т-киллеры, что, вероятно, сдерживает процесс метастазирования. С другой стороны, на более поздних стадиях опухолевого роста изменения сосудистой стенки и циркуляторные расстройства сопровождаются отложением внутри- и внесосудистого фибрина, затрудняя тем самым рециркуляцию лимфоцитов и, следовательно, приводят к уменьшению числа трансформированных Т-киллеров, способных уничтожать попадающие в лимфатический узел опухолевые клетки, что, по мнению авторов, предопределяет процесс метастазирования. При появлении в лимфатических узлах метастазов фибрин уже способствует их закреплению в лимфоидной ткани, а также изолирует от цитотоксического действия оставшихся в небольшом количестве Т-эффекторов.
На сегодняшний день накопилось достаточное количество данных, свидетельствующих о роли стромального микроокружения в становлении лимфопролиферативных заболеваний. При этом отсутствует целостное представление о структурных особенностях лимфоидной стромы при нарушениях пролиферации и дифференцировки В-лимфоцитов. Дальнейшее изучение лимфоидного микроокружения, его морфофункциональных особенностей, адгезивных взаимодействий с использованием современных методов структурного анализа может способствовать поискам новых методов лечения гемобластозов и лимфопролиферативных заболеваний.
Гистология. Полный курс за 3 дня
В отличие от миелопоэза лимфоцитопоэз в эмбриональном и постэмбриональном периодах осуществляется поэтапно, сменяя разные лимфоидные органы. Как отмечалось ранее, лимфоцитопоэз подразделяется на:
В свою очередь, они делятся на три этапа:
1) костномозговой этап;
2) этап антигеннезависимой дифференцировки, осуществляемый в центральных иммунных органах;
3) этап антигензависимой дифференцировки, осуществляемый в периферических лимфоидных органах.
Т-лимфоцитопоэз
Первый этап осуществляется в лимфоидной ткани красного костного мозга, где образуются следующие классы клеток:
1) стволовые клетки – I класс;
2) полустволовые клетки предшественники Т-лимфоцитопоэза – II класс;
3) унипотентные Т-поэтинчувствительные клетки, предшественницы Т-лимфоцитопоэза. Эти клетки мигрируют в кровяное русло и достигают вилочковой железы (тимуса) – III класс.
Второй этап – антигеннезависимая дифференцировка, которая осуществляется в корковом веществе тимуса. При этом происходит дальнейшее образование Т-лимфоцитов. Стромальными клетками выделяется тимозин, под влиянием которого происходит превращение унипотентных клеток в Т-лимфобласты. Они являются клетками IV класса в Т-лимфоцитопоэзе. Т-лимфобласты превращаются в Т-пролимфоциты (клетки V класса), а они в Т-лимфоциты – VI класс.
В тимусе из унипотентных клеток развиваются самостоятельно три субпопуляции Т-лимфоцитов – Т-киллеры, Т-хелперы, Т-супрессоры.
Образовавшиеся Т-лимфоциты приобретают в корковом веществе тимуса разные рецепторы к разнообразным антигенам, при этом сами антигены в тимус не поступают. Защита вилочковой железы от попадания чужеродных антигенов осуществляется за счет наличия гематотимусного барьера и отсутствия приносящих сосудов в тимусе.
В результате второго этапа образуются субпопуляции Т-лимфоцитов, которые обладают различными рецепторами к определенным антигенам. В тимусе также происходит образование Т-лимфоцитов, обладающих рецепторами к антигенам собственных тканей, однако такие клетки сразу же разрушаются макрофагами.
После образования Т-лимфоциты, не проникая в мозговое вещество тимуса, поступают в кровоток и заносятся в периферические лимфоидные органы.
Третий этап (антигеннезависимая дифференцировка) осуществляется в Т-зависимых зонах периферических лимфоидных органов – лимфатических узлах и селезенке. Здесь создаются условия для встречи антигена с Т-лимфоцитом (киллером, хелпером или супрессором), имеющим рецептор к данному антигену.
Чаще всего происходит не непосредственное взаимодействие Т-лимфоцита с антигеном, а опосредованное – через макрофаг. При поступлении в организм чужеродного антигена он вначале фагоцитируется макрофагом (завершенный фагоцитоз), частично расщепляется, а антигенная детерминанта выносится на поверхность макрофага, где концентрируется. Затем эти детерминанты передаются макрофагами на соответствующие рецепторы различных субпопуляций Т-лимфоцитов. Под влиянием специфического антигена происходит реакция бластотрансформации – превращение Т-лимфоцита в Т-лимфобласт. Дальнейшая дифференцировка клеток зависит от того, какая субпопуляция Т-лимфоцитов провзаимодействовала с антигеном.
Т-киллерный лимфобласт дает следующие клоны клеток.
1. Т-киллеры (или цитотоксические лимфоциты), являющиеся эффекторными клетками, обеспечивающими клеточный иммунитет. Т-киллеры обеспечивают первичный иммунный ответ – реакцию организма на первое взаимодействие с антигеном.
В процессе уничтожения киллерами чужеродного антигена можно выделить два основных механизма: контактное взаимодействие – разрушение участка цитолеммы клетки-мишени и дистантное взаимодействие – выделение цитотоксических факторов, действующих на клетку-мишень постепенно и длительно.
2. Клетки Т-памяти. Эти клетки при повторной встрече организма с тем же антигеном обеспечивают вторичный иммунный ответ, который сильнее и быстрее первичного.
Т-хелперный лимфобласт дает следующие клоны клеток:
1) Т-хелперы, секретирующие медиатор лимфокин, стимулирующий гуморальный иммунитет. Это индуктор иммунопоэза;
2) клетки Т-памяти.
Т-супрессорный лимфобласт дает следующие клоны клеток:
2) клетки Т-памяти.
Таким образом, в ходе третьего этапа Т-лимфоцитопоэза происходит образование эффекторных клеток каждой субпопуляции Т-лимфоцитов (Т-киллеров, Т-хелперов и Т-супрессоров), обладающих определенной функцией, и клеток Т-памяти, обеспечивающих вторичный иммунный ответ.
В клеточном иммунитете можно выделить два механизма уничтожение киллерами клеток-мишеней – контактное взаимодействие, при котором происходит разрушение участка цитолеммы клетки-мишени и ее гибель, и дистантное взаимодействие – выделение цитотоксических факторов, действующих на клетку-мишень постепенно и вызывающих ее гибель через определенное время.
В-лимфоцитопоэз
В процессе В-лимфоцитопоэза можно выделить следующие этапы.
Первый этап – осуществляется в красном костном мозге, где образуются следующие классы клеток:
1) стволовые клетки – I класс;
2) полустволовые клетки, предшественницы лимфопоэза – II класс;
3) унипотентные В-лимфопоэтинчувствительные клетки – предшественницы В-лимфоцитопоэза – III класс.
Второй этап – антигеннезависимая дифференцировка – у птиц осуществляется в специальном органе – фабрициевой сумке, у млекопитающих в том числе и у человек такой орган не найден. Большинство исследователей считает, что второй этап (так же как и первый) осуществляется в красном костном мозге, где образуются В-лимфобласты – клетки IV класса. Затем происходит их пролиферация в В-пролимфоциты – клетки V класса и в В-лимфоциты – клетки VI класса. В процессе второго этапа В-лимфоциты приобретает разнообразные рецепторы к антигенам. При этом установлено, что рецепторы представлены белками – иммуноглобулинами, которые синтезируются в самих же созревающих В-лимфоцитах, затем выносятся на поверхность и встраиваются в плазмолемму. Концевые химические группировки у этих рецепторов различны, и именно этим объясняется специфичность восприятия ими определенных антигенных детерминант разных антигенов.
Третий этап – антигензависимая дифференцировка осуществляется в В-зависимых зонах периферических лимфоидных органов – в селезенке и лимфатических узлах. Тут происходит встреча В-лимфоцитов с антигенами, их последующая активация и трансформация в иммунобласт. Это происходит только при участии дополнительных клеток – макрофагов, Т-хелперов и Т-супрессоров. Следовательно, для активации В-лимфоцитов необходима кооперация следующих клеток – В-лимфоцита, Т-хелпера или Т-супрессора, а также гуморального антигена – бактерии, вируса или белка полисахарида. Процесс взаимодействия протекает следующим образом: антигенпредставляющий макрофаг фагоцитирует антиген и выносит на поверхность клеточной мембраны антигенную детерминанту, после этого детерминанта воздействует на В-лимфоциты, Т-хелперы и Т-супрессоры. Таким образом, влияния антигенной детерминанты на В-лимфоцит недостаточно для реакции бластотрансформации, она протекает после активации Т-хелпера и выделения им активирующего лимфокина. После этого В-лимфоцит превращается в иммунобласт. После пролиферации иммунобласта образуются клоны клеток – плазмоциты – эффекторные клетки гуморального иммунитета, они синтезируют и выделяют в кровь иммуноглобулины – антитела различных классов и клетки В-памяти.
Иммуноглобулины (антитела) взаимодействуют со специфическими антигенами, образуется комплекс «антиген – антитело», таким образом происходит нейтрализация чужеродных антигенов.
Т-хелперы играют следующую функцию в осуществлении гуморального иммунитета – способствуют реакции бластотрансформации, заменяют синтез неспецифических иммуноглобулинов на специфические, стимулируют синтез и выделение иммуноглобулинов плазмоцитами.
Т-супрессоры активируются этими же антигенами и выделяют лимфокины, угнетающие образование плазмоцитов и синтез ими иммуноглобулинов вплоть до полного прекращения. Таким образом, воздействие на В-лимфоцит Т-киллеров и Т-хелперов регулирует реакции гуморального иммунитета.
Дифференцировка лимфоидных клеток. Лимфопоэз
Дифференцировка лимфоидных клеток. Лимфопоэз
К сожалению, именно для этого, важнейшего в иммунологии направления дифференцировки стволовых клеток, пока нет данных, позволяющих сколько-нибудь детально охарактеризовать гистогенез лимфоцитов. Обусловлено это в первую очередь отсутствием клональных методов исследования. Только в последние два года удалось получить в культуре лимфоидные колонии, состоящие из В- (Metcalf е. а., 1975) или Т- (Rosenszajn е. а., 1975) лимфоцитов. Однако большая частота клеток, продуцирующих лимфоидные колонии, доказывает, что они не являются предшественниками лимфоцитов, занимающими в гистогенетическом ряду положение, аналогичное, например, эритропоэтинчувствительным клеткам.
Речь идет о более зрелых членах ряда, пролиферация которых регулируется антигеном. Рассмотрение этих проблем не входит в задачу настоящего обзора.
В гистогенезе лимфоидных клеток, видимо, есть стадия общей клетки-предшественника как Т-, так и В-лимфоцитов. Эмбриональная печень при трансплантации аллогенному реципиенту (гибриду F1) не вызывает у него вторичной болезни, так как возникающие иммунологически компетентные клетки оказываются иммунологически толерантными. Однако через 60 дней пролиферации в таком реципиенте продуцируются клетки, содержащиеся в селезенке и лимфатических узлах, которые способны вызывать при переносе к вторичному реципиенту того же генотипа реакцию «трансплантат против хозяина».
Отсюда можно заключить, что существует какая-то стадия дифференцировки стволовой кроветворной клетки, промежуточная между последней и зрелой, иммунологически компетентной клеткой, характеризующаяся тем, что клетка не способна стать толерантной, и ее потомки оказываются иммунологически компетентными против антигенов реципиента (Туап, 1969). Дифференцируются эти клетки-предшественники в костном мозге и лишь оттуда поступают в периферические лимфоидные органы (Nossal, Pike, 1973), что подтверждает их гистогенетическую близость к стволовым кроветворным клеткам.
И, наконец, при разделении клеток в изопикнических или в изокинетических градиентах удалось показать, что предшественники как Т-, так и В-лимфоцитов имеют одинаковую плотность (порядка 1,064 г/см3), причем они тяжелее КОЕс (1,060 г/см3), легче зрелых Т-лимфоцитов (1,069 г/см3) и оседают в изокинетическом градиенте бычьего сывороточного альбумина с одинаковой скоростью — 3 мм/час.
Подтверждается существование этого предшественника и наличием дифференцировочного антигена, общего для молодых Т- и В-лимфоцитов (Yutoku е. а., 1975). Неясно, идет ли речь о клетке-предшественнике лимфопоэза, возможной стволовой лимфоидной клетке, или это уже более поздний продукт ее дифференцировки. Трудно также сказать, на каком этапе происходит коммитирование лимфоидного предшественника на клетки родоначальницы Т- и В-лимфоцитов соответственно. Тем более нет данных о том, регулируется ли пролиферация и дифференцировка этих предшественников, есть ли гормональная регуляция в этом отделе (по аналогии со всеми остальными направлениями дифференцировки стволовой клетки), какие гормоны в ней участвуют, в частности не обладает ли такими свойствами один из гормонов тимуса, фабрициевой сумки и т. д.
Поэтому схему дифференцировок в лимфоидном направлении сегодня можно рассматривать только как гипотетическую. В основу ее положены антигенные свойства предшественников, наличие различных рецепторов, аналогии с клетками злокачественных лимфопролиферативных заболеваний.
Предполагается, что одно из первых мест в гистогенетическом ряду лимфоидных дифференцировок занимают так называемые 0-клетки, ненесущие поверхностных маркеров ни Т-, ни В-клеток. Видимо, 0-клетки очень быстро коммитируются и дифференцируются в клетки-предшественники Т- и В-лимфопоэза. Такое заключение основано на крайней клинической редкости гипогаммаглобулинемии при остром лимфолеккозе, поражающем преимущественно Т-клетки, и редкости снижения клеточного иммунитета в большинстве случаев агаммаглобулинемии, поражающей В-клетки (Davis, 1975). Несмотря на это, выявление в крови клеток, несущих как поверхностные иммуноглобулины, так и рецепторы для эритроцитов барана, т. е. обладающих свойствами и Т- и В-клеток, является аргументом в пользу наличия общего предшественника обоих этих направлений лимфопоэза. По морфологии 0-клетки похожи на малые и средние лимфоциты.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лимфопоэз. Созренивание лимфоцитов в костном мозге
Лимфоидный росток гемопоэза в костном мозге представлен В-, Т- и NK-клеточными линиями. Клетки-предшественники имеют морфологическую характеристику бластов или зрелых лимфоцитов. В костном мозге В- и Т-лимфобласты составляют очень небольшую долю клеток (менее 0,5 %), лимфоциты - 4,3-13,7 %.
В-лимфоидные предшественники в костном мозге - центральном органе В-лимфопоэза проходят антигеннезависимую стадию созревания. При этом происходит перестройка (реаранжировка) генов иммуноглобулинов, расположенных на хромосомах 2, 22 и 14. Отдельные этапы дифференцировки характеризуются появлением специфичных макромолекул, определяющих иммунофенотип клеток.
На самых ранних про-В-клетках сохраняются антигены стволовых элементов (CD34 и CD38) и появляются специфические макромолекулы пан-BCD19, а затем цитоплазматический CD22. Эти антигены характерны для всех элементов В-лимфоидного ряда. Затем на пре-В-клетках снижается содержание стволово-клеточных и появляются другие В-антигены - CD 10, CD20 и CD24. Следующий этап созревания (npe-В-бласты) характеризуется появлением в цитоплазме клеток (J-цепи Ig. На последнем этапе костномозговой В-дифференцировки на мембране лимфоидных элементов экспрессируется полная молекула (легкие и тяжелые цепи) IgM.
После этого морфологически зрелые, но иммунологически «наивные» В-лимфоциты попадают в кровь и в периферические органы иммунной системы: лимфатические узлы, селезенку и др. Там после контакта с антигеном в зародышевых центрах вторичных лимфоидных фолликулов они проходят антигензависимую стадию дифференцировки. В итоге формируется пул зрелых В-лимфоцитов и плазматических клеток, способных синтезировать и продуцировать иммуноглобулины разных классов, что позволяет им принимать участие в регуляции и осуществлении гуморального ответа иммунной системы.
Предшественники Т-клеток в костном мозге характеризуются экспрессией стволово-клеточных (CD34, HLA-Dr) и Т-антигенов (CD7, цитоплазматический CD3±). Сначала Т-предшественники мигрируют в тимус, который является центральным органом Т-лимфопоэза, а затем поступают в периферические лимфоидные органы, где проходят антигензависимую стадию дифференцировки. В вилочковой железе осуществляется перестройка генов, кодирующих Т-клеточный рецептор (TCR), и TCR появляется на поверхностной мембране. Этот рецептор совместно с белками-продуктами гена главного комплекса гистосовместимости распознает и связывает антигены. Большинство Т-лимфоцитов крови экспрессируют а- и бета-цепи TCR, в то время как Т-лимфоциты эпителия кишечника и слизистой оболочки влагалища - у-и сигма-цепи.
T-лимфоциты: этапы внутритимусной дифференцировки.
Этапы внутритимусной дифференцировки клеток от мигрировавшего в орган костномозгового предшественника (пре-Т-клеток) до зрелого T-лимфоцита, покидающего тимус, связаны с изменением экспрессии фенотипических Т-клеточных маркеров. Основными из них являются: CD4 - корецептор T-хелперов , CD8 - корецептор цитотоксических T-лимфоцитов (T-киллеров) и альфа-бета ТКР (Т-клеточный антигенраспознающий рецептор). Специфическая комбинация этих поверхностных молекул может быть использована в качестве маркеров дифференцировки клеток в тимусе.
Дифференцировка лимфоидных клеток. Лимфопоэз
1 ГБОУ ВПО «Саратовский государственный медицинский университет им. В.И. Разумовского Минздрава России»
1. Алмазов В.А., Петрищев Н.И., Шляхто Е.В., Леонтьева И.В. Клиническая патофизиология. – М.: ВУНМЦ, 1999. – 464 с.
2. Белоцкий С.М., Авталион Р.Р. Воспаление. Мобилизация клеток и клинические эффекты. – М.: Изд-во БИНОМ, 2008. – 240 с.
5. Маянский А.Н. Лекции по иммунологии. – Изд-во Нижегородской медицинской академии.- Н. Новгород, 2003. – 200 с.
6. Нормальная физиология: учебник [Н.А. Агаджанян, Н.А. Барабаш, А.Ф. Белов и др.] / Под ред. проф. В.М. Смирнова. – 3-е изд. – М.: Издательский центр «Академия», 2010. – 480 с.
9. Типовые реакции иммунной системы на действие антигенов–аллергенов / Под общей ред. проф. Чесноковой Н.П. – Изд-во Саратов. мед. ун-та. Саратов, 2014. – 154 с.
10. Тотолян А.А. Клетки иммунной системы / А.А. Тотолян, И.С. Фрейдлин. – СПб.: Наука, 2000. – 231 с.
11. Фрейдлин И.С. Регуляторные Т–клетки: происхождение и функции / И.С. Фрейдлин / Медицинская иммунология. – 2005. – Т. 7, № 4. – С. 347–354.
12. Хаитов Р.М. Оценка иммунного статуса в норме и патологии / Р.М. Хаитов, Б.В. Пинегин // иммунология. – 2001. – № 4. – С. 4–6.
13. Ярилин А.А. Цитокины в тимусе. Биологическая активность и функции цитокинов в тимусе // Цитокины и воспаление. – 2003. – Т. 2, № 2. – С. 3–11.
14. Ярилин А.А., Донецкова А.Д. Регуляторные Foxp3+ – Т– клетки и их роль при аллергии // Росс. Аллергол. Журнал. – 2005. – № 2. – С. 22–26.
В-система лимфоцитов (лимфопоэз)
К центральным лимфоидным органам человека относят вилочковую железу (тимус), у птиц – «бурсу» (сумку Фабрициуса). У человека аналогом бурсы считают костный мозг, групповые лимфатические фолликулы кишечника (пейеровы бляшки).
В костном мозге поддерживается пул кроветворных стволовых клеток, являющихся источником образования всех клеток крови, в том числе и лимфоцитов.
Подавляющее большинство костномозговых лимфоцитов относится к бурсазависимым или В-лимфоцитам, обеспечивающим развитие иммунных или аллергических реакций гуморального типа.
В костном мозге под влиянием микроокружения стромальных костно-мозговых клеток осуществляется дифференцировка большей части В-лимфоцитов, относящихся к В2-субпопуляции клеток.
В1-субпопуляция лимфоцитов еще в эмбриональном периоде покидает костный мозг. Физиологическая регенерация В1-лимфоцитов в течение жизни человека поддерживается преимущественно в брюшной и плевральных полостях.
В1- и В2-субпопуляции лимфоцитов отличаются по своей функциональной значимости и экспонируемым на поверхности мембраны маркерам.
В процессе дифференцировки В2-лимфоцитов на их мембране экспонируются рецепторы иммуноглобулиновой природы, причем, незрелые В2-лимфоциты экспрессируют IgМ и небольшое количество молекул главного комплекса гистосовместимости класса II. По мере созревания В2-лимфоцитов на их поверхности экспрессируются молекулы иммуноглобулинов всех 5 классов. В то же время появляются рецепторы для различных компонентов комплемента и другие маркерные молекулы, в частности, СD19, СD21, СD23, СD35. Антигенчувствительными рецепторами В-лимфоцитов являются мембраносвязанный мономер IgМ, а возможно, и IgD.
Степень зрелости В-лимфоцитов определяется наличием на их мембране следующих рецепторов: антигенспецифических иммуноглобулиновой природы, к Fc-фрагменту Ig, к комплементу, к поликлональным В-активаторам, липополисахаридам и монопротеинам. В2-лимфоциты являются предшественниками клеток – плазмоцитов, обеспечивающих синтез иммуноглобулинов в ответ на антигенную стимуляцию. Необходимым условием их трансформации в клетки-продуценты антител является их взаимодействие с Т-лимфоцитами-хелперами.
В связи с этим очевидно, что В2-лимфоциты ответственны за развитие гуморального ответа на тимусзависимые антигены.
В настоящее время определена структура рецепторов В2 лимфоцитов, включающих помимо иммуноглобулина еще 4 полипептидные цепи, расположенные попарно с каждой стороны молекулы иммуноглобулина, обозначаемые как Ig-a и Ig-b. Назначение указанных пептидных компонентов заключается в проведении сигнала о связывании антигена иммуноглобулиновой частью рецептора в глубь клетки.
Как указывалось выше, дифференцировка и поддержание жизненного пула В1-лимфоцитов осуществляются за пределами костного мозга в основном в плевральной и брюшной полостях. В1-лимфоциты обеспечивают синтез антител только класса IgМ без взаимодействия с Т-хелперами. Особенностью иммуноглобулинов, продуцируемых В1-лимфоцитами, является их широкая перекрестная реактивность в ответ на воздействие бактериальных антигенов полисахаридной структуры.
Не доказана возможность реакции В1-лимфоцитов на антигены белковой природы. Характерно наличие на поверхности В1-лимфоцитов маркерной молекулы CD5, поэтому указанную субпопуляцию В-лимфоцитов нередко именуют CD5-лимфоциты.
В2-лимфоциты после созревания в костном мозге поступают в системный кровоток, а затем заселяют периферические лимфоидные органы (селезенку, лимфатические узлы, лимфоидную ткань кишечника, миндалин и других органов).
Как известно, в периферической крови в условиях нормы содержатся от 20 до 40 % лимфоцитов, причем, среди лимфоцитов периферической крови на долю В-лимфоцитов приходится лишь 20–30 %; 50–65 % составляют Т-лимфоциты и около 10 % лимфоцитов не имеют рецепторов, свойственных Т- и В-лимфоцитам; их называют «нуль-лимфоциты».
Незначительная часть лимфоцитов периферической крови имеет на своей поверхности маркеры Т- и В-лимфоцитов (D клетки).
В лимфатических узлах В-лимфоциты располагаются в тимуснезависимых зонах фолликулов, составляя лишь 35 % всех лимфоцитов. В-лимфоциты находятся в кортикальной зоне в покоящемся состоянии и образуют так называемые первичные фолликулы. На фоне антигенной стимуляции они формируют вторичные фолликулы.
Важным компонентом системы иммунопоэза является селезенка, в которой содержание В-лимфоцитов достигает 65 %, что обеспечивает быстрое накопление антителпродуцирующих плазматических клеток на фоне антигенной стимуляции.
При внутривенном введении антигена антитела образуются преимущественно в селезенке.
Лимфоидные образования червеобразного отростка, а также групповые лимфатические фолликулы – пейеровы бляшки – участвуют в синтезе антител класса IgA, тем самым обеспечивая иммунитет слизистых.
В миндалинах глоточного кольца имеются Т- и В-лимфоциты, обеспечивающие клеточный и гуморальный механизмы защиты, в частности, синтез антител класса IgA и IgG. В связи с этим тонзиллэктомия, проведенная в раннем возрасте, снижает противоинфекционную защиту глоточного кольца.
Т-система лимфоцитов
Тимус, как и костный мозг, является центральным, или первичным органом лимфоидной ткани. В составе тимуса имеются несколько долек, каждая из которых представлена эпителиальными клетками, дендритными клетками, макрофагами, лимфоцитами и другими клетками. Эпителиальные клетки тимуса синтезируют такие пептидные гормоны, как тимолин, тимозины, тимопоэтин. Крупные эпителиальные клетки коркового вещества выполняют роль «клеток-кормилиц» для лимфоцитов. Эпителиальные клетки коркового вещества имеют разветвленные отростки с большим количеством молекул главного комплекса гистосовместимости. В то же время на поверхности отростков эпителиальных клеток мозгового вещества тимуса представлены молекулы главного комплекса гистосовместимости классов II и I.
Продвигаясь из коркового вещества в мозговое, предшественники Т-лимфоцитов дифференцируются в Т-лимфоциты под влиянием тимических гормонов. В то же время секретируемые в кровь гормоны тимуса обеспечивают дозревание Т-лимфоцитов в периферических лимфатических органах – селезенке и лимфатических узлах.
Долгое время полагали, что дифференцировка всех Т-лимфоцитов происходит на территории тимуса. Однако в настоящее время обнаружены Т-лимфоциты с рецептором, большая часть которых дифференцируется экстратимически, преимущественно в стенке кишечника. В тимусе Т-лимфоциты составляют менее 0,5 % от общего числа тимоцитов.
Тимические Т-лимфоциты приобретают способность распознавать антигены в комплексе с собственными продуктами главного комплекса гистосовместимости.
Масса вилочковой железы достигает максимума к 10–12 годам, что соответствует периоду «иммунного созревания». Инволюция тимуса начинается обычно после 30 лет, но полной инволюции никогда не происходит. Касаясь особенностей дифференцировки Т-лимфоцитов в тимусе, следует отметить сохранение в клетках-предшественниках уникального репарирующего хромосомы фермента-теломеразы, что указывает на возможность многократной пролиферации Т-лимфоцита в течение жизни.
На мембране тимических Т-лимфоцитов экспрессируется специфический рецептор для распознавания антигена. В отличие от антигенраспознающего рецептора В-лимфоцитов иммуноглобулиновой природы специфический рецептор Т-лимфоцита является гетеродимером, состоящим из a- и b-цепей, обеспечивающих распознавание специфичности антигена, а также молекулы CD3. Последняя состоит из трех пептидных цепей и обеспечивает передачу сигнала о взаимодействии антигенраспознающих пептидных цепей a, b с антигеном в глубь клетки. Таким образом, полная структура рецептора Т-лимфоцитов представляется комплексом из пяти пептидов, включающих гетеродимер и молекулу CD3. Поверхностными антигенными маркерами Т-лимфоцитов являются CD3-рецепторы.
Помимо дифференцировки Т-лимфоцитов в тимусе осуществляются процессы элиминации и позитивной селекции указанных клеток. Элиминации подвергаются Т-лимфоциты, не связавшие или чрезвычайно сильно связавшие своим рецептором антигены системы МНС I и II класса, укомплектованные на клеточной мембране дендритных клеток тимуса. Такие тимоциты способны реагировать против собственных антигенов организма. Позитивная селекция проявляется в защите от апоптоза тех Т-лимфоцитов, которые связали своим антигенчувствительным рецептором антигены I и II класса МНС (HLA) со средней аффинностью.
Содержание Т-лимфоцитов в периферической крови достигает 50-65 % всех лимфоцитов крови, в грудном лимфатическом протоке – 85 % лимфоцитов.
Уровень Т-лимфоцитов в селезенке составляет 35 %, в лимфатических узлах – 65 %, где они занимают паракортикальные или тимус-зависимые зоны.
Главный комплекс гистосовместимости – группа генов, играющих важную роль не только в регуляции контроля иммунного ответа на аллотрансплантаты, но и в контроле клеточных взаимодействий.
Установлено, что система HLA (МНС) локализуется на коротком плече справа от центромеры VI аутосомной пары хромосом, включает примерно 105-106 генов. Продукты этих генов поставляются на мембраны клеток и являются антигенами гистосовместимости.
Гены, кодирующие антигены системы HLA, делят на IV класса.
Гены I класса – А, В, С, а кодируемые ими продукты – HLA-А, HLA-B, HLA-C. Гены II класса включают D-область, в которой, в свою очередь, выделяют 4 сублокуса: HLA-D, HLA-DR, HLA-DQ, HLA-DP. В состав III класса входят гены компонентов комплемента С2, С4а, С4в, пропердиновый фактор Вf. Антигены III класса присутствуют в сыворотке, на мембранах клеток их нет. К IV классу условно отнесены гены, связь которых с системой HLA требует дальнейших доказательств. Антигены HLA-системы I–II классов имеют гликопротеидную структуру. Антигены I класса присутствуют практически на всех ядросодержащих клетках организма, за исключением ранних эмбриональных и злокачественных клеток; в наибольшем количестве представлены на мембранах лимфоцитов, эпителиальных клетках, эндотелии, дендритных антигенпредставляющих клетках. Антигены А, В, С локусов системы HLA занимают примерно около 1 % клеточной поверхности.
Антигены II класса есть только на В-лимфоцитах, Т-лимфоцитах, макрофагах, дендритных антигенпредставляющих клетках.
Антигены I–II классов системы HLA выступают в качестве рецепторов для чужеродных антигенов. Антигенам I класса отводится главная роль во взаимодействии между клеткой-мишенью и Т-киллером в реакциях гиперчувствительности замедленного типа, в развитии инфекционного иммунитета. Между тем, Т-хелперы как предшественники, так и зрелые, распознают антигены II класса системы HLA в комплексе с негидролизованной частью антигена, в результате чего синтезируется интерлейкин-2. В свою очередь, интерлейкин-2 стимулирует созревание эффекторных клеток – Т-киллеров.
В связи с этим очевидна важная роль активности генов I и II классов в механизмах развития иммунных и аллергических реакций.
Следует отметить, что в системе HLA в структуре DR, т.е. генах II класса, предполагается наличие генов иммунного ответа (immune response).
HLA-DR-антигены экспонируются на В-лимфоцитах, макрофагах, эндотелии сосудов, сперматозоидах. На Т-клетках HLA-DR антигены в обычном состоянии не обнаруживаются, экспонируются лишь на фоне антигенной стимуляции.
Таким образом, HLA (МНС)- система представляет собой полиморфную систему генов и кодируемых ими продуктов- антигенов, экспонированных на мембранах различных клеток, участвующих в развитии иммунологических реакций.
Субпопуляционная характеристика T-лимфоцитов
Как указывалось выше, все Т-лимфоциты имеют на своей поверхности молекулу CD3, представленную 3 полипептидными цепями. Эти цепи армируют по бокам рецептор Т-лимфоцитов для антигена. У Т-лимфоцитов млекопитающих есть два молекулярных типа рецепторов для связывания антигена. Каждая из 4 пептидных цепей антигенсвязывающего рецептора Т-лимфоцитов кодируется отдельным геном. На каждом лимфоците есть только одна из двух пар полипептидных цепей.
В то же время, на мембранах Т- и В- лимфоцитов располагаются поверхностные антигенные маркеры, обозначаемые символом CD (Claster definion). В настоящее время идентифицировано всего свыше 130 маркерных молекул клеточных мембран лимфоцитов.
Субпопуляция CD4 Т-лимфоцитов
Характерная особенность субпопуляции CD4 Т-лимфоцита состоит в том, что антигенраспознающий рецептор представлен a- и b-полипептидными цепями. Последний способен распознавать только пептидные антигены в комплексе с молекулами МНС-II, экспрессируемыми на антигенпредставляющих дендритных клетках, В-лимфоцитах, макрофагах, эндотелии сосудов. Свободный антиген не распознается CD4-лимфоцитами.
Основными функциональными субпопуляциями CD4 лимфоцитов являются Т-хелперы (Th0, Th1, Th2, Th3) , выделена также минорная субпопуляция цитотоксических лимфоцитов с мембранным маркером CD4.
Разделение ТCD4-лимфоцитов на отдельные субпопуляции обусловлено их способностью к синтезу тех или иных лимфокинов с различной степенью интенсивности.
Ниже представлена функциональная характеристика отдельных субпопуляций CD4-лимфоцитов, используемая в нашей стране на протяжении ряда лет.
Th0 отличаются незначительной интенсивностью экспрессии генов, кодирующих цитокины всех других трех субпопуляций (Th1, Th2, Th3).
Th1 продуцируют лимфотоксин, интерлейкин-2, g-интерферон, туморнекротизирующий фактор (ФНО).
Th2 на фоне антигенной стимуляции продуцируют интерлейкин-4, интерлейкин-5, интерлейкин –9, интерлейкин-10, интерлейкин-13.
Th3 выделяют интерлейкин-4, интерлейкин-10, трансформирующий фактор роста В.
Однако, в последние годы в отечественной и зарубежной литературе предложено, наряду с представленными выше субпопуляциями Th1 и Th2, выделить субпопуляцию Th17, ответственную за развитие аутоиммунных воспалительных реакций за счет продукции провоспалительных и гемопоэтических цитокинов (TNFα, IL–6, IL–1β, IL–10, GCSF и др.
И, наконец, к числу Th относятся так называемые регуляторные Т–лимфоциты с маркерными молекулами CD4 + , CD25 + , Fox 3 , оказывающие иммуносупрессирующее действие за счет IL–10 , TGFB. Treg составляют около 10 % периферической крови, подавляют гиперактивность иммунной системы.
Следует отметить, что на поверхности всех лимфоцитов помимо антигенчувствительных рецепторов, CD-рецепторов различных категорий к малоизученным лигандам, имеются рецепторы к интерлейкинам, С3- и С4-компонентам комплемента, к Fc-фрагментам иммуноглобулинов и другим антигенам. Установлено, что продуцируемые Th цитокины обеспечивают межклеточное взаимодействие не только между отдельными субпопуляциями лимфоцитов, но и клетками мононуклеарной фагоцитирующей системы, костномозговыми клетками и другими клеточными элементами.
В настоящее время идентифицировано около 300 цитокинов, а история их изучения началась в 40-е годы 20 в. с описания биологических эффектов кахектина. Термин цитокины предложен N. Cohen в 1974 г.
Цитокины – белково-пептидные факторы с ММ от 5 до 50 кДа, участвующие в формировании и регуляции защитных реакций в ответ на действие экзогенных или эндогенных патогенов инфекционной или неинфекционной природы.
Цитокины включают следующие группы пептидов: интерлейкины, интерфероны, ростовые факторы, факторы некроза опухоли, колониестимулирующие факторы, хемокины.
К особенностям биологического действия действия цитокинов относят аутокринную стимуляцию, паракринную регуляцию межклеточного взаимодействия, а также системное действие. Цитокины обеспечивают одномоментное вовлечение иммунной, эндокринной и нервной систем в формирование реакций адаптации в ответ на действие стрессорного раздражителя.
Цитокины не являются антигенспецифическими факторами, но мониторинг показателей их содержания в крови позволяет сделать заключение об интенсивности антигенной стимуляции моноцитарно–макрофагальной и лимфоидной систем, степени активности патологических процессов или заболеваний.
На фоне антигенной стимуляции прежде всего возникает секреция цитокинов 1-го поколения с выраженной провоспалительной активностью (IL–1, IL–6, TNFα), которые индуцируют биосинтез центрального регуляторного цитокина IL–2, а затем противовоспалительных цитокинов IL–4, IL–10, TGFB и др.
Такое разделение цитокинов на про– и противоспалительные соединения далеко не всегда оправдано: так, IL–4 обеспечивает развитие IgЕ–зависимых атопических воспалительных реакций, а IL–10 подавляет продукцию ряда провоспалительных цитокинов, обеспечивающих формирование защитных реакций в зоне воспаления.
Достаточно четко определено участие Th в продукции цитокинов. Так Th1 продуцируют IFNγ, IL–2, TNFα, а Th2 – IL4, IL–5, Il–9,IL–10, IL–13.
Th17 – участники аутоиммунных реакций, синтезируют IL–17, а также GCSF, TNF, IL–6, IL–10, IL–12 и др.
Treg CD4 + , CD25 + являются источниками IL–10, TGFB, подавляющих суперэкспрессию ряда про– и противовоспалительных цитокинов.
Таким образом, в связи с гетерогенностью структуры лимфоидной ткани и многогранностью функций лимфоцитов становится очевидной значимость этих клеточных элементов в обеспечении не только специфических иммунологических механизмов защиты, развитии аллергических реакций гуморального и клеточного типов, но и в формировании синдрома системного воспалительного ответа за счет продукции цитокинов. Последние обладают способностью регулировать не только межклеточные взаимодействия в лимфоидной и моноцитарно-макрофагальной системах и, соответственно, интенсивность развития адаптивных реакций, но и дистантным действием на гипоталамо-гипофизарно-надпочечниковую систему, обеспечивая реализацию стресс-реакций, а также интенсивность продукции острофазных белков, изменение функциональной активности жизненно важных органов и систем.
Читайте также:
