Длительная катетеризация ретробульбарного пространства при эндофтальмите
Добавил пользователь Alex Обновлено: 30.01.2026
Авторы: Егоров В.В. 1 , Поваляева Д.А. 2 , Смолякова Г.П. 1 , Данилова Л.П. 2 , Еманова Л.П. 2
1 Хабаровский филиал ФГАУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» МЗ РФ; КГБОУ ДПО «Институт повышения квалификации специалистов здравоохранения» МЗ Хабаровского края
2 Хабаровский филиал ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» МЗ РФ; КГБОУ ДПО «Институт повышения квалификации специалистов здравоохранения» МЗ Хабаровского края
Ключевые слова: оптический неврит, кортикостероидная терапия, адресная доставка, дексаметазон.
Для цитирования: Егоров В.В., Поваляева Д.А., Смолякова Г.П., Данилова Л.П., Еманова Л.П. Новые возможности повышения эффективности патогенетического лечения оптического неврита // РМЖ. Клиническая офтальмология. 2016. № 3. С. 140–144.
Для цитирования: Егоров В.В., Поваляева Д.А., Смолякова Г.П. и др. Новые возможности повышения эффективности патогенетического лечения оптического неврита. Клиническая офтальмология. 2016;17(3):140-144.
New features to increase the efficiency of pathogenetic treatment of optic neuritis
Egorov V.V. 1,2 , Povalyaeva D.A. 1 , Smolyakova G.P. 1,2 , Danilova L.P. 1,2 , Emanova L.P. 1
1 The Khabarovsk branch of the State Institution Eye Microsurgery Complex named after S.N. Fyodorov
2 Postgraduate Institute for Public Health Workers, Khabarovsk
Objective. To evaluate the clinical effectiveness of the irrigation-infusion method of local glucocorticosteroid (GCS) therapy in patients with optic neuritis (ON).
Material and methods. The study involved 40 patients (49 eyes) with ON aged from 17 to 36 years (avg 26.4±5.7 years). Depending on the method of GCS infusion – dexamethasone, patients were divided into two groups: main (23 pers. – 28 eyes) and control (17 pers. – 21 eyes). Patients of the main group received dexamethasone infusion to the optic nerve through the implanted in the retrobulbar space irrigation system in the first half of the day at a dose of 2 mg. During first four days – 4 infusions (daily dose of 8 mg); on days 5–7 – 3 infusions (6 mg); on days 8–9 – 2 infusions (4 mg); on tenth day – 1 infusion (2 mg). The total dose of dexamethasone was 60 mg. Control group received dexamethason intravenously at a dose of 8 mg during first 4 days, then 3 days – 6 mg, 2 days – 4mg and the last 10th day – 2 mg. Additionally during these10 days patients received daily retrobulbar dexamethasone injections at a dose of 2 mg. The total dose of dexamethasone was 80 mg.
Results and discussion. All studied parameters improved in both groups of patients with OТ after GCS treatment. However, a more significant positive changes and shortening the terms of their occurrence were obtained in the main group during the topical corticosteroids therapy by irrigation-infusion method in comparison with the control group who received traditional GCS treatment regimen.
Conclusions. Clinical and functional benefits of infusion-irrigation method of corticosteroids retrobulbar infusion compared to the traditional scheme of infusion is 1.3 times increase of visual acuity and 2.7 times reduction of incidence of postneuritic optic nerve atrophy during 12 months follow-up.
Compared with the traditional scheme of GCS therapy irrigation-infusion method reduces terms of recovery of lost visual functions by 3 times, and decreases the total corticosteroid dose in 1.2 times.
Key words: optic neuritis, corticosteroid therapy, address delivery, dexamethasone.
For citation: Egorov V.V., Povalyaeva D.A., Smolyakova G.P., Danilova L.P., Emanova L.P. New features to increase the efficiency of pathogenetic treatment of optic neuritis // RMJ. Clinical ophthalmology. 2016. № 3. P. 140–144.
Статья посвящена новым возможностям повышения эффективности патогенетического лечения оптического неврита

В структуре заболеваний зрительного нерва (ЗН) оптический неврит (ОН) составляет 30–40% [1]. В 30–60% случаев при ОН наблюдается двустороннее поражение ЗН. Для ОН характерны особая тяжесть клинического течения, высокий риск потери зрения и наступления инвалидности. Практическая слепота при ОН встречается в 21% случаев, инвалидами по зрению становятся 15% пациентов, что обусловливает высокую медицинскую и социальную значимость данной проблемы [2–4].
Успех реабилитации больных ОН во многом зависит от своевременного лечебного воздействия на патогенетические механизмы заболевания [5].
Установлено, что ключевую роль в патогенезе ОН (независимо от причины его возникновения) играют активация нейроглии, избыточное образование нейроглией и клетками иммунной системы (ИС) провоспалительных цитокинов и других медиаторов воспаления, нарушения микроциркуляции и внутрисосудистого гемостаза, повышение проницаемости гематоневрального барьера, проникновение в аксоны ЗН гематогенных факторов ИС (Т- и В-лимфоцитов) и их сенсибилизация. В результате срыва механизмов иммунной толерантности происходит запуск клеточно-опосредованных иммунопатологических реакций аксонального поражения ЗН [6–8].
Как правило, триггером вышеописанных изменений являются сопутствующие острые и хронические вирусные и бактериальные инфекции.
К особенностям лечения ОН (до выяснения этиологии заболевания) относится незамедлительное проведение лечебных мероприятий, направленных на подавление иммунопатологических механизмов воспалительной реакции в ЗН и восстановление зрительных функций.
Базовым и самым эффективным методом неотложной патогенетической терапии ОН на ранних этапах его клинической манифестации считается системное (в/в, пероральное) и/или местное (ретробульбарное) введение глюкокортикостероидов (ГКС), блокирующих иммунопатологические, биохимические и патофизиологические механизмы развития воспалительного процесса в ЗН [2, 9–12].
Однако при системном введении ГКС из-за автономности органа зрения в ЗН не возникает терапевтической концентрации препарата, достаточной для быстрого и полного купирования воспалительного процесса и восстановления зрения. Ежедневные ретробульбарные инъекции ГКС могут привести к образованию внутриорбитальной гематомы, травматическим повреждениям ЗН и перфорации склеры глазного яблока с высоким риском необратимой потери зрения [13, 14].
Для достижения оптимального противовоспалительного эффекта у больных ОН нами применен ирригационно-инфузионный способ местной ГКС-терапии, при котором инфузии данного препарата в ретробульбарное пространство осуществляются через ирригационную систему [15]. Предложенный способ обеспечивает постоянную терапевтическую концентрацию ГКС, необходимую для быстрого и стойкого купирования воспалительного процесса в ЗН [16–18].
Целью настоящей работы явилась оценка клинической эффективности ирригационно-инфузионного способа местной кортикостероидной терапии у больных ОН.
Результаты и обсуждение. Результаты офтальмологического обследования в день поступления показали, что в большинстве случаев среди пациентов как основной (16 человек, 69,5±2,3%), так и контрольной группы (12 человек, 70,6±2,5%) ОН протекал в форме папиллита и сопровождался типичной офтальмоскопической картиной: гиперемией и нечеткостью границ диска ЗН различной степени выраженности; расширением венул и мелкими штрихообразными и петехиальными кровоизлияниями в ткань диска и перипапиллярную сетчатку; наличием воспалительного экссудата в задних отделах стекловидного тела и сосудистой воронке диска ЗН. У остальных больных основной группы (7 человек, 30,5±1,9%) и контрольной группы (5 человек, 29,4±2,5%) имел место ретробульбарный неврит с отсутствием явных офтальмоскопических изменений диска ЗН, подтвержденный показателями ЗВП и результатами ультразвукового В-сканирования его ретробульбарной части.
Исходная острота зрения при поступлении в клинику была резко снижена: в среднем до 0,14±0,02 отн. ед. у пациентов основной группы и до 0,18±0,03 у пациентов контрольной группы. При статической периметрии у пациентов обеих групп в центральном поле зрения (0–20 град.) диагностированы абсолютные и относительные скотомы, суммарное количество которых не имело достоверных межгрупповых различий (р>0,05) и составило у больных основной группы соответственно в среднем 18,6±1,5 и 14,1±0,5, контрольной – 17,4±1,3 и 14,7±0,7.
Как в основной, так и в контрольной группе в исходном состоянии у больных на глазах с ОН по сравнению с интактными глазами регистрировали равнозначные нарушения электрофизиологических показателей: достоверное увеличение латентных периодов и снижение амплитудных характеристик позитивного компонента Р100 ЗВП; статистически значимые повышение ПЭЧ и снижение ЭЛ ЗН (р <0,05). По данным ультразвукового В-сканирования в обеих группах больных ОН регистрировали соизмеримое увеличение диаметра ретробульбарной части ЗН до 5,2±0,5 мм в основной группе и 5,05±0,57 мм – в контрольной при норме 3,5±0,09 мм.
Динамика клинико-функциональных и ультразвуковых показателей у больных ОН при различных методах введения ГКС приведена в таблице 1.
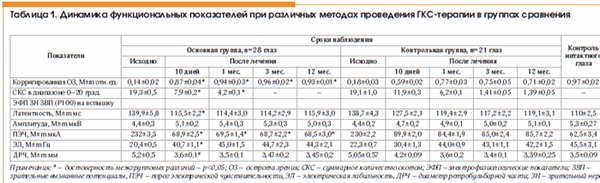
Анализ представленных в таблице 1 данных показал, что в обеих группах больных ОН после окончания ГКС-терапии отмечалось улучшение всех изучаемых параметров. Однако более значимые положительные изменения и укорочение сроков их наступления наблюдались у больных основной группы при проведении топической ГКС-терапии ирригационно-инфузионным методом в сравнении с контрольной группой, в которой применялась традиционная схема лечения ГКС.
Так, острота зрения у больных основной группы сразу после окончания курса ГКС-терапии возросла в среднем в 5,3 раза против исходной, в то время как у пациентов контрольной группы она увеличилась в среднем только в 3,3 раза (р <0,05).
Данные электрофизиологических исследований после завершения ГКС-терапии у больных основной группы в сравнении с исходными в среднем характеризовались снижением латентности на 17,4±1,5% и повышением амплитуды на 15,9±0,9% Р100 ЗВП; увеличением почти в 2 раза ЭЛ и снижением в 3,4 раза ПЭЧ ЗН и статистически значимо не отличались от нормы (р≥0,05). В то же время в контрольной группе пациентов, получавших ГКС-терапию традиционным методом, относительно исходных значений был менее выраженный клинико-функциональный эффект: снижение латентности на 8,1%±0,5, повышение амплитуды Р100 ЗВП на 6,8±0,4%, увеличение ЭЛ в 1,3 раза и уменьшение ПЭЧ ЗН в 2,6 раза. И только спустя 1 мес. после лечения средние значения клинико-функциональных показателей у пациентов контрольной группы достигли значений, соответствующих норме (р>0,05).
По данным компьютерной периметрии у всех больных основной группы после завершения курса инфузионно-ирригационной ГКС-терапии регистрировали уменьшение в 3,5 раза суммарного количества скотом, которые к 1 мес. наблюдения полностью исчезали. В контрольной группе после окончания традиционной ГКС-терапии отмечали менее заметное снижение (в среднем в 1,3 раза относительно исходных) суммарного количества скотом и диагностировали их присутствие у 72% пациентов даже к 3 мес. наблюдения.
В процессе ультразвукового исследования была выявлена тесная взаимосвязь между темпами восстановления нормального диаметра ретробульбарной части ЗН и утраченных зрительных функций. У больных основной группы сразу после окончания инфузионно-ирригационной ГКС-терапии диаметр ретробульбарного отдела ЗН достигал нормальных значений, что соответствовало максимальному улучшению клинико-функциональных показателей. В контрольной группе после традиционной схемы ГКС-терапии наблюдали удлинение периода восстановления нормального диаметра ретробульбарного отдела ЗН (до 1 мес.), что сопровождалось пролонгированием сроков улучшения зрительных функций.
Через 12 мес. после окончания курса лечения ОН ГКС у большинства пациентов основной группы (21 человек – 26 глаз (92,9%) достигнутый ранее результат лечения оставался стабильным. И только на 2 глазах (7,1 %) у 2 человек была выявлена тенденция к снижению остроты зрения до 0,7–0,8 (на 0,1–0,2 ниже ранее достигнутого уровня). Офтальмоскопически это проявлялось деколорацией височной половины диска ЗН и расценено нами как свидетельство развития постневритической частичной атрофии ЗН.
У пациентов контрольной группы к этому периоду наблюдения постневритическая частичная атрофия ЗН диагностировалась в 2,7 раза чаще, чем в основной группе, и была отмечена на 4 глазах (19%) у 4 человек. У всех этих пациентов было выявлено снижение остроты зрения до 0,4–0,7 (на 0,2–0,3 ниже ранее достигнутого уровня) и электрофизиологических показателей, а также офтальмоскопически отмечалась деколорация диска ЗН.
Выводы
1. Топическая ретробульбарная инфузионно-ирригационная ГКС-терапия оптимизирует эффективность медицинской реабилитации больных ОН путем быстрого купирования воспалительной реакции, полноценного восстановления и сохранения способности к нормальному функционированию нервных волокон ЗН.
2. Клинико-функциональным преимуществом инфузионно-ирригационного метода ретробульбарного введения ГКС по сравнению с традиционной схемой введения являются увеличение в 1,3 раза остроты зрения и уменьшение в 2,7 раза частоты развития постневритической атрофии ЗН при сроках наблюдения 12 мес.
3. По сравнению с традиционной схемой ГКС-терапии ирригационно-инфузионный метод введения в ретробульбарное пространство ГКС сокращает в 3 раза длительность периода восстановления утраченных зрительных функций при уменьшении в 1,2 раза суммарной курсовой дозы ГКС, что особенно важно, учитывая известные в клинической фармакотерапии их побочные эффекты.
4. Предложенный способ адресной доставки в ткани ЗН ГКС малотравматичен, прост в использовании, не вызывает побочных реакций и в связи с высокой эффективностью может быть рекомендован для широкого применения в клинической практике.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Длительная катетеризация ретробульбарного пространства при эндофтальмите
Супрахориоидальное введение и непрерывная перфузия стекловидного тела антибиотиками при эндофтальмите
Т. А. Морозова предлагает с целью лечения эндофтальмита вводить антибиотики в супрахориоидальное пространство. При этом автор считает, что данный способ терапии является более обоснованным, чем введение препарата в стекловидное тело. В последнем случае, по мнению автора, происходит воздействие на следствие (экссудат), а не на причину инфекции. По мнению Л. Е. Федорищсвой, этот метод введения более эффективен при инфекции переднего отдела глаза — гнойном иридоциклитс, и равнозначен по эффективности внутри камерному введению антибиотика.
Данный метод в настоящее время широко используется в профилактике раневой инфекции при роговично-склеральных и склеральных прободных ранениях глазного яблока.
Непрерывная перфузия стекловидного тела при эндофтальмите
Данный способ лечения бактериального эндофтальмита заключается в длительном непрерывном орошении инфицированного стекловидного тела раствором соответствующего антибиотика. Непрерывное введение антибактериального препарата и синхронное ему выведение из полости глаза продуктов распада при воспалительном инфекционном процессе обеспечивают поступление антибиотика непосредственно в очаг инфекции и активное дренирование полости глазного яблока (Южаков А. М.).
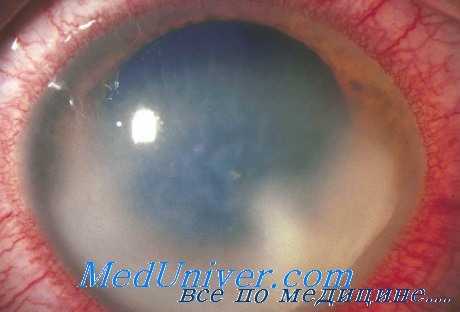
Через надрезы склеры в стекловидное тело вводят две иглы (безопаснее использовать иглы с ограничителем типа иглы Пур-Неддена), перфорируя оставшиеся склеральные слои. Предварительные П-образные швы затягивают вокруг игл, герметизируя места склеральных пункций. Посредством тонких силиконовых трубочек иглы соединяют со специальным автоматическим дозирующим устройством и фиксируют на фиксационном кольце, которое укрепляют па голове больного. При этом исключаются случайные перекосы введенных в стекловидное тело перфузионных игл и травматизация хрусталика или внутренних оболочек глаза. Острие игл, особенно приводящей (ирригационной), должно быть направлено строго в передние слои стекловидного тела. В противном случае нетоксичная для сетчатки доза антибиотика может стать токсичной при его введении в непосредственной близости от сетчатой оболочки. Необходимо строго выполнять данное требование при любом интранитреальиом введении антибиотика.
Вводимые в стекловидное тело дозы антибиотиков рассчитывают таким образом, чтобы они при непрерывном и длительном введении не превышали терапевтические и были нетоксичными для сетчатой оболочки. Аппарат должен обеспечивать поступление раствора антибиотика в полость глаза со скоростью не более 10 капель в мин.
При использовании данного способа лечения необходимо учитывать следующее обстоятельство. Определенный диаметр перфузионных игл и микрокатетеров ограничивает возможность применения данного способа лечения при некоторых видах помутнения стекловидного тела. Экссудат в стекловидном геле при прогрессирующем эндофтальмите подвержен быстрой организации. Образующиеся в связи с этим плотные экссудативные пленчатые образования могут облитерировать просвет отводящей перфузионной иглы или микрокатетера, что приводит к нарушению режима перфузии.
Таким образом, предлагаемый способ лечения бактериального эндофтальмита целесообразно использовать в начальных стадиях патологического процесса при еще достаточно жидкой консистенции стекловидного тела.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Витрэктомия при внутриглазной раневой инфекции - эндофтальмите
Известно, что в общей хирургии одним из главных принципов лечения виутриполостных гнойных процессов является вскрытие гнойной полости и освобождение ее от скопившегося гноя. Однако в клинической офтальмологии способы лечения внутриглазной гнойной инфекции, основанные на этом принципе, до 80-х гг. не применялись в силу тонкого анатомического строения глазного яблока и большой опасности повреждения внутриглазных структур при подобных операциях. Совершенствование офтальмохирургической техники и технического обеспечения внутриглазных, в том числе интравитреальных вмешательств, позволило обеспечить существенный прогресс в данной области.
Исторической основой для современных хирургических методов лечения внутриглазной инфекции стало признание практически всеми офтальмологами необходимости удаления внутриглазного инородного тела при наличии раневого гнойного воспаления в полости глаза. В предыдущих статьях на сайте показана роль микрофлоры, попавшей и глаз вместе с инородным телом, в развитии этого воспаления. По этой причине удаление инфицированного инородного тела является обязательной операцией в комплексе современного лечения внутриглазной инфекции. При этом инородное тело удаляют вместе с окружающим его гнойным экссудатом, а в полость глазного яблока вводят антибиотики в указанных выше дозах.
Техника удаления инородных тел в зависимости от их природы, локализации, сопутствующих изменений глазного яблока подробно описана в соответствующих руководствах, например в нашей монографии «Травмы глаза» (Гундорова Р. А., Малаев А. А., Южаков А. М.).
В конце 70-х — начале 80-х гг. появились первые публикации об использовании для лечения эндофтальмита специальных аппаратов — витреотомов.
В настоящее время витрэктомия получила всеобщее признание. Однако вопрос о сроках витрэктомии и ее роли в лечении внутриглазной раневой инфекции остается дискутабельным. Большинство офтальмологов признает целесообразность и особую эффективность ранней витрэктомии как диагностической и терапевтической манипуляции, включая забор образца стекловидного тела и введения антибиотиков. Вместе с тем некоторые авторы считают, что немедленная витрэктомия с введением антибиотиков должна проводиться только при эндофтальмите с экссудацией в стекловидном теле, препятствующей офтальмоскопии глазного дна. Они рекомендуют проводить отсроченную витрэктомию, рассматривая ее как вспомогательное средство при отсутствии эффекта от интравитреального введения антибиотиков (Speaker). Объем витрэктомии во всех случаях лечения эндофтальмита должен быть ограниченным, что связано с высоким риском интраоперанионных осложнений.
Цель витрэктомии сводится к уменьшению микробной нагрузки, удалению продуктов воспаления и токсинов, предоставлению возможности циркуляции антибиотиков и их свободного доступа ко всем отделам витреальной полости.
При лечении позднего вялотекущего эпдофтальмита со слабовирулентной флорой к витрэктомии прибегают только после безуспешного иптравитреального введения комбинации антибиотиков и микробиологического подтверждения диагноза. Процедура заключается в максимальном удалении листков капсулы хрусталика как очага инфекции и иногда ИОЛ.
По способу хирургического подхода можно выделить две группы операций на стекловидном теле — витрэктомии. К первой группе относятся хирургические вмешательства с широким разрезом — до 180° окружности лимба или плоской части цилиарного тела. Это так называемая витрэкто-мия «open sky» («открытое небо»). Учитывая, что при таких операциях существует опасность гипотонии глаза и развития тяжелых осложнений, связанных с этим, при их выполнении применяют различные склероудерживающие приспособления (например, кольцо Флиринга).
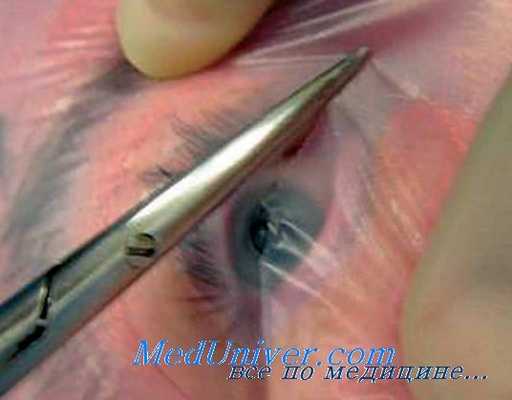
Подобная операция для лечения эндофтальмита была предложена В. В. Волковым в 1972 г. Суть ее заключается в широком вскрытии полости глазного яблока по лимбу (разрез на 3/4 его окружности) и иссечении из открытого стекловидного тела осумкованного гнойника с помощью микроножниц и микропинцета. Операция получила название витреопусэктомии.
Операции второй группы осуществляют через небольшой (1-2 мм) разрез склеры в области плоской части цилиарного тела или в зоне лимба. По этой причине их называют операциями «закрытого типа». Их осуществляют с помощью витреофагов различной конструкции с меньшей операционной травмой при сохранении офтальмотонуса в ходе операции почти на нормальном уровне. В силу малой травматичности эти операции имеют существенные преимущества в сравнении с витрэктомией по типу «открытое небо».
Эндофтальмит нередко сопровождается помутнением хрусталика. Причиной развития катаракты является как сама травма, так и токсическое воздействие на хрусталик продуктов распада при инфекционном процессе. При помутнении хрусталика витрэктомию сочетают с факофрагментацией. При этом характер помутнений стекловидного тела и плотность хрусталикового ядра, зависящая от возраста пострадавшего, являются основными факторами, определяющими показания к выбору прибора.
Клинические исследования показали, что ультразвуковые аппараты более рационально использовать в I стадии очагового и в I—II стадиях диффузного или смешанного эндофтальмита. В последующих стадиях патологического процесса, когда в стекловидном теле появляется большое количество грубых фиксированных помутнений, ультразвуковая фрагментация экссудативных пленчатых образований высокой плотности представляет значительные трудности. В настоящее время механические витреофаги являются наиболее часто применяемыми приборами для выполнения витрэктомии при эндофтальмите.
Закрытую витрэктомию выполняют, как правило, доступом через плоскую часть цилиарного тела. При диффузной форме эндофтальмита меридиан, по которому производят разрез склеры для введения рабочего наконечника прибора, не имеет принципиального значения. Чаще всего используют традиционные доступы в верхних квадрантах, если в этой зоне нет грубых изменений, вызванных травмой. Однако при очаговой форме инфекции разрез целесообразнее проводить в секторе, противоположном локализации очага в стекловидном теле. При этом данные ультразвукового предоперационного исследования, особенно В-мстода эхографии, являются определяющими.
Эхографию для уточнения зоны разреза необходимо проводить в положении больного лежа на спине, чтобы учесть возможные смещения очага в стекловидном теле. Удобнее всего это осуществлять непосредственно перед витрэктомией на операционном столе.
При наличии катаракты витрэктомию производят одновременно с удалением мутного хрусталика. При этом сначала выполняют факофрагментацию. Если передняя капсула хрусталика не повреждена при травме и сохраняет свою прозрачность, целесообразно сохранить ее как анатомический барьер между передним и задним отрезком глазного яблока. После этого удаляют помутнения стекловидного тела, начиная с передних сто отделов. Формируют «колодец» в центральных отделах стекловидного тела, доходящий до сетчатки. Затем удаляют боковые пропитанные экссудатом отделы стекловидного тела, сохраняя только крайние периферические отделы, играющие каркасную роль.
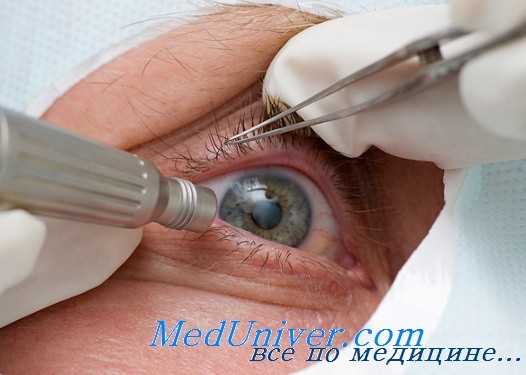
Операция требует хорошего визуального контроля и должна осуществляться с использованием высококачественных операционных микроскопов. При работе в задних отделах стекловидного тела для их визуализации используют специальную оптическую насадку на микроскоп или операционные контактные фундус-линзы.
В ходе операции необходимо стремиться к максимальному удалению измененного стекловидного тела. Однако при IV стадии диффузного и смешанного зндофтальмита это часто бывает невозможно из-за высокой плотности экссудативных пленок и их спаяния с внутренними оболочками глаза. В таких случаях иссекают только центральные отделы стекловидного тела во избежание повреждения внутренних оболочек и развития острого гемофтальма.
В некоторых случаях витрэктомию проводят передним путем через разрез в области лимба. Показанием для этого служит афакия, наличие хрусталиковых масс в передней камере, выпадение в переднюю камеру пропитанного гнойным экссудатом стекловидного тела, а также ограниченные экс-судативные помутнения передних слоев стекловидного тела. В этих случаях витрэктомию удобнее осуществлять мономануальным витреофагом, в рабочем наконечнике которого объединены режущая часть, аспирационная и ирригационная системы (например, витреофаг Клоти). Для выполнения операции необходим хороший мидриаз.
Одной из особенностей технического проведения закрытой витрэктомии при эндофтальмите является необходимость максимально полного удаления нежизнеспособных и инфицированных структур при значительном снижении возможности визуального контроля за манипуляциями внутри глаза, что обусловлено изменениями роговицы (ее отеком) ил и ригидностью зрачка. Для повышения прозрачности роговицы при ее отеке можно попытаться сделать ее более прозрачной с помощью инсталляции гипертонического раствора глюкозы, глицерола, метилцеллюлозы. В более тяжелых случаях можно удалить отечный эпителий с помощью скарификатора. При выраженных стромальных отеках роговицы или начавшейся гнойной инфильтрации эти приемы неэффективны. Приходится оперировать почти без визуального контроля, крайне осторожно, чтобы не повредить оболочки.
В клинике ММА разработан, испытан и рекомендуется для внедрения метод витрэктомии под непрерывным акустическим контролем в тех случаях, когда затруднено визуальное наблюдение за ходом внутриглазных манипуляций. Для этого датчик ультразвукового сканера устанавливают на склеру в противоположном от витреофага меридиане и производят сканирование полости глаза одномоментно с процессом витрэктомии. При этом следует располагать датчик в одной плоскости с наконечником витреофага, что позволит исключить повреждение внутренних оболочек и объективно оценить объем, локализацию и плотность удаляемых структур (Гундорова Р. А., Южаков А. М., Малаев А. А.).
По завершению витрэктомии предварительно наложенный шов на склеральный разрез в области плоской части цилиарного тела затягивают и в стекловидное тело вводят стерильный воздух.
Особенностью витрэктомии при эндофтальмите является необходимость перфузии через полость глаза значительно большего количества замещающего раствора, чем при обычной витрэктомии. Это объясняется необходимостью более полного механического вымывания из глаза микроорганизмов и продуктов их жизнедеятельности. Если обычно на одну витрэктомию следует расходовать 5-10 мл замещающего раствора, то при эндофтальмите это количество возрастает до 100-200 мл.
Если в глазу находится инородное тело, то его следует удалить, при доступности диасклерального подхода, на первом этапе лечения. Иногда удаление осколка позволяет купировать эндофтальмит и не производить витрэктомию.
Инородные тела, расположенные в задних отделах глаза, рекомендуется удалять одновременно с проведением витрэктомии. При планировании трансвитреалыюго удаления инородного тела следует предусматривать проведение склерального разреза над плоской частью цилиарного тела с учетом размера осколка. Для удаления инородных тел размером более 3 мм необходимый по размеру разрез оболочек выполняют параллельно лимбу в 3,5-4,0 мм от него. Вскрытие сосудистой оболочки осуществляют микроножницами после коагуляции и наложения предварительных швов на склеру.
Витрэктомию выполняют с использованием ирригационного раствора (замещающей жидкости), содержащего антибиотик. Таким образом, в процессе операции осуществляют непрерывную ирригацию полости глаза раствором антибактериального препарата. Используют антибиотики широкого спектра действия, те же, что и при интраокулярных инъекциях. Антибиотик выбирают, по возможности, с учетом чувствительности к нему выделенной микрофлоры. Концентрацию препарата рассчитывают таким образом, чтобы она была высокоактивной и в то же время не вызывала токсического поражения внутриглазных тканей, в частности сетчатой оболочки. Например, при использовании 0,9% раствора хлорида натрия в качестве замещающей жидкости оптимальной концентрацией гентамицина считается 8 мкг/мл (Peyman).
Данный способ лечения эндофтальмита более эффективен, чем витрэктомии, осуществляющаяся без интравитреалыюй инфузии антибиотика или с введением препарата методом однократной его инъекции в стекловидное тело в конце операции (Южаков А. М. и соавт.).
Опыт применения ирригационной терапии при различных глазных заболеваниях
Для цитирования: Даниленко О.А., Березников А.И. Опыт применения ирригационной терапии при различных глазных заболеваниях. Клиническая офтальмология. 2014;15(1):20.
Резюме Представлен обзор результатов использования метода катетеризации ретробульбарного пространства для длительной ирригационной терапии за период с 1999 по 2008 г. у 1748 пациентов с острой патологией зрительного нерва и сетчатки (воспалительные процессы, окклюзионные поражения сосудов), с атрофией зрительного нерва различного генеза, проникающими ранениями глаза. Метод длительной катетеризации ретробульбарного пространства зарекомендовал себя эффективным и безопасным способом лечения.
Представлен обзор результатов использования метода катетеризации ретробульбарного пространства для длительной ирригационной терапии за период с 1999 по 2008 г. у 1748 пациентов с острой патологией зрительного нерва и сетчатки (воспалительные процессы, окклюзионные поражения сосудов), с атрофией зрительного нерва различного генеза, проникающими ранениями глаза. Метод длительной катетеризации ретробульбарного пространства зарекомендовал себя эффективным и безопасным способом лечения.
Ключевые слова: метод катетеризации ретробульбарного пространства, ирригационная терапия, окклюзия сосудов сетчатки, атрофия зрительного нерва, проникающие ранения глаза.
Abstract
Results of irrigation therapy in various eye diseases
O.A. Danilenko, A.I. Bereznilov
Kursk State Medical University
The review of results of usage of a catheterization method of a retrobulbar space for prolonged irrigation therapy is presented. All studies were carried out in the period from 1999 to 2008 with participation of 1748 patients with acute pathology of an optic nerve and retina, atrophy of an optic nerve, penetrating eye wounds.
The technique of prolonged catheterization of the retrobulbar space is characterized as an efficient and safe method of treatment.
Key words: method of catheterization of retrobulbar space, irrigation therapy, occlusion of retinal vessels, atrophy of an optic nerve, penetrating eye wounds.
Проблема адресной доставки и поддержания длительной терапевтической концентрации лекарственных препаратов в тканях глазного яблока вблизи очага поражения весьма актуальна. Основными факторами, затрудняющими проникновение препаратов в ткани глаза, являются существующие на их пути гематоретинальный и гематоофтальмический барьеры [17, 22, 23].
Наименее эффективным является энтеральный путь введения препаратов, что связано с относительно медленным всасыванием действующего вещества в кровь из желудочно-кишечного тракта и инактивацией его ферментами печени [10, 18]. Инстилляции препаратов в конъюнктивальную полость, а также внутривенное и внутримышечное введение характеризуются быстрым проникновением препаратов в структуры глаза, но практически не создают необходимой терапевтической концентрации [6, 9].
По мнению многих авторов, наиболее эффективным является введение лекарственных веществ в переднюю камеру и интравитреально, минуя гематоофтальмический барьер. Так, при введении в переднюю камеру в тканях глаза накапливается до 32,3% от введенной дозы препарата, а при интравитреальном введении – 91,5% [2, 3, 6, 21]. Но при этом необходимо отметить относительную техническую сложность и травматичность метода. Другие авторы отдают предпочтение введению лекарственных веществ в супрахориоидальное пространство, в т. ч. путем его длительного дренирования [8, 14], отмечая при этом травматичный способ крепления и выведения дренажной трубки, доставляющий постоянный дискомфорт пациенту [4].
С учетом наличия анастомозов наружной сонной артерии и глазничной артерии разработан метод введения препаратов в поверхностную височную артерию путем ее катетеризации, а также ретроградно в глазничную артерию через супраорбитальную или лобную артерию [11]. Еще более технически сложным является метод введения лекарственных препаратов в вортикозную вену глаза [15].
В отличие от перечисленных выше методов введения лекарственных веществ более простыми в техническом исполнении и распространенными являются инъекции препаратов в субконъюнктивальное, парабульбарное и ретробульбарное пространство глаза [5, 7]. При субконъюнктивальных инъекциях в тканях глаза обнаруживается лишь 17,6% от вводимой дозы препарата, из них 13,9% – в склере, граничащей с областью введения, и 3,7% – в передней камере; после однократной ретробульбарной инъекции – 17,7% от введенной дозы медикамента, в сетчатке – 9,3%, в стекловидном теле – 5,2%. Через 4–6 ч от момента ретробульбарного введения содержание препарата в тканях глаза практически равно нулю [6, 7, 16]. Но увеличение кратности ретробульбарных инъекций в практической офтальмологии невозможно в силу объективных причин, таких как болезненность, возможность осложнений, занятость медицинского персонала.
Все вышеизложенное привело в 1989 г. к разработке на нашей кафедре под руководством профессора Д.С. Кроля метода катетеризации ретробульбарного пространства для длительной ирригационной терапии, а также его апробации и широкому внедрению в клинику (рац. предложение № 865-89 от 29.11.1989 г.). Метод позволяет не только поддерживать терапевтическую концентрацию лекарственного вещества в тканях глаза в течение всего курса лечения, но и снижать до минимума риск осложнений и болезненность при ретробульбарном введении [1]. Используя этот метод, можно не только вводить через катетер лекарственные вещества, но и проводить прямую электрофармакостимуляцию зрительного нерва посредством временной трансплантации через катетер игольчатого платино-иридиевого электрода. Благодаря своей эффективности и безопасности метод длительной катетеризации ретробульбарного пространства получил мировое признание, что подтверждено присуждением золотой медали и диплома I степени на выставке изобретений в г. Брюсселе в 1996 г.
Целью данной работы являлось изучение клинической эффективности метода катетеризации ретробульбарного пространства для длительной ирригационной терапии при различных глазных заболеваниях по данным кафедры офтальмологии Курского государственного медицинского университета.
Методы исследования
За прошедшее время четко конкретизировались показания к применению метода: острая патология зрительного нерва и сетчатки (воспалительные процессы, окклюзионные поражения сосудов), атрофии зрительного нерва различного генеза (для проведения электрофармакостимуляции), проникающие ранения глаза, в особенности у детей.
Имплантация катетера в ретробульбарное пространство проводилась в условиях операционной или процедурного кабинета: у взрослых – под местной анестезией, у детей – под кратковременным наркозом.
В дальнейшем, в течение всего курса лечения в процедурном кабинете медицинская сестра 4–6 раз в день делала инъекции необходимых для лечения препаратов. При проведении электрофармакостимуляции после инъекции препарата через катетер к зрительному нерву подводился электрод, посредством которого и осуществлялась терапия по данной методике. Длительность нахождения катетера в ретробульбарном пространстве составляла 10–14 сут.
За период с 1999 по 2008 г. метод был применен у 1748 пациентов. Мы проанализировали клиническую эффективность метода при наиболее тяжелой, трудно поддающейся традиционным методам терапии глазной патологии.
Одним из важнейших направлений применения метода является детская офтальмология, т. к. традиционные глазные инъекции у детей часто трудновыполнимы, а порой и просто невозможны в связи с неадекватным поведением ребенка. Под нашим наблюдением находились 214 детей с проникающими ранениями глазного яблока различной степени тяжести. Наибольшее количество составляли дети от 5 до 10 лет (110 больных, 51,4%), мальчики (199 больных, 93%), проживающие в сельской местности (170 больных, 79,4%). Проникающие ранения роговицы имелись у 143 пациентов (66,8%), корнеосклеральные – у 47 (22%), склеральные – у 24 (11,2%). Внутриглазная инфекция присутствовала у 40 больных (18,7%). Гнойный иридоциклит отмечался у 24 (11,2%) пациентов, эндофтальмит – у 16 (7,5%). Таким образом, в структуре инфекционных осложнений гнойный иридоциклит составлял 60%, эндофтальмит – 40%.
Ирригационная терапия через ретробульбарный катетер была проведена у 145 пациентов (67,8%). Контрольную группу, где применялись традиционные глазные инъекции, составили 69 больных (32,2%). Всем пациентам обеих групп после хирургической обработки ранения проводилась интенсивная общая и местная антибактериальная терапия, при этом местно идентичные антибиотики вводились в 1-й группе через катетер, во 2-й – с помощью глазных инъекций.
Второй категорией больных, у которых мы использовали метод, были больные с окклюзионными поражениями сосудов сетчатки и зрительного нерва. Под нашим наблюдением находилось 176 таких пациентов, из них мужчин – 95 (54%), женщин – 81 (46%). С непроходимостью центральной вены сетчатки или ее ветвей было 84 больных (47,7%), с непроходимостью центральной артерии сетчатки или ее ветвей – 18 (10,3%), с сосудистой оптической нейропатией – 74 (42%). Метод длительной катетеризации ретробульбарного пространства был применен у 98 больных (55,7%), из них у 45 – с окклюзией центральной вены сетчатки или ее ветвей, у 10 – с окклюзией центральной артерии сетчатки или ее ветвей, у 43 – с сосудистой оптической нейропатией.
Контрольную группу, в которой лечение проводилось с помощью традиционных глазных инъекций, составили 78 пациентов (44,3%), из них с окклюзией центральной вены сетчатки или ее ветвей – 39, с окклюзией центральной артерии сетчатки или ее ветвей – 8, с сосудистой оптической нейропатией – 31. Необходимые при данной патологии лекарственные препараты, вводившиеся в 1-й группе через катетер, а во 2-й – с помощью инъекций, а также применяемые для парентерального введения были идентичны (антикоагулянты, антиагреганты, кортикостероиды, вазодилятаторы, ретинопротекторы).
Средняя острота зрения и средний показатель суммарного периферического поля зрения при различных окклюзионных поражениях сосудов сетчатки в основной и контрольной группах при поступлении были примерно одинаковы.
С частичной атрофией зрительного нерва различного генеза было пролечено 542 человека (786 глаз). Одностороннее поражение наблюдалось у 298 человек, двустороннее – у 244. С глаукомой был 271 пациент, сосудистая атрофия наблюдалась у 192, поствоспалительная – у 122, травматическая – у 80, токсическая – у 55, центрального генеза – у 66.
Среди пациентов были выделены 2 группы – основная и контрольная. В основную группу вошли 465 человек (660 глаз), которым для проведения прямой электрофармакостимуляции были имплантированы катетеры в ретробульбарное пространство. Ретробульбарно вводились дексаметазон, эмоксипин, пирацетам, трентал, церебролизин. Один раз в день проводилась прямая электростимуляция игольчатым электродом, установленным через тот же катетер, с помощью аппарата «Амплипульс». Контрольную группу составили 77 пациентов (126 глаз), получавших лишь медикаментозное лечение: инъекции трентала парабульбарно, введение милдроната и эмоксипина под кожу в височной области, эмоксипина с дексаметазоном – под кожу в области сосцевидного отростка, электрофорез с никотиновой кислотой эндоназально.
Результаты исследования и их обсуждение
У детей с проникающими ранениями глазного яблока, которым лечение проводилось с применением нашего метода (145 больных), внутриглазная инфекция наблюдалась в 14,5% случаев (21 человек), в контрольной группе – в 27,5% случаев (19 человек). Гнойный иридоциклит в основной группе встречался в 7,6% случаев, а в контрольной – в 18,8%, то есть в 2,5 раза чаще, эндофтальмит – в 6,9% и 8,7% случаев соответственно, что чаще в 1,3 раза.
Сроки купирования явлений гнойного иридоциклита мы оценивали по времени исчезновения основных симптомов (перикорнеальная инъекция, цилиарная болезненность, рассасывание экссудата в передней камере, сроки восстановления рисунка радужной оболочки). Применение метода длительной катетеризации ретробульбарного пространства привело к сокращению сроков купирования симптомов иридоциклита в среднем на 1,8 сут. в сравнении с контролем (р <0,05).
Эффективность лечения эндофтальмитов мы оценивали по срокам исчезновения основных симптомов (болевой синдром, рассасывание экссудата в передней камере и стекловидном теле) и органосохранному эффекту. Применение метода привело к сокращению сроков купирования симптомов эндофтальмита в среднем на 2 сут. в сравнении с контролем (р <0,05), глазное яблоко удалось сохранить у 8 пациентов из 10 (80%), в контрольной группе – у 3 из 6 (50%).
В исследуемой группе больных с окклюзионными поражениями сосудов сетчатки и зрительного нерва (176 человек) применение метода длительной катетеризации ретробульбарного пространства у 98 пациентов привело к улучшению зрительных функций в 93,9% случаев (92 человека), в контрольной группе из 78 больных – в 88,5% случаев (69 человек). Острота зрения у больных в основной группе с окклюзией центральной вены сетчатки или ее ветвей повысилась в среднем на 0,18±0,02 (р <0,01), в контрольной – на 0,13±0,02, суммарное периферическое поле зрение расширилось в среднем на 67º±5º (р<0,01), в контрольной – на 40º±5º.
У больных в основной группе с окклюзией центральной артерии сетчатки или ее ветвей острота зрения после лечения увеличилась в среднем на 0,09±0,03 (р <0,05), в контрольной – на 0,07±0,04. Суммарное периферическое поле зрения расширилось в среднем на 35º±4,3º (р<0,05), в контрольной группе – на 21º±4,6º.
У больных в основной группе с сосудистой оптической нейропатией острота зрения после лечения увеличилась в среднем на 0,26±0,02 (р <0,01), а в контрольной – на 0,18±0,04, суммарное периферическое поле зрения расширилось в среднем на 80º±4,6º (р<0,01), в контрольной группе – на 64º±5º.
При проведении прямой электрофармакостимуляции у больных с частичной атрофией зрительных нервов в основной группе улучшение зрительных функций было достигнуто в 424 случаях (65%), а в контрольной – в 52 (41%), зрительные функции остались без перемен в основной группе в 136 случаях (36%), в контрольной – в 70 (59%). Случаев ухудшения зрительных функций отмечено не было.
Выводы
1. Доказана высокая эффективность метода длительной ирригационной терапии через катетер, имплантированный в ретробульбарное пространство, при лечении проникающих ранений глаз у детей, что выразилось в более быстром купировании симптомов воспаления глаза, а также органосохранном эффекте при эндофтальмите в 80% случаев (в контрольной группе – в 50%).
2. Применение метода при окклюзионных поражениях сосудов сетчатки и зрительного нерва привело к улучшению зрительных функций в 93,9% случаев (в контрольной группе – в 88,5%), а также позволило добиться значительно большего прироста средней остроты зрения и увеличения суммарного периферического поля зрения при всех видах нозологии в сравнении с контролем.
3. Проведение прямой электрофармакостимуляции зрительного нерва при его атрофиях различного генеза с использованием нашего метода привело к улучшению функций в 65% случаев (в контрольной группе – в 41%).
4. Таким образом, за более чем 20-летнюю историю применения метод длительной катетеризации ретробульбарного пространства зарекомендовал себя эффективным и безопасным способом лечения, что позволяет его считать методом выбора при лечении различных глазных заболеваний.
Литература
1. Баранов В.И., Березников А.И., Даниленко О.А., Мясникова Т.А., Брежнев А.Ю. Первый опыт применения комбинированной методики лечения дистрофических заболеваний сетчатки и зрительного нерва // Русский мед. журн. Клиническая офтальмология. 2009. Т. 10. № 1. С. 1–2.
2. Волков В.В., Михайлов А.М., Плошинская Н.В., Райнес Л.Л. Профилактика гнойных осложнений при прободных ранениях глазного яблока // Офтальмол. журнал. 1976. №1. С. 12–16.
3. Гусев Ю.А., Глинчук Л.И., Малышев В.Б. Исследование токсичности и фармакокинетики некоторых антибиотиков при их интравитреальном введении в эксперименте // Офтальмохирургия. 1993. № 3. С. 50–53.
4. Гыцу Ф.И., Бобу И.Ф., Боиштян В.Е. Лечение эндофтальмита способом длительного субсклерального орошения и дренирования // Офтальмол. журнал. 1976. № 3. С. 219–220.
5. Гюрджян Т.А., Бондаренко А.И. Эффективность субконъюнктивального применения ацетилсалициловой кислоты при проникающих ранениях глазного яблока // Офтальмол. журнал. 1987. № 5. С. 306.
6. Даниличев В.Ф. Патология глаз. Ферменты и ингибиторы. СПб.: Стройлеспечать, 1996. С. 49–61.
7. Даниличев В.Ф. Современная офтальмология. СПб., 2000. С. 528–531.
8. Дудинов О.О. Обоснование супрахориоидального метода введения медикаментов // Актуальные вопросы офтальмологии: Сб. науч. трудов. Харьков, 1987. С. 12–14.
9. Ермакова В.И., Румянцев Д.О., Пиотровский В.К. Фармакокинетика проксодолола в водянистой влаге и сыворотке крови после инстилляций в глаз кролика // Хим. фарм. журнал. 1995. Т. 29. №1. С. 34–36.
10. Ершов Ф.И., Сумин В.И. Фармакокинетика индуктора интерферона ПХЛ-6 и синтез интерферона в органах-мишенях при различных способах его введения // Антибиотики и химиотерапия. 1992. Т. 37. № 1. С. 37–39.
11. Краснов М.М. Новый способ ретроградного внутриартериального введения лекарственных веществ в а. ophtalmica // Офтальмол. журнал. 1976. № 3. С. 97–99.
12. Линник Л.Ф., Шигина П.А. Фармакокинетика интерферона при различных путях введения // Экспериментальные исследования в офтальмологии: Сб. науч. трудов. М.: МНТК «Микрохирургия глаза», 1986. С. 132.
13. Михайлов А.И., Кочеровец В.И., Марьяновский А.А. О способности гентамицина проникать в зону инфицированного ранения внутренних оболочек глаза в зависимости от способа введения антибиотика // Вестник офтальмологии. 1979. № 5. С. 38–41.
14. Пеньков М.А. Новый способ введения кортикостероидов для терапии увеитов // Вестник офтальмологии. 1970. № 3. С. 67–68.
15. Пеньков М.А., Саитов М.А. Введение препаратов в вортикозную вену глаза в комплексном лечении тяжелых форм увеитов // Офтальмол. журнал. 1989. № 5. С. 287–289.
16. Чикало И.И. Поступление веществ в глаз при субъконъюнктивальном их введении // Офтальмол. журнал. 1992. № 6. С. 354–361.
17. Cunna – Vas J.G., Shakib M., Ashton N. Stadies on the permeability of the blood retinalbarrier // Brit. J. Ophtalmol. 1966. Vol. 50. P. 441.
18. Hart L.G., Curdy D.H. Teichman R. Оcular uptake and kinetics of orally administeredisosorbide in rabbits // Proc. Soc. Exp. Biol. 1972. Vol. 140. P. 715–719.
19. Kapp G.P. et al. Supraophtalmic carotid infusion for brain chemotherapy, experience with anew single lumen cateter // J. Neurosurgery. 1985. Vol. 62 (6). P. 823–825.
20. Kapp G.P. et al. Supraophtalmic carotid infusion for recurrent glioma: rational technique and preliminary results for cisplatin and BCNU // J. Neurooncology. 1985. Vol. 3. № 1. P. 5–11.
21. Peyman G.A., Horton M.B. etc. Intraocular 9-((2-hydroxy-1-(hydroxymethylethoxy)methyl) guanine levels after intravitreal and subconjunctival administration // Ophtalmol. Surg. 1986. Vol. 17. № 7. P. 429–432.
22. Peyman G.A., Spitznas M., Straatsma B.R. Chorioretinal diffusion of peroxidase4 before and after photocoagulation // Invest. Ophtalmol. 1971. Vol. 10. P. 489–495.
23. Tso M.O., Cunha-Vaz J.J. Clinicopathological study of blood-retinal barrier in experimental diabetes mellitus // Arch. Ophtalmol. 1980. Vol. 98. № 11. P. 2032–2040.
Ретробульбарная инфузионная терапия интраокулярных осложнений локального лечения ретинобластомы
1. Березников А.И., Баранов В.И. Использование метода длительной мелиорации ретробульбарного пространства посредством его катетеризации в терапии заболеваний глаз // Вестник новых медицинских технологий [Электронное издание]. – 2012. – № 1.
2. Павлова Т.В., Лобанова И.В. Ирригационная терапия в клинической практике детских стационаров // В книге: X Съезд офтальмологов России. – 2015. – С. 261.
3. Павлова Т.В. Ирригационная терапия – высокоэффективный метод лечения заболеваний сетчатки и зрительного нерва у детей // Российская детская офтальмология. – 2013. – № 1. – С. 39-43.
4. Яровой А.А., Ушакова Т.Л., Поляков В.Г., Булгакова Е.С., Кривовяз О.С., Горовцова О.В. Результаты локального лечения ретинобластомы при недостаточной эффективности полихимиотерапии // Офтальмохирургия. – 2014. – Т. 1. – С. 79-84.
5. Abramson D.H., Shields C.L., Munier F.L., Chantada G.L. Treatment of retinoblastoma in 2015: agreement and disagreement // JAMA Ophthalmology. – 2015. – Vol. 133, № 11. – P. 1341-1347.
6. Baumal C.R., Shields C.L., Shields J.A., Tasman W.S. Surgical repair of rhegmatogenous retinal detachment after treatment for retinoblastoma // Ophthalmology. – 1998. – Vol. 105, № 11. – P. 2134-2139.
7. Berry J.L., Kogachi K., Jubran R., Kim J.W. Loss of fundus view as an indication for secondary enucleation in retinoblastoma // Pediatric blood & cancer. – 2018. – Vol. 65, №. 4. – P. e26908. doi:10.1002/pbc.26908
8. Dalvin L.A., Ancona-Lezama D., Lucio-Alvarez J.A., Masoomian B., Jabbour P., Shields C.L. Ophthalmic vascular events after primary unilateral intra-arterial chemotherapy for retinoblastoma in early and recenteras // Ophthalmology. – 2018. – Vol. 125, № 11. – P. 1803-1811.
9. Honavar S.G., Shields C.L., Shields J.A., Demirci H., Naduvilath T.J. Intraocular surgery after treatment of retinoblastoma // Archives of Ophthalmology. – 2001. – Vol. 119, № 11. – P. 1613-1621.
10. Kiratli H., Koc I., Varan A., Akyuz C. Intravitreal chemotherapy in the management of vitreous disease in retinoblastoma // European journal of ophthalmology. – 2017. – Vol. 27, № 4. – P. 423-427. doi:10.5301/ejo.5000921
11. Requejo F., Marelli J., Ruiz Johnson A., Sampor C., Chantada G. The technique of superselective ophthalmic artery chemotherapy for retinoblastoma: The Garrahan Hospital experience // Interventional Neuroradiology. – 2018. – Vol. 24, № 1. – P. 93-99. doi:10.1177/1591019917738962
12. Schueler A.O., Fluhs D., Anastassiou G., Jurklies C., Neuhauser M., Schilling H. β-Ray brachytherapy with 106Ru plaques for retinoblastoma //International Journal of Radiation Oncology Biology Physics. – 2006. – Vol. 65, № 4. – P. 1212-1221.
13. Shields C.L., Alset A.E., Say E.A., Caywood E., Jabbour P., Shields J.A. Retinoblastoma Control With Primary Intraarterial Chemotherapy: Outcomes Before and During the Intravitreal Chemotherapy Era // J Pediatr Ophthalmol Strabismus. – 2016. – Vol. 53, № 5. – P. 275-284. doi: 10.3928/01913913-20160719-04
14. Shields C.L., Manjandavida F.P., Lally S.E., Pieretti G., Arepalli S.A., Caywood E.H., Jabbour P.M., Shields J.A. Intra-arterial chemotherapy for retinoblastoma in 70 eyes: outcomes based on the international classification of retinoblastoma // Ophthalmology. – 2014. – Vol. 121, № 7. – P. 1453-1460. doi:10.1016/j.ophtha.2014.01.026
15. Susskind D., Hagemann U., Schrader M., Januschowski K., Schnichels S., Aisenbrey S. Toxic effects of melphalan, topotecan and carboplatin on retinal pigment epithelial cells // Acta ophthalmologica. – 2016. – Vol. 94, № 5. – P. 471-478.
16. Yarovoy A.A., Ushakova T.L., Gorshkov I.M., Polyakov V.G., Golubeva O.V., Gorovtsova O.V., Krivovyaz O.S. Intraocular surgery with melphalan irrigation for vitreous hemorrhage in an only eye with retinoblastoma // Eur J Ophthalmol. – 2015. – Dec. 1. – Vol. 26, № 1. – P. e17-e19.
17. Zhao J. Li Q., Wu S., Jin L., Ma X., Jin M., Wang Y., Gallie B. Pars plana vitrectomy and endoresection of refractory intraocular retinoblastoma // Ophthalmology. – 2018. – Vol. 125, № 2. – P. 320-322
Читайте также:
- Особенности речи у глухих. Мимика и жесты
- Диагностические лапаротомии при травме живота. Частота ненужных лапаротомий
- Гипоманиакальная фаза опьянения. Клиника гипоманиакальной фазы
- Оптимальная ориентация сегментарной пломбы при отслойке сетчатки. Рекомендации
- Оценка перфузии миокарда при контрастной эхокардиографии
