Дорзальная аорта эмбриона. Ветви аорты эмбриона
Добавил пользователь Morpheus Обновлено: 27.01.2026
Дорзальная аорта эмбриона. Ветви аорты эмбриона
В области головы дорзальные межсегментарные сосуды дают ряд анастомозов, которые образуют позвоночные артерии (аа. vertebrates). Краниально от уровня шеи позвоночные артерии растут к средней линии и соединяются друг с другом, образуя срединный сосуд, расположенный вентрально от миелэнцефалона. Это a. basalis.
Вентрально от краниального изгиба нервной трубки внутренние сонные артерии посылают ветви к середине, соединяясь с a. basilaris.
Этот анастомоз между внутренними сонными артериями и a. basilaris образует артериальное (виллизиево) кольцо, с помощью которого в анатомии обнаруживают гипофиз.
На уровне почек передних конечностей седьмая пара дорзальных межсегментных дуг увеличивается и продолжается в виде подключичных артерий (аа. subclaviae) к рукам. Дальше, к хвостовому концу, дорзальные межсегментные артерии превращаются в межреберные артерии (аа. intercostales), сохраняя свое сегментарное расположение даже во взрослом состоянии.
При своем образовании дорзальная аорта, как мы видели, является парным сосудом. Эта особенность сохраняется в области бронхов, но каудально две первичные аорты вскоре срастаются друг с другом, формируя срединный сосуд. Срастание вначале происходит в средней части тела, а затем распространяется в краниальном направлении до уровня почек передних конечностей и каудально — по всей длине аорты.
У ранних эмбрионов наиболее заметными сосудами, отходящими от дорзальной аорты в вентральном направлении, являются аа. omphalomesentericae, которые в качестве желточных артерий продолжаются в желточный мешок, а также аллантоидные, или пупочные, артерии, идущие к сосудистому сплетению хориона. Эти сосуды отходят от аорты до ее срастания и, образуясь в результате увеличения ее первичных вентральных сегментных ветвей на соответствующем уровне, вначале являются парными — правыми и левыми.
Пупочные артерии остаются двойными, но когда тело закрывается с вентральной стороны, правая и левая аа. omphalo-mesentericae соединяются по средней линии и срастаются друг с другом, образуя срединный сосуд, идущий в брыжейку. В связи с ранней дегенерацией желточного мешка этот сосуд относительно уменьшается и приобретает название верхней брыжеечной артерии (a. mesentericus sup.).
Тем не менее ее происхождение легко проследить благодаря ее ходу вдоль кишечной петли в брюшной стебелек к месту, где желточный мешок сохраняет свою связь с кишкой.
Аналогичным образом, но несколько краниальнее от верхней брыжеечной артерии, образуется чревная артерия (coeliacus), которая проходит по брыжейке к желудочному отделу кишечного тракта. У взрослых чревная верхняя брыжеечная и нижняя брыжеечная артерии составляют группу сходных сосудов, одинаковых по вентральному возникновению из аорты, по их прохождению в брыжейке и окончанию в желудочно-кишечном тракте.
Нижняя брыжеечная артерия у шестинедельных эмбрионов еще незаметна. Она возникает таким же образом из аорты, каудально по отношению к первым двум сосудам, но несколько позже в ходе развития.
На уровне середины тела от аорты отходит в латеральном направлении много мелких мезонефрических ветвей. Эти сосуды питают капиллярные сплетения (гломерулы) в расширенных концах трубочек мезонефроса и сеть капилляров, окружающих эти трубочки. Каждая из этих веточек очень мала, но объем крови, пропускаемый одновременно всеми веточками, очень велик, на что указывает размер вен (vv. post- и subcardinalis), отходящих от мезонефросов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Дорзальная аорта эмбриона. Ветви аорты эмбриона
Сердечно-сосудистая система и кровь не рассматриваются или занимают второстепенное положение в известных представлениях о конституции человека. Сосуды с кровью в их полости морфологически (сердечно-сосудистая система) и физиологически (кровообращение) играют ключевую роль в жизни человека. Тело человека, с моей точки зрения, имеет квазисегментарное устройство: аорта и ее ветви образуют осевой скелет дефинитивных корпоральных сегментов – вокруг них группируются органы. Взаимодействия собственно тела человека и его внутренностей в ходе онтогенеза детерминируют их дефинитивные взаимоотношения, в т.ч. морфотипов аорты и соматотипов индивида. Аорта и ее ветви объединяют органы в дефинитивные корпоральные сегменты в виде периартериальных комплексов. Органы дифференцируют тело человека на корпоральные сегменты, направляя рост аорты и ее ветвей.
1. Богомолец А.А. Введение в учение о конституциях и диатезах. – М.: Изд-е М. и С. Сабишниковых, 1926. – 172 с.
2. Воробьев В.П. Анатомия человека. Руководство и атлас для студентов и врачей. – М.: Гос. мед. изд-во, 1932. – Т. 1. – 702 с.
3. Кованов А.А., Аникина Т.И. Хирургическая анатомия артерий человека. – М.: «Медицина», 1974. – 360 с.
4. Лисицын М.С. К хирургической анатомии art. anonymae с точки зрения оперативных доступов к ней // Юбил. сб. проф. И.И. Грекова. – 1921. – С. 229-234.
5. Лисицын М.С. Ductus thoracicus // Новый хирургический архив. – 1922. – Т. 1. – Кн. 4. – С. 576-584.
6. Петренко В.М. Развитие лимфатической системы в пренатальном онтогенезе человека. – СПб.: СПбГМА, 1998. – 364 с.
7. Петренко В.М. Эмбриональные основы возникновения врожденной непроходимости двенадцатиперстной кишки человека. – СПб.: СПбГМА, 2002. – 150 с.
8. Петренко В.М. Эволюция и онтогенез лимфатической системы. Второе издание. – СПб.: ДЕАН, 2003. – 336 с.
9. Петренко В.М. Квазисегментарное устройство тела человека // Международный журнал прикладных и фундаментальных исследований. – 2014. – № 8. – Ч. 1. – С. 59-62.
10. Петренко В.М. Общая конституция человека и ее типы. Вазогемальный аспект проблемы // Международный журнал прикладных и фундаментальных исследований. – 2014. – № 11. – Ч. 2. – С. 291-294.
11. Петренко В.М. Сосуды на этапах органогенеза // Международный журнал экспериментального образования. – 2015. – № 2. – Ч. 2. – С. 180-181.
12. Петренко В.М. Механика развития кровеносного русла в брыжейке двенадцатиперстной кишки человека // Международный журнал экспериментального образования. – 2015. – № 3. – Ч. 3. – С. 404.
13. Романов П.А. Клиническая анатомия вариантов и аномалий толстой кишки. – М.: «Медицина», 1987. – 192 с.
15. Семенов Г.М. Хирургическая анатомия брюшной части грудного протока // Арх.анат. – 1988. – Т. 94. – № 10. – С. 55-59.
18. Шевкуненко В.Н., Геселевич А.М. Типовая анатомия человека. – Л.; М.: ОГИЗ, Гос. изд-во биол. и мед. лит-ры, 1935. – 232 с.
Введение
Представления о конституции человека, общей и, особенно, частной, о их морфологических проявлениях (соматотипе и морфотипах отдельных систем органов) остаются сегодня весьма противоречивыми. Единая, общепринятая концепция отсутствует.
Для решения данной проблемы применяются разные подходы, порой диаметрально противоположные. В частности, центральное положение в подобных исследованиях занимают либо соматические, либо висцеральные органы, а у физиологов – эндокринные железы или их комплекс с нервной системой. Сердечно-сосудистая система и кровь не рассматриваются или занимают второстепенное положение в известных построениях [1,2,16]. Между тем сосуды с кровью, как главная часть циркуляционной системы: 1) объединяют все органы всех систем как локальные центры метаболизма, что обеспечивает координацию их функционирования, включая рост и развитие; 2) образуют остов общей конституции человека, связывающий функциональную конституцию (циркуляция как «управляющая сетка» жизнедеятельности) с морфологической (сосудистый каркас как «защитная сетка» кровотоков – часть мягкого, стромального скелета тела). Если кратко: тип обмена веществ ↔ соматотип. Поэтому вазогемальный (циркуляционный) фактор, с моей точки зрения, должен занимать центральное положение в любой схеме общего устройства человека [10].
Аорта и устройство человека
Сосуды с кровью в их полости морфологически (сердечно-сосудистая система) и физиологически (кровообращение) играют ключевую роль в жизни человека. Тело человека, с моей точки зрения, имеет квазисегментарное устройство [9]: аорта и ее ветви образуют «осевой скелет» дефинитивных корпоральных сегментов – вокруг них группируются органы. Аорта становится организатором сегментарного морфогенеза тела человека, поскольку: 1) связана со всеми органами и сосудами биомеханически (периадвентиция стенок), гидравлически (кровоток) и биохимически (кровь), 1а) ветви аорты внедряются в толщу вещества / стенок органов, обеспечивая их питание; 2) устойчива к давлению окружения, 2а) обладая толстыми и плотными стенками и высоким кровяным давлением, причем среди сосудов – наиболее, 2б) поэтому артерии доминируют во взаимодействиях с другими сосудами, детерминируя сегментарную организацию всего сосудистого русла, морфогенез региональных и сегментарных сосудисто-нервных пучков тела.
Эмбриональный морфогенез сосудистого русла органов коррелирует с их интенсивным ростом и гистогенезом, которые требуют адекватного кровоснабжения и дренирования органа – определяют функциональную нагрузку на его сосуды [11]. Интенсивная пролиферация энтодермы средней кишки приводит к ее ложной многорядности в окружении мезенхимы, вторично уплотняющейся в результате пролиферации. В ее составе кровеносные протокапилляры формируют все более густую сеть вокруг эпителиальной трубки кишки. Стенки артерий, приносящих в эту сеть кровь, утолщаются и дифференцируются, приобретают адвентициальную оболочку, которая затем разделяется на дефинитивные слои (реакция на растущее кровяное давление). Вены, выносящие кровь из той же сети, первоначально реагируют на увеличение объема дренажа из органа умножением числа и расширением. Плотная мезенхима у эмбрионов 5-6 нед сдавливает протокапилляры в стенках органов и таким образом тормозит и приток крови из артерий, увеличивая нагрузку на их стенки, и отток крови в вены брыжейки, что уменьшает давление на стенки вен и тормозит их дифференциацию. Затем первичные вены разделяются на вторичные вены с адвентициальной оболочкой и первичные лимфатические сосуды с эндотелиальными стенками, когда в слизистой оболочке средней кишки формируются кишечные ворсинки на фоне массовой гибели эпителиоцитов (антигенная стимуляция). Последняя продолжается на этапе морфогенеза кишечных крипт у плодов 3-го мес, когда в расширяющемся просвете лимфатических сосудов (увеличение объема дренажа) брыжейки ДК появляются зачатки регионарных лимфоузлов. Они подвергаются первичной дифференциации на этапе развития дуоденальных желез (плоды 4-5 мес). B. Zweifach (1961) считал капиллярную сеть частью кровеносного русла, которая не подверглась структурной трансформации, т.е. недоразвитой частью сосудистой системы. W. Roux (1879) полагал, что рост сосудов и дифференциацию их стенок индуцируют функциональные раздражения – потребности органов. Локальные особенности развития первичного кровеносного русла как капиллярной сети и его гетерогенность в дефинитивном состоянии можно объяснить локальными особенностями гемодинамических условий или метаболическим градиентом Ch. Child (1921). Таким путем формируется кровеносное русло брыжейки двенадцатиперстной кишки в пренатальном онтогенезе человека. Его морфогенез коррелирует с интенсивным ростом и гистогенезом органа, обусловливающих адекватную функциональную нагрузку на кровеносное русло [12].
Я предложил использовать эти представления в разработке концепции общей конституции человека и ее типов. Тем более, что о существовании коррелятивных связей между типовой анатомией сердечно-сосудистой системы и соматотипами человека известно давно [18], хотя сведения об этом в литературе ограничены и неоднозначны. Наиболее известна зависимость размещения ветвей аорты человека от его соматотипа в области дуги и брюшной части аорты [18]: расширение тела человека с его укорочением сопровождаются сближением ветвей брюшной аорты и расхождением ветвей ее дуги. Это отражается на окружении, в частности, на строении и положении начального и конечного отделов грудного протока [5,6,15]. В литературе, впрочем, по разному описываются указанные процессы.
Так Е.П. Мерперт [3] описал два типа брюшной аорты в связи с положением ее висцеральных ветвей – концентрированный и деконцентрированный, или дисперсный. Он считал, что чем ниже проходит верхняя граница брюшной аорты, тем выше концентрация ее ветвей. В.Н. Шевкуненко [18] выделял два типа ветвей брюшной аорты по их строению – магистральный и рассыпной соответственно при низком и высоком уровне размещения бифуркации брюшной аорты. По А.А. Кованову и Т.И. Аникиной [3], концентрированный тип брюшной аорты у Е.П. Мерперта соответствует ее рассыпному типу у В.Н. Шевкуненко, а дисперсный тип – магистральному. Е.П. Мерперт не нашел подтверждения положениям В.Н. Шевкуненко о том, что концентрированный тип брюшной аорты (рассыпной по В.Н. Шевкуненко) сочетается с высоким уровнем бифуркации аорты, а ее дисперсный тип (магистральный по В.Н. Шевкуненко) – с ее низким уровнем. Чем ниже верхняя граница брюшной аорты (аортальное отверстие диафрагмы), тем больше концентрация висцеральных ее ветвей. По ориентирам Е.П. Мерперта концентрация (сближение) ветвей брюшной аорты происходит при ее укорочении, что характерно для брахиморфного соматотипа, а дисперсия ветвей удлиняющейся брюшной аорты характерна для долихоморфного соматотипа.
Я объяснил такие морфотипы брюшной аорты, которые обнаружил уже у плодов человека, следующим образом [6]. Тело поджелудочной железы разделяет чревный ствол (выше) и верхнюю брыжеечную артерию (ниже), правая почечная артерии отходит от аорты между ними, позади головки поджелудочной железы, которая обычно срастается с задней брюшной стенкой позднее ее тела. Короткий чревный ствол «опирается» на поджелудочную железу своими ветвями. Большая часть верхней брыжеечной артерии находится в корне брыжейки тонкой кишки, т.е. нисходящей части пупочной кишечной петли до вторичных сращений брюшины, которые начинаются в области двенадцатиперстно-тощекишечного изгиба и тела поджелудочной железы. Клубок петель интенсивно удлиняющейся тонкой (средней) кишки «тянет» верхнюю брыжеечную артерию каудально с удалением от чревного ствола. Чем быстрее фиксируются тело и головка поджелудочной железы к задней брюшной стенке, а корень брыжейки пупочной кишечной петли (и начальный отрезок тощей кишки) к головке поджелудочной железы, тем быстрее стабилизируются уровни отхождения висцеральных ветвей от брюшной аорты и взаиморасположение их начальных отрезков [6]. Установлено, что нефиксация брыжеек толстой кишки (восходящей части пупочной кишечной петли) чаще обнаруживается у людей с брахиморфным телосложением, чем у людей с долихоморфным телосложением [13]. В таких случаях под давлением печени, особенно ее правой доли, тело и головка поджелудочной железы, двенадцатиперстная кишка, правые почка и надпочечник, сопряженные с ними начальные отрезки висцеральных ветвей брюшной аорты смещаются каудально. Напротив, при ранней и быстрой фиксации указанных органов указанные артерии сохраняют высокое положение. Если дорсальные сращения брюшины опережают вентральные (относительно поджелудочной железы и двенадцатиперстной кишки), то расстояние между чревным стволом и, возможно, правой почечной артерий, краниально, и верхней брыжеечной артерией, каудально, увеличивается. Обычно головка поджелудочной железы фиксируется к задней брюшной стенке позднее ее тела, дорсальная фиксация двенадцатиперстной кишки наблюдается еще позднее. А это область правой почечной ножки. Возможны другие варианты вторичных сращений брюшины и становления дефинитивных анатомо-топографических взаимоотношений внутренних органов брюшной полости в парааортальной области, поскольку индивидуальны темпы роста печени и других органов плода человека [7]. И не только внутренних органов. Печень доминирует в органогенезе брюшной полости, особенно заметно у эмбрионов 2-го мес, но и сама (и не только !) находится в тесных «рамках» стенок формирующейся брюшной полости (~ соматотип). Поэтому на 5-й нед эмбриогенеза возникает пупочная кишечная петля, которая возвращается в брюшную полость плода 9-9,5 нед в связи с уменьшением объема печени относительно емкости брюшной полости [7].
Строение ветвей аорты очень варьирует и не всегда удается установить ясную корреляционную связь между их морфотипом и соматотипом человека, тем более – устройством регионального окружения. Так по данным В.А. Павленко [18], у лиц с брахиморфным телосложением чаще всего наблюдается горизонтальное положение петель тонкой кишки, у лиц с долихоморфным телосложением – вертикальное, с мезоморфным – косое. Все эти три типа положения петель тонкой кишки отражают характер прикрепления корня ее брыжейки, линия которого может приближаться к горизонтали или вертикали, а может иметь косое направление. Сопоставление рассуждений Е.П. Мерперта и В.Н. Шевкуненко позволяет сделать вывод, что при долихоморфном телосложении человека длинная верхняя брыжеечная артерия должна иметь магистральное строение и более вертикальную ориентацию, как и петли тонкой кишки, а при брахиморфном телосложении короткий ствол артерии должен быстро рассыпаться в коротком корне брыжейки тонкой кишки на множество ветвей к ее поперечным петлям. В действительности рассыпной тип архитектоники верхней брыжеечной артерии обнаружен лишь в 4% случаев, магистральный тип – в 80% случаев. Но астеники и долихоморфы не встречаются в 20 раз чаще гиперстеников и брахиморфов! При этом магистральный тип строения верхней брыжеечной артерии характеризуется чаще всего тем, что только основной ствол артерии имеет вид магистрали, вторичные же его ветви и их разветвления большей частью построены по рассыпному типу [17,18]. Следует добавить, что ствол верхней брыжеечной артерии имеет очень вариабельное строение (отсутствие, удвоение и т.д.) и три разных топографических отдела (поджелудочный, поджелудочно-двенадцатиперстный и брыжеечный). Обычно рассматривается и обсуждается строение брыжеечного отрезка артерии, которое зависит от разных причин, в т.ч. от очень вариабельной длины тонкой кишки и ее брыжейки. Ветви от артерии к петлям тонкой кишки могут отходить более или менее самостоятельно (сегментарное строение – множество мелких ветвей), общими стволами (зональное строение) или комбинированным способом (зонально-сегментарное строение) [3]. Конечной ветвью верхней брыжеечной артерии может служить подвздошно-ободочная артерия или артерия червеобразного отростка. Подвздошно-ободочная артерия может быть конечной или боковой ветвью верхней брыжеечной артерии, иметь разное строение – магистральное, рассыпное, петлистое или переходное, причем соотношение вариантов ее строения по разным данным очень варьирует [3,17]. Аппендикулярная артерия отходит от ствола подвздошно-ободочной артерии или от ее подвздошной ветви [17]. Магистральный тип аппендикулярной артерии совпадает чаще с низким положением подвижного червеобразного отростка (как и слепой кишки, что характерно для брахиморфов [13,17]), который при рассыпном типе строения своей артерии занимает более высокое положение. При ее петлистом строении (31% случаев) обнаружено наиболее высокое положение червеобразного отростка с плотной его фиксацией позади тонкой или слепой кишки [18]: выше давление на брыжейку – больше анастомозов.
Тип и уровень слияния поясничных стволов коррелирует с ветвлением брюшной аорты (сближение ее висцеральных ветвей – расширение начала грудного протока) как у взрослого человека [15], так и у его плодов [6]. Уровень и тип слияния корней грудного протока коррелируют с размещением как ветвей брюшной аорты, так и связанных с ними поясничных лимфоузлов, которое устанавливается у плодов в период вторичных сращений брюшины [6]. Они кардинально изменяют анатомо-топографические взаимоотношения внутренних органов брюшной полости, а закладка лимфоузлов – строение лимфатической системы. Оба процесса связаны с давлением растущих органов брюшной полости на ее стенки и содержимое. Вторичные сращения брюшины определяют линии и уровни прикрепления брыжеек и брюшинных связок, где размещаются висцеральные лимфоузлы. Закладка поясничных лимфоузлов происходит раньше, чем висцеральных, дорсальные вторичные сращения брюшины протекают быстрее, чем вентральные. Необычно раннее, тем более опережающее развитие вторичных сращений ободочной кишки сопровождается вентральным отклонением и деформациями двенадцатиперстной кишки с уменьшением: 1) давления на заднюю брюшную стенку и брыжейки; 2) расчленения их лимфатических коллекторов закладками лимфоузлов. При ранних дорсальных вторичных сращениях брюшины двенадцатиперстная кишка и поджелудочная железа, вероятно, тормозят каудальное смещение чревного ствола, верхних брыжеечной и поясничных артерий. При этом обнаруживаются более высокое и рассеянное размещение поясничных лимфоузлов, более высокие начало и слияние поясничных стволов [6]. Нефиксация брыжеек толстой кишки обнаруживается у людей с брахиморфным телосложением чаще, чем у людей с долихоморфным телосложением [13]. У первых из них З.А. Махмудов [14] нашел больше, чем у вторых, верхних брыжеечных лимфоузлов, причем всех и периферических.
М.С. Лисицын [4,5] описал варианты ветвления дуги аорты и размещения ее ветвей, а также особенности хода грудного протока в этой области в связи с формой грудной клетки. При узкой верхней апертуре удлиненной, узкой грудной клетки, характерной для долихоморфов, крутая дуга аорты стоит кососагиттально и высоко, проецируясь на верхний край рукоятки грудины; отходящие от дуги ветви расположены близко одна к другой (концентрация стволов); грудной проток образует «высокую», крутую шейную дугу, а бифуркация трахеи – острый угол. При широкой апертуре короткой и широкой грудной клетки у брахиморфов плоская, почти фронтальная дуга аорты находится ниже, на уровне II межреберья, ее ветви широко расставлены (дисперсия стволов); грудной проток образует «низкую», плоскую дугу, а бифуркация трахеи – почти прямой угол [3,18].
Заключение
Таким образом, сома человека и его висцера, включая внутренние органы и аорту, тесно взаимосвязаны с эмбрионального периода его развития. Их взаимодействия в ходе онтогенеза человека детерминируют их дефинитивные взаимоотношения, в т.ч. морфотипов аорты и соматотипов индивида. Аорта и ее ветви объединяют органы в дефинитивные корпоральные сегменты в виде периартериальных комплексов. Органы, в свою очередь, дифференцируют тело человека на корпоральные сегменты, направляя рост аорты и ее ветвей. Поэтому тело человека имеет квазисегментарное устройство: осевой скелет дефинитивных корпоральных сегментов, в разной степени сливающихся местами, особенно на периферии, образуют аорта и ее ветви – вокруг ветвей аорты группируются кровоснабжаемые ими органы.
научная статья по теме АОРТА, ЛЕГОЧНАЯ АРТЕРИЯ И ПОТОКИ КРОВИ ПО НИМ У КУР ВО ВТОРОЙ ПОЛОВИНЕ ЭМБРИОГЕНЕЗА И ПОСЛЕ ВЫЛУПЛЕНИЯ Биология

Текст научной статьи на тему «АОРТА, ЛЕГОЧНАЯ АРТЕРИЯ И ПОТОКИ КРОВИ ПО НИМ У КУР ВО ВТОРОЙ ПОЛОВИНЕ ЭМБРИОГЕНЕЗА И ПОСЛЕ ВЫЛУПЛЕНИЯ»
АОРТА, ЛЕГОЧНАЯ АРТЕРИЯ И ПОТОКИ КРОВИ ПО НИМ У КУР ВО ВТОРОЙ ПОЛОВИНЕ ЭМБРИОГЕНЕЗА И ПОСЛЕ ВЫЛУПЛЕНИЯ © 2014 г. В. М. Беличенко, Е. В. Ходырев, К. А. Шошенко
Научно-исследовательский институт физиологии и фундаментальной медицины Сибирского отделения РАМН
Окончательный вариант получен 21.08.13 г.
Цель работы — определить изменения потока крови в артериальных магистралях, выходящих из сердца кур, по изменению просвета этих магистралей в период эмбриогенеза (на 10-, 15- и 19-е сут) и через 6 сут после вылупления. Для этого проводили посмертную морфометрию аорты, легочных артерий и артериальных (боталловых) протоков АП от выхода их из сердца до конечного внеорган-ного ветвления. Показано, что в этот период: 1, — начальные просветы аорты и легочной артерии равны между собой и равно повышаются (с временной остановкой в последнюю четверть эмбриогенеза) по мере увеличения массы тела (Мт); 2, — доля правого желудочка в суммарном минутном объеме кровообращения (МОК) несколько меньше, чем левого, но приближается к равному с ним к концу эмбриогенеза; 3, — по мере роста эмбрионов доля суммарного МОК, протекающая: через переднюю (до впадения в аорту АП) часть тела снижается (с 41% до 33%), среднюю часть — растет (с 17% до 31%), а в задней части (после бифуркации аорты), где располагается хориоаллантоисная мембрана ХАМ, почти не меняется; 4, — после вылупления (и исчезновения ХАМ) МОК левого желудочка кратно растет из-за соединения двух потоков крови из сердца (через восходящую аорту и АП) в один, который течет последовательно по малому и большому кругам, приводя к кратному повышению органного кровотока.
Ключевые слова: распределение сердечного выброса, аорта, артериальный проток, куры, эмбриогенез.
ВВЕДЕНИЕ Значительный интерес к закономерностям раннего развития сердечно-сосудистой системы (ССС) в настоящее время обусловлен убеждением, что нарушения в ее структуре и функции, обнаруженные у взрослого организма, могут начинаться в период эмбрионального и раннего онтогенетического формирования этой системы, особенно, если оно протекает в присутствии неблагоприятных факторов (Felmeden et al., 2003; Nathanielsz, Hanson, 2003; Savolainen et al., 2009). Этот интерес, возникший давно, касается и закономерностей эмбрионального формирования крупных сосудистых магистралей, прежде всего, артериальных, знания о которых необходимы для понимания характера нарушения кровотока при пороках ССС и поиска наиболее адекватных способов их оперативного лечения.
Эмбриональное развитие ССС теплокровных часто изучается на куриных эмбрионах, ССС которых во многом сходна с млекопитающими, а ряд параметров ее доступен для прямых морфо-функциональных измерений (White, 1974; Hu,
Clark, 1989; Mulder et al., 1998, 2002; Burggren et al., 2004; Lucitti et al., 2005; Беличенко, Шошенко, 2009; Wang et al., 2009). Характерной структурой эмбриональной ССС теплокровных является артериальный (боталлов) проток (АП), через который венозная кровь, поступившая в правое предсердие, течет в дорзальную аорту. АП развивается параллельно с разделением желудочков сердца на две полости, артериального конуса на аорту и легочную артерию и с формированием дыхательных органов эмбрионов — плаценты у млекопитающих и хорио-аллантоисной мембраны (ХАМ) у птиц. Одновременно развиваются и сами легкие (рис. 1). Для кур все эти процессы начинаются на 3—4-е сутки эмбриогенеза и завершаются, в основном, к концу его. Легочная артерия выделяется из артериального конуса вместе с последней 6-й парой аортальных дуг, которые превращаются в две ветви этой артерии, временно сохраняющие связь с дорзальной аортой. Место этой связи означает у кур переход грудной части аорты в дорзальную. Левая и правая легочные артерии в начале своего пути отдают небольшие ветви в сами
Рис. 1. Схема артериального дерева и направление потоков крови у 19-суточного куриного эмбриона (а) и цыпленка (б), (Беличенко и др., 2011).
I и 2 — левый и правый желудочки, 3 и 4 — правое и левое легкое, 5 и 6 — восходящая аорта и ее дуга, 7 — артерии передней части туловища и головы, 8 — дорзальная аорта, 9 — легочные артерии, 10 — артериальные (боталловы) протоки,
II — артерии пищеварительных органов и селезенки, 12 — артерии почек, 13 — седалищные (ягодичные) артерии для тканей задней части туловища, 14 — аллантоисные артерии у эмбриона. Зачерненные просветы сосудов 10 и 14 у цыплят обозначают их исчезновение.
ОСК, пф.ед. 60 50 40 30 20 10
Рис. 2. Объемная скорость кровотока в органах кур в период эмбриогенеза (1—10 сут, 2—15 сут, 3—19 сут) и 4—5 сут после вылупления, М ± т.
Рисунок сделан по опубликованным данным (Беличенко и др., 2011: Турганбаева и др., 2011). Скорость кровотока измерялась лазер — Допплер флоуметром ЛАКК-01 и выражалась в перфузионных единицах; КИМ и БГМ — красная икроножная и белая грудная мышцы. Показано достоверное отличие (*) по сравнению с предыдущим возрастом прир < 0.05.
легкие, после чего они становятся АП. У птиц их два, у млекопитающих сохраняется только левый АП (Карлсон, 1983). АП вместе с межпредсерд-ным отверстием необходимы для адекватного кровоснабжения эмбриона. Через межпредсерд-ное отверстие часть венозной крови, притекающей из верхней и нижней полых вен в правое предсердие, попадает в левый желудочек, а из него, — в восходящую аорту, ее дугу и в переднюю часть туловища, где располагаются сердце и голова. Другая часть крови течет в правый желудочек и через АП возвращается в дорзальный отдел аорты, который снабжает кровью заднюю часть туловища с пищеварительными органами, почками и дыхательные органы плода. При переходе на легочное дыхание АП закрываются, Механизм их закрытия, интенсивно изучаемый в последние годы, схож у млекопитающих и птиц, и сигналом к нему служит подъем концентрации кислорода в крови при появлении легочного дыхания. При этом необходима зрелость всей биохимической цепочки, приводящая к сокращению мышечных клеток, преимущественно расположенных в легочной части АП (Л§геп е! а1., 2007; Бе1ап§ег е! а1., 2008; СоЕоПиёо е! а1., 2009).
Предпосылкой нашей работы были данные о динамике объемной скорости кровотока (ОСК в единице массы органа) в органах кур во второй половине эмбриогенеза и первые дни после вы-лупления (Беличенко и др. 2011; Турганбаева
и др., 2011). Оказалось, что величины ОСК в печени и икроножных мышцах, получающих кровь из дорзальной аорты, и в грудных мышцах, кровоснабжение которых осуществляют подключичные артерии (из дуги аорты), всю вторую половину эмбриогенеза сохраняются почти неизменными, однако кратно (и почти одинаково для мышц) возрастают после вылупления. При этом кровоток в полушариях головного мозга увеличивался постоянно за все время наблюдений (рис. 2). Очевидно, механизмы изменения ОСК при появлении дыхания и закрытии АП в органах, "принадлежащих" дуге аорты и ее дорзальной части, различны. И для понимания их необходимо было сопоставить величину потоков крови из аорты в переднюю и заднюю части тела в разные периоды эмбриогенеза и после вылупления.
Единственная работа с оценкой таких потоков у птиц была проведена Р.Т. White (1974) на 16-су-точных куриных эмбрионах (весь эмбриогенез 21 сут). Исследователь показал, что тушь, введенная в аллантоисную вену, попадает в оба предсердия, легочную артерию и аортальную дугу, а тушь из верхней полой вены — только в правое предсердие и легочную артерию. При этом среднее насыщение кислородом крови в аллантоисной вене, левом и правом желудочках, аллантоисной артерии и яремной вене равнялось 66, 50, 32, 32 и 22% при максимальном насыщении ее (100%) 10.3 об. %. Используя эти данные, уравнение Фика и извест-
ный по публикациям кислородный запрос 16-су-точного плода (Мт ~ 14 г), исследователь примерно оценил у него суммарный (для обоих желудочков) минутный объем кровообращения (МОК), его доли, протекающие по аорте до впадения АП и после его впадения, в том числе долю, адресованную в ХАМ, а также соотношение потоков крови из левого и правого (через АП) желудочков в дор-зальной аорте.
Других данных на эту тему у птиц до сих пор нет, поэтому ряд основных вопросов в ней остаются практически без ответа: какое количество крови попадает из правой половины сердца в левую, и каково соотношение МОК каждого желудочка в их суммарном МОК? Каково в дорзаль-ной аорте соотношение крови из АП и из грудной аорты? Каковы доли суммарного МОК, адресованные в разные сегменты тела (передний, средний и задний)? Как меняются потоки крови в аорте в период эмбриогенеза и после вылупления?
Заметим, что млекопитающие в этом отношении исследованы лучше. Данные для них получены, как правило, на овцах во второй половине беременности, когда масса тела (Мт) плода достигала приемлемых для опытов размеров (>100 г) и позволяла канюлировать его центральные сосуды для взятия проб крови и применения методов измерения кровотока (лазер — Допплер флоуметрия или меченые микросферы) (Rudolph, 1985; Itsko-vitz et al., 1987). В последние годы с помощью эхо-кардиографии просвета крупных артерий и наружных допплеровских измерителей скорости кровотока в них, получены данные о величинах МОК и о кровоснабжении разных регионов и органов человека на протяжении большей части его эмбриональной жизни (Poutanen et al., 2003; Vimpeli et al., 2009).При обсуждении нашего материала мы используем эти данные.
Мы решили подойти к оценке потоков крови из сердца у развивающихся кур, используя доступный морфометрический метод, — оценивать величину потока, покидающего аорту, по изменению ее просвета. Основанием для такого исследования послужили следующие данные. Хорошо известно, что у взрослых и растущих животных просвет аорты по мере удаления от сердца сужается, что связано с отхождения от нее в соответствующие сегменты туловища магистральных артерий. При этом исследователи подтверждают правило аортальных разветв
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.
Дорзальная аорта эмбриона. Ветви аорты эмбриона
Тело человека имеет квазисегментарное устройство в виде периартериальных органокомплексов, которые сливаются в разной степени, особенно на периферии, в результате их неравномерного роста в онтогенезе.
1. Бючли О. Лекции по сравнительной анатомии / пер. с нем.яз. – Петроград: изд-во А.Ф.Девриена, 1917. – 502 с.
2. Карлсон Б. Основы эмбриологии по Пэттену / пер. с англ.яз. – М.: изд-во «Мир», 1983. – Т. 1. – 360 с.
3. Лебедкин С.И., Герке П.Я. Основы теоретической анатомии человека. – Рига: изд-во АН Латвийской ССР, 1963. – 356 с.
4. Петренко В.М. Эмбриональные основы возникновения врожденной непроходимости двенадцатиперстной кишки человека. – СПб: СПбГМА, 2002. – 150 с.
5. Петренко В.М. Структурные основы сегментарной организации лимфооттока из органов // Актуал.вопросы соврем.морфол-и и физиол-и. – СПб: изд-во ДЕАН, 2007. – С. 59-139.
6. Петренко В.М. Сегментарная организация лимфатической системы и тела человека // Междунар. журнал приклад. и фунд. исслед-й. – 2012. – № 12. – С. 82.
7. Петренко В.М. Устройство организма у человека и высших животных // Успехи соврем.естеств-я. – 2014. – № 2. – С. 32-35.
9. Привес М.Г., Лысенков Н.К., Бушкович В.И. Анатомия человека. 12-е изд-е. – СПб: издат.дом СПбМАПО, 2004. – 720 с.
10. Шмальгаузен И.И. Основы сравнительной анатомии позвоночных животных. – М.: гос.уч-пед.изд-во наркомпроса РСФСР, 1938. – 488 с.
11. William D., Willis Jr. Фундаментальная и клиническая физиология / Камкин А.Г., Каменский А.А. – М.: изд-во «Академия», 2004. – 1073 с.
«Прежде чем начать анализ строения отдельных систем нашего тела, необходимо остановиться на трех принципах строения тела позвоночных, знание которых в значительной степени поможет нам, если не объяснить особенности строения, то правильно поставить вопросы для получения объяснений… современная анатомия, называемая очень удачно «думающей анатомией», стремится осмыслить, осознать известные факты, понять особенности строения человеческого тела, основываясь на сравнительной анатомии, физиологии и других науках. Особенно важны для правильной постановки вопроса три принципа, или закона, которые проявляются в строении тела человека: 1) принцип, или закон, симметрии; 2) принцип, или закон, сегментации; 3) принцип, или закон, корреляции…
Сегментацией мы называем такую особенность строения организмов, при которой тело состоит из следующих друг за другом сходных элементов, расположенных по главной оси тела. У некоторых червей все тело снаружи разделено на ряд отдельных сегментов, причем в каждом из них содержится весь набор органов, характеризующих строение данного животного. Тело как бы состоит из ряда самостоятельных сходных организмов, соединенных в одно целое, как цепь состоит из своих звеньев. У многих животных сегментарное строение выражено ясно на их наружной поверхности. У позвоночных оно проявляется лишь в строении внутренних органов…
У высших позвоночных, особенно у человека, наблюдается сложное сочетание проявлений этого принципа строения с отклонением от него… Знание приципа, или закона, сегментации помогает нам в изучении строения тела, заставляя искать части, которые свойственны сегменту, но которые непосредственно не видны. Так обстоит дело не только в костях, но и в мышцах, сосудистой системе и т.д.» [3].
Топологическая организация человека
Устройство организма человека обычно представляется в виде вертикали: клетки (→ ткани) → органы (→ системы органов) → индивид, хотя и с разными вариациями [7]. Гораздо реже обсуждается взаимосвязь органов разных систем в топографо-анатомическом аспекте, например – сегментарном [8].
Сегментарная организация представляется разновидностью дробления тела многоклеточного животного – разделения целого на сходные, взаимосвязанные части, выполняющие общую функцию. В результате появляются возможности более эффективной ее реализации и / или экономного использования маломощного источника энергии для выполнения работы – функционирования организма в условиях низких энергий и скоростей (в т.ч. малой интенсивности обмена веществ и циркуляции жидкостей), что целесообразно для осуществления ряда процессов жизнедеятельности (вегетативные функции) [5].
Одним из проявлений квазисегментарного устройства человека, которое имеет важное практическое значение в современной медицине, представляется так называемая кожная сегментация (например, зоны Захарьина-Геда). Ее смысл заключается в возможности организма отвечать на внешние раздражения поверхности тела человека реакцией отдельных частей тела и образованием местных рефлексов. Первичные афференты взрослого организма распределены в определенном пространственном порядке как на периферии, так и в центральной области тела. Такая топологическая организация закладывается в эмбриогенезе, когда каждый сомит, в т.ч. дерматом, получает ветвь от ближайшего сегмента нервной трубки. Однако в ходе дальнейшего развития очертания многих дерматомов искажаются, главным образом, в результате вращения формирующихся верхних и нижних конечностей, а также благодаря вертикальной позе человека. Последовательность расположения дерматомов легко представить себе, если изобразить тело человека опирающимся на четыре конечности. Хотя дерматом получает наибольшее количество нервных волокон от ближайшего к нему сегмента спинного мозга, он снабжается нервами еще от нескольких соседних сегментов спинного мозга. Вот почему перерезка только одного заднего корешка не ведет к существенной потере чувствительности иннервируемого дерматома. Для его анестезии необходимо заблокировать несколько последовательных задних корешков спинного мозга [9, 11].
Иначе говоря, каждый участок кожи человека имеет несколько источников иннервации (нервный центр → нерв → дерматом), основной и дополнительные, причем соседние дерматомы могут иметь и имеют общую (перекрестную) иннервацию. Причина – неравномерный рост тела человека и его частей. Таким же образом можно объяснить и морфогенез нервных сплетений. Лимфатическая система устроена так же: она разделена на топографо-анатомические сегменты, сливающиеся на периферии, в т.ч. – основные (генеральные, параартериальные – саттелитное лимфатическое русло) и дополнительные (вставочные, пери- и, особенно, абартериальные – аберрантные лимфатические сосуды) [8].
Сегменты тела человека: определение и морфогенез
Метамеры и сегменты – это неоднозначные понятия. В обычном, широком смысле «segmentum» (лат.) – это отрезок, его пространственные очертания различны. Сегмент может быть плоским и сферическим. Так межклапанный сегмент лимфатического сосуда можно оценить как плоский, (разветвленно-) линейный, а периартериальный сегмент сосудистого русла – как сферический, он имеет конфигурацию сектора, но с оговорками, которые расширяются в перинодальном сегменте, особенно сложном. «Metameros» (греч. – пере- + часть) – часть чего-то, следующая за или после чего-то. Этим термином обозначают сходные по строению, следующие друг за другом части тела или органа животного. Метамер – более узкое понятие, чем сегмент, закрепившееся в литературе за вполне определенными объектами: такой сегмент выступает в роли мономера, звена относительно однородного по составу образования. Метамерия – полимерный вариант линейной сегментарной организации. В этом смысле метамерия лимфатического сосуда (межклапанные сегменты) так же уместна, как и для позвоночного столба. Поэтому я предпочитаю использовать только термин «сегмент», чтобы избежать путаницы и перегрузки текста [5].
Повторяемость органов, ведущая к метамерии, вполне сравнима с лучевым строением кишечнополостных с 2 плоскостями симметрии [1]. Черви первыми в эволюции приобрели метамерию – плоскую, продольно-осевую сегментарную организацию тела (цестоды → полихеты). У хордовых (ветвь олигохетов) она утрачивается в разной мере [10] и даже в эмбриогенезе не воспроизводится в полном объеме. Первые сосуды образуются в стенках желточного мешка на 2-й нед развития человека и сходятся радиально к телу эмбриона, где через неделю возникает новый центр их образования. В теле сосуды идут также радиально, особенно вены, которые конвергируют в сердце. Однако формирующееся тело зародыша сразу же подвергается продольному вытяжению вдоль хорды с удлинением дорсальной аорты и кардинальных вен. В результате происходит линейное развертывание кровеносной системы (? как архимедовой спирали – эвольвента круга): радиальные региональные сосуды отходят от продольных центральных сосудов последовательно. Тело эмбрионов 3-6 нед разделяется на цепь метамеров. На всю жизнь такое строение сохраняет только грудная клетка с межреберными мышцами, сосудами и нервами, им соответствуют грудные сегменты спинного мозга. Это часть сомы. А как быть с другими частями тела?
С целью классификации лимфоузлов брюшной полости Б.В.Огнев выделил нервно-сосудистые фрагменты (лат. – обломок, отрывок) – группы внутренних органов, кровоснабжаемые одной ветвью аорты, ее сопровождают нервы, вены, лимфатические пути. Я [6] уточнил название таких образований, расширив их значение – дефинитивные корпоральные сегменты (ДКС). Они формируются на основе неравномерного роста тела и его частей. У эмбрионов 2-го мес аорта становится новым организатором сегментарного морфогенеза (рис. 1), т.к. она: 1) своими ветвями связана со всеми органами и обеспечивает их питание; 2) устойчива к давлению окружения, 2а) приобретая с ветвями адвентициальную оболочку, все более толстую и плотную. Обладая, кроме того, более высоким кровяным давлением, артерии доминируют во взаимодействиях с другими сосудами, детерминируя сегментарную организацию всего сосудистого русла: 1) их всегда сопровождают первичные вены с эндотелиальными стенками; 2) часть их выключается из кровотока в виде первичного лимфатического русла. По градиенту кровяного давления его корни отделяются от кровеносного русла. Лимфоток становится маятникообразным, чем обусловлены морфогенез множества клапанов и собственная полисегментарность путей лимфооттока из органов [5,8]. Нервно-сосудистые пучки ДКС вариабельны на протяжении так же, как обслуживаемые ими органы и области тела человека (рис. 2).
Рис. 1. Принципиальная схема сегментации тела человека: Co – сердце; Ao – аорта с ее ветвями; V – главные (полые) вены с их притоками; L – лимфатические протоки с их притоками; MСB – микроциркуляторное русло; S, J – сегменты тела (органы и связанные с ними сосуды ~ периферические сегменты лимфатической и всей сердечно-сосудистой системы) и их слияние / сращение на периферии
Рис. 2. Схема квазисегментарного устройства тела человека: S – корпоральные сегменты, сращенные в их основании (их слияние происходит на периферии, причем неравномерно); NVB – главный, продольно-осевой нервно-сосудистый пучок тела, его ветви направляются в корпоральные сегменты, где соединяются различным образом, но адекватно вариантам слияния сегментов
Первичной, парахордальной сегментации подвергается только дорсальная часть эмбриона [2]. Дробление дорсальной мезодермы на сомиты напоминает разделение первичной кишки на трехслойные закладки дефинитивных органов вокруг эпителиальных зачатков; участки мезенхимы между ними прогрессивно сужаются [4,7]. К сомитам растут дорсальные сегментарные ветви дорсальной аорты и нервной трубки. Почти сегментарны латеральные ветви аорты к клубочкам мезонефросов, могут отходить от сомитных артерий. Вентральные сегментарные артерии мало (не) соответствуют названию. Они отходят от короткой дорсальной аорты. Вентральные (желточные, пупочные) вены скорее радиальны. Тело эмбриона, нервная трубка, дорсальная аорта и первичная кишка удлиняются, а желточный мешок уменьшается с сужением желточно-кишечного протока. Средняя кишка, «зажатая» между бурно растущей печенью (краниально) и аллантоисом (каудально), в процессе своего еще более быстрого удлинения образует петлю, которая выходит в полость пупочного канатика (пупочная кишечная петля). При этом проекционная (на осевые органы) длина средней кишки остается небольшой. Из множества вентральных артерий этой области сохраняются только три (к печени, пупочной кишечной петле и задней кишке), самой крупной становится средняя – верхняя брыжеечная. Группа органов, кровоснабжаемых ее ветвями (главным образом тонкая кишка и правая 1/2 толстой кишки), претерпевает самые сложные морфогенетические изменения – от многоэтапного поворота вокруг артерии до обширных вторичных сращений брюшины в связи с интенсивным ростом средней кишки в длину в ограниченном пространстве [4]. Так же можно описать морфогенез чревного и нижнего брыжеечного ДКС вокруг соименных артерий. Венозные коллекторы этих ДКС впадают в парааортальную нижнюю полую вену не напрямую, а через печень, под влиянием прежде всего которой сливаются в один ствол – воротную вену печени. В связи с редукцией поясничных ребер их сегментарные мышцы срастаются в единый пласт парной квадратной мышцы поясницы, хотя поясничные артерии и вены сохраняют сегментарность. В связи с редукцией мезонефросов редуцируются их сегментарные артерии. Немногие из них сохраняются и формируют парные почечную и половую артерии. Таким образом, типичная сегментарность изначально характерна только для сомитов и связанных с ними сосудов. К еще большим нарушениям в не совсем стройной схеме первичного сегментарного строения сосудистого русла и тела эмбриона в целом приводит неравномерный рост провизорных и дефинитивных органов, который очень часто сопровождается их более или менее значительными перемещениями и деформациями, сращениями и слияниями, редукцией и т.п.
Заключение
Тело человека имеет квазисегментарное устройство: ДКС сращены в разной степени, особенно на периферии, их «осевой скелет» образуют ветви аорты и сопровождающие их вены, лимфатические сосуды и нервы. Сегментарный морфогенез тела человека начинается с сомитов эмбриона. Метамерия позднее утрачивается в той или иной мере. При этом сегментация тела сохраняется, даже нарастает, хотя и видоизменяется. Сама неполная первичная, продольно-осевая сегментация эмбриона человека (парахордальные сомиты) трансформируется во вторичную, продольно-радиальную квазисегментацию путем разделения его тела на периартериальные комплексы дефинитивных органов в процессе все более неравномерного роста сомитов и других органов, ресегментирующего тело с адекватными изменениями сосудов и нервов 6. Причем морфогенез ДКС вокруг ветвей аорты – процесс апериодический, в отличие от сомитогенеза.
Заболевания аорты и магистральных сосудов
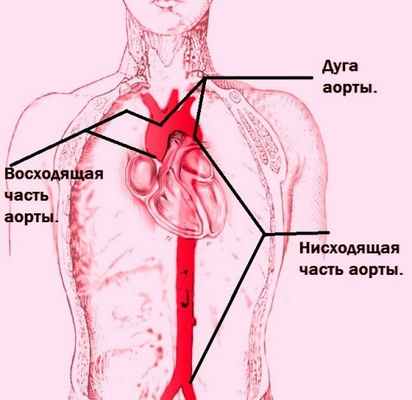
Аорта – самая крупная артерия организма, берущая свое начало из левого желудочка сердца. Максимальный диаметр аорты в норме составляет около 3 см. По аорте и ее ветвям течет обогащенная кислородом артериальная кровь, снабжающая органы и ткани кислородом и питательными веществами. Аорта имеет несколько отделов: восходящая аорта, дуга аорты и нисходящая аорта.
Хирургия аорты по праву считается одним из самых сложных разделов кардиохирургии, которым в России занимаются единичные клиники и специалисты. В ФГБУ «ФЦССХ им. С.Г. Суханова» Минздрава России (г. Пермь) выполняются все виды хирургического лечения патологии аорты.
Аневризма аорты – бомба замедленного действия. Аневризма аорты – это выпячивания стенки вследствие ее истончения или растяжения. В результате появляется так называемый аневризматический мешок, который может сдавливать расположенные вблизи органы и ткани. С ним можно жить годами, заниматься повседневными делами и не испытывать никаких симптомов. А тем временем аневризма будет незаметно расти, угрожая в любой момент разорваться.
Диагностика аневризм аорты
Часто аневризму обнаруживают случайно, при ультразвуковом или рентгенологическим исследовании. При ее выявлении требуется срочное лечение, так как разрыв аневризмы приводит к кровоизлиянию, способному привести к смерти. В момент разрыва аневризмы человек чувствует боль, а его артериальное давление начинает стремительно падать из-за большой потери крови.
Наиболее точную информацию о наличии аневризм дают такие методы диагностики, как компьютерная томография, магнитно-резонансная томография, ангиография.
Лечение аневризм аорты заключается в их хирургическом иссечении с последующей заменой удаленного участка аорты сосудистым синтетическим протезом (трубкой).
В ФГБУ «ФЦССХ им. С.Г. Суханова» Минздрава России (г. Пермь) выполняются операции по поводу аневризм восходящей аорты и дуги аорты, аневризм дуги аорты, аневризм нисходящей грудной аорты, аневризм брюшной аорты, аневризм торакоабдоминальной аорты. Успешно применяются технологии реконструкции корня аорты – клапаносохраняющие операции на аортальном клапане – операция Дэвида. В Центре выполняются операции по реконструкции дуги аорты – с использованием различных современных методик защиты головного мозга – антеградной церебральной перфузии, циркуляторного арреста.
Специалисты ФГБУ «ФЦССХ им. С.Г. Суханова» Минздрава России (г. Пермь) применяют эндоваскулярные технологии в лечении аневризм аорты. Такие операции проводятся в специальных рентгеноперационных, главным их отличием от «большой» хирургии является малая травматичность процедуры и быстрое восстановление пациента. Через небольшой прокол на бедре выше и ниже расширенного участка аорты устанавливается стент-графт – каркасная трубка, которая будет выполнять функцию аорты с полным восстановлением кровотока и изоляцией аневризмы.
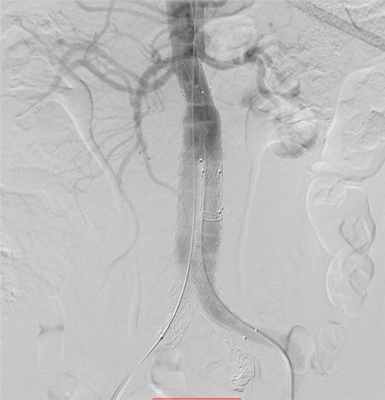
Имплантация стент-графта брюшной аорты
- Помимо плановой медицинской помощи, что является основной задачей Центра, в ФГБУ «ФЦССХ им. С.Г. Суханова» Минздрава России (г. Пермь) оказывается экстренная кардиохирургическая помощь пациентам с грозным осложнением заболеваний аорты – острым расслоением.
Расслоение аорты может начаться без видимой причины, однако часто оно возникает в результате выполнения тяжелой физической работы или вследствие резкого подъема артериального давления. В большинстве случаев в момент расслоения возникает боль различной интенсивности, начиная от неприятных болевых ощущений в области расслоения и заканчивая очень сильной болью. Иногда боль может вызывать болевой шок в сочетании с резким снижением артериального давления и последующим обмороком.
Своевременно заподозрить начавшееся расслоение аорты удается далеко не всегда. В связи с тем, что расслоение аорты может «маскироваться» под другие заболевания, его часто принимают за острый инфаркт миокарда, острое нарушение мозгового кровообращения или так называемый «острый живот». В такой ситуации крайне важно исключить острый инфаркт миокарда, так как лечение расслоения аорты и инфаркта миокарда предполагает диаметрально противоположные меры.
Для диагностики расслоения аорты используются такие методы исследования, как электрокардиография (ЭКГ), рентгенография, ультразвуковые исследования (эхокардиография – ЭхоКГ, в частности чреспищеводная, ультразвуковое исследование брюшной полости), магнитно-резонансная томография, компьютерная томография с внутривенным введением контрастного вещества. Ангиография аорты (аортография) – эталонный метод диагностики расслоения аорты.
Лечение расслоения аорты
Тактика лечения больных с расслоением аорты различна в зависимости от давности расслоения и его расположения. Острое расслоение аорты встречается в сроки до 2 недель от начала заболевания, хроническое расслоение – после этого периода. При подозрении на расслоение аорты больной должен быть в экстренном порядке на носилках доставлен в стационар, где ему и дальше будет предписан строгий постельный режим. Любое физическое напряжение может привести к необратимым последствиям. Расслоение восходящей аорты и дуги из-за возможности развития опасных для жизни осложнений в большинстве случаев является абсолютным показанием к экстренной хирургической операции вне зависимости от сроков давности расслоения. При расслоении нисходящей и брюшной аорты в отсутствии непосредственной угрозы для жизни операция может быть выполнена в плановом порядке.
Показаниями к экстренной операции при расслоении нисходящей и брюшной аорты являются угроза дальнейшего расслоения или начинающийся разрыв стенки аорты с внутренним кровотечением. Дополнительным аргументом в пользу выполнения операции у таких больных является развитие аневризмы аорты или прогрессирующее нарушение функции органов грудной клетки и брюшной полости, в частности, почек.
- В ФГБУ «ФЦССХ им. С.Г. Суханова» Минздрава России (г. Пермь) проводятся сочетанные процедуры при реконструктивной хирургии аорты: коронарное шунтирование, ластика митрального клапана, протезирование митрального клапана, пластика трикуспидального клапана, процедура MAZE.
На сегодняшний день реконструктивная хирургия патологии аорты является золотым стандартом лечения. В ФГБУ «ФЦССХ им. С.Г. Суханова» Минздрава России (г. Пермь) ежегодно выполняется порядка 50-60 операций по поводу патологии аорты, 10-15 оперативных вмешательств при расслоении аорты. Результаты хирургического лечения сопоставимы с лучшими клиниками Европы и США. Экстренные операции связаны с достаточно высоким риском, летальность даже в лучших мировых клиниках достигает 10-25%, однако это несопоставимо с тем фактом, что без оперативного хирургического лечения такие пациенты по сути обречены – смертность составляет 100%.
Читайте также:
