Дронедарон при аритмии сердца - показания, противопоказания
Добавил пользователь Алексей Ф. Обновлено: 30.01.2026
Амиодарона гидрохлорид — кристаллический порошок белого или кремового цвета. Малорастворим в воде, растворим в спирте, хорошо растворим в хлороформе.
Фармакологическое действие
Фармакология
Блокирует ионные каналы (главным образом калиевые, в меньшей степени — кальциевые и натриевые) мембран кардиомиоцитов, тормозит возбуждение альфа- и бета-адренорецепторов. Увеличивает продолжительность потенциала действия всех сердечных структур за счет выраженного снижения его амплитуды. Обладает отрицательным хронотропным влиянием. Симпатолитическая активность и блокада калиевых и кальциевых каналов уменьшают потребность миокарда в кислороде, приводят к отрицательному дромотропному эффекту: замедляется проводимость и удлиняется рефрактерный период в синусном и AV узлах. Обладая свойством вазодилататора, может снижать сопротивление коронарных сосудов.
Биодоступность после приема внутрь составляет почти 50% (варьирует от 35 до 65%). Cmax достигается в плазме через 3–7 ч после приема однократной дозы, средняя концентрация в плазме составляет от 1 до 2,5 мг/л. Связывание с белками плазмы — 96%. Обладает способностью к выраженной аккумуляции, накапливается в хорошо перфузируемых органах (печень, легкие и селезенка) и депонируется в жировой ткани. Преодолевает плацентарный барьер (10–50%) и проникает в грудное молоко. Основной путь выделения — через желчь (может иметь место незначительная энтеропеченочная рециркуляция). Имеет низкий плазменный клиренс с незначительной почечной экскрецией.
Применение вещества Амиодарон
Тяжелые аритмии (как правило, при неэффективности или невозможности другой терапии): предсердная и желудочковая экстрасистолия, WPW-синдром , трепетание и мерцание предсердий, желудочковая тахикардия, фибрилляция желудочков; аритмии на фоне коронарной или сердечной недостаточности, желудочковые аритмии у больных с миокардитом Шагаса.
Противопоказания
Гиперчувствительность (в т.ч. к йоду), синусовая брадикардия, AV блокада, синдром синусовой недостаточности, выраженные нарушения проводимости, кардиогенный шок, дисфункция щитовидной железы.
Применение при беременности и кормлении грудью
Категория действия на плод по FDA — D.
Побочные действия вещества Амиодарон
Микроотслойки сетчатки, неврит зрительного нерва, гипер- (требуется отмена препарата) или гипотиреоз, фиброз легких, пневмонит, плеврит, бронхиолит, пневмония, периферические невропатии и/или миопатии, экстрапирамидный тремор, атаксия, черепно-мозговая гипертензия, ночные кошмары, брадикардия, асистолия, AV блокада, тошнота, рвота, нарушение функции печени, алопеция, эпидидимит, анемия, фотосенсибилизация, аллергические реакции.
Взаимодействие
Бета-адреноблокаторы увеличивают риск возникновения гипотензии и брадикардии. Несовместим с БКК (повышается вероятность развития AV блокады и гипотензии). Колестирамин уменьшает T1/2 и уровень амиодарона в плазме, циметидин — увеличивает. Усиливает эффект непрямых антикоагулянтов, препаратов наперстянки. Повышает концентрацию циклоспорина в крови.
Передозировка
Симптомы: брадикардия, выраженное снижение АД , AV блокада, электромеханическая диссоциация, кардиогенный шок, асистолия, остановка сердца.
Способ применения и дозы
В/в, насыщающая доза — 5 мг/кг в в течение 15 мин по 2–3 раза в сутки, поддерживающая терапия — 10–20 мг/кг/сут (250 мл 5% водного раствора).
Внутрь, от 100 до 400 мг/сут (максимальная доза — 600 мг/сут) в течение 8–10 дней, возможен перерыв — 2 дня в неделю.
Меры предосторожности
Обязателен ЭКГ-контроль. Не рекомендуется сочетать с бета-адреноблокаторами, верапамилом, дилтиаземом, слабительными, стимулирующими моторику ЖКТ . С осторожностью комбинируют с препаратами, вызывающими гипокалиемию (диуретики, кортикостероиды, амфотерицин В для в/в введения), и назначают больным с тяжелой и длительной диареей. При длительном лечении необходимо наблюдение окулиста, регулярный контроль функции щитовидной железы, рентгенологический контроль легких.
Лечение нарушений ритма сердца
Почему терапия аритмий считается одним из самых сложных разделов кардиологии? Как классифицируются аритмии? Какие группы лекарственных препаратов используются при лечении аритмий? Нарушения ритма сердца (аритмии) представляют собой один из самы
Почему терапия аритмий считается одним из самых сложных разделов кардиологии?
Как классифицируются аритмии?
Какие группы лекарственных препаратов используются при лечении аритмий?

Нарушения ритма сердца (аритмии) представляют собой один из самых сложных разделов клинической кардиологии. Отчасти это объясняется тем, что для диагностики и лечения аритмий необходимо очень хорошее знание электрокардиографии, отчасти — огромным разнообразием аритмий и большим выбором способов лечения. Кроме того, при внезапных аритмиях нередко требуется проведение неотложных лечебных мероприятий.
Одним из основных факторов, повышающих риск возникновения аритмий, является возраст. Так, например, мерцательную аритмию выявляют у 0,4% людей, при этом большую часть пациентов составляют люди старше 60 лет [1, 2, 4]. Увеличение частоты развития нарушений ритма сердца с возрастом объясняется изменениями, возникающими в миокарде и проводящей системе сердца в процессе старения. Происходит замещение миоцитов фиброзной тканью, развиваются так называемые «склеродегенеративные» изменения. Кроме этого, с возрастом повышается частота сердечно-сосудистых и экстракардиальных заболеваний, что также увеличивает вероятность возникновения аритмий [17, 18].
Основные клинические формы нарушений ритма сердца
- Экстрасистолия.
- Тахиаритмии (тахикардии).
- Наджелудочковые.
- Желудочковые.
По характеру клинического течения нарушения ритма сердца могут быть острыми и хроническими, преходящими и постоянными. Для характеристики клинического течения тахиаритмий используют такие определения, как «пароксизмальные», «рецидивирующие», «непрерывно рецидивирующие» [2].
Лечение нарушений ритма сердца
Показаниями для лечения нарушений ритма являются выраженные нарушения гемодинамики или субъективная непереносимость аритмии. Безопасные, бессимптомные или малосимптомные легко переносящиеся аритмии не требуют назначения специального лечения. В этих случаях основным лечебным мероприятием является рациональная психотерапия. Во всех случаях прежде всего проводится лечение основного заболевания.
Антиаритмические препараты
Основным способом терапии аритмий является применение антиаритмических препаратов. Хотя антиаритмические препаты не могут «вылечить» от аритмии, они помогают уменьшить или подавить аритмическую активность и предотвратить рецидивирование аритмий.
Любое воздействие антиаритмическими препаратами может вызывать как антиаритмический, так и аритмогенный эффект (то есть, наоборот, способствовать возникновению или развитию аритмии). Вероятность проявления антиаритмического эффекта для большинства препаратов составляет в среднем 40–60% (и очень редко для некоторых препаратов при отдельных вариантах аритмии достигает 90%). Вероятность развития аритмогенного эффекта составляет в среднем примерно 10%, при этом могут возникать опасные для жизни аритмии. В ходе нескольких крупных клинических исследований было выявлено заметное повышение общей летальности и частоты случаев внезапной смерти (в 2 — 3 раза и более) среди больных с органическим поражением сердца (постинфарктный кардиосклероз, гипертрофия или дилатация сердца) на фоне приема антиаритмических препаратов класса I, несмотря на то что эти средства эффективно устраняли аритмии [7, 8, 9].
Согласно наиболее распространенной на сегодняшний день классификации антиаритмических препаратов Вогана Вильямса, все антиаритмические препараты подразделяются на 4 класса:
I класс — блокаторы натриевых каналов.
II класс — блокаторы бета-адренергических рецепторов.
III класс — препараты, увеличивающие продолжительность потенциала действия и рефрактерность миокарда.
IV класс — блокаторы кальциевых каналов.Применение комбинаций антиаритмических препаратов в ряде случаев позволяет достичь существенного повышения эффективности антиаритмической терапии. Одновременно отмечается уменьшение частоты и выраженности побочных явлений вследствие того, что препараты при комбинированной терапии назначают в меньших дозах [3, 17].
Следует отметить, что показаний для назначения так называемых метаболических препаратов пациентам с нарушениями ритма не существует. Эффективность курсового лечения такими препаратами, как кокарбоксилаза, АТФ, инозие-Ф, рибоксин, неотон и т. п., и плацебо одинаковы. Исключение составляет милдронат, препарат цитопротективного действия, имеются данные об антиаритмическом эффекте милдроната при желудочковой экстрасистолии [3].
Особенности лечения основных клинических форм нарушений ритма
Экстрасистолия
Клиническое значение экстрасистолии практически целиком определяется характером основного заболевания, степенью органического поражения сердца и функциональным состоянием миокарда. У лиц без признаков поражения миокарда с нормальной сократительной функцией левого желудочка (фракция выброса больше 50%) наличие экстрасистолии не влияет на прогноз и не представляет опасности для жизни. У больных с органическим поражением миокарда, например с постинфарктным кардиосклерозом, экстрасистолия может рассматриваться в качестве дополнительного прогностически неблагоприятного признака. Однако независимое прогностическое значение экстрасистолии не определено. Экстрасистолию (в том числе экстрасистолию «высоких градаций») даже называют «косметической» аритмией, подчеркивая таким образом ее безопасность.
Как было уже отмечено, лечение экстрасистолии с помощью антиаритмических препаратов класса I C значительно увеличивает риск смерти. Поэтому при наличии показаний лечение начинают с назначения β-блокаторов [8, 17, 18]. В дальнейшем оценивают эффективность терапии амиодароном и соталолом. Возможно также применение седативных препаратов. Антиаритмические препараты класса I C используют только при очень частой экстрасистолии, в случае отсутствия эффекта от терапии β-блокаторами, а также амидороном и соталолом (табл. 3)
Тахиаритмии
В зависимости от локализации источника аритмии различают наджелудочковые и желудочковые тахиаритмии. По характеру клинического течения выделяют 2 крайних варианта тахиаритмий (постоянные и пароксизмальные. Промежуточное положение занимают преходящие или рецидивирующие тахиаритмии. Чаще всего наблюдается мерцательная аритмия. Частота выявления мерцательной аритмии резко увеличивается с возрастом больных [1, 17, 18].
Мерцательная аритмия
Пароксизмальная мерцательная аритмия. В течение первых суток у 50% больных с пароксизмальной мерцательной аритмией отмечается спонтанное восстановление синусового ритма. Однако произойдет ли восстановление синусового ритма в первые часы, остается неизвестным. Поэтому при раннем обращении больного, как правило, предпринимаются попытки восстановления синусового ритма с помощью антиаритмических препаратов. В последние годы алгоритм лечения мерцательной аритмии несколько усложнился. Если от начала приступа прошло более 2 суток, восстановление нормального ритма может быть опасным — повышен риск тромбоэмболии (чаще всего в сосуды мозга с развитием инсульта). При неревматической мерцательной аритмии риск тромбоэмболий составляет от 1 до 5% (в среднем около 2%). Поэтому, если мерцательная аритмия продолжается более 2 суток, надо прекратить попытки восстановления ритма и назначить больному непрямые антикоагулянты (варфарин или фенилин) на 3 недели в дозах, поддерживающих показатель международного нормализованного отношения (МНО) в пределах от 2 до 3 (протромбиновый индекс около 60%). Через 3 недели можно предпринять попытку восстановления синусового ритма с помощью медикаментозной или электрической кардиоверсии. После кардиоверсии больной должен продолжить прием антикоагулянтов еще в течение месяца.
Таким образом, попытки восстановления синусового ритма предпринимают в течение первых 2 суток после развития мерцательной аритмии или через 3 недели после начала приема антикоагулянтов. При тахисистолической форме сначала следует уменьшить ЧСС (перевести в нормосистолическую форму) с помощью препаратов, блокирующих проведение в атриовентрикулярном узле: верапамила, β-блокаторов или дигоксина.
Для восстановления синусового ритма наиболее эффективны следующие препараты:
- амиодарон - 300-450 мг в/в или однократный прием внутрь в дозе 30 мг/кг;
- пропафенон - 70 мг в/в или 600 мг внутрь;
- новокаинамид - 1 г в/в или 2 г внутрь;
- хинидин - 0,4 г внутрь, далее по 0,2 г через 1 ч до купирования (макс. доза - 1,4 г).
Сегодня с целью восстановления синусового ритма при мерцательной аритмии все чаще назначают однократную дозу амиодарона или пропафенона перорально. Эти препараты отличаются высокой эффективностью, хорошей переносимостью и удобством приема. Среднее время восстановления синусового ритма после приема амиодарона (30 мг/кг) составляет 6 ч, после пропафенона (600 мг) — 2 ч [6, 8, 9].
При трепетании предсердий кроме медикаментозного лечения можно использовать чреспищеводную стимуляцию левого предсердия с частотой, превышающей частоту трепетания, — обычно около 350 импульсов в минуту, продолжительностью 15–30 с. Кроме того, при трепетании предсердий очень эффективным может быть проведение электрической кардиоверсии разрядом мощностью 25–75 Дж после в/в введения реланиума.
Постоянная форма мерцательной аритмии. Мерцание предсердий является наиболее часто встречающейся формой устойчивой аритмии. У 60% больных с постоянной формой мерцательной аритмии основным заболеванием являются артериальная гипертония или ИБС. В ходе специальных исследований было выявлено, что ИБС становится причиной развития мерцательной аритмии примерно у 5% больных. В России существует гипердиагностика ИБС у больных с мерцательной аритмией, особенно среди людей пожилого возраста. Для постановки диагноза ИБС всегда необходимо продемонстрировать наличие клинических проявлений ишемии миокарда: стенокардии, безболевой ишемии миокарда, постинфарктного кардиосклероза.
Мерцательная аритмия обычно сопровождается неприятными ощущениями в грудной клетке, могут отмечаться нарушения гемодинамики и, главное, повышается риск возникновения тромбоэмболий, прежде всего в сосуды мозга. Для снижения степени риска назначают антикоагулянты непрямого действия (варфарин, фенилин). Менее эффективно применение аспирина [1, 17, 18].
Основным показанием для восстановления синусового ритма при постоянной форме мерцательной аритмии является «желание больного и согласие врача».
Для восстановления синусового ритма используют антиаритмические препараты или электроимпульсную терапию.
Антикоагулянты назначают, если мерцательная аритмия наблюдается более 2 суток. Особенно высок риск развития тромбоэмболий при митральном пороке сердца, гипертрофической кардиомиопатии, недостаточности кровообращения и тромбоэмболиях в анамнезе. Антикоагулянты назначают в течение 3 недель до кардиоверсии и в течение 3 — 4 недель после восстановления синусового ритма. Без назначения антиаритмических препаратов после кардиоверсии синусовый ритм сохраняется в течение 1 года у 15 — 50% больных. Применение антиаритмических препаратов повышает вероятность сохранения синусового ритма. Наиболее эффективно назначение амиодарона (кордарона) — даже при рефрактерности к другим антиаритмическим препаратам синусовый ритм сохраняется у 30 — 85% больных [2, 12]. Кордарон нередко эффективен и при выраженном увеличении левого предсердия.
Кроме амиодарона для предупреждения повторного возникновения мерцательной аритмии с успехом используются соталол, пропафенон, этацизин и аллапинин, несколько менее эффективны хинидин и дизопирамид. При сохранении постоянной формы мерцательной аритмии больным с тахисистолией для снижения ЧСС назначают дигоксин, верапамил или β-блокаторы. При редко встречающемся брадисистолическом варианте мерцательной аритмии эффективным может быть назначение эуфиллина (теопек, теотард).
Проведенные исследования показали, что две основные стратегии ведения больных с мерцательной аритмией — попытки сохранения синусового ритма или нормализация ЧСС на фоне мерцательной аритмии в сочетании с приемом непрямых антикоагулянтов — обеспечивают примерно одинаковое качество и продолжительность жизни больных [17].
Пароксизмальные наджелудочковые тахикардии
Пароксизмальные наджелудочковые тахикардии, встречающиеся гораздо реже, чем мерцательная аритмия, не связаны с наличием органического поражения сердца. Частота их выявления с возрастом не увеличивается.
Купирование пароксизмальных наджелудочковых тахикардий начинают с применения вагусных приемов. Наиболее часто используют пробу Вальсальвы (натуживание на вдохе около 10 с) и массаж сонной артерии. Очень эффективным вагусным приемом является «рефлекс ныряния» (погружение лица в холодную воду) — восстановление синусового ритма отмечается у 90% больных. При отсутствии эффекта от вагусных воздействий назначают антиаритмические препараты. Наиболее эффективны в этом случае верапамил, АТФ или аденозин.
У больных с легко переносящимися и сравнительно редко возникающими приступами тахикардии практикуется самостоятельное пероральное купирование приступов. Если в/в введение верапамила оказывается эффективным, можно назначить его внутрь в дозе 160–240 мг однократно, в момент возникновения приступов. Если более эффективным признается в/в введение новокаинамида — показан прием 2 г новокаинамида. Можно иcпользовать 0,5 г хинидина, 600 мг пропафенона или 30 мг/кг амиодарона внутрь.
Желудочковые тахикардии
Желудочковые тахикардии в большинстве случаев возникают у больных с органическим поражением сердца, чаще всего при постинфарктном кардиосклерозе [13, 14].
Лечение желудочковой тахикардии. Для купирования желудочковой тахикардии можно использовать амиодарон, лидокаин, соталол или новокаинамид.
При тяжелых, рефрактерных к медикаментозной и электроимпульсной терапии, угрожающих жизни желудочковых тахиаритмиях применяют прием больших доз амиодарона: внутрь до 4 — 6 г в сутки перорально в течение 3 дней (то есть по 20 — 30 табл.), далее по 2,4 г в сутки в течение 2 дней (по 12 табл.) с последующим снижением дозы [6, 10, 15, 16].
Предупреждение рецидивирования тахиаритмий
При частых приступах тахиаритмий (например, 1 — 2 раза в неделю) последовательно назначают антиаритмические препараты и их комбинации до прекращения приступов. Наиболее эффективным является назначение амиодарона в качестве монотерапии или в комбинации с другими антиаритмическими препаратами, прежде всего с β-блокаторами.
При редко возникающих, но тяжелых приступах тахиаритмий подбор эффективной антиаритмической терапии удобно проводить с помощью чреспищеводной электростимуляции сердца — при наджелудочковых тахиаритмиях — и программированной эндокардиальной стимуляции желудочков (внутрисердечное электрофизиологическое исследование) — при желудочковых тахиаритмиях. С помощью электростимуляции в большинстве случаев удается индуцировать приступ тахикардии, идентичный тем, которые спонтанно возникают у данного больного. Невозможность индукции приступа при повторной электрокардиостимуляции на фоне приема препаратов обычно совпадает с их эффективностью при длительном приеме [17, 18]. Следует отметить, что некоторые проспективные исследования продемонстрировали преимущество «слепого» назначения амиодарона и соталола при желудочковых тахиаритмиях перед тестированием антиаритмических препаратов класса I с помощью программированной электростимуляции желудочков или мониторирования ЭКГ.
При тяжелом течении пароксизмальных тахиаритмий и рефрактерности к медикаментозной терапии применяют хирургические способы лечения аритмий, имплантацию кардиостимулятора и кардиовертера-дефибриллятора.
Подбор антиаритмической терапии у больных с рецидивирующимим аритмиями
С учетом безопасности антиаритмических препаратов оценку эффективности целесообразно начинать с β-блокаторов или амиодарона. При неэффективности монотерапии оценивают действенность назначения амиодарона в комбинации с β-блокаторами [17]. Если нет брадикардии или удлинения интервала РR, с амиодароном можно сочетать любой β-блокатор. У больных с брадикардией к амиодарону добавляют пиндолол (вискен). Показано, что совместный прием амиодарона и β-блокаторов способствует значительно большему снижению смертности пациентов с сердечно-сосудистыми заболеваниями, чем прием каждого из препаратов в отдельности. Некоторые специалисты даже рекомендуют имплантацию двухкамерного стимулятора (в режиме DDDR) для безопасной терапии амиодароном в сочетании с β-блокаторами. Антиаритмические препараты класса I применяют только при отсутствии эффекта от β-блокаторов и/или амиодарона. Препараты класса I C, как правило, назначают на фоне приема бета-блокатора или амиодарона. В настоящее время изучается эффективность и безопасность применения соталола (β-блокатора, обладающего свойствами препаратов класса III).
П. Х. Джанашия, доктор медицинских наук, профессор
Н. М. Шевченко, доктор медицинских наук, профессор
С. М. Сорокoлетов, доктор медицинских наук, профессор
РГМУ, Медицинский центр Банка России, МоскваДронедарон при аритмии сердца - показания, противопоказания
Амиодарон при аритмии сердца - показания, противопоказания
Амиодарон имеет ряд преимуществ над остальными препаратами. Он высокоэффективен как при суправентрикулярных, так и при желудочковых нарушениях ритма сердца. Даже если аритмия рефрактерна к другим средствам антиаритмической терапии, назначение амиодарона оказывается успешным в 70% случаев.
Препарат имеет необычайно длинный период полувыведения (20-100 дней) и поэтому его принимают лишь 1 раз в сутки или даже реже. Он не оказывает существенного влияния на функцию желудочков, и его можно назначать пациентам с сердечной недостаточностью.
Вместе с тем амиодарон обладает рядом существенных нежелательных эффектов, поэтому длительно назначать его следует только больным с опасными для жизни или рефрактерными к другим препаратам нарушениями ритма сердца, или в тех случаях, когда риск развития побочных эффектов не столь значим в связи с общим плохим прогнозом (например, у лиц старческого возраста или пациентов с тяжелым поражением миокарда).
Несмотря на то что амиодарон эффективен в лечении желудочковых аритмий, недавно было показано, что у пациентов со сниженной функцией желудочков он не играет большой роли в «первичной профилактике» внезапной смерти, т.е. не предотвращает развития фатальных желудочковых нарушений ритма сердца у таких больных. Тем не менее многие пациенты с имплантированными дефибрилляторами нуждаются в приеме амиодарона с целью подавления желудочковых аритмий и, соответственно, снижения частоты срабатывания устройства.
![Амиодарон]()
Побочные эффекты амиодарона
При кратковременном парентеральном применении амиодарона возникновение побочных эффектов маловероятно, хотя описаны редкие случаи развития амиодарон-ассоциированного лекарственного гепатита. Введение в периферическую вену нередко сопровождается развитием флебита.
Длительный прием препарата внутрь, напротив, ассоциирован с высоким риском возникновения побочных эффектов.
Основные нежелательные эффекты амиодарона:
- Дерматологические: фотосенсибилизация и сине-серая пигментация
- Роговичные микродепозиты
- Дисфункция щитовидной железы: гипер- и гипотиреоз
- Фиброз легких
- Гепатит
- Нейропатия
- Миопатия
- Нарушения сна: бессонница, слишком яркие или кошмарные сновидения
- Тремор
- Алопеция
- Тахикардия типа «пируэт»
- Усиление действия варфаринаДерматологические эффекты амиодарона
Фотосенсибилизация, т.е. повышение чувствительности кожи к воздействию ультрафиолетовых лучей, наблюдается у 2/3 пациентов. Несмотря на то что тяжелая фотосенсибилизация возникает лишь в незначительном числе случаев, о возможности ее развития следует предупреждать каждого, кто принимает амиодарон. При необходимости можно рекомендовать использовать специальную защитную одежду и защитные кремы, содержащие оксид цинка, избегать длительного пребывания на солнце.
Тяжелая реакция фотосенсибилизации является наиболее частой причиной отмены препарата, после которой симптомы могут сохраняться в течение года. Связь между типом кожи или дозой препарата и выраженностью этой реакции, по-видимому, отсутствует. У небольшого числа пациентов после длительного приема амиодарона развивается заметная сине-серая пигментация кожи, особенно в области носа и лба. Эта пигментация сохраняется в течение многих лет после отмены препарата.
Офтальмологические эффекты амиодарона
Тиреотропное действие амиодарона
Амиодарон содержит очень большое количество йода и вызывает умеренное увеличение сывороточного уровня тироксина и реверсивного трийодтиронина, а также снижение уровня сывороточного трийодтиронина. Концентрация тиреотропного гормона в сыворотке также может снижаться. Эти изменения на фоне терапии амиодароном свидетельствуют о нормальной функции щитовидной железы. Однако амиодарон может вызвать развитие как гипо-, так и гипертиреоза, что наблюдается у 15% пациентов.
Гипертиреоз может быть следствием активизации предсуществующей субклинической патологии щитовидной железы (которая, в свою очередь, может привести к увеличению синтеза тиреоидных гормонов) или следствием тиреоидита, развивающегося в исходно нормальной щитовидной железе и приводящего к усилению высвобождения ее гормонов. При развитии гипертиреоза часто ухудшается общее самочувствие пациента, наблюдаются снижение массы тела и другие признаки гиперфункции щитовидной железы.
Возможно рецидивирование аритмии, которую ранее удавалось контролировать лечением. В сыворотке повышается содержание как тироксина, так и трийодтиронина. Гипертиреоз может развиться достаточно остро и протекать тяжело. Он может возникнуть даже через много месяцев после прекращения приема амиодарона.
При развитии гипотиреоза в сыворотке крови снижается содержание тироксина, а уровень тиреотропного гормона повышается. Иногда данное состояние развивается без клинических проявлений. Показана заместительная терапия гормонами щитовидной железы. Отмена амиодарона не требуется. Обнаружение аутоантител к ткани щитовидной железы заставляет предположить наличие предсуществующей патологии железы и то, что гипотиреоз может прогрессировать даже после отмены амиодарона.
У больных, длительно принимающих амиодарон, состояние щитовидной железы необходимо контролировать каждые 6-12 месяцев. Всегда должен быть высокий уровень настороженности в плане возможного развития гипертиреоза у лиц, которые получают амиодарон или принимали его ранее.
Прочие побочные эффекты амиодарона
К другим серьезным побочным эффектам амиодарона относятся фиброз легких, гепатит, нейропатия и миопатия. Иногда несколько серьезных нежелательных эффектов проявляются одновременно. Как правило (но не всегда!), возникновение серьезных побочных эффектов связано с приемом высоких доз амиодарона.
Легочный фиброз - наиболее частая проблема. Клиническими проявлениями обычно становятся одышка (может быть выраженной) и обширные затемнения легочных полей, которые можно перепутать с отеком легких. Наличие предсуществующей патологии легких не влияет на риск этого осложнения. Как только диагноз поставлен, следует прекратить терапию амиодароном и провести короткий курс лечения глюкокортикостероидами. Часто наблюдается снижение диффузионной способности легких без каких-либо клинических проявлений.
Другими нежелательными эффектами являются тошнота, кожная сыпь, алопеция, тремор, тестикулярная дисфункция, бессонница и кошмарные сновидения, которые могут быть очень, яркими.
Важно отметить, что амиодарон потенцирует действие оральных антикоагулянтов, в результате чего дозу последних приходится уменьшать, обычно вдвое. Кроме того, препарат увеличивает концентрацию в плазме крови дигоксина, хинидина, верапамила, флекаинида и циклоспорина.
При некоторых формах аритмии основные преимущества амиодарона (высокая эффективность, отсутствие отрицательного инотропного действия и большая продолжительность действия) «перевешиваются» обширным списком побочных эффектов. Однако большинство из них являются обратимыми, и риск их развития не должен служить противопоказанием к назначению амиодарона пациентам с угрожающими жизни нарушениями ритма сердца, с короткой ожидаемой продолжительностью жизни, а также в тех случаях, когда другие антиаритмические препараты оказались неэффективны.
![Выбор лекарства для лечения аритмии сердца]()
Дозировки и сроки применения амиодарона
Начало действия препарата существенно сдвинуто во времени. При приеме внутрь действие начинает проявляться на 3-7-е сутки лечения, а для развития максимального эффекта может потребоваться до 50 дней. При необходимости скорость наступления действия можно увеличить, назначив препарат в очень высоких дозах (например, по 600-1200 мг/сут.) в течение 1-2 нед. Затем дозу следует снизить до 400 мг/сут.
После достижения антиаритмического эффекта рекомендуется постепенное снижение дозы препарата, пока не будет определена минимальная эффективная доза. Обычно поддерживающая доза составляет 200-400 мг/сут. Для отдельных больных оказывается достаточным прием 200 мг через день. По опыту автора, при снижении суточной дозы у взрослых до уровня менее 300 мг/сут. рецидивы аритмии обычно возобновляются. При опасных формах аритмии не стоит рисковать и уменьшать дозу препарата ниже 300 мг/сут.
Препарат подвергается метаболизму в печени; почками не экскретируется. Основным метаболитом является дезэтиламиодарон, который сам по себе оказывает антиаритмическое действие. Очень высокая концентрация амиодарона и его метаболита наблюдается в легких, сердце, печени и жировой ткани.
При внутривенном введении действие развивается быстрее, чем при приеме внутрь, однако, в отличие от большинства других препаратов, немедленный антиаритмический эффект наблюдается редко. Как правило, он развивается через 1-24 ч. Если аритмия плохо поддается лечению, представляется целесообразным внутривенное введение амиодарона (несмотря на возможную задержку начала действия) вместо попыток примения других препаратов, которые менее эффективны и часто вызывают побочное действие.
Рекомендованная доза для внутривенного введения составляет 5 мг/кг за 30-60 мин с последующей инфузией 15 мг/кг в течение 24 ч. В экстренных ситуациях первичное внутривенное введение можно осуществлять с большей скоростью, однако вазодилатирующее действие амиодарона может привести к развитию выраженной артериальной гипотензии. Чтобы избежать развития флебита, препарат следует вводить через центральную вену. Если это невозможно, рекомендуется чаще менять места инфузии (обычно этого бывает достаточно).
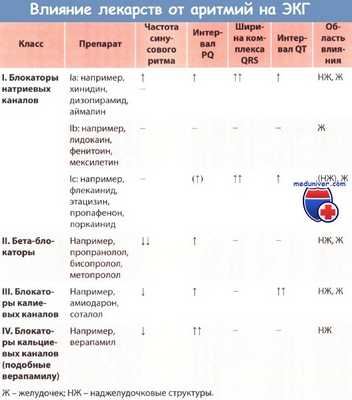
![Влияние лекарств от аритмий на ЭКГ]()
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Мультак ® (Multaque) инструкция по применению
Форма выпуска, упаковка и состав препарата Мультак ®
Таблетки, покрытые пленочной оболочкой 1 таб. дронедарон 400 мг 10 шт. - блистеры из ПВХ/алюминиевой фольги (1) - пачки картонные.
10 шт. - блистеры из ПВХ/алюминиевой фольги (2) - пачки картонные.
10 шт. - блистеры из ПВХ/алюминиевой фольги (6) - пачки картонные.
10 шт. - блистеры из ПВХ/алюминиевой фольги (10) - пачки картонные.Дронедарон обладает электрофизиологическими свойствами, характерными для всех четырех классов антиаритмиков по классификации Воген-Вильямса. Дронедарон является блокатором нескольких ионных каналов, ингибирующим калиевые токи (эффект антиаритмиков III класса), включая выходящий калиевый ток задержанного выпрямления, активируемый ацетилхолином (IK (Ach)), сверхбыстрый выходящий калиевый ток задержанного выпрямления (IKur), быстрый выходящий калиевый ток задержанного выпрямления (IКr) и медленный выходящий калиевый ток задержанного выпрямления (IKs). За счет этого происходит удлинение потенциала действия и рефрактерного периода клеток миокарда. Дронедарон также ингибирует натриевые токи (эффект антиаритмнков IB класса) и кальциевые токи (эффект антиаритмнков IV класса). Дронедарон является неконкурентным антагонистом адренергической активности (эффект антнаритмиков II класса).
У животных в зависимости от используемой экспериментальной модели дронедарон предотвращает развитие мерцательной аритмии или восстанавливает нормальный синусовый ритм. Также он предотвращает развитие желудочковой тахикардии или фибрилляции желудочков на некоторых экспериментальных моделях у животных. Дронедарон урежает сердечный ритм. Удлиняет продолжительность периода Венкебаха и интервалы АН, PQ, QT, при этом, не оказывая влияния или вызывая слабое удлинение интервалов QTc (QT, корректированного по формуле Bazett), HVи QRS. Он увеличивает эффективный рефрактерный период предсердий, атриовентрикулярного узла и желудочков с минимальной степенью обратной зависимости этого увеличения от частоты сердечных сокращений. Дронедарон снижает артериальное давление, сократимость миокарда (dP/dt макс) без изменения фракции выброса левого желудочка, а также потребление кислорода миокардом.
Дронедарон обладает сосудорасширяющим действием, связанным с активацией синтеза оксида азота и более выраженным в коронарных, чем в периферических артериях.
Дронедарон оказывает непрямое антиадренергическое действие, снижает опосредуемую через альфа-адренергические рецепторы реакцию артериального давления на эпинефрин (адреналин) и опосредуемую через бета 1 - и бета 2 -адренергические рецепторы реакции на нзопротеренол.
У здоровых добровольцев при приеме 400 мг дронедарона 2 раза/сут и в более высоких дозах наблюдалось умеренное увеличение продолжительности интервала PR и QTc. Даже при приеме дронедарона в дозе 1600 мг 2 раза/сут продолжительность интервала QTc не превышала 500 мс.
Уменьшение риска госпитализации и смерти по поводу сердечно-сосудистых заболеваний
При приеме в дозе 400 мг 2 раза в день дронедарон по сравнению с плацебо и независимо от сопутствующей терапии (ингибиторы ангиотензинпревращающего фермента или ангиотензина II рецепторов антагонисты, бета-адреноблокаторы, дигоксин, статины, блокаторы «медленных» кальциевых каналов (БМКК), диуретики) снижает на 24.2 % риск госпитализации по поводу сердечно-сосудистых заболеваний или смертности по любой причине у пациентов с мерцательной аритмией/трепетанием предсердий или с мерцательной аритмией/трепетанием предсердий в анамнезе, имеющих дополнительные факторы риска, включая возраст, артериальную гипертензию, сахарный диабет, предшествующее нарушение мозгового кровообращения, размер левого предсердия >50 мм или фракцию выброса левого желудочка менее 0.40. В частности дронедарон уменьшает риск сердечно-сосудистой смертности на 30%, внезапной смертности, обусловленной сердечно-сосудистыми причинами, на 59.5% и смертности от инсульта на 38.3%.
Поддержание синусового ритма
Дронедарон способствует поддержанию синусового ритма, снижая риск возникновения рецидива мерцательной аритмии/трепетания предсердий в течение 6 месяцев на 55% и в течение 12 месяцев на 25% по сравнению с плацебо.
Влияние на частоту сердечных сокращений
При постоянной форме мерцательной аритмии (длящейся более 6 месяцев) при применении дронедарона в дополнение к общепринятой терапии на 14 день лечения уменьшается ЧСС в покое (в среднем приблизительно на 9 уд./мин.) и во время максимальной физической нагрузки (в среднем на 25 уд./мин.). Этот эффект не зависит от стандартной терапии, направленной на контроль ЧСС.
У пациентов, получающих дронедарон с целью поддержания синусового ритма, в случае возникновения рецидива мерцательной аритмии, последний протекает с меньшей частотой желудочковых сокращений, чем таковой у не получающих дронедарон пациентов.
Фармакокинетика
При приеме внутрь одновременно с пищей дронедарон хорошо абсорбируется (не менее 70%). Однако в связи с пресистемным метаболизмом при «первом прохождении» через печень абсолютная биодоступность дронедарона (принятого с пищей) составляет 15%. Одновременный прием пищи увеличивает биодоступность дронедарона в 2-4 раза. После приема внутрь с пищей C max дронедарона и его основного активного метаболита (N-дебутил метаболита) достигается в течение 3-6 ч. При курсовом приеме по 400 мг 2 раза в день, равновесная плазменная концентрация достигается за 4-8 дней лечения и среднее значение коэффициента накопления дронедарона составляет 2.6-4.5. Среднее значение C max дронедарона в равновесном состоянии составляет 84-147 нг/мл, концентрация основного N-дебутилметаболита имеет такие же средние значения. При увеличении доз дронедарона значения C max и площадь под кривой «концентрация — время» (AUC) дронедарона и его N-дебутилметаболита также повышаются, причем их повышение незначительно опережает простую пропорциональность дозе: увеличение дозы в 2 раза приводит к увеличению соответствующих фармакокинетических показателей в 2.5-3 раза.
Связь белками плазмы крови дронедарона и его N-дебутилметаболита in vitro превышает 98% и является ненасыщаемой. Оба вещества связываются преимущественно с альбумином. После внутривенного введения объем распределения в равновесном состоянии (Vss) колеблется от 1200 до 1400 л.
Дронедарон интенсивно метаболизируется преимущественно с помощью изофермента CYP3A4 (см. раздел «Взаимодействия с другими лекарственными средствами»). Основной путь метаболизма состоит из N-дебутилироваиня с образованием основного активного метаболита, присутствующего в крови с его последующим окислением, окислительным дезаминированием с образованием неактивного метаболита пропионовой кислоты с ее дальнейшим окислением. Моноаминооксидазы частично вносят свой вклад в метаболизм активного метаболита дронедарона- Фармакодинамическая активность N-дебутилметаболита в 3-10 раз меньше, фармакодинамической активности дронедарона.
После приема внутрь примерно 6% меченого радиоактивным изотопом дронедарона выводится почками, преимущественно в виде метаболитов (неизмененный дронедарон в моче не определяется) и 84% выделяется через кишечник, также преимущественно в виде метаболитов. После внутривенного введения клиренс дронедарона из плазмы крови составляет 130-150 л/час. Конечный T 1/2 дронедарона - около 25-30 ч, а его N-дебутилметаболита - около 20-25 ч. У пациентов после окончания приема дронедарона по 400 мг 2 раза в день дронедарон и его метаболит полностью выводятся из плазмы крови в течение 2 недель.
Фармакокинетика у особых групп пациентов
Фармакокинетнка дронедарона у пациентов с мерцательной аритмией не отличается от таковой, у здоровых добровольцев. Основные источники вариабельности плазменных концентраций дронедарона (возраст, пол, масса тела, сопутствующий прием слабых и умеренных ингибиторов изофермента CYP3A4) влияют на его плазменные концентрации довольно слабо (изменяют менее чем в 2 раза).
Плазменные концентрации дронедарона у женщин в среднем на 30% выше, чем у мужчин.
У пациентов в возрасте 65 лет и старше, плазменные концентрации дронедарона на 23% выше, чем у пациентов моложе 65 лет.
Нарушение функции печени
У пациентов с умеренными нарушениями функции печени плазменные концентрации общего и несвязанного дронедарона возрастают в 1.3 и 2 раза, соответственно, а активного метаболита — уменьшаются в 1.6—1.9 раз (см. раздел «Способ применения и дозы»).
Влияние тяжелых нарушений функции печени на фармакокинетику дронедарона не изучалось (см. раздел «Противопоказания»).
Нарушение функции почек
У пациентов с нарушением функции почек, в том числе и с тяжелыми поражениями почек, изменений показателей фармакокинетикн не отмечалось, что связано с очень незначительным выведением дронедарона через почки (см. раздел «Способ применения и дозы»).
Противопоказания для антиаритмических лекарственных средств
Антиаритмические лекарственные средства обладают ограниченным действием и часто вызывают развитие побочных эффектов. Они с более очевидным успехом используются для купирования аритмий, чем для предотвращения их рецидива. Препараты могут оказывать проаритмическое действие, особенно при нарушенной функции ЛЖ.
Флекаинид эффективен в предотвращении ФП, однако противопоказан пациентам с нарушенной функцией ЛЖ или страдающим ИБС. Аденозин является препаратом выбора для купирования реципрокной тахикардии из АВ-соединения. Внутривенное введение верапамила при ФП или ТП позволяет быстро добиться контроля частоты сокращений желудочков.
В лечении суправентрикулярных и желудочковых аритмий эффективным может оказаться соталол, однако при его назначении требуется соблюдать осторожность, поскольку он вызывает увеличение продолжительности интервала QT. Токсическое действие дигоксина проявляется достаточно часто, и в большинстве случаев можно воспользоваться другими лекарственными средствами.
Наиболее эффективным из них является амиодарон, однако в связи с многочисленными побочными эффектами назначать его следует только пациентам с опасными аритмиями или рефрактерным к другим видам лечения.
Лекарственные препараты широко используются в лечении аритмий, однако следует учитывать ограничения к их применению. Эффективность антиаритмических средств ограничена. Другими словами, препарат, назначенный в правильной дозе и при наличии соответствующих показаний, может не подействовать. Постоянный терапевтический уровень многих средств бывает трудно поддерживать.
Достигнуты значительные успехи в понимании механизмов действия тех или иных средств антиаритмической терапии, однако индивидуальный подбор препарата, который оказался бы эффективным и хорошо переносимым, зачастую по-прежнему осуществляется методом проб и ошибок.
Нередко развиваются нежелательные эффекты, наиболее частыми из которых являются артериальная гипотензия, сердечная недостаточность, угнетение функции специализированной проводящей ткани сердца и симптомы, связанные с воздействием на желудочно-кишечный тракт и центральную нервную систему.
Проаритмическое действие
Многие антиаритмические средства, особенно относящиеся к классам IA и IС, иногда могут ухудшать течение существующей аритмии или вызывать появление новых форм нарушения ритма сердца, причем в отдельных случаях - с фатальными последствиями. Риск наиболее высок у пациентов с нарушенной функцией желудочков, тогда как у лиц со структурно нормальным сердцем риск низок.
Ограничения применения антиаритмических средств:
- Ограниченная эффективность
- Трудность подержания терапевтического уровня
- Подбор эффективного препарата часто осуществляется методом проб и ошибок
- Частое развитие нежелательных эффектов
- Проаритмическое действиеВыбор лечения аритмии сердца
Лекарственная терапия является лишь одним из видов лечения, и в некоторых ситуациях предпочтительнее использовать другие методы (например, катетерную аблацию, кардоверсию, ЭКС или хирургическое вмешательство).
На выбор метода лечения оказывают влияние несколько факторов: тип аритмии, ургентность ситуации, необходимость продолжения лечения в краткосрочной или отдаленной перспективе, наличие органического заболевания сердца, СССУ или нарушений АВ-проводимости.
Важно осознавать, для чего, собственно, назначается антиаритмический препарат: для купирования аритмии, для предотвращения ее рецидивов или для контроля частоты сокращений желудочков при продолжающейся аритмии. В ряде случаев лекарственные средства назначаются для устранения симптомов, тогда как в других ситуациях их целью является предотвращение опасных аритмий.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.Читайте также:
- Солитарная врожденная гипертрофия пигментного эпителия сетчатки: признаки, гистология, лечение, прогноз
- Планирование имплантации зубов. Рекомендации
- Способ криминального аборта. Криминальный аборт и сепсис
- Кинины. Лейкотриены. Простагландины. Белки острой фазы воспаления. Цитокины. Реакции воспаления. Патогенез воспаления.
- Патогенез волосатоклеточного лейкоза - механизмы развития