Дыхательную недостаточность в послеоперационном периоде. Профилактика дыхательной недостаточности
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Отделение кардиореанимации и интенсивной терапии ФГБУ РНЦХ им. акад. Б.В. Петровского РАМН, Москва
ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского», Москва, Россия
Проблема послеоперационной острой дыхательной недостаточности в кардиохирургии
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2019;(8): 5‑11
Цель исследования — оценка частоты развития, причин, структуры и исходов острой дыхательной недостаточности (ОДН) у больных после операций на сердце и аорте. Материал и методы. Ретроспективное исследование проведено среди 3972 пациентов после плановых кардиохирургических операций, выполненных в РНЦХ им. акад. Б.В. Петровского в 2013—2017 гг. Критерии включения: устойчивое снижение оксигенирующей функции легких (РаO/FiO
Несмотря на многолетний опыт выполнения кардиохирургических операций, совершенствование хирургической техники, методик искусственного кровообращения (ИК), анестезиологического пособия, внедрение протективных методов искусственной вентиляции легких (ИВЛ), частота развития послеоперационной острой дыхательной недостаточности (ОДН) у кардиологических больных остается довольно высокой и в зависимости от используемых критериев оценки находится в пределах 3,2—28,6% [1—6]. Среди дооперационных факторов риска ОДН выделяют возраст, длительный стаж курения, ожирение, хроническую обструктивную болезнь легких (ХОБЛ), особенно средней и тяжелой степени, бронхиальную астму и хроническую сердечную недостаточность с развитием легочной гипертензии [4, 5, 7]. По данным литературы [1, 8, 9], в структуре послеоперационной ОДН ведущее место занимают острый респираторный дистресс-синдром (ОРДС), обострение ХОБЛ и бронхиальной астмы, нарушение коллоидно-осмотического давления крови, ателектазы и вентилятор-ассоциированные пневмонии, однако в России крупные исследования по этой тематике единичны [1].
При реконструктивных операциях на аорте с использованием методики циркуляторного ареста, длительной однолегочной вентиляции большей, чем при других кардиохирургических операциях, кровопотере частота легочных осложнений и ОДН значительно выше, особенно при работе на нисходящем отделе аорты, и достигает 29—48% [3, 6, 10, 11]. Эти операции могут вызывать тяжелую системную воспалительную реакцию с последующим развитием ОРДС, что значительно увеличивает послеоперационную летальность — 29—53% и более [1, 8, 9, 12]. ОРДС может быть обусловлен непрямыми, внелегочными факторами и развиваться как «неспецифическая фазовая реакция вначале не пораженных легких на длительные расстройства периферической микроциркуляции с сопутствующей гипоперфузией тканей и возникновением тяжелой и длительной циркуляторной гипоксии» [13], а может быть вызван прямым повреждением легких [14], что при кардиологических операциях наблюдается в 55% случаев [10, 11]. У кардиохирургических больных в этиологии ОДН немалое значение имеют нарушение каркаса грудной клетки, болевой синдром, интраоперационная травма легких, пневмоторакс, повреждение диафрагмальных нервов с развитием пареза диафрагмы [15, 16]. В патогенезе послеоперационной ОДН важное значение имеют неврологические осложнения: острое нарушение мозгового кровообращения (ОНМК), сопор, кома, послеоперационный делирий, требующий проведения продленной седации, ИВЛ, которая применяется у большинства кардиохирургических больных с ОДН. Перечисленные факторы приводят к нарушению механики дыхания, развитию гиповентиляции, ателектазов, вентилятор-ассоциированной пневмонии, частота которой увеличивается пропорционально длительности ИВЛ, достигая 35% [17, 18].
Цель исследования — оценка частоты развития, причин, структуры и исходов ОДН у больных после операций на сердце и аорте.
Материал и методы
Исследование выполнено на основании ретроспективного анализа послеоперационного периода у 3972 больных в возрасте 40—79 лет (29 женщин и 109 мужчин) после плановых кардиохирургических операций, проведенных в РНЦХ им. акад. Б.В. Петровского в 2013—2017 гг. Основной критерий включения пациентов в исследование — стойкое снижение оксигенирующей функции легких (РаO2/FiO22 30—40 мм рт.ст.) с помощью аппаратов ServoVentilator-S и ServoVentilator-i (MAQUET, Германия), НAMILTON-G5 («Нamilton Medical», Швейцария). Для проведения НМВЛ использовали аппарат Respironics BiPAP Vision («Respironics», США). Фракция кислорода во вдыхаемой смеси (FiO2) в обычных условиях составляла 40—50%, что было достаточным для поддержания насыщения крови кислородом в пределах 96—100%. При развитии явлений ОДН применяли различные режимы ИВЛ, необходимые для обеспечения адекватного газообмена. При ИВЛ более 7 сут респираторную терапию проводили через пункционную трахеостомическую канюлю. Мониторинг витальных функций в послеоперационном периоде включал в себя регистрацию ЭКГ, контроль газового состава крови (СО2, рО2, Sat венозной и артериальной крови), биомеханику дыхания, при необходимости — исследование параметров внутрисердечной гемодинамики с использованием трансторакальной, чреспищеводной эхокардиографии или катетера Свана—Ганса («Arrow», CША). Статистическую обработку полученных данных проводили с использованием пакета Statistica 7.0 («Statsoft Inc.», США).
Результаты
Анализ течения послеоперационного периода показал, что у 138 (3,5%) из 3972 оперированных на сердце, аорте и магистральных сосудах больных диагностирована ОДН. Частота развития ОДН по годам в зависимости от вида операций представлена в табл. 1.

Таблица 1. Частота развития ОДН по видам оперативного вмешательства, количество операций/количество случаев Примечание. ОДН — острая дыхательная недостаточность, АКШ — аортокоронарное шунтирование, МКШ — маммарокоронарное шунтирование, ИК — искусственное кровообращение; * р=0,0001 по сравнению с другими видами оперативных вмешательств, **p=0,0469 по сравнению с АКШ+МКШ без ИК.
Установлено, что ОДН наиболее часто (в среднем 11,2%) встречалась у больных, перенесших реконструктивные операции по поводу аневризмы аорты различной локализации. Второе место (суммарно) занимают пациенты после операций аортокоронарного (АКШ) или маммарокоронарного шунтирования в условиях ИК или без его использования, ОДН достигает у них 5,1%, что в 2,2 раза ниже, чем при операциях на аорте (р=0,0001). Прослеживается также тенденция к меньшей частоте ОДН при операциях АКШ без ИК (р=0,0469). Причины послеоперационной ОДН представлены в табл. 2.
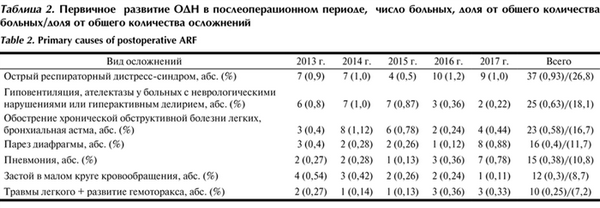
Таблица 2. Первичное развитие ОДН в послеоперационном периоде, число больных, доля от общего количества больных/доля от общего количества осложнений
Наиболее частой причиной ОДН у больных после операций на сердце и сосудах, по нашим данным, является ОРДС. Большинству этих пациентов (64,9%) выполнены реконструктивные операции на аорте, причем 11 (45,8%) из 24 оперированы на нисходящем ее отделе или в сочетании с протезированием других отделов аорты. На втором месте по частоте развития ОРДС (29,7% всех больных) находятся пациенты после АКШ, протезирования клапанов сердца или после комбинированных операций. Единичные случаи этого осложнения отмечены у больных после операций аортобедренного протезирования. ОДН не наблюдалась после выполнения эндоваскулярного стентирования различных отделов аорты.
У 67,6% больных наблюдали непрямые (внелегочные) формы ОРДС. Основной причиной непрямого повреждения легких являлось кровотечение, требовавшее проведения массивных гемотрансфузий, — 13 (35,1%) из 37 пациентов. Второе место занимает механическая травма левого легкого при его выделении или смещении во время операций на нисходящем отделе аорты с эндобронхиальным кровотечением и длительной однолегочной вентиляцией — 11 (29,7%) из 37 пациентов. Мы отнесли данные случаи к прямым (легочным) формам ОРДС. У одного пациента прямое повреждение легких возникло в ответ на аспирацию желудочного содержимого. У 8 (21,6%) из 37 больных ОРДС развился вследствие анафилактического шока или длительного (более 5 ч) ИК. В 13,5% случаев причинами ОРДС были реперфузионный синдром (n=2) и сепсис (n=3). У 89,2% пациентов ОРДС возникал в первые 48 ч после операции вследствие массивной кровопотери и гемотрансфузии, шока различной этиологии, длительного ИК и большого объема оперативного вмешательства. ОРДС в отсроченном периоде развился у 10,8% больных на фоне сепсиса и полиорганной недостаточности (ПОН).
У 27,7% из 37 больных диагностирована легкая степень ОРДС, у 59,5% — средняя, а у 12,8% — тяжелая. У 43,2% больных на фоне ОРДС развилась пневмония. Общая летальность при ОРДС составила 21,6% (8 больных), при тяжелой форме она достигла 75%.
У 25 (18,1%) из 138 пациентов ОДН развилась на фоне неврологических осложнений (ОНМК, отек головного мозга, послеоперационный делирий) и вторично возникших ателектазов, что привело к гипоксемии и необходимости проведения ИВЛ в течение более 24 ч или применения длительных сеансов НМВЛ.
Обострение ХОБЛ или бронхиальной астмы наблюдали в 0,58% общего числа операций (16,7% в структуре ОДН). Причем мы учитывали наличие в анамнезе только средних или тяжелых форм ХОБЛ. Частота развития пневмонии составила 8,7%, летальных исходов не было.
ОДН, связанная с развитием пареза диафрагмы, зафиксирована в 0,4% случаев (11,7% в структуре ОДН). У 9 больных наблюдали частичный двусторонний и у 7 — полный парез диафрагмы, что значительно увеличило сроки пребывания пациентов в отделении реанимации (максимально до 53 сут), одну больную не удалось отключить от ИВЛ (пациентка переведена в стационар по месту жительства). У 50% больных с парезом диафрагмы в поздние сроки развилась пневмония. Летальных исходов не было.
В 10,8% случаев в структуре ОДН первичной причиной тяжелых расстройств газообмена послужила пневмония, потребовавшая продленной ИВЛ, 3 (20%) из этих больных умерли в поздние сроки после операций на фоне медиастинита и сепсиса.
Относительно редкой причиной ОДН явились нарушения газообмена, обусловленные застоем в малом круге кровообращения в связи с выраженной левожелудочковой сердечной недостаточностью или гиперволемией. В структуре ОДН частота данного осложнения составила 8,7%. Один больной скончался на 66-е сутки на фоне медиастинита. Пневмония развилась у 4 (33,3%) из 12 больных.
У 10 (7,2%) из 138 больных ОДН была следствием травмы легкого с развитием гемоторакса, но без признаков ОРДС. Частота пневмонии у этой категории больных составила 10%, один пациент умер от прогрессирующей ПОН.
Внутрибольничная пневмония наблюдалась у 56 (1,4%) из 3972 больных. У 15 она была первичной причиной тяжелых расстройств газообмена, у 41 (29,7%) из 138 развилась как осложнение других причин ОДН и вследствие длительной ИВЛ. Общий показатель летальности у кардиохирургических больных с послеоперационной ОДН составил 9,4%.
Выявлено, что частота ОДН у больных после операций на сердце, аорте и магистральных сосудах составляет 3,5% и в последние годы не имеет отчетливой тенденции к уменьшению. В структуре причин ОДН, требующей продленной ИВЛ, основные позиции занимают ОРДС, неврологические осложнения с последующим развитием ателектазов, обострение ХОБЛ и бронхиальной астмы (суммарно 87 больных, 61,6%).
Хотя частота развития ОРДС среди всех больных составила всего 0,93%, этот синдром занимал ведущее положение в структуре ОДН (26,8%), а летальность имела довольно высокий уровень (21,6%) и практически не снижалась в последние годы. Показано, что несмотря на значительное (с 1,7 до 0,61—0,12%) снижение частоты развития в ОРДС, у кардиохирургических больных к концу анализируемого срока (1980—2012 гг.), летальность при его тяжелых формах остается высокой [9]. Данные многих исследований [1, 9, 12, 18] свидетельствуют, что несмотря на существенный прогресс в развитии методов респираторной поддержки и терапии, летальность при ОРДС зависит от его тяжести и достигает 50—55%.
Мы выявили, что 61,5% летальных исходов у больных с ОДН связано с ОРДС. Суммарная летальность при легкой и средней степени тяжести ОРДС составила 15,2%, при этом 75% больных умерли при тяжелом его течении.
Известно, что вероятность запуска системной воспалительной реакции и развития ОРДС находится в прямой зависимости от объема и травматичности оперативных вмешательств и связанного с этим более высокого риска возникновения осложнений. Эта закономерность прослеживается и в нашем исследовании. Так, среди всех пациентов с ОРДС 62,2% составили больные после реконструктивных операций на аорте, причем в 47,8% случаев операции выполняли на нисходящем отделе аорты или в комбинации с протезированием других ее отделов. В то время как у 19 (79,2%) из 24 больных данной категории причиной ОРДС явились кровопотеря с массивными гемотрансфузиями, травма левого легкого с внутрибронхиальным кровотечением, длительная однолегочная вентиляция. Роль большой кровопотери и гемотрансфузии в развитии ОРДС широко обсуждается в литературе. Так, в работах [8, 9] указано, что переливание 3—5 доз эритроцитной взвеси является фактором повреждения легких и повышает риск развития ОРДС. Установлено [20], что летальность при ОРДС напрямую зависит от количества доз перелитой эритроцитной взвеси в первые 48 ч после операции — рост с 21% при трансфузии до 3 доз, до 63% при переливании более 10 доз. Таким образом, снизить частоту развития ОРДС и улучшить результаты его лечения можно, в первую очередь используя методы, направленные на снижение объема кровопотери и гемотрансфузии, предотвращение интраоперационного повреждения легочной ткани, сокращение длительности операций, совершенствование методов органопротекции. Это верно и в отношении больных с травмой легкого без последующего развития ОРДС (одностороннее повреждение в сочетании с внелегочной причиной). В нашем исследовании летальность при ОРДС достигала при различных видах операций 28,6%, что соответствует среднему уровню этого показателя, полученному в других работах. Такие причины ОРДС, как анафилактический шок, длительный ИК, реперфузионный синдром и пр., по нашим данным, встречаются значительно реже.
Мы выявили, что второе место в структуре первичных причин послеоперационной ОДН занимают неврологические осложнения: ОНМК, постгипоксический отек головного мозга, делирий и связанное с ним центральное угнетение дыхания вследствие использования больших доз седативных препаратов и нейролептиков. Это приводило к необходимости применения длительной ИВЛ или НМВЛ. У таких пациентов длительность первичной ИВЛ составила в среднем 47 ч, а повторная интубация трахеи потребовалась в 68% случаев. Снижению частоты возникновения ОДН, развитию ИВЛ-ассоциированной пневмонии у больных с неврологическим дефицитом и сокращению времени пребывания в ОРИТ способствует уменьшение продолжительности и глубины седации пациентов, применение препаратов, не угнетающих дыхательный центр, в частности дексмедетомедина, который снижает частоту развития делирия и позволяет сохранить вербальный контакт с пациентом [21, 22].
Несмотря на то что обострение ХОБЛ или бронхиальной астмы в структуре ОДН наблюдалось в нашей работе у 16,7% больных, течение этого осложнения было благоприятным. Применение в послеоперационном периоде патогенетической ингаляционной терапии позволило в большинстве случаев предотвратить развитие пневмонии, частота ее составила всего 8,7%, все пациенты выжили.
В источниках литературы парез диафрагмы описывают как более часто встречающееся осложнение при кардиохиругических вмешательствах в связи с прямым механическим (при выделении внутренней грудной артерии) или термическим (обкладывание сердца льдом) повреждением диафрагмального нерва. В большинстве случаев парез диафрагмы является односторонним, а диагностика основывается на данных УЗИ, сочетающем простоту использования, невысокую стоимость и возможность ежедневного прикроватного контроля [23].
ОДН, связанная с парезом диафрагмы, хотя и редко встречалась в нашем исследовании, приводила к значительному увеличению длительности ИВЛ, осложнениям (пневмония развивается у 50% больных), увеличению сроков нахождения в отделении реанимации (максимально до 53 сут) и, как следствие, к удорожанию лечения.
Застойные явления в легких в нашем исследовании были относительно редкой причиной в структуре ОДН (8,7%) и встречались при левожелудочковой сердечной недостаточности или гипергидратации. В литературе эта причина ОДН описывается как часто встречаемая у больных после кардиохирургических вмешательств, что связывают с повышением давления в левом предсердии вследствие поражения клапанов или избыточного объема инфузионной терапии во время и после операции [7, 24]. В исследовании [1] частота данного осложнения составила 1,1% от общего количества операций и 25,2% от случаев послеоперационной ОДН. В 98% случаев это были пациенты после операций АКШ или клапанной коррекции. В нашей работе данное осложнение наблюдалось в 3 раза реже, что можно объяснить различием в протоколах кардиоплегии, кардиотонической и инфузионной терапии.
Таким образом, частота развития ОДН у кардиохирургических больных, требующей проведения длительной (более 24 ч) ИВЛ или неинвазивной респираторной поддержки, составляет в среднем 3,5%. Наиболее часто (в 11,2%) ОДН возникает при операциях на аорте, при остальных оперативных вмешательствах ее частота варьирует от 1 до 3,5%, а при эндоваскулярном стентировании аорты ОДН не наблюдают. Ведущими причинами ОДН являются ОРДС (26,8%), неврологические осложнения с последующим развитием гиповентиляции, ателектазов (18,1%), обострение ХОБЛ и бронхиальной астмы (16,1%), парез диафрагмы (11,7%). ОРДС осложняет течение послеоперационного периода у 0,93% кардиохирургических больных. При ОРДС легкой и средней степени летальные исходы наблюдают у 15,1%, при тяжелой — у 75% больных. Внутрибольничная пневмония развивается у 1,4% больных, в структуре ОДН этот показатель достигает 40,6%, летальных исходов от пневмонии не наблюдали. Общая летальность при послеоперационной ОДН у кардиохирургических больных составляет 9,4%.
Участие авторов:
Концепция и дизайн исследования — Еременко А.А., Зюляева Т.П..
Сбор, обработка материала, статистика — Зюляева Т.П..
Написание статьи — Зюляева Т.П..
Редактирование статьи, написание резюме на английском языке — Еременко А.А..
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Дыхательную недостаточность в послеоперационном периоде. Профилактика дыхательной недостаточности
Клиника дыхательной недостаточности характеризуется четко очерченными симптомами: одышкой, акроцнанозом кожи и слизистых оболочек, снижением парциального напряжения кислорода в артериальной крови, увеличением парциального напряжения углекислоты. Снижение сердечного выброса, увеличение артсриовспозпой разности по кислороду, повышение содержания лактата крови свидетельствуют о присоединившейся вторичной сердечной недостаточности. При этом, как правило, имеет место компенсаторное учащение сердцебиения — тахикардия.
В условиях гипоксии ее применение является рискованным. Эндотрахеальпая интубация и искусственная вентиляция легких после хирургических вмешательств широко используются главным образом в первые дни послеоперационного периода.
Пожилым больным, подвергнутым большим хирургическим вмешательствам, и больным, имеющим низкие резервы дыхания в связи с хроническими заболеваниями легких, у которых по окончании операции имеют место недостаточность кровообращения или дыхания, показано продолжение управляемой искусственной вентиляции легких в первые часы, сутки, а в случае необходимости и в последующие дни после операции.
Если дыхательная недостаточность развивается в послеоперационном периоде, при решении вопроса об эндотрахеалыюй интубации и управляемой ИВЛ учитывается сумма показателей: тяжесть состояния и выраженность дыхательной недостаточности, причина, вызвавшая дыхательную недостаточность, реальные возможности преодоления ее другими методами, наличие сопутствующей недостаточности кровообращения, состояние газового состава крови. Показанием к ИВЛ является падение парциального давления кислорода в артериальной крови до 8 кПа и ниже или повышение давления углекислоты более 6—7,3 кПа. В ближайшем послеоперационном периоде редко отмечается гиперкапния; чаше имеет место снижение уровня артериального рО2.
В зависимости от места вскрытия трахеи различают верхнюю, среднюю, нижнюю трахсостомию. У детей чаще производится нижняя трахеостомия в связи с более сложным обнажением верхних трахсальных хрящей и наличием достаточно большого расстояния между перешейком щитовидной железы и яремной вырезкой грудины. У взрослых может быть сделана либо верхняя, либо нижняя трахсостомия. При наложении трахеостомы больной лежит на спине с запрокинутой головой и валиком под лопатками. Кожу вскрывают поперечно, реже продольно, соответственно уровню второго — третьего трахсального хряща.
Строго по средней линии вскрывают поверхностную фасцию, сосуды перевязывают или коагулируют. Перешеек щитовидной железы оттягивают тупым крючком в краниальном или в дистальном направлении с таким расчетом, чтобы обнажились второй и третий или третий и четвертый трахеальные хрящи. Стенку трахеи захватывают двумя острыми крючками и рассекают между ними скальпелем в вертикальном направлении. Края разреза трахеи растягивают. Ннтубационную трубку извлекают. Отсасывают мокроту из просвета трахеи и бронхов. Через отверстие в трахее вводят трахсостомнчсскую канюлю и фиксируют ее тесьмой на шее.
В комплексе мер по ликвидации дыхательной недостаточности, если нет опасности развития пневмоторакса, возможно использование гипербарической оксигенации. У больных с легочной недостаточностью, по-видимому, перспективным является метод вспомогательного дыхания с помощью экстракорпорального кровообращения и искусственного легкого. Возможность заместить функцию легких с помощью мембранного оксигенатора создает перспективы для лечения массивных пневмоний, отека легких и других острых состояний, сопровождающихся развитием легочной недостаточности.
Важной проблемой послеоперационного периода является коррекция изменений водно-электролитного баланса. Общеизвестно, что сама по себе операционная травма ведет к задержке жидкости и натрия в организме и усиленному выведению калия. Кроме того, развитию послеоперационной гипокалнемии (главным образом у больных желудочно-кишечными заболеваниями и заболеваниями сердца) способствует предоперационная потеря электролитов вследствие применения сердечных гликозидов н диуретиков. Нарушение электролитного обмена является одной из причин появления расстройств сердечного ритма, повышенной чувствительности к сердечным гликозидам (с развитием дигиталисной интоксикации), пареза желудка и кишечника, дыхательной, сердечной и вторичной почечной недостаточности, послеоперационного метаболического алкалоза.
Наиболее часто аритмии возникают как проявление сердечной недостаточности, гипоксии. Экстрасистолия, бради- и тахнаритмия — наиболее частые нарушения ритма сердца, нередко предшествующие развитию фибрилляции желудочков. Следует отметить, что расстройства ритма чаще всего возникают в течение первых 5 дней после операции, главным образом после хирургических вмешательств на сердце. Коррекция электролитного обмена, введение антиаритмических препаратов способствуют ликвидации нарушений ритма сердца. При пароксизмальной тахикардии, пароксизмальной фор. ме мерцания и трепетания предсердий шнрокое распространение нашла электрическая дефибрилляция сердца.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Респираторная поддержка в послеоперационном периоде - принципы
Профилактике и лечению дыхательной недостаточности в послеоперационном периоде при ранениях шеи, груди и живота во все времена уделялось большое внимание. А. К. Цельс при возникновении дыхательной недостаточности рекомендовал «. растолочь хорошо высушенную печень лисы и получившийся порошок прибавлять к питью или есть самое свежее легкое того же животного, поджаренное, но приготовленное в печке не в посуде из железа».
В наше время, как и на всех предыдущих этапах оказания хирургической помощи, первостепенной задачей является надежное обеспечение проходимости дыхательных путей. В первые несколько суток после операции на фоне медикаментозного угнетения дыхательного центра, снижения кашлевого рефлекса, усиленной секреции слизистой оболочки трахеи и бронхов легко возникает обструкция дыхательных путей.
Поэтому в первые часы после восстановления сознания и мышечного тонуса необходимо принимать меры к стимуляции кашлевого рефлекса и двигательной активности. Эти задачи можно решить только при условии полноценного обезболивания.
В целях профилактики дыхательной недостаточности используют перкуссионно-вибрационный массаж, ингаляцию аэрозолей, содержащих муколитики, бронхолитики, глюкокортикоиды. При неэффективности перечисленных средств прибегают к чрескожной катетеризации трахеи. Для этого используют методику Сельдингера с пункцией толстой иглой перстневиднощитовидной мембраны строго по средней линии. Иглу наклоняют вниз, в направлении к бифуркации трахеи, вводят по ней тонкий катетер на глубину 4-5 см. После этого иглу извлекают, а катетер фиксируют одним швом к коже.
Многократная санация трахеобронхиального дерева эндоскопическим методом или простой аспирацией по трахеальному катетеру позволяет сохранять проходимость бронхов и предупреждать серьезные осложнения со стороны легких.
Сразу после операции и в течение первых суток послеоперационного периода, пока пациент не экстубирован, санация выполняется через эндотрахеальную трубку, а при выполненной во время операции трахеостомии (ранения гортани, трахеи) — через трахеостомическую трубку.
При сохраняющейся гиповолемии в первые часы после операции пострадавший может находиться в горизонтальном положении или даже с приподнятым ножным концом кровати, однако при стабильной гемодинамике ему следует придать положение Фовлера и следить за тем, чтобы пациент не сползал вниз, ухудшая условия вентиляции легких.

Дыхательная недостаточность, не позволяющая отключить пострадавшего от ИВЛ и убрать интубационную трубку в течение 4-5 сут, является показанием к наложению послеоперационной трахеостомы, что позволяет, с одной стороны, избежать осложнений, связанных с длительной интубацией трахеи, и облегчить процедуру санации трахеобронхиального дерева, но, с другой стороны, увеличивает возможность гнойных осложнений, особенно у пострадавших, оперированных на первой или второй зоне шеи.
С первых суток после операции нельзя допускать гиповентиляции, чреватой развитием ателектазов, а следовательно, пневмонии («пульмонита» по выражению С. С. Юдина). В таких случаях при отсутствии противопоказаний ИВЛ проводится в режиме повышенного давления в конце выдоха (ПДКВ), а при естественном дыхании пациенту обеспечивают дыхательную гимнастику, в том числе — раздуванием эластичных баллонов. Следует еще раз подчеркнуть, что полноценное глубокое самостоятельное дыхание является наиболее эффективным методом профилактики легочных осложнений, и оно возможно только в условиях полноценного обезболивания.
Следующий аспект профилактики и коррекции дыхательной недостаточности в раннем послеоперационном периоде заключается в ингаляции смеси воздуха с кислородом. Через катетеры, введенные в нижние носовые ходы, увлажненный во флаконе с водой кислород подается обычно со скоростью 5-7 л/мин.
Большой и, к сожалению, часто встречающейся на практике опасностью в послеоперационном периоде у пострадавших с ранениями шеи и груди является гипергидратация. В первую очередь это отражается на легких, вызывая интерстициальный отек, облегчающий развитие острого респираторного дистресс-синдрома (ОРДС). В плане комплексной оценки функции дыхания весьма важен контроль за динамикой напряжения кислорода и углекислого газа в артериальной крови.
Выраженные нарушения функции дыхания, обусловленные как тяжестью сочетанных ранений, так и степенью кровопотери, заставляют в течение нескольких суток после хирургического лечения под общим обезболиванием продолжать ИВЛ.
Однако при сочетанных ранениях груди и массивной кровопотере объем травмы и большой объем инфузионной терапии на 3-4-е сутки после ранения может привести к развитию ОРДС. Клинические проявления ОРДС характеризуются резким ухудшением состояния с одышкой, цианозом. В легких прослушиваются влажные рассеянные храпы на фоне жесткого дыхания. На рентгенограммах появляется двусторонняя диффузная инфильтрация легких. Несмотря на ингаляцию кислорода, введение глюкокортикоидов и диуретиков, гипоксия и отек легких нарастают. В таких случаях реаниматологам приходится переходить на продленную ИВЛ в режиме гипервентиляции с минутным объемом от 10 до 14 л, с положительным давлением в конце выхода от 5 до 15 см водн. ст.
В заключение необходимо подчеркнуть, что быстрая и эффективная коррекция дыхательных и сердечно-сосудистых нарушений в ближайшем послеоперационном периоде является в то же время и эффективным средством профилактики гнойно-септических (особенно легочно-плевральных) осложнений.
Считается, что при стабилизации состояния пострадавшего параметры гомеостаза должны быть следующие: АДмакс > 120 мм рт. ст.; ЧСС < 100 в минуту; ЦВД >10 см водн. ст.; РаО2 > 70 мм рт. ст.; SaО2> 90%; VО2> 140 мл/мин/м2; Hb > 100 г/л; тромбоциты > 100 тыс/мл; мочеотделение > 25 мл/ч.
В то же время с учетом побочных эффектов и отрицательных последствий ИВЛ следует при первой же возможности переводить этих пострадавших на вспомогательное, а затем и на самостоятельное дыхание через интубационную трубку.
Критерием окончательного перехода к самостоятельному дыханию и экстубации служит стабильность газового состава крови (напряжение кислорода не ниже 70 мм рт. ст., напряжение углекислого газа — не выше 45 мм рт. ст.) в течение 30 мин после отключения вспомогательного дыхания.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Дыхательная недостаточность после операции на легком. Легочная вентиляция в послеоперационном периоде
Нами в течение длительного времени изучались особенности лечения острой дыхательной недостаточности в раннем послеоперационном периоде с использованием респираторов.
Основными причинами острой дыхательной недостаточности в хирургии легких, когда возникла необходимость или для реанимации, или при крайней степени артериальной гипоксемии и гиперкапнии применить искусственную вентиляцию легких были двусторонние пневмонии, пневмонии в единственно оставшемся легком после пневмонэктомии, отек легких, отек мозга, стойкий ателектаз на фоне значительной дооперационной редукции функции аппарата внешнего дыхания и др.
При острой дыхательной недостаточности редко наблюдаются изолированные синдромы, чаще возникают комбинированные нарушения дыхания. Лечение комбинированных форм дыхательной недостаточности (например, послеоперационная пневмония яа фоне эмфиземы и правожелудочковой недостаточности и др.) представляет большие трудности и является сложным делом.
Острая дыхательная недостаточность в результате пневмонии, занимающей большую часть оставшейся перенхимы легкого, как правило, не может быть ликвидирована только оксигенотерапией и трахеостомией. В этих случаях возникает не только кислородное голодание, но и присходит накопление углекислоты с нарастанием респираторного ацидоза. Патогенетическим методом лечения такой дыхательной недостаточности может быть искусственное усиление вентиляции легких.
В наших наблюдениях острая дыхательная недостаточность возникала при массивных послеоперационных пневмониях, обусловленных характером вмешательства и тяжестью состояния больного до операции (двусторонние пневмонии были у 7 больных и пневмонии в единственном, оставшемся после пневмонэктомии, легком — у 17).
Опыт клинических наблюдений показал необходимость специальной тактики при двусторонних послеоперационных пневмониях и пневмониях в единственном оставшемся после пневмонэктомии легком. У этой категории больных обычно эффективным методом лечения являлась трахеостомия и искусственная вентиляция легких.
Двусторонние послеоперационные пневмонии и пневмонии в единственном оставшемся после пневмонэктомии легком (также пневмонии на фоне выраженной эмфиземы и пневмосклероза) следует рассматривать не только как воспалительный процесс с его общими закономерностями, но и как гипертонический криз в малом кругу кровообращении, обусловленный легочной гипоксемией.
О тяжести, возникшей в этих случаях острой дыхательной недостаточности, говорит то, что 19 больным были произведены трахеостомии с целью реанимации, или при крайней степени артериальной гипоксемии и гиперкапнии, причем у 9 из них для проведения длительной искусственной вентиляции легких. Последняя оказалась эффективной у 8 больных, однако позже 4 больных погибли от присоединившихся осложнений (свищи, эрозивные кровотечения).
В 3 наблюдениях легочно-сердечная декомпенсация была настолько выражена, что искусственную вентиляцию необходимо было проводить более 20 суток (у одного больного — 27 суток, впоследствии выписанного из отделения с клиническим эффектом).
Применяя искусственную вентиляцию легких, следует учитывать, что в связи с механическим воздействием (вдувание газовой смеси) воспалительный процесс в легких пролангируется и пневмония при этом приобретает затяжное течение. Однако только применение искусственной вентиляции являлось эффективным методом реанимации, несмотря на то, что воспалительный процесс в легких на какой-то период времени обострялся. Искусственная вентиляция, таким образом, обязывает к проведению систематической трахеобронхиальной санации.
Пресс-центр
Дыхательная недостаточность в послеоперационном периоде
Операции в условиях эндотрахеальной анестезии часто сопровождаются нарушениями функции легких. Выраженность этих нарушений может быть ми-нимальной, без явных клинических проявлений или значительной, с осложнен-ным течением послеоперационного периода. Наиболее частым осложнением являются ателектаз и дистелектаз легких, которые могут привести к развитию послеоперационной пневмонии. Ателектаз - образование участка безвоздушной легочной ткани вследствие нарушения про-цессов, поддерживающих воздушность и объем респиронов в этой зоне. Сохра-нение частичной пневматизации патологически измененной зоны легких при по-явлении признаков нарушения оксигенации крови и усиления венозного приме-шивания в легких носит название дистелектаза, рентгенологически описывает-ся как симптом гиповентиляции. Наиболее тяжелым осложнением является острое легочное повреждение (ОЛП) и респираторный дистресс-синдром (РДС).
Операции с лапаротомией – операции на брюшном отделе аорты, операции с торако- и стернотомией – кардиохирургические операции с искусственным кровообращением и без искусственного кровообращения – неизбежно нарушают функцию легких в течение 4-6 дней после операции. После операции уменьшает-ся функциональная жизненная емкость и форсированная жизненная емкость лег-ких, что приводит к ателектазированию и накоплению бронхиального секрета.Функциональная остаточная емкость легких снижается в положении на спине и продолжает уменьшаться сразу после вводного наркоза. У больных с сопутствующими заболеваниями легких частота и тяжесть послеоперационных нарушений увеличивается. Пожилой возраст, ожирение, курение увеличивают этот риск. Вероятность послеоперационных легочных осложнений возрастает после операций продолжительностью свыше 4 часов.
Нарушения функции легких, сопровождающиеся дыхательной недостаточностью осложняют течение послеоперационного периода, что может приводить к удлинению времени пребывания больного в отделении реанимации, требует увеличения затрат на лечение дыхательной недостаточности, возникших инфекционных осложнений – пневмонии, обострения хронических неспецифических заболеваний лёгких (ХНЗЛ). Поэтому очень важно на всех этапах периоперационного периода проводить необходимые профилактические и лечебные мероприятия.
В предоперационном периоде важно выявить у больного сопутствующие легочные заболевания, оценить тяжесть функциональных расстройств, установить факторы риска и характер возможного влияния анестезии и операции на функции легких. Помимо клинического обследования необходимо проведение инструментальных исследований: рентгенография органов грудной клетки позволяет под-твердить наличие легочной патологии или обнаружить заболевание, не выявленное при клиническом обследовании. Это может быть ателектаз легкого, пневмосклероз, булла, пневмоторакс, гидроторакс, опухоль или сердечная недостаточность. Любое из этих состояний увеличивает риск анестезии и операции.
Исследование функции внешнего дыхания (далее ФВД) имеет решающее значение для определения степени тяжести заболевания, определения характера легочных расстройств.
Все больные перед плановыми операциями на брюшной аорте, кардиохирургическими операциями консультируются врачом физиотерапевтом, осваивают упражнения послеоперационной дыхательной гимнастики, лечебной физкультуры, при необходимости проходят физиотерапевтическое лечение. У пациентов с хроническим бронхитом с явлениями обострения инфекции в предоперационном периоде проводится антибиотикотерапия, для улучшения элиминации мокроты используется физиотерапия на фоне отказа от курения как минимум 2-3 недель перед плановой операцией.
После вводного наркоза, интубации, начала искусственной вентиляции легких (далее ИВЛ) оценивается состояние легких больного клинически, по показателям биомеханики дыхания на мониторе наркозно-дыхательного аппарата (Fabius фирмы Drager): давление в дыхательных путях (Р aw), пиковое давление (Реак), среднее давление (Р mean), РЕЕР, дыхательный объем (Vt), выдыхаемый минутный объем (MV),проводится постоянный мониторинг пульсоксиметрии (SPO 2), капнометрия (рСО2 в выдыхаемом воздухе), проводится анализ газов артериальной и венозной крови, кислотно-щелочного состояния (КЩС) с определением респираторного индекса (РаО2/FiO2). В ходе операции проводится контроль количества и качества секрета в трахеобронхиальных путях и при необходимости санация верхних дыхательных путей, мероприятия по профилактике ателектазирования легких – включение РЕЕР, периодическое раздувание легких повышенным дыхательным объемом.
В послеоперационном периоде проводится искусственная вентиляция лег-ких аппаратами Savina фирмы Drager, Raphael фирмы Hamilton Medical AG. При этом учитываются выявленные во время операции нарушения функции легких, проводится клиническая, инструментальная, лабораторная оценка состояния дыхательной системы. После операций на грудной полости – всегда, при остальных операциях – при необходимости, проводится рентгенография грудной клетки; продолжается мониторинг SpO2, рСО2. При ИВЛ учитываются показатели биомеханики дыхания: пиковое давление, давление инспираторного плато, среднее давление; оценивается сопротивление инспираторному потоку – R (resistance) смН2О/л/с и растяжимость С (compliance) мл/см.вод.ст., проводится анализ газов крови с определением респираторного индекса.
Всем больным после полостных, длительных операций в условиях эндо-трахеальной анестезии проводится респираторная терапия: дыхательная гимнастика, методика дыхания с положительным давлением в конце выдоха (выдох через трубочку во флакон с водой, надувание мяча), массаж грудной клетки.
При выявлении признаков дыхательной недостаточности исключаются возможные причины ее развития – пневмоторакс, эндобронхиальная интубация, наличие нерасправленных во время торакотомических операций участков лег-ких. При отсутствии указанных состояний предполагается наличие у больного синдрома ОПЛ – при снижении респираторного индекса (РаО2/FiO2) менее 300 мм.рт.ст., а при его снижении менее 200 мм.рт.ст. – острый респираторный дистресс-синдром (ОРДС).
Читайте также:
