Гастроинтестинальные стромальные опухоли (GIST, Gastrointestinal Stromal Tumors)
Добавил пользователь Alex Обновлено: 29.01.2026
Гастроинтестинальные стромальные опухоли (GIST, Gastrointestinal Stromal Tumors) - причины, признаки, лечение
Гастроинтестинальные стромальные опухоли (GIST - Gastrointestinal Stromal Tumors) - наиболее распространенные мезенхимальные опухоли ЖКТ, которые происходят из клеток кишечных пейсмейкеров, т.н. интестинальных клеток Кахаля.
Отличием от других мезенхимальных опухолей ЖКТ (например, лейомиомы, шванномы и т.д.) является наличие специфических маркеров GIST с экспрессией, равной наблюдаемой в интерстициальных клетках Кахаля, и выявляемых при иммуногистохимическом анализе:
• CD117 (KIT): генный продукт c-kit протоонкогена рецептора фактора роста стволовой клетки.
• CD34: антиген гемопоэтических клеток-предшественников.
• PDGF альфа-рецептор (PDGFRA): альтернативный с c-kit механизм онкогенеза.
Злокачественный потенциал GIST сложен для оценки:
• Благоприятные факторы прогноза: локализация в желудке, диаметр < 5 см, митотический индекс < 5 митозов на 10 полей зрения при большом увеличении, отсутствие некрозов, низкий уровень ядерного антигена пролиферирующих клеток, аналог индекса Ki-67 < 10%, ограниченная опухоль, отсутствие метастазов в других органах.
• Неблагоприятные факторы прогноза: локализация в пищеводе, ободочной/прямой кишке, диаметр > 10 см, митотический индекс > 10 митозов на 10 полей зрения при большом увеличении, инвазия в соседние органы, признаки отсевов по брюшине или отдаленные метастазы.
Гастроинтестинальные стромальные опухоли (GIST) высокорезистентны к обычной химиотерапии. Лечение в основном хирургическое: резекция локализованной GIST, если опухоль резектабельна.
При рецидивных или местнораспространенных опухолях, а также при метастазах в последнее время как с паллиативной целью, так и с целью адъювантной и неоадъювантной терапии все чаще применяют иматиниб (Gleevec). Ответ опухоли на иматиниб (Gleevec) - ингибитор активности КГГ-киназы - коррелирует с экспрессией CD117.
а) Эпидемиология:
• Составляют 0,1-3% от всех опухолей ЖКТ. Ожидаемая ежегодная заболеваемость: 10-15 новых случаев на 1 миллион населения, т.е. в США регистрируется 3000-5000 новых случаев каждый год. Средний возраст: 50-60 лет, с одинаковой частотой для обоих полов.
• Локализация GIST: желудок - 50-60%, тонкая кишка - 25-30%, ободочная/прямая кишка и ректовагинальная перегородка - 2-10%, пищевод - 9% случаев. Другие локализации: забрюшинное пространство, поджелудочная железа и т.д. На момент постановки диагноза приблизительно 50% GIST имеют мультифокальный рост или метастазы.
б) Симптомы. Неспецифические симптомы: боль, обструкция, кровотечение или видимая/пальпируемая опухоль. Случайные находки при обследовании с помощью методов лучевой визуализации, эндоскопии.
в) Дифференциальный диагноз:
• Другие доброкачественные мезенхимальные опухоли: лейомиома, липома, нейрофиброма (шваннома).
• Другие злокачественные мезенхимальные опухоли: лейомиосаркома, нейрофибросаркома и т.д.
• Эпителиальные опухоли.
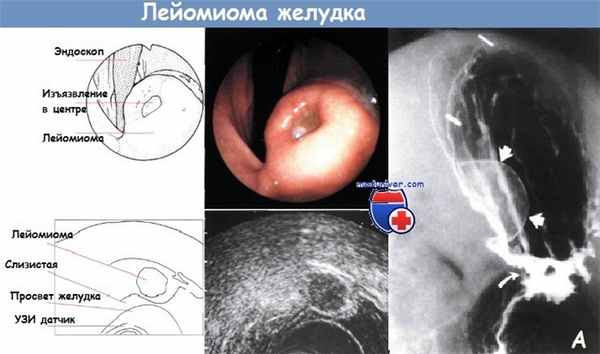
А - Рентгенологическое исследование желудка с двойным контрастированием.
Обнаружена лейомиома — гладкое образование в подслизистом слое (прямые стрелки) в области дна желудка.
Можно заметить гастроеюноанастомоз (изогнутая стрелка) у этого пациента после резекции желудка по Бильрот II.
г) Патоморфология гастроинтерстициальных стромальных опухолей
Макроскопическое исследование:
• Солидная или с кистозными участками опухоль различного размера: 1-20 см.
• Геморрагии.
• Очаговый некроз.
• Пути диссеминации: вовлечение лимфатических узлов относительно редко (менее 25% случаев); метастазирование в печень, по брюшине, реже - в легкие и кости.
Микроскопическое исследование:
• Веретеновидноклеточные, эпителиоидные или плеоморфные (смешанные) опухоли => ультраструктурные и иммуногистохимические отличия от лейомиомы, лейомиосаркомы или шванномы.
Иммуногистохимическое исследование:
• CD117 (KIT): 75-80% (цитоплазма).
• CD34 (антиген гемопоэтических клеток-предшественников): 60-70%.
• PDGFRA: 5-10%.
Обычные прогностические параметры:
1) размер опухоли;
2) митотический индекс (митозы/число полей зрения при большом увеличении). Выраженность KIT коррелирует с ответом на иматиниб.
д) Обследование при гастроинтерстициальной стромальной опухоли
Необходимый минимальный стандарт:
• Полное обследование толстой кишки (предпочтительно колоноскопия) в обязательном порядке при плановых операциях для выявления мультифокальных опухолей, синхронных раковых опухолей или полипов, а также сопутствующих заболеваний толстой кишки.
• Методы лучевой визуализации: КТ, ПЭТ, МРТ для оценки местной распространенности и выявления отдаленных метастазов.
Дополнительные исследования (необязательные):
• Такие же, как при КРР.
• ЭГДС.
е) Классификация:
• Иммуногистохимическая: KIT-положительные (GIST 85-95%) или KIT-отрицательные (GIST 5-15%).
• Характер опухоли: доброкачественные GIST/злокачественные GIST.
• Операбельные/неоперабельные или мультифокальные/метастатические GIST.
ж) Лечение без операции гастроинтерстициальной стромальной опухоли (GIST) зависит от степени распространенности опухоли:
• Возможная адъювантная химиотерапия во всех случаях?
• (Нео-)адъювантная терапия иматинибом (Gleevec, ингибитор тирозинкиназы) при условно резектабельных GIST.
• Рецидивные, местнораспространенные, нерезектабельные или метастатические GIST: 45-80% первичного ответа на паллиативное лечение Gleevec.
• Роль лучевой терапии не определена.
з) Операця при гастроинтерстициальной стромальной опухоли (GIST)
Показания:
• Любая локализованная форма GIST, при которой возможно полное удаление опухоли без инвалидизации, за исключением случаев абсолютных противопоказаний или множественных метастазов.
• Мультифокальные GIST, только у тщательно отобранных больных (после нео-адъювантной терапии иматинибом).
Хирургический подход. Резекция органа, пораженного опухолью, en-block интактной псевдокапсулой; радикальная лимфаденэктомия показана не во всех случаях.
и) Результаты гастроинтерстициальной стромальной опухоли (GIST):
• Локализованные GIST: выживаемость без признаков заболевания в течение одного года составляет 80-90%, пятилетняя выживаемость после полного хирургического удаления в среднем составляет 50%.
• Метастатические GIST: средняя выживаемость по данным литературы составляет около 20 месяцев, однако 80% больных при назначении иматиниба имеют преимущество в выживаемости.
к) Наблюдение:
• Общее клиническое наблюдение в настоящее время четко не определено.
• Методы лучевой визуализации: КТ, ПЭТ с обычными интервалами.
• Эндоскопия (колоноскопия/ЭГДС), по крайней мере, через каждые 6-12 месяцев.
• В зависимости от локализации: эндоректальная ультрасонография.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Материалы конгрессов и конференций
Гастроинтестинальные стромальные опухоли (GIST-Gastrointestinal Stromal Tumors) составляют по разным данным от 0,1% до 3% от всех злокачественных новообразований желудочно-кишечного тракта и принадлежат к наиболее часто встречаемым мезенхимальным опухолям данной локализации (1).
Термин GIST впервые был предложен в 1983 г. для описания гастроинтестинальных неэпителиальных опухолей, которые отличаются по своим иммуногистохимическим и ультраструктурным характеристикам от опухолей с истинной нейрогенной и гладкомышечной дифференцировкой (2). До недавнего времени среди патоморфологов не было единого мнения о том, какие опухоли следует относить к GIST, поскольку отсутствовал надежный диагностический критерий, позволяющий дифференцировать этот вид новообразований от других опухолей желудочно-кишечного тракта мезенхимального происхождения, прежде всего от шванномы, лейомиомы и лейомиосаркомы. Существенный вклад в уточнение классификации и понимание патогенеза GIST внесли исследования, в результате которых был выделен основной механизм, ответственный за развитие данного новообразования, – гиперэкспрессия клетками GIST тирозинкиназного рецептора с-KIT (CD117) и его гиперактивация (3-5).
Общий фенотип (экспрессия CD117) и морфологическое сходство с интерстициальными клетками Кахала позволили предположить, что GIST развивается из этих клеток или их предшественников. Интерстициальные клетки Кахала формируют сеть в мышечной стенке желудочно-кишечного тракта и регулируют его автономную перистальтическую активность, т.е. являются пейсмекерными клетками, обеспечивающими связь между гладкомышечными клетками и нервными окончаниями. Именно наличие или отсутствие активированного c-KIT рецептора определяет дальнейшую дифференцировку примитивных мезенхимальных клеток-предшественников, которая может пойти в направлении как интерстициальных клеток Кахала, так и гладкомышечной ткани соответственно.
В настоящее время к GIST относят мехенхимальные опухоли гастроинтестинального тракта, позитивные по CD117, а результаты иммуногистохимического анализа на наличие экспрессии CD117 являются определяющими в проведении дифференциальной диагностики. Другими маркерами, которые помогают иммунофенотипировать и дифференцировать GIST от других опухолей желудочно-кишечного тракта мезенхимального происхождения, являются CD34-антиген, S-100 протеин, гладкомышечный актин (SMA) и десмин (табл. 1). Таким образом, иммуногистохимическое исследование является неотъемлемой частью диагностического процесса и должно проводиться в специализированном лечебном учреждении при всех мезенхимальных новообразованиях желудочно-кишечного тракта и забрюшинного пространства.
Таблица 1.
Иммуногистохимические маркеры, используемые для дифференциальной диагностики мезенхимальных опухолей желудочно-кишечного тракта (цит. по C. Fletcher et al., Human Pathology, Vol 33, №5, p.461, 2002).
| с-KIT (СD117) | СD34 | SMA | Десмин | S-100 | |
|---|---|---|---|---|---|
| GIST | + | + (60-70%) | + (30-40%) | + (1-2%) | + (5%) |
| Гладкомышечные опухоли | - | + (10-15%) | + | + | - |
| Шваннома | - | + | - | - | + |
| Фиброматоз | ? | - | + | + | - |
с-KIT рецептор экспрессируется не только клетками GIST и интерстициальными клетками Кахала, но и нормальными клетками (мастоцитами, меланоцитами, клетками Лейдига, сперматогониями, гемопоэтическими стволовыми клетками), и играет важную роль в меланогенезе, сперматогенезе и гемопоэзе (6-7). Более того, экспрессия данного рецептора наблюдается при мелкоклеточном раке легкого, семиноме, саркоме Юинга, ангиосаркоме, меланоме, остром миелолейкозе, раке яичников, нейробластоме. Однако эти опухоли крайне редко приходится дифференцировать с GIST, поскольку они обладают достаточно яркими собственными морфологическими особенностями и не вызывают существенных трудностей у патоморфологов.
В нормальных условиях c-KIT-тирозинкиназный рецептор (белковый продукт с-kit протоонкогена) активизируется в результате связывания внеклеточного домена рецептора с соответствующим лигандом – фактором роста стволовых клеток (stem cell factor, SCF). В дальнейшем происходит гомодимеризация рецептора, активация его внутриклеточного АТФ-связывающего и тирозинкиназного доменов с последующим фосфорилированием тирозиновых остатков целого ряда внутриклеточных сигнальных белков, передающих импульс к ядру клетки. В результате инициируется клеточная пролиферация, дифференцировка и включаются механизмы, регулирующие процессы апоптоза. В патогенезе GIST ключевую роль играет лиганднезависимая активация рецептора c-KIT, которая чаще всего (до 92% случаев) происходит вследствие мутации с-kit онкогена (5, 8). Данные мутации могут наблюдаться в эксонах 9, 11, 13 или 17, кодирующих внеклеточный или внутриклеточный домены рецептора. В тех случаях, когда мутации с-kit с помощью доступных на сегодняшний день методов (полимеразная цепная реакция, секвенирование ДНК) выявить не удается, предполагается, что активация с-KIT в опухолевых клетках происходит вследствие нарушения механизмов регуляции функции данного рецептора: гиперэкспрессия рецептора или SCF, инактивация с-KIT ингибирующих фосфатаз, гетеродимеризация с-KIT c другой рецепторной тирозинкиназой или независимое включение альтернативных путей внутриклеточной передачи сигнала.
В зависимости от преобладания того или иного компонента при морфологическом исследовании выделяют веретеноклеточный (70%), эпителиоидный (20-25%) и смешанный варианты GIST. Большинство опухолей на этапе их первичного диагностирования при отсутствии диссеминации и инфильтрации органов/тканей выглядят как доброкачественные новообразования (до 70%). Однако морфологи предпочитают не использовать термин “доброкачественный”, поскольку считается, что практически все GIST имеют злокачественный потенциал и, вероятно, при длительном периоде наблюдения опухоль приобретает черты “злокачественного” новообразования. Поэтому в клиническом отношении более важно другое деление, которое на основании митотической активности и размеров образования позволяет оценить риск агрессивности опухолевого процесса (табл. 2) (9).
Таблица 2.
Определение риска агрессивности (злокачественности) GIST.
Типичной локализацией GIST является желудок (60-70%), тонкая кишка (25-35%), толстая и прямая кишка (5%). В редких случаях опухоль может выявляться в пищеводе, брыжейке, сальнике, забрюшинном пространстве (10). Поскольку первичная опухоль локализуется в подслизистом слое, то существуют определенные трудности в гистологической верификации диагноза на предоперационном этапе. С помощью эндоскопических методов гистологический диагноз удается установить лишь в 50% случаев. Небольшие образования, чаще всего, не дают клинических симптомов и являются случайными находками при проведении эндоскопических исследований или лапаротомии вследствие других причин. Нередко GIST диагностируется в ходе экстренных операций, связанных с перфорацией органа или кровотечением. На момент диагностирования заболевания у 15-50% больных уже имеются метастазы, но степень распространения болезни, как правило, ограничена пределами брюшной полости. При этом в 65% случаев выявляются метастазы в печень, в 21% наблюдается диссеминация по брюшине. Крайне редко поражаются регионарные лимфатические узлы, кости и легкие (12).
Хирургический подход остается основным при отсутствии признаков диссеминации процесса. Однако его эффективность ограничена и определяется степенью локальной распространенности болезни и радикальностью операции. При локальном поражении частота рецидивов после радикальной операции приближается к 35%, при местно-распространенном заболевании (т.е. при вовлечении окружающих органов и тканей) достигает 90%. При рецидивах опухолевый процесс в основном локализован интраабдоминально. В среднем 5-летняя выживаемость больных после хирургического лечения варьирует от 35% до 65%. Прогноз больных зависит от митотической активности опухоли, размеров первичного образования и его локализации. Последние исследования также выявляют корреляцию между характером мутации с-KIT и безрецидивной выживаемостью больных (8).
В случае рецидива заболевания или при первичном диагностировании диссеминированного/неоперабельного процесса медиана выживаемости не превышает 10-20 мес. (11-14). Хирургическое удаление рецидивных образований в целом не приводит к улучшению выживаемости больных. По данным Mudan с соавт., медиана выживаемости больных после повторной операции составила всего лишь 15 мес. (15).
Данные о выживаемости больных в первую очередь свидетельствуют о низкой эффективности имеющихся химиотерапевтических подходов при этом заболевании, что объясняется высокой экспрессией Р-гликопротеина и MDR1-протеина опухолевыми клетками. В настоящее время трудно интерпретировать результаты исследований, проведенных до введения в клиническую практику основного диагностического критерия – наличие экспрессии CD117, - позволяющего дифференцировать GIST и лейомиосаркомы. Учитывая, что на долю GIST приходится до 80% всех мезенхимальных гастроинтестинальных опухолей, большинство “лейомиосарком” данной локализации на сегодняшний день следует классифицировать как GIST. Опираясь на данные исследований, посвященных изучению эффективности химиотерапии при лейомиосаркомах желудочно-кишечного тракта, можно предположить, что активность цитотоксических агентов при GIST колеблется от 0% до 15%, составляя в среднем 5% (16-18).
Идентификация основного патогенетического механизма, ответственного за развитие GIST, - гиперактивации c-KIT рецептора, а также результаты предклинических исследований послужили основанием для клинического изучения эффективности препарата STI-571 (иматиниб, Гливек) при данном заболевании. Гливек является низкомолекулярным ингибитором ряда рецепторных (с-KIT, PDGFR) и нерецепторных тирозинкиназ (Abl, Bcr-Abl). Конкурируя с АТФ за АТФ-связывающий домен рецептора с-KIT, препарат предотвращает фосфорилирование тирозиновых остатков внутриклеточных белков, тем самым, блокируя передачу сигнала к ядру клетки. Необходимо заметить, что к этому времени иматиниб уже демонстрировал впечатляющую клиническую эффективность у больных хроническим миелолейкозом, при котором ключевым механизмом патогенеза является активность другой тирозинкиназы - внутриклеточного Bcr-Abl протеина.
Предварительные результаты последующих многоцентровых исследований III фазы, результаты которых были впервые представлены на 39 ежегодной конференции ASCO в 2003 г., пока также указывают на равную эффективность двух дозовых режимов иматиниба - 400 мг/сут. и 800 мг/сут. (табл. 3) (22-23).
Таблица 3.
Предварительные результаты рандомизированных исследований III фазы.
| Исследование | Число больных | Доза (мг/сут.) | ПР+ЧР | СБ | Выживаемость без прогрес- сирования через 6 мес. |
|---|---|---|---|---|---|
| EORTC, AGITG,ISG | 946 | 400 | 43% | Нет данных | 73% |
| 800 | 43% | 78% | |||
| S0033 | 746 | 400 | 43% | 32% | 80% |
| 800 | 41% | 32% | 82% |
- сохраняющаяся активность с-KIT рецептора вследствие мутации его АТФ-связывающего (эксон 13) и тирозинкиназного (эксон 17) доменов;
- гиперэкспрессия с-KIT рецептора;
- активация альтернативной рецепторной тирозинкиназы, сопровождающаяся потерей экспрессии с-KIT;
- новые приобретенные точечные мутации с-KIT или PDGFR.
Параллельно изучаются факторы прогноза эффективности и токсичности терапии Гливеком. Уже выделены клинические параметры, ассоциированные с высокими показателями выживаемости без прогрессирования, к которым на сегодняшний день относят хороший общий соматический статус пациента, высокий уровень гемоглобина и локализацию первичной опухоли в желудке (25). Требуют своего решения и ряд других клинических вопросов. Какова оптимальная продолжительность терапии иматинибом? Как влияет характер мутации на вероятность развития рецидива заболевания после хирургического лечения? Должен ли использоваться Гливек у больных при отсутствии мутации с-KIT? Целесообразно ли проводить адъювантную терапию больным после радикально выполненной операции? Каково место неоадъювантной терапии в комплексном лечении больных GIST? Вероятно, проводимые клинические исследования в скором будущем ответят на поставленные вопросы. Но уже сейчас можно с уверенностью сказать, что это один из первых позитивных примеров рационального использования в онкологии препарата с молекулярно направленным действием, который открыл дорогу интенсивному клиническому изучению ингибиторов внутриклеточной передачи сигнала при других злокачественных новообразованиях.
Список литературы:
1. 1.Sakurai S, Fukasawa T, Chong J, et al. C-kit gene abnormalities in gastrointestinal stromal tumors. Jpn J cancer Res, V 90: 1321-1328, 1999.
2. Mazur MT, Clark HB. Gastric stromal tumors: R=re appraisal of histogenesis. Am J Surg pathol, V 7: 507-519, 1983.
4. Kindblom LG, Remotti HE, Aldenborg F, et al.: Gastrointestinal pacemaker cell tumor: Gasrtrointestinal stromal tumors show phenotypic characteristics of the intestinal cells of Cajal. Am J Pathology 152: 1259-1269, 1998.
5. Hirota S, Isozaki K, Moriyama Y, et al.: Gain-function mutations of c-kit in human gastrointestinal stromal tumors. Science 279:577-580, 1998.
6. Tsuura Y, Hiraki H, Watanabe K, et al. Preferential localization of c-kit product in tissue mast cells, basal cell of skins, epithelial cells of breast, small cell lung carcinoma, and seminoma/dysgerminoma in humans: immunohistochemical study of formalin-fixed, paraffin-embedded tissues. Virchows Arch; 424: 135-141,1994.
9. Fletcher C, Berman J, Corless C, et al. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Human Pathology, V 33, №5: p.459-465, 2002.
10. Miettinen M, Lasota J. Gastrointestinal stromal tumors – definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnoses. Virchows Arch, V 438:1-12, 2001.
11. Dougherty M, Compton C, Talbert M, et al. Sarcomas of the gastrointestinal tract. Separation into favorable and unfavorable prognostic groups by mitotic count. Annal Surg, V 214: 569-574, 1991.
12. De Matteo R, Lewis J, Leung D, et al. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surgery, V 231: 51-58, 2000.
13. Crossby J, Catton C, Davis A, et al. Malignant gastrointestinal stromal tumors of the small intestine: a review of 50 cases from prospective database. Ann Surg Oncol, V 8: 50-59, 2001.
14. Plaat B, Hollema H, Molenaar W, et al. Soft tissue leiomyosarcomas and malignant gastrointestinal stromal tumors: differences in clinical outcome and expression a multidrug resistance proteins. J Clin Oncol, V 18: 3211-3220, 2000.
15. Mudan S, Conlon K, Woodruff J, et al. Salvage surgery in recurrent gastrointestinal sarcoma: prognostic factors to guide patient selection. Cancer, V 88: 66-74, 1999.
16. Zalupski M, Metch B, Balcerzak S, et al. Phase III comparison of doxorubicin and dacarbazine given by bolus vs infusion in patients with soft tissue sarcomas. SWOG study. Jour Nath Cancer Inst, V 83: 926-932, 1991.
17. Edmonson J, Maarks R, Buckner J, et al. Contrast of response to D-MAP plus sargramostin between patients with advanced malignant gastrointestinal stromal tumors and patients with other advanced leiomyosarcomas. Proc Am Assoc Cancer Res, V 18: abst 541, 1999.
18. Antman K, Crowley J, Balcerzak S, et al. An intergroup phase III randomized study of doxorubicin and dacarbazine with or without ifosfamide and mesna in advanced soft tissue and bone sarcomas. J Clin Oncol, V 11: 1276-1285, 1993.
19. van Oosterom AT, Judson IR, Verweij J, et al. Update of phase I study of imatinib (STI571) in advanced soft tissue sarcomas and gastrointestinal stromal tumors: a report of the EORTC Soft Tissue and Bone Sarcoma Group. Eur J Cancer, V 38, Suppl 5: S83-87, 2002.
21. Demetri G, von Mehren M, Blanke C, et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med, V 347: 472-480, 2002.
22. Verweij J, Casali P, Zalcberg J, Cesne A, et al. Early efficacy comparison of two doses of imatinib for the treatment of advanced gastrointestinal stromal tumors: interim results of a randomized phase III trial from the EORTC-STBSG, ISG and AGITG. Proc Am Soc Clin Oncol, V 22: 3272a, 2003.
23. Benjamin R, Rankin C, Fletcher C, et al. Phase III dose-randomized study of imatinib mesylate (STI571) for GIST: intergroup S0033 early results. Proc Am Soc Clin Oncol, V 22: 3271a, 2003.
24. Fletcher J, Corless C, Dimitrijevic S, et al. Mechanisms of resistance to imatinib mesylate in advanced gastrointestinal stromal tumors. Proc Am Soc Clin Oncol, V 22: 3275a, 2003.
25. Van Glabbeke M., Verweij J., Casali P, et al. Prognostic factors of toxicity and efficacy in patients with gastrointestinal stromal tumors (GIST) treated with imatinib: a study of the EORTC-STBSG, ISG and AGITG. Proc Am Soc Clin Oncol, V 22: 3286a, 2003.
Copyright © Российское общество клинической онкологии (RUSSCO).
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Видео
Еще фото
Автор (ы): Н.В. Митрохина, к.в.н., ветеринарный врач-патоморфолог, генеральный директор Ветеринарного центра патоморфологии и лабораторной диагностики доктора Митрохиной
Журнал: №5-2017
Ключевые слова : гастроинтестинальная стромальная опухоль, C-kit, маркеры, иммунофенотип, гистогенез, морфология
Key words : gastrointestinal stromal tumor, C-kit, markers, immunophenotype, histogenesis, morphology
История описания особой категории стромальных опухолей желудочно-кишечного тракта, обладающих признаками как миогенных, так и нейрогенных новообразований, насчитывает немногим более 25 лет работ американских медицинских патологов. При этом истинная их природа, обосновывающая выделение данной нозологической единицы, стала понятна только с 1998 г. благодаря исследованиям японских авторов. В отечественной медицинской литературе пристальный интерес к гастроинтестинальным стромальным опухолям (GIST – gastrointestinal stromal tumors) наблюдается только в последние 10 лет. В литературе по ветеринарной онкологии нет точных данных о частоте встречаемости этого заболевания, соответственно, не разработаны рекомендации по диагностическим алгоритмам данной патологии.
В связи с этим имеются объективные причины недостаточного знания практическими патологами морфологической диагностики GIST, их особенностей. Другой причиной является относительная редкость этой группы новообразований. Однако могут встретиться эти заболевания в практике любого патологоанатомического отделения, но не каждый ветеринарный патолог способен дифференцировать GIST от других новообразований ЖКТ.
Несмотря на редкость GIST, знание их морфологического строения имеет непосредственное клиническое значение, так как к настоящему времени достаточно детально расшифрованы их биологические особенности и имеются методы таргетной лекарственной терапии. Решающую роль в диагностике GIST имеет морфологическое и иммуногистохимическое исследование.
History of the description of a special category of stromal tumors of the gastrointestinal tract with symptoms as the myogenic and neurogenic tumors, has a little more than 25 years – with the work of the American medical pathologists. While their true nature, justifying the allocation of this nosologic units, it has become clear only since 1998, thanks to the research of Japanese authors. In the domestic medical literature, a keen interest in gastrointestinal stromal tumors (GIST – gastrointestinal stromal tumors) is observed only in the last 10 years. In the literature on veterinary Oncology no exact data on the frequency of occurrence of this disease, and therefore not recommendations for diagnostic algorithms of this disease.
In this regard there are objective reasons for insufficient knowledge of practical pathology and morphological diagnosis of GIST. Another reason is the relative rarity of this group of neoplasms. However, can meet these diseases in the practice of any mortuaries, but not every veterinary pathologist is able to differentiate GIST from other tumors of the gastrointestinal tract.
Despite the rarity of GIST, the knowledge of their morphological diagnosis is of direct clinical relevance, as to date sufficient detail deciphered their biological characteristics and methods of targeted drug therapy. A crucial role in the diagnosis of GIST has a morphological and immunohistochemical study.
В настоящее время к гастроинтестинальным стромальным опухолям (ГИСО) относят мезенхимальные новообразования желудочно-кишечного тракта (ЖКТ), для которых характерна гиперэкспрессия гена С-kit, а также антигенов гладкомышечной и нейрогенной дифференцировки. На их долю у людей приходятся 80% всех сарком ЖКТ и 5% сарком мягких тканей. Подобной статистики в ветеринарной литературе нет. ГИСО встречаются в любом отделе ЖКТ, но чаще в желудке и тонкой кишке, редко – в пищеводе и толстой кишке, еще реже – вне ЖКТ, например, в брыжейке или сальнике.
В отдельную нозологическую группу ГИСО были выделены после того, как в 1983 г. M.T. Mazur и H.B. Clark описали ультраструктурные отличия ГИСО от опухолей с истинной нейрогенной (шванномы) и гладкомышечной (лейомиомы и лейомиосаркомы) дифференцировкой. В прошлом большая часть ГИСО диагностировались как «другие» типы сарком.
В настоящее время патологоанатомический диагноз ГИСО базируется на морфологических и иммуногистохимических данных. Основными гистологическими типами ГИСО считаются веретеноклеточный, эпителиоидный и смешанный.
Следует отметить, что, несмотря на то что клеточный полиморфизм в той или иной степени свойственен всем ГИСО, при эпителиоидном типе гистологического строения опухоли он наиболее выражен. С данным типом строения ГИСО сопряжено более агрессивное течение заболевания.
Биологическое поведение и диагностика ГИСО
Ранее опухоли этой группы диагностировались как лейомиосаркомы или лейомиомы. Дифференцировка ГИСО от других опухолей мезенхимального происхождения основана на иммуногистохимическом анализе. Иммуногистохимическими маркерами ГИСО являются C-kit или CD117 (положительный в 95% случаев), гладкомышечный актин (30-40%). Кроме того, для диагностики ГИСО используются реакции на виментин, S100, десмин. Повышенная экспрессия тирозинкиназного рецептора C-kit (CD117) на поверхности опухолевой клетки является патогномоничным признаком для ГИСО.
Все ГИСО потенциально злокачественны и различаются только по степени риска прогрессирования, для определения которой имеют значение размер опухоли, митотический индекс, а также локализация. Митотический индекс определяется на площади 5 мм 2 . Для микроскопов стандартной конструкции это составляет 50 полей зрения при увеличении х400. Митотический показатель для ГИСО классифицируется как «низкий» для 0–5 митозов и «высокий» – при 6 или более митозах на 5 мм 2 . Размер опухоли и митотическая активность коррелируют с риском рецидива: опухоли больших размеров и с высоким митотическим индексом более агрессивны. Учитывая локализацию первичной опухоли, следует отметить, что более неблагоприятно протекает заболевание при поражении кишечника.
Основные гистологические критерии злокачественности ГИСО следующие:
1) высокая клеточность;
2) выраженная атипия ядер и клеток;
3) свыше 5 митозов в 50 полях зрения (х400);
4) прорастание слизистой оболочки;
5) наличие опухолевых эмболов в просвете сосудов;
6) очаги некроза.
Безусловным критерием злокачественности является наличие метастазов.
Макроскопическая картина ГИСО следующая. Рост опухолей характеризуется тремя вариантами:
2) экзоорганный (наиболее частый);
Опухоли обычно хорошо отграничены, но лишены истинной капсулы. Структуры по типу ложной капсулы формируются за счет сдавливания прилежащих тканей. Растет опухоль в виде одного или множественных узлов, которые могут формировать конгломераты. Покрывающая слизистая оболочка может быть мало измененной, но до 50% случаев встречаются изъязвления. На разрезе ткань опухоли розоватая или серая. Часто в опухолях крупного размера развиваются некрозы, кровоизлияния, происходит кистозная дегенерация. Опухоль может приобретать вид многокамерной кисты с геморрагическим содержимым. Ранее такие новообразования попадали в диагностическую категорию кистозных лейомиом.
Микроскопическая картина
Гистологическая структура ГИСО достаточно вариабельна. Клеточные элементы чаще веретенообразные или эпителиоидные, но могут встречаться плазмоцитоидные, миксоидные, плеоморфные, перстневидные, онкоцитарные и даже многоядерные клетки. Варианты гистологических структур следующие:
3) в виде клеточных гнезд;
Наиболее часто встречается веретеноклеточный гистологический, вторыми «частым» вариантом являются эпителиоидные (эпителиоидноклеточные) ГИСО. Последний вариант ранее характеризовался как лейомиобластомы или эпителиоидные лейомиомы. До трети случаев составляют смешанные ГИСО.
При веретеноклеточном варианте опухоль состоит из вытянутых клеток с различной эозинофилией цитоплазмы, часто со слабо различимыми границами. Ядра овальные, расположены центрально, содержат мелкодисперсный хроматин. При выраженной вакуолизации цитоплазмы клетки приобретают перстневидную структуру. Расположение клеток в виде пучков различной длины, коротких вихреобразных структур или палисадообразное. За счет этого структура опухоли может симулировать лейомиомы или нейральные опухоли. Нередко опухоли отличаются высокой степенью васкуляризации, приобретая вид новообразований, ранее диагностировавшихся как ангиолейомиомы.
Относительно часто встречаются изменения опухолевой стромы в виде полей гиалиноза, особенно периваскулярно, миксоидные изменения, кровоизлияния.
Морфологическая картина эпителиоидных ГИСО соответствует традиционному описанию лейомиобластом или эпителиоидных лейомиом. Светлые овальные или округлые клетки складываются в клеточные гнезда или альвеолярные структуры, часто вокруг кровеносных сосудов.
Диагноз ГИСО при типичной макро- и микроскопической картине может быть предварительно поставлен и на основании рутинного исследования. Но во всех случаях необходимо последующее проведение иммуногистохимического исследования, которое может иметь значение не столько для подтверждения диагноза, сколько для определения показаний к назначению таргетной терапии – выполнения протокола диагностики и лечения.
Основным маркером ГИСО является CD117, экспрессия которого может быть различной: цитоплазматической, мембранной, в виде пятна в области комплекса Гольджи, чаще – смешанная.
1. Частота экспрессии различных иммуногистохимических маркеров отличается в зависимости от локализации опухоли, ее гистологического варианта, размеров. Поиск корреляций между морфологическими, иммунофенотипическими и прогностическими характеристиками GIST, безусловно, необходим.
2. Диагностика стромальных опухолей желудочно-кишечного тракта не должна основываться на «гистологической очевидности».
3. Верификация всех веретено- и эпителиоидноклеточных опухолей желудочно-кишечного тракта требует выполнения иммуногистохимического исследования.
4. Определение биологического потенциала должно основываться на выработанном в настоящее время комплексе гистологических критериев с учетом клинических данных, прежде всего, размера опухоли, с определением степени риска.
1. Анурова О.А. Морфологическая и иммуногистохимическая диагностика стромальных опухолей желудочно-кишечного тракта (GIST). Материалы выездной школы 16–18.10.2006 «Актуальные проблемы диагностики и лечения стромальный опухолей ЖКТ(GIST). Современная онкология (экстравыпуск). 2007.
2. Анурова О.А., Снигур П.В., Филиппова Н.А., Сельчук В.Ю. Морфологическая характеристика стромальных опухолей желудочно-кишечного тракта. Арх. патол. 2006; 68 (1).
3. Братанчук С.Ю., Мацко Д.Е., Имянитов Е.Н. и др. Гастроинтестинальная стромальная опухоль пищевода. Арх. патол. 2010; 69(1).
4. Бурмистров М.В. Диагностика и лечение доброкачественной патологии пищевода: дис. … докт. мед. наук. 2005.
5. Казанцева И.А. Морфологические особенности GIST. Материалы выездной школы 16–18.10.2006 «Актуальные проблемы диагностики и лечения стромальных опухолей ЖКТ (GIST). Современная онкология (экстравыпуск). 2007.
6. Проценко С.А. Практическая онкология. 2010; 11 (3).
7. Agaimy A., Wunsch P.H. Sporadic Cajal cells hyperplasia is common in resection specimens for distal oesophageal carcinoma. Virchows Arch. 2006.
8. Daum O., Klecka J., Ferda J. et. al. Gastrointestinal stromal tumor of the pancreas: case report with documentation of KIT gene mutation. Virchows Arch. 2005.
9. Hirota S. Gastrointestinal stromal tumors: their origin and cause. Int. J. Clin. Oncol. 2001.
10. Miettinen M., Sobin L.H., Sarlomo-Rikala M. Immunohistochemical spectrum of GISTs at different sites and their differential diagnosis with a reference tо CD117 (KIT). Mod. Pathol. 2000.
11. Yamaguchi U., Hasegawa T., Masuda T. et al. Differential diagnosis of gastrointestinal stromal tumor and other spindle cell tumors in the gastrointestinal tract based on immunohistochemical analysis. Virchows Arch. 2004.
Гастроинтестинальные стромальные опухоли (GIST, Gastrointestinal Stromal Tumors)
Гастроинтестинальные стромальные опухоли являются достаточно редкой группой опухолей с пограничной злокачественностью, которые микроскопически расценивались как лейомиомы, лейомиосаркомы или шванномы. Основным предиктором гастроинтестинальных стромальных опухолей является экспрессия маркера CD117 и CD34. Обнаружение других маркеров имеет меньшее диагностическое значение. На прогноз гастроинтестинальных стромальных опухолей влияют такие показатели как локализация опухоли, ее размеры и количество митозов в 50 полях зрения. В статье приведены результаты лечения 38 случаев заболевания с локализацией в желудке (20), тонкой кишке (6), толстой кишке (9), забрюшинном пространстве и поджелудочной железе (3). Лечение включало удаление опухоли и назначение Иматиниба при высоком риске прогрессирования. Послеоперационных осложнений не было. Летальность составила 4 человека в сроки от 1 года до 2 лет.
1. Гастро-интестинальные стромальные опухоли: современная классификация, дифференциальная диагностика и факторы прогноза / А.Г. Корнилова, Л.М. Когония, В.С. Мазурин, С.В. Морданов, О.С. Оксенюк // Эффективная фармакотерапия. – 2014. – № 14. – С.20-23.
2. Клиническое наблюдение первично-множественных синхронных опухолей: аденокарциномы и гастроинтестинальной стромальной опухоли толстой кишки / А.О. Расулов, З.З. Мамеддли, А.Б. Байчоров, А.Г. Перевощиков, А.О. Анурова, А.И. Сендерович // Онкологическая колопроктология. – 2015. – № 2. – С.45-49.
5. Mazur M.T., Clark H.B. Gastric stromal tumors. Reappraisal of histogenesis // Am J SurgPathol. 1983. 7(6). P.507-19.
6. NCCN Task Force Report: Optimal Managment of Panients with Gastroimtestinal Stromal Tumor (GIST) - Update of the NCCN Clinical Practice Guidlines / JNCCN. 2007. Vol.5, Suppl.2. P. s-5.
Термин «гастроинтестинальная стромальная опухоль» (gastrointestinal stromal tumor, ГИСТО, GIST) был предложен американскими морфологами M.T. Mazur и H.B. Clark в 1983 году для обозначения особого вида злокачественных опухолей, которые до этого расценивались как лейомиомы, лейомиосаркомы или шванномы. После внедрения в клиническую практику иммуногистохимического исследования и электронной микроскопии, появилась возможность выделить ГИСТО в отдельную нозологическую форму [1, 5].
Считается, что данный вид опухоли возникает из интерстициальных клеток Кахаля, являщихся пейсмекерами желудочно-кишечного тракта, но факты выявления в неорганных ГИСТО вызывают противоречие с вышеназванной гипотезой. Основным предиктором, позволяющим выделить ГИСТО в отдельную нозологическую группу, в настоящее время является определение мутации в гене c-kit, экспрессирующий маркер CD117 в мезенхимальных и нейрогенных опухолях [1, 2, 6].
ГИСТО является относительно редкой опухолью и составляя от 1 до 3 % от общего числа злокачественных опухолей. Ежегодно в мире выявляется от 10 до 40 новых случаев той опухоли на 1 миллион населения. Самая высокая заболеваемость регистрируется в возрасте 50–60 лет – более 75 %, чаще у мужчин. По данным американских авторов, в США ежегодно регистрируется около 5000 новых случаев этого заболевания. По России точные данные в настоящее время отсутствуют, экспертная частота возникновения составляет 2000–2500 случаев в год [2, 4, 6].
Чаще всего ГИСТО выявляются в желудке (до 70 %) и тонкой кишке (от 25 % до 35 %), и данная локализация характеризуется более неблагоприятным, по сравнению с другими, прогнозом. Значительно реже – менее 5 % – данный тип опухоли обнаруживают в толстой кишке и аппендиксе. Описаны также поражения поджелудочной железы, предстательной железы, матки и экстраорганные ГИСТО, с локализацией в сальнике, забрюшинном пространстве, брыжейках толстой и тонкой кишки [1, 6].
Для ГИСТО характерно весьма редкое метастазирование в лимфатические узлы, что накладывает определенные особенности на хирургическую технику: нецелесообразность выполнения лимфодиссекции при данной нозологии.
ГИСТО по своей гистологической структуре делятся на веретеноклеточные, эпителиоидные и смешанные. Веретеноклеточный тип опухоли представлен полисадообразными структурами с мономорфными ядрами округлой или вытянутой формы. Эпителиоидный тип характеризуется наличием полигональных или округлых форм со светлой цитоплазмой, которые формируют солидные, солидно-альвеолярные и клеточные гнезда. Изредка встречаются плеоморфный, перстневидно-клеточный, мезотелиомоподобный и онкоцитарный тип опухоли. Клеточный полиморфизм максимально выражен при эпителиоидном типе опухоли, что сопряжено с более агрессивным течением заболевания [1, 5].
Клинические проявления, макроскопические и гистологические характеристики опухолей неспецифичны. Лабораторная диагностика этих образований основывается на определении экспрессии мембранных белков CD117 и, в меньшей степени, CD34. Главный механизм неопластической трансформации и возникновения данного типа опухолей обусловлен гиперэкспрессией клетками тиразинкиназного рецептора KIT (CD117) и его безлигантной активацией. Кодируемый геном белок выступает в качестве трансмембранного рецептора фактора роста стволовых клеток. Мутации гена могут наблюдаться в 9, 11, 13 или 17 экзоне, кодирующих внутриклеточные и внеклеточные домены данного рецептора. Аналогичные, но взаимоисключающие мутации, хотя и редко, могут происходить со стороны гена, кодирующего рецептор тромбоцитарного фактора роста альфа (PDGFRA). Примерно в 10–15 % ГИСТО мутации генов с-KIT и PDGFRA могут отсутствовать, что говорит о диком типе данной опухоли.
Основным методом лечения местных и местнораспространенных форм ГИСТО является хирургическое лечение. В случае рецидива или обнаружения метастазов – показана таргетная терапия иматинибом. При этом опухоли размером менее 2 см возможно динамическое наблюдение с использованием методов КТ и МРТ визуализации [3].
Опухоли больших размеров подлежат безусловной резекции с отступлением от краев опухоли 1–2 см. Лимфодиссекция при неизмененных лимфатических узлах нецелесообразна. Возможно выполнение профилактической оментэктомии, но рандомизированных данных о ее целесообразности в настоящее время нет.
При локализации опухоли в пищеводе, кардиальном отделе желудка, двенадцатиперстной и прямой кишке, а также при сомнительной резектабельности рекомендуется предоперационное лечение иматинибом в течение 6–12 месяцев [1, 3].
За период с 2012 по 2016 г. в Волгоградском областном клиническом онкологическом диспансере по поводу ГИСТО проходили лечение 38 человек в возрасте от 24 до 79 лет. Медиана возраста составила 61 год. Женщин было 15, мужчин – 23.
В подавляющем числе случаев опухоль локализовалась в желудке – 20 наблюдений. Среди других локализаций нами были отмечены: тонкая кишка – 6, ободочная кишка – 6, прямая кишка – 3, поджелудочная железа и забрюшинное пространство –3.
Пациенты были госпитализированы в стационар в плановом порядке, после углубленного исследования органов желудочно-кишечного тракта, включающего УЗИ и КТ органов брюшной полости и забрюшинного пространства, ФГДС, рентгенографию желудка и двенадцатиперстной кишки, рентгенографию по пассажу, ФКС и ирригографию. Необходимо признать, что дооперационная диагностика неэпителиальных опухолей желудочно-кишечного тракта представляет весьма трудную задачу из-за редкости этой патологии и отсутствия сколь-нибудь характерной клинической картины. Таким образом, наиболее частым дооперационным клиническим диагнозом являлись «подслизистая опухоль желудка или кишки» и «внеорганая опухоль брюшной полости».
Клинические проявления ГИСТО были разнообразны и неспецифичны и сводились в основном к болям неопределенного характера, дискомфорту в брюшной полости, ухудшению общего самочувствия, диспепсии. Так болевой синдром у наших больных был отмечен в 26 (68, 4 %) наблюдениях. У 8 (21,1 %) пациентов опухоль определялась пальпаторно: в 5 случаях при локализации в желудке и забрюшинном пространстве и в 3 наблюдениях – при пальцевом исследовании прямой кишки. Анемия различной степени тяжести отмечалась при поступлении пациентов в 12 (31,6 %) случаях, а указания на состоявшееся кровотечение было у 5 (13,2 %) пациентов. В 3 (7,9 %) кровотечение возникло в период пребывания больных в нашем стационаре, что явилось показанием к экстренной операции, как мы показываем в следующем клиническом наблюдении.
Пациент С., 64 лет, и.б. №112628, поступил в хирургическое отделение №5 Волгоградского областного клинического онкологического диспансера 27.10.2016 г. При поступлении предъявлял жалобы на общую слабость, боли в эпигастральной области и левом подреберье, наличие в анамнезе черного стула. При поступлении состояние расценено как относительно удовлетворительное. Нормостеничного сложения. Кожные покровы обычной окраски. В общем анализе крови отмечается умеренная анемия со снижение Hb до 103г/л, эритроцитов 3,8х10 12 , лейкоцитов 6,3х10 9 , лейкоцитарная формула в пределах физиологической нормы, СОЭ 45 мм/ч. Креатинин 87,9 мкмоль/л, билирубин 6,3 мкмоль/л, глюкоза крови 4,7 ммоль/л.
20.10.2017. Фиброгастродуоденоскопия: Слизистая оболочка пищевода и кардии гиперемирована. Желудок деформирован по задней поверхности и большой кривизне в результате оттеснения извне объемным процессом от субкардиального кардиального отдела до нижней трети тела желудка. Слизистая оболочка в этой зоне инфильтрирована, складки разглажены. Отмечаются множественные эрозии различной величины. Признаков кровотечения не обнаружено. Привратник проходим. В двенадцатиперстной кишке явления фолликулярного бульбита.
26.10.2017. Рентгеноскопия пищевода, желудка и двенадцатиперстной кишки: опухоль желудка, субтотальное поражение и распространением на кардиальный жом. Вероятно ГИСТО, менее вероятно лимфома. Эвакуация из желудка не нарушена.
31.10.2017. Компьютерная томография с контрастным усиление «Ultravist»: опухоль верхнего этажа брюшной полости 8,3х10,7х13,7 см, исходящая из стенки желудка – ГИСТО (Рис. 1).
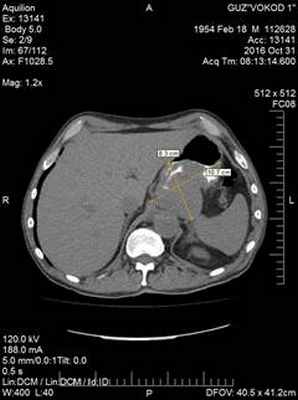
Рис. 1. Компьютерная томограмма пациента С
Гистологическое исследование (двукратное): лимфоидная инфильтрация слизистой оболочки, фиброзная ткань.
В соответствии с установленным диагнозом «Гастро-интестинальная стромальная опухоль желудка» была начата предоперационная подготовка.
01.11.2017. Отмечено ухудшение состояния пациента. Жалобы на слабость, головокружение, черный неоформленный кал. Объективно: состояние средней тяжести, кожные покровы бледные, влажные. АД 110/65 мм рт. ст., пульс 96 уд. в мин., ЧДД 18 в 1 мин. Гемоглобин 82 г/л, Гематокрит 27 %.
Установлен назо-гастральный зонд. По зонду отделяемое типа «кофейной гущи». Желудок по зонду отмыт до чистых вод, через зонд с целью гемостаза введено 100 мл 5 % раствора аминокапроновой кислоты. Начата гемостатическая терапия.
Фиброгастродуоденография: в полости желудка свежая кровь и сгустки. В теле желудка в области опухоли два язвенных дефекта размером 1,8х1,5 см и 1,5х1,5 см прикрытые фиксированными сгустками крови из под которых сохраняется кровотечение.
В срочном порядке пациенту выполнена лапаротомия, чрезбрюшная гастроспленэктомия (Рис. 2).
Рис. 2. Пациент С. Удаленный препарат
Послеоперационный период протекал без осложнений.
Гистологическое исследование удаленного препарата: гастро-интестинальная стромальная опухоль смешанного строения. При иммуногистохимическом исследовании: гиперэкспрессия в большинстве клеток CD117, гнездная гиперэкспрессия CD34, виментина. Митотический индекс в 50 полях – 8/50.
В послеоперационном периоде, с учетом высокого риска прогрессирования: размеры опухоли и митотический индекс – в адъювантном режиме назначена терапия Иматинибом в дозе 400 мг/сутки.
Осмотрен в феврале 2017 г. Признаков прогрессирования опухоли не обнаружено. Рекомендовано продолжение таргетной терапии до 3 лет.
Перечень выполненных нами хирургических вмешательств при ГИСТО представлен нами в ниже приведенной табл. 1.
Гастроинтестинальная стромальная опухоль (GIST)
Гастроинтестинальная стромальная опухоль (GIST) составляет примерно 1% от всех злокачественных опухолей желудочно-кишечного тракта, но 80% от сарком данной локализации. В последние два десятилетия заболеваемость в странах Европы и Северной Америки выросла в 2-3 раза.
GIST могут развиваться в любом отделе пищеварительного тракта, но с разной частотой: в желудке – 60%; в тонкой кишке – 25%; в толстой кишке - 8%; в прямой кишке – 5%; в пищеводе – 2%.
GIST имеют сходство с гладкомышечными (лейомиомами, лейомиосаркомами) и нейрогенными (шваномами) опухолям. Однако принципиальные особенности, выявляемые при иммуногистохимическом исследовании, позволяют выделить эти опухоли в отдельную нозологическую группу.
Все виды GIST потенциально злокачественны и метастазируют преиму-щественно гематогенным путем. Злокачественный потенциал опухоли зависит от ее локализации, размера и показателя митотической активности клеток. Так, опухоли размером 2-5 см обладают низким злокачественным потенциалом, то образования диаметром более 10 см - высоким
Наиболее часто метастазы обнаруживают в печени (60%), на брюшинном покрове (30%), в костях (6%) и в легких (2%). Регионарные лимфоузлы поражаются редко (6-8%). Именно это обстоятельство позволяет рассчитывать на радикальное вмешательство даже при опухолях больших размеров.
GIST представляют собой внутристеночный (подслизистый) узел, кото-рый вдается в просвет органа (склонны к экзофитному, экстраорганному росту).
Жалобы и симптомы
Специфических проявлений GIST не существует.
На ранних стадиях большинство GIST остаются нераспознанными. Более того, даже большие по размерам опухоли могут никак себя не проявлять и протекать бессимптомно.
Основными симптомами GIST являются дискомфорт и боль в животе , тошнота, потеря массы тела, общее недомогание, быстрая утомляемость.
Над опухолевым узлом на слизистой оболочке может образоваться язва и послужить источником желудочно-кишечного кровотечения (от скрытого до массивного). После этого естественно развивается вторичная железодефицитная анемия. GIST при прорастании серозного покрова может также изъязвится и стать источником внутрибрюшного кровотечения.
Опухоль антрального отдела желудка может вызвать стеноз выходного отдела желудка
Диагностика
Примерно 20% опухолей являются случайной находкой при стандартных контрастной рентгенографии желудка и эзофагогастродуоденоскопии (в сочетании с эндосонографией). В обязательном порядке берут тонкоигольную бипсию опухоли для гистологического, иммуногистохимического и молекулярногенетического анализа.
При выявлении опухоли подозрительной на GIST показана рентгеновская компьютерная томография брюшной полости с внутривенным контрастированием.
Окончательная верификация диагноза GIST проводится только при им-муногистохимическом (специфический маркер - CD 117) и молекулярно-генетическом анализах биопсийного материала.
Сегодня основным методом лечения GIST является хирургический, при котором стремятся максимально радикально удалить опухолевые узлы. После радикальной операции пациенты несколько лет находятся под наблюдением специалистов с тщательным обследованием 2 раза в год. Распространенные формы заболевания (неудалимые опухоли и/или отдаленные метастазы) достаточно успешно лечат консервативно современным системным химиотерапевтическим препаратом - иматинибом (Гливеком). В настоящее время обсуждается вопрос о целесообразности комбинированного (операция + Гливек) лечения GIST.;
На практике тактика лечения GIST всегда выбирается индивидуально в каждом случае. Так, за опухолями диаметром до 2,0 см наблюдают с контрольными эндоскопическим исследованием 1-2 раза в год. От вылущивания даже небольших опухолей воздерживаются из-за угрозы распространения злокачественных клеток по брюшине. Опухоль более 2,0 см – служит показанием к операции.
Резекцию желудка выполняют в стандартном объеме в пределах здоро-вых тканей – отступя не менее 2,0 см от края опухоли. При гигантских опухолях выполняют гастрэктомию. Резекцию органа предпочтительнее дополнять удалением регионарных лимфоузлов (лимфодисекцией).
Читайте также:
