Генетика мышечных дистрофий Дюшенна и Беккера. Наследование, молекулярные основы
Добавил пользователь Валентин П. Обновлено: 16.01.2026
Генетика мышечной дистрофии Дюшенна и Беккера у детей. Патогенез
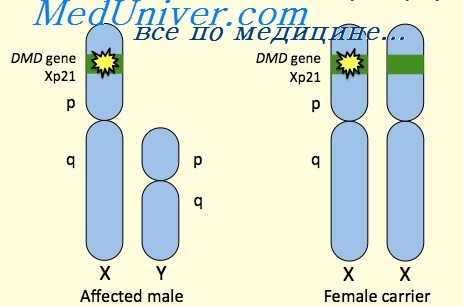
Несмотря на Х-сцепленный рецессивный тип наследования мышечной дистрофии Дюшенна, примерно у 30 % пациентов заболевание обусловлено новой мутацией, а мать больного не является носителем. У женщин-носителей, как правило, отсутствует мышечная слабость и другие клинические проявления заболевания. Однако иногда заболевание развивается и у девочек, в этом случае мышечная слабость выражена значительно меньше, чем у мальчиков.
В соответствии с гипотезой, предложенной Лайном (Lyon), клинические проявления мышечной дистрофии Дюшенна у девочек объясняются инактивацией нормальной Х-хромосомы, при этом другая Х-хромосома с делецией гена находится в активном состоянии. Полная клиническая картина дистрофии Дюшенна описана у нескольких девочек с синдромом Тернера, при этом единственная Х-хромосома содержала делецию в локусе Хр21.
Еще в 10 % случаев носительство мышечной дистрофии можно установить у женщин с нормальной активностью КФК в крови при мышечной биопсии. Определяющее значение имеет специфический генетический анализ крови с помощью ПЦР.
Выявление носителей путем определения КФК в крови или мышечной биопсии вскоре будет иметь ограниченное значение в связи с открытием молекулярно-генетической основы мышечной дистрофии Дюшенна. Протяженность гена мышечной дистрофии Дюшенна в локусе Хр21 составляет более 2000 kb, однако соответствующая ДНК занимает всего 14 kb. Картированы все нуклеотидные последовательности гена.

Цитоскелетный протеин с молекулярной массой 147 кДа, известный как дистрофин, кодируется в локусе Хр21.2. Субсарколеммно расположенный протеин присоединяется к сарколемме, покрывая А- и М-полоски миофибрилл и состоит из четырех различных регионов (доменов): первый домен представляет собой аминокислотное окончание, содержит 250 аминокислот и связан с N-актинсвязывающим сайтом ct-актинина; второй домен самый большой по протяженности, он содержит 2800 аминокислот и насчитывает множество повторов, что придает ему характерную форму стержня; третий домен, богатый цистеином, связан с карбоксильным окончанием а-актинина.
Последний домен представляет собой карбоксильное окончание и содержит 400 аминокислот; он имеет уникальное строение, свойственное дистрофину и дистрофинассоциированным протеинам, кодируемым хромосомой 6. Дистрофин выявляется в формирующихся мышцах плода начиная с 11-й недели геста-ции. мРНК дистрофина в норме обнаруживается в сердечной и гладких мышцах, а также в скелетной мускулатуре и в головном мозге. Все эти ткани в различной степени участвуют в развитии клинических проявлений заболевания.
При дистрофинопатиях возможны молекулярные дефекты различных типов: интрагенные делеции, дупликации или точечные мутации нуклеоти-дов. Примерно у 65 % пациентов выявляются делении и только у 7 % — дупликации. Локализация и размер интрагенных аномалий не всегда четко коррелируют с тяжестью фенотипических проявлений заболевания. Как при дистрофии Беккера, так и при болезни Дюшенна мутации локализуются главным образом ближе к средней части гена, включая делеции экзонов 46-51.
Фенотипические или клинические варианты заболевания объясняются нарушениями при трансляции мРНК, что приводит к синтезу нестабильных усеченных молекул дистрофина и клиническим проявлениям тяжелой классической дистрофии Дюшенна. Мутации с сохранением рамки считывания не препятствуют трансляции кодирующих последовательностей гена, что приводит к синтезу полуфункционального дистрофина; при этом развивается клиническая картина мышечной дистрофии Беккера. Даже в основе наиболее легкой формы с дебютом во взрослом возрасте, известной как миопатия четырехглавой мышцы, лежит аномалия молекул дистрофина.
Клинический спектр дистрофинопатий включает не только классические формы Дюшенна и Беккера, но и охватывает многочисленные заболевания, начиная от тяжелой мышечной дистрофии новорожденных до бессимптомных случаев у детей со стойким повышением уровня КФК в крови выше 1000 ЕД/л.
Отсутствие дистрофина приводит к вторичной редукции нескольких дистрофинассоциированных гликопротеидов в сарколемме, что вызывает потерю связи с экстрацеллюлярным матриксом и делает сарколемму более восприимчивой к некрозу. Дистрогликан, уровень которого часто снижается вторично при мышечной дистрофии Дюшенна, также необходим для нормального развития мозга, особенно для укрепления радиальной глии и образования межклеточных контактов. Для выявления дистрофина необходима мышечная биопсия. Дистрофии определяется путем вестерн-блоттинга или в материале биопсии с помощью иммуногистохимических методов окрашивания, флюоресцентной или световой микроскопии сыворотки с антителами к дистрофину.
При классической дистрофии Дюшенна уровень дистрофина составляет менее 3 % от нормального, при мышечной дистрофии Беккера молекулярная масса дистрофина снижена и составляет 20-90 % от нормальной у 80 % пациентов; у 15 % пациентов дистрофии имеет нормальный размер, но его количество снижено; у 5 % пациентов аномально крупный белок, что обусловлено избыточными дупликациями или повтором кодонов. Селективная иммунореактивность различных частей молекулы дистрофина при исследовании мышечного биоптата позволяет отличить формы Дюшенна и Беккера. Определение делеций и дупликаций возможно также при исследовании крови с помощью ПЦР, охватывающей 18 экзонов, что позволяет идентифицировать до 98 % делеций, однако этот метод не может обнаружить дупликации. Диагноз, таким образом, может быть подтвержден на молекулярно-генетическом уровне при исследовании мышечного биоптата или периферической крови, хотя у 1/3 мальчиков с мышечной дистрофией Дюшенна и Беккера исследование крови методом ПЦР дает ложноотрицательный (нормальный) результат. Все случаи дистрофинопатий диагностируются при мышечной биопсии.
Тот же метод ДНК-диагностики по анализу крови может применяться для выявления носителей среди женщин из группы риска, состоящих в родственных отношениях с больными с мышечной дистрофией, например у родных и двоюродных сестер пациентов. Это позволяет определить, является ли мать носителем или имеет место мутация de novo в эмбриональном периоде. Пренатальная диагностика возможна уже на 12-й неделе беременности: проводится биопсия ворсин хориона для ДНК-анализа с помощью саузерн-блоттинга или метода ПЦР. После аборта диагноз подтверждается у плодов с мышечной дистрофией при иммунохимическом анализе на дистрофии в мышцах.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Мышечная дистрофия Дюшенна-Беккера
Биохимическим маркером заболевания является повышенный (в 100-200) раз уровень креатинфосфокиназы (КФК) в крови. У носительниц поврежденного гена уровень КФК в среднем также несколько повышен.
Тип наследования мышечной дистрофии Дюшенна – Х-сцепленный рецессивный, т.е. им страдают почти исключительно мальчики, женщины же с поврежденным геном в одной из Х-хромосом являются носительницами МДД. Но в редких случаях миодистрофией Дюшенна могут болеть и девочки. Причинами этого могут быть преимущественная инактивация Х-хромосомы с нормальным аллелем у гетерозиготных носительниц мутантного гена DMD, Х-аутосомная транслокация, затрагивающая этот ген, гемизиготность по мутантному аллелю и наличие фенокопий (заболеваний, связанных с нарушением других белков, входящих в дистрофин-гликопротеиновый комплекс). Приблизительно в 2/3 случаев сын получает хромосому с повреждением от матери-носительницы, в остальных случаях заболевание возникает в результате мутации de novo в половых клетках матери или отца, либо в предшественниках этих клеток. Мышечная дистрофия Дюшена (МДД) встречается приблизительно у одного из 2500-4000 новорожденных мальчиков.
Ген DMD, ответственный за прогрессирующую мышечную дистрофию Дюшена/Беккера (МДД/МДБ), находится в локусе Хр21.2, имеет размер 2,6 млн п.н. и состоит из 79 экзонов. В 60% случаев мутации, приводящие к МДД/МДБ, представляют собой протяженные делеции (от одного до до нескольких десятков экзонов), в 30% случаев – точковые мутации и в 10% случаев – дупликации. Из-за наличия так называемых «горячих участков» делеций амплификация 27 экзонов и промоторной области гена DMD позволяет выявлять примерно 98% всех крупных делеций. Поиск точковых мутаций затруднен из-за большого размера гена и отсутствия мажорных мутаций.
В Центре Молекулярной Генетики проводится измерение уровня КФК в крови, а также прямая диагностика МДД/МДБ, представляющая собой поиск крупных делеций/lдупликаций во всех экзонах гена DMD и поиск «точковых» мутаций гена DMD методом NGS (next generation sequensing). Исследование методом NGS позволяет так же выявлять делеции всех экзонов гена DMD у больных мальчиков. Анализ всех экзонов гена позволяет определить точные экзонные границы делеции в сучае ее выявления, и таким образом, установить приводит ли данная делеция к сдвигу рамки считывания белка, что в свою очередь важно для прогноза формы заболевания - миодистрофия Дюшенна или Беккера. Таким образом, сочетание различных методов исследования позволяет выявлять практически все мутации гена DMD.
Наличие любого типа мутаций (делеции/дупликации в одном или нескольких экзонах, «точковые» мутации) является молекулярно-генетическим подтверждением клинического диагноза миодистрофии Дюшена/Беккера и позволяет проводить дородовую диагностику в данной семье.
Внимание! Для измерения уровня КФК кровь должна быть свежей (не замороженной)!
Нами разработаны наборы для ДНК-диагностики прогрессирующей мышечной дистрофии Дюшенна / Беккера. Наборы предназначены для использования в диагностических лабораториях молекулярно-генетического профиля.
При проведении пренатальной (дородовой) ДНК-диагностики в отношении конкретного заболевания, имеет смысл на уже имеющемся плодном материале провести диагностику частых анеуплоидий (синдромы Дауна, Эдвардса, Шерешевского-Тернера и др), пункт 54.1. Актуальность данного исследования обусловлена высокой суммарной частотой анеуплоидий - около 1 на 300 новорожденных, и отсутствием необходимости повторного забора плодного материала.
Генетика мышечных дистрофий Дюшенна и Беккера. Наследование, молекулярные основы
Подобно муковисцидозу, мышечная дистрофия Дюшенна давно привлекала внимание общества и медиков, поскольку это тяжелое, до настоящего времени неизлечимое, сравнительно частое заболевание с прогрессирующим клиническим течением. Выделение гена, поражаемого при данном Х-сцепленном заболевании, и описание нарушенного белка (названного дистрофином из-за связи с миодистрофией Дюшенна) дали понимание всех аспектов болезни, существенно улучшили генетическое консультирование отягощенных семей и позволили выработать новые подходы к лечению.
Клинический фенотип мышечной дистрофии Дюшенна
Пораженные мальчики здоровы в течение первых нескольких лет жизни, но в возрасте 3-5 лет развивается мышечная слабость, дети начинают испытывать трудности при подъеме по лестнице и при вставании из положения сидя. Ребенок к 12 годам становится инвалидом-колясочником и редко доживает до 20 лет.
Больные умирают от дыхательной или, поскольку также поражается мышца сердца, сердечной недостаточности. На доклиническом и раннем этапах болезни сильно повышается активность креатинфосфокиназы сыворотки крови (в 50-100 раз выше нормы) из-за выхода ее из пораженных мышц. Страдает также и мозг; происходит снижение IQ b среднем на 20 пунктов.
Мышечная дистрофия Беккера
Мышечная дистрофии Беккера также вызвана мутацией в гене дистрофина, но аллели Беккера приводят к значительно более мягкому фенотипу. Считают, что у пациента мышечная дистрофия Беккера, если он сохраняет способность ходить в возрасте 16 лет. Отмечена существенная изменчивость течения болезни, и некоторые пациенты остаются подвижными в течение многих лет. В общих чертах пациенты с миодистрофией Беккера несут мутант-ные аллели, поддерживающие рамку считывания белка, и, таким образом, экспрессируют некоторое количество дистрофина, хотя часто измененного и на малом уровне.
Присутствие дистрофина в мышцах пациентов с миодистрофией Беккера обычно можно обнаружить Вестерн-гибридизацией и иммунофлюоресценцией. В отличие от миодистрофии Беккера, у пациентов с миодистрофией Дюшенна дистрофии не обнаруживается ни одним методом.
Генетика мышечных дистрофий Дюшенна и Беккера
Миодистрофия Дюшенна встречается с частотой около 1 на 3300 живых новорожденных мальчиков, расчетный показатель мутирования 10-4, величина на порядок выше, чем в генах большинства других генетических болезней. Фактически, принимая скорость образования сперматозоидов 8х107 в день, нормальный мужчина производит сперматозоид с новой мутацией в гене миодистрофии Дюшенна каждые 10-11 с!
Ранее миодистрофия Дюшенна была представлена как типичное Х-сцепленное рецессивное заболевание, летальное у мужчин, при этом одна треть случаев обусловлена новыми мутациями, а две трети пациентов имеют мать-носительницу мутации. Подавляющее большинство женщин-носительниц не имеют клинических проявлений, хотя примерно у 70% несколько повышен уровень креатинкиназы сыворотки.
В связи со случайной инактивацией Х-хромосомы, тем не менее, у некоторых женщин гетерозигот нормальная Х-хромосома оказывается инактивированной в критической части клеток; около 19% взрослых женщин-носителей имеют некоторую мышечную слабость, а в 8% — жизнеугрожающие кардиомиопатии и серьезные нарушения работоспособности проксимальных мышц. В редких случаях у женщин описана миодистрофия Дюшенна; некоторые имели транслокации X на аутосому, другие только одну Х-хромосому (синдром Тернера) с мутацией миодистрофии Дюшенна в этой хромосоме, и небольшая группа представлена гетерозиготными монозиготными близнецами.
Миодистрофия Беккера составляет приблизительно 15% мутаций в локусе. Важное генетическое различие между этими аллельными фенотипами: если миодистрофия Дюшенна генетически летальна, способность к воспроизводству у мужчин с миодистрофией Беккера достаточно высока (около 70% нормы), чтобы они могли передавать свои гены дочерям. Следовательно, большая часть случаев миодистрофии Беккера унаследована, и только небольшая часть (около 10%) представлена новыми мутациями.
Ген миодистрофии Дюшенна и его продукт
Наиболее примечательная характеристика гена миодистрофии Дюшенна — его размер, оцениваемый в 2300 килобаз, или 1,5% длины Х-хромосомы. Этот огромный ген, подобно гену нейрофиброматоза I типа (NF1) и нескольким другим, находится в группе самых больших известных генов среди всех видов. Высокий показатель частоты мутаций, следовательно, может, по крайней мере частично, объясняться тем, что локус — большая цель для мутаций.
Ген миодистрофии Дюшенна структурно представляет комплекс из 79 экзонов и 7 тканеспецифичных промоторов с различными тканеспецифичными сплайсингами, зависимыми от стадии развития. В мышцах, первичном очаге болезни, большой транскрипт дистрофина (14 килобаз) кодирует огромный белок (427 килодальтон). В соответствии с клиническим фенотипом болезни этот белок в основном представлен в скелетных и сердечной мышце и мозге, хотя большинство тканей экспрессируют по крайней мере одну изоформу дистрофина.
Дистрофии — структурный белок, фиксирующий большой белковый комплекс к мембране клетки. Белковый комплекс дистрофина — настоящее созвездие полипептидов, связанных с генетически различающимися мышечными дистрофиями. Состав комплекса может значительно изменяться в зависимости от изоформ белка как самого дистрофина, так и других присутствующих компонентов, особенно саркогликанов. Комплекс дистрофина выполняет несколько основных функций. Во-первых, его считают существенным для поддержания целостности мышечной мембраны, связывая актиновый цитоскелет с внеклеточной матрицей.
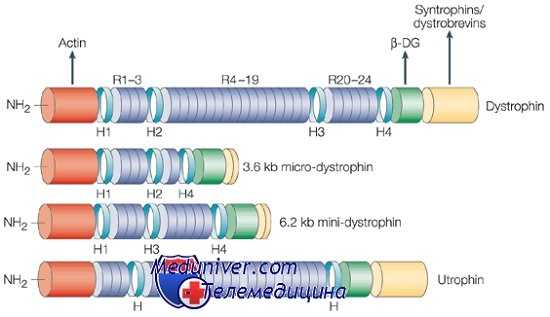
Во-вторых, он играет роль в позиционировании белков в комплексе, обеспечивая их правильное функционирование. Например, комплекс дистрофина необходим в нервномышечных синапсах для соответствующей кластеризации ацетилхолина в ходе развития. Комплекс может также содержать ионные каналы и сигнальные молекулы, что указывает на его возможное участие в опознавании субстратов или других клеток. Хотя функция многих белков в комплексе неизвестна, их ассоциация с болезнями мышц указывает, что они — существенные компоненты комплекса.
Таким образом мутации в некоторых белках комплекса гликопротеидов дистрофина ответственны за аутосомно-рецессивные формы Дюшенно-подобных мышечных дистрофий, пояснично-конечностные и другие мышечные дистрофии.
Посттрансляционная модификация комплекса дистрофина при мышечных дистрофиях Дюшенна и Беккера
Особый интерес представляют пять болезней, вызванных мутациями в гликозилтрансферазах, потеря функции любой из которых приводит к гипогликозилированию а-дистрогликана. То, что для посттрансляционной модификации одного полипептида необходимо пять белков, свидетельствует о значении таких модификаций для нормального функционирования большинства белков вообще и, в частности, о важности гликозилирования а-дистрогликана.
Молекулярный анализ мышечных дистрофий Дюшенна и Беккера
Наиболее частые молекулярные дефекты у пациентов с миодистрофией Дюшенна — делеции (60% аллелей). Распределение делеций в гене не произвольное; они концентрируются в одном из двух регионов в пределах гена, в 5'-половине или в центральном регионе, создающих «горячие точки» делеций. Механизм возникновения делеций в центральном регионе неизвестен, но он включает третичную структуру ДНК и в некоторых случаях рекомбинации между повторяющимися Alu-последовательностями в больших центральных интронах.
Точковые мутации составляют приблизительно треть аллелей и случайно распределены по всему гену.
Прогрессирующая мышечная дистрофия Дюшенна/Беккера
1. Polyakov A.V., Zaytseva S.P., Evgrafov O.V., Malygina N.A., Makarov V.B. DMD locus: some new data. // Human gene mapping 11. Abstracts.- 1991.- P.223.
2. А.В.Поляков, С.П.Зайцева, Евграфов О.В. Использование нерадиоактивно меченых ДНК-зондов для ДНК-диагностики миодистрофии Дюшенна. // Молек. генетика, микробиол. и вирусология.- 1991.- Т.5.- С. 21-23. [PubMed]
3. Евграфов О.В., Поляков А.В., Зайцева С.П., Виноградов С.В., Бахарев В.А., Мильман Ф.А., Лисова Т.А., Зарецкая Е.А., Малыгина Н.А., Бадалян Л.О., Макаров В.Б. Пренатальная диагностика модистрофии Дюшенна. // Молек. генетика, микробиол. и вирусология.- 1991.- Т.2.- С. 15-16. [PubMed]
4. Поляков А.В., Стрельченко Л.В., Пугачев В.В., Евграфов О.В. Использование полиморфизма локуса pERT87-1 для ДНК-диагностики миодистрофии Дюшенна. // 2-ой Всесоюзный симпозиум "Теоретические и прикладные аспекты молекулярной биологии", Самарканд. - 1991. - Тезисы докл. - С.156.
5. Макаров В.Б., Евграфов О.В., Поляков А.В., Зайцева С.П., Малыгина Н.А. МДД локус: некоторые новые данные. // IV Всесоюзная научная конференция "Экологическая генетика растений, животных, человека", Кишинев. - 1991. - Тезисы докл. - С. 510.
6. Поляков А.В., Евграфов О.В., Черников А.И., Макаров В.Б. Исследование 5' концевой последовательности гена дистрофина. // IV Всесоюзная научная конференция "Экологическая генетика растений, животных, человека", Кишинев. - 1991. - Тезисы докл. - С. 512.
7. Малышева О.В., Поляков А.В., Зайцева С.П., Малыгина Н.А., Горбунова В.Н., Евграфов О.В., Макаров В.Б., Красильников В.В., Баранов В.С., Бадалян Л.О. Анализ делеций в гене дистрофина методом мультиплексной амплификации у пациентов, страдающих миодистрофией Дюшенна. // Молек. генетика, микробиол. и вирусология.- 1992.- №5-6. - С. 27-31.
[PubMed]
8. Н.А.Малыгина, Л.О.Бадалян, П.А.Темин, Л.Н.Каменных, Н.Н.Заваденко, А.Л.Чухрова, А.В.Поляков, О.В.Евграфов. Делеции гена дистрофина у больных миодистрофией Дюшенна и Беккера: корреляция клинических проявлений с типом делеций. // VI Cъезд ВОГИС, Минск. – 1992. - Тезисы докл. - Ч.1. - С. 124.
9. Evgrafov O.V., Baranov V.S., Polyakov A.V., Malysheva O.V., Chuhrova A.L., Artem'eva O.V., Malygina N.A., Gorbunova V.N. Deletion screening of Duchenne muscular dystrophy patients in Russia: Unusual high frequency of deletions of 17 - 19 exons. // 24 Ann. Meeting of European Soc. Hum. Genet. Abstr. - 1992.- P. 69.
11. Evgrafov O.V., Baranov V.S., Polyakov A.V., Malysheva O.V., Chuhrova A.L., Artem'eva O.V., Malygina N.A., Gorbunova V.N., Makarov V.B. Deletion screening of Duchenne muscular dystrophy patients in Russia: unusual high frequency of deletions of 17 or 19 exons. // 4 Meeting of the Society of Human Genetics, Mains. Abstracts. - 1992.- P. 280.
12. Baranov V.S., Gorbunova V.N., Malysheva O.V., Artemyeva O.V., Kascheeva T.K., Evgrafov O.V., Polyakov A.V., Lebedev V.M., Kuznetsova T.V., Shlykova S.N., Mikhailov A.V., Vakharlovsky V.G. Dystrophin gene analysis and prenatal diagnosis of Duchenne muscular dystrophy in Russia // Prenatal diagnosis. - 1993. -Vol. 13, №5. - P.323 - 333.
[PubMed]
13. Chuhrova A.L., Polyakov A.V., Evgrafov O.V. A new approach to investigation of deletion breakpoints // 26th Annual Meeting of European Society of Human Genetics. - Paris. - 1994, June 1-5.
14. Комаpова Н.В., Чухpова А.Л., Дадали Е.Л., Ситников В.Ф., Евгpафов О.В. ДНК-диагностика миодистpофии Дюшенна // I (III) Съезд медицинских генетиков Pоссии. Тезисы. - 1994. - С . 31.
15. Чухpова А.Л., Поляков А.В., Евгpафов О.В. Новый подход к изучению pазpывов ДНК пpи делециях // I (III) Съезд медицинских генетиков Pоссии. Тезисы. - 1994. - С . 67.
16. Дадали Е.Л., Чухpова А.Л., Ситников В.Ф., Окунева Е.Г., Евгpафов О.В. Анализ взаимосвязи некотоpых клинических пpизнаков миодистpофии Дюшенна и делетиpованных участков гена дистpофина // I (III) Съезд медицинских генетиков Pоссии. Тезисы. - Москва. - 1994. - C. 19.
17. Чухpова А.Л., Малыгина Н.А., Поляков А.В., Зайцева С.П., Ситников В.Ф., Дадали Е.Л., Каменных Л.Н., Хpенников В.Ю., Бадалян Л.О., Евгpафов О.В. Скpининг делеций у больных миодистpофией Дюшенна методом мультиплексной амплификации // Цитология и генетика - 1994/ - Т.28, № 4. - С. 80-83.
[PubMed]
18. Чухpова А.Л., Поляков А.В., Малыгина Н.А., Дадали Е.Л., Евгpафов О.В. Каpтиpование делеций в гене дистpофина // Четвеpтая конфеpенция “Геном человека - 94”. Тезисы. - г.Чеpноголовка. - 9-11 маpта, 1994.
19. Комаpова Н.В., Чухpова А.Л., Дадали Е.Л., Ситников В.Ф., Евгpафов О.В. Пpименение ДНК-диагностики для пpофилактики миодистpофии Дюшенна-Беккеpа // Симпозиум “Пpофилактика неинфекционных заболеваний”. Тезисы. - Москва. - 1995.
20. Чухрова А.Л., Дадали Е.Л., Ситников В.Ф., Вассерман Н.Н., Евграфов О.В. (1996) Изучение распределения точек разрывов при делециях в гене дистрофина. V конф. “Геном человека-96”. Г. Черноголовка 15-18 января 1996. Тезисы докл. Стр. 72.
21. Артемьева О.В., Чухрова А.Л., Крапивская Е.Е., Малашенко А.М., Пахомова Е.А., Вассерман Н.Н., Дадали Е.Л., Баранов В.С., Евграфов О.В. (1996) Подходы к генотерапии миодистрофии Дюшенна. V конф. “Геном человека-96”. Г. Черноголовка 15-18 января 1996. Тезисы докл. Стр. 83-84.
22. Chuhrova A., Evgrafov O.V. (1996) Deletion pattern of Moscow’s patients with Duchenne/Bekker muscular dystrophy reveals some population specifity. 28 Ann. Meeting of European Soc. Hum. Genet. Abstr. P.61
23. Baranov V., Zelenin A., Tarasenko O., Kolesnikov V., Mikhailov V., Ivaschenko T., Kiselev A., Evgrafov O., Dickson G., Shafei R., Artemyeva O., Kascheeva T., Baranov A. (1997) Human dystrophin gene expression in skeletal muscles of mdx mice after ballistic transfection. ESHG conference, abstract, Medizinische Genetik 9(2): 135.
24. Zelenin AV, Kolesnikov VA, Tarasenko OA, Shafei RA, Zelenina IA, Mikhailov VV, Semenova ML, Kovalenko DV, Artemyeva OV, Ivaschenko TE, Evgrafov OV, Dickson G, Baranov VS (1997) Bacterial beta-galactosidase and human dystrophin genes are expressed in mouse skeletal muscle fibers after ballistic transfection. FEBS Lett;414(2):319-322.
[PubMed]
25. Баранов В.С., Тарасенко О.В., Баранов А.Н., Киселев А.В., Иващенко Т.Э., Евграфов О.В., Михайлов В.М., Диксон Дж. (1998) Экспрессия гена дистрофина человека в мышечных волокнах мышей mdx после трансфекции с помощью липосом и синтетических олигопептидов. Генетика 34: 876-882.
[PubMed]
26. Evgrafov O.V., Artemyeva O.V., Chuhrova A.L., Ivaschenko T., Hodgson S., Abbs S., Lindlof M., Bobrow M., Edwards J., Baranov V.S. (1998) Comparison of dystrophin gene deletion breakpoint, patterns in Russian and other European Duchenne/Becker muscular dystrophy patients. BJMG 1 (2): 54-59.
27. Grinchuk O., Evgrafov O., Khusnutdinova E. “The fine mapping of deletion breakpoints in the major deletion hotspot of the dystrophin gene in Duchenne muscular dystrothy patients from Bashkortostan” 2000, European Journal of Human Genetics, v.8, p.463.
28. Shokenova M., Lukasheva L., Evgrafov O. “ Expression of beta-galactosidase gene in different organs of mice mdx after intravenous injection of naked DNA and DNA-peptide complex” 2000, European Journal of Human Genetics, v.8, p.726.
29. Гринчук О., Евграфов О., Хуснутдинова Э. «Тонкое картирование делеционных точек разрыва в 3’-горячей области возникновения делеций в гене дистрофина», материалы 2(4) Российского съезда медицинских генетиков, Курск, 17-19 мая 2000 г., т.1, стр.99.
30. Дадали Е.Л., Поляков А.В., Комарова Н.В., Ба-рышникова Н.В., Чухрова А.Л. Диагностика и профилактика псевдогипертрофических вариантов прогрессирующих мы-шечных дистрофий // Вестник РГМУ, 2002, №4 (25), стр. 27-32.
31. Кривов Л.И., Стенина М.А., Ярыгин В.Н., Поляков А.В., Савчук В.И., Обрубов С.А., Комарова Н.В., Новая генетическая разновидность MDX мышей: исследование особенностей фенотипа // Генетика, 2009, N5, с. 557-561[PDF]
Прогрессирующая мышечная дистрофия Беккера
Прогрессирующая мышечная дистрофия Беккера — вариант наследственной сцепленной с Х-хромосомой миодистрофии, отличающейся более замедленным и доброкачественным течением. Заболевание характеризуется постепенно усугубляющейся и распространяющейся мышечной слабостью, гипотонией и атрофией, первоначально возникающей в мышцах бедер и тазового пояса. Диагностический поиск включает неврологическое обследование, консультацию генетика и кардиолога, нейрофизиологическое тестирование нервно-мышечного аппарата, ДНК диагностику, биопсию мышц с морфологическим, иммунологическим и гистохимическим изучением полученных образцов. Лечение симптоматическое и, к сожалению, малоэффективное. Прогрессирование болезни приводит к потери больными способности самостоятельно передвигаться к возрасту 40 лет.
Общие сведения
Прогрессирующая мышечная дистрофия Беккера впервые была описана в 1955 г. как доброкачественный вариант течения мышечной дистрофии Дюшенна. В последующем многочисленные исследования в области клинической неврологии, генетики и биохимии обнаружили существенные отличия в характере течения, биохимической и морфологической основе этих заболеваний. В результате клиническая форма Беккера была выделена как самостоятельная нозология.
Мышечная дистрофия Беккера входит в группу миопатий (миодистрофий) — заболеваний, возникающих вследствие нарушений строения и метаболизма мышечной ткани и проявляющихся мышечной слабостью. Патология наследуется рецессивно сцеплено с Х-хромосомой, поэтому болеют только лица мужского пола. Частота встречаемости составляет 1 новорожденный на 20 тыс. детей.
Причины
В основе заболевания лежит мутация в гене, ответственном за кодирование белка дистрофина. Примерно 30% от общего числа случаев мышечной дистрофии Беккера приходится на т. н. «свежие» мутации. Ген располагается в 21 локусе (в регионе Хр21.2–р21.1) короткого плеча Х-хромосомы. Примерно у 65-70% больных обнаруживаются крупные делеции указанного участка, у 5% - дупликации, у остальных — точковые мутации. Указанные структурные перестройки гена не влекут за собой полного прекращения синтеза дистрофина, как при дистрофии Дюшенна, а потенцируют синтез аномального усеченного белка, в некоторой степени способного выполнять свои функции. Это и обуславливает более доброкачественный характер дистрофии Беккера в сравнении с вариантом Дюшенна.
Патогенез
В норме белок дистрофин поддерживает целостность сарколеммы - мембраны миоцитов (мышечных волокон), обеспечивает эластичность и устойчивость миофибрилл при мышечном сокращении. Неспособность аномального дистрофина адекватно выполнять эти функции приводит к нарушению целостности мембран мышечных волокон. В следствие этого происходят дегенеративные изменения цитоплазматических компонентов последних и повышенная транспортировка ионов калия внутрь миоцитов. Результатом таких биохимических и морфологических сдвигов является гибель миофибрилл и разрушение мышечных волокон. На месте погибших миоцитов происходит образование соединительной ткани, что обуславливает феномен псевдогипертрофии — увеличение объема и плотности мышцы при резком снижении ее сократительной способности.
Симптомы
Прогрессирующая мышечная дистрофия Беккера манифестирует обычно в период от 10 до 15 лет, в некоторых случаях раньше. Начальными признаками заболевания выступают чрезмерная утомляемость и мышечная слабость в тазовом поясе и нижних конечностях. У ряда пациентов первыми проявлениями являются периодические болезненные мышечные судороги (крампи), локализующиеся в ногах. Мышечная слабость обуславливает затруднение при подъеме по лестнице, при необходимости встать из положения сидя. Со временем формируется переваливающаяся «утиная походка». Для того, чтобы встать, пациент вынужден использовать вспомогательные миопатические приемы — опираться руками о расположенные рядом предметы мебели или, при отсутствии таковых, использовать в качестве опоры собственное тело (симптом Говерса).
Как и другие наследственные миопатии, заболевание Беккера характеризуется симметрично развивающимися атрофиями мышц. В первую очередь поражаются мышцы бедра и тазового пояса, затем процесс распространяется на мускулатуру плечевого пояса и проксимальных мышц рук. В начале болезни формируются псевдогипертрофии, наиболее выраженные в икроножных, дельтовидных, трех- и четырехглавых мышцах. По мере прогрессирования миодистрофии они трансформируются в мышечные гипотрофии.
Клиническая картина мышечной дистрофии Беккера во многом сходна с миодистрофией Дюшенна. Усугубление мышечной слабости с течением времени приводит к обездвиженности пациента и формированию контрактур суставов. Однако развитие дистрофического процесса в мышечной ткани при дистрофии Беккера идет гораздо медленнее, что обуславливает длительную двигательную активность больных. В среднем пациенты сохраняют способность самостоятельно передвигаться до 35-40-летнего возраста. Кроме того, дистрофия Беккера не сопровождается олигофренией, выраженным искривлением позвоночника и другими скелетными деформациями. Возможна кардиомиопатия дилятационного или гипертрофического типа, блокада ножек пучка Гисса, но сердечно-сосудистые расстройства выражены умеренно. Может наблюдаться снижение либидо, гинекомастия, атрофия яичек, импотенция.
Диагностика
Прогрессирующая мышечная дистрофия Беккера диагностируется неврологом на основании анамнеза, клинических данных, дополнительных обследований и генетического тестирования. В неврологическом статусе наблюдается снижение мышечной силы и умеренное снижение мышечного тонуса в проксимальных отделах конечностей, выпадение коленных рефлексов при симметричном снижении сухожильных рефлексов дистальных отделов ног и верхних конечностей, полная сохранность чувствительности.
Среди клинических анализов наибольшее значение имеет биохимический анализ крови, который выявляет многократное повышение уровня КФК. Данные электронейрографии позволяют исключить поражение нервных волокон, электромиография свидетельствует о первично-мышечном типе поражения. Биопсия мышц проводится только после отрицательных результатов генетического анализа. Морфологическое исследование полученного материала определяет диффузную разнокалиберность, дистрофические и некротические изменения мышечных волокон, разрастание соединительной ткани. Проводится специальное иммунное окрашивание образцов с последующим определением наличия в них дистрофина.
Подтвердить диагноз мышечной дистрофии Беккера позволяет консультация генетика с проведением анализа ДНК. Выявление дупликаций или делеций в гене Хр21 дает возможность установить точный диагноз. Отрицательный результат анализа ДНК не говорит об отсутствии патологии, поскольку могут иметь место точковые мутации, поиск которых представляет собой сложную и более дорогостоящую процедуру.
С целью выявления сердечной патологии назначается электрокардиография, Эхо-КГ, консультация кардиолога. Кардиологическое обследование может обнаружить нарушение внутрижелудочковой проводимости, АВ-блокаду, дилатацию желудочков, гипертрофические изменения миокарда, кардиомиопатию, сердечную недостаточность.
Пренатальная диагностика рекомендована, когда мать является носителем патогенного гена. Если ребенок мужского пола, то вероятность развития заболевания у него составляет 50%. Биопсия хориона может проводиться в сроке 11-14 нед. беременности, амниоцентез — после 15-й недели, забор пуповинной крови (кордоцентез) — на сроке больше 18 нед.
Дифференциальная диагностика
Дифференциальная диагностика проводится с прогрессирующей мышечной дистрофией Дрейфуса, миодистрофией Дюшена, мышечной дистрофией Эрба-Рота, метаболической миопатией, полимиозитом и дерматомиозитом, воспалительной миопатией, спинальной амиотрофией, наследственной полиневропатией.
Лечение миодистрофии Беккера
На современном этапе несколькими группами ученых ведутся настойчивые исследования в области поиска эффективных методов лечения прогрессирующих миодистрофий. В настоящее время пациенты получают в основном метаболическую и симптоматическую терапию. Разработаны различные схемы лечения, позволяющие улучшить двигательные возможности больного и несколько замедлить прогрессирование болезни.
Терапия глюкокортикоидами используется для снижения скорости прогрессирование атрофии мышечной ткани. Пациентам назначают метаболические средства (витамины группы В, левокарнитин), витамин D и препараты кальция для профилактики остеопороза, β-адреноблокаторы и ингибиторы АПФ для предупреждения кардиомиопатии, диуретики при сердечной недостаточности.
Наблюдения показали, что постельный режим усугубляет мышечную слабость. Поэтому пациентам рекомендуется умеренная физическая активность, занятия плаванием. Поддержание мышечной эластичности и силы, а также профилактика контрактур проводится средствами массажа, физиотерапии и лечебной гимнастики. Применение различных ортопедических средств (ходунков, инвалидных колясок, фиксаторов для ног, экзоскелетов) позволяет расширить двигательные возможности пациентов и их способность к самообслуживанию. По показаниям проводится хирургическое лечение контрактур.
Прогноз и профилактика
Прогрессирующая мышечная дистрофия Беккера имеет неблагоприятный прогноз. Хотя обездвиженность у пациентов наступает гораздо позже, чем при дистрофии Дюшенна, в конечном итоге поражение сердечной мышцы и дыхательной мускулатуры приводят к гибели пациентов от сердечной или дыхательной недостаточности. Продуманный уход, адекватная терапия, вентиляционная поддержка дыхания, применение ортопедических средств могут лишь увеличить продолжительность и улучшить качество жизни пациента. Профилактика заключается в предупреждении рождения ребенка с патологией путем генетического консультирования будущих родителей и проведение пренатальной диагностики.
Читайте также:
- ДВС-синдром. Плазмаферез при ДВС-синдроме
- Показания для аксиального межтелового спондилодеза поясничного отдела позвоночника
- Сбор анамнеза при артериальной гипертензии ( АГ ).
- Диагностика и лечение апокринной аденокарциномы.
- Импедансная энцефалография. Транскраниальная ультразвуковая допплерография (ТКДГ)
