Генетика рака эндометрия. Какова наследственность?
Добавил пользователь Alex Обновлено: 24.01.2026
Родственник болен раком, ему сочувствуют и стараются помочь, и боятся за свою жизнь — вдруг тоже заболею. Наследственных злокачественных опухолей немного, из всей многомиллионной когорты больных онкологией всего лишь 3% — 10% стали заложниками передающихся из поколения в поколение недоброкачественных мутаций генов.
Подавляющее большинство онкологических больных становятся жертвами случайных генетических мутаций, к которым могли привести некоторые вирусные инфекции, курение и избыток ультрафиолета. Поэтому вопрос «заболею ли я» следует обратить только к себе и срочно предпринять усилия для изменения образа жизни, сделав насущной потребностью регулярное обследование.
Рак у нескольких поколений семьи всегда наследственный?
Почти 90% страдающих тяжелой онкологической патологией «выковали» её своими нездоровыми привычками, а семейная история со злокачественными процессами в каждом поколении всего лишь совпадение. Как правило, и в этом случае не отрицается предрасположенность к злокачественным процессам, в биогенетическом субстрате которой учёные пока не разобрались, но и не отвергают. То есть гены рака не передаются, но от предков достается легкость трансформации генов с дефектами удаления недоброкачественных мутаций.
Не отрицается и предрасположенность целых народов к злокачественным опухолям определенной локализации. Как считается, способствуют этому устойчивые пищевые привычки, потому что смена образа жизни, к примеру, эмиграция в другую страну, полностью избавляет от «проклятия» следующее поколение семьи.
Невозможно заразиться раком от болеющего родственника — это миф. Легко заразиться вирусными заболеваниями, приводящими к развитию злокачественной опухоли в поражённом возбудителем органе — вирусы гепатитов и папилломы человека инфицируют при половом контакте и через кровь. Если близкий человек хронический носитель ВПЧ, вирусов гепатита В и С, ВИЧ, то опасен контакт с его кровью и биологическими жидкостями, при этом не всегда развиваются злокачественные процессы, для этого требуется очень продолжительный период времени, при гепатите С — почти 40 лет.
Какие злокачественные опухоли наследуются?
Список наследственных заболеваний и синдромов, осложняющихся злокачественными процессами, известен. Это синдром Линча и семейный аденоматоз толстого кишечника (САТК), последний практически у всех носителей мутаций гарантирует рак толстой кишки. При синдроме Линча вероятность рака весьма высока, но локализоваться опухоль может в разных органах: кишечнике, желудке, мочевом пузыре, матке, яичниках, головном мозге. Причём вероятность рака вариабельна: в кишечнике 75%, в матке чуть больше 30%, в остальных органах в разы реже.
Известны обещающие рак молочной железы, толстой кишки и яичников мутации генов BRCA, компьютерная программа может рассчитать примерную вероятность развития заболевания, но без 100% гарантии результата. Среди всех больных раком молочной железы наследственный процесс занимает долю не более 5%.
Синдром Ли-Фраумени с высокой вероятностью и часто уже в детстве приводит к развитию разнообразных злокачественных процессов, кроме частых при спонтанных мутациях карциномах желудка, молочной железы или лейкоза, развиваются и очень редко встречающиеся опухоли надпочечника и саркомы.
Злокачественное поражение глаза у детей— ретиносаркома в 40% всех случаев обусловлена наследованием, также и нефробластома — опухоль почки, но её наследственная форма встречается на порядок реже, в подавляющем большинстве случаев болезнь обусловлена аномалиями внутриутробного развития.
Как выявляют раковую наследственность?
Наследственные раки выявляют методом «от противного», то есть обследуют близких родственников онкологического пациента, у которого была обнаружена определённая мутация. Получается, что наблюдаются и лечатся не все носители неблагоприятной наследственности, а только активно выявленные родные уже заболевшего человека. Нельзя сказать, что выявляют 100% наследственных заболеваний, потому что генетический анализ проводят не всем онкопациентам, а только при ярких клинических проявлениях наследственных синдромов.
Такую диагностику по собственной инициативе прошла Анджелина Джоли, в России этот подход закреплен нормативными документами и клиническими рекомендациями, обязывающими проводить бесплатное генетическое тестирование прямых родственников носителей синдрома Линча, Ли-Фраумени, САТК, BRCA и другими.
Носители онкогенных мутаций должны состоять на диспансерном учете, часто и тщательно обследоваться. Как правило, каждые полгода проводится клинический осмотр, УЗИ и анализы, ежегодно выполняется МРТ по «опасным» анатомическим зонам. При синдроме Ли-Фраумени эндоскопия кишечника проводится каждые 2-3 месяца, некоторым носителям уже в молодом возрасте проводят обширные профилактические хирургические вмешательства вплоть до удаления всего кишечника.
Как обследоваться здоровым родственникам онкобольного?
При доказанном носительстве злокачественной наследственности такого вопроса возникать не должно, пациент всю жизнь следует определенной программе диагностики и прикрепляется к государственному лечебному учреждению.
Подавляющее большинство родственников 95% больных раком должны проходить регулярный скрининг на злокачественные процессы, включённый в стандартную программу диспансеризации, которая предполагает обследование каждые 3 года.
Для своевременного выявления злокачественных процессов женщинам необходимо:
- каждые 2 года выполнять УЗИ молочных желез или маммографию;
- при исходной патологии груди целесообразна МРТ молочных желез;
- ежегодно осматриваться гинекологом с применением кольпоскопии и взятием Пап-теста.
Для мужчин важен уровень ПСА и чем старше, тем чаще его определяют, разумеется с урологическим осмотром.
Вне зависимости от половой принадлежности ежегодно следует проходить:
- Рентгенографию органов грудной клетки, часто в государственных учреждениях подменяемую вредной и бесполезной флюорографией, при том что идеальное обследование легких — только КТ, именно она способна выявить ранний рак.
- УЗИ брюшной полости и органов малого таза специальными датчиками.
- Колоноскопию с интервалом в соответствии с возрастом и имеющимися заболеваниями кишечника.
- Гастроскопию с анализами на хеликобактер можно делать и реже, и чаще в зависимости от наличествующей патологии.
Анализ на опухолевые маркеры не применяется для профилактической диагностики, используется только для контроля динамики и эффективности лечения рака.
Большое значение придается диагностическому оборудованию, оно должно быть не просто современным, а высокоточным. Не разумно каждый год проходить КТ или МРТ в разных учреждениях, разрешающая способность аппаратуры может существенно отличаться, не позволяя ни увидеть патологии, ни сравнить прошлую картину с настоящей.

Польза регулярного обследования нивелируется некачественным его выполнением, поэтому желательно проводить профилактический осмотр в специализированных онкологических учреждениях, где делаются тысячи таких исследований, а врачи не только прошли обучение, но и имеют богатый клинико-диагностический опыт.
Высокопрофессиональное онкологическое обследование — неотъемлемая характеристика «Евроонко», мы успешно лечим злокачественные процессы и умеем видеть опухоль на ранней стадии роста. Мы знаем, что ещё необходимо приложить к отлично проведенному обследованию, чтобы долго жить и не бояться рака.
Генетика рака эндометрия. Какова наследственность?
Рак эндометрия (РЭ) — самое распространенное онкологическое заболевание женских половых органов в США. Чаще других встречаются три гистологических варианта: аденокарцинома, серозно-папиллярный и светлоклеточный рак. В этиологии РЭ прослеживается выраженный наследственный компонент, например связь с синдромом Линча II типа. Подсчитано, что около 6 % всех случаев РЭ обусловлены наследственными причинами. Большинство больных наследственным РЭ — выходцы из семей, страдающих ННПКРР.
Аденокарцинома — наиболее частый гистотип, встречающийся примерно в 70 % случаев рака эндометрия (РЭ). Выделяют два патогенетических варианта при аденокарциноме эндометрия. Предраковым предшественником аденокарциномы I типа служит гиперплазия эндометрия; злокачественный процесс развивается на фоне ожирения и/или приема эстрогенов. Аденокарцинома II типа возникает в условиях атрофического эндометрия.
Серозно-папиллярная аденокарцинома — особо агрессивная опухоль, часто развивающаяся на фоне гиперплазии эндометрия.
Молекулярные изменения, приводящие к развитию рака эндометрия (РЭ), изучены недостаточно. Несколько исследований выявило утрату гетерозиготности в различных участках генома. Это стало причиной поиска гснов-супрессоров в этих областях. Обнаружены делеции на участках 3р, 10q, 17р и 18q. При серозно-папиллярном раке часто определяют делеции в области 1р.
В небольших исследованиях обнаружены повреждения онкогенов, например ras, K-ras, c-fms и с-erb-1, которые могут играть роль в развитии и прогрессии рака эндометрия (РЭ). Okamoto и соавт. исследовали генетические нарушения в 24 аденокарциномах эндометрия и выявили утрату гетерозиготности в 7 случаях, в 5 из которых отсутствовал локус на коротком плече хромосомы 17 (17р), где находится ген ТР53. Risinger и соавт. исследовали 21 случай рака эндометрия (РЭ) и обнаружили точечные мутации гена ТР53 в 3 (14 %) из них.
Рак эндометрия (РЭ) часто развивается у больных ННПКРР (синдром Линча типа II), что указывает на возможность участия одного и того же гена в развитии обоих заболеваний.
Поскольку прослеживается взаимосвязь рака эндометрия (РЭ) с ННПКРР, при котором выявляют дефекты репарации ДНК, многие исследователи изучали функции именно этой системы при РЭ и в 20—25 % случаев определили микросателлитную нестабильность. Однако мутации известных генов системы репарации ДНК (MSH2, MLH1, MSH3, PMS2, PMS1) обнаружены в малом проценте случаев. Система репарации ДНК подвержена метилированию промоторного региона MLH1, что ведет к его инактивации.
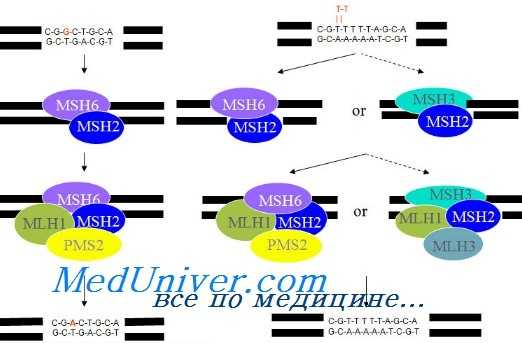
Генетика наследственного неполипозного колоректального рака (ННПКРР)
Интересно отметить, что существует полиморфизм системы репарации ДНК, отличающийся у представителей разных рас. Приблизительно у 6 % больных РЭ выявлены наследственные мутации генов репарации ДНК, которые могут быть первичными по крайней мере в одном из этих генов. Первичная мутация может локализоваться в половых клетках и, следовательно, определять наследственную форму РЭ. Какужеупоминалось, выявлены полиморфизмы, характерные для определенных рас. Kowalski идентифицировал 8 вариантов генов MLH1 или MSH2, наблюдаемых исключительно у чернокожих женщин.
Это может объяснять известные различия в выживаемости белых женщин и чернокожих со злокачественными опухолями и требует более подробного исследования. Кроме того, такие отличия важны для определения прогноза заболевания в различных группах пациентов. Можно было бы ожидать повышенную частоту мутаций онкогенов или опухолевых супрессоров в новообразованиях с нарушениями системы репарации ДНК, однако часто это оказывается не так, что демонстрирует неслучайность генетических мутаций.
Выявлено несколько опухолевых супрессоров, связанных с развитием злокачественных опухолей эндометрия. Гиперэкспрессия белка р53 или явные дефекты гена ТР53 обнаружены в 5—50 % случаев аденокарцином эндометрия. При гиперплазии эндометрия эти нарушения встречаются реже, что наводит на мысль о том, что мутации р53 — позднее событие в патогенезе рака эндометрия (РЭ). Частота мутаций ТР53 связана с морфологическим вариантом рака эндометрия (РЭ). В большинстве серозных опухолей матки выявляют мутации ТР53.
В то же время частота мутаций при аденокарциномах эндометрия значительно ниже. Эта связь между частотой мутаций и гистотипом опухоли может отчасти объяснить расовую предрасположенность чернокожих к раку эндометрия (РЭ). Экспрессия р53 может сопровождаться неблагоприятным прогнозом. Интересно отметить, что экспрессия р53 обратно пропорциональна экспрессии Bcl-2; мутации р21 и р185 также связаны с РЭ.
В нескольких исследованиях выявлена утрата гетерозиготности на хромосоме 10. В области 10q23—10q24 обнаружен ген-супрессор PTEN (гомолог фосфатазы и тензина); его мутации часто происходят при РЭ. PTEN кодирует цитоплазматическую фосфатазу белков и липидов, главным субстратом которой служит фосфатидилинозитол-(3,4,5)-трифосфат (PIP-3). Накопление PIP-3 в клеточной мембране ведет к активации белков серин-треониновых киназ семейства Akt. Активация Akt, в свою очередь, оказывает влияние на выживаемость клеток, зависящую от уровня апоптоза и регуляции других генов. Мутация PTEN — раннее явление в патогенезе РЭ.
Экспрессия PTEN отсутствует в большинстве аденокарцином эндометрия, а также аномально пролиферирующих железах. Интересно, что мутации PTEN чаще выявляют на ранних стадиях заболевания. Прогностическая ценность мутаций PTEN и/или отсутствие экспрессии этого гена при РЭ, а также связь этих факторов с расовой принадлежностью, стадией и степенью злокачественности непонятны. Возможно, существует связь между инактивацией PTEN и дефектами системы репарации ДНК (фенотип микросателлитной недостаточности). Утраты других регионов на длинном плече хромосомы 10 не связаны с геном PTEN и могут содержать другие опухолевые супрессоры.
К онкогенам, связанным с раком эндометрия (РЭ), относится K-ras, мутации которого наблюдаются в 10—30 % случаев, причем, согласно предварительным данным, их считают ранним событием в патогенезе. Мутации K-ras при аденокарциномах встречаются чаще, чем при серозной опухоли. Ген HER-2/neu также связан с опухолями эндометрия; при этих новообразованиях возможна его гиперэкспрессия или амплификация; активация этого гена указывает на неблагоприятный прогноз. Молекулярные изменения, связанные с РЭ, интенсивно изучаются рядом исследовательских групп, и ожидается, что в ближайшие несколько лет представления об этиопатогенезе этого заболевания значительно прояснятся.
Геномные исследования рака эндометрия (РЭ) начаты совсем недавно; для этого используют и мышиные модели этого заболевания. Анализ генетических изменений при рак эндометрия (РЭ) с помощью биочипов обозначил ключевые молекулярные различия между аденокарциномами и другими, более агрессивными серозными гистотипами. Недавно Ferguson и соавт. выявили молекулярные особенности, указывающие на исход заболевания. Быстрый прогресс в изучении молекулярных нарушений при злокачественных опухолях эндометрия ведет к разработке новых методов их профилактики, диагностики и лечения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Передается ли рак по наследству
Злокачественные опухоли не наследуются, как цвет глаз, группа крови или такие генетические заболевания, как некоторые формы гемофилии. Поэтому если рассматривать вопрос «передается ли рак по наследству» в бытовом, общеупотребительном смысле, то короткий ответ здесь — «нет».
Однако генетика играет свою роль в вероятности возникновения онкологической патологии. О том, что это за роль и насколько сильное значение имеют наследственные факторы, расскажем в данной статье.
Какова вероятность заболеть раком, если им болели родственники

Для всех онкологических заболеваний назвать какую-то конкретную цифру в целом не получится. Да, можно с определенной достоверностью утверждать, что если в семейной истории болезни были эпизоды онкологических патологий, то и у вас риск их появления выше, чем у людей без такой наследственности.
Однако как утверждают специалисты Национального института рака США, около 95-97% случаев онкологических заболеваний — это так называемые спорадические, то есть случайные патологии. Основную роль в их возникновении играют внешние факторы:
- курение;
- малоподвижный образ жизни;
- воздействие химических, физических и биологических канцерогенов;
- излишняя масса тела и т.д.
Лишь для 3-5% злокачественных опухолей получается обнаружить специфическую связь с наследственностью. Тем не менее такие ситуации имеют место, поэтому рассмотрим их подробнее.
Хотите мы вам перезвоним?
Какие злокачественные опухоли наследуются
Специалисты-онкологи выделяют ряд генетических нарушений, которые могут передаваться по наследству и связаны с высоким риском развития опухоли. Их объединяют общим названием «синдромы семейного рака». К ним относятся:
- анемия Фанкони;
- семейный аденоматозный полипоз;
- наследственный рак яичников и/или молочной железы;
- наследственный неполипозный рак толстой кишки;
- наследственная феохромоцитома;
- синдром Ли-Фраумени;
- болезнь вон Хиппеля-Линдау;
- пигментная ксеродермия;
- полипоз, ассоциированный с мутацией гена MUTYH;
- невоидная базальноклеточная карцинома и др.
Всего выделяют более 50 патологий, при которых можно говорить, что предрасположенность к онкологии передается по наследству. Однако такие генетические заболевания довольно редки. Согласно статистике ВОЗ, носители всех известных подобных хромосомных поломок составляют не более 0,3% населения планеты.
Как выявляют неблагоприятную наследственность

Для этого существуют два довольно надежных способа:
По сути, это составление истории болезни семьи. Если у кого-то из родственников было обнаружено одно из вышеперечисленных нарушений, то с определенной точностью можно рассчитать вероятность его «наследования» вами или вашими детьми.
Важно помнить, что одну общую цифру для всех синдромов семейного рака назвать нельзя. Они связаны с разными генетическими поломками, а потому и наследоваться могут очень по-разному, например, в зависимости от пола человека.
Это молекулярно-генетический анализ, в ходе которого проверяют целостность хромосомного материала. Ведь раз вышеперечисленные заболевания наследуются, это означает, что причина их — в каком-то специфическом изменении одного или нескольких генов. Такие изменения вполне можно обнаружить современными методами лабораторной диагностики.
Как снизить вероятность заболеть раком при неблагоприятной наследственности
Хоть сам рак и не передается по наследству от матери или отца, повышенная вероятность возникновения новообразования может быть связана с генетическими дефектами. А значит люди, чьи родственники имеют такие семейные «прецеденты», находятся в группе риска. Следовательно, им необходимо принимать специальные меры профилактики, чтобы свести риск развития опухоли к минимуму.
В первую очередь, придется точно определить, какое именно наследственное заболевание присутствует в семье. Это могут сделать генетики, составив карту наследственности. Во-вторых, методом исследования генетического материала можно определить, унаследовали вы это нарушение или нет. Кстати, вполне может оказаться, что та мутация, которая дает повышенный риск развития рака и имеется у родственника, отсутствует у вас.
Если же вы окажетесь носителем данного хромосомного изменения, это должно стать поводом к более внимательному отношению к своему здоровью. Профилактические обследования нужно будет проходить чаще и начинать делать это намного раньше — фактически сразу после выявления генетической предрасположенности вне зависимости от возраста.
Скрининговые обследования единственный способ выявить онкологическое заболевание на самой ранней стадии развития, когда шансы на излечение максимальны.
Какие гены повышают риск рака матки?
Ученые проанализировали данные 149 исследований и выявили 24 генетических варианта, которые повышают риск развития рака матки.
Систематический обзор был проведен профессором Эммой Кросби (Emma Crosbie) из Манчестерского университета (University of Manchester). Результаты опубликованы в Журнале медицинской генетики (Journal of Medical Genetics), есть надежда, что они помогут разработать эффективные меры профилактики и скрининга для женщин, у которых повышен риск рака эндометрия.
В России, по данным за 2018 год, злокачественные опухоли тела матки находятся на втором месте по распространенности среди онкологических заболеваний у женщин, уступая только раку кожи. Известны многие факторы риска, включая ожирение, нарушения гормонального фона (в том числе прием гормональных препаратов), возраст, большое количество жиров в рационе, сахарный диабет II типа.
Считается, что в большинстве случаев рак эндометрия возникает спорадически и связан с образом жизни, внешними факторами. Но, конечно же, присутствует и наследственный компонент. Гены в клетках тела женщины могут быть представлены разными вариантами, и определенные их наборы способны повышать вероятность развития заболевания.
Роль однонуклеотидных полиморфизмов
Генетический код в виде молекул ДНК состоит из «букв» — азотистых оснований. Они составляют «слова», каждое из которых кодирует структуру определенного белка или выполняет другие функции. Иногда в этих «словах» встречаются «опечатки» — однонуклеотидные полиморфизмы (single-nucleotide polymorphism — SNP)
. Сами по себе они не приводят к порокам развития и заболеваниям, но могут менять активность генов, нарушают регуляцию их функции, приводят к появлению белков, которые работают не совсем правильно.
В геноме человека встречается около 10 миллионов однонуклеотидных полиморфизмов. Ученые из Манчестерского университета решили разобраться, какие из них способствуют развитию рака тела матки.
Авторы работы отобрали 149 научных публикаций и выявили 24 генетических варианта, связанных с повышенным риском злокачественных опухолей эндометрия. Среди них такие SNP, как KLF, HNF1B, CYP19A1, EIF2AK, MYC и SOX4.
Эмма Кросби отмечает:
Многие исследования, проведенные к настоящему времени, были разного качества, и мы решили, что важно более детально разобраться в генетической предрасположенности к раку эндометрия.
Мы надеемся, что наша работа поможет в индивидуальной оценке рисков, повышении эффективности профилактики и скрининга.
Данные генетические варианты, повышающие риск развития рака тела матки, связаны с поддержанием жизнедеятельности клеток, контролем транскрипции, обменом эстрогенов.
Каждая из перечисленных в этой работе SNP — лишь капля в море, она повышает риск развития рака матки очень незначительно. Но их эффекты суммируются, и это отражает специальная оценка полигенного риска. Если она составляет более 1%, то вероятность развития заболевания у женщины в 3,16 раза выше, чем в среднем.
В настоящее время не существует специальных скрининговых исследований для выявления рака тела матки, которые были бы рекомендованы для всех женщин. Но, если женщина входит в группу повышенного риска, она нуждается в более тщательном наблюдении со стороны гинеколога. В ряде случаев могут быть рекомендованы ежегодные обследования с биопсией эндометрия. Возможно, дальнейшее исследование SNP поможет выделить новые группы риска, чтобы принять по отношению к этим женщинам дополнительные меры профилактики и ранней диагностики.
Рак эндометрия (рак тела матки) - симптомы и лечение
Что такое рак эндометрия (рак тела матки)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Ильина Антона Алексеевича, онколога-гинеколога со стажем в 13 лет.
Над статьей доктора Ильина Антона Алексеевича работали литературный редактор Вера Васина , научный редактор Сергей Федосов и шеф-редактор Маргарита Тихонова
Определение болезни. Причины заболевания
Рак эндометрия (endometrial cancer) — это злокачественная опухоль, которая развивается из клеток внутреннего слоя матки. Основным симптомом, который появляется уже на начальной стадии болезни, являются кровянистые выделения из половых путей.
Рак эндометрия ещё называют раком тела матки и аденокарциномой эндометрия.
Распространённость
Рак эндометрия — это самая частая злокачественная опухоль женских половых органов. Но если болезнь выявлена своевременно и проведено адекватное лечение, большинство пациенток выздоравливает [1] .
В основном раком эндометрия заболевают женщины в постменопаузе: более 90 % случаев диагностируются после 50 лет. Чаще всего болезнь встречается среди пациенток в возрасте 65–69 лет — заболеваемость среди них составляет 98,1 на 100 тыс. женщин. Средний возраст на момент начала болезни — 63 года. До 49 лет рак эндометрия встречается относительно редко: в 4–5 % от всех случаев [11] .
Факторы риска
Около 5 % случаев рака эндометрия имеют наследственный характер. Злокачественная опухоль эндометрия может развиться при наследственном неполипозном колоректальном раке (синдроме Линча) [12] . Болезнь возникает из-за поломки генов MLH1, MSH2, MSH6 или PMS2. При таких мутациях риск развития рака эндометрия и колоректального рака составляет 24–51 %, рака яичников — 11–15 % [13] .
Помимо генетической предрасположенности, на заболеваемость влияют следующие факторы:
- лишний вес (риск развития рака эндометрия повышается в 1,32 раза); (в 2,54 раза); (в 2,1 раза);
- раннее начало и позднее прекращение менструаций: до 10–12 и после 55 лет (в 2,1 раза); (в 2,9 раза);
- приём Тамоксифена — гормонального препарата для лечения рака молочной железы (в 2,5 раза);
- монотерапия эстрогенами более пяти лет (в 10–30 раз); ;
- лучевая терапия на органы малого таза.
Ожирение является одним из основных факторов риска. Жировая ткань преобразует в эстрогены другие гормоны — андрогены. Если уровень эстрогенов значительно повышен, то риск развития опухолей эндометрия также увеличивается. Получается, чем больше жировой ткани, тем выше вероятность заболеть раком эндометрия.
Тамоксифен — это препарат, который используется при лечении рака груди. В ткани молочной железы он действует как антиэстроген, но в матке механизм действия иной, аналогичный гормону эстрогену. При лечении Тамоксифеном рекомендуется ежегодно наблюдаться у гинеколога.
При синдроме поликистозных яичников значительно повышается уровень андрогенов и эстрогена, а также снижается уровень прогестерона. Изменение соотношения эстрогена и прогестерона является одной из основных причин развития рака эндометрия.
Предшествующая лучевая терапия. Радиация используется для лечения некоторых типов опухолей. При облучении сложно, а иногда невозможно не затронуть смежные органы. Радиация повреждает ДНК здоровых тканей и может приводить к развитию рака в прежде здоровых органах.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы рака эндометрия
Эффективных программ скрининга рака эндометрия пока не существует. Единственный способ обнаружить заболевание на ранней стадии — это ежегодно посещать гинеколога. Также к доктору нужно обратиться, если болит низ живота или появились кровянистые выделения из половых путей между менструациями или в постменопаузе. Кровянистые выделения при раке эндометрия встречаются у 90 % пациенток. Чаще всего выделения слабые или умеренные, их характер зависит от распространения опухоли.
Признаком злокачественной опухоли также может быть изменение характера выделений, даже без примеси крови [2] . Боль, потеря веса и тяжесть в животе появляются уже на поздних стадиях болезни.
Патогенез рака эндометрия
Матка состоит из двух частей: тела и шейки. В теле матки выделяют три слоя:
- наружный — серозная оболочка;
- средний — миометрий, или мышечный слой;
- внутренний — эндометрий, который частично отторгается вместе с кровью при каждой менструации.
Аденокарцинома развивается непосредственно из эндометрия.
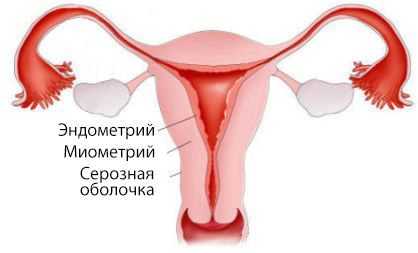
В 1963 году была предложена и обоснована теория о двух основных типах аденокарциномы матки. Первый вариант наблюдается у 60–70 % пациенток и протекает с нарушениями углеводного и жирового обмена на фоне избыточного количества эстрогенов [14] [15] . Женщины с этим типом рака страдают маточными кровотечениями, бесплодием, ожирением и сахарным диабетом. У них поздно наступает менопауза и развиваются гиперпластические процессы в эндометрии (качественно-количественное изменение его клеток).
Второй патогенетический вариант болезни встречается у 30–40 % пациенток. У них описанные выше нарушения выражены слабо или отсутствуют [14] [15] . Изменения в эндометрии носят атрофичный характер, развиваются полипы, атипическая гиперплазия и рак.
Отнести заболевание к первому типу можно в следующих случаях:
- присутствует более половины перечисленных признаков;
- симптомы гиперэстрогении (болезненные менструации и маточные кровотечения вне их) сочетаются с обменными нарушениями, например с ожирением и сахарным диабетом.
Согласно другому разделению, к первому типу рака эндометрия относят эндометриоидный рак, ко второму — неэндометриоидный (серозный или светлоклеточный). Они встречаются в 80–90 % и 10–20 % случаев соответственно [3] . Такое разделение связано с различиями в молекулярном профиле опухолей, методах лечения и прогнозе.
Чаще всего раковые опухоли образуются из-за повреждения гена-супрессора PTEN, который подавляет развитие и рост раковых клеток. Данная аномалия встречается у 83 % пациенток с раком эндометрия [4] .
Болезнь также может развиваться при поломке в системе репарации (т. е. исправления) ошибок спаривания нуклеотидов. Эта система отвечает за важный этап нормального деления здоровых клеток. Рак эндометрия первого типа, как правило, связан с мутациями в генах KRAS и CTNNB. Второй тип часто протекает на фоне хромосомной нестабильности, генетических расстройств и мутации в гене р53.
Классификация и стадии развития рака эндометрия
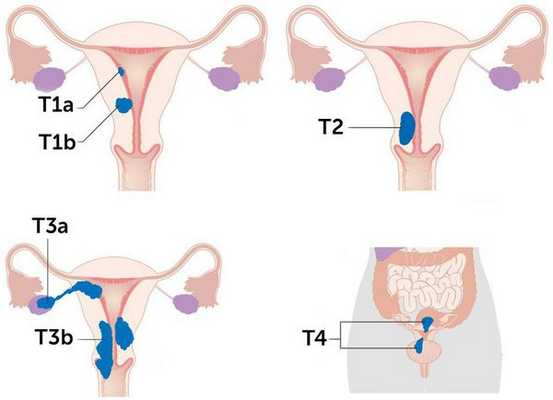
В онкологии существуют две системы TNM, т. е. стадирования рака — FIGO (International Federation of Gynecology and Obstetrics) и AJCC (American Joint Committee on Cancer). Обе системы используют следующие ключевые параметры для описания рака и установки стадии:
- размер опухоли (Tumor);
- наличие или отсутствие опухоли в лимфатических узлах (Node);
- наличие или отсутствие метастазов опухоли (Metastasis) [5] .
Исходя из этих признаков, выделяют четыре основные стадии. Чем меньше стадия, тем лучше прогноз. Рак обычно стадируется дважды. Первый раз — до лечения, такое стадирование называется клиническим. Второй раз — после операции, такое стадирование называется патологоанатомическим и считается более точным и окончательным. Со временем опухоль может расти или распространяться на органы, в которых её раньше не было, а также повторно развиваться после полного излечения. В этом случае стадия, установленная однажды, меняться не будет.
Стадии рака эндометрия по системе TNM
Более схематично стадии рака эндометрия отражены на рисунке:
Согласно международной гистологической классификации рака тела матки, выделяют несколько видов опухолей:
- Злокачественные эпителиальные опухоли. В эту группу входят различные виды рака, среди которых эндометриальная аденокарцинома, серозный и светлоклеточный рак.
- Злокачественные смешанные эпителиальные и мезенхимальные опухоли — аденосаркома и карциносаркома.
- Мезенхимальные опухоли — леймиосаркома, эпителиоидная и миксоидная леймиосаркома, эндометриальная стромальная саркома низкой и высокой степени злокачественности.
Лучший прогноз имеет эндометриоидная форма, худший — серозная и светлоклеточная, но основным прогностическим критерием является стадия заболевания. Например, выживаемость с IV стадией эндометриоидного рака ниже, чем с I стадией светлоклеточного.
Рак тела матки также классифицируется на основании вида клеток, из которых он развился. Чтобы установить разновидность рака и его дифференцировку, исследуются удалённые органы или их части. Тип опухоли устанавливает эксперт-патолог, работающий с тканями под микроскопом.
Дифференцировка — это схожесть раковой клетки со здоровой. Она отражает, насколько быстро опухоль может расти и распространяться. Описаны три степени дифференцировки: G1, G2, G3, где G3 — самая неблагоприятная с быстрым ростом опухоли. Сейчас чаще выделяют только два класса: низкой злокачественности (low grade) и высокой (high grade). Low grade включает G1 и G2, a high grade — G3.
Осложнения рака эндометрия
Без специализированного лечения рак эндометрия неизбежно прогрессирует: боль и кровотечение из половых путей усиливаются, мочевой пузырь и прямая кишка сдавливаются, их функции нарушаются. У пациенток учащается мочеиспускание и стул либо, наоборот, возникают запоры.
Если опухоль проросла в мочевой пузырь и кишку, в моче и кале может появиться кровь. Очаги опухоли могут также образоваться в других органах и тканях: печени, лёгких и брюшной полости. При метастазах в лёгких появляется кашель, боль в грудной клетке и одышка; метастазы в печени проявляются болью в правом подреберье [6] .
Диагностика рака эндометрия
В отличие от рака шейки матки для рака эндометрия не существует программ скрининга. Диагноз устанавливается после комплексного обследования, которое включает:
- осмотр на гинекологическом кресле;
- подтверждение наличия опухолевых клеток;
- магнитно-резонансную томографию (МРТ) с контрастированием;
- ультразвуковое исследование (УЗИ);
- компьютерную томографию (КТ).
Осмотр на гинекологическом кресле позволяет оценить, где расположена и насколько распространилась опухоль, а также выявить, поражены ли смежные органы малого таза.
Подтверждение наличия опухолевых клеток, или верификация, — это необходимый компонент обследования. Получить клетки можно двумя способами:
- Пайпель-биопсия — процедура, при которой эндометрий забирается из полости матки с помощью тонкого зонда. Не требует общего наркоза и специальных условий.
- Гистерорезектоскопия — операция, при которой перед забором эндометрия врач может осмотреть полость матки. Гистероскопия предпочтительна при безоперационном лечении, проводится под наркозом и редко занимает более 15 минут. Точность гистероскопии выше, чем пайпель-биопсии, и составляет около 72 % [7] .
Ультразвуковое исследование может быть выполнено через брюшную стенку и интравагинально, т. е. через влагалище. Интравагинальное УЗИ позволяет лучше оценить состояние эндометрия, аномальное утолщение которого может косвенно указывать на онкологическое заболевание. Данная процедура является относительно простой и не требует специальной подготовки, поэтому часто назначается пациенткам на первом этапе диагностики. Правильно интерпретировать результаты УЗИ может только врач-онкогинеколог.
Магнитно-резонансная томография с контрастированием является более точным методом диагностики по сравнению с УЗИ. МРТ назначается при планировании лечения и позволяет определиться с объёмом операции.
Компьютерную томографию (КТ) с контрастированием применяют, чтобы определить, есть ли метастазы в органах грудной клетки и брюшной полости.
Специфических онкомаркеров для диагностики рака эндометрия не существует. Один из немногих маркеров с относительной чувствительностью — Са-125, но такой анализ не входит в стандартное обследование. Этот онкомаркер выявляется при лимфоме, раке яичников, поджелудочной и молочной железы. Также его уровень может повышаться при беременности, различных воспалительных заболеваниях или доброкачественных образованиях, например кистах яичников и миоме матки.
Лечение рака эндометрия
Основной метод лечения рака эндометрия — это операция, при которой удаляются тело и шейка матки с придатками.
Операция может проводиться через три вида доступа:
- лапаротомный (разрез передней брюшной стенки);
- лапароскопический (через проколы 5–10 мм);
- влагалищный.
Чаще всего применяется лапароскопия, так как после неё пациентки быстрее всего восстанавливаются.
Необходимость лимфодиссекции (удаления лимфатических узлов) зависит от наличия факторов риска метастазирования опухоли, результатов морфологического заключения и данных инструментальной диагностики. При удалении лимфатических узлов важно оценить, есть ли в них опухолевые клетки, что имеет решающее значение при планировании лечения после операции.
Чем больше объём операции, тем выше риски послеоперационных осложнений. При удалении лимфоузлов примерно в половине случаев образуются лимфокисты — отграниченные скопления лимфатической жидкости в малом тазу [8] . Чтобы минимизировать риски их развития и избежать лимфодиссекции, в некоторых клиниках используется технология определения сигнальных лимфоузлов (СЛУ). Во время процедуры в шейку матки вводится краситель, который по лимфатическим сосудам попадает в лимфоузлы. Затем хирург находит лимфоузлы, в которых накопился краситель, и удаляет узел, расположенный ближе всего к матке. Далее, непосредственно во время операции, проводится гистологическое исследование, позволяющее подтвердить или исключить наличие метастазов в СЛУ и избежать их полного удаления.
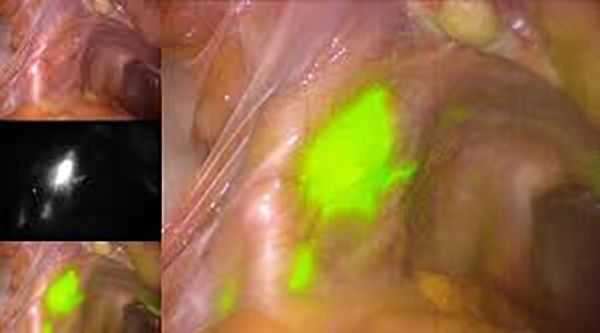
Если женщина планирует беременность, то в некоторых случаях допустимо безоперационное лечение. Оно возможно при эндометриоидном типе рака, стадии IA и высокой дифференцировке. Лечение проводится гормональными препаратами, которые блокируют работу яичников и оказывают терапевтический эффект на опухоль. Применяются два основных препарата: Мегестрола ацетат и Медроксипрогестерон.
Продолжительность гормонального лечения, как правило, составляет 6–12 месяцев. Затем при хорошем эффекте врач может разрешить беременность. После родов зачастую рекомендуется удалить матку, так как опухоль часто развивается повторно.
Лучевая терапия или химиотерапия на первом этапе менее эффективны, чем хирургическое лечение. Они назначаются, если нельзя провести операцию, например при тяжёлых хронических заболеваниях, распространённости опухоли и лечении рецидивов.
Чтобы предотвратить повторное появление опухоли, после операции могут проводиться дистанционное облучение малого таза и брахитерапия (контактная лучевая терапия, при которой источник излучения вводится внутрь поражённого органа).
Метод подбирается врачом в зависимости от типа и стадии рака, состояния лимфатических узлов. Например, при неэндометриоидном раке после операции назначается химиотерапия в сочетании с брахитерапией, а при эндометриальном раке I стадии может быть достаточно брахитерапии или наблюдения.
Прогноз. Профилактика
Без лечения рак эндометрия неизбежно прогрессирует и со временем приводит к гибели пациентки.
Для оценки прогнозов в онкологии используется термин «пятилетняя выживаемость», который сравнивает пациентов с конкретной стадией болезни с людьми из общей популяции. Например, если пятилетняя выживаемость при первой стадии болезни достигает 95 %, то такие пациенты по сравнению со здоровыми людьми с вероятностью 95 % проживут пять лет.
При своевременном выявлении и лечении рак эндометрия имеет самые благоприятные прогнозы среди всех злокачественных опухолей женских половых органов:
- для I стадии пятилетняя выживаемость составляет 85–95 %;
- для II — 65–70 %;
- для III — 29 % [9] .
Стадия болезни является самым значимым фактором при определении прогноза, но далеко не единственным. Онкологи оценивают гистологический тип опухоли, её дифференцировку, размеры, расположение в матке, прорастание или метастазирование в другие органы и лимфатические узлы. Точный прогноз врач сможет дать только после всестороннего анализа этих параметров.
Читайте также:
