Генетика рака маточной трубы и его наследственность
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Генетика рака эндометрия. Какова наследственность?
Рак эндометрия (РЭ) — самое распространенное онкологическое заболевание женских половых органов в США. Чаще других встречаются три гистологических варианта: аденокарцинома, серозно-папиллярный и светлоклеточный рак. В этиологии РЭ прослеживается выраженный наследственный компонент, например связь с синдромом Линча II типа. Подсчитано, что около 6 % всех случаев РЭ обусловлены наследственными причинами. Большинство больных наследственным РЭ — выходцы из семей, страдающих ННПКРР.
Аденокарцинома — наиболее частый гистотип, встречающийся примерно в 70 % случаев рака эндометрия (РЭ). Выделяют два патогенетических варианта при аденокарциноме эндометрия. Предраковым предшественником аденокарциномы I типа служит гиперплазия эндометрия; злокачественный процесс развивается на фоне ожирения и/или приема эстрогенов. Аденокарцинома II типа возникает в условиях атрофического эндометрия.
Серозно-папиллярная аденокарцинома — особо агрессивная опухоль, часто развивающаяся на фоне гиперплазии эндометрия.
Молекулярные изменения, приводящие к развитию рака эндометрия (РЭ), изучены недостаточно. Несколько исследований выявило утрату гетерозиготности в различных участках генома. Это стало причиной поиска гснов-супрессоров в этих областях. Обнаружены делеции на участках 3р, 10q, 17р и 18q. При серозно-папиллярном раке часто определяют делеции в области 1р.
В небольших исследованиях обнаружены повреждения онкогенов, например ras, K-ras, c-fms и с-erb-1, которые могут играть роль в развитии и прогрессии рака эндометрия (РЭ). Okamoto и соавт. исследовали генетические нарушения в 24 аденокарциномах эндометрия и выявили утрату гетерозиготности в 7 случаях, в 5 из которых отсутствовал локус на коротком плече хромосомы 17 (17р), где находится ген ТР53. Risinger и соавт. исследовали 21 случай рака эндометрия (РЭ) и обнаружили точечные мутации гена ТР53 в 3 (14 %) из них.
Рак эндометрия (РЭ) часто развивается у больных ННПКРР (синдром Линча типа II), что указывает на возможность участия одного и того же гена в развитии обоих заболеваний.
Поскольку прослеживается взаимосвязь рака эндометрия (РЭ) с ННПКРР, при котором выявляют дефекты репарации ДНК, многие исследователи изучали функции именно этой системы при РЭ и в 20—25 % случаев определили микросателлитную нестабильность. Однако мутации известных генов системы репарации ДНК (MSH2, MLH1, MSH3, PMS2, PMS1) обнаружены в малом проценте случаев. Система репарации ДНК подвержена метилированию промоторного региона MLH1, что ведет к его инактивации.
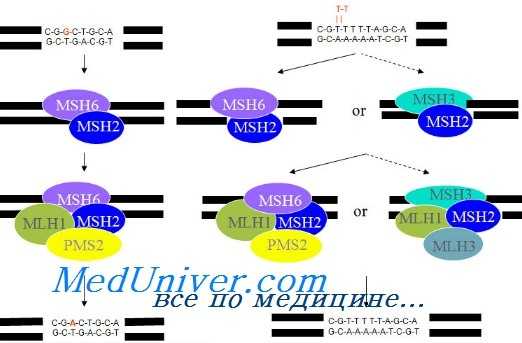
Генетика наследственного неполипозного колоректального рака (ННПКРР)
Интересно отметить, что существует полиморфизм системы репарации ДНК, отличающийся у представителей разных рас. Приблизительно у 6 % больных РЭ выявлены наследственные мутации генов репарации ДНК, которые могут быть первичными по крайней мере в одном из этих генов. Первичная мутация может локализоваться в половых клетках и, следовательно, определять наследственную форму РЭ. Какужеупоминалось, выявлены полиморфизмы, характерные для определенных рас. Kowalski идентифицировал 8 вариантов генов MLH1 или MSH2, наблюдаемых исключительно у чернокожих женщин.
Это может объяснять известные различия в выживаемости белых женщин и чернокожих со злокачественными опухолями и требует более подробного исследования. Кроме того, такие отличия важны для определения прогноза заболевания в различных группах пациентов. Можно было бы ожидать повышенную частоту мутаций онкогенов или опухолевых супрессоров в новообразованиях с нарушениями системы репарации ДНК, однако часто это оказывается не так, что демонстрирует неслучайность генетических мутаций.
Выявлено несколько опухолевых супрессоров, связанных с развитием злокачественных опухолей эндометрия. Гиперэкспрессия белка р53 или явные дефекты гена ТР53 обнаружены в 5—50 % случаев аденокарцином эндометрия. При гиперплазии эндометрия эти нарушения встречаются реже, что наводит на мысль о том, что мутации р53 — позднее событие в патогенезе рака эндометрия (РЭ). Частота мутаций ТР53 связана с морфологическим вариантом рака эндометрия (РЭ). В большинстве серозных опухолей матки выявляют мутации ТР53.
В то же время частота мутаций при аденокарциномах эндометрия значительно ниже. Эта связь между частотой мутаций и гистотипом опухоли может отчасти объяснить расовую предрасположенность чернокожих к раку эндометрия (РЭ). Экспрессия р53 может сопровождаться неблагоприятным прогнозом. Интересно отметить, что экспрессия р53 обратно пропорциональна экспрессии Bcl-2; мутации р21 и р185 также связаны с РЭ.
В нескольких исследованиях выявлена утрата гетерозиготности на хромосоме 10. В области 10q23—10q24 обнаружен ген-супрессор PTEN (гомолог фосфатазы и тензина); его мутации часто происходят при РЭ. PTEN кодирует цитоплазматическую фосфатазу белков и липидов, главным субстратом которой служит фосфатидилинозитол-(3,4,5)-трифосфат (PIP-3). Накопление PIP-3 в клеточной мембране ведет к активации белков серин-треониновых киназ семейства Akt. Активация Akt, в свою очередь, оказывает влияние на выживаемость клеток, зависящую от уровня апоптоза и регуляции других генов. Мутация PTEN — раннее явление в патогенезе РЭ.
Экспрессия PTEN отсутствует в большинстве аденокарцином эндометрия, а также аномально пролиферирующих железах. Интересно, что мутации PTEN чаще выявляют на ранних стадиях заболевания. Прогностическая ценность мутаций PTEN и/или отсутствие экспрессии этого гена при РЭ, а также связь этих факторов с расовой принадлежностью, стадией и степенью злокачественности непонятны. Возможно, существует связь между инактивацией PTEN и дефектами системы репарации ДНК (фенотип микросателлитной недостаточности). Утраты других регионов на длинном плече хромосомы 10 не связаны с геном PTEN и могут содержать другие опухолевые супрессоры.
К онкогенам, связанным с раком эндометрия (РЭ), относится K-ras, мутации которого наблюдаются в 10—30 % случаев, причем, согласно предварительным данным, их считают ранним событием в патогенезе. Мутации K-ras при аденокарциномах встречаются чаще, чем при серозной опухоли. Ген HER-2/neu также связан с опухолями эндометрия; при этих новообразованиях возможна его гиперэкспрессия или амплификация; активация этого гена указывает на неблагоприятный прогноз. Молекулярные изменения, связанные с РЭ, интенсивно изучаются рядом исследовательских групп, и ожидается, что в ближайшие несколько лет представления об этиопатогенезе этого заболевания значительно прояснятся.
Геномные исследования рака эндометрия (РЭ) начаты совсем недавно; для этого используют и мышиные модели этого заболевания. Анализ генетических изменений при рак эндометрия (РЭ) с помощью биочипов обозначил ключевые молекулярные различия между аденокарциномами и другими, более агрессивными серозными гистотипами. Недавно Ferguson и соавт. выявили молекулярные особенности, указывающие на исход заболевания. Быстрый прогресс в изучении молекулярных нарушений при злокачественных опухолях эндометрия ведет к разработке новых методов их профилактики, диагностики и лечения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Наследственный рак яичников
Наследственный рак яичников – злокачественная эпителиальная опухоль яичников, генетическая предрасположенность к которой передаётся потомкам. Овариальная карцинома сопровождается неспецифическими признаками – снижением аппетита, слабостью, желудочно-кишечным дискомфортом, неопределёнными болевыми ощущениями в животе и пояснице, на поздних стадиях - асцитом. Диагноз устанавливается по данным гинекологического осмотра, лучевых методов, лабораторных анализов крови и биоптатов. Лечение комбинированное или комплексное, основными методами являются оперативное вмешательство и полихимиотерапия, дополнительно может применяться лучевая терапия.
МКБ-10
Общие сведения
Наследственный (семейный) рак яичников – карцинома женских гонад, ассоциированная с генеративными (герминальными) генными мутациями. Частота таких мутаций среди европейцев составляет в среднем 0,2–0,5% и резко (в 4-10 раз) повышена у евреев ашкенази. На наследственно обусловленные формы приходится 10-19% всех злокачественных эпителиальных новообразований яичников. Средний возраст больных ‒ 48 лет (против 56 лет при спорадическом раке), нередко наследственный рак манифестирует и у более молодых женщин. Риск развития раковой опухоли у женщин-носителей мутации составляет 11-40%, а при отягощённом семейном анамнезе возрастает в 1,1-1,5 раза. Опухолевый процесс в яичниках часто сочетается с карциномами других органов – как репродуктивной системы, так и экстрагенитальными.
Причины наследственного рака яичников
Причиной семейного рака женских гонад является генеративная мутация - повреждение определённых генов в хромосомах половых клеток, передающееся последующим поколениям. К генным нарушениям может приводить воздействие ионизирующего излучения, пестицидов и сельскохозяйственных удобрений, растворителей, алкалоидов, ряда лекарственных препаратов, инфекционных агентов.
Впервые возникшая герминальная мутация проявляется лишь в следующей генерации, то есть повышенному риску рака будут подвержены сибсы (родные сёстры и братья) этого поколения и их дети, но не пробанды (родители, у которых возникла генетическая мутация). В настоящее время известны следующие наследственные состояния, одним из проявлений которых является овариальная карцинома:
- Синдром рака молочной железы и яичника. Обусловлен мутацией в генах BRCA1 и BRCA2 и является основной причиной наследственного овариального рака (доля BRCA-ассоциированных карцином составляет 90-95% всех семейных злокачественных опухолей яичника). Риск развития рака яичника при герминальной мутации BRCA1 достигает 44%, а BRCA2 – 27%. К другим клиническим проявлениям синдрома относятся злокачественные опухоли органов пищеварительной системы, меланома. Одной из разновидностей синдрома является семейный органоспецифичный рак яичника, протекающий изолированно, не сочетаясь с первично-множественными неоплазмами других органов.
- Синдром Линча второго типа (наследственный неполипозный колоректальный рак). Ассоциирован в основном с мутациями в генах MLH1, MSH2. Клинические проявления включают опухоли желудочно-кишечного тракта, женской репродуктивной системы и ряд других.
В группе риска развития наследственного рака яичника находятся женщины, среди близких кровных родственниц которых регистрировались карциномы молочных желёз, яичников, тела матки, толстой кишки и поджелудочной железы, меланома, а по мужской линии – указанные экстрагенитальные опухоли, рак простаты и первичный рак брюшины. Особая роль в плане риска отводится карциноме груди у кровных родственников мужского пола, ранним (до 40-50 лет) эпизодам рака и их первично-множественной (синхронной или метахронной) форме – поражению нескольких разных или парных органов.
Риск развития неоплазии у носителей мутации накапливается с возрастом и имеет прямую зависимость от распространённости наследственных синдромов среди родственников. Значимые для большинства типов спорадического овариального рака факторы риска (нарушения функции яичников, нереализованный репродуктивный потенциал, медикаментозная стимуляция овуляции, гиперэстрогения) практически не влияют на развитие наследственных карцином, поскольку в клетках 80-90% этих опухолей отсутствуют рецепторы эстрогена, прогестерона и эпидермального фактора роста.
Патогенез
Мутации, связанные с наследственной предрасположенностью к овариальному раку, поражают гены, несущие функцию подавления опухолевого роста. Клинически значимые «поломки» приводят к нарушению механизмов восстановления разрывов ДНК и накоплению множественных ошибок в её структуре. В результате утрачивается способность организма к своевременному опознанию и уничтожению изменённых клеток, что влечёт нарушение их дифференцировки, неконтролируемую пролиферацию, инвазию в соседние структуры и формирует высокозлокачественный фенотип опухоли. Нарушением синтеза белка, ответственного за репарацию ДНК, обусловлена и уязвимость клеток перед лечением антибластомными препаратами.
Патогенез наследственного рака яичников до конца не изучен, однако результаты последних исследований позволяют полагать, что источником опухоли является не эпителий капсулы яичника, как считалось ранее, а эпителиальная выстилка маточных труб и брюшины (чем можно объяснить морфологическое и клиническое сходство рака яичника с первичной перитонеальной карциномой). Основной и самый ранний путь метастазирования овариального рака – имплантационный, с поражением брюшины, большого сальника, органов малого таза и капсул печени, селезёнки. Другим характерным путём распространения метастазов является лимфогенный – сначала поражаются забрюшинные лимфатические узлы, затем периферические. Гематогенное метастазирование встречается крайне редко, при этом поражается лёгкое, печень, головной мозг.
Классификация
Наиболее полно оценить анатомическую распространённость опухоли с целью правильной постановки диагноза, определения прогноза и выработки рационального лечения позволяет классификация TNM. Наряду с TNM, в онкологии и гинекологии активно используется классификация неоплазий, разработанная Международной федерацией гинекологов и акушеров (FIGO), которая отражает последовательное развитие опухолевого процесса по стадиям. Ниже представлена классификация FIGO пересмотра 2014 года (в скобках указаны соответствующие значения TNM):
- Стадия I (T1N0M0). Опухолевый процесс ограничен яичниками. Выделяют 5 подстадий в зависимости от одно- или двусторонней локализации процесса, наличия раковых клеток в смывах с брюшины, повреждения капсулы яичника в пред- или интраоперационный период.
- Стадия II (T2N0M0). Опухоль распространяется на органы малого таза. Включает две подстадии – поражение только половых органов и вовлечение в процесс других структур.
- Стадия III (T3N0M0 илиT1-3N1M0). Опухоль поражает брюшину за пределами малого таза или (и) регионарные лимфоузлы (необходимо морфологическое подтверждение). В зависимости от размеров метастазов и их локализации внутри стадии выделяют 5 подстадий.
- Стадия IV (T1-3N0-1M1). Имеются метастазы в отдалённых органах (исключая внутрибрюшинные) и периферических лимфоузлах. Включает 2 варианта – наличие злокачественных клеток в плевральном выпоте и вовлечение других дистантных органов.
Симптомы наследственного рака яичников
Первыми субъективными признаками опухоли могут быть проявления паранеопластического синдрома – снижение аппетита, слабость и быстрая утомляемость, общее недомогание, субфебрилитет. По мере роста опухоли симптоматика становится более выраженной, присоединяются тупые распирающие боли в области пупка, нижней части живота, эпигастрия, подреберья. Сдавление кишечника сопровождается тошнотой, рвотой, запорами, вздутием живота, неприятными ощущениями во рту, а сдавление мочевыводящего тракта – частыми позывами на мочеиспускание, затруднением отхождения мочи. При асците увеличивается объём живота, скопление выпота в брюшной полости и в плевре проявляется усиливающейся одышкой, кашлем, сердцебиением, ощущением дурноты в ответ на привычные ранее нагрузки. Распространение процесса на маточные трубы и матку может сопровождаться серозно-кровянистыми выделениями.
Кожные покровы сначала имеют бледный вид, затем приобретают землисто-серый цвет с желтоватым оттенком (ввиду присоединения гемолитической анемии, сдавления или прорастания опухолью билиарной системы). Чаще всего наблюдается снижение веса, однако кахексия не характерна для больных даже с запущенным раком яичника, их вид не всегда может соответствовать тяжести заболевания. Нередко рак яичника сопровождают тромбофлебиты и флеботромбозы таза и нижних конечностей, проявляющиеся болью, уплотнением, гиперемией по ходу поражённой вены. Иногда при овариальной карциноме отмечается характерное выпячивание пупка – появление пупочной грыжи обусловлено выходом за пределы пупочного кольца поражённого опухолью большого сальника.
Осложнения
Осложнения могут быть связаны с местным распространением опухоли, сосудистыми проявлениями паранеопластического синдрома, отдалёнными метастазами. У молодых больных нередко возникает перекрут ножки новообразования, сопровождающийся картиной острого живота. Такое состояние может приводить к некрозу, перитониту, бурному прогрессированию рака. Подобными последствиями грозит и ущемление сальника. Тромбозы могут повлечь тромбоэмболию лёгочной артерии. В результате длительного накопления асцитической жидкости развивается выраженная сердечно-лёгочная недостаточность. Сдавление толстой кишки может закончиться полной кишечной непроходимостью и смертью. Метастазы в печени, лёгких, головном мозге вызывают серьёзные расстройства и значительно ухудшают качество жизни, распространение процесса приводит к летальному исходу.
Диагностика
Диагностика овариального рака осложнена труднодоступностью опухоли и отсутствием специфических гинекологических симптомов. В результате больные длительно и безуспешно лечатся по поводу несуществующих внутренних болезней, а опухоль выявляется слишком поздно. Диагностический поиск направлен на определение BRCA-статуса, морфологическую верификацию неоплазии, оценку распространённости опухолевого процесса и включает следующие исследования:
- Гинекологический и физикальный осмотр. В ходе бимануального ректовагинального исследования можно обнаружить опухоль придатка и по характеру изменений (неровности, подвижности, плотности, фиксации к соседним органам) предположить первичное злокачественное новообразование. При общем осмотре по косвенным признакам (асцит, увеличение периферических лимфоузлов) также можно заподозрить рак яичника.
- Лучевые методы. Абдоминальное УЗИ половых органов с дополнительным применением трансвагинальных, внутриматочных и ректальных датчиков, цветной допплерометрии позволяет обнаружить признаки злокачественного роста (неравномерность структуры, наличие множества беспорядочно расположенных перегородок, нечёткость контура, гиперваскуляризация, асцит). Для более точного исследования первичной опухоли, а также с целью выявления метастазов в матке, печени, лёгких, селезёнке могут назначаться КТ и МРТ малого таза, брюшной полости, грудной клетки. Для обнаружения опухолевого поражения толстой кишки применяется колоноскопия.
- Анализы крови. Производится определение уровня опухолевого маркёра (ИФА-анализ) и дисфункции генов наследственных синдромов (ПЦР-тест). Повышение уровня ассоциированного с раком яичника антигена Ca-125 свидетельствует о высокой вероятности овариальной карциномы, а обнаружение мутаций в BRCA1, 2 – о наследственном характере патологического процесса.
- Морфологические анализы биоптатов. Цитологическое исследование пунктатов дугласова пространства, брюшной и плевральной полости позволяет обнаружить раковые клетки, верифицировать диагноз и уточнить стадию опухолевого процесса.
- Лапароскопию. В некоторых случаях (ожирение, спаечные процессы у больной) точный диагноз возможно установить только хирургическим методом. Диагностическая лапароскопия позволяет наиболее точно диагностировать опухоль яичника и определить стадию.
Дифференциальная диагностика проводится с участием онкогинеколога, врачей лабораторной и ультразвуковой диагностики, медицинского генетика, радиолога, патоморфолога. Рак яичника дифференцируют с овариальными и забрюшинными кистами, доброкачественными и другими злокачественными опухолями яичников, синдромом Мейгса, неоплазиями соседних органов, метастазами рака желудка и толстой кишки, гнойно-воспалительными заболеваниями придатков, пупочной грыжей, гастроэнтеральной, кардиологической, пульмонологической патологией.
Лечение наследственного рака яичников
На ранних стадиях основной целью лечения является радикальное удаление опухоли и достижение стойкой и длительной ремиссии без рецидива. Однако распространённость первично диагностированной неоплазии в большинстве случаев не позволяет уничтожить все раковые клетки в организме, поэтому лечение в таких случаях направлено на стабилизацию процесса и удлинение периода без прогрессирования. Для достижения этих целей применяется комбинация двух методов – хирургического и медикаментозного, которая иногда может дополняться лучевой терапией.
- Циторедуктивная операция. При раке яичника, в отличие от большинства других злокачественных неоплазий, удаление любого технически возможного объёма опухоли позволяет улучшить прогноз, поэтому хирургическая операция выполняется при любой стадии. Если опухоль была удалена не полностью, вмешательства повторяются после нескольких курсов химиотерапии.
- Полихимиотерапия. Наследственные раковые опухоли яичников более чувствительны к химиотерапии, чем спорадические, поэтому медикаментозное лечение тоже можно считать основным методом, применяемым с целью частичной регрессии неоплазии. При наличии асцита или плеврита химиотерапия проводится до операции, в остальных случаях – после. Лечение проводят препаратами платины и таксанами.
- Лучевая терапия. Лечение в основном малоэффективно при эпителиальных опухолях и назначается после операции только в случае резистентности карциномы к лекарственным препаратам.
Прогноз и профилактика
Прогноз безрецидивной и общей выживаемости при семейном раке благоприятнее, чем при спорадическом. В среднем пятилетняя выживаемость составляет 36-40%. При I стадии процесса этот показатель составляет 70-100%, при II – 45%, при III – 35-40%, при IV – 5-10%. Более половины рецидивов регистрируется в течение года после лечения. Частота рецидивов в среднем составляет 20-50%. Пятилетний порог безрецидивной выживаемости перешагивает 27% больных, десятилетний – 7%.
Профилактическая программа включает медико-генетическое консультирование женщин группы риска для расчёта вероятности развития у них рака яичника, ДНК-тестирование для выявления мутаций BRCA. При наличии наследственной предрасположенности молодым (до 35-40 лет) пациенткам с целью раннего выявления вероятных неоплазий рекомендовано ежегодное тщательное обследование (гинекологическое УЗИ, ректовагинальное исследование, определения уровня CА-125). После реализации репродуктивной функции женщинам может быть предложена превентивная тубовариэктомия, снижающая риск развития опухоли яичников на 95%, а опухоли молочной железы – на 50%, или альтернатива – перевязка маточных труб (снижает риск на 60-70% в связи с атрофией эпителия, являющегося источником патологического процесса). Больным, получавшим лечение по поводу рака яичника, необходимо пожизненное динамическое наблюдение онкогинеколога для своевременной диагностики возможного рецидива.
1. 1. Ошибки в клинической онкологии: руководство для врачей/ ред. В.И. Чиссов, А.Х. Трахтенберг – 2009.
2. Наследственный рак яичника (литературный обзор)/ М.П.Казаков, И.В.Поддубная, Л.Н.Любченко, Т.В.Харитонова// Современная онкология. - 2012 - №1.
3. Молекулярная генетика рака яичников/ 3. К.П. Хансон, Е.Н. Имянитов// Практическая онкология. - 2004 - №4.
Рак яичников
Рак яичников – первичное, вторичное или метастатическое опухолевое поражение женских гормонопродуцирующих половых желез – яичников. На ранних стадиях рак яичников малосимптомен; патогномоничные проявления отсутствуют. Распространенные формы проявляются слабостью, недомоганием, снижением и извращением аппетита, нарушениями функции ЖКТ, дизурическими расстройствами, асцитом. Диагностика рака яичников включает проведение физикального и вагинального обследования, УЗИ, ЯМРТ или КТ малого таза, лапароскопии, исследование онкомаркера СА 125. В лечении рака яичников применяется хирургический подход (пангистерэктомия), полихимиотерапия, радиотерапия.
Рак яичников стоит на седьмом месте в структуре общей онкопатологии (4-6%) и занимает третье место (после рака тела матки и рака шейки матки) среди злокачественных опухолей в онкогинекологии. Чаще рак яичников поражает женщин предклимактерического и климактерического периода, хотя не является исключением и среди женщин моложе 40 лет.
Причины
Проблема развития рака яичников рассматривается с позиций трех гипотез. Считается, что как и другие овариальные опухоли, рак яичников развивается в условиях длительной гиперэстрогении, что повышает вероятность опухолевой трансформации в эстрогенчувствительной ткани желез.
Другой взгляд на генез рака яичников основан на представлениях о постоянной овуляции при раннем наступлении менархе, поздней менопаузе, малом количестве беременностей, укорочении лактации. Непрерывные овуляции способствуют изменению эпителия стромы яичника, тем самым создавая условия для аберрантного повреждения ДНК и активации экспрессии онкогенов.
Генетическая гипотеза выделяет среди группы потенциального риска женщин с семейными формами рака груди и яичников. По наблюдениям, повышенный риск развития рака яичников ассоциирован с наличием бесплодия, дисфункции яичников, гиперплазии эндометрия, частых оофоритов и аднекситов, миомы матки, доброкачественных опухолей и кист яичников. Применение гормональной контрацепции длительнее 5 лет, напротив, снижает вероятность возникновения рака яичников практически вдвое.
По месту возникновения изначального очага рака различают первичное, вторичное и метастатическое поражения яичников.
- Первичный рак яичника сразу развивается в железе. По своему гистотипу первичные опухоли являются эпителиальными образованиями папиллярного или железистого строения, реже развиваются из клеток покровного эпителия. Первичный рак яичника чаще носит двустороннюю локализацию; имеет плотную консистенцию и бугристую поверхность; встречается преимущественно у женщин до 30 лет.
- Вторичный рак яичников. На его долю приходится до 80% клинических случаев. Развитие данной формы рака происходит из серозных, тератоидных или псевдомуцинозных кистом яичников. Серозные цистаденокарциномы развиваются в возрасте 50-60 лет, муцинозные - после 55-60 лет. Вторичные эндометриоидные цистаденокарциномы встречаются у молодых женщин, обычно страдающих бесплодием.
- Метастатическое поражение яичников развивается в результате распространения опухолевых клеток гематогенным, имплантационным, лимфогенным путями из первичных очагов при раке желудка, молочной железы, матки, щитовидной железы. Метастатические опухоли яичников обладают быстрым ростом и неблагоприятным течением, обычно поражают оба яичника, рано диссеминируют по брюшине малого таза. Макроскопически метастатическая форма рака яичников имеет белесоватый цвет, бугристую поверхность, плотную или тестоватую консистенцию.
Более редкие типы рака яичников представлены папиллярной цистаденомой, гранулезоклеточным, светлоклеточным (мезонефроидным) раком, аденобластомой, опухолью Бреннера, стромальными опухолями, дисгерминомой, тератокарциномой и др. В клинической практике рак яичников оценивается в соответствии с критериями FIGO (стадии I-IV) и TNM (распространенность первичной опухоли, регионарных и отдаленных метастазов).
I (T1) – распространенность опухоли ограничивается яичниками:
- IA (T1a) – рак одного яичника без прорастания его капсулы и разрастания опухолевых клеток на поверхности железы
- IB (T1b) – рак обоих яичников без прорастания их капсул и разрастания опухолевых клеток на поверхности желез
- IC (T1c) – рак одного или двух яичников с прорастанием и/или разрывом капсулы, опухолевыми разрастаниями на поверхности железы, наличием атипичных клеток в асцитических или смывных водах
II (T2) – поражение одного или обоих яичников с распространением опухоли на структуры малого таза:
- IIA (T2a) - рак яичников распространяется или метастазирует в маточные трубы или матку
- IIB (T2b) - рак яичников распространяется на другие структуры таза
- IIC (T2c) – опухолевый процесс ограничен поражением малого таза, определяется наличие атипичных клеток в асцитических или смывных водах
III (T3/N1) - поражение одного или обоих яичников с метастазированием рака яичников по брюшине или в регионарные лимфоузлы:
- IIIA (T3a) – наличие микроскопически подтвержденных внутрибрюшинных метастазов
- IIIB (T3b) – макроскопически определяемые внутрибрюшинные метастазы диаметром до 2 см
- IIIC (T3c/N1) - макроскопически определяемые внутрибрюшинные метастазы диаметром более 2 см или метастазы в регионарные лимфоузлы
IV (M1) – метастазирование рака яичников в отдаленные органы.
Симптомы рака яичников
Проявления рака яичников вариабельны, что объясняется многообразием морфологических форм заболевания. При локализованных формах рака яичников симптоматика, как правило, отсутствует. У молодых женщин рак яичников может клинически манифестировать с внезапного болевого синдрома, вызванного перекрутом ножки опухоли или перфорацией ее капсулы.
Активизация проявлений рака яичников развивается по мере распространения опухолевого процесса. Происходит нарастание недомогания, слабости, утомляемости, субфебрилитета; ухудшение аппетита, функции ЖКТ (метеоризм, тошнота, запоры); появление дизурических явлений.
При поражении брюшины развивается асцит; в случае метастазов в легкие – опухолевый плеврит. В поздних стадиях нарастает сердечно-сосудистая и дыхательная недостаточность, развиваются отеки нижних конечностей, тромбозы. Метастазы при раке яичников, как правило, выявляются в печени, легких, костях.
Среди злокачественных опухолей яичников встречаются гормонально-активные эпителиальные образования. Гранулезоклеточный рак яичников – феменизирующая опухоль, способствующая преждевременному половому созреванию девочек и возобновлению маточных кровотечений у пациенток в менопаузе. Маскулинизирующая опухоль – адренобластома, напротив, приводит к гирсутизму, изменению фигуры, уменьшению груди, прекращению менструаций.
Комплекс методов диагностики рака яичников включает проведение физикального, гинекологического, инструментального обследования. Распознавание асцита и опухоли может быть произведено уже в ходе пальпации живота.
- Гинекологическое исследование хоть и позволяет выявить наличие одно- или двустороннего овариального образования, но не дает четкого представления о степени его доброкачественности. С помощью ректовагинального исследования определяется инвазия рака яичников в параметрий и параректальную клетчатку.
- Методы визуализации. С помощью трансвагинальной эхографии (УЗИ), МРТ и КТ малого таза выявляется объемное образование неправильной формы без четкой капсулы с бугристыми контурами и неодинаковой внутренней структурой; оцениваются его размеры и степень распространенности.
- Диагностическая лапароскопия при раке яичников необходима для проведения биопсии и определения гистотипа опухоли, забора перитонеального выпота или смывов для цитологического исследования. В ряде случаев получение асцитической жидкости возможно посредством пункции заднего свода влагалища.
При подозрении на рак яичников показано исследование опухолево-ассоциированных маркеров в сыворотке (СА-19.9, СА-125 и др.). Для исключения первичного очага или метастазов рака яичников в отдаленных органах производится маммография, рентгенография желудка и легких, ирригоскопия; УЗИ брюшной полости, УЗИ плевральной полости, УЗИ щитовидной железы; ФГДС, ректороманоскопия, цистоскопия, хромоцистоскопия.

Лечение рака яичников
Вопрос выбора лечебной тактики при раке яичников решается с учетом стадии процесса, морфологической структуры опухоли, потенциальной чувствительности данного гистиотипа к химиотерапевтическому и лучевому воздействию, отягощающих соматических и возрастных факторов. В лечении рака яичников сочетается хирургический подход (пангистерэктомия) с проведением полихимиотерапии и радиотерапии.
Оперативное лечение
Хирургическое лечение локализованной формы рака яичников (I-II ст.) заключается в проведении удаления матки с аднексэктомией и резекцией большого сальника. У ослабленных или пожилых пациенток возможно выполнение надвлагалищной ампутации матки с придатками и субтотальной резекции большого сальника. В процессе операции обязательна интраоперационная ревизия парааортальных лимфоузлов с их срочным интраоперационным гистологическим исследованием. При III-IV ст. рака яичников производится циторедуктивное вмешательство, направленное на максимальное удаления опухолевых масс перед химиотерапией. При неоперабельных процессах ограничиваются биопсией опухолевой ткани.
Противоопухолевая терапия
Полихимиотерапия при раке яичников может проводиться на предоперационном, послеоперационной этапе или являться самостоятельным лечением при распространенном злокачественном процессе. Полихимиотерапия (препаратами платины, хлорэтиламинами, таксанами) позволяет добиться подавления митоза и пролиферации опухолевых клеток. Побочными действиями цитостатиков выступают тошнота, рвота, нейро- и нефротоксичность, угнетение кроветворной функции. Лучевая терапия при раке яичников обладает незначительной эффективностью.
Отдаленная выживаемость при раке яичников обусловлена стадией заболевания, морфологической структурой опухоли и ее дифференцировкой. В зависимости от гистотипа опухоли пятилетний порог выживаемости преодолевает 60-90% пациенток с I ст. рака яичников, 40-50% - со II ст., 11% - с III ст.; 5% - с IV ст. Более благоприятны в отношении прогноза серозный и муцинозный рак яичников; менее – мезонефроидный, недифференцированный и др.
В постоперационном периоде после радикальной гистерэктомии (пангистерэктомии) пациенткам требуется систематическое наблюдение онкогинеколога, предупреждение развития посткастрационного синдрома. В профилактике рака яичников существенная роль отводится своевременному выявлению доброкачественных опухолей желез, онкопрофилактическим осмотрам, снижению воздействия неблагоприятных факторов.
Генетика рака маточной трубы и его наследственность
В некоторых исследованиях было выявлено несколько вариантов генетических нарушений, сопровождающих рак маточной трубы (РМТ), которые характерны и для рака яичника (РЯ); к ним относятся генные мутации, изменение числа копий генов, утрата гетерозиготности. К характерным генным мутациям относятся ERBB-2 (HER-2/neu), ТР53 (р53) и K-RAS (K-ras).
Для всех злокачественных опухолей маточных труб характерно большое число отклонений количества копий генов, при этом одинаковые нарушения были выявлены несколькими авторами. Наиболее частыми нарушениями при раке маточной трубы (РМТ) были увеличение копий 3q (70 %) и 8q (75 %), в некоторых случаях с высоким уровнем амплификации генов.
Аналогичные нарушения описаны при РЯ с амплификацией в локусах 8q, 1q, 20q, а также 18q. При BRCA-обусловленном раке маточной трубы (РМТ) и раке яичника (РЯ) описана потеря гетерозиготности в локусе 13q, но значимость этой генетической перестройки остается неясной.
Изменения уровня белков, зафиксированные при иммуногистохимическом исследовании, характерны и для рака маточной трубы (РМТ), и для РЯ: повышается содержание белков, связанных с пролиферацией MKI67 (Ki-67), и снижается содержание белков, ингибирующих клеточный цикл CDKN1A (р21) и CDKN1B (р27). К другим белкам, уровень которых повышается при раке обеих локализаций, относятся р53, MYC (c-myc), ERBB-2, АКТ2, WT1 (Wilms tumor 1) и PCNA.
Повышение р53 сопровождается снижением выживаемости, кроме того, он повышается при дисплазии маточных труб, характерной для рака маточной трубы (РМТ). Определение генетических и молекулярных отклонений при РМТ, а также сравнение с отклонениями, сопровождающими другие интраперитонеальные злокачественные опухоли, возможно, позволят лучше понять взаимосвязь между этими вариантами рака.
Наследственный рак маточной трубы
С большей частотой (1,7—3 %) рак маточной трубы (РМТ) диагностировался в центрах, в которых официально утверждены скрининговые программы для женщин с высоким риском злокачественных новообразований половых органов: как у пациенток, обследовавшихся согласно протоколу скрининга, так и у пациенток, избравших профилактическое оперативное вмешательство.
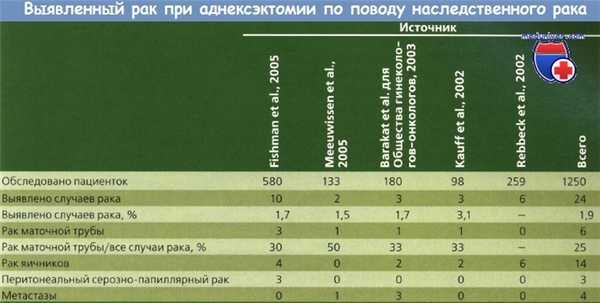
Считается, что риск возникновения рака маточной трубы (РМТ) в течение жизни у носительниц BRCA-мутаций составляет 0,6—3 %. По данным самого крупного к настоящему времени исследования, проведенного Fishman и соавт., у 581 носительницы BRCA-мутации, подвергшейся профилактической аднексэктомии, было зафиксировано 10 (1,8 %) случаев рака, из которых у 3 (30 %) женщин был диагностирован рак маточной трубы (РМТ).
Barakat и соавт. зафиксировали 3(1,7 %) случая рака у 180 пациенток — носительниц мутации, в 1 случае рак локализовался в маточной трубе. Meeuwissen и соавт. выявили 2 случая рака у 133 обследованных ими пациенток, в 1 (50 %)из этих случаев был диагностирован рак маточной трубы (РМТ). С другой стороны, Rebbeck и соавт. сообщили о 6 случаях рака яичника (РЯ) у 259 пациенток и ни об одном случае рака маточной трубы (РМТ).
За последнее время несколько авторов указывали па значительное увеличение частоты выявления во время профилактической аднексэктомии скрытых злокачественных опухолей женских половых органов, включая рак маточной трубы (РМТ) и рак in situ (CIS), в том случае, если выполнялось обширное иссечение патологических очагов с забором образца ткани.
Большинство злокачественных опухолей половых органов у данной группы женщин с повышенным риском составляет рак маточной трубы (РМТ) и перитонеальный сероз-по-папиллярный рак, а не рак яичника (РЯ). В своем исследовании в 2001 г. Colgan и соавт. выявили рак маточной трубы (РМТ) у 5(8 %) из 60 пациенток, при этом в 2 (40 %) из 5 случаев заболевание было ограничено маточной трубой, в 1 — распространялось на маточную трубу и яичник, в 1 — были поражены маточная труба, яичник и серозная оболочка матки.
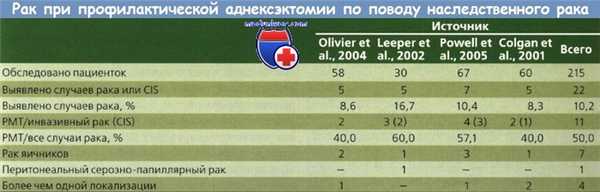
Эти данные подтверждены другими исследователями. Olivier и соавт. сообщили о 5 случаях рака у 58 обследованных пациенток; при этом в 2 (40 %) случаях обнаружен рак маточной трубы (РМТ) и в 1 — рак маточной трубы (РМТ) и рак яичника (РЯ). Leeper и соавт. в ходе профилактической аднексэктомии выявили 5 (17 %) из 30 пациенток со скрытой злокачественной опухолью, при этом в 3 (60 %) из 5 случаев был диагностирован рак маточной трубы (РМТ).
Молекулярные причины рака молочной железы и яичников
Powell и соавт. описали 7 (10 %) случаев рака у 67 пациенток, при этом у 4 (57 %) пациенток обнаружен рак маточной трубы (РМТ). Обобщая данные, приведенные в литературе, можно сказать, что в общей сложности у 215 обследованных пациенток, подвергшихся профилактической аднексэктомии с целью понизить риск наследственного рака, было выявлено 22 (10,2 %) случая рака, при этом у 11 (50 %) больных опухоль локализовалась в маточной трубе.
Кроме того, у женщин из группы повышенного риска чаще обнаруживались предраковые изменения маточных труб. Carcangiu и соавт., исключив пациенток, у которых при операции был выявлен рак, исследовали образцы ткани внешне не измененных маточных труб, полученные при профилактической аднексэктомии, на предмет изменений эпителия и обнаружили CIS или атипическую гиперплазию у 4 (18 %) из 22 пациенток — носительниц мутаций BRCA1, в то время как ни у одной из 4 носительниц BRCA2-мутаций клеточные атипии не определялись.
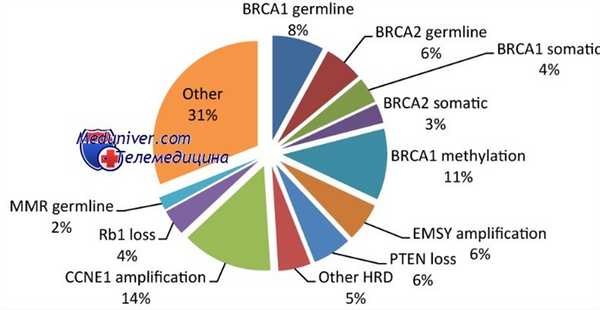
BRCA-мутации чаще встречаются при раке маточной трубы (РМТ), чем при раке яичника (РЯ), при этом, по данным последних исследований, мутации обнаруживались у 16—43 % пациенток. По-видимому, рак маточной трубы (РМТ) имеет большую взаимосвязь с BRCA1, чем с BRCA2, хотя большинство имеющихся к настоящему времени источников литературы, указывающих на взаимосвязь BRCA2 и рак маточной трубы (РМТ), представляет собой описания отдельных клинических случаев. Наличие BRCA-мутации также определяет гистологический вариант возникающего рака.
Исследовав 50 случаев рака маточной трубы (РМТ), связанного с BRCA-мутациями, Piek и соавт. не обнаружили ни одной неэпителиальной злокачественной опухоли, при этом в 94 % случаев рак был серозно-папиллярный по сравнению с 62 % при спорадических интраперитонеальных злокачественных опухолях. Имеются данные о том, что для носительниц BRCA-мутаций, страдающих раком маточной трубы (РМТ), характерен более высокий показатель выживаемости, а именно медиана выживаемости составляет 148 мес. по сравнению с 41 мес. при спорадическом раке.
У пациенток из группы высокого риска в качестве обязательных должны проводиться исследования перитонеальных смывов и серии срезов образцов ткани, т. к. они увеличивают частоту обнаружения как рак маточной трубы (РМТ), так и скрытого РЯ. До недавнего подтверждения взаимосвязи BRCA1/2-мутаций и рак маточной трубы (РМТ) некоторые специалисты рассматривали овариэктомию в качестве необходимого профилактического оперативного вмешательства у пациенток из группы высокого риска.
Есть описание одного случая рака маточной трубы (РМТ) после выполнения только овариэктомии; известно также, что у этих пациенток высок риск поражения эпителия труб, поэтому сальпин-гэктомия наряду с овариэктомией должна быть частью профилактического оперативного вмешательства. Кроме того, указывается на нивелирование возможного риска рака интерстициальной части трубы после выполнения гистерэктомии, хотя этот вопрос остается спорным.
Так, недавно Cass и соавт. показали, что у обследованных ими 50 пациенток раком маточной трубы (РМТ) представлял собой патологический процесс, вовлекающий дистальную и среднюю части маточной трубы, и ни одного случая поражения раком интерстициальной ее части зафиксировано не было.
В случае выявления при профилактической аднексэктомии скрытой опухоли необходимо повторное определение стадии заболевания, которое может быть выполнено при лапароскопии, при этом более чем в половине случаев (5/8) предполагаемых ранних стадий рака маточной трубы (РМТ) Leblanc и соавт. диагностировали более поздние стадии заболевания. По-видимому, для пациенток с раком маточной трубы (РМТ) или CIS характерен высокий риск носительства BRCA-мутаций, поэтому с целью достоверной консультации по поводу возможного повышенного риска других злокачественных опухолей у пациентки и членов ее семьи должно быть предложено проведение теста на BRCA.
Наследственные формы рака
Наследственные формы рака – разнородная группа злокачественных опухолей различных органов, обусловленных наследованием одного или нескольких генов, которые вызывают определенную форму рака или повышают вероятность ее развития. Диагностируются на основании семейного анамнеза, генетических анализов, симптомов и данных дополнительных исследований. Тактика лечения определяется типом и распространенностью неоплазии. Важнейшую роль отводят профилактике развития новообразований, которая включает в себя регулярные обследования больного, исключение факторов риска, лечение предраковых заболеваний и удаление органов-мишеней.
Наследственные формы рака – группа злокачественных новообразований, обусловленных мутацией одного или нескольких генов и передающихся по наследству. Составляют около 7% от общего количества онкологических заболеваний. Вероятность появления опухоли существенно варьирует в зависимости от конкретной генетической мутации и условий жизни носителей гена. Существуют так называемые «раковые семьи», в которых злокачественными неоплазиями страдает до 40% кровных родственников.
Современный уровень развития генетических исследований позволяет достоверно устанавливать наличие дефектных генов у членов семей, входящих в группу риска возникновения наследственных форм рака. В связи с этим современные ученые и практические врачи все больше акцентируют внимание на профилактических мероприятиях, направленных на предотвращение заболеваний данной группы. Диагностику и лечение наследственных форм рака осуществляют генетики, специалисты в сфере онкологии, гастроэнтерологии, пульмонологии, эндокринологии и других областей медицины.
Причины возникновения наследственных форм рака
Современные исследования достоверно подтверждают версию о генетической природе рака. Установлено, что причиной развития всех форм онкологических заболеваний являются мутации ДНК, в результате которых образуется клон клеток, способных к неконтролируемому размножению. Несмотря на генетически обусловленную природу злокачественных опухолей, не все неоплазии являются наследственными формами рака. Обычно возникновение неоплазий обусловлено не передающимися по наследству соматическими мутациями, вызванными ионизирующим излучением, контактом с канцерогенами, некоторыми вирусными инфекциями, снижением иммунитета и другими факторами.
Истинно наследственные формы рака встречаются реже спорадических. При этом риск развития злокачественной неоплазии крайне редко составляет 100% - генетические нарушения, обязательно вызывающие рак, обнаруживаются лишь у 1 человека из 10 тысяч населения, в остальных случаях речь идет о более или менее выраженной предрасположенности к возникновению определенных онкологических поражений. Около 18% здоровых людей имеют двух либо более родственников, страдающих онкологическими заболеваниями, однако часть таких случаев обусловлена совпадениями и влиянием неблагоприятных внешних факторов, а не наследственными формами рака.
Специалисты смогли выделить признаки наследственного опухолевого фенотипа:
- Молодой возраст больных на момент появления симптомов заболевания
- Склонность к множественному поражению различных органов
- Двухсторонние неоплазии парных органов
- Наследование онкологического заболевания в соответствии с законами Менделя.
Следует учитывать, что у больных с наследственными формами рака могут выявляться не все перечисленные выше признаки. Однако выделение таких параметров позволяет с достаточной уверенностью дифференцировать наследственные опухоли от спорадических. С учетом характера наследуемого признака выделяют следующие варианты передачи генетических аномалий:
- Наследование гена, провоцирующего развитие определенного онкологического заболевания
- Наследование гена, повышающего вероятность развития определенного онкологического поражения
- Наследование нескольких генов, вызывающих рак или повышающих риск его возникновения.
Механизмы развития наследственных форм рака пока окончательно не установлены. Ученые предполагают, что наиболее вероятными являются увеличение количества клеточных мутаций, снижение эффективности устранения мутаций на клеточном уровне и снижение эффективности элиминации патологически измененных клеток на уровне организма. Причиной увеличения количества клеточных мутаций является наследственно обусловленное снижение уровня защиты от внешних мутагенов либо нарушение функций определенного органа, вызывающее усиленную пролиферацию клеток.
Причиной снижения эффективности устранения мутаций на клеточном уровне при наследственных формах рака может стать отсутствие либо недостаток активности определенных ферментов (например, при пигментной ксеродерме). Снижение элиминации измененных клеток на уровне организма может быть вызвано наследственно обусловленными расстройствами иммунитета или вторичным подавлением иммунной системы при семейных нарушениях метаболизма.
Наследственные формы рака женской репродуктивной системы
Существует несколько синдромов, характеризующихся высоким риском развития онкологических заболеваний женской репродуктивной системы. При трех синдромах передаются опухоли одного органа: рак яичников, рак матки и рак молочной железы. При остальных наследственных формах рака выявляется предрасположенность к развитию неоплазий различных локализаций. Выделяют семейный рак яичников и молочной железы; семейный рак яичников, матки и молочной железы; семейный рак яичников, матки, молочной железы, ЖКТ и легких; семейный рак матки и ЖКТ.
Все перечисленные наследственные формы рака могут быть обусловлены различными генетическими аномалиями. Наиболее распространенными генетическими дефектами являются мутации генов-супрессоров опухоли BRCA1 и BRCA2. Эти мутации присутствуют у 80-90% пациенток с наследственным раком яичников и молочной железы. Вместе с тем, при некоторых синдромах данные мутации выявляются всего у 80-45% больных, что свидетельствует о наличии других, еще неизученных генов, провоцирующих развитие наследственных форм рака женской репродуктивной системы.
Для пациенток с наследственными синдромами характерны определенные особенности, в частности – раннее наступление менархе, частые воспалительные и диспластические процессы (мастопатия, эндометриоз, воспалительные заболевания женских половых органов), высокая распространенность сахарного диабета. Диагноз выставляют на основании семейной истории и данных молекулярно-генетических исследований.
При выявлении предрасположенности к наследственным формам рака проводят расширенное обследование, рекомендуют отказаться от вредных привычек, назначают специальную диету, осуществляют коррекцию гормонального профиля. По достижении возраста 35-45 лет по показаниям профилактически выполняют двухстороннюю мастэктомию или овариэктомию. План лечения сформировавшихся опухолей составляют в соответствии с общими рекомендациями для неоплазий соответствующей локализации. Наследственные новообразования этой группы протекают достаточно благоприятно, пятилетняя выживаемость при таких формах рака в 2-4 раза выше, чем при спорадических случаях заболевания.
Наследственные формы рака пищеварительной системы
Существует обширная группа наследственных синдромов с высокой вероятностью возникновения опухолей ЖКТ. Наиболее распространенным является синдром Линча – неполипозный рак толстой кишки, передающийся по аутосомно-доминантному типу. Наряду с карциномой толстого кишечника у больных синдромом Линча могут выявляться рак мочеточника, рак тонкой кишки, рак желудка и рак тела матки. Заболевание может быть обусловлено терминальными мутациями различных генов, чаще всего – MLH1, MSH2 и MSH6. Вероятность развития синдрома Линча при аномалиях этих генов колеблется от 60 до 80%.
Поскольку пациенты с этой наследственной формой рака составляют всего около 3% от общего количества больных с онкологическими заболеваниями толстой кишки, скрининговые генетические исследования считаются нецелесообразными и проводятся только при выявлении предрасположенности. Здоровым пациентам советуют регулярно проходить расширенное обследование, включающее в себя колоноскопию, гастроскопию, УЗИ брюшной полости и УЗИ органов малого таза (у женщин). При появлении новообразования рекомендуют осуществлять не сегментарную резекцию, а субтотальную колэктомию.
Второй по распространенности наследственной формой рака ЖКТ является семейный аденоматоз толстого кишечника (САТК), также передающийся по аутосомно-доминантному типу. Заболевание обусловлено мутацией в гене APC. Выделяют три типа САТК: ослабленный (менее 100 полипов), классический (от 100 до 5000 полипов), тяжелый (более 5000 полипов). Риск злокачественной трансформации при отсутствии лечения составляет 100%. У пациентов с этой наследственной формой рака также могут выявляться аденомы тонкой кишки, двенадцатиперстной кишки и желудка, опухоли ЦНС, новообразования мягких тканей, множественные остеофибромы и остеомы. Всем больным проводят ежегодную колоноскопию. При угрозе малигнизации пациентам с тяжелыми и классическими наследственными формами рака осуществляют колпроктэктомию. При ослабленном типе САТК возможна эндоскопическая полипэктомия.
Группа гамартомных полипозных синдромов включает в себя ювенильный полипоз, синдром Пейца-Егерса и болезнь Коудена. Эти наследственные формы рака проявляются полипозом желудка, тонкого и толстого кишечника. Часто сочетаются с поражениями кожи. Возможно возникновение колоректального рака, опухолей желудка и тонкого кишечника. Показаны регулярные эндоскопические исследования ЖКТ. При угрозе злокачественного перерождения осуществляют эндоскопическую полипэктомию.
Наследственные формы рака желудка подразделяются на два типа: диффузный и интестинальный. Диффузные новообразования развиваются при собственном наследственном синдроме, обусловленном мутацией гена CDH1. Интестинальные опухоли выявляются при других синдромах, в том числе – при мутациях, вызывающих злокачественные неоплазии яичников и молочной железы, а также при синдроме Линча. Риск развития онкологического заболевания при мутации гена CDH1 составляет примерно 60%. Пациентам рекомендуют профилактическую гастрэктомию. При других синдромах осуществляют регулярные обследования.
Другие наследственные формы рака
Одной из широко известных наследственных неоплазий является ретинобластома, передающаяся по аутосомно-доминантному типу. Ретинобластома относится к числу редких опухолей, наследственные формы рака составляют около 40% от общего количества диагностированных случаев заболевания. Обычно развивается в раннем детском возрасте. Может поражать один или оба глаза. Лечение – криокоагуляция или фототерапия, возможно, в сочетании с лучевой терапией и химиотерапией. При распространенных формах осуществляют энуклеацию глазного яблока.
Еще одна наследственная форма рака, возникающая в детском возрасте – нефробластома (опухоль Вильмса). Семейные формы заболевания выявляются достаточно редко. Нефробластома часто сочетается с аномалиями развития мочеполовой системы. Проявляется болями и макрогематурией. Лечение – нефрэктомия, лучевая терапия, химиотерапия. В литературе встречаются описания успешных органосохраняющих операций, однако подобные вмешательства пока не внедрены в широкую клиническую практику.
Синдром Ли-Фраумени является наследственной формой рака, передающейся по аутосомно-доминантному типу. Проявляется ранним возникновением сарком, рака молочной железы, острого лейкоза, неоплазий надпочечников и центральной нервной системы. Новообразования обычно диагностируются в возрасте до 30 лет, обладают высокой склонностью к рецидивированию. Показаны регулярные профилактические обследования. В связи с высоким риском возникновения других опухолей тактика лечения уже существующих неоплазий может отличаться от общепринятой.
Читайте также:
