Генная терапия сердечно-сосудистых заболеваний. Исследования генной терапии в кардиологии
Добавил пользователь Евгений Кузнецов Обновлено: 25.01.2026
Кардиология:
Генная терапия болезней сердца и сердечной недостаточности
Генная терапия — новейший терапевтический подход к лечению сердечной недостаточности (СН). Развитие направлений и методологии передачи генов позволило рекомбинантным генам стабильно экспрессироваться в КМЦ. Более того, последние достижения в сфере интерференции рибонуклеиновой кислоты свидетельствуют, что можно использовать генную терапию для «отключения» ключевых генов, ответственных за патологию, или путей их активации в поврежденном сердце.
Для успешного клинического применения любого из генетических терапевтических подходов необходимы 3 условия. Во-первых, для доставки генетического материала необходим переносчик (вектор) или система упаковки. Только несколько из доступных сейчас вирусных векторов (аденовирусы, адено-ассоциированные вирусы и, возможно, лентивирусы) способны дать достаточную трансгенную экспрессию высокого уровня в постмитотических клетках, какими являются КМЦ. Рекомбинантные аденовирусы использовали наиболее часто из-за их способности «упаковывать» большие конструкции ДНК, а также способности к трансдукции нерепликационных клеток.
Однако стойкий иммунный ответ, который вызывают эти векторы, позволил предположить, что в клинике понадобятся другие векторы или более очищенные аденовирусные системы. Во-вторых, вектор необходимо точно доставить в поврежденную ткань. Возможность передачи кардиальных генов через вирусный вектор in vivo стабильно демонстрировалась в экспериментальных работах. На рисунке ниже показан ряд механических подходов, которые используют для передачи кардиальных генов. Путем интракоронарной катетерной доставки аденовируса, кодирующего ген бета-галактозидазы, была достигнута 30% передача КМЦ в бассейн артерии, через которую проводили введение.
Прямая инъекция аденовируса в стенку желудочка через эпикардиальный доступ продемонстрировала значительное увеличение генерируемых конструкций, однако экспрессия была фокальной, а укол иглой приводил к дополнительному повреждению миокарда. Интрамиокардиальную доставку аденовируса через внутрижелудочковый доступ путем ретроградной инфузии через коронарные вены широко использовали в экспериментах на крупных животных с целью определения зон регионарной трансдукции. Инъекция аденовируса, несущего b-галактозидазу в полость перикарда, вызывала трансдукцию только в перикардиальных клеточных слоях.
В-третьих, обязательным условием успешности геннотерапевтического подхода является определение соответствующей мишени, требующей коррекции.
Различные технологии для in vivo передачи кардиального гена:
(А) Коронарная перфузия. (Б) Интрамиокардиальная инъекция.
(В) Перикардиальная инъекция. (Г) Пережатие аорты.
(Д) Перекрестное пережатие аорты и легочной артерии.
ВПВ — верхняя полая вена; НПВ — нижняя полая вена
В таблице ниже перечислены потенциальные мишени генной терапии при сердечной недостаточности (СН), определенные при экспериментальных исследованиях. Наиболее многообещающими мишенями для генной терапии служат гены, регулирующие сигнальные пути b-адренорецепторов (b-АР), и гены, управляющие транспортом кальция в сердце.
Сигнальные пути b-АР ответственны за модулирование миокардиальной сократимости. Исследования выявили, что повреждение миокардиальных b-АР может предшествовать, а также сопровождать развитие СН у людей, включая дисрегуляцию b-АР, функциональное разобщение b-АР от второй сигнальной системы и повышенные уровни ингибирующих G-белков, которые снижают передачу сигналов b-АР.
Действительно, трансгенные мыши с кардиорестриктивной гиперэкспрессией b2-АР обладают повышенной миокардиальной сократимостью. Однако, чрезмерная и/или постоянная стимуляция b-АР может также привести к активации мальадаптивных сигнальных путей в сердце (например, активации фетальной генетической программы), а также гибели миоцитов вследствие как некроза, так и апоптоза. Например, у трансгенных мышей, гиперэкспрессирующих b1-АР, развивается ДКМП. Эти экспериментальные исследования вызывают значительный интерес к использованию селективных генетических подходов для модулирования сигнальных путей b-АР в моделях СН. Пока в результате передачи генов человеческих b2-АР с помощью аденовирусов можно было наблюдать улучшение сократимости кардиомиоцитов (КМЦ), полученных от модели СН на кроликах, и КМЦ поврежденных сердец.
Подобным образом трансдукция с помощью аденовируса генов пептидного ингибитора b-АР киназы заканчивалась восстановлением передачи сигналов b-АР, повышением циклического аденозин-монофосфата и инверсией желудочковой дисфункции в модели СН на кроликах.
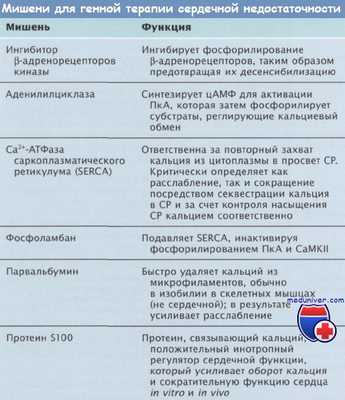
CaMKII — Са2+/кальмодулин-зависимая протеинкиназа II;
ПкА — протеинкиназа А; СР — саркоплазматический ретикулум.
Улучшение миокардиальной сократимости посредством воздействия на передачу сигналов через внутриклеточный кальций является целью генной терапии при сердечной недостаточности (СН). Отдельные исследования выявили, что функциональное подавление Са2+-АТФазной активности саркоплазматического ретикулума или абсолютное сокращение количества протеина SERCA2a может значительно изменять транспорт кальция и влиять на сократимость миокарда при его поражении. В экспериментальных моделях гипертрофии при перегрузке давлением, которая ведет к СН, гиперэкспрессия SERCA2a после генной трансдукции in vivo приводила к восстановлению систолической и диастолической функций до нормы.
Подобным образом гиперэкспрессия SERCA2a в результате генной терапии с использованием мишени приводила к нормализации объемов ЛЖ в моделях на животных, улучшая энергетику и увеличивая выживаемость при гипертрофии, обусловленной перегрузкой давлением. Недавно было показано, что повышенная экспрессия конструкции антисмыслового фосфоламбана или доминантнонегативной мутации фосфоламбана повышает активность SERCA2a. Это совпадает с прежними наблюдениями, когда функциональные нарушения в мышиных моделях ДКМП предотвращали с помощью генетической аблации этого фосфоламбана. Подобные положительные эффекты, связанные с сердечной сократимостью, включая нормализацию транспорта кальция и повышение активности SERCA2a, наблюдались в экспериментальных моделях сердечной недостаточности (СН) и у людей после трансдукции гена S100A1 (кальцийсвязывающего белка).
В дополнение к модуляции миокардиальной сократимости генные терапевтические подходы могут также быть нацелены на повышение жизнеспособности кардиомиоцитов (КМЦ) или фенотипирование фибробластов. Морфологические и биологические маркеры запрограммированной клеточной смерти, или апоптоза, были идентифицированы у человека при сердечной недостаточности (СН). Высказано предположение, что эти пути в каскадах реакций способствуют утрате КМЦ и развитию дисфункции сердца при сердечной недостаточности (СН). В связи с этим еще одной задачей продолжающихся исследований стало выявление потенциальной возможности блокирования апоптоза КМЦ методом передачи соматических генов.
Возможность модулирования фенотипа фибробластов изучали на экспериментальных моделях ИМ, когда для превращения сердечных фибробластов в функциональные скелетные мышечные клетки с целью уменьшения размера ИМ или распространения его на периинфарктные зоны использовали генноопосредованную передачу гена миогенного детерминирования MyoD.
Перспективы применения генной терапии
Стратегии передачи генов, которые приводят к изменению миокардиальной сократимости и/или ремоделирования сердца, в экспериментальных моделях СН оказались многообещающими. Однако следует подчеркнуть, что предстоит еще большая работа по улучшению векторных технологий и методов доставки кардиальных генов. Возможно, наиболее важно проведение клинических исследований пациентов с СН в целях выяснения, для каких генных мишеней это воздействие безопасно. В настоящее время отсутствуют клинические данные о применении генной терапии у пациентов с СН, однако уже запланированы небольшие клинические исследования с использованием SERCA2.
Генная терапия сердечно-сосудистых заболеваний. Исследования генной терапии в кардиологии
Адено-ассоциированный вирус (AAV). Катионные липиды в качестве векторов
Адено-ассоциированный вирус (AAV) - это дефектный парвовирус человека, свойства которого позволяют использовать его в качестве вектора для переноса генов. Вирусный вектор с высоким титром в норме для человека не патогенен, но в условиях in vitro инфицирует клетки различных типов. Геном AAV представлен одпоцепочечной линейной молекулой ДНК длиной 5 тыс. п.н. AAV дикого типа сайт-специфичным образом интегрируется в особый участок 19-й хромосомы человека длиной 7 тыс. п.н.
Геном AAV фланкирован попарно-инвертированными терминальными повторами (по 145 п.н. каждый), содержащими последовательности, необходимые для упаковки, репликации ДНК и ее интеграции. Кодирующая область содержит две открытых рамки считывания, которые в процессе конструкции вектора удаляются и заменяются одной или более молекулами кДПК вместе с транскрипционными регуляторными единицами.
AAV-векторы связывают трансгенные кассеты (упакованный генетический материал, содержащий более одного гена и предназначенный для вставки в геном клетки.) длиной не более 4-5 тыс. п.н., что лимитирует число их вариантов. Для репродукции AAV-векторов необходима сложная упаковка, включающая белки Rep и Сар, специфические для AAV, и пять аденовирусных белков (Е1А, Е1В, Е2А, Е4 и VA). Столь жесткие требования к упаковке исключают конструкцию линии клеток-хелперов AAV. В настоящее время векторы конструируют путем котрансфекции клеток AAV-всктором и неупаковываемой плазмидой, содержащей присущие AAV белки Rep и Сар.
Вслед за этим трансфектированные клетки инфицируют аденовирусом-помощником дикого типа или мутантным. AAV отделяют от аденовируса путем нагревания и центрифугирования в равновесном градиенте плотности. В работе изложены протоколы конструкции AAV-векторов.
В условиях in vitro AAV-векторы инфицируют многие типы клеток, однако возможность их применения в условиях in vivo остается неопределенной. Неясной остается возможность трансдукции сосудистых эпдотелиальных клеток и ГМК. К дополнительным ограничениям можно отнести отсутствие упаковочных клеточных линий и необходимость коинфекции с аденовирусом, что затрудняет приготовление чистых AAV-векторов в значительных количествах.

Удаление вирусных генов в процессе конструкции вектора ограничивает их способность к сайт-специфичной интеграции, по ставит вопрос о возможности инсерционного мутагенеза. Теоретически AAV векторы весьма привлекательны, однако еще многое предстоит сделать, прежде чем они найдут применение в клинике.
Катионные липиды — это препараты положительно заряженных клеток, которые спонтанно образуют комплексы с отрицательно заряженной ДНК, формируя ДНК-липидные конъюгаты. Липидный компонент способствует доставке ДНK в клетки путем слияния с мембраной плазмиды или с мембранами эндосом после завершения эпдоцитоза. После выхода из эндосом плазмидная ДНК находится вне хромосом.
Катионные липосомы были апробированы в исследованиях по переносу генов в клетки артерий на многих животных моделях, включая крыс, кроликов, собак и свиней. К преимуществам применения катионных липосом следует отнести их благоприятный профиль безопасности, отсутствие вирусных кодирующих последовательностей и ограничений на размер кДНК.
Эти липосомы отличает минимальное токсическое действие на биохимические процессы, гемодинамику и сердечную функцию как у животных, так и у человека. Эти векторы практически готовы к использованию в экспериментах и в клинике, Лимитирует их внедрение низкая эффективность трансфекции и кратковременность генной экспрессии.
Нуклеиновые кислоты и лекарственные препараты в виде полимерных гелей, которыми изнутри покрывали стенты или баллоны, вводили непосредственно в артерии. Использование многих полимеров первого поколения ассоциировалось с интенсивными воспалительными реакциями. Новые составы успешно применяют в разработке стентов с лекарственным покрытием.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Исследования по применению генной терапии при ССЗ движутся по синусоиде. Завершено много исследований В рамках фазы I, но лишь немногие из них перешли в фазу II. Возникли сомнения относительно использования аденовирусных векторов как на сердце, так и на сосудах, а также по поводу низкой эффективности трапсфекции in vivo.
Большинство исследований направлено на стимуляцию ангиогенеза и артериогенеза с целью улучшения перфузии миокарда или скелетных мышц. К настоящему времени проведено три фазы терапевтических исследований по ангиогенезу. В исследованиях в рамках фазы 1 для индукции ангиогенеза при периферической или миокардиальной ишемии использовали плазмиду ДНK и аденовирусы.
В этих работах у небольшого числа пациентов оценивали безопасность применения векторов и сравнивали их доставку через катетер и прямую инъекцию. Были получены убедительные результаты: отсутствие серьезных побочных явлений, сопряженных с применением генного вектора или зависящих от способа его доставки. Вслед за этим в клинических исследованиях фаз I/II с включением большего числа пациентов оценивали безопасность и эффективность лечения, используя мягкие конечные точки. Серьезных нежелательных явлений обнаружено не было; правда, многие из этих исследований не были контролируемыми, хотя и них звучала положительная оценка генной терапии.
В совокупности накопились следующие научные данные. Эффект плацебо был одинаковым у всех прошедших курс лечения пациентов, что, возможно, обусловлено изменениями гемодинамики или улучшением качества медицинского наблюдения. Значимые клинические конечные точки были не всегда определены заранее, что подвергает сомнению результаты по эффективности лечения. Отсутствие контролируемых рандомизированных исследований также не способствует продвижению в этой области. В настоящее время начат целый ряд плацебо-контролируемых клинических исследований в рамках фазы III, в которых будет участвовать значительное число пациентов со строго определенными клиническими конечными точками.
Результаты исследований фазы III и длительные проспективные наблюдения крайне необходимы для утверждения в Food and Drug Administration (США) препаратов для генной терапии и разрешения на их клиническое применение при ишемии миокарда или периферических органов. Существенным является знание фармакокипетики новых препаратов. Все это предполагает дальнейшее внедрение тщательно организованных клинических исследований.
В настоящее время молекулярная и клеточная биология влились в поток исследований ССЗ. Эти подходы углубили понимание патогенеза этих заболеваний, привели к созданию чрезвычайно полезных животных моделей и позволили заложить основы молекулярной терапии. В настоящее время исследования в области ССЗ поворачиваются в сторону молекулярной генетики, которая станет следующей научной ареной с возможностью основных прорывов. Сегодня приходит понимание механизмов, согласно которым отдельные гены вызывают ССЗ, что позволяет проникнуть в патофизиологию сложных и широко распространенных ССЗ.
Следующая важнейшая задача исследований в области молекулярной генетики заключается в более четком объяснении генетической предрасположенности к этим заболеваниям. Генотипирование, гепомика и протеомика — многообещающие подходы, применяемые пока недостаточно. Информация, которую можно получить с помощью этих методов, служит лишь характеристикой клинических фенотипов для вдумчивого наблюдательного врача, который замечает у своих пациентов необычные разновидности заболеваний.
И хотя многие исследователи полны надежд, неизвестно, какую роль генетика или клеточная терапия будут играть в практике клинического кардиолога. Сначала необходимы тщательные, хорошо организованные исследования, требующие усилий многих врачей-ученых и клиницистов. Только после этого перспективы молекулярной генетики смогут быть реализованы и найдут практическое применение в лечении больных ССЗ.
1. Эпидемиологические переходные периоды США. Период эпидемий и дефицита питания в США
2. Период дегенеративных и антропогенных заболеваний. Распространение сердечно-сосудистых заболеваний
3. Период поздних дегенеративных заболеваний. Снижение смертности от сердечно-сосудистых заболеваний
4. Период низкой физической активности и ожирения. Тенденции сердечно-сосудистых заболеваний
5. Заболеваемость в странах с высоким уровнем доходов. Смертность от сердечно-сосудистых заболеваний в Западной Европе
6. Заболеваемость в Японии. Сердечно-сосудистые заболевания в странах с низким и средним уровнями доходов
7. Сердечно-сосудистые заболевания в Восточной Европе. Эпидемиология сердечно-сосудистых заболеваний в Азии
8. Заболеваемость в Китае. Сердечно-сосудистые заболевания в Южной Азии и Индии
9. Заболеваемость в Африке. Сердечно-сосудистые заболевания в Африке
10. Заболеваемость в Латинской Америке. Сердечно-сосудистые заболевания на Ближнем Востоке
2. Факторы риска сердечно-сосудистых заболеваний. Курение как причина сердечно-сосудистых заболеваний
3. Влияние питания на развитие сердечно-сосудистых заболеваний. Значение физической активности в кардиологии
4. Уровни липидов при сердечно-сосудистых заболеваниях. Холестерин
5. Ожирение при сердечно-сосудистых заболеваниях. Избыточная масса тела и болезни сердца
6. Гипертензия как фактор риска ишемической болезни сердца. Распространенность артериальной гипертензии
7. Сахарный диабет как фактор риска сердечно-сосудистых заболеваний. Прогноз сердечно-сосудистых заболеваний
8. Стратегия снижения сердечно-сосудистых заболеваний. Смертность от сердечно-сосудистых заболеваний
9. Тенденции сердечно-сосудистых заболеваний в странах с низким доходом. Борьба с сердечно-сосудистыми заболеваниями в бедных странах
10. Проблема распространения сердечно-сосудистых заболеваний в бедных странах. Экономическая роль сердечно-сосудистых заболеваний
2. Влияние демографии населения на сердечно-сосудистые заболевания. Распространенность артериальной гипертензии
3. Распространенность сахарного диабета. Распространенность избыточной массы тела
4. Распространенность избыточного потребления натрия. Значение диеты в развитии сердечно-сосудистых заболеваний
5. Смертность от болезней сердца. Распространенность коронарной болезни сердца
6. Медицинская помощь при сердечно-сосудистых заболеваниях. Доступность медицины при болезнях сердца
7. Артериальная гипертензия в популяционных группах. Распространенность гипертензии среди американцев
8. Артериальная гипертензия среди афроамериканцев. Факторы риска развития артериальной гипертензии
9. Лечение артериальной гипертензии среди американцев. Влияние антигипертензивных препаратов на афроамериканцев
10. Распространенность ишемической болезни сердца. Эпидемиология инфаркта миокарда
1. Эпидемиология сердечной недостаточности. Причины сердечной недостаточности
2. Эффективность лечения сердечной недостаточности. Препараты для лечения сердечной недостаточности
3. Дифференцированный подход к лечению больных. Принципы терапия различных кардиологических больных
4. Экономика сердечно-сосудистых заболеваний. Социальная эффективность лечения болезней сердца
5. Медицинские расходы. Затраты на медицинское обеспечение
6. Экономический анализ лечения сердечно-сосудистых заболеваний. Экономика лечения острого коронарного синдрома
7. Экономика чрескожных коронарных вмешательств. Экономика антикоагулянтной и антитромботической терапии
8. Экономика коронарного шунтирования. Экономика стентирования коронарных артерий
9. Экономика имплантируемого кардиовертер-дефибриллятора. Экономика хронической сердечной недостаточности
10. Экономика профилактики заболеваний. Экономика вакцинации и приема аспирина
2. Клиническое решение врача. Ведение пациента в кардиологии
3. Диагностические гипотезы в кардиологии. Подходы к диагностике в кардиологии
4. Оценка диагностических тестов в кардиологии. Прогностическая ценность тестов в кардиологии
5. Теорема Bayes. Отношение правдоподобия диагностических тестов
6. Назначение диагностических тестов. Скринирующие тесты
7. Терапевтические решения. Уровни доказательств эффективности лекарств
8. Значение р в доказательствах. Риск и польза лечения
9. Стратификация риска. Риск-лечение
10. Согласие пациента на лечение. Разделение принятия решений с пациентом
2. Инновации в медицине для врача. Изменчивость медицинских публикаций
3. Качество медицинской помощи в кардиологии. Критерии качества медицинской помощи
4. Документы для анализа качества медицинской помощи. Ретроспективный анализ медицинской документации
5. Определение понятия качество медицинской помощи. Современные показатели качества медицинской помощи
6. Качество медицинской помощи в кардиологии. Кардиологическая медицинская помощь в США
7. Повышение качества медицинской помощи в кардиологии. Компьютеры в кардиологии
8. Лекарственная терапия в кардиологии. Риск и польза лекарств
9. Риск лекарственной терапии. Различные варианты действия лекарственных средств
10. Механизмы различного действия лекарств. Вариабельность фармакодинамики
1. Протеомика. Хроматография белков
2. Генетически модифицированные мыши в изучении сердечно-сосудистых заболеваний. Трансгенные мыши
3. Методы отключения гена. Условно нокаутные мыши
4. Изучение сердца на лабораторных мышах. Перенос генов - трансфекция генов
5. Векторы для переноса генов. Ретровирусы и аденовирусы в качестве векторов
6. Адено-ассоциированный вирус (AAV). Катионные липиды в качестве векторов
7. Изучение сердечно-сосудистых заболеваний на животных. Перенос генов в соматические клетки животных
8. Генная терапия сердечно-сосудистых заболеваний. Исследования генной терапии в кардиологии
9. Генетические факторы сердечно-сосудистых заболеваний. Наследственная предрасположенность в кардиологии
10. Аномалии хромосом человека. Анеуплоидия
Наследственные заболевания сердечно-сосудистой системы
Генетические болезни сердечно-сосудистой системы
2. Синдром Noonan. Причины и проявления синдрома Ноонан
3. Трисомия 21 - синдром Down. Синдром Turner
4. Опухоли сердца. Перспективы генетики сердечно-сосудистых заболеваний
5. Важность сбора анамнеза в кардиологии. Анамнез и план обследования сердечно-сосудистого больного
6. Сбор анамнеза у кардиологических больных. Клинические симптомы сердечно-сосудистых заболеваний
7. Физикальное обследование в кардиологии. Общий вид сердечно-сосудистого больного
8. Голова и шея кардиологического больного. Конечности при сердечно-сосудистых заболеваниях
9. Грудная клетка у кардиологического больного. Живот при сердечно-сосудистых заболеваниях
10. Давление в яремных венах. Венозное давление
Оценка давления, пульса и тонов сердца
2. Клиника тройного стеноза. Незаращение артериального протока
3. Сужение устья легочной артерии. Незаращение межпредсердной перегородки
4. Признаки незаращения межпредсердной перегородки. Незаращение межжелудочковой перегородки
5. Механизмы возбуждения клеток сердца. Электрокардиограмма
6. Hodgkin А о возбуждении кардиомиоцитов. Фазы возбуждения мышечных клеток
7. Синусовый узел сердца. Дипольная теория возбуждения сердца
8. Возбуждение АВ-соединения и желудочков. Зубцы ЭКГ при возбуждении желудочков
9. Угасание возбуждения желудочков. Векторкардиограмма
10. Двухполюсные отведения Einthoven'а. Однополюсные отведения ЭКГ
1. Малый круг кровообращения. Сосуды малого круга кровообращения
2. Артериолы легких. Прекапилляры и капилляры малого круга кровообращения
3. Легочные вены и бронхиальные артерии. Связь большого и малого круга кровообращения
4. Артерио-венозные анастомозы малого круга. Рефлексогенные зоны малого круга кровообращения
5. Развитие малого круга кровообращения. Онтогенез легочного кровообращения
6. Морфология артерий малого круга. Показатели гемодинамики в малом круге
7. Легочные вены и сопротивление легочных сосудов. Минутный объем малого круга кровообращения
8. Резервная емкость легочных сосудов. Дыхание и кровоток в легких
9. Врожденные пороки сердца плода. Легочный кровоток у плода
10. Малый круг кровообращения после рождения плода. Когда закрывается артериальный (боталлов) проток?
2. Гемодинамика при дефекте межжелудочковой перегородки. Виды ДМЖП
3. Объемная перегрузка левого желудочка. Фазы течения ДМЖП
4. Легочно-сосудистое сопротивление. Легочная гипертензия при дефекте межжелудочковой перегородки (ДМЖП)
5. Дефект межпредсердной перегородки (ДМПП). Гемодинамика при дефекте межпредсердной перегородки
6. Большой круг кровообращения при легочной гипертензии. Системное влияние легочной гипертензии
7. Склероз легочных сосудов. Компенсаторная гиперфункция сердца
8. Приобретенная легочная гипертензия. Патогенез при легочной гипертензии
9. Младенческая легочная гипертензия. Эмбрионально-гиперпластическая или склеротическая легочная гипертензия
10. Легочная гипертензия при дефекте межпредсердной перегородки (ДМПП). Эуфиллин и нитроглицерин при легочной гипертензии
2. Фармакология легочной гипертензии. Сосудорасширяющие средства при легочной гипертензии
3. Влияние нитроглицерина на малый круг кровообращения. Гемодинамика после приема нитроглицерина
4. Умеренная реакция легочных сосудов на препараты. Слабая реакция малого круга на гипотензивные препараты
5. Гистология легких при легочной гипертензии. Рефлекторный спазм легочных сосудов
6. Виды легочной гипертензии. Классификация легочной гипертензии
7. Классификация общелегочного сопротивления. Группы больных с легочной гипертензией
8. Сердечный цикл при легочной гипертензии. Методика исследования сердечного цикла
9. Пример исследования сердечного цикла. Сердечный цикл при ДМПП
10. Сердечный цикл при ДМЖП. Открытый артериальный проток и дефект перегородки сердца
ФГБОУ ВО «Рязанский государственный медицинский университет им акад. И.П. Павлова» Минздрава России, Рязань, Россия
ГБОУ ВПО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, Рязань
Кафедра детской хирургии МГМСУ, Москва
ОАО «Институт стволовых клеток человека», Москва, Россия;
ФГАОУ ВПО «Казанский (Приволжский) федеральный университет», Казань, Россия
Становление и развитие метода терапевтического ангиогенеза в российской сердечно-сосудистой хирургии
Современные достижения сердечно-сосудистой хирургии позволяют сохранить жизнь и здоровье миллионам пациентов со сложными врожденными и приобретенными пороками сердца, патологией аорты, коронарных, церебральных и периферических артерий. Тем не менее ишемическая болезнь сердца и ее осложнения являются ведущей причиной смертности населения. Конвенционные методы лечения пациентов с хронической ишемией миокарда и нижних конечностей, такие как реконструктивные операции, эндоваскулярные вмешательства, использование разнообразных фармакологических препаратов, в ряде случаев (анатомические особенности, сопутствующая патология, стадия заболевания и т.п.) не могут быть применены в полном объеме либо обладают недостаточной эффективностью для повышения качества жизни пациентов и улучшения прогнозов исхода заболевания. Более 25 лет ученые России и всего мира исследуют новые подходы к лечению пациентов с заболеваниями сердца и сосудов в ситуациях, когда стандартные хирургические и терапевтические методы неэффективны. Применение терапевтического ангиогенеза с использованием разнообразных генов, молекул и клеток призвано открыть новые горизонты в лечении вышеуказанной категории больных.
За время, которое потребуется на прочтение данной статьи, у 15 пациентов в России будет зафиксирован острый коронарный синдром (ОКС), который закончится инфарктом миокарда у каждого третьего [24]; от 2 до 5 больным будет выполнена ампутация конечности [7, 49]. Распространенность ишемической болезни сердца (ИБС) и заболеваний периферических артерий крайне высока [8, 11, 60, 75]. На вооружении современной сердечно-сосудистой хирургии (ССХ) имеется широкий спектр медицинских средств оказания помощи пациентам с ИБС и хронической ишемией нижних конечностей (ХИНК): «классическая» открытая фармакотерапия, а также бурно развивающаяся эндоваскулярная хирургия [14]. Тем не менее статистика не утешительна: риск большой ампутации у пациентов с критической ишемией нижних конечностей (КИНК) превышает 20%, а риск смерти в течение 30 дней после нее достигает 30%, в том числе в специализированных стационарах [10, 48]. Существует насущная потребность в поиске новых методов лечения пациентов с ИБС и ХИНК. В последние годы особое внимание уделяется возможностям терапевтического ангиогенеза (ТА), цель которого — улучшение кровоснабжения ишемизированной мускулатуры и других тканей конечностей. В узком смысле стратегия ТА применима для лечения ишемических заболеваний сердечно-сосудистой системы. ТА развивается по трем магистральным направлениям: использование постгеномных, клеточных и генных технологий [21]. Данная статья посвящена применению ТА с использованием рекомбинантных белков, разнообразных клеток и генной терапии в сфере ССХ в России.
Постгеномные технологии терапевтического ангиогенеза: рекомбинантные факторы роста
Знания, накопленные в сфере сосудистой биологии, позволили понять тонкие сигнальные механизмы, лежащие в основе процессов васкуло-, артерио- и ангиогенеза, что помогло выявить медиаторы, ответственные за новообразование сосудов. Многочисленные эксперименты показали, что применение рекомбинантных ангиогенных факторов роста (ФР), таких как основной ФР фибробластов (FGF) [28] и сосудистый эндотелиальный ФР (VEGF) [66], в значительной степени способствовало неоваскуляризации ишемизированных тканей, однако сложности возникли в создании и поддержании эффективной концентрации ФР в тканях [37]. Основные исследования в сфере постгеномных технологий были посвящены VEGF-165, FGF-1, FGF-2, а также ФР гепатоцитов (HGF) [27]. Исследования VIVA и FIRST не выявили значимых положительных результатов применения рекомбинантных VEGF и FGF-2 в лечении пациентов с ИБС [63, 70]. Исследование TRAFFIC позволило сделать вывод, что зафиксированное в первые 3 мес увеличение дистанции безболевой ходьбы (ДБХ) у получавших FGF-2 пациентов с ХИНК полностью нивелировалось через 6 мес. Исследование RAVE (регионарный ангиогенез с помощью VEGF) также не оправдало возложенных на него ожиданий [53]. Возможно, неудачи связаны с тем, что указанные рекомбинантные белки имели короткий период полужизни в кровотоке и лишь крайне незначительное количество введенных ФР задерживалось и функционировало в мышечной ткани [40]. Эти обстоятельства указывают на то, что требуются дополнительные исследования возможности применения рекомбинантных ФР в индукции ангиогенеза, а также разработка оптимальных комбинаций, способов, режимов дозирования и введения.
Клеточные технологии терапевтического ангиогенеза
Использование клеточных технологий в сфере ССХ наиболее перспективно в лечении ИБС, хронической сердечной недостаточности и ХИНК [42, 73]. В нашей стране пионерами интеграции клеточной трансплантации различных типов клеток, кардио- и ангиохирургических методов терапии были врачи-клиницисты, повседневно нуждающиеся в новых способах лечения тяжелой категории своих пациентов: акад. Л.А. Бокерия (Научный центр ССХ им. А.Н. Бакулева, Москва) [30], акад. Ю.Л. Шевченко (Военно-медицинская академия им. С.М. Кирова, Санкт-Петербург) [22, 23], акад. В.И. Шумаков (Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова, Москва) [25], акад. А.М. Караськов (Новосибирский НИИ патологии кровообращения им. акад. Е.Н. Мешалкина, Новосибирск) [20].
В настоящее время в клинической практике апробируется применение различных видов клеток, обладающих различным ангиогенным и гистопротекторным потенциалом. Многочисленные исследования посвящены применению прогениторных эндотелиальных клеток (ПЭК). С момента первых испытаний ПЭК в сфере индукции ангиогенеза, проведенных T. Asahara в 1997 г. [26], к настоящему моменту опубликовано внушительное количество статей о возможностях использования данного вида клеточной терапии [65, 68]. Изучение мультипотентных мезенхимальных стромальных клеток показало, что они обладают высоким пролиферативным потенциалом, способностью к самообновлению и продукции необходимых для ангиогенеза ФР: VEGF, FGF, HGF [54, 71, 76]. Научный интерес медиков вызывает перспектива применения стромальных клеток жировой ткани, способных дифференцироваться в адипоциты и эндотелиоциты, секретировать разнообразные ФР, такие как HGF, VEGF, ФР тромбоцитов, а также тканевый ФР и ангиогенин-1 (ANG-1) [16, 43, 77]. Большие надежды связаны с применением аутогенной клеточной трансплантации мононуклеаров костного мозга [67]. В качестве одного из наиболее перспективных подходов в клеточной терапии в ССХ рассматривается использование мобилизированных мононуклеаров периферической крови, клеток CD133 + или высокоочищенной фракции мобилизированных гранулоцитарным колониестимулирующим фактором клеток периферической крови CD34 + [41]. Успех I и II фаз клинического исследования применения аутоконцентрата клеток костного мозга у пациентов с КИНК [32] позволил ученым Cesca Therapeutics в 2015 г. приступить к III фазе исследования (CLIRST III), в которой клетки подготовлены к применению с помощью технологии SurgWerk [33]. Изучение возможности использования в ССХ другого вида клеток — скелетных «миобластов» — велось в начале 2000-х годов (H. Haider, 2004), однако к настоящему времени данный вид клеточной терапии не нашел своего применения в лечении заболеваний сердца и сосудов [46]. Работы проводятся в отношении выделяемых из пуповинной крови клеток CD34 + , CD133 + [45, 69], плацентарных клеток (PLX, Pluristem), представляющих собой мезенхимальные стромальные клетки, прошедшие особую обработку [52]. В настоящее время клинические испытания I и II фаз, посвященные применению PLX-клеток в виде внутримышечных инъекций в лечении пациентов с КИНК и ХИНК соответственно, призваны определить эффективность и безопасность данного вида ТА в улучшении качества жизни и прогноза у лиц с заболеванием периферических артерий [55, 58]. Активно исследуется использование эндометриальных регенеративных клеток [74], применение которых может способствовать реваскуляризации ишемизированной мускулатуры в связи с их высокой конституциональной способностью продуцировать ангиогенные Ф.Р. Специалистами компании Medistem/Regen BioPharma в настоящее время проводятся I и II фазы клинических исследований применения клеточной терапии эндометриальных регенеративных клеток у пациентов с КИНК [50].
Гибель значительного количества клеток после трансплантации, трудности в получении достаточного количества материала для клинических целей и ряд организационных и экономических сложностей препятствуют внедрению клеточной терапии в широкую клиническую практику. Возможно, часть указанных проблем будет решена при помощи применения генных технологий [12, 72].
Мировой опыт и основные тенденции развития генных технологий в российской сердечно-сосудистой хирургии
В ходе многолетних исследований процессов неоваскуляризации было выявлено, что следующие ФР являются ключевыми в образовании сосудов: VEGF, FGF, HGF, ANG, фактор, полученный из стромальных клеток (SDF) и индуцированный гипоксией фактор-1α (HIF-1α). Знание патологических процессов, лежащих в основе реакции скелетной мускулатуры на артериальную недостаточность, и понимание механизмов адаптации к острой и хронической ишемии играют важнейшую роль в поиске оптимальных подходов к лечению заболеваний, ведущим звеном в которых является нарушение перфузии тканей [36].
Основоположником ТА в сфере ССХ в России является акад. РАН Л.А. Бокерия. Наряду с зарубежными специалистами, Л.А. Бокерия и другие именитые российские ученые, включая акад. РАН В.А. Ткачука и Е.И. Чазова, на рубеже 1990–2000-х годов проявили интерес к возможностям применения индукции ангиогенеза. В печати появляются первые отечественные статьи, посвященные генной терапии сердечно-сосудистых заболеваний, в том числе с использованием гена VEGF [17].
В 2004 г. в нашей стране были опубликованы данные о возможностях применения генных и клеточных технологий для лечения сердечно-сосудистых заболеваний [2], а также результаты 4-летнего исследования безопасности и эффективности плазмидной конструкции, содержащей ген VEGF165 человека под названием ангиостимулин, проведенного на базе НЦССХ им. А.Н. Бакулева. Препарат-кандидат вводился 10 пациентам с ХИНК IIВ—IV стадий заболевания по А.В. Покровскому—Фонтейну при невозможности проведения реконструктивного вмешательства и/или анатомо-функциональной недостаточности коллатерального кровотока. По данным Л.А. Бокерии, В.С. Аракеляна, О.А. Демидовой, после однократного введения 1000 мкг ангиостимулина внутриартериально в магистральную артерию проксимальнее зоны окклюзии либо внутримышечно путем обкалывания области икроножной мышцы у всех пациентов зафиксирована положительная динамика в отношении лодыжечно-плечевого индекса (ЛПИ), транскутанного напряжения кислорода (ТКНК), качества жизни, показателей свертывающих свойств крови. Исследователи установили, что при внутримышечном введении ангиостимулина эффект наступает быстрее. При ангиографии отмечено увеличение числа вновь образованных коллатералей [3]. Позже Л.А. Бокерия, Е.З. Голухова, М.В. Еремеева опубликовали результаты исследования индукции ангио- и миогенеза у больных ИБС и ХИНК. Новое клиническое испытание вышеуказанного препарата включало 58 пациентов с ИБС и ХИНК. Больные ИБС были разделены на группы в зависимости от вида проведенного лечения: коронарное шунтирование в сочетании с интракардиальным введением ангиостимулина и/или трансмиокардиальной лазерной реваскуляризацией. Больным ХИНК с неудовлетворительным периферическим руслом было проведено лечение препаратом в дозировке 1000 мкг, введенным внутриартериально либо внутримышечно в область икроножной мышцы пораженной конечности. Применение ангиостимулина повысило эффективность хирургического лечения при ИБС за счет поддержания высокого уровня экспрессии факторов, требующихся для ангиогенеза [35]. В группе пациентов с ХИНК объективное улучшение состояния конечности отмечалось в 80% случаев к концу 1-го месяца после начала лечения и в 100% случаев к 3-му месяцу [4]. В 2013 г. тот же коллектив авторов сообщил о положительном воздействии препарата ангиостимулин на реологические свойства крови у пациентов с ХИНК [5].
Акад. РАМН Н.П. Бочковым и специалистами Российского научного центра хирургии им. Б.В. Петровского А.В. Гавриленко и Д.А. Вороновым выполнен ряд работ, посвященных изучению вирусных конструкций, несущих гены VEGF и/или ANG, в комплексном лечении пациентов с ХИНК. Исследование, результаты которого опубликованы в 2011—2013 гг., включало 134 пациента с ХИНК II—III стадий по классификации А.В. Покровского—Фонтейна, диффузным атеросклеротическим поражением артерий голени. В зависимости от выбранного вида лечения пациентам клинической группы в икроножные мышцы ишемизированной конечности вводились нативные плазмиды с генами VEGF и ANG либо вирусные векторные конструкции CELO-ANG, Ad5-ANG и Ad5-(ANG+VEGF). Генная терапия проводилась как самостоятельно, так и в сочетании с хирургическими реконструктивными вмешательствами. При изолированном применении генных индукторов ангиогенеза лучшие результаты были получены у пациентов со IIВ стадией заболевания. При комбинации генной терапии с хирургическим лечением сохранность конечности в клинической группе превысила аналогичный показатель в группе контроля. Авторы выявили, что статистически значимо лучшие показатели критериев эффективности (увеличение ДБХ, ЛПИ, перфузии мышц по данным сцинтиграфии) отмечались у всех пациентов, кому вводились любые векторные конструкции, однако применение вирусных конструкций сопровождалось развитием системной воспалительной реакции, особенно на основе вируса CELO [6].
За рубежом проведено исследование эффективности генной терапии HIF-1α у 289 пациентов с перемежающейся хромотой, в ходе которого не было выявлено статистически значимых различий в показателях основных критериев эффективности между пациентами клинической и контрольной групп [31]. Другими широко исследуемыми генами являются FGF и HGF. В ряде работ выявлены безопасность и умеренная эффективность конструкций на основе плазмидной ДКН с FGF-1 при внутримышечном введении в ишемизированную конечность при ХИНК и КИНК [47]. Авторский коллектив включил в исследование пациентов с язвенно-некротическими стадиями заболевания, в связи с чем в качестве критериев эффективности были определены жесткие точки, например количество ампутаций за время наблюдения. С участием внушительного числа пациентов с КИНК в более чем 30 странах проведена III фаза клинических испытания препарата на основе FGF-1, однако результаты исследования показали отсутствие статистически значимых различий между клинической и контрольной группами в отношении сохранности конечности [29]. Сейчас проводится III фаза исследования ASPIRE — многоцентрового клинического испытания интракоронарного введения конструкции с аденовирусным вектором и геном, кодирующим FGF-4, у пациентов с ИБС [34]. В Корее в 2013 и 2014 г. соответственно завершены клинические исследования препарата на основе плазмидной ДНК с геном HGF (ViroMed Co., Ltd.; VM Biopharma), который применялся у пациентов с КИНК [57] и ИБС [59] при шунтирующих операциях на коронарных сосудах. II фаза клинического испытания препарата Collategene на основе HGF (AnGes Inc.) у пациентов с КИНК выявила положительные результаты в 70% случаев [62]. В настоящее время проводится III фаза исследования эффективности и безопасности применения данной конструкции у пациентов с КИНК [56]. Перспективной считается индукция ангиогенеза при помощи гена, кодируюшего SDF, способствующего рекрутингу проангиогенных ПЭК костного мозга и периферической крови (JVC-100) [64]. Результаты последних клинических испытаний SDF к настоящему времени не опубликованы.
Предположительно геннотерапевтические агенты, несущие FGF и HGF, более перспективны в лечении пациентов с ИБС, в то время как гены, ответственные за синтез VEGF и SDF, имеют большую эффективность в отношении лечения ХИНК.
Заключение
Исследования нескольких российских научно-исследовательских коллективов, индуцированные явной клинической необходимостью, позволили создать опережающий научно-технический задел в части разработки и клинического внедрения геннотерапевтических препаратов для лечения пациентов с ишемической сердечно-сосудистой патологией. Эффективное и безопасное лечение пациентов с ИБС и периферическим атеросклерозом, осложненным развитием ХИНК и КИНК, является одним из наиболее приоритетных направлений практической медицины в связи с крайне высокими морбидностью, инвалидизацией, летальностью и стоимостью лечения. Успешные результаты исследований ТА в сфере ССХ дают основания для использования данного подхода в лечении ишемических заболеваний сердца и сосудов.
Читайте также:
